Method Article
피질 마우스 성상세포를 개별화하기 위해 다각형 게놈 통합 색상(MAGIC) 마커의 자궁 전기포게에서
* 이 저자들은 동등하게 기여했습니다
요약
성상 세포는 대뇌 피질을 균일하게 타일로 만들어 세포 수준에서 복잡한 형태에 대한 분석을 어렵게 만듭니다. 여기에 제공된 프로토콜은 자궁 전기포레이션을 기반으로 하는 다색 라벨을 사용하여 피질 성상신구를 선별하고 사용자 친화적인 이미지 분석 파이프라인을 사용하여 볼륨 및 형태를 분석합니다.
초록
마우스 대뇌 피질에 위치한 프로토플라스믹 성상세포(PrA)는 단단히 나란히 배치되어 성인 단계에서 명백하게 연속적인 3차원 매트릭스를 형성합니다. 지금까지, 어떤 면역 염색 전략은 그(것)들을 밖으로 단정하고 성숙한 동물및 코르티코 발생의 과정을 통해 그들의 형태를 분할할 수 없습니다. 피질 PrA는 등쪽 팔륨에 위치한 선조에서 유래하고 쉽게 통합 벡터의 자궁 전기 포기에 사용하여 표적화 할 수 있습니다. 프로토콜은 피기박/Tol2 전치 및Cre/lox 재조합에 의존하는 다각형 게놈 통합 색상(MAGIC) 마커 전략으로 이러한 세포를 특정 세포 구획에 다루어주는 뚜렷한 형광 단백질(파란색, 시안, 노란색 및 빨간색)으로 라벨링하기 위해 여기에 제시됩니다. 이 다색 운명 매핑 전략은 교형성의 시작 전에 색상 마커의 조합과 함께 현장에서 표시하고 개별 세포 수준에서 배아에서 성인 단계에 성상 세포를 포함하여 자신의 후손을 추적 할 수 있습니다. 다주소 있는 게놈 통합 색상 마커(MAGIC Markers 또는 MM)에서 제공하는 전극형 벡터 및 색상 대비의 농도를 조정하여 달성된 반 스파스 라벨링은 조밀한 해부학적 배열에도 불구하고 성상 세포와 복잡한 형태를 개별화하고 영토및 복잡한 형태를 배제할 수 있게 합니다. 여기에 제시된 전기공분화 절차의 세부 사항, 공초점 현미경에 의한 멀티채널 이미지 스택 획득, 실험자가 개별 PrA 부피 및 형태학을 평가할 수 있는 컴퓨터 보조 3차원 세분화 등의 포괄적인 실험 워크플로우가 있습니다. 요약하자면, MAGIC Markers의 전기화는 수많은 성상세포에 개별적으로 라벨을 지정하고 다양한 발달 단계에서 해부학적 특징에 접근할 수 있는 편리한 방법을 제공합니다. 이 기술은 형질전환 기자 라인을 가진 복잡한 십자가에 의지하지 않고 다양한 마우스 모델에서 피질 성상세포 형태학적 특성을 분석하는 데 유용할 것이다.
서문
성상 세포는 뇌 발달 및 생리학1에서수많은 중요한 기능을 재생합니다. 그들은 영양소 섭취와 혈류를 조절 하는 혈액-뇌 장벽에서 그들의 역할 옆에, 그들은 적극적으로 신경 활동 및 행동을 변경할 수 있는 신경 변조기를 생산 하는 동안 시 냅 스 형성 및 기능에 기여2. 더욱이, 성상세포 기능 장애는 다양한 신경장애3에기여한다. 대뇌 피질에 있는 성상 세포는 신경 프로세스와 광대한 접촉을 가능하게 하는 정교한 형태 표시합니다. 회로 기능에 필수적인 이들 접촉은 세포 접착 단백질4를통해 성상세포 형태발생 및 시냅토 발생을 제어한다. 신경 과학자들은 관심의 그들의 신경 모델에서 성상 세포 발달 및 형태 발생을 조사하기 위하여 편리하고 강력한 공구가 필요합니다. 그러나, 그들의 이웃에 성상 세포의 가까운 삽화와 그들의 균일 한 입체 타일링으로 인해, 피질 성상신을 밖으로 선별하고 면역 마커를 사용하여 그들의 형태를 종합적으로 평가하는 것이 도전적입니다.
현재, 두 가지 주요 유전 공학 전략은 피질 성상세포의 라벨링 및 개별화를 가능하게 합니다: 기자 플라스미드의 전기포레이션을 사용하여 형질전환 마우스 선또는 체세포 간 발생에서 희소한 리포터 활성화. 첫 번째 전략은 타목시펜 납품 시 성상세포에서 특별히 활성화된 Cre 재조합제의 유도가능한 형태를 표현하는 마우스로 플로싱 리포터 마우스 라인을 사육하는 데 의존한다(예: Aldh1l1-CreERT25). 몇 가지 단점은이 전략과 관련이 있습니다. 첫째, 사육 형질 성생쥐는 많은 수의 동물을 필요로 하며, 여러 분석법은 전형적으로 피질 성상세포의 적절한 희소 라벨링을 제공하기 위해 타목시펜의 적절한 복용량을 결정하는 데 필요합니다. 관심의 유전 마우스 모델에서 피질 성상 세포 표현형을 분석하려면 더 많은 번식과 마우스 소비가 필요합니다. 더욱이, 자궁 타목시펜 주사는 부분화를 방해하는 것으로 알려져 있으며, 이 전략은 성상세포 발달의 초기 단계의 연구에 적용하기 어렵게 만듭니다. 생체 내 DNA 전기화는 동물의 최소 수에 의존하는 대체 타목시펜없는전략이다 6. 배아 또는 산후 단계에서 수행, 이 접근법은 설치류의 측면 심실에 기자 플라스미드를 주입하고 세포막에 기공을 만드는 전기 펄스로 구성되어 있으며, 따라서 DNA가 심실을 안대기하는 전구 세포에 들어갈 수 있도록 합니다. 이어서, 전기폴리플라스미드에 의해 운반된 리포터 전진은 표적 세포기계에 의해 처리되고7을발현한다. 두 개의 전기 기화 방법은 이전에 마우스 피질 성상세포에 레이블을 기재하였다: 1) 출생 후 성상 세포 (PALE)에 의한 성상 세포 라벨링, 이는 초기 산후 단계4에서1-2 단일 색 에피소피 기자 플라스미드의 전기 포기에 의존; 2) 여러 단일 색 통합 기자 플라스미드8,9,10의자궁 전기 화 (IUE)를 기반으로 스타 트랙 전략 . 이 두 기술은 대뇌 피질에서 PrA를 효율적으로 레이블을 지정하지만, 그들은 또한 몇 가지 한계를 제시한다. 그들의 초기 버전에서, 두 방법 모두 성상세포에서 발현을 구동하는 신경교 섬유 산성 단백질 (GFAP) 프로모터에 의존, 이는 방사형 glia뿐만 아니라 일반 휴식 PrA 보다 더 강하게 GFAP를 표현하는 피알 및 반응성 성상세포로 라벨을 편향 할 수있다11,12. PALE에 관해서는, 그밖 단점은 초기 태어난 PrA의 표시를 방지하는 전기 기질의 늦은 단계입니다 (또는 초기 delaminating 선조에서 유래하는 그)와 천체 발달의 초기 단계의 분석, 그리고 PrA가 첫번째 산후 1주 동안 겪는 대규모 확산 도중 연속적인 분열을 통해 희석되는 episomal 벡터의 사용,14. PALE와 는 달리, StarTrack은 PrA에 배아와 산후 선조의 기여를 추적할 수 있는 통합 기자 플라스미드의 배아 전기화를 기반으로 합니다. 유비퀴틴 C 프로모터(UbC-StarTrack)에 의존하는업데이트된 스타트랙 방식은 신경전구15,16,17의신경전도 및 신경교 하강(성구포함)에서 형광 기자의 폭넓은 표현을 달성한다. 그러나, 현재 버전에서는 부분 적인 흥분 및 방출 스펙트럼 중복이 있는 6개의 형광 단백질 (FP)을 표현하는 12개의 명백한 플라스미드의 평형 혼합물에 의존하기 때문에 이 접근법의 구현은 복잡합니다.
여기에 제시된 우테로 전기화 기반의 멀티컬러 라벨링 방법은 피질성상세포(14)를배제하기 위해 강력하고 광범위하게 능동적인 프로모터에 의해 구동되는 통합 리포터 구조를 이용한 간단한 것이다. 또한, 허가된(예: Imaris)과 오픈 액세스(Vaa3D18,19,20)이미지 분석 소프트웨어를 모두 사용하는 쉬운 이미지 분석 파이프라인이 각각 성상세포 영토 볼륨 및 소극을 분할하도록 제공됩니다. 이전에 설명된 방법에 비해, 이 전략은 세포질로 향하는 1-2가지 색 통합 형 트랜스게네스 다중 게놈-통합 컬러 마커(MAGIC Markers 또는 MM21)에전적으로의존하며, (선택적으로) 핵세포 구획은 사이토메갈로바이러스 증강제, β 닭액틴 프로모터, β β 이를 통해 GFAP발현(14,23)과무관하게 배아에서 후기 산후 단계에 이르는 피질 성상세포의 라벨링 및 추적을 가능하게 한다. 이러한 각 유전자는 다음과 같은 네 가지 FP를 부담: eBFP, mTurquoise2/mCerulean, EYFP, 그리고 tdTomato/mCherry, 쉽게 우회 할 수 있는 최소한의 스펙트럼 중복을 표시 1) 순차 채널 취득; 2) 최적화 된 흥분 력 및 수집 이득; 및 3) 좁은 FP 방출 창을 수집하는 특정 이차 필터. MM 전략은Cre/lox재조합을 자기 흥분 가능한 Cre 재조합(seCre)과 결합하여 세포 집단에서 FP의 궤적 표현을 유도합니다. MM 트랜스진의 단일 사본은 상호 배타적인 방식으로 FP를 표현하고, 여러 개의 트랜스게네스는 FP 조합을 만들어 수십 개의 독특한 색조를 생성합니다. 게놈의 게놈 통합은 피기박(PB) 또는 Tol2 전치시스템(24,25,26)에의해 구동된다. 따라서 자궁 전기포공을 통해 MM 툴킷과 다색 '모자이크'를 통해 인접한 여러 피질 선조의 동시 표시와 피질 성상주기를 포함한 교반 하강의 추적을 장기간 가능하게 한다. 색상 대비는 PrA의 윤곽을 뚜렷하게 FP 허용 한 표현의 표현으로 인한 다음 자신의 영토 볼륨 (IMARIS 사용) 및 복잡한 형태 (Vaa3D 사용)에 대한 주요 정보를 추출합니다. 여기에 상세히 제시된 멀티컬러 전략은 다양한 발달 단계에서 야생형 마우스의 피질 성상세포 표면 및 형태에 빠르고 쉽게 접근할 수 있는 편리하고 견고한 방법이며, 형질대사라인을 사용하지 않고 신경질환의 마우스 모델에서 성상세포 해부학적 특징을 쉽게 조사할 수 있다.
프로토콜
여기에 설명된 모든 동물 절차는 제도적 지침에 따라 수행되었다. 동물 프로토콜은 찰스 다윈 동물 실험 윤리 위원회 (CEEACD / N °5)에 의해 승인되었습니다.
1. 자궁 전기 포기에서 MAGIC 마커에 대한 내독신프리 플라스미드의 준비
- 세균 성 변환
- 얼음에, -70 °C에 저장된 DH5 알파 유능한 세포를 해동.
- 37°C에서 적절한 항생제(100 μg/mL 암피실린 또는 50 μg/mL 카나마이신)를 함유한 한천판을 데우고 있다.
- 5-50 ng의 5-50 ng의 μL을 해동 DH5 알파 유능한 세포의 10 μL에 넣고 혼합하지 않고 10 분 동안 얼음에 배양하십시오.
- 열 충격 변환을 위해 알리쿼트를 42°C 수조에 45초 동안 넣고 얼음 위에 바로 놓고 3-5분 기다립니다.
- 멸균 조건하에서 SOC 배지 230 μL을 추가하고 37°C에서 1시간 동안 배양합니다.
- 천판 위에 알리쿼트의 함량을 확산시키고 37°C에서 하룻밤 동안 배양한다.
- 플라스미드 문화
- 다음 날 아침, 멸균 조건하에서, 한천 판에서 식민지를 집어 적절한 항생제로 LB 배지 2mL를 포함하는 14 mL 튜브에 넣습니다. 300 rpm에서 흔들리는 인큐베이터에서 37 °C에서 하루 동안 배양하십시오.
- 하루의 끝에서, 종자 300 mL 항생제와 항생제와 2 mL 스타터 배양에서 단계 1.2.1 및 300 rpm에서 흔들리는 인큐베이터에서 37 °C에서 하룻밤 배양.
- 플라스미드 DNA 제제
- 다음 날 아침에는 실내독소프리 맥시프렙 키트를 사용하여 매직 마커 플라스미드 DNA(예: PB-CAG-Cytbow 및 Tol2-CAG-Nucbow, PB 및 Tol2 transposass 및 Cre recombinasase)를 표현하는 CAG 중심의 플라스미드의 정제를 진행합니다.
- -20°C에서 저장하기 전에 200μL의 멸균수에서 DNA를 엘테우고 분광계를 사용하여 농도를 추정한다.
2. 자궁 전기 기화에서 매직 마커에 대한 준비 (MM IUE)
- 솔루션 준비
- 수조에서 37°C에서 0.9% 식염수의 30mL를 따뜻하게 하고 수술 기간 내내 따뜻하게 유지한다.
- PB-CAG-Cytbow 및 Tol2-CAG-Nucbow (최종 농도, 0.8 μg/μL 각), PB 및 Tol2 트랜스포지스(최종 농도, 0.4 μg/μL), CAG-seCre(최종 농도, 0.16 μg/μL), 그리고 0.01% 초율 2°C를 포함하는 플라스미드 믹스를 PB-CAG-Cytbow 및 0.01% 초율 2+2+2++0.1%의 초고속Cec+ 및 0.01% MgS+의 경우 2.01%
참고: 성상세포 해부학 적 재건 을 위해 Tol2-CAG-Nucbow 구조가 생략 될 수 있습니다. 그러나,이 플라스미드는 밀접하게 나란히 된 성상 세포의 이중을 구별하고 점상 세포 사이의 복제 관계를 조사하기 위해 MAGIC 마커를 사용할 때 유용합니다14. - 식염수 용액2mL에서 희석된 케타민 100 μL(100 mg/mL) 및 자일라진(20 mg/mL)의 100 μL을 포함하는 마취 용액을 준비합니다.
- 식염수 용액으로 0.3 mg /mL buprenorphine 재고 용액 1:10을 희석하여 진통 용액을 준비하십시오.
- 수술 재료의 준비
- 유리 비드 멸균기 또는 이에 상응하는 수술 도구 (재료 표참조)를 고온에서 살균하십시오.
- 전극 젤 한 방울을 35mm 접시에 놓습니다.
- 마이크로피펫 홀더에 마이크로파이프를 삽입하고, 마이크로피펫의 끝을 부수고, DNA 용액을 갈망한다.
- 빠른 녹색 솔루션의 1 μL 드롭 (0.01%) 배치 3cm 접시의 뚜껑에, 참고로 사용하여 미세 한 집게로 팁을 깨고 마이크로 파이펫의 팁의 직경을 조정합니다. 압력 파라미터를 조정하여 동일한 크기 방울이 마이크로인젝터에 의해 생성되도록 조정하여 주입당 약 1 μL의 DNA 용액을 전달할 수 있게 한다.
- 임신 한 여성 마우스의 준비
- RjOrl: 스위스 임신 한 마우스의 무게.
- 마취 용액의 체중(BW) 그램당 12.5 μL의 복막 주사를 수행합니다. 5 분 동안 기다렸다가 마우스가 발가락을 꼬집어 잠들어 있는지 확인하십시오.
- 동물이 핀치에 반응하지 않는 후, 진통제 용액의 1.6 μL / g BW로 피하로 주입하십시오.
- 각 눈에 안구 젤 한 방울을 추가하여 수술 중 건조를 방지하고 동물 배를 온난화 패드에 올려 놓습니다.
- 복부를 부드럽게 면도하고 요오드에 담근 패드로 청소하고 면도 부위를 알코올 패드로 소독합니다.
- 면도, 청소 및 위생 영역 주위에 멸균 압축을 배치하여 운영 필드를 정렬합니다.
3. 자궁 전기 기화 (IUE)
- 정맥 내 주입
- 복부의 하부에서 시작하여 피부를 통해, 그리고 근본적인 근육을 통해 중간선을 따라 2cm 수직 절개를 잘라냅니다. 배아 봉투를 부드럽게 조작하여 자궁 뿔을 노출하고 자궁 경부의 각 면에 자궁 경부의 위치와 배아 봉투의 수를 평가합니다.
- 뇌를 보기 위해 전극되는 E15.5 배아의 뇌를 지향하며, 대뇌 균열을 따라 실행되는 3개의 주요 혈관의 접합과 일치하는 위치로 쉽게 인식된다.
- 브레그마 (두개골을 통해 볼 수) 및 눈 사이의 가상 선을 상상해보십시오. 가상 선과 세로 균열 사이의 마이크로 피펫을 소개한 다음 인젝터의 발 페달을 눌러 표적 반구의 측면 심실에서 DNA 용액 1 μL을 전달합니다.
참고: 적절한 위치에 주입하면 채워진 측면 심실이 파란색으로 나타나 DNA 용액으로 채워졌음을 나타냅니다.
- 전기 기공
- 이전에 전극(재료 표참조)을 적용하여 주입된 배아의 양면에 주입된 반구를 덮는 양극을 사용했습니다. 전기포레이터의 발 페달을 눌러 각각 950ms 간격으로 분리된 35V의 4개의 50ms 펄스 시리즈를 전달합니다.
- 따뜻한 식염수 용액으로 배아를 약화시다.
참고: 배아는 전체 수술 중에 온난한 식염수 용액을 사용하여 습한 유지되어야하며 자궁은 건조해서는 안됩니다. - 각 배아에 대해 3.1.2-3.2.2단계를 반복한다.
- 모든 표적 배아가 전포화되면, 복부의 자궁 뿔을 원래 위치로 부드럽게 밀어 넣음으로써 교체하십시오. 봉합사가 만들어지는 동안 자궁이 건조되는 것을 방지하기 위해 데운데온 식염수 용액으로 복강을 채웁니다.
- 먼저 연속 흡수 봉합사로 복부 근육을 닫은 다음 4-0 봉합사를 사용하여 여러 개별 바늘 (~10)으로 피부를 닫습니다.
- 깨끗한 케이지에 동물을 넣고 깨끗한 종이 타월에 옆에 누워 서서 5-10 분마다 동물을 다른 쪽으로 돌려 서 깨어나서 스스로 움직이기 시작합니다.
- 특히 둥지가 만들어진 경우 다음 날 동물의 상태를 평가합니다.
참고: 수술 후 치료가 필요하지 않습니다. 둥지가 없는 경우 통증의 징후(예: 프로스티네이션, 털이 많은 모피) 및/또는 무거운 출혈이 있을 때, 동물은 지체 없이 안락사되어야 합니다.
4. 조직 수확 및 단면
- 티슈 컬렉션
- 원하는 수확 시간에 말단 마취를 위해 페노바르비탈(100 mg/kg BW)을 회대적으로 주입합니다. 이 경우, 수확 시간은 출생 후 (P) 일 P4, P7 및 P21에 있었다.
- 차가운 미리 만들어진 파라포름알데히드 기반 용액을 사용하여 심내 관류를 수행합니다.
- 뇌를 해부하고 후고사를 위한 파라포름알데히드 기반 용액에서 4°C로 하룻밤 을 배치합니다.
- 조직학
- 다음 날 아침 1x PBS로 10분 동안 뇌를 3배 헹구는 다.
- 1x PBS에 용해된 3%의 아가로즈에 뇌를 포함시켰습니다.
- 진동 블레이드 마이크로톤을 사용하여 80 μm 섹션을 잘라냅니다.
- 1x PBS로 미리 채워진 24 개의 웰 플레이트에서 섹션을 수집합니다.
- 슬라이드와 커버슬립 사이에 마운팅 매체(재료 표 참조)의마운트 섹션. 최적의 형광 단백질 보존 및 장기 저장을 위해 장착 된 슬라이드를 -20 °C로 유지하십시오.
5. 멀티 채널 공초점 이미징
- 현미경 설정
- 각각 440, 515 및 559 nm 레이저 라인을 사용하여 mCerulean /mTurquoise2, EYFP, tdTomato / mCherry를 자극하는 공초점 현미경의 구성을 설정합니다.
- 20x 0.8 NA(또는 NA 이상) 목표를 사용하고 나이퀴스트 기준에 따라 XY 샘플링 및 Z 단계 크기를 조정합니다.
참고: 고해상도(예: 60x 1.4 NA 오일 목표)와 데옹볼루션 알고리즘으로 획득한 이미지는 성상세포 식소의 미세한 세부 사항을 재구성할 수 있습니다. 그러나, 실험자는 최고성상세포 공정이 기존의 광학 이미징에 의해 해결되지 않을 수 있다는 점을 명심해야 한다.
- 이미지 수집
- 전기 화 영역에서 가장 밝은 성상구를 찾을 수 있습니다.
- 서피스 가까이에 있는 레이블이 표시된 셀이 슬라이스의 더 깊은 셀보다 더 밝게 보일 수 있으므로 표면 셀의 획득 설정을 조정하여 이미지를 포화하지 않도록 합니다.
- 3개 채널 각각에 대해 개별적으로 획득 설정을 조정하는 동시에 0값을 파란색으로 표시하고 최대 픽셀 값을 빨간색으로 표시하는 HiLo LUT를 사용하여 픽셀 채도를 방지할 수 있습니다.
참고: 균형 잡힌 이미지는 파란색이 몇 개이고 빨간색 픽셀이 거의 표시되지 않습니다. - 마이크로코프의 전동 단계를 사용하여 타일로 된 1,024 x 1,024 픽셀 Z 스택을 획득하고, 인접한 스택 사이에 10% 겹쳐서 전기폴화된 영역 또는 관심 영역의 모자이크 재구성을 가능하게 합니다.
6. 천체 영토 체적 세분화
참고: 이 프로그램은 상용 소프트웨어 프로그램(예: IMARIS)을 사용하여 수행됩니다.
-
데이터 집합 준비
- 3D 재구성(250 x 250 픽셀) 내에서 표지된 성상세포를 심작하여 이미지 된 조직 섹션에 완전히 동봉된 세포를 선택합니다.
참고: 사용된 컴퓨터가 처리할 수 있는 경우 더 많은 볼륨에서 직접 작업할 수도 있습니다. - 능가 뷰의 오브젝트 도구 모음의 파란색 표면 버튼을 클릭하여 각 성상세포에 대한 새 표면을 만듭니다.
- 더 나은 시각화 대비를 얻으려면 먼저 편집 | 클릭하여 최소 및 최대 색상 대비 값을 조정합니다. 표시 조정 옵션을 표시하고 두 핸들을 모두 드래그합니다. 필요한 경우 새 색상을 선택하려면 디스플레이 조정 창의 채널 이름을 직접 클릭하여 채널 색상을 변경합니다.
참고: 시각적 편향을 방지하기 위해 항상 동일한 색상 디스플레이로 작업합니다. - | 편집을 클릭합니다. 이미지 특성은 마이크로미터에서 복셀 크기를 수동으로 나타냅니다. 복셀 크기가 정확하지 않으면 볼륨 계산이 올바르지 않습니다.
- 새 설정을 저장합니다.
- 3D 재구성(250 x 250 픽셀) 내에서 표지된 성상세포를 심작하여 이미지 된 조직 섹션에 완전히 동봉된 세포를 선택합니다.
-
표면 세분화
- 파란색 아이콘을 사용하여 서피스를 소개합니다. Surface 아이콘과 상자가 장면 목록에 나타납니다. 볼륨 박스를 사용하면 데이터 집합을 보거나 숨길 수 있습니다.
- 서피스 라인을 선택하고 자동 생성 건너뛰기 | 클릭합니다. 수동으로 편집할 수 있습니다.
- 컨투어 | 클릭하십시오. 가시성 및 없음을 클릭합니다. 그런 다음 선택 보기로 이동하여 그리기 단추를 클릭합니다.
- 모드를 클릭하여 그리기 모드를 선택합니다.
- 빠르고 효율적인 Isoline 반자동 드로잉 도구를 사용합니다. 마우스 포인터를 이동하여 셀 윤곽선을 정의합니다. isoline 미리 보기가 성상세포 윤곽선과 일치하지 않으면 마우스 포인터 위치를 조정합니다. 미리 보기의 유효성을 검사하려면 선택 영역을 클릭합니다. 잠재적인 실수를 해결하려면 보드 창을 사용하여 현재 Z-평면 윤곽을 삭제하거나 Ctrl + Z를누릅니다.
- 슬라이스 | 사용 Z-평면을 탐색하고 Z-평면 번호를 변경하여 다음 비행기로 이동하고 새 윤곽을 시작합니다. 우선적으로 셀의 중간에서 시작한 다음 사지로 이동합니다.
- 성상세포가 포함된 모든 Z 평면에 윤곽선이 그려진 경우 Surface 만들기를클릭합니다. 서피스를 만들기 전에 모든 구성 요소가 연결되어 있는지 확인합니다. 그렇지 않은 경우 볼륨 데이터를 내보내기 전에 가장 큰 것을 선택하거나 관련 데이터를 연결합니다.
- 데이터 패널에 표시된 정량적 데이터를 확인하고 통계를 스프레드시트 형식으로 내보내 볼륨 값과 단위를 절약합니다.
- 새 이름으로 서피스를 저장하여 나중에 액세스할 수 있습니다.
7. 성상세포 식목을 추적
참고: 오픈 액세스 소프트웨어 프로그램 Vaa3D를 사용하여 수행됩니다.
- 데이터 집합 준비
- 이미지 스택을 로드하고 분리된 성상세포 또는 고유한 색상을 표시하는 근처의 성상세포를 검색합니다.
참고: 목표 NA 및 샘플링을 증가시켜 재구성의 해상도를 향상시킬 수 있습니다. 그러나 궁극적으로, 공초점 현미경 검사법의 해상도 한계로 인해 최고의 성상세포 공정을 정확하게 추적할 수 없습니다. 획득한 이미지의 해상도를 넘어서 는 과분할을 방지하기 위해 주의를 기울여야 합니다. - 피지를 사용 하 여, 자르기 250 x 250 픽셀 이미지 각 성상 세포 주위에 스택.
- Vaa3D 추적은 하나의 색상에서만 수행하므로 하나의 채널을 선택하고 다른 채널을 비활성화합니다.
- 이미지를 RGB로 변환하고 .tiff 형식으로 저장합니다.
- 이미지 스택을 로드하고 분리된 성상세포 또는 고유한 색상을 표시하는 근처의 성상세포를 검색합니다.
- 아버 추적
- Vaa3D에서 RGB 이미지를 엽니다. 이미지 | 이동 데이터 | 그런 다음 형상을 다시 샘플링하고X/Y 및 Z 복셀 크기 값을 조정합니다.
참고: 성상세포 아버를 재구성하는 동안 이미지에서 제공하는 해상도보다 세부 정보를 더 미세하게 추적하지 않도록 주의해야 합니다. - 전체 이미지에 대해 | 3D 뷰어 를 시각화를클릭하여 3D 창을 엽니다. 3D 이미지를 마우스 오른쪽 버튼으로 클릭하고 마커를 정의하려면 1-오른쪽 클릭을 선택합니다. 커서를 사용하여 성상세포의 중심을 점한 다음 오른쪽 단추를 클릭하여 마커를 설정합니다.
참고: 이스케이프를 클릭하여 3D 보기에 다시 액세스할 수 있습니다. - 고급 | 3D 추적 | Vaa3D-Neuron2 자동 추적.
- 새로 열린 창에서 플러그인을 적용할 채널을 선택합니다.
- 배경 임계값(종종 30~90개 사이)을 선택합니다. 필요한 경우 각 성상세포에 대해 이 값을 조정합니다.
- 2D에서 반경을 선택 취소하고 자동 다운 샘플 및 자동 다시 샘플링을 확인합니다.
- cnn_type 3, length_thresh 1로 설정하고 0.1로 SR_ratio.
- 확인을클릭한 후 플러그인이 원래 이름에 따라 두 개의 파일을 자동으로 생성하도록 합니다. 접미사 -ini.swc 및 -좌표X-좌표Z-app2.swc가 추가됩니다. 플러그인을 계속 실행하는 동안 덮어 쓰지 않도록 이러한 이름 파일에 고유한 레이블을 수동으로 추가합니다.
- 개체 관리자열기, 뉴런 | 선 구조,추적 된 성상 구조를 선택하고 디스플레이 모드를클릭하고 항상 라인 모드를 선택합니다.
- 성상세포의 골격이 나타나는 3D 창으로 돌아갑니다.
참고: 세분화 및 신호가 일치하지 않는 경우 7.2.3-7.2.10 단계를 반복하고 임계값을 조정할 때까지 조정합니다. 플러그인을 다시 시작할 때 재설정될 때 다른 매개 변수를 다시 입력해야 합니다. - 골격을 마우스 오른쪽 버튼으로 클릭하고 첫 번째 선택 뉴런 | 라인 #1을 선택 ... APP2_Tracing 새 창 표면에 표시되는 정량적 측정에 액세스합니다| 개체 에노션.
참고: 빛 현미경 검사법의 제한된 해상도로 인해 나열된 품목에 표시된 측정 분기 수및 분기 수는 성상 세포 식소 복잡성의 대략적인 추정치만 제공합니다.
- Vaa3D에서 RGB 이미지를 엽니다. 이미지 | 이동 데이터 | 그런 다음 형상을 다시 샘플링하고X/Y 및 Z 복셀 크기 값을 조정합니다.
결과
배아 피질 전조자에서 MAGIC 마커의 전기화는 대뇌 피질 발달의 초기단계에서 후반 단계까지 성상신구의 라벨링을 허용한다(도1). 이 성상 세포는 전체 대뇌 피질에 넓게 분산되는 각종 산후 단계 (P4, P7, P21)에 있는 모든 피질 층에서 찾아냈습니다. 그들은 20x 0.8 NA (또는 더 높은 NA) 목표로 획득 한 타일 공초점 이미지로 평가되고 Z 스택 재구성(그림 2)으로조립되었습니다. MAGIC 마커 결합 라벨은 피질 성상 세포의 개별화와 볼륨 및 형태에 관한 정보의 추출을 가능하게했습니다. 상용 이미지 분석 소프트웨어를 사용하여, 개별 성상 세포의 윤곽은 각 성상세포에 의해 점유된 영토 도메인을 세그먼트및 재구성하기 위해 공초점 이미지 스택의 각 개별 광학 섹션에 묘사되었다(그림3). 동일한 Z-이미지 스택에서, 단일 피질 성상세포의 분기 형태는 주요 성상세포 공정의 골격을 추출할 수 있는 개방형 액세스 소프트웨어를 사용하여 분할되었다(그림4). 이러한 세분화 및 추적 도구는 초기에서 후반산후단계(14)까지 개별 피질 성상세포에 대해 발생한 영토 부피(도3)및형태학적 복잡성(도4)의증가에 대한 반정량적 평가를 제공했다. 이러한 접근법은 또한 도 2, 도 3및 도 4에도시된 바와 같이 동일한 개발 단계에서 뚜렷한 피질 성상세포에 의해 표시되는 부피 및 형태학의 이질성을 드러냈다.

그림 1: 자궁 전기기(IUE)에서 MAGIC 마커(MM)의 회로도 표현은 뇌 발달 중 피질 전조자와 하강을 라벨링합니다. (A)MM 툴킷은 PB-Cytbow, Tol2-Nucbow,PB 및 Tol2 트랜스포지, 및 자가 소비성 Cre 재조합(seCre)을 코딩하는 여러 플라스미드로 구성됩니다. MM 구조에서 호환되지 않는 록스 사이트(loxN, lox2272및 loxP)3쌍의 플런지 네 가지 FP 코딩 시퀀스(EBFP2, mTurquoise2/mCerulean, EYFP, tdTomato/mCherry)가 결합시 상호 배의 절제 가능성을 생성합니다. Cre 작용 전에, 첫 번째 유전자(EBFP2)만 발현된다. 세크레에 의해 유도된 Cre-매개 절제 후, tdTomato/mCherry(레드 FP), EYFP(녹색 FP), 또는 mTurquoise2/mCerulean(시안 FP)이 표현된다. 여러 MAGIC 마커사본으로부터 FP의 공동 발현은 라벨이 부착된 세포의세포질(PB-CAG-Cytbow)또는핵(Tol2-CAG-Nucbow)에서색 조합을 산출한다. MM 카세트를 프레이밍하는 PB 및 Tol2 전치 엔드피트는 MM 구조가 PB 및 Tol2 트랜스포지코딩 플라스미드와 함께 코전기포이트될 때 피질 전조자의 게놈에 통합할 수 있게 합니다. (B-G) 마취된 임신생(B)의 복강경 절제술을 포함한 IUE 연속단계의 그래픽 일러스트는 배아의 측면 심실에서 MM 플라스미드믹스(C)를주입하고, 신중하게 배치된 트위저로데스(E)를 통한 전기 펄스의 전달을 통해 두 개의 뇌 반구(Fmen)와 임신한마우스(Fmen)의주사를 포함한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
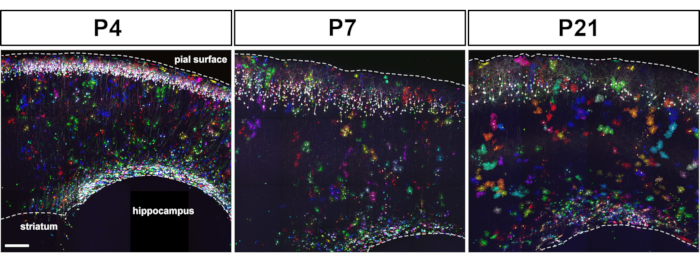
그림 2: MAGIC 마커 툴킷의 자궁 전기화에 따라, 다색 성상세포는 산후 단계에서 전체 대뇌 피질에 흩어져 있는 것을 발견하였다. E15.5 마우스 피질 선조에서 MM, seCre, PB 및 Tol2 트랜스포지스 발현을 구동하는 플라스미드의 IUE는 P4, P7 및 P21에서 2-3 뉴런 및 성상세포를 표지하는 결과를 낳았다. 발현 수준과 색상 팔레트는 피질 전구의 게놈에 통합된 MM 전분의 수에 의존한다. 80 μm 처진 뇌 섹션에서 획득 한 타일 공초점 이미지 스택에서 최대 강도 투영의 몽타주. 스케일 바: 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 뚜렷한 발달 단계에서 피질 성상세포 영토 도메인의 세분화. 자른 공초점 Z 스택 프레이밍 개별 성상세포(A-F)와상업 소프트웨어(A'-F)와세 가지 별개의 개발 단계에서 분할 된 해당 관련 영토 도메인의 최대 강도 투영 : P4(A-B, A'-B'),P7(C-D, C'D'),및 P21(E-F, E'F). 스케일 바: 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
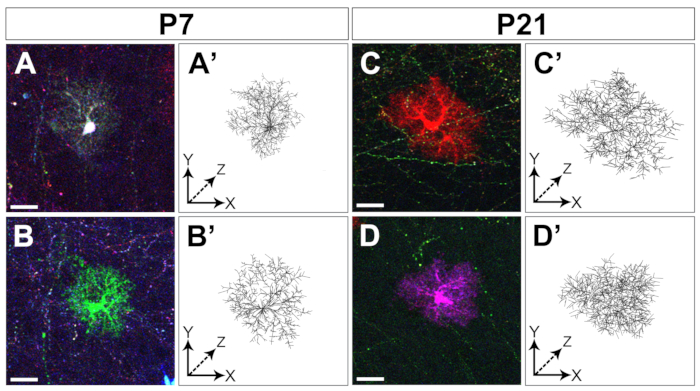
그림 4: 피질 성상세포 식소의 추적. 공초점Z-스택(A-D)에서자른 두 개의 뚜렷한 성상세포와 그들의 배분 재구성의 예는 각각 두 개의 별개의 발달 단계에서 수집된 Vaa3D(A'-D)와 P21(C-D,C'D')로거칠게 세분화되어 있다. 스케일 바: 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
피질 전구체에서 MAGIC 마커의 자궁 전기기화(IUE)에서(도1)다른 산후 단계에서 산후 대뇌 피질 전체에 성상세포의 라벨링을 가능하게 하였다(P4-P7-P21, 도 2). 흥미롭게도, E13.5에서 E15.5로 수행된 전기포기는 피질 성상세포14에관한 유사한 라벨링 패턴을 산출하기 때문에 IUE의 단계는 중요하지 않습니다. 그러나, 피질 빈당에 표지된 피라미드 뉴런의 위치는 전기기질 단계에 따라 다릅니다. 실제로, IUE는 E15 마크 층 에서 수행 2-3 뉴런 반면 IUE는 층 5에서 층 2-36,27에모든 피질 층에서 E13 라벨 피라미드 뉴런에서 수행. MM IUE에 이어 피질 피라미드 뉴런의 이 조인트 라벨링은 조밀한 뉴런 라벨링이 성상세포 공정 인식을 방해하는 층에서 성상세포 형태학의 반자동 세분화를 방지하기 때문에 이 방법의 주요 한계입니다. 그것이 문제가 될 경우, MM은 PALE에서와 같이 산후 단계에서 전포 될 수 있습니다. P4에서, 그 단계에 아직도 존재하는 방사형 glia 섬유의 라벨링은 또한 Vaa3D 중단 분할을 방해할 수 있습니다. 번거롭지만, 이 단계에서 성상세포 아버 재건을 진행하고자하는 경우 해결책은 Adobe Photoshop을 사용하여 관심있는 성상 세포 주위에 검은 색 픽셀로 방사형 섬유 신호를 점진적으로 교체하여 방사형 신경교 섬유를 수동으로 제거하는 것입니다.
이러한 제한에도 불구하고 MM IUE는 적절하게 수행될 때 강력한 기술입니다. 몇 가지 중요한 단계는 신중하게 처리될 필요가 있습니다: 1) 태아는 전체 수술 절차 도중 습하게 유지하고 그들의 생존을 증가시키기 위하여 주의 깊게 조작되어야 합니다; 2) 직경이 큰 유리 모세 혈관을 사용하거나 배아 봉투를 너무 단단히 압착하면 가방 파열로 이어질 수 있으므로 배아의 사망; 3) DNA 주입 하는 동안, 혈관 출혈을 방지 하기 위해 피해야 한다; 4) 전체 절차는 배아 생존을 극대화하기 위해 마취에서 봉합사까지 40 분 이상 지속되어서는 안됩니다. 5) 스트레스는 IUE 성공에 중요한 역할을하므로 케이지, 운송, 소음 및 진동 변경과 같은 추가 스트레스 원천은 낙태와 식인풍을 방지하기 위해 출생 후 5 일 에서 출생 후 7 일까지 피해야합니다.
참고로, 주어진 단계에서 태어난 세포를 구체적으로 표적으로 삼고자 하는 실험자는 전공시 태어난 세포만이 조합라벨을 표현하는 피기박 및 Tol2 트랜스포아제를 첨가하지 않고 MM 툴킷을 사용할 수 있다. 이 방법의 또 다른 장점은 표지된 세포의 밀도와 다양한 뇌 영역에서의 위치 측면에서 부여하는 유연성입니다. 실제로, 피질 성상세포의 밀도 가성 라벨링은 플라스미드 비율을 일정하게 유지하면서 MM 트랜스게네스의 총 농도를 증가시킴으로써 달성될 수 있다(Cre 재조합/MM 구조의 경우 1:10 비 및 트랜스포지/MM 구조의 경우 1:2 비율). 개별 성상세포를 단략하는 능력이 희소 라벨링을 필요로 하는 Ai9 마우스의 단일 색 트랜스포슨 또는 Cre 전기포기의 전기화와 같은 흑백 접근법과는 달리 MAGIC Markers 전략에 의해 제공되는 색상 대비는 광범위한 라벨링 밀도에 걸쳐 성상세포의 개별화를 가능하게 합니다. 또한, 뚜렷한 방향으로 전극 프로브를 포지셔닝하면 예비 물자(대뇌 피질에서 전기화를 달성하는 데 필요한 등쪽 위치와 반대되는 복부 위치의 양극) 또는 해마(내측 위치의 양극)와 같은 뚜렷한 뇌 영역을 타겟팅할 수있다. 마지막으로, IUE는 트랜스제닉 동물 질환 모델에서 MM 툴킷을 사용하는 길을 열어주는 근친교(OF1, Swiss) 및 근친교(C57BL/6J 또는 N) 마우스와 같은 다른 마우스 균주에서 수행될 수 있다. 그러나, 성공적으로 근친생쥐에서 IUE를 달성하기 위하여는, 하나는 펄스의 수(스위스에서 5개의 펄스대 C57BL/6 마우스를 위한 3개의 펄스), 전압(35V 대신 30V), 및 진통 복용량(0.15 mg/mL buprenorphine 주식 용액 및 0.8 μL/g BW의 주입된 부피)를 조정해야 합니다.
형질 전환식 동물 사육 또는 창백한 스타트랙 접근법과 비교하여 이 방법은 몇 가지 이점을 제공합니다. 시작하려면, 번식 전략과는 달리, 그것은 몇 가지 동물을 사용합니다. 그것은 또한 태아 단계와 는 달리, 태아 단계를 포함하여 그들의 발달의 초기 단계부터 피질 성상세포의 표시를허용합니다,산후 전기화에 의존하는. 또한 StarTrack 접근법8에사용되는 12개의 리포터 구성에 비해 이 전략은 두 개의 다색 트랜스진에만 의존하여 DNA 혼합 준비 및 이미징을 더 간단하게 만듭니다. 더욱이, MM에 의해 발현된 상이한 색 사이의 균형은 본질적으로 트랜스게네시스의 구조에 의해 결정되며 실험자가 상이한 성분의 혼합에 의존하지 않는다. 또한, 이 전략은 단순한 해부학적 고려를 넘어 확장될 수 있으며 이전에 발표된작업(14)에서설명한 바와 같이 성상세포 발달의 다중 클론 분석을 성공적으로 적용할 수 있다. 이 작품은 세포질 및 핵 마커의 희귀 한 색상 조합을 사용하여 피질 성상 세포 클론을 정의하며 생성 된 세포의 공간 분포, 구조 조직, 수 및 하위 유형측면에서 광범위한 가변성을 표시한다는 것을 입증했습니다.
MM 라벨피질 선조에서 태어난 피질 성상세포는 상당한 색상 대비를 표시하고 전체 대뇌 피질(그림2)에걸쳐 널리 분산되었다. 공초점 현미경을 이용한 간단한 멀티채널 Z-스택 인수는 여러 산후 단계에서 자신의 영토 부피(도3)및 형태학적 복잡성(도4)과같은 주요 성상세포 기능에 액세스하는 데 사용되었습니다. 성상 세포 를 넘어, 이 방법론은 oligodendrocytes와 같은 그밖 신경교 세포의 형태를 공부하기 위하여 적응될 수 있습니다. 그러나, 공초점 현미경 검사법에 의해 제공된 제한된 해상도는 성상 세포 형태학적 복잡성의 부분 렌더링만 제공할 수 있다는 것을 명심해야 합니다. 고해상도(예: 63x 1.4 NA 오일 목표)와 deconvolution 알고리즘으로 얻은 이미지는 성상세포 아버14의미세한 세부 사항을 재구성하는 데 사용될 수 있지만, 기존의 광학 이미징으로는 최고의 공정을 해결할 수 없습니다. 그럼에도 불구 하 고, 여기에 제시 된 전략은 신경 질환의 마우스 모델에서 피질 성상세포 볼륨 또는 형태에 영향을 미치는 잠재적 인 표현형을 위해 효율적으로 선별하는 것이 흥미가 될 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 S. Fouquet와 Institut de la Vision 및 Institut des Neurosciences de Montpellier (MRI 및 RAM)의 이미징 및 동물 핵심 시설에 대한 기술 지원을 감사드립니다. 이 작품은 레기온 일 드 프랑스와 퐁당 ARC에서 S.C에 라 레체쉬 쉬르 르 암을 부어, 그리고 유니버시테 파리 - 사클레이 (이니셔티브 박사 박사 인터디스클레나테르)에서 L.A.에, 유럽 연구 위원회 (ERC-SG 336331, PI J. Valette)에서 E.H.에 자금을 지원함으로써, 기관 국립 드 라 레체쉬 계약에 따라 ANR-10-LABX-65 (LabEx 라이프 센스), ANR-11-EQPX-0029 (Equipex Morphoscope2), ANR-10-INB4 유럽연구위원회(ERC-CoG 649117, PI J. Livet)와 ATIP-Avenir 프로그램(PI K. Loulier)에 의해, 라 레체쉬 메디칼(Ref. DBI20141231328)을 지원한다.
자료
| Name | Company | Catalog Number | Comments |
| 1.1 Bacteria transformation | |||
| Ampicillin | Euromedex | EU0400-C | |
| DH5 alpha competent cells | Fisher Scientitic | 11563117 | |
| Ice box | Dutscher | 139959 | |
| Kanamycin | Sigma | 60615 | |
| LB Agar | Sigma | L2897 | |
| SOC medium | Fisher Scientitic | 11563117 | |
| Sterile petri dish- 10 cm | Thermo Fisher | 150350 | |
| Water bath | VWR | 462-0556H | |
| 1.2 Plasmid culture | |||
| 14 ml culture tube | Dutscher | 187262 | |
| Glass erlenmeyer- 2L | Fisher Scientitic | 11383454 | |
| LB medium | Sigma | L3522 | |
| 1.3 Plasmid DNA preparation | |||
| NucleoBond Xtra Maxi Plus EF | Macherey-Nagel | 740426.10 | |
| 2.1 Preparation of the solutions | |||
| 26 G x 1/2 needle | Terumo | 8AN2613R1 | |
| 30 G x 1/2 needle | Terumo | 8AN3013R1 | |
| Fast Green | Sigma Aldrich | F7272 | |
| NaCl | VWR | 27810.295 | |
| Single-use polypropylene syringe, 1 mL | Dutscher | 50002 | |
| 2.2 Preparation of the surgery material | |||
| Adson Forceps - DeBakey Pattern- 12.5 cm | FST | 11617-12 | |
| Arched tip Forceps- 10 cm | FST | 11071-10 | |
| Glass bead sterilizer Steri 250 | Sigma | Z378569 | |
| Glass micropipette 1 mm diameter | FHC | 10-10-L | |
| Graefe Forceps - Titanium 1 mm Tips Slight Curve- 10 cm | FST | 11651-10 | |
| Graefe Forceps - Titanium 1 mm Tips Straight- 10 cm | FST | 11650-10 | |
| Iris Scissors - Delicate Straight- 9 cm | FST | 14060-09 | |
| Laboratory tape | Fisher Scientitic | 11730454 | |
| Microinjector | INJECT+MATIC | No catalog number | |
| Olsen-Hegar Needle Holder - 12 cm | FST | 12002-12 | |
| Optical fiber | VWR | 631-1806 | |
| Plastic-coated white paper | Distrimed | 700103 | |
| Signagel electrode gel | Free-Med | 15-60 | |
| Sterile Petri dish- 35 mm | Dutscher | 056714 | |
| Sterilizer, glass dry bead, Steri 250 | Sigma | Z378569 | |
| 2.3 Preparation of the pregnant female mouse | |||
| Alcohol pad | Alcomed | 1731000 | |
| Buprecare | Axience | 0.3 mg/ml | |
| Compress | tRAFFIN | 70189 | |
| Ketamine | Merial | Imalgene 1000 | |
| Ocular gel | tvm lab | Ocry-gel | |
| RjOrl:SWISS mice | Janvier Labs | ||
| Vetadine, 10% solution | Vetoquinol | 4337400113B | |
| Warming pad | Harvard Apparatus | 72-0493 | |
| Xylazine | Bayer | Rompun 2% | |
| 3.2 Electroporation | |||
| Absorbable suture Size 4-0 45 cm Suture 1-Needle 19 mm Length 3/8 Circle Reverse | Novosyn | C0068220 | |
| Electroporateur Sonidel | Sonidel | NEPA 21 | |
| Sterile transfer pipets (individually wrapped) | Dutscher | 043202S | |
| Tweezers with 3 mm platinium disk electrodes | Sonidel | CUY650P3 | |
| 4.1 Tissue harvesting and sectioning | |||
| 24-well plate | Falcon | 353047 | |
| Agarose | Lonza | 50004 | |
| Antigenfix | Microm Microtech | U/P0014 | |
| Coverslip | Dutscher | 100266 | |
| Dolethal | Vetoquinol | DOL202 | |
| DPBS (10X), no calcium, no magnesium | Fisher Scientific | 11540486 | |
| Nail polish | EMS | 72180 | |
| Slide | Dutscher | 100001 | |
| Vectashield | Vectorlabs | H-1000 | |
| Vibratome | Leica | VT1000S | |
| 5. Multichannel confocal imaging | |||
| 20X oil NA 0.85 | Olympus | ||
| Confocal Laser Scanning Microscope | Carl Zeiss | LSM880 | |
| Confocal Laser Scanning Microscope | Olympus | FV1000 | |
| Plan Apochromat 20x/0.8 M27 | Carl Zeiss | ||
| 6. Astrocyte territorial volume segmentation | |||
| IMARIS 8.3 and later versions | Bitplane | ||
| 7. Astrocyte arborization tracing | |||
| 3D Visualization-Assisted Analysis software suite (Vaa3D) | HHMI - Janelia Research Campus /Allen Institute for Brain Science |
참고문헌
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nature Reviews Neuroscience. 14 (5), 311-321 (2013).
- Ma, Z., Stork, T., Bergles, D. E., Freeman, M. R. Neuromodulators signal through astrocytes to alter neural circuit activity and behaviour. Nature. 539 (7629), 428-432 (2016).
- Blanco-Suárez, E., Caldwell, A. L. M., Allen, N. J. Role of astrocyte-synapse interactions in CNS disorders: Astrocyte-synapse disease. The Journal of Physiology. 595 (6), 1903-1916 (2017).
- Stogsdill, J. A., et al. Astrocytic neuroligins control astrocyte morphogenesis and synaptogenesis. Nature. 551 (7679), 192-197 (2017).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes in Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development, Growth & Differentiation. 50 (6), 499-506 (2008).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Martín-López, E., García-Marques, J., Núñez-Llaves, R., López-Mascaraque, L. Clonal Astrocytic Response to Cortical Injury. PLoS ONE. 8 (9), 74039(2013).
- Gutiérrez, Y., et al. Sibling astrocytes share preferential coupling via gap junctions. Glia. 67 (10), 1852-1858 (2019).
- Lee, Y., Messing, A., Su, M., Brenner, M. GFAP promoter elements required for region-specific and astrocyte-specific expression. Glia. 56 (5), 481-493 (2008).
- Yoon, H., Walters, G., Paulsen, A. R., Scarisbrick, I. A. Astrocyte heterogeneity across the brain and spinal cord occurs developmentally, in adulthood and in response to demyelination. PloS One. 12 (7), 0180697(2017).
- Ge, W. P., Miyawaki, A., Gage, F. H., Jan, Y. N., Jan, L. Y. Local generation of glia is a major astrocyte source in postnatal cortex. Nature. 484 (7394), 376-380 (2012).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Figueres-Oñate, M., García-Marqués, J., López-Mascaraque, L. UbC-StarTrack, a clonal method to target the entire progeny of individual progenitors. Scientific Reports. 6 (1), 33896(2016).
- Figueres-Oñate, M., García-Marqués, J., Pedraza, M., De Carlos, J. A., López-Mascaraque, L. Spatiotemporal analyses of neural lineages after embryonic and postnatal progenitor targeting combining different reporters. Frontiers in Neuroscience. 9, 87(2015).
- Figueres-Oñate, M., Sánchez-Villalón, M., Sánchez-González, R., López-Mascaraque, L. Lineage Tracing and Cell Potential of Postnatal Single Progenitor Cells In Vivo. Stem Cell Reports. 13 (4), 700-712 (2019).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Peng, H., Bria, A., Zhou, Z., Iannello, G., Long, F. Extensible visualization and analysis for multidimensional images using Vaa3D. Nature Protocols. 9 (1), 193-208 (2014).
- Peng, H., et al. Virtual finger boosts three-dimensional imaging and microsurgery as well as terabyte volume image visualization and analysis. Nature Communications. 5 (1), 4342(2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108 (2), 193-199 (1991).
- Abdeladim, L., et al. Multicolor multiscale brain imaging with chromatic multiphoton serial microscopy. Nature Communications. 10 (1), 1662(2019).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate Mapping by PiggyBac Transposase Reveals That Neocortical GLAST+ Progenitors Generate More Astrocytes Than Nestin+ Progenitors in Rat Neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-502 (2010).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and Improved Tools for In Utero Electroporation Studies of Developing Cerebral Cortex. Cerebral Cortex. 19, suppl 1 120-125 (2009).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using in utero Electroporation. Journal of Visualized Experiments. (65), e4163(2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유