Method Article
Um método revisado para induzir o linfedema secundário no hindlimb dos ratos
Neste Artigo
Resumo
Este modelo animal permite que os investigadores induzam o linfedema secundário estatìstica significativo no retrospecto dos ratos, durando pelo menos 8 semanas. O modelo pode ser usado para estudar a fisiopatologia do linfedema e para investigar novas opções de tratamento.
Resumo
Os modelos animais são de suma importância na pesquisa do linfedema, a fim de compreender a fisiopatologia da doença, mas também para explorar potenciais opções de tratamento. Este modelo do rato permite que os investigadores induzam o linfedema significativo que dura pelo menos 8 semanas. O linfedema é induzido usando uma combinação de radioterapia fracionada e ablação cirúrgica de linfáticos. Este modelo exige que os ratos recebem uma dose de 10 cinza (Gy) radiação antes e depois da cirurgia. A parte cirúrgica do modelo envolve a ligadura de três vasos linfáticos e extração de dois gânglios linfáticos do membro posterior do rato. Ter acesso a ferramentas microcirúrgicas e um microscópio é essencial, devido às pequenas estruturas anatômicas dos camundongos. A vantagem deste modelo é que ele resulta em linfedema estatisticamente significativo, o que fornece uma boa base para avaliar diferentes opções de tratamento. É também uma opção grande e facilmente disponível para o treinamento microcirúrgico. A limitação deste modelo é que o procedimento pode ser demorado, especialmente se não for praticado com antecedência. O modelo resulta em linfedema objetivamente quantificável em camundongos, sem causar morbidade grave e foi testado em três projetos separados.
Introdução
O linfedema é caracterizado por um acúmulo de líquido linfático que leva ao inchaço do tecido localizado, que ocorre principalmente devido ao fluxo prejudicado ou interrompido de fluido linfático nos vasos linfáticos1. O fluxo linfático pode ser prejudicado ou interrompido por infecção, obstrução, lesão ou defeitos congênitos no sistema linfático2. Essas etiologias resultam em acúmulo de líquido linfático, o que leva a um estado crônico de inflamação, resultando em fibrose subseqüente, bem como a deposição do tecido adiposo3. O linfedema pode ser categorizado como linfedema primário ou secundário. O linfedema primário é causado por anormalidades no desenvolvimento ou mutação genética2,4. O linfedema secundário ocorre devido à doença sistêmica subjacente, cirurgia ou trauma2,4. Linfedema secundário é a forma mais comum de linfedema no mundo2. Nos países desenvolvidos, a causa mais comum do linfedema secundário é a terapia oncológica, como radioterapia adjuvante e dissecção do nóde linfático5. O linfedema é mais frequente entre os pacientes com câncer de mama, mas também pode se desenvolver em pacientes com câncer ginecológico, melanoma, genitourinário ou pescoço6. Tem sido sugerido que de todas as mulheres diagnosticadas com câncer de mama, 21% desenvolverão linfedema7.
Linfedema pode ser estressante para o paciente física e psicologicamente. Pacientes com linfedema têm um risco aumentado de infecção5,8,9, má qualidade de vida e podem desenvolver ansiedade social e sintomas de depressão10. As complicações do linfedema crônico levam ao alto custo dos cuidados e ao aumento da carga da doença9,11. Os resultados também sugeriram que o linfedema pode estar associado ao aumento do risco de morte após o tratamento do câncer de mama12. A gerência conservadora tal como a compressão da área afetada, a drenagem manual do linfa e o skincare geral permanecem a primeira aproximação da linha. Atualmente não há tratamento curativo6. Embora o progresso foi feito no campo da terapia cirúrgica e médica, há ainda um quarto para a melhoria. Mais pesquisa, fornecendo a introspecção na fisiopatologia e progressão da doença, é necessário permitir clínicos de fornecer melhores opções do tratamento para os pacientes5.
Modelos animais estão sendo usados em pesquisas pré-clínicas para entender a fisiopatologia de doenças e desenvolver opções potenciais de tratamento. Vários modelos animais linfedemos diferentes foram estabelecidos em caninos13,14,coelhos15,ovelhas16,porcos17,18 e roedores19,20, 21,22,23,24. O modelo de roedores parece ser o modelo mais econômico, ao investigar a reconstrução da função linfática, devido a roedores serem facilmente acessíveis e relativamente de baixo preço25. A maioria dos modelos de camundongos se concentraram em induzir linfedema na cauda dos camundongos21,22,23. O modelo da cauda é muito de confiança mas a técnica cirúrgica exata para induzir o linfedema varia significativamente no material publicado precedente. Isso resulta em flutuações de duração e robustez do linfedema desenvolvido apresentado sapateado conhecido25. Diferentes técnicas também estão sendo usadas para induzir linfedema no modelo de membros posteriores e também produzem resultados variados, mas o modelo de membros posteriores pode ser mais fácil de entender de uma perspectiva translacional. Modelos anteriores de linfedema foram prejudicados pela resolução espontânea do linfedema e, portanto, um modelo de linfedema reproduzível e permanente é necessário25. Os investigadores têm tentado previamente aumentar a dose da radiação, para impedir a definição espontânea do linfedema, mas esta conduziu frequentemente à morbosidade severa subseqüente25.
Este modelo resulta em linfedema estatisticamente significativo, sem causar morbidade grave, combinando microcirurgia com radiação. O modelo foi revisado a partir de um modelo cirúrgico anterior, adicionando uma dose de irradiação que induz o linfedema, sem causar morbidade grave26. Ele também oferece uma grande oportunidade para o treinamento microcirúrgico. É necessário ter acesso a equipamentos microcirúrgicos e microscópio, devido às pequenas estruturas anatômicas dos camundongos. O procedimento cirúrgico pode ser realizado quando o usuário foi ensinado técnicas microcirúrgicas básicas, como a sutura com instrumentos microcirúrgicos. Os operadores que realizaram este procedimento assistiram a vídeos tutoriais de Acland sobre as pré-condições de habilidades microcirúrgicas (1981) e técnica de microssutura básica (1985). Recomendamos a prática do procedimento cirúrgico 8 a 10 vezes antes de usá-lo em pesquisa. A prática do procedimento garante que menos erros sejam cometidos e que o procedimento possa ser realizado de forma mais eficiente. Quando dominado, o procedimento cirúrgico pode ser realizado em 45 minutos.
Protocolo
Os animais foram alojados na Universidade do Sul da Dinamarca Animal Care Facility de acordo com as orientações institucionais. Todos os procedimentos que envolvem indivíduos animais foram aprovados pela Inspecção de Experiências Animais, Ministério do Ambiente e Alimentação da Dinamarca.
1. Irradiação pré-cirurgia
NOTA: A irradiação pré-cirurgia ocorre 7 dias antes da cirurgia.
- Induzir anestesia.
- Coloque o mouse em uma caixa de indução e coloque o vaporizador para 3% isoflurano com uma taxa de fluxo de oxigênio de 0,8 a 1,2 L/min para induzir anestesia de inalação.
NOTA: Alternativamente, anestésicos injetáveis podem ser usados, mas para a curta duração da inalação induzindo aanestesia foi suficiente. Para obter os resultados apresentados neste artigo, foram utilizados camundongos C57BL6 fêmeas de 9 semanas. - Certifique-se que o rato está anestesiado inteiramente pelo teste da pitada da cauda ou da pata.
- Coloque o mouse em uma caixa de indução e coloque o vaporizador para 3% isoflurano com uma taxa de fluxo de oxigênio de 0,8 a 1,2 L/min para induzir anestesia de inalação.
- Posicione o mouse para irradiação.
- Se totalmente sedado, mova o mouse da caixa de indução e coloque-o a fonte de radiação em posição supina e fixar suavemente os membros traseiros com fita adesiva.
NOTA: O rato permanecerá sedado para a curta duração da radiação. - Coloque uma almofada de chumbo de 1,5 mm de espessura para garantir que apenas a área que passa por cirurgia (ou seja, a área circular com um diâmetro de 25 mm ao redor do joelho) seja irradiada.
- Se totalmente sedado, mova o mouse da caixa de indução e coloque-o a fonte de radiação em posição supina e fixar suavemente os membros traseiros com fita adesiva.
- Administrar uma dose de 10 radiação Gy a uma taxa de dose de 5,11 Gy/min (100 kVp, 10 mA).
CUIDADO: Precauções de segurança devem ser tomadas ao trabalhar com radiação. Durante este experimento, toda a irradiação foi realizada em uma sala isolada de radiação, e a fonte de radiação só foi ativada quando todo o pessoal saiu e selou a sala. - Coloque o rato de volta em sua gaiola.
2. Configuração de equipamento
NOTA: A cirurgia deve ser realizada em uma sala dedicada aos procedimentos cirúrgicos. A superfície operativa deve ser estéril.
- Limpe completamente todas as superfícies operativas com 70% de etanol. Use rede de cabelo e coberturas. Use instrumentos cirúrgicos estéreis e luvas estéreis.
- Prepare anestesia.
- Elabore 1 mL de fentanil (0,315 mg/mL), 1 mL de midazolam (5 mg/mL) e 2 mL de água estéril. Use diferentes seringas e agulhas para os diferentes componentes.
- Misture fentanil e água estéril esvaziando lentamente as seringas em um tubo de vidro estéril. Quando misturado, adicione midazolam para completar a solução de trabalho.
- Prepare analgesia.
- Elabore 0,2 mL de buprenorfina (0,3 mg/mL) e 2 mL de soro.
- Misture os volumes esvaziando lentamente as seringas em um tubo de vidro estéril para completar a solução de trabalho.
- Ligue o microscópio e certifique-se de que a iluminação é suficiente, e que o microscópio é bem ajustado para os olhos do operador.
NOTA: Todos os procedimentos cirúrgicos devem ser realizados um microscópio operacional. Uma faixa de ampliação de 4x-25x é suficiente.
3. Preparação
- Pese o rato pré-cirurgia, colocando o mouse em um recipiente vazio em uma escala limpa.
- Administrar anestésico.
- Elabore 0,1 mL de anestésico por 10 g de peso corporal do rato. Injete o anestésico subcutâneo como uma injeção de búso.
- Deixe o rato descansar em uma gaiola com muito fundamento e abrigo por aproximadamente 10 min até ficar totalmente sedado. Examine a profundidade anestésica avaliando o relaxamento muscular e realize o teste de compressão da pata ou da cauda.
- Quando totalmente sedado, raspar o membro traseiro escolhido para o procedimento usando cortadores elétricos. Certifique-se de limpar o excesso de cabelo.
- Ligue o dispositivo de aquecimento, como uma almofada de aquecimento e cubra-o com um pano cirúrgico.
- Defina o fluxo de oxigênio para 0,8 L/min e conectá-lo com um nariz. Use 100% de oxigênio.
NOTA: O nariz é apenas para entrega de oxigênio e não anestesia. - Aplique a pomada oftalmológica e injete 0,5 mL de salina subcutâneamente, de preferência na nuca do rato, para prevenir a hipovolemia durante a cirurgia.
- Posicione o mouse para cirurgia.
- Coloque o rato no pano cirúrgico em posição supina. Coloque o nariz sobre o cnout.
- Fixe a extremidade dos membros posteriores suavemente com fita adesiva para evitar que o mouse mude durante a cirurgia.
- Esterilizar a pele usando álcool / clorexidina ou álcool / povidone iodo.
4. Cirurgia
NOTA: Neste exemplo, o membro traseiro esquerdo (quando o mouse é visto na posição supina), foi escolhido para o procedimento.
- Faça uma incisão circular.
- Levante a pele com fórceps lisos e refide uma pequena abertura aproximadamente 5 mm proximal para a fossa popliteal.
- Deslize tesouraafiada na abertura e clipe em direção ao joelho para que a incisão termina logo acima do joelho. Certifique-se de não perfurar os vasos subjacentes, levantando a pele com fórceps durante o recorte.
- Mova o mouse para a posição propensa e continue a cortar do joelho em direção à fossa popliteal até que a incisão circunferente esteja completa.
- Dissecar a pele abaixo do joelho.
- Delicadamente blunt dissecar a área abaixo do joelho para um par de milímetros acima do tornozelo, lentamente abrindo e fechando a microtesoura ao levantar a pele com fórceps.
- Corte cuidadosamente as adesões visíveis remanescentes usando microtesouras. Use soro salino estéril regularmente para manter o tecido úmido durante todo o procedimento.
- Dissecar a pele na borda proximal da incisão circumferential para que ela possa ser retraída com um retrator elástico.
NOTA: O retrator permite ao operador uma melhor visão do vaso linfático proximal e impede que a borda proximal de mudar durante a cirurgia. - Enquanto ainda em posição propensa, gire o membro traseiro suavemente e fixe-o com fita adesiva, de modo que a veia ischiatic seja visível do ponto mais proximal da área exposta ao ponto mais distal.
- Injete aproximadamente 0,01 mL de Patente Azul V subcutâneamente entre o segundo e o terceiro dedo do dedo do dedo do dedo do dedo do dia usando uma seringa de 0,5 mL com uma agulha de 30 G. Pressione delicadamente a pata um par vezes para distribuir o V. azul da patente visualize as embarcações linfáticas e o nóde linfonodo através do microscópio enquanto o V azul da patente enche as embarcações do linfático.
NOTA: Se a cor azul dos vasos linfáticos desaparece durante o procedimento, massageie suavemente a pata para promover a captação, em vez de injetar mais Patente Blue V. Uso excessivo de Patente Blue V pode levar ao vazamento e coloração do tecido em torno dos vasos linfáticos que podem comprometer o procedimento. - Localizar as estruturas importantes: o nólina linfática popliteal (PLN), as duas embarcações linfáticas distal para o nólina (DLV1 e DLV2), eo vaso linfa proximal para o nólino linfático (PLV).
NOTA: Todos os vasos linfáticos podem ser encontrados ao lado da veia ischiatic. A embarcação de linffa proximal é geralmente encontrada medial na veia, os dois vasos linfáticos distais são encontrados medial e lateral para a veia. As abreviaturas das estruturas são usadas no vídeo que acompanha. - Amplie para visualizar claramente o PLV e liga-lo com uma sutura de nylon 10-0 usando suporte de micro-agulha e microfórios. Pressione a pata um par de vezes para garantir que nenhuma patente Blue V passa proximal para a sutura.
NOTA: Aparar a gordura em torno do vaso linfático pode ser necessário. - Repita o passo 4.7 para ligar as duas embarcações linfáticas distal. Pressione a pata várias vezes para garantir que nenhuma Patente Blue V passe proximal para a ligadura. Se as embarcações linfáticas se encontram para fechar a veia ischiatic, tente dissecar ainda mais distally.
NOTA: Neste exemplo, pode-se ver que uma das embarcações linfáticas estoura devido à ligadura que impede o fluxo linfático. As embarcações linfáticas, muitas vezes se separam da veia mais abaixo. - Retire o nólina linfático popliteal.
- Localizar o nólina linfática popliteal e cortar um pequeno buraco com microtesoura para acessá-lo e removê-lo com microfórios e microtesouras.
NOTA: O nó de linfa tem uma superfície pérola-como lisa em contraste com o tecido gordo circunvizinho. - Para testar se o tecido removido é um nóde linfático, coloque-o em um tubo de ensaio cheio de água.
NOTA: Se o tecido é composto de gordura, o tecido vai flutuar. Se o tecido é um nódelina linfática, ele vai afundar até o fundo.
- Localizar o nólina linfática popliteal e cortar um pequeno buraco com microtesoura para acessá-lo e removê-lo com microfórios e microtesouras.
- Retire a almofada de gordura inguinal e nóurico linfático.
- Antes de remover a almofada gorda inguinal, use um coagulator bipolar para cauterizar as embarcações que funcionam através da gordura.
- Reseque a almofada de gordura inguinal usando microfóricos e microtesouras. Delicadamente cortar os vasos cauterizados que atravessam a gordura. Em seguida, delicadamente reseque o tecido adiposo na área inguinal.
NOTA: O nódelga linfática localizado na gordura raramente é colorido pela Patente Azul V e pode ser difícil de diferenciar da gordura. Remover a almofada gorda em uma parte é a melhor maneira de assegurar-se de que o nó de linfa esteja removido.
- Lave a perna completamente com soro salino estéril e confirme através do microscópio que quaisquer pequenos pêlos e partículas foram completamente removidos da área cirúrgica para evitar a contaminação da ferida e infecção. Certifique-se de que não há sangramento ativo.
- Sutura as bordas da pele até a facia muscular com uma sutura de nylon 6-0 usando fórceps e suporte de agulha, deixando uma lacuna de 2-3 mm para restringir o fluxo superficial de linfa.
NOTA: O vídeo que acompanha mostra um exemplo de suturas acabadas. - Administrar analgesia. Elabore 0,1 mL de analgesia por 30 g de peso corporal do rato. Injetar a analgesia subcutâneamente como uma injeção de bósco.
- Pese o mouse para comparação pós-cirurgia.
- Coloque o rato em uma gaiola em um armário aquecido para recuperação.
5. Cuidados pós-operatórios
- Dê aos ratos gaiolas individuais para se recuperar após a cirurgia com água e alimentos ad libitum.
- Administrar uma dose subcutânea bolus de 0,02 mL de buprenorfina 3x diariamente por 3 dias para analgesia.
- Monitorar o animal diariamente para a cicatrização adequada da ferida, sinais de dor e infecção. Se os sinais de infecção estão presentes, use pomada antibiótica.
6. Irradiação pós-cirurgia
- Três dias após a cirurgia, repita o procedimento para irradiação pré-cirurgia (passos 1,1-1,4).
Resultados
Este procedimento foi usado previamente em três experiências separadas. Todos os experimentos foram feitos por diferentes investigadores principais que todos são co-autores deste artigo. Em todos os três experimentos, foi tomado grande cuidado para aderir ao mesmo procedimento descrito neste protocolo. Em todos os três experimentos, o linfedema secundário foi induzido em um membro posterior, enquanto o outro membro posterior serviu como controle. Os volumes dos membros posteriores foram o principal resultado em todos os três experimentos. A figura 1 ilustra o projeto do estudo.
Todos os camundongos foram submetidos a tomografia microcomputadorizada (μCT) nas semanas seguintes à cirurgia para medir o volume dos membros posteriores. As varreduras μCT foram realizadas em um scanner pré-clínico multimodalidade(Tabela de Materiais)e o volume dos membros posteriores foi medido através da função de região de interesse (ROI) no software associado, conforme descrito anteriormente26. A articulação distal tibiofibular foi localizada em imagens axonais tridimensionais (3D) usando um método previamente descrito27. O ROI começou na articulação tibiofibular distal e incluiu todo o tecido distal a esse ponto. A escala de Hounsfield para a análise foi ajustada a -500 a 4000.
Todos os dados foram analisados por meio de software estatístico(Tabela de Materiais). O teste de comparação múltipla de Sidak foi usado para comparar o volume do retrospectlimb induzido do linfedema, com o retrospecto do controle. Uma diferença significativa entre o membro traseiro controle e o membro do linfoma é definida como um valor P <0.05.

Figura 1: Projeto do estudo e pontos de tempo para medidas do resultado. Clique aqui para ver uma versão maior deste número.
O experimento 126 incluiu 32 camundongos distribuídos em grupos de quatro. Um dos objetivos foi estudar várias doses diferentes de radiação e encontrar a dose mais preferível, para induzir linfedema duradouro sem causar morbidade grave. O grupo que recebeu duas doses de 10 irradiação Gy incluiu quatro camundongos. A figura 2 mostra que um estado consistente de linfedema foi alcançado em todas as 8 semanas. A tabela 1 mostra que houve uma diferença significativa no volume entre o membro do linfoluz e o membro traseiro do controle nas semanas 1, 7 e 8. Quando um estado consistente de linfedema induzido foi conseguido, não havia uma diferença estatìstica significativa entre os hindlimbs durante todas as 8 semanas. Este resultado difere dos dois outros experimentos e pode ser explicado devido ao tamanho da amostra relativamente menor de quatro camundongos. Aumentar o número de medições aumentaria o poder do estudo e, por isso, a probabilidade de detectar uma diferença se existe uma diferençade 28.

Figura 2: Média de volume de membros traseiros: Experimento 1. Medições de 4 camundongos do grupo que recebeu duas doses de 10 irradiação gy estão incluídas nesta figura. Este gráfico mostra os volumes dos membros traseiros média no mm3 nas 8 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. As barras de erro representam o desvio padrão (SD). Clique aqui para ver uma versão maior deste número.
| Semana | Volume de linfedema no mm3 (n = 4) | Volume de controle no mm3 (n = 4) | P-valor | Intervalo de confiança de 95% |
| 1 | 218,53 ± 9,3 | 136,78 ± 2,48 | 0.002 | 53,77−109,73 |
| 2 | 202,25 ± 10,24 | 141,88 ± 8,02 | 0.066 | (-6,53)−127,28 |
| 3 | 193,28 ± 10,80 | 141,20 ± 6,80 | 0.060 | (-3,7)−107,85 |
| 4 | 194,95 ± 21,05 | 141,50 ± 8,03 | 0.224 | (-41,85)−148,75 |
| 5 | 193,75 ± 7,07 | 141,70 ± 8,60 | 0.051 | (-0,27)−104,37 |
| 6 | 193,23 ± 3,42 | 141,78 ± 10,29 | 0.054 | (-1,56)−104,46 |
| 7 | 194,95 ± 7,26 | 143,23 ± 8,90 | 0.050 | 0,17-103,28 |
| 8 | 195,8 ± 9,65 | 152,18 ± 5,81 | 0.009 | 19,88-67,38 |
Tabela 1: Teste de múltiplas comparações de Sidak: Experiment 1. Esta tabela mostra a comparação estatística entre os volumes médiode hindlimbs induzidos do linfedema e os hindlimbs do controle durante as 8 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. Os valores são apresentados como: média ± SD no mm3. P-valor < 0,05 é considerado como uma diferença significativa entre o membro traseiro controle e linfoedema hindlimb. n (número de observações) = 4.
O experimento 2 incluiu 45 camundongos. 15 camundongos serviram como controles e receberam injeções salinas. Os controles são usados como resultados representativos, pois assumimos que as injeções salinas não tiveram efeito sobre o volume de linfedema induzida. A figura 3 mostra que o linfedema era menos estável do que na experiência 1. Além disso, o volume dos membros posteriores de controle aumentou durante as 8 semanas. Isso diminui a diferença relativa apresentada na Tabela 2. Tem sido especulado que os ratos usam seu hindlimb não operado mais, nas semanas seguintes à cirurgia, e que isso leva à hipertrofia e aumento no volume dos membros do membro não operado. Mais importante ainda, a tabela 3 mostra que há uma diferença estatìstica significativa entre o retrospectlimb do linfedema e o retrospecto do controle durante todas as 8 semanas após a cirurgia. O maior número de camundongos prova que este procedimento pode induzir linfedema estatisticamente significativo por pelo menos 8 semanas.
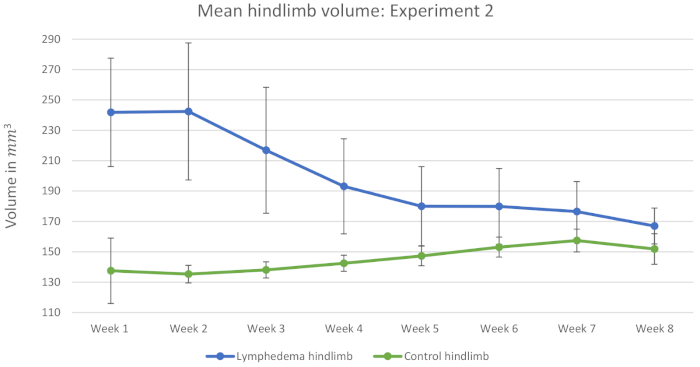
Figura 3: Média de volume de membros traseiros: Experimento 2. As medidas de 15 ratos do grupo controle são incluídas nesta figura. Este gráfico mostra os volumes dos membros traseiros média no mm3 nas 8 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. As barras de erro representam SD. Clique aqui para ver uma versão maior deste número.
| Experimento 1 | Experiência 2 | Experimento 3 | Experimento 1, 2 e 3 combinados | |||||
| Semana | Diferença absoluta (mm3) | Diferença relativa (%) | Diferença absoluta (mm3) | Diferença relativa (%) | Diferença absoluta (mm3) | Diferença relativa (%) | Diferença absoluta (mm3) | Diferença relativa (%) |
| 1 | 81,75 ± 7,20 | 0,60 ± 0,04 | 104,34 ± 25,96 | 0,76 ± 0,23 | 85,20 ± 35,05 | 0,64 ± 0,27 | 94,02 ± 29,57 | 0,69 ± 0,24 |
| 2 | 60,38 ± 17,21 | 0,43 ± 0,14 | 107,12 ± 44,33 | 0,79 ± 0,33 | 85,63 ± 37,94 | 0,63 ± 0,29 | 92,77 ± 41,68 | 0,68 ± 0,31 |
| 3 | 52,08 ± 14,35 | 0,37 ± 0,11 | 78,77 ± 39,45 | 0,57 ± 0,28 | 74,67 ± 49,57 | 0,54 ± 0,38 | 73,74 ± 41,51 | 0,53 ± 0,31 |
| 4 | 53,45 ± 24,51 | 0,38 ± 0,19 | 50,67 ± 29,94 | 0,36 ± 0,21 | 50,62 ± 16,35 | 0,37 ± 0,11 | 51,01 ± 24,03 | 0,37 ± 0,17 |
| 5 | 52,05 ± 13,46 | 0,37 ± 0,11 | 32,74 ± 24,66 | 0,22 ± 0,17 | 42,67 ± 11,81 | 0,31 ± 0,07 | 39,08 ± 20,02 | 0,27 ± 0,14 |
| 6 | 51,45 ± 13,63 | 0,36 ± 0,11 | 26,80 ± 22,35 | 0,18 ± 0,14 | 32,86 ± 10,90 | 0,22 ± 0,08 | 32,32 ± 18,96 | 0,21 ± 0,13 |
| 7 | 51,73 ± 13,26 | 0,36 ± 0,11 | 19,04 ± 17,22 | 0,12 ± 0,11 | - | - | 25,92 ± 21,15 | 0,17 ± 0,15 |
| 8 | 43,63 ± 6,11 | 0,29 ± 0,04 | 15,15 ± 11,70 | 0,10 ± 0,08 | - | - | 21,15 ± 15,96 | 0,14 ± 0,10 |
Tabela 2: Diferença absoluta e relativa. Esta tabela mostra a diferença absoluta no volume entre os membros posteriores do linfedema e controle ± SD no mm3 e a diferença relativa ± SD em por cento.
| Semana | Volume de linfedema no mm3 (n = 15) | Volume de controle no mm3 (n = 15) | P-valor | Intervalo de confiança de 95% |
| 1 | 241,82 ± 35,69 | 137,48 ± 21,54 | E 0,001 | 82,21-126,47 |
| 2 | 242,41 ± 45,13 | 135,29 ± 5,81 | E 0,001 | 69,33-144,89 |
| 3 | 216,85 ± 41,47 | 138,08 ± 5,31 | E 0,001 | 45.15-112,39 |
| 4 | 193,10 ± 31,27 | 142,43 ± 5,29 | E 0,001 | 25,15-76,18 |
| 5 | 180,03 ± 26,03 | 147,29 ± 6,45 | 0.002 | 11,72-53,76 |
| 6 | 179,89 ± 25,00 | 153,09 ± 6,56 | 0.004 | 7,74-45,85 |
| 7 | 176,45 ± 19,77 | 157,41 ± 7,49 | 0.008 | 4,35-33,71 |
| 8 | 166,97 ± 11,8 | 151,82 ± 10,07 | 0.002 | 5.18-25.12 5.18-25.12 |
Tabela 3: Teste de múltiplas comparações de Sidak: Experiment 2. Esta tabela mostra a comparação estatística entre os volumes médio de hindlimbs induzidos do linfedema e de membros traseiros do controle nas 8 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. Os valores são apresentados como: média ± SD no mm3. P-valor < 0,05 é considerado como uma diferença significativa entre o membro traseiro controle e linfoedema hindlimb. n (número de observações) = 15.
O experimento 3 incluiu 36 camundongos. 12 camundongos serviram como controles e receberam injeções salinas. Os controles são usados como resultado representativo, pois assumimos que as injeções salinas não tiveram efeito sobre o volume de linfedema induzida. Neste experimento, o volume posterior dos camundongos foi medido por 6 semanas em vez de 8. O experimento durou apenas 6 semanas devido a dificuldades logísticas quando o experimento foi realizado. A figura 4 mostra um linfedema mais consistente do que o experimento 2. A tabela 4 mostra que há linfoema estatisticamente significativa nas 6 semanas após a cirurgia.

Figura 4: Média de volume de membros traseiros: Experimento 3. As medidas de 12 ratos do grupo controle são incluídas nesta figura. Este gráfico mostra os volumes dos membros traseiros média no mm3 nas 6 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. As barras de erro representam SD. Clique aqui para ver uma versão maior deste número.
| Semana | Volume de linfedema no mm3 (n = 12) | Volume de controle no mm3 (n = 12) | P-valor | Intervalo de confiança de 95% |
| 1 | 219,06 ± 35,00 | 133,86 ± 10,02 | E 0,001 | 51,66−118,74 |
| 2 | 220,90 ± 36,98 | 135,27 ± 5,89 | E 0,001 | 49,33−121,94 |
| 3 | 211,74 ± 47,30 | 137,07 ± 7,56 | 0.002 | 27.24-122.11 |
| 4 | 186,09 ± 20,36 | 135,47 ± 5,70 | E 0,001 | 34,98-66,27 |
| 5 | 182,35 ± 18,25 | 139,68 ± 7,45 | E 0,001 | 31,37-53,98 |
| 6 | 183,44 ± 12,11 | 150,58 ± 8,37 | E 0,001 | 22,42-43,29 |
Tabela 4: Teste de múltiplas comparações de Sidak: Experiment 3. Esta tabela mostra a comparação estatística entre os volumes médio de hindlimbs induzidos do linfedema e de membros traseiros do controle nas 6 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. Os valores são apresentados como: média ± SD no mm3. P-valor < 0,05 é considerado como uma diferença significativa entre o membro traseiro controle e linfoedema hindlimb. n (número de observações) = 12.
A Figura 5 e a Tabela 5 mostram o volume médio dos membros traseiros dos três experimentos combinados. A tabela 5 mostra que o uso deste procedimento resulta em linfedema estatisticamente significativo com duração de pelo menos 8 semanas. Dados das primeiras 6 semanas, são as medidas combinadas de 31 camundongos dos experimentos 1, 2 e 3. Na semana 7-8, tivemos apenas dados dos experimentos 1 e 2, resultando em medições combinadas de 19 camundongos.

Figura 5: Volume combinado dos membros traseiros: Experimento 1, 2 e 3. Trinta e um camundongos incluídos nas primeiras 6 semanas após a cirurgia e 19 camundongos incluídos nas 2 semanas seguintes. Este gráfico mostra os volumes dos membros traseiros média no mm3 nas 8 semanas após a cirurgia. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. As barras de erro representam SD. Clique aqui para ver uma versão maior deste número.
| Semana | Volume de linfedema no mm3 (Semana 1-6 n = 31) (Semana 7-8 n = 19) | Volume de controle no mm3 (Semana 1-6 n = 31) (Semana 7-8 n = 19) | P-valor | Intervalo de confiança de 95% |
| 1 | 230,00 ± 34,46 | 135,99 ± 16,03 | E 0,001 | 78,19-109,84 |
| 2 | 228,90 ± 40,91 | 136,13 ± 6,32 | E 0,001 | 70,47−115,07 |
| 3 | 211,83 ± 41,15 | 138,09 ± 6,36 | E 0,001 | 51,53-95,95 |
| 4 | 190,63 ± 25,81 | 139,62 ± 6,54 | E 0,001 | 38,15-63,87 |
| 5 | 182,70 ± 21,52 | 143,62 ± 7,79 | E 0,001 | 28,36-49,79 |
| 6 | 182,98 ± 19,11 | 150,66 ± 8,36 | E 0,001 | 22,18-42,47 |
| 7 | 180,34 ± 19,31 | 154,43 ± 9,60 | E 0,001 | 11,61-40,22 |
| 8 | 173,04 ± 16,42 | 151,89 ± 9,19 | E 0,001 | 10,35-31,94 |
Tabela 5: Teste de múltiplas comparações de Sidak: Experimento 1, 2 e 3 combinados. Esta tabela mostra a comparação estatística entre os volumes médio de hindlimbs induzidos do linfedema e os membros traseiros do controle de 31 ratos nas primeiras 6 semanas após a cirurgia e 19 ratos nas seguintes 2 semanas. Todos os camundongos receberam uma dose de 10 irradiação Gy pré e pós-cirurgia. Os valores são apresentados como: média ± SD no mm3. P-valor < 0,05 é considerado como uma diferença significativa entre o membro traseiro controle e linfoedema hindlimb. n (número de observações) = 31.
Discussão
Há alguns passos críticos neste protocolo. Em primeiro lugar, é importante que os pesquisadores tomem precauções de segurança ao trabalhar com radioatividade. Em segundo lugar, durante a parte cirúrgica deste protocolo, é importante iniciar o procedimento uma vez que o rato tenha sido anestesiado e terminá-lo sem pausas desnecessárias. Isso é importante para evitar um período cirúrgico excessivamente longo para o animal e evitar que a anestesia perca efeito durante a cirurgia. Recomenda-se administrar apenas uma injeção de anestésico e completar o procedimento cirúrgico em uma sessão. É também um passo crítico, para não administrar muito Patente Blue V, como excesso de Patente Blue V irá descolorar o tecido em torno dos vasos linfáticos. Se o tecido circundante fica descolorido, pode ser quase impossível visualizar os vasos linfáticos e isso compromete o procedimento. Mesmo se um controla visualizar as embarcações do linfático, o tecido descolorido fará duro avaliar se o V azul da patente passa proximal à ligadura ou não. Isso é problemático porque o operador deve ter certeza de que as ligaduras colocadas estão restringindo o fluxo linfático, para garantir que o procedimento será bem sucedido. Também é importante deixar uma lacuna de 2 a 3 mm ao fechar a ferida. Como uma lacuna temporária da pele é muitas vezes necessária para imitar o processo de cicatrização de feridas humanas29.
As limitações deste método são que é um procedimento demorado que requer acesso a um microscópio e treinamento microcirúrgico anterior. Ao realizar a parte cirúrgica deste protocolo, é importante planejar o tempo entre os procedimentos cirúrgicos. Muito tempo vai para esperar que o animal seja anestesiado, raspar o membro traseiro e geralmente se preparar para cada procedimento cirúrgico. Portanto, recomenda-se preparar habitação e anestesia com antecedência. É importante notar que, para ter certeza de que o linfedema crônico foi induzido, a histopatologia deve ser analisada. Não incluímos histopatologia neste artigo, o que é uma limitação. Sem histopatologia apoiando o fato de que as mudanças histológicas aconteceram com as embarcações linfáticas as mudanças no volume nos membros posteriores só podem ser descritas como edema. O artigo que inclui todos os dados sobre os quatro camundongos do experimento 126 inclui histopatologia e mostra que houve mudanças significativas na histopatologia usando essa técnica. O artigo também inclui imagens linfáticas. O mesmo procedimento foi usado nos ratos na experiência 2 e 3, mas a histopatologia não mostrou nenhuma diferença significativa entre o retrospecto do linfedema e o membro traseiro do controle nestas experiências. Mais estudos, incluindo histopatologia são necessários para que este modelo esclareça se o linfedema é induzido em um nível histológico. Os experimentos 2 e 3 ainda não foram publicados e, portanto, não podemos nos referir a elas.
Embora o uso de varreduras μCT para medir o volume dos membros traseiros possa ser mais objetivo do que usar o método de deslocamento de água ou medições circunferentes, ele ainda tem suas limitações. A técnica de medição é cara, demorada e requer acesso a um scanner μCT e software de análise.
Um dos maiores desafios com modelos de linfoema de roedores em geral, foram a resolução espontânea do linfedema, a menos que a radiação excessiva tenha sido realizada25. Ao desenvolver este modelo, testamos várias doses diferentes de radiação para encontrar uma dose que induziria linfedema duradouro sem causar morbidade grave26. Anteriormente, os modelos de linfedema não foram padronizados nos métodos de indução de linfedema ou avaliações de resultados. Oashi et al.20 usaram uma única dose de 30 irradiação Gy, e ligaram cada navio linfático em três pontos separados. Nesse estudo, o procedimento cirúrgico levou 90 min para realizar. Embora o método apresentado neste artigo possa ser considerado demorado, a parte cirúrgica do procedimento ainda pode ser realizada aproximadamente duas vezes mais rápido que o método apresentado por Oashi et al.20. Eles também tiveram um período de acompanhamento de 6 meses, o que é consideravelmente maior do que qualquer um dos estudos apresentados neste artigo. Entretanto, incluíram somente um rato e mediram manualmente a circunferência do membro para avaliar o inchamento, visto que os volumes apresentados neste artigo foram medidos em 31 ratos usando varreduras do μCT e software 3D da análise. Komatsu et al.30 removeram os gânglios linfáticos inguinais e os vasos linfáticos periféricos associados e tecido adiposo usando uma faca elétrica. Usar uma faca elétrica pôde ser uma aproximação mais simples que não exija o treinamento microsurgical, mas o edema induzido resolvido após o dia 4 quando o método apresentado neste artigo oferecer o linfedema consistente que dura pelo menos 8 semanas.
Esperamos que este protocolo permita aos investigadores considerar as limitações e vantagens do modelo de linfedema revisto. O protocolo também deve ajudar os pesquisadores a replicar com sucesso o modelo. O método pode ser usado em futuros estudos observacionais e intervencionistas para entender a fisiopatologia do linfedema e pesquisar novas opções de tratamento. Em estudos futuros, também seria interessante ter um acompanhamento superior a 8 semanas para observar quanto tempo dura o linfedema induzido. Também seria interessante observar o efeito da realização de irradiação mais direcionada dos camundongos pré e pós-cirurgia. Isso poderia ser feito realizando uma tomografia computadorizada e planejando um volume alvo. Em estudos futuros, esse modelo também pode ser suportado por estudos de imagem linfática guiada por fluorescência, perometria ou bioimpemia. Este método oferece linfedema estatisticamente significativo com duração de pelo menos 8 semanas, que foi medido diretamente via CT volumetric em três experimentos separados por diferentes investigadores principais.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem peter Bollen, cabeça do laboratório biomédico para emprestar o equipamento necessário gravar a metragem vista através dos microscópios.
Materiais
| Name | Company | Catalog Number | Comments |
| 10-0 Nylon suture | S&T | 12051-10 | |
| 6-0 Nylon suture - Dafilon | B Braun | C0933112 | |
| Coagulator - ICC 50 | ERBE | ||
| Cotton tipped applicators | Yibon medical co | ||
| Dissecting forceps | Lawton | 09-0190 | |
| Elastic retractors | Odense University Hospital | ||
| Electrical clipper | Aesculap | GT420 | |
| Fentanyl 0,315 mg/ml | Matrix | ||
| Heating pad - PhysioSuite | Kent Scientific Corp. | ||
| Isoflurane 1000mg Attane | Scan Vet | ||
| Isoflurane vaporizer - PPV | Penlon | ||
| Micro jewler forceps | Lawton | 1405-05 | |
| Micro Needle holder | Lawton | 25679-14 | |
| Micro scissors | Lawton | 10128-15 | |
| Micro tying forceps | Lawton | 43953-10 | |
| Microfine U-40 syringe 0,5ml | BD | 328821 | |
| Microlance syringe 25g | BD | ||
| Microlance syringe 27g | BD | ||
| Midazolam 5 mg/ml (hameln) | Matrix | ||
| Needle holder - Circle wood | Lawton | 08-0065 | |
| Non woven swabs | Selefa | ||
| Opmi pico microscope F170 | Zeiss | ||
| Patent blue V - 25 mg/ml | Guerbet | ||
| Scissors - Joseph | BD | RH1630 | |
| Siemens INVEON multimodality pre-clinical scanner | Siemens pre-clinical solutions | ||
| Source of radiation - D3100 | Gulmay | ||
| Stata Statistical Software: Release 15 | StataCorp LLC | ||
| Temgesic - 0,2 mg | Indivior | ||
| Vet eye ointment - viscotears | Bausch & Lomb |
Referências
- Lawenda, B. D., Mondry, T. E., Johnstone, P. A. S. Lymphedema: a primer on the identification and management of a chronic condition in oncologic treatment. CA: A Cancer Journal for Clinicians. 59 (1), 8-24 (2009).
- Greene, A. K. Epidemiology and morbidity of lymphedema. Lymphedema: Presentation, Diagnosis, and Treatment. Greene, A. K., Slavin, S. A., Brorson, H. , Springer International Publishing. New York, NY. 33-44 (2015).
- Hespe, G. E., Nores, G. G., Huang, J. J., Mehrara, B. J. Pathophysiology of lymphedema-Is there a chance for medication treatment? Journal of Surgical Oncology. 115 (1), 96-98 (2017).
- Grada, A. A., Phillips, T. J. Lymphedema: Pathophysiology and clinical manifestations. Journal of the American Academy of Dermatology. 77 (6), 1009-1020 (2017).
- Chang, D. W., Masia, J., Garza, R. 3rd, Skoracki, R., Neligan, P. C. Lymphedema: Surgical and Medical Therapy. Plastic and Reconstructive Surgery. 138 (3 Suppl), 209S-218S (2016).
- Carl, H. M., et al. Systematic Review of the Surgical Treatment of Extremity Lymphedema. Journal of Reconstructive Microsurgery. 33 (6), 412-425 (2017).
- DiSipio, T., Rye, S., Newman, B., Hayes, S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. The Lancet Oncology. 14 (6), 500-515 (2013).
- Douglass, J., Graves, P., Gordon, S. Self-Care for Management of Secondary Lymphedema: A Systematic Review. PLoS Neglected Tropical Diseases. 10 (6), e0004740(2016).
- Shih, Y. C. T., et al. Incidence, treatment costs, and complications of lymphedema after breast cancer among women of working age: a 2-year follow-up study. Journal of Clinical Oncology. 27 (12), 2007-2014 (2009).
- Ridner, S. H. The psycho-social impact of lymphedema. Lymphatic Research and Biology. 7 (2), 109-112 (2009).
- Gutknecht, M., et al. Cost-of-illness of patients with lymphoedema. Journal of the European Academy of Dermatology and Venereology. 31 (11), 1930-1935 (2017).
- Hayes, S., et al. Prevalence and prognostic significance of secondary lymphedema following breast cancer. Lymphatic Research and Biology. 9 (3), 135-141 (2011).
- Danese, C. A., Georgalas-Bertakis, M., Morales, L. E. A model of chronic postsurgical lymphedema in dogs' limbs. Surgery. 64 (4), 814-820 (1968).
- Das, S. K., Franklin, J. D., O'Brien, B. M., Morrison, W. A. A practical model of secondary lymphedema in dogs. Plastic and Reconstructive Surgery. 68 (3), 422-428 (1981).
- Huang, G. K., Hsin, Y. P. An experimental model for lymphedema in rabbit ear. Microsurgery. 4 (4), 236-242 (1983).
- Tobbia, D., et al. Lymphedema development and lymphatic function following lymph node excision in sheep. Journal of Vascular Research. 46 (5), 426-434 (2009).
- Lahteenvuo, M., et al. Growth factor therapy and autologous lymph node transfer in lymphedema. Circulation. 123 (6), 613-620 (2011).
- Honkonen, K. M., et al. Lymph node transfer and perinodal lymphatic growth factor treatment for lymphedema. Annals of Surgery. 257 (5), 961-967 (2013).
- Wang, G. Y., Zhong, S. Z. A model of experimental lymphedema in rats' limbs. Microsurgery. 6 (4), 204-210 (1985).
- Oashi, K., et al. A new model of acquired lymphedema in the mouse hind limb: a preliminary report. Annals of Plastic Surgery. 69 (5), 565-568 (2012).
- Slavin, S. A., Van den Abbeele, A. D., Losken, A., Swartz, M. A., Jain, R. K. Return of lymphatic function after flap transfer for acute lymphedema. Annals of Surgery. 229 (3), 421-427 (1999).
- Cheung, L., et al. An experimental model for the study of lymphedema and its response to therapeutic lymphangiogenesis. BioDrugs : Clinical Immunotherapeutics, Biopharmaceuticals and Gene Therapy. 20 (6), 363-370 (2006).
- Rutkowski, J. M., Moya, M., Johannes, J., Goldman, J., Swartz, M. A. Secondary lymphedema in the mouse tail: Lymphatic hyperplasia, VEGF-C upregulation, and the protective role of MMP-9. Microvascular Research. 72 (3), 161-171 (2006).
- Tammela, T., et al. Therapeutic differentiation and maturation of lymphatic vessels after lymph node dissection and transplantation. Nature Medicine. 13 (12), 1458-1466 (2007).
- Frueh, F. S., et al. Animal models in surgical lymphedema research--a systematic review. Journal of Surgical Research. 200 (1), 208-220 (2016).
- Jorgensen, M. G., et al. Quantification of Chronic Lymphedema in a Revised Mouse Model. Annals of Plastic Surgery. 81 (5), 594-603 (2018).
- Frueh, F. S., et al. High-resolution 3D volumetry versus conventional measuring techniques for the assessment of experimental lymphedema in the mouse hindlimb. Scientific Reports. 6, 34673(2016).
- Biau, D. J., Kerneis, S., Porcher, R. Statistics in brief: the importance of sample size in the planning and interpretation of medical research. Clinical Orthopaedics and Related Research. 466 (9), 2282-2288 (2008).
- Korula, P., Varma, S. K., Sunderrao, S. Inhibition of wound contraction by point-to-point adherent splintage. Plastic and Reconstructive Surgery. 95 (4), 725-730 (1995).
- Komatsu, E., et al. Lymph Drainage During Wound Healing in a Hindlimb Lymphedema Mouse Model. Lymphatic Research and Biology. 15 (1), 32-38 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados