Method Article
Eine überarbeitete Methode zur Induktion von Sekundärlymphödemen im Hinterglied von Mäusen
In diesem Artikel
Zusammenfassung
Dieses Tiermodell ermöglicht es Forschern, statistisch signifikante sekundäre Lymphödeme im Hinterglied von Mäusen zu induzieren, die mindestens 8 Wochen dauern. Das Modell kann verwendet werden, um die Pathophysiologie von Lymphödemen zu untersuchen und neue Behandlungsmöglichkeiten zu untersuchen.
Zusammenfassung
Tiermodelle sind von größter Bedeutung in der Erforschung von Lymphödemen, um die Pathophysiologie der Krankheit zu verstehen, aber auch um mögliche Behandlungsmöglichkeiten zu erkunden. Dieses Mausmodell ermöglicht es Forschern, signifikante Lymphödeme zu induzieren, die mindestens 8 Wochen dauern. Lymphödem wird durch eine Kombination aus fraktionierter Strahlentherapie und chirurgischer Ablation von Lymphatik induziert. Dieses Modell erfordert, dass die Mäuse eine Dosis von 10 Grau (Gy) Strahlung vor und nach der Operation erhalten. Der chirurgische Teil des Modells beinhaltet ligation von drei Lymphgefäßen und Extraktion von zwei Lymphknoten aus der Maus hinterdlimb. Der Zugang zu mikrochirurgischen Werkzeugen und einem Mikroskop ist aufgrund der kleinen anatomischen Strukturen von Mäusen unerlässlich. Der Vorteil dieses Modells besteht darin, dass es zu einem statistisch signifikanten Lymphödem führt, das eine gute Grundlage für die Bewertung verschiedener Behandlungsmöglichkeiten bietet. Es ist auch eine großartige und leicht verfügbare Option für mikrochirurgisches Training. Die Einschränkung dieses Modells ist, dass das Verfahren zeitaufwändig sein kann, vor allem, wenn es nicht im Voraus praktiziert wird. Das Modell führt zu objektiv quantifizierbaren Lymphödemen bei Mäusen, ohne schwere Morbidität zu verursachen und wurde in drei separaten Projekten getestet.
Einleitung
Lymphödem ist durch eine Ansammlung von Lymphflüssigkeit gekennzeichnet, die zu lokalisierten Gewebeschwellungen führt, die hauptsächlich durch einen gestörten oder gestörten Fluss der Lymphflüssigkeit in denLymphgefäßen1 auftreten. Der Lymphfluss kann durch Infektionen, Obstruktionen, Verletzungen oder angeborene Defekte im Lymphsystem beeinträchtigt oder gestört werden2. Diese Ätiologien führen zu einer Ansammlung von Lymphflüssigkeit, was zu einem chronischen Entzündungszustand führt, was zu einer nachfolgenden Fibrose sowie ablagerungen von Fettgewebe3führt. Lymphödem kann als primäres oder sekundäres Lymphödem kategorisiert werden. Primäres Lymphödem wird durch Entwicklungsanomalien oder genetische Mutation2,4verursacht. Sekundäres Lymphödem tritt aufgrund einer zugrunde liegenden systemischen Erkrankung, Operation odertrauma2,4auf. Sekundäres Lymphödem ist die häufigste Form von Lymphödem in der Welt2. In industrieländern Ländern ist die häufigste Ursache für sekundäres Lymphödem eine onkologische Therapie wie adjuvante Strahlentherapie und Lymphknotensektion5. Lymphödem ist am häufigsten bei Brustkrebspatientinnen, kann aber auch bei Patienten mit gynäkologischem, Melanom, Urogenital- oderNackenkrebs6 entwickeln. Es wurde vorgeschlagen, dass von allen Frauen, bei denen Brustkrebs diagnostiziert wurde, 21% Lymphödeme entwickeln 7.
Lymphödem eimmen kann für den Patienten sowohl körperlich als auch psychisch belastend sein. Patienten mit Lymphödem haben ein erhöhtes Infektionsrisiko5,8,9, schlechte Lebensqualität und können soziale Angst und Symptome von Depressionen entwickeln10. Die Komplikationen des chronischen Lymphödemführens führen zu hohen Pflegekosten und einer erhöhten Krankheitsbelastung9,11. Ergebnisse deuten auch darauf hin, dass Lymphödem e.A. mit einem erhöhten Sterberisiko nach Brustkrebsbehandlung in Verbindung gebracht werden könnte12. Konservatives Management wie Kompression des betroffenen Bereichs, manuelle Lymphdrainage und allgemeine Hautpflege bleiben der erste Linienansatz. Derzeit gibt es keine kurative Behandlung6. Obwohl auf dem Gebiet der chirurgischen und medizinischen Therapie Fortschritte erzielt wurden, gibt es noch Raum für Verbesserungen. Mehr Forschung, die Einblicke in die Pathophysiologie und das Fortschreiten der Krankheit bietet, ist notwendig, um Ärzten zu ermöglichen, bessere Behandlungsmöglichkeiten für die Patienten zu bieten5.
Tiermodelle werden in der präklinischen Forschung eingesetzt, um die Pathophysiologie von Krankheiten zu verstehen und mögliche Behandlungsmöglichkeiten zu entwickeln. Mehrere verschiedene Lymphödem Tiermodelle wurden in Denkanleben13,14, Kaninchen15, Schafe16, Schweine17,18 und Nagetiere19,20, 21,22,23,24. Das Nagetiermodell scheint das kostengünstigste Modell zu sein, wenn es um die Rekonstruktion der Lymphfunktion geht, da Nagetiere leicht zugänglich und relativ preisgünstigsind 25. Die mehrheit der Mäusemodelle haben sich auf die Induktion von Lymphödem enden im Schwanz der Mäuse21,22,23. Das Schwanzmodell ist sehr zuverlässig, aber die genaue chirurgische Technik zur Induktion von Lymphödem variiert erheblich in früheren veröffentlichten Materialien. Dies führt zu Schwankungen in der Dauer und Robustheit des entwickelten Lymphödemes, das in bekannter Litteratur25dargestellt wird. Verschiedene Techniken werden auch verwendet, um Lymphödeme im Hinterkiefermodell zu induzieren, und sie liefern auch unterschiedliche Ergebnisse, aber das Hinterglied-Modell könnte aus translationaler Sicht leichter zu verstehen sein. Frühere Lymphödemmodelle wurden durch spontane Lymphödemauflösung behindert und daher wird ein reproduzierbares und dauerhaftes Lymphödem-Modell benötigt25. Forscher haben zuvor versucht, die Dosis der Strahlung zu erhöhen, um die spontane Lymphödem-Auflösung zu verhindern, aber dies hat oft zu einer nachfolgenden schweren Morbiditätgeführt 25.
Dieses Modell führt zu statistisch signifikanten Lymphödemen, ohne eine schwere Morbidität zu verursachen, indem Mikrochirurgie und Strahlung kombiniert werden. Das Modell wurde von einem früheren chirurgischen Modell durch Zugabe einer Dosis von Bestrahlung, die Lymphödem induziert, ohne schwere Morbidität26. Es bietet auch eine großartige Gelegenheit für mikrochirurgische Ausbildung. Aufgrund der kleinen anatomischen Strukturen der Mäuse ist der Zugang zu mikrochirurgischen Geräten und einem Mikroskop notwendig. Der chirurgische Eingriff kann durchgeführt werden, wenn dem Benutzer grundlegende mikrochirurgische Techniken vermittelt wurden, wie z. B. das Absaten mit mikrochirurgischen Instrumenten. Die Bediener, die dieses Verfahren durchführten, sahen sich alle Tutorial-Videos von Acland über die Voraussetzungen der mikrochirurgischen Fähigkeiten (1981) und der grundlegenden Mikronahttechnik (1985) an. Wir empfehlen, den chirurgischen Eingriff 8-10 Mal zu praktizieren, bevor Sie ihn in der Forschung verwenden. Das Üben des Verfahrens stellt sicher, dass weniger Fehler gemacht werden und dass das Verfahren effizienter durchgeführt werden kann. Nach der Beherrschung kann der chirurgische Eingriff in 45 Minuten durchgeführt werden.
Protokoll
Die Tiere wurden gemäß den institutionellen Leitlinien in der Tierpflegeeinrichtung der Universität Süddänemark untergebracht. Alle Verfahren, an denen Tierquäler beteiligt sind, wurden von der Tierversuchsinspektion, dem dänischen Umwelt- und Lebensmittelministerium genehmigt.
1. Vorchirurgische Bestrahlung
HINWEIS: Die Bestrahlung vor der Operation erfolgt 7 Tage vor der Operation.
- Anästhesie induzieren.
- Legen Sie die Maus in eine Induktionsbox und stellen Sie den Verdampfer auf 3% Isofluran mit einer Sauerstoffdurchflussrate von 0,8 x 1,2 L/min, um Inhalationsanästhesie zu induzieren.
HINWEIS: Alternativ können injizierbare Anästhetika verwendet werden, aber für die kurze Dauer der Bestrahlung, die inhalative Inhalationsanästhesie induzieren, war ausreichend. Zur Erlangung der in diesem Artikel vorgestellten Ergebnisse wurden 9 Wochen alte weibliche C57BL6-Mäuse verwendet. - Stellen Sie sicher, dass die Maus vollständig durch Schwanz- oder Pfoten-Pinch-Test beäpft ist.
- Legen Sie die Maus in eine Induktionsbox und stellen Sie den Verdampfer auf 3% Isofluran mit einer Sauerstoffdurchflussrate von 0,8 x 1,2 L/min, um Inhalationsanästhesie zu induzieren.
- Positionieren Sie die Maus für die Bestrahlung.
- Wenn vollständig sediert, bewegen Sie die Maus aus dem Induktionskasten und legen Sie sie unter die Strahlungsquelle in Supine-Position und fixieren Sie die Hinterbeine vorsichtig mit Klebeband.
HINWEIS: Die Maus bleibt für die kurze Dauer der Strahlung sediert. - Legen Sie ein 1,5 mm dickes Bleipolster auf, um sicherzustellen, dass nur der Bereich, der operiert wird (d. h. der kreisförmige Bereich mit einem Durchmesser von 25 mm um das Knie), bestrahlt wird.
- Wenn vollständig sediert, bewegen Sie die Maus aus dem Induktionskasten und legen Sie sie unter die Strahlungsquelle in Supine-Position und fixieren Sie die Hinterbeine vorsichtig mit Klebeband.
- Verabreichen Sie eine Dosis von 10 Gy-Strahlung mit einer Dosis rate von 5,11 Gy/min (100 kVp, 10 mA).
VORSICHT: Bei der Arbeit mit Strahlung sind Sicherheitsvorkehrungen zu treffen. Während dieses Experiments wurde die gesamte Bestrahlung in einem strahlungsisolierten Raum durchgeführt, und die Strahlungsquelle wurde erst eingeschaltet, wenn das gesamte Personal den Raum verlassen und versiegelt hatte. - Legen Sie die Maus wieder in den Käfig.
2. Ausrüstungsaufbau
HINWEIS: Die Operation sollte in einem Raum durchgeführt werden, der chirurgischen Eingriffen gewidmet ist. Die Operationsoberfläche muss steril sein.
- Reinigen Sie alle operativen Oberflächen gründlich mit 70% Ethanol. Tragen Sie Haarnetz und Coveralls. Verwenden Sie sterile chirurgische Instrumente und sterile Handschuhe.
- Bereiten Sie Anästhesie vor.
- 1 ml Fentanyl (0,315 mg/ml), 1 ml Midazolam (5 mg/ml) und 2 ml steriles Wasser zeichnen. Verwenden Sie verschiedene Spritzen und Nadeln für die verschiedenen Komponenten.
- Fentanyl und steriles Wasser vermischen, indem Sie die Spritzen langsam in ein steriles Glasrohr entleeren. Wenn gemischt, fügen Sie Midazolam, um die Arbeitslösung zu vervollständigen.
- Bereiten Sie Analgesie vor.
- 0,2 ml Buprenorphin (0,3 mg/ml) und 2 ml Saline aufziehen.
- Mischen Sie die Volumina, indem Sie die Spritzen langsam in ein steriles Glasrohr entleeren, um die Arbeitslösung zu vervollständigen.
- Schalten Sie das Mikroskop ein und stellen Sie sicher, dass die Beleuchtung ausreichend ist und dass das Mikroskop gut auf die Augen des Bedieners eingestellt ist.
HINWEIS: Alle chirurgischen Eingriffe sollten unter einem Operationsmikroskop durchgeführt werden. Ein Vergrößerungsbereich von 4x-25x ist ausreichend.
3. Vorbereitung
- Wiegen Sie die Maus vor der Operation, indem Sie die Maus in einem leeren Behälter auf einer gelöschten Skala platzieren.
- Anästhetikum verabreichen.
- Zeichnen Sie 0,1 ml Anästhetikum pro 10 g Mauskörpergewicht. Injizieren Sie das Anästhetikum subkutan als Bolus-Injektion.
- Lassen Sie die Maus in einem Käfig mit viel Bettzeug und Unterschlupf für ca. 10 min ruhen, bis sie vollständig sediert ist. Untersuchen Sie die Anästhesietiefe, indem Sie die Muskelentspannung bewerten und einen Pfoten- oder Schwanzpinch-Test durchführen.
- Wenn vollständig sediert, rasieren Sie die hintere Gliedmaße für das Verfahren mit elektrischen Clippern gewählt. Achten Sie darauf, überschüssiges Haar zu wischen.
- Schalten Sie das Heizgerät ein, z. B. ein Heizkissen, und bedecken Sie es mit einem chirurgischen Tuch.
- Stellen Sie den Sauerstofffluss auf 0,8 l/min ein und verbinden Sie ihn mit einem Nosecon. Verwenden Sie 100% Sauerstoff.
HINWEIS: Das Nosecon ist nur für die Sauerstoffzufuhr und nicht für die Anästhesie. - Ophthalmologische Salbe auftragen und 0,5 ml Salin subkutan injizieren, vorzugsweise in der Schroffe der Maus, um Hypovolämie während der Operation zu verhindern.
- Positionieren Sie die Maus für eine Operation.
- Legen Sie die Maus auf das chirurgische Tuch in Supine-Position. Legen Sie den Nosecone über die Schnis.
- Fixieren Sie das Ende der Hinterbeine vorsichtig mit Klebeband, um zu verhindern, dass sich die Maus während der Operation verschiebt.
- Sterilisieren Sie die Haut mit Alkohol/Chlorhexidin oder Alkohol/Povidon Jod.
4. Chirurgie
HINWEIS: In diesem Beispiel wurde die linke Hinterseite (wenn die Maus in Supine-Position angezeigt wird) für die Prozedur ausgewählt.
- Machen Sie einen kreisförmigen Schnitt.
- Heben Sie die Haut mit glatten Zangen an und schneiden Sie eine kleine Öffnung ca. 5 mm proximal zur poplitealen Fossa.
- Schieben Sie eine scharfe Schere in die Öffnung und clip in Richtung Knie, so dass der Schnitt endet knapp über dem Knie. Achten Sie darauf, die darunter liegenden Gefäße nicht zu durchstechen, indem Sie die Haut beim Schneiden mit Zangen heben.
- Bewegen Sie die Maus in eine anfällige Position und schneiden Sie weiter vom Knie in Richtung der poplitealen Fossa, bis der Umfangsschnitt abgeschlossen ist.
- Sezieren Sie die Haut unter dem Knie.
- Sanft stumpf sezieren Sie den Bereich unter dem Knie bis ein paar Millimeter über dem Knöchel, indem Sie langsam öffnen und schließen Sie die Mikroschere, während die Haut mit Zange angehoben.
- Mit Mikroscheren vorsichtig die sichtbaren Verklebungen schnipsen. Verwenden Sie sterile Saline regelmäßig, um das Gewebe während des gesamten Eingriffs feucht zu halten.
- Sezieren Sie die Haut am proximalen Rand des Umfangsschnitts, so dass sie mit einem elastischen Retraktor zurückgezogen werden kann.
HINWEIS: Der Retraktor ermöglicht dem Bediener eine bessere Sicht auf das proximale Lymphgefäß und verhindert, dass sich der proximale Rand während der Operation verschiebt. - Drehen Sie das Hinterglied vorsichtig, während Sie sich in einer anfälligen Position befinden, und fixieren Sie ihn mit Klebeband, so dass die ischiatische Vene vom proximalerten Punkt des exponierten Bereichs bis zum distalsten Punkt sichtbar ist.
- Mit einer 0,5 ml Spritze mit einer 30 G Nadel wird etwa 0,01 ml Patent Blue V subkutan zwischen dem zweiten und dritten Zehen injiziert. Drücken Sie die Pfote ein paar Mal vorsichtig, um das Patent Blue V zu verteilen. Visualisieren Sie die Lymphgefäße und den Lymphknoten durch das Mikroskop, während das Patent Blue V die Lymphgefäße füllt.
HINWEIS: Wenn die blaue Farbe der Lymphgefäße während des Eingriffs verblasst, massieren Sie vorsichtig die Pfote, um die Aufnahme zu fördern, anstatt mehr Patent Blue V zu injizieren. Übermäßige Verwendung von Patent Blue V kann zu Leckagen und Färbung des Gewebes um die Lymphgefäße führen, die die Lymphgefäße umgeben können, die das Verfahren zu kompromittieren. - Suchen Sie die wichtigen Strukturen: den poplitealen Lymphknoten (PLN), die beiden Lymphgefäße distal zum Lymphknoten (DLV1 und DLV2) und das eine Lymphgefäß proximal zum Lymphknoten (PLV).
HINWEIS: Alle Lymphgefäße befinden sich neben der ischiatischen Vene. Das proximale Lymphgefäß wird in der Regel medial zur Vene gefunden, die beiden distalen Lymphgefäße sind medial und seitlich zur Vene gefunden. Die Abkürzungen der Strukturen werden im begleitenden Video verwendet. - Vergrößern Sie, um die PLV klar zu visualisieren und mit einer 10-0 Nylon-Nähte mit Mikronadelhalter und Mikrozange zu ligisieren. Drücken Sie die Pfote ein paar Mal, um sicherzustellen, dass kein Patent Blue V proximal an die Naht geht.
HINWEIS: Das Fett, das das Lymphgefäß umgibt, kann gestutzt werden. - Wiederholen Sie Schritt 4.7, um die beiden distalen Lymphgefäße zu ligieren. Drücken Sie mehrmals die Pfote, um sicherzustellen, dass kein Patent Blue V proximal an die Ligatur übergeht. Wenn die Lymphgefäße in der Nähe der ischiatischen Vene liegen, versuchen Sie, noch weiter distally zu sezieren.
HINWEIS: In diesem Beispiel kann man sehen, dass eines der Lymphgefäße aufgrund der Ligatur platzt, die den Lymphfluss behindert. Die Lymphgefäße spalten sich oft weiter unten von der Vene. - Entfernen Sie den poplitealen Lymphknoten.
- Suchen Sie den poplitealen Lymphknoten und schneiden Sie ein kleines Loch mit Mikroschere, um darauf zuzugreifen und ihn mit Mikrozangen und Mikroscheren zu entfernen.
HINWEIS: Der Lymphknoten hat eine glatte perlähnliche Oberfläche im Gegensatz zum umgebenden Fettgewebe. - Um zu testen, ob das entfernte Gewebe ein Lymphknoten ist, legen Sie es in ein mit Wasser gefülltes Reagenzglas.
HINWEIS: Wenn das Gewebe aus Fett besteht, schwimmt das Gewebe. Wenn das Gewebe ein Lymphknoten ist, sinkt es auf den Boden.
- Suchen Sie den poplitealen Lymphknoten und schneiden Sie ein kleines Loch mit Mikroschere, um darauf zuzugreifen und ihn mit Mikrozangen und Mikroscheren zu entfernen.
- Entfernen Sie das Leistenfettpad und den Lymphknoten.
- Vor dem Entfernen der Leistenfettpad, verwenden Sie einen bipolaren Koagulator, um die Gefäße durch das Fett laufen kauterisieren.
- Resektieren Sie das Leistenfettpad mit Mikrozangen und Mikroscheren. Schneiden Sie vorsichtig die kauterisierten Gefäße, die durch das Fett laufen. Dann resektieren Sie das Fettgewebe im Leistenbereich sanft.
HINWEIS: Der Lymphknoten im Fett wird selten durch Patent Blue V gefärbt und kann schwer vom Fett zu unterscheiden sein. Das Entfernen des Fettpolsters in einem Stück ist der beste Weg, um sicherzustellen, dass der Lymphknoten entfernt wurde.
- Spülen Sie das Bein gründlich mit steriler Saline und bestätigen Sie durch das Mikroskop, dass alle kleinen Haare und Partikel gründlich aus dem chirurgischen Bereich entfernt wurden, um Wundkontamination und Infektion zu vermeiden. Stellen Sie sicher, dass keine aktive Blutung vorliegt.
- Die Hautränder mit einer 6-0 Nylonnaht mit Einer 6-0 Nylonnaht mit Zangen und Nadelhalter bis zur Muskelfazie zu befolgen, sodass ein Spalt von 2 x 3 mm entsteht, um den oberflächlichen Lymphfluss zu beschränken.
HINWEIS: Das begleitende Video zeigt ein Beispiel für fertige Nähte. - Analgesie verabreichen. Zeichnen Sie 0,1 ml Analgesie pro 30 g Mauskörpergewicht. Injizieren Sie die Analgesie subkutan als Bolus-Injektion.
- Wiegen Sie die Maus für die Post-Chirurgie zum Vergleich.
- Legen Sie die Maus in einen Käfig in einem Schrank für die Wiederherstellung erhitzt.
5. Postoperative Pflege
- Geben Sie den Mäusen einzelne Käfige, um sich nach der Operation mit Wasser und Nahrung ad libitum zu erholen.
- Verabreichen Sie eine subkutane Bolusdosis von 0,02 ml Buprenorphin 3x täglich für 3 Tage für Analgesie.
- Überwachen Sie das Tier täglich auf eine angemessene Wundheilung, Schmerz- und Infektionsspuren. Wenn Anzeichen einer Infektion vorhanden sind, verwenden Sie Antibiotikasalbe.
6. Bestrahlung nach der Operation
- Wiederholen Sie drei Tage nach der Operation den Vorgang der vorchirurgischen Bestrahlung (Schritte 1.1-1.4).
Ergebnisse
Dieses Verfahren wurde bisher in drei getrennten Experimenten eingesetzt. Alle Experimente wurden von verschiedenen leitenden Forschern gemacht, die alle Co-Autoren dieses Artikels sind. In allen drei Experimenten wurde sehr darauf geachtet, dass elbe Verfahren wie in diesem Protokoll beschrieben zu befolgen. In allen drei Experimenten wurde ein sekundäres Lymphödem in einem Hinterglied induziert, während das andere Hinterglied als Kontrolle diente. Volumen der Hinterbeine waren das primäre Ergebnis in allen drei Experimenten. Abbildung 1 zeigt den Studienentwurf.
Alle Mäuse wurden in den Wochen nach der Operation einer Mikro-Computer-Tomographie unterzogen, um das Volumen der Hinterbeine zu messen. Die CT-Scans wurden an einem präklinischen Multimodalitätsscanner (Materialtabelle) durchgeführt und das Volumen der Hinterbeine wurde über die Region-of-Interest(ROI)-Funktion in der zugehörigen Software gemessen, wie zuvor beschrieben26. Das distale tibiofibuläre Gelenk befand sich in dreidimensionalen (3D) axonalen Bildern mit einer zuvor beschriebenen Methode27. Der ROI begann am distalen tibiofibulären Gelenk und umfasste bis zu diesem Punkt alle Gewebedistal. Der Hounsfield-Bereich für die Analyse wurde auf -500 bis 4000 festgelegt.
Alle Daten wurden mit statistischer Software analysiert (Tabelle der Materialien). Sidaks mehrfacher Vergleichstest wurde verwendet, um das Volumen des induzierten Lymphödems hinter dem Hinterglied mit dem Kontrollhinterglied zu vergleichen. Ein signifikanter Unterschied zwischen dem Kontroll-Hinterglied und dem Lymphödem-Hinterglied ist definiert als ein P-Wert <0.05.

Abbildung 1: Studiendesign und Zeitpunkte für Ergebnismessungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Experiment 126 umfasste 32 Mäuse, die in Vierergruppen verteilt waren. Eines der Ziele war es, mehrere verschiedene Strahlendosen zu untersuchen und die am besten bevorzugte Dosis zu finden, um ein dauerhaftes Lymphödem zu induzieren, ohne eine schwere Morbidität zu verursachen. Die Gruppe, die zwei Dosen von 10 Gy Bestrahlung gegeben wurde, umfasste vier Mäuse. Abbildung 2 zeigt, dass in allen 8 Wochen ein gleichbleibender Zustand des Lymphödems erreicht wurde. Tabelle 1 zeigt, dass es in den Wochen 1, 7 und 8 einen signifikanten Volumenunterschied zwischen dem Lymphödem-Hinterglied und dem Kontroll-Hinterglied gab. Während ein konsistenter Zustand des induzierten Lymphödems erreicht wurde, gab es keinen statistisch signifikanten Unterschied zwischen den Hinterbeinern während aller 8 Wochen. Dieses Ergebnis unterscheidet sich von den beiden anderen Experimenten und könnte aufgrund der relativ geringeren Stichprobengröße von vier Mäusen erklärt werden. Eine Erhöhung der Anzahl der Messungen würde die Leistung der Studie und damit die Wahrscheinlichkeit erhöhen, eine Differenz zu erkennen, wenn eine Differenz besteht28.

Abbildung 2: Mittleres Hintergliedvolumen: Experiment 1. Messungen von 4 Mäusen aus der Gruppe, die zwei Dosen von 10 Gy Bestrahlung gegeben wurde, sind in dieser Abbildung enthalten. Diese Grafik zeigt die mittleren Hinterbder-Volumen in mm3 in den 8 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Fehlerbalken stellen die Standardabweichung (SD) dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| woche | Lymphödemvolumen in mm3 (n = 4) | Regelvolumen in mm3 (n = 4) | P-Wert | 95% Konfidenzintervall |
| 1 | 218,53 € 9,3 | 136,78 € 2,48 | 0.002 | 53,77 bis 109,73 |
| 2 | 202,25 € 10,24 | 141,88 bei 8,02 | 0.066 | (-6,53) 127,28 |
| 3 | 193,28 € 10,80 | 141,20 bei 6,80 | 0.060 | (-3.7)€107,85 |
| 4 | 194,95 € 21,05 | 141,50 € 8,03 | 0.224 | (-41,85) 148,75 € |
| 5 | 193,75 € 7,07 | 141,70 bei 8,60 | 0.051 | (-0,27) 104,37 € |
| 6 | 193,23 € 3,42 | 141,78 € 10,29 | 0.054 | (-1.56)€104,46 |
| 7 | 194,95 € 7,26 | 143,23 € 8,90 | 0.050 | 0,17 bis 103,28 |
| 8 | 195,8 € 9,65 | 152,18 bei 5,81 | 0.009 | 19,88 bis 67,38 |
Tabelle 1: Sidaks Mehrfachvergleichstest: Experiment 1. Diese Tabelle zeigt den statistischen Vergleich zwischen den mittleren Volumina der induzierten Lymphödem-Hinterbeine und kontrollischen Hinterbleibs während der 8 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Werte werden wie: Mittelwert sD in mm3dargestellt. Der P-Wert < 0,05 gilt als signifikanter Unterschied zwischen dem Kontroll-Hinterglied und dem Lymphödem. n (Anzahl der Beobachtungen) = 4.
Experiment 2 umfasste 45 Mäuse. 15 Mäuse dienten als Kontrollpersonen und erhielten Saline-Injektionen. Die Kontrollen werden als repräsentative Ergebnisse verwendet, da wir davon ausgehen, dass die Saline-Injektionen keinen Einfluss auf das Volumen des induzierten Lymphödems hatten. Abbildung 3 zeigt, dass das Lymphödem weniger stabil war als in Experiment 1. Zusätzlich erhöhte sich das Volumen der Kontrollhinterbeinen während der 8 Wochen. Dadurch verringert sich die relative Differenz, die in Tabelle 2dargestellt wird. Es wurde spekuliert, dass die Mäuse ihre nicht operierte Hinterbeine mehr verwenden, in den Wochen nach der Operation, und dass dies zu Hypertrophie und Erhöhung des Gliedmaßenvolumens der nicht-operierten Hinterbeine führt. Am wichtigsten ist, dass Tabelle 3 zeigt, dass es statistisch signifikante Unterschiede zwischen dem Lymphödem hinterdlimb und der Kontrolle hinter den Hinterbleib während aller 8 Wochen nach der Operation. Die höhere Anzahl von Mäusen beweist, dass dieses Verfahren mindestens 8 Wochen lang statistisch signifikante Lymphödeme auslösen kann.
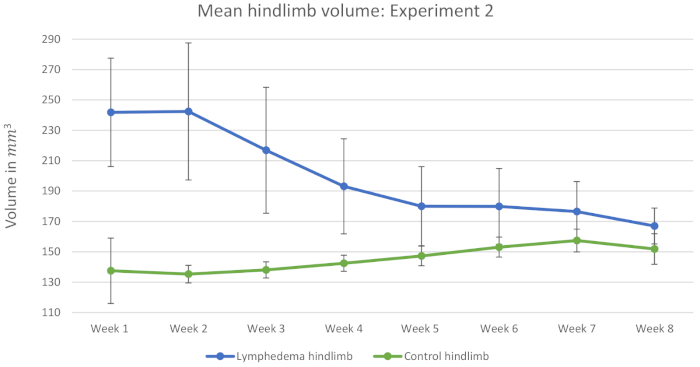
Abbildung 3: Mittleres Hintergliedvolumen: Experiment 2. Messungen von 15 Mäusen aus der Kontrollgruppe sind in dieser Abbildung enthalten. Diese Grafik zeigt die mittleren Hinterbder-Volumen in mm3 in den 8 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Fehlerbalken stellen SD dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Experiment 1 | Experiment 2 | Experiment 3 | Experiment 1, 2 und 3 kombiniert | |||||
| woche | Absolute Differenz (mm3) | Relative Differenz (%) | Absolute Differenz (mm3) | Relative Differenz (%) | Absolute Differenz (mm3) | Relative Differenz (%) | Absolute Differenz (mm3) | Relative Differenz (%) |
| 1 | 81,75 € 7,20 | 0,60 € 0,04 | 104,34 € 25,96 | 0,76 € 0,23 | 85,20 € 35,05 | 0,64 € 0,27 | 94,02 € 29,57 | 0,69 € 0,24 |
| 2 | 60,38 € 17,21 | 0,43 € 0,14 | 107,12 € 44,33 | 0,79 € 0,33 | 85,63 € 37,94 | 0,63 € 0,29 | 92,77 € 41,68 | 0,68 bei 0,31 |
| 3 | 52,08 € 14,35 | 0,37 € 0,11 | 78,77 € 39,45 | 0,57 € 0,28 | 74,67 € 49,57 | 0,54 bei 0,38 | 73,74 € 41,51 | 0,53 € 0,31 |
| 4 | 53,45 € 24,51 | 0,38 € 0,19 | 50,67 € 29,94 | 0,36 € 0,21 | 50,62 € 16,35 | 0,37 € 0,11 | 51,01 € 24,03 | 0,37 € 0,17 |
| 5 | 52,05 € 13,46 | 0,37 € 0,11 | 32,74 € 24,66 | 0,22 € 0,17 | 42,67 € 11,81 | 0,31 € 0,07 | 39,08 € 20,02 | 0,27 € 0,14 |
| 6 | 51,45 € 13,63 | 0,36 € 0,11 | 26,80 € 22,35 | 0,18 € 0,14 | 32,86 € 10,90 | 0,22 € 0,08 | 32,32 € 18,96 | 0,21 x 0,13 |
| 7 | 51,73 € 13,26 | 0,36 € 0,11 | 19,04 € 17,22 | 0,12 € 0,11 | - | - | 25,92 € 21,15 | 0,17 € 0,15 |
| 8 | 43,63 € 6,11 | 0,29 € 0,04 | 15,15 € 11,70 | 0,10 x 0,08 | - | - | 21,15 € 15,96 | 0,14 x 0,10 |
Tabelle 2: Absoluter und relativer Unterschied. Diese Tabelle zeigt den absoluten Volumenunterschied zwischen Lymphödem- und Kontrollhinterbeinen in mm3 und den relativen Unterschied sD in Prozent.
| woche | Lymphödemvolumen in mm3 (n = 15) | Regelvolumen in mm3 (n = 15) | P-Wert | 95% Konfidenzintervall |
| 1 | 241,82 € 35,69 | 137,48 bei 21,54 | <0,001 | 82,21 bis 126,47 |
| 2 | 242,41 € 45,13 | 135,29 € 5,81 | <0,001 | 69,33 bis 144,89 |
| 3 | 216,85 € 41,47 | 138,08 bei 5,31 | <0,001 | 45,15 bis 112,39 |
| 4 | 193,10 € 31,27 | 142,43 € 5,29 | <0,001 | 25,15 bis 76,18 |
| 5 | 180,03 € 26,03 | 147,29 € 6,45 | 0.002 | 11,72 bis 53,76 |
| 6 | 179,89 € 25,00 | 153,09 € 6,56 | 0.004 | 7,74 bis 45,85 |
| 7 | 176,45 € 19,77 | 157,41 € 7,49 | 0.008 | 4,35 bis 33,71 |
| 8 | 166,97 € 11,8 | 151,82 € 10,07 | 0.002 | 5.18 bis 25.12 |
Tabelle 3: Sidaks Mehrfachvergleichstest: Experiment 2. Diese Tabelle zeigt den statistischen Vergleich zwischen den mittleren Volumina der induzierten Lymphödem-Hinterbeine und kontrollischen Hinterbleibs in den 8 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Werte werden wie: Mittelwert sD in mm3dargestellt. Der P-Wert < 0,05 gilt als signifikanter Unterschied zwischen dem Kontroll-Hinterglied und dem Lymphödem. n (Anzahl der Beobachtungen) = 15.
Experiment 3 umfasste 36 Mäuse. 12 Mäuse dienten als Kontrolldienen und erhielten Saline-Injektionen. Die Kontrollen werden als repräsentatives Ergebnis verwendet, da wir davon ausgehen, dass die Saline-Injektionen keinen Einfluss auf das Volumen des induzierten Lymphödems hatten. In diesem Experiment wurde das Hintergliedvolumen der Mäuse für 6 Wochen statt 8 gemessen. Das Experiment dauerte nur 6 Wochen aufgrund logistischer Schwierigkeiten, als das Experiment durchgeführt wurde. Abbildung 4 zeigt ein konsistenteres Lymphödem als Experiment 2. Tabelle 4 zeigt, dass es in den 6 Wochen nach der Operation statistisch signifikante Lymphödeme gibt.

Abbildung 4: Mittleres Hintergliedvolumen: Experiment 3. Messungen von 12 Mäusen aus der Kontrollgruppe sind in dieser Abbildung enthalten. Diese Grafik zeigt die mittleren Hinterbder-Volumen in mm3 in den 6 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Fehlerbalken stellen SD dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| woche | Lymphödemvolumen in mm3 (n = 12) | Regelvolumen in mm3 (n = 12) | P-Wert | 95% Konfidenzintervall |
| 1 | 219,06 € 35,00 | 133,86 € 10,02 | <0,001 | 51,66 bis 118,74 |
| 2 | 220,90 € 36,98 | 135,27 € 5,89 | <0,001 | 49,33 bis 121,94 |
| 3 | 211,74 € 47,30 | 137,07 € 7,56 | 0.002 | 27.24-122.11 |
| 4 | 186,09 € 20,36 | 135,47 bei 5,70 | <0,001 | 34,98 bis 66,27 |
| 5 | 182,35 € 18,25 | 139,68 bei 7,45 | <0,001 | 31,37 bis 53,98 |
| 6 | 183,44 € 12,11 | 150,58 € 8,37 | <0,001 | 22,42 bis 43,29 |
Tabelle 4: Sidaks Mehrfachvergleichstest: Experiment 3. Diese Tabelle zeigt den statistischen Vergleich zwischen den mittleren Volumina der induzierten Lymphödem-Hinterbeine und kontrollischen Hinterbleibs in den 6 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Werte werden wie: Mittelwert sD in mm3dargestellt. Der P-Wert < 0,05 gilt als signifikanter Unterschied zwischen dem Kontroll-Hinterglied und dem Lymphödem. n (Anzahl der Beobachtungen) = 12.
Abbildung 5 und Tabelle 5 zeigen das mittlere Hintergliedsvolumen aller drei Experimente zusammen. Tabelle 5 zeigt, dass die Anwendung dieses Verfahrens zu einem statistisch signifikanten Lymphödem führt, das mindestens 8 Wochen dauert. Daten aus den ersten 6 Wochen sind die kombinierten Messungen von 31 Mäusen aus den Experimenten 1, 2 und 3. In Woche 7 bis 8 hatten wir nur Daten aus den Experimenten 1 und 2, die zu kombinierten Messungen von 19 Mäusen führten.

Abbildung 5: Kombiniertes mittleres Hintergliedvolumen: Experiment 1, 2 und 3. Einunddreißig Mäuse in den ersten 6 Wochen nach der Operation und 19 Mäuse in den folgenden 2 Wochen enthalten. Diese Grafik zeigt die mittleren Hinterbder-Volumen in mm3 in den 8 Wochen nach der Operation. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Fehlerbalken stellen SD dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| woche | Lymphödemvolumen in mm3 (Woche 1-6 n = 31) (Woche 7-8 n = 19) | Steuervolumen in mm3 (Woche 1-6 n = 31) (Woche 7-8 n = 19) | P-Wert | 95% Konfidenzintervall |
| 1 | 230,00 € 34,46 | 135,99 € 16,03 | <0,001 | 78,19 bis 109,84 |
| 2 | 228,90 € 40,91 | 136,13 € 6,32 | <0,001 | 70,47 bis 115,07 |
| 3 | 211,83 € 41,15 | 138,09 € 6,36 | <0,001 | 51,53 bis 95,95 |
| 4 | 190,63 € 25,81 | 139,62 bei 6,54 | <0,001 | 38,15 bis 63,87 |
| 5 | 182,70 € 21,52 | 143,62 € 7,79 | <0,001 | 28,36 bis 49,79 |
| 6 | 182,98 € 19,11 | 150,66 € 8,36 | <0,001 | 22,18 bis 42,47 |
| 7 | 180,34 € 19,31 | 154,43 € 9,60 | <0,001 | 11,61 bis 40,22 |
| 8 | 173,04 bei 16,42 | 151,89 € 9,19 | <0,001 | 10,35 bis 31,94 |
Tabelle 5: Sidaks Mehrfachvergleichstest: Experiment 1, 2 und 3 kombiniert. Diese Tabelle zeigt den statistischen Vergleich zwischen den mittleren Volumina der induzierten Lymphödem-Hinterbeine und Kontrollhinterbleibs von 31 Mäusen in den ersten 6 Wochen nach der Operation und 19 Mäusen in den folgenden 2 Wochen. Alle Mäuse erhielten eine Dosis von 10 Gy Bestrahlung vor und nach der Operation. Die Werte werden wie: Mittelwert sD in mm3dargestellt. Der P-Wert < 0,05 gilt als signifikanter Unterschied zwischen dem Kontroll-Hinterglied und dem Lymphödem. n (Anzahl der Beobachtungen) = 31.
Diskussion
Es gibt einige wichtige Schritte in diesem Protokoll. Erstens ist es wichtig, dass die Forscher Sicherheitsvorkehrungen treffen, wenn sie mit Radioaktivität arbeiten. Zweitens, während des chirurgischen Teils dieses Protokolls, ist es wichtig, das Verfahren zu starten, sobald die Maus beästhestisiert wurde und beenden Sie es ohne unnötige Pausen. Dies ist wichtig, um eine übermäßig lange Operationszeit für das Tier zu vermeiden und zu verhindern, dass die Anästhesie während der Operation an Wirkung verliert. Es wird empfohlen, nur eine Bolus-Injektion von Anästhetikum zu verabreichen und den chirurgischen Eingriff in einer Sitzung abzuschließen. Es ist auch ein kritischer Schritt, nicht zu viel Patent Blue V zu verabreichen, da überschüssiges Patent Blue V das Gewebe um die Lymphgefäße verfärben wird. Wenn das umgebende Gewebe verfärbt wird, kann es fast unmöglich sein, die Lymphgefäße zu visualisieren und dies beeinträchtigt das Verfahren. Selbst wenn es einem gelingt, die Lymphgefäße zu visualisieren, wird es das verfärbte Gewebe schwierig machen, zu beurteilen, ob das Patent Blue V proximal an die Ligatur übergeht oder nicht. Dies ist problematisch, da der Bediener sicher sein muss, dass die platzierten Ligaturen den Lymphfluss verengen, um sicherzustellen, dass das Verfahren erfolgreich ist. Es ist auch wichtig, beim Schließen der Wunde einen Abstand von 2 x 3 mm zu hinterlassen. Da eine temporäre Hautlücke oft benötigt wird, um den menschlichen Wundheilungsprozess nachzuahmen29.
Die Grenzen dieser Methode sind, dass es sich um ein zeitaufwändiges Verfahren handelt, das den Zugang zu einem Mikroskop und vorheriger mikrochirurgischer Ausbildung erfordert. Bei der Durchführung des chirurgischen Teils dieses Protokolls ist es wichtig, die Zeit zwischen den chirurgischen Eingriffen zu planen. Es wird viel Zeit darauf aufdas Warten auf die Anästhesierstinde des Tieres, das Rasieren des Hinterbeins und die Vorbereitung auf jeden chirurgischen Eingriff. Daher wird empfohlen, Gehäuse und Anästhesie im Voraus vorzubereiten. Es ist wichtig zu beachten, dass, um sicher zu sein, dass chronischeSödem induziert wurde, Histopathologie analysiert werden muss. Wir haben die Histopathologie nicht in diesen Artikel aufgenommen, was eine Einschränkung ist. Ohne histopathologische Unterstützung der Tatsache, dass histologische Veränderungen an den Lymphgefäßen stattgefunden haben, können die Volumenänderungen in den Hinterbeinern nur als Ödeme beschrieben werden. Der Artikel, der alle Daten über die vier Mäuse aus Experiment 126 enthält, beinhaltet die Histopathologie und zeigt, dass es signifikante Veränderungen in der Histopathologie mit dieser Technik gab. Der Artikel enthält auch lymphatische Bildgebung. Das gleiche Verfahren wurde an den Mäusen in Experiment 2 und 3 angewendet, aber die Histopathologie zeigte in diesen Experimenten keinen signifikanten Unterschied zwischen Lymphödem-Hinter- und Kontroll-Hinterglied. Weitere Studien einschließlich Histopathologie sind für dieses Modell erforderlich, um zu klären, ob Lymphödem auf histologischer Ebene induziert wird. Die Experimente 2 und 3 wurden noch nicht veröffentlicht, und wir können uns daher nicht darauf beziehen.
Während die Verwendung von CT-Scans zur Messung des Hinterbleibsvolumens objektiver sein kann als die Verwendung der Wasserverschiebungsmethode oder umlaufende Messungen, hat es immer noch seine Grenzen. Die Messtechnik ist teuer, zeitaufwändig und erfordert den Zugriff auf einen CT-Scanner und die Analysesoftware.
Eine der größten Herausforderungen bei Nagetier-Lymphödem-Modellen im Allgemeinen war die spontane Lymphödem-Auflösung, es sei denn, übermäßige Strahlung wurde25durchgeführt. Bei der Entwicklung dieses Modells testeten wir mehrere verschiedene Strahlendosen, um eine Dosis zu finden, die ein dauerhaftes Lymphödem induzieren würde, ohne eine schwere Morbidität zu verursachen26. Bisher wurden Lymphödemmodelle in den Methoden der Lymphödeminduktion oder Ergebnisbeurteilungen nicht standardisiert. Oashi et al.20 verwendeten eine Einzeldosis von 30 Gy Bestrahlung, und ligted jedes Lymphgefäß an drei separaten Punkten. In dieser Studie dauerte der chirurgische Eingriff 90 min. Obwohl die in diesem Artikel vorgestellte Methode als zeitaufwändig angesehen werden kann, kann der chirurgische Teil des Verfahrens immer noch etwa doppelt so schnell durchgeführt werden wie die von Oashi et al.20vorgestellte Methode. Sie hatten auch eine Nachbeobachtungszeit von 6 Monaten, die erheblich länger ist als jede der in diesem Artikel vorgestellten Studien. Sie enthielten jedoch nur eine Maus und sie maßen manuell den Gliedmaßenumfang, um die Schwellung zu bewerten, während die in diesem Artikel vorgestellten Volumina an 31 Mäusen mit Hilfe von CT-Scans und 3D-Analysesoftware gemessen wurden. Komatsu et al.30 entfernten die Leistenlymphknoten und die damit verbundenen peripheren Lymphgefäße und das Fettgewebe mit einem elektrischen Messer. Die Verwendung eines elektrischen Messers könnte ein einfacherer Ansatz sein, der kein mikrochirurgisches Training erfordert, aber das induzierte Ödem nach Tag 4 gelöst, während die in diesem Artikel vorgestellte Methode ein konsistentes Lymphödem bietet, das mindestens 8 Wochen dauert.
Dieses Protokoll wird es den Forschern hoffentlich ermöglichen, die Einschränkungen und Vorteile des überarbeiteten Lymphödemmodells zu berücksichtigen. Das Protokoll sollte auch Forschern helfen, das Modell erfolgreich zu replizieren. Die Methode kann in zukünftigen Beobachtungs- und Interventionsstudien eingesetzt werden, um die Pathophysiologie von Lymphödemen und forschungsneue Behandlungsmöglichkeiten zu verstehen. In zukünftigen Studien wäre es auch interessant, eine Nachbeobachtung länger als 8 Wochen zu haben, um zu beobachten, wie lange das induzierte Lymphödem dauert. Es wäre auch interessant, die Wirkung einer gezielteren Bestrahlung der Mäuse vor und nach der Operation zu beobachten. Dies kann durch ausführen eines CT-Scans und Planen eines Zielvolumes erfolgen. In zukünftigen Studien könnte dieses Modell auch durch fluoreszenzgeführte lymphatische Bildgebungs-, Perometrie- oder Bioimpedanzstudien unterstützt werden. Diese Methode bietet statistisch signifikante Lymphödeme von mindestens 8 Wochen, die direkt über CT volumetrisch in drei separaten Experimenten von verschiedenen leitenden Forschern gemessen wurde.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Peter Bollen, Leiter des Biomedizinischen Labors, für die Ausleihe der Notwendigen, um die Aufnahmen durch die Mikroskope aufzunehmen.
Materialien
| Name | Company | Catalog Number | Comments |
| 10-0 Nylon suture | S&T | 12051-10 | |
| 6-0 Nylon suture - Dafilon | B Braun | C0933112 | |
| Coagulator - ICC 50 | ERBE | ||
| Cotton tipped applicators | Yibon medical co | ||
| Dissecting forceps | Lawton | 09-0190 | |
| Elastic retractors | Odense University Hospital | ||
| Electrical clipper | Aesculap | GT420 | |
| Fentanyl 0,315 mg/ml | Matrix | ||
| Heating pad - PhysioSuite | Kent Scientific Corp. | ||
| Isoflurane 1000mg Attane | Scan Vet | ||
| Isoflurane vaporizer - PPV | Penlon | ||
| Micro jewler forceps | Lawton | 1405-05 | |
| Micro Needle holder | Lawton | 25679-14 | |
| Micro scissors | Lawton | 10128-15 | |
| Micro tying forceps | Lawton | 43953-10 | |
| Microfine U-40 syringe 0,5ml | BD | 328821 | |
| Microlance syringe 25g | BD | ||
| Microlance syringe 27g | BD | ||
| Midazolam 5 mg/ml (hameln) | Matrix | ||
| Needle holder - Circle wood | Lawton | 08-0065 | |
| Non woven swabs | Selefa | ||
| Opmi pico microscope F170 | Zeiss | ||
| Patent blue V - 25 mg/ml | Guerbet | ||
| Scissors - Joseph | BD | RH1630 | |
| Siemens INVEON multimodality pre-clinical scanner | Siemens pre-clinical solutions | ||
| Source of radiation - D3100 | Gulmay | ||
| Stata Statistical Software: Release 15 | StataCorp LLC | ||
| Temgesic - 0,2 mg | Indivior | ||
| Vet eye ointment - viscotears | Bausch & Lomb |
Referenzen
- Lawenda, B. D., Mondry, T. E., Johnstone, P. A. S. Lymphedema: a primer on the identification and management of a chronic condition in oncologic treatment. CA: A Cancer Journal for Clinicians. 59 (1), 8-24 (2009).
- Greene, A. K., Greene, A. K., Slavin, S. A., Brorson, H. Epidemiology and morbidity of lymphedema. Lymphedema: Presentation, Diagnosis, and Treatment. , 33-44 (2015).
- Hespe, G. E., Nores, G. G., Huang, J. J., Mehrara, B. J. Pathophysiology of lymphedema-Is there a chance for medication treatment?. Journal of Surgical Oncology. 115 (1), 96-98 (2017).
- Grada, A. A., Phillips, T. J. Lymphedema: Pathophysiology and clinical manifestations. Journal of the American Academy of Dermatology. 77 (6), 1009-1020 (2017).
- Chang, D. W., Masia, J., Garza, R., Skoracki, R., Neligan, P. C. Lymphedema: Surgical and Medical Therapy. Plastic and Reconstructive Surgery. 138 (3 Suppl), 209S-218S (2016).
- Carl, H. M., et al. Systematic Review of the Surgical Treatment of Extremity Lymphedema. Journal of Reconstructive Microsurgery. 33 (6), 412-425 (2017).
- DiSipio, T., Rye, S., Newman, B., Hayes, S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. The Lancet Oncology. 14 (6), 500-515 (2013).
- Douglass, J., Graves, P., Gordon, S. Self-Care for Management of Secondary Lymphedema: A Systematic Review. PLoS Neglected Tropical Diseases. 10 (6), e0004740 (2016).
- Shih, Y. C. T., et al. Incidence, treatment costs, and complications of lymphedema after breast cancer among women of working age: a 2-year follow-up study. Journal of Clinical Oncology. 27 (12), 2007-2014 (2009).
- Ridner, S. H. The psycho-social impact of lymphedema. Lymphatic Research and Biology. 7 (2), 109-112 (2009).
- Gutknecht, M., et al. Cost-of-illness of patients with lymphoedema. Journal of the European Academy of Dermatology and Venereology. 31 (11), 1930-1935 (2017).
- Hayes, S., et al. Prevalence and prognostic significance of secondary lymphedema following breast cancer. Lymphatic Research and Biology. 9 (3), 135-141 (2011).
- Danese, C. A., Georgalas-Bertakis, M., Morales, L. E. A model of chronic postsurgical lymphedema in dogs' limbs. Surgery. 64 (4), 814-820 (1968).
- Das, S. K., Franklin, J. D., O'Brien, B. M., Morrison, W. A. A practical model of secondary lymphedema in dogs. Plastic and Reconstructive Surgery. 68 (3), 422-428 (1981).
- Huang, G. K., Hsin, Y. P. An experimental model for lymphedema in rabbit ear. Microsurgery. 4 (4), 236-242 (1983).
- Tobbia, D., et al. Lymphedema development and lymphatic function following lymph node excision in sheep. Journal of Vascular Research. 46 (5), 426-434 (2009).
- Lahteenvuo, M., et al. Growth factor therapy and autologous lymph node transfer in lymphedema. Circulation. 123 (6), 613-620 (2011).
- Honkonen, K. M., et al. Lymph node transfer and perinodal lymphatic growth factor treatment for lymphedema. Annals of Surgery. 257 (5), 961-967 (2013).
- Wang, G. Y., Zhong, S. Z. A model of experimental lymphedema in rats' limbs. Microsurgery. 6 (4), 204-210 (1985).
- Oashi, K., et al. A new model of acquired lymphedema in the mouse hind limb: a preliminary report. Annals of Plastic Surgery. 69 (5), 565-568 (2012).
- Slavin, S. A., Van den Abbeele, A. D., Losken, A., Swartz, M. A., Jain, R. K. Return of lymphatic function after flap transfer for acute lymphedema. Annals of Surgery. 229 (3), 421-427 (1999).
- Cheung, L., et al. An experimental model for the study of lymphedema and its response to therapeutic lymphangiogenesis. BioDrugs : Clinical Immunotherapeutics, Biopharmaceuticals and Gene Therapy. 20 (6), 363-370 (2006).
- Rutkowski, J. M., Moya, M., Johannes, J., Goldman, J., Swartz, M. A. Secondary lymphedema in the mouse tail: Lymphatic hyperplasia, VEGF-C upregulation, and the protective role of MMP-9. Microvascular Research. 72 (3), 161-171 (2006).
- Tammela, T., et al. Therapeutic differentiation and maturation of lymphatic vessels after lymph node dissection and transplantation. Nature Medicine. 13 (12), 1458-1466 (2007).
- Frueh, F. S., et al. Animal models in surgical lymphedema research--a systematic review. Journal of Surgical Research. 200 (1), 208-220 (2016).
- Jorgensen, M. G., et al. Quantification of Chronic Lymphedema in a Revised Mouse Model. Annals of Plastic Surgery. 81 (5), 594-603 (2018).
- Frueh, F. S., et al. High-resolution 3D volumetry versus conventional measuring techniques for the assessment of experimental lymphedema in the mouse hindlimb. Scientific Reports. 6, 34673 (2016).
- Biau, D. J., Kerneis, S., Porcher, R. Statistics in brief: the importance of sample size in the planning and interpretation of medical research. Clinical Orthopaedics and Related Research. 466 (9), 2282-2288 (2008).
- Korula, P., Varma, S. K., Sunderrao, S. Inhibition of wound contraction by point-to-point adherent splintage. Plastic and Reconstructive Surgery. 95 (4), 725-730 (1995).
- Komatsu, E., et al. Lymph Drainage During Wound Healing in a Hindlimb Lymphedema Mouse Model. Lymphatic Research and Biology. 15 (1), 32-38 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten