Method Article
マウスの後肢における二次リンパ浮腫を誘導する改訂方法
要約
この動物モデルは、研究者がマウスの後肢で統計的に有意な二次リンパ浮腫を誘導することを可能にし、少なくとも8週間持続する。モデルはリンパ浮腫の病態生理学を研究し、新しい処置の選択を調査するために使用することができる。
要約
動物モデルは、病気の病態生理学を理解するだけでなく、潜在的な治療オプションを探求するためにリンパ浮腫の研究において最も重要である。このマウスモデルは、研究者が少なくとも8週間持続する有意なリンパ浮腫を誘発することを可能にする。リンパ浮腫は、分画放射線療法とリンパ薬の外科的アブレーションの組み合わせを使用して誘導される。このモデルは、マウスが手術の前後に10グレー(Gy)放射線の用量を得ることを必要とします。モデルの外科的部分は、3つのリンパ管の結び合合とマウス後肢からの2つのリンパ節の抽出を含む。マウスの小さな解剖学的構造のために、マイクロ外科ツールと顕微鏡へのアクセスが不可欠です。このモデルの利点は、統計的に有意なリンパ浮腫をもたらし、異なる治療オプションを評価するための良好な基礎を提供することです。それはまたマイクロ外科の訓練のための大きく、容易に利用できる選択である。このモデルの制限は、特に事前に練習していない場合、手順に時間がかかる可能性が高いということです。このモデルは、重篤な罹患率を引き起こすことなく、マウスにおいて客観的に定量可能なリンパ浮腫をもたらし、3つの別々のプロジェクトで試験されている。
概要
リンパ浮腫は、局所的な組織腫脹につながるリンパ液の蓄積を特徴とし、これは主にリンパ管1におけるリンパ液の流れの障害または破壊によって生じる。リンパ系2における感染、閉塞、傷害または先天性欠陥によってリンパ流が損なわれたり、破壊されたりする。これらの病因は、炎症の慢性状態につながるリンパ液の蓄積をもたらし、その後の線維化、ならびに脂肪組織3の沈着をもたらす。リンパ浮腫は、原発性または二次リンパ浮腫として分類することができる。原発性リンパ浮腫は、発達異常または遺伝子変異によって引き起こされる2、4。二次リンパ浮腫は、基礎的な全身性疾患、手術または外傷2、4のために生じる。二次リンパ浮腫は、世界で最も一般的なリンパ浮腫の形態である 2.先進国では、二次リンパ浮腫の最も一般的な原因は、アジュバント放射線療法やリンパ節解離5などのオンコロジー療法である。リンパ浮腫は乳癌患者の間で最も頻繁であるが、婦人科、黒色腫、泌尿生殖器または頸部癌6の患者においても発症し得る。乳がんと診断されたすべての女性のうち、21%がリンパ浮腫7を発症することが示唆されている。
リンパ浮腫は、身体的にも心理的にも患者にストレスを与える可能性があります。リンパ浮腫の患者は、感染のリスクが高い5,8,9, 生活の質が悪く、社会不安やうつ病 10 の症状を発症する可能性があります。慢性リンパ浮腫の合併症は、高いケアコストと増加した疾患負担9、11につながります。所見はまた、リンパ浮腫が乳癌治療12後の死亡リスクの増加に関連している可能性を示唆している。患部の圧縮、手動リンパドレナージ、一般的なスキンケアなどの保守的な管理は、最初のラインアプローチのままです。現在、治癒治療はありません6.外科・医療の分野では進歩を遂げていますが、まだ改善の余地があります。より多くの研究は、疾患の病態生理学および進行に関する洞察を提供し、臨床医が患者に対してより良い治療オプションを提供することを可能にするために必要である5。
動物モデルは、疾患の病態生理学を理解し、潜在的な治療オプションを開発するために、前臨床研究で使用されています。いくつかの異なるリンパ浮腫動物モデルは、イヌ13、14、ウサギ15、羊16、豚17、18とげっ歯類19、20で確立されています。 21、22、23、24.げっ歯類モデルは、リンパ機能の再構築を調査する際に、げっ歯類が容易にアクセスでき、比較的低価格の25に起因する、最も費用対効果の高いモデルのようです。マウスモデルの大半は、マウス21、22、23の尾部にリンパ浮腫を誘導することに焦点を当てている。尾部モデルは非常に信頼できるが、リンパ浮腫を誘発するための正確な外科技術は以前に出版された材料で有意に異なる。これは、既知のゴミ捨て場25に提示される発達リンパ浮腫の持続時間および堅牢性の変動をもたらす。後肢モデルでリンパ浮腫を誘導するために異なる技術が使用されており、それらはまた様々な結果をもたらすが、後肢モデルは翻訳の観点から理解しやすいかもしれない。以前のリンパ浮腫モデルは自発的リンパ浮腫分解能によって妨げられているので、再現性と永久的なリンパ浮腫モデルが必要です25.研究者は以前、自発的なリンパ浮腫の分解能を防ぐために放射線の線量を増やそうとしましたが、これはしばしばその後の重度の罹患率25につながっています。
このモデルは、微小手術と放射線を組み合わせることにより、重度の罹患率を引き起こすことなく、統計的に有意なリンパ浮腫をもたらす。モデルは、重篤な罹患率26を引き起こすことなく、リンパ浮腫を誘発する照射の用量を追加することによって、以前の外科モデルから改訂された。また、マイクロサージカルトレーニングの絶好の機会です。マウスの小さな解剖学的構造のために、マイクロサージカル装置と顕微鏡へのアクセスが必要です。外科的処置は、ユーザーがマイクロ手術器具で縫合するなど、基本的な微小外科技術を教えられたときに行うことができる。この手順を実行したオペレータは、すべてマイクロサージカルスキル(1981)と基本的なマイクロ縫合技術(1985)の前提条件に関するAclandによるチュートリアルビデオを見ました。研究に使用する前に、8-10回の手術を行うお勧めします。手順を練習すると、ミスが少なくなり、手順をより効率的に実行できます。マスターすると、外科的処置は45分で行うことができる。
プロトコル
動物は、機関のガイドラインに従って、南デンマーク大学動物介護施設に収容されました.動物の被験者に関するすべての手順は、デンマーク環境・食品省動物実験検査所によって承認されています。
1. 手術前照射
注:手術前照射は手術の7日前に行われます。
- 麻酔を誘発する。
- 誘導ボックスにマウスを入れ、気化器を酸素流量0.8−1.2 L/minの3%アイソフルランに設定し、吸入麻酔を誘発します。
注:あるいは、注射麻酔薬を使用できるが、吸入麻酔を誘発する照射の短期間で十分であった。本稿で提示した結果を得るために、9週齢の雌C57BL6マウスを用いた。 - マウスがテールまたはポーピンチテストによって完全に麻酔されていることを確認します。
- 誘導ボックスにマウスを入れ、気化器を酸素流量0.8−1.2 L/minの3%アイソフルランに設定し、吸入麻酔を誘発します。
- マウスを照射用に配置します。
- 完全に鎮静した場合は、誘導ボックスからマウスを移動し、放射線源の下に配置し、後肢をテープでゆっくりと固定します。
メモ:マウスは放射線の短い間鎮静されたままになります。 - 1.5 mm の厚さのリード パッドを配置して、手術を受ける領域 (膝の周りに直径 25 mm の円形領域) のみが照射されるようにします。
- 完全に鎮静した場合は、誘導ボックスからマウスを移動し、放射線源の下に配置し、後肢をテープでゆっくりと固定します。
- 5.11 Gy/min(100 kVp、10 mA)の線量で10 Gy放射線の用量を投与する。
注意: 放射線を使用する場合は、安全上の注意が必要です。この実験では、すべての照射が放射線絶縁室で行われ、放射線源は全ての人員が部屋を出て密閉した時にのみオンになりました。 - マウスをケージに戻します。
2. 機器の設定
注:手術は外科的処置専用の部屋で行われるべきである。手術面は無菌でなければならない。
- 70%エタノールですべての手術面を徹底的に洗浄します。ヘアネットとカバーオールを着用してください。無菌手術器具と滅菌手袋を使用してください。
- 麻酔を準備します。
- フェンタニル1mL(0.315 mg/mL)、ミダゾラム1mL(5mg/mL)、滅菌水2mLを引き上げます。コンポーネントごとに異なる注射器と針を使用します。
- シリンジを無菌ガラスチューブにゆっくりと空にして、フェンタニルと滅菌水を混ぜます。混合した場合は、ミダゾラムを加えた作業液を完成させる。
- 鎮痛を準備します。
- ブプレノルフィン(0.3 mg/mL)の0.2 mLと生理食リンの2 mLを描きます。
- シリンジを無菌ガラス管にゆっくりと空にして、加工液を完成させ、ボリュームを混ぜます。
- 顕微鏡の電源を入れ、照明が十分であり、顕微鏡がオペレータの目に合わせて十分に調整されていることを確認します。
メモ:すべての外科的処置は操作顕微鏡の下で行われるべきである。4x-25xの倍率の範囲で十分です。
3. 準備
- クリアされたスケールで空の容器にマウスを置くことによって、マウスの前手術の重量を量ります。
- 麻酔薬を投与する。
- マウスの体重10gあたり麻酔薬の0.1 mLを描きます。ボーラス注射として麻酔薬を皮下注射する。
- 十分な寝具と避難所を備えたケージで、完全に鎮静するまで約10分間、マウスを休ませます。筋肉の弛緩を評価することによって麻酔の深さを調べ、足または尾のピンチテストを行う。
- 完全に鎮静したら、電気バリカンを使用して手順のために選択した後肢を剃ります。余分な髪を拭くようにしてください。
- 暖房パッドなどの加熱装置をオンにし、手術用の布で覆います。
- 酸素の流れを0.8 L/minに設定し、ノセコンで接続します。100%酸素を使用してください。
メモ:ノセコーンは酸素供給のためだけであり、麻酔ではありません。 - 眼科軟膏を塗布し、皮下に0.5mLの生理食リンを注射し、好ましくはマウスの擦り傷で、手術中の低血圧を予防する。
- 手術のためにマウスを置きます。
- 手術用の布の上にマウスを置きます。ノセコーンをスヌートの上に置きます。
- 手術中にマウスがずれるのを防ぐために、後肢の端をテープでゆっくりと固定します。
- アルコール/クロルヘキシジンまたはアルコール/ポビドネヨウ素を使用して皮膚を殺菌します。
4. 手術
注: この例では、左の後肢(マウスが配置位置で表示されている場合)が手順に対して選択されています。
- 円形の切開を行います。
- 滑らかな鉗子で皮膚を持ち上げ、ポピュライトフォッサに約5mm近似する小さな開口部をクリップします。
- 鋭いはさみを開口部にスライドさせ、膝のすぐ上に切り傷が終わるように膝に向かってクリップします。クリッピング中に鉗子で皮膚を持ち上げて、下にある血管を穿刺しないようにしてください。
- マウスを動かしやすく、円周切開が完了するまで、膝からポプリタルフォッサに向かってクリップを続けます。
- 膝の下の皮膚を解剖します。
- 膝の下の部分を足首の上の数ミリメートルにゆっくりと解剖し、鉗子で皮膚を持ち上げながらマイクロシブをゆっくりと開閉します。
- マイクロハサミを使用して、慎重に残りの目に見える癒着を切り取ります。滅菌生理食塩分を定期的に使用して、手順全体で組織を湿らせておきます。
- 円周切開部の近位縁で皮膚を解剖し、弾性リトラクタで後退できるようにします。
注:レトラクターはオペレータが近位リンパ管のよりよい眺めを可能にし、外科の間に近位の縁がずれるのを防ぐ。 - まだ傾向のある位置にいる間に、後肢を穏やかに回転させ、テープで固定して、露出した領域の最も近位の点から最も遠位点まで、傾斜静脈が見えるようにします。
- 30 G針で0.5 mLの注射器を使用して、2番目と3番目のつま先の間に約0.01 mLのパテントブルーVを皮下注射します。足を数回軽く押して、特許ブルーVを顕微鏡で視覚化し、特許ブルーVがリンパ管を満たすようにします。
注:リンパ管の青色が処置中に薄れた場合、取り込みを促進するために足を穏やかにマッサージし、より多くの特許ブルーVを注入するのではなく、特許ブルーVの過剰使用は、リンパ管を取り巻く組織の漏れおよび着色につながる可能性があります。手順を損なう。 - 重要な構造を見つける:ポプリタルリンパ節(PLN)、リンパ節(DLV1およびDLV2)に遠位の2つのリンパ管、およびリンパ節(PLV)に近位の1つのリンパ管。
注:すべてのリンパ管は、イスキア様静脈に隣接して見つけることができます。近位リンパ管は通常静脈の内側に見られ、2つの遠位リンパ管は静脈の内側および横に見られる。構造の省略形は、付属のビデオで使用されます。 - PLVを明確に視覚化し、マイクロニードルホルダーとマイクロフォースプを使用して10-0ナイロン縫合でそれをリゲートする拡大。プットを数回押して、特許ブルーVが縫合糸に近接して通過しないようにします。
注:リンパ管を取り囲む脂肪をトリミングする必要がある場合があります。 - ステップ4.7を繰り返して、2つの遠位リンパ管をリゲートします。足を数回押して、パテントブルーVが合字に近位を通過しないようにします。リンパ管がうるさかの静脈に近い場合は、さらに遠くまで解剖してみてください。
注:この例では、合字がリンパの流れを妨げることにより、リンパ管の1つが破裂していることがわかる。リンパ管はしばしば静脈からさらに下に分裂する。 - ポピュライトリンパ節を取り外します。
- ポピュライトリンパ節を見つけ、小さな穴をマイクロシザーでクリップしてアクセスし、マイクロフォースプスとマイクロシザーで取り外します。
注:リンパ節は、周囲の脂肪組織とは対照的に、滑らかな真珠のような表面を有する。 - 除去した組織がリンパ節であるかどうかをテストするには、水で満たされた試験管に入れます。
注:組織が脂肪で構成されている場合、組織は浮遊します。組織がリンパ節の場合、底部に沈みます。
- ポピュライトリンパ節を見つけ、小さな穴をマイクロシザーでクリップしてアクセスし、マイクロフォースプスとマイクロシザーで取り外します。
- 鼠径脂肪パッドとリンパ節を取り外します。
- 鼠径脂肪パッドを取り外す前に、双極性凝固器を使用して、脂肪を通る血管を焼灼します。
- マイクロフォースとマイクロシザーを使用して鼠径脂肪パッドを切り離します。脂肪を通って走る焼灼容器をゆっくりとクリップします。その後、鼠径部の脂肪組織を穏やかに切除します。
注:脂肪に位置するリンパ節は、特許ブルーVによって着色されることはほとんどなく、脂肪との区別が難しい場合があります。脂肪パッドを1枚で取り外すことを、リンパ節が取り外した状態を確認する最善の方法です。
- 無菌生理食塩水で脚を十分に洗い流し、小さな毛や粒子が外科的領域から完全に取り除かれ、創傷汚染や感染を避けるために顕微鏡を通して確認します。アクティブな出血がないことを確認します。
- 鉗子と針ホルダーを使用して6-0ナイロン縫合糸で筋肉のファシアに皮膚の縁を縫合し、表面的なリンパの流れを拘束するために2-3 mmのギャップを残します。
メモ:付属のビデオは、完成した縫合糸の例を示しています。 - 鎮痛を投与する。マウスの体重30gあたり0.1 mLの鎮痛を描きます。ボーラス注射として皮下に鎮痛を注射する。
- 比較のために手術後のためにマウスの重量を量ります。
- 回復のために加熱したキャビネット内のケージにマウスを置きます。
5. 術後ケア
- 水と食物アドリビタムで手術後に回復するためにマウスに個々のケージを与えます。
- 鎮痛のために3日間、ブプレノルフィン3xの0.02 mLの皮下用量を投与する。
- 適切な創傷治癒、痛みおよび感染の徴候のために毎日動物を監視する。感染の徴候がある場合は、抗生物質軟膏を使用してください。
6. 手術後の照射
- 手術の3日後に、手術前照射の手順を繰り返します(ステップ1.1−1.4)。
結果
この手順は、以前に 3 つの別々の実験で使用されています。すべての実験は、すべてこの記事の共同執筆者である異なるリード研究者によって行われました。3つの実験すべてにおいて、このプロトコルで説明したのと同じ手順に従うように細心の注意を払った。3つの実験すべてにおいて、二次リンパ浮腫は一方の後肢に誘発され、もう一方の後肢はコントロールとして機能した。後肢の体積は、3つの実験すべてにおいて主要な結果であった。図 1は、スタディ設計を示しています。
すべてのマウスは、後肢の体積を測定するために手術後数週間でマイクロコンピュータ断層撮影(μCT)スキャンを受けた。μCTスキャンは、マルチモダリティ前臨床スキャナ(材料テーブル)上で行い、後肢の体積は、前述の26として関連するソフトウェアの対象領域(ROI)機能を介して測定した。遠位脛骨関節は、先に説明した方法を用いて3次元(3D)軸索画像に位置した。ROIは遠位脛骨関節から始まり、その時点まですべての組織遠位を含んでいた。分析のハウンズフィールド範囲は-500~4000に設定されました。
すべてのデータは、統計ソフトウェア(材料表)を使用して分析されました。シダックの多重比較試験は、誘発されたリンパ浮腫後肢の体積を対照後肢と比較するために用いられた。対照後肢とリンパ浮腫後肢の有意差は、P値 <0.05 と定義される。

図1:結果測定の設計点と時間点を調べる。この図の大きなバージョンを表示するには、ここをクリックしてください。
実験126は、4つの群に分布する32匹のマウスを含んでいた。目的の一つは、重度の罹患率を引き起こすことなく持続的なリンパ浮腫を誘発するために、放射線のいくつかの異なる用量を研究し、最も好ましい用量を見つけることでした。10Gy照射の2回投与を与えられた群には、4匹のマウスが含まれていた。図2は、リンパ浮腫の一貫した状態がすべての8週間で達成されたことを示す。表1は、リンパ浮腫後肢とコントロール後肢の間に有意な差があったことを示す。誘発リンパ浮腫の一貫した状態が達成されたが、すべての8週間の間に後肢間に統計的に有意な差はなかった。この結果は他の2つの実験とは異なり、4匹のマウスのサンプルサイズが比較的小さいために説明できる。測定数を増やすと、研究の検出力が増加し、差が存在する場合に差を検出する確率は28である。

図2:平均後肢容積:実験1.この図には、10Gy照射の2回の用量を与えられた群からの4匹のマウスの測定値が含まれる。このグラフは、手術後8週間のmm3の平均後肢容積を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。誤差範囲は標準偏差(SD)を表します。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 週 | リンパ浮腫体積 mm3 (n = 4) | mm3の制御容積 (n = 4) | P値 | 95% 信頼区間 |
| 1 | 218.53 ± 9.3 | 136.78 ± 2.48 | 0.002 | 53.77−109.73 |
| 2 | 202.25 ± 10.24 | 141.88 ± 8.02 | 0.066 | (-6.53)−127.28 |
| 3 | 193.28 ± 10.80 | 141.20 ± 6.80 | 0.060 | (-3.7)−107.85 |
| 4 | 194.95 ± 21.05 | 141.50 ± 8.03 | 0.224 | (-41.85)−148.75 |
| 5 | 193.75 ± 7.07 | 141.70 ± 8.60 | 0.051 | (0.27)−104.37 |
| 6 | 193.23 ± 3.42 | 141.78 ± 10.29 | 0.054 | (-1.56)−104.46 |
| 7 | 194.95 ± 7.26 | 143.23 ± 8.90 | 0.050 | 0.17−103.28 |
| 8 | 195.8 ± 9.65 | 152.18 ± 5.81 | 0.009 | 19.88−67.38 |
表1:シダックの多重比較検定:実験1.この表は、手術後8週間の間に誘発されたリンパ浮腫後肢とコントロール後肢の平均体積との統計的比較を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。値は、mm3の平均 ± SD として表示されます。P値 < 0.05は、対照後肢とリンパ浮腫後肢との有意差と考えられる。n (観測値の数) = 4。
実験2には45匹のマウスが含まれていた。15匹のマウスが対照として働き、生理線注射を行った。コントロールは、生理線注射が誘発リンパ浮腫の体積に影響を与えたと仮定して代表的な結果として使用されます。図3は、リンパ浮腫が実験1よりも安定でないことを示す。さらに、コントロールの後肢の体積は8週間の間に増加した。これにより、表 2に示す相対的な差が減少します。マウスは手術後の数週間で、非手術後の後肢をより多く使用し、これが肥大化し、非手術後肢の四肢容積の増加につながると推測されている。最も重要なことは、表3は、手術後8週間の間にリンパ浮腫後肢と対照後肢との間に統計的に有意な差があることを示す。マウスの数が多いほど、この手順は少なくとも8週間統計的に有意なリンパ浮腫を誘発できることを証明する。
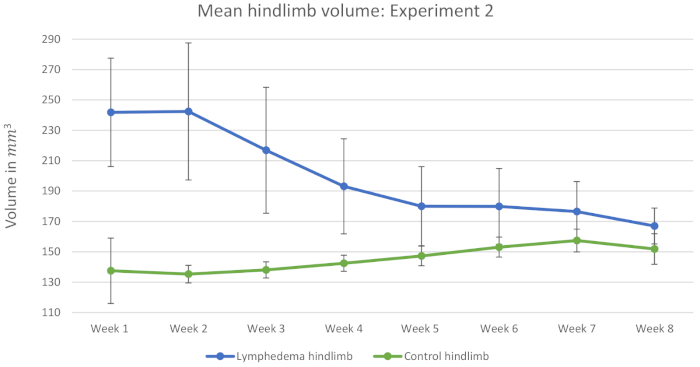
図3:平均後肢容積:実験2。この図には対照群からの15匹のマウスの測定値が含まれる。このグラフは、手術後8週間のmm3の平均後肢容積を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。誤差範囲は SD を表します。
| 実験1 | 実験2 | 実験3 | 実験1、2、3を組み合わせた | |||||
| 週 | 絶対差 (mm3) | 相対差 (%) | 絶対差 (mm3) | 相対差 (%) | 絶対差 (mm3) | 相対差 (%) | 絶対差 (mm3) | 相対差 (%) |
| 1 | 81.75 ± 7.20 | 0.60 ± 0.04 | 104.34 ± 25.96 | 0.76 ± 0.23 | 85.20 ± 35.05 | 0.64 ± 0.27 | 94.02 ± 29.57 | 0.69 ± 0.24 |
| 2 | 60.38 ± 17.21 | 0.43 ± 0.14 | 107.12 ± 44.33 | 0.79 ± 0.33 | 85.63 ± 37.94 | 0.63 ± 0.29 | 92.77 ± 41.68 | 0.68 ± 0.31 |
| 3 | 52.08 ± 14.35 | 0.37 ± 0.11 | 78.77 ± 39.45 | 0.57 ± 0.28 | 74.67 ± 49.57 | 0.54 ± 0.38 | 73.74 ± 41.51 | 0.53 ± 0.31 |
| 4 | 53.45 ± 24.51 | 0.38 ± 0.19 | 50.67 ± 29.94 | 0.36 ± 0.21 | 50.62 ± 16.35 | 0.37 ± 0.11 | 51.01 ± 24.03 | 0.37 ± 0.17 |
| 5 | 52.05 ± 13.46 | 0.37 ± 0.11 | 32.74 ± 24.66 | 0.22 ± 0.17 | 42.67 ± 11.81 | 0.31 ± 0.07 | 39.08 ± 20.02 | 0.27 ± 0.14 |
| 6 | 51.45 ± 13.63 | 0.36 ± 0.11 | 26.80 ± 22.35 | 0.18 ± 0.14 | 32.86 ± 10.90 | 0.22 ± 0.08 | 32.32 ± 18.96 | 0.21 ± 0.13 |
| 7 | 51.73 ± 13.26 | 0.36 ± 0.11 | 19.04 ± 17.22 | 0.12 ± 0.11 | - | - | 25.92 ± 21.15 | 0.17 ± 0.15 |
| 8 | 43.63 ± 6.11 | 0.29 ± 0.04 | 15.15 ± 11.70 | 0.10 ± 0.08 | - | - | 21.15 ± 15.96 | 0.14 ± 0.10 |
表 2: 絶対差と相対差この表は、リンパ浮腫と制御後肢±SDとmm3の間の体積の絶対差をパーセントで±SDに示す。
| 週 | リンパ浮腫体積 mm3 (n = 15) | mm3の制御容積 (n = 15) | P値 | 95% 信頼区間 |
| 1 | 241.82 ± 35.69 | 137.48 ± 21.54 | <0.001 | 82.21−126.47 |
| 2 | 242.41 ± 45.13 | 135.29 ± 5.81 | <0.001 | 69.33−144.89 |
| 3 | 216.85 ± 41.47 | 138.08 ± 5.31 | <0.001 | 45.15−112.39 |
| 4 | 193.10 ± 31.27 | 142.43 ± 5.29 | <0.001 | 25.15−76.18 |
| 5 | 180.03 ± 26.03 | 147.29 ± 6.45 | 0.002 | 11.72−53.76 |
| 6 | 179.89 ± 25.00 | 153.09 ± 6.56 | 0.004 | 7.74−45.85 |
| 7 | 176.45 ± 19.77 | 157.41 ± 7.49 | 0.008 | 4.35−33.71 |
| 8 | 166.97 ± 11.8 | 151.82 ± 10.07 | 0.002 | 5.18−25.12 |
表3:シダックの多重比較検定:実験2.この表は、手術後8週間における誘発リンパ浮腫後肢と対照後肢の平均体積との統計的比較を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。値は、mm3の平均 ± SD として表示されます。P値 < 0.05は、対照後肢とリンパ浮腫後肢との有意差と考えられる。n (観測値の数) = 15。
実験3には36匹のマウスが含まれていた。12匹のマウスが対照として機能し、生理線注射を行った。コントロールは、生理線注射が誘発リンパ浮腫の体積に影響を与えたと仮定して代表的な結果として使用されます。この実験では、マウスの後肢体積を8の代わりに6週間測定した。実験は、実験を行った時の物流上の困難のために6週間しか続かなかった。図4は、実験2よりも一貫したリンパ浮腫を示す。表4は、手術後6週間に統計的に有意なリンパ浮腫があることを示す。

図4:平均後肢容積:実験3.この図には対照群からの12匹のマウスの測定値が含まれる。このグラフは、手術後6週間でmm3の平均後肢容積を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。誤差範囲は SD を表します。
| 週 | リンパ浮腫体積 mm3 (n = 12) | mm3の制御容積 (n = 12) | P値 | 95% 信頼区間 |
| 1 | 219.06 ± 35.00 | 133.86 ± 10.02 | <0.001 | 51.66−118.74 |
| 2 | 220.90 ± 36.98 | 135.27 ± 5.89 | <0.001 | 49.33−121.94 |
| 3 | 211.74 ± 47.30 | 137.07 ± 7.56 | 0.002 | 27.24−122.11 |
| 4 | 186.09 ± 20.36 | 135.47 ± 5.70 | <0.001 | 34.98−66.27 |
| 5 | 182.35 ± 18.25 | 139.68 ± 7.45 | <0.001 | 31.37−53.98 |
| 6 | 183.44 ± 12.11 | 150.58 ± 8.37 | <0.001 | 22.42−43.29 |
表4:シダックの多重比較検定:実験3.この表は、手術後6週間における誘発リンパ浮腫後肢と対照後肢の平均体積との統計的比較を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。値は、mm3の平均 ± SD として表示されます。P値 < 0.05は、対照後肢とリンパ浮腫後肢との有意差と考えられる。n (観測値の数) = 12。
図5と表5は、3つの実験すべてを組み合わせた平均後肢体積を示す。表5は、この手順の使用が少なくとも8週間持続する統計的に有意なリンパ浮腫をもたらすことを示す。最初の6週間のデータは、実験1、2および3からの31匹のマウスの合計測定値である。第7-8週では、実験1と2のデータのみが得られ、19匹のマウスからの測定値が組み合わされました。

図5:複合平均後肢体積:実験1、2、3。手術後の最初の6週間に含まれる31匹のマウスと、次の2週間に含まれる19匹のマウス。このグラフは、手術後8週間のmm3の平均後肢容積を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。誤差範囲は SD を表します。
| 週 | リンパ浮腫体積 (mm3 (第 1-6 n = 31) (第7-8 n = 19週) | mm3の制御容積 (第 1-6 n = 31) (第7-8 n = 19週) | P値 | 95% 信頼区間 |
| 1 | 230.00 ± 34.46 | 135.99 ± 16.03 | <0.001 | 78.19−109.84 |
| 2 | 228.90 ± 40.91 | 136.13 ± 6.32 | <0.001 | 70.47−115.07 |
| 3 | 211.83 ± 41.15 | 138.09 ± 6.36 | <0.001 | 51.53−95.95 |
| 4 | 190.63 ± 25.81 | 139.62 ± 6.54 | <0.001 | 38.15−63.87 |
| 5 | 182.70 ± 21.52 | 143.62 ± 7.79 | <0.001 | 28.36−49.79 |
| 6 | 182.98 ± 19.11 | 150.66 ± 8.36 | <0.001 | 22.18−42.47 |
| 7 | 180.34 ± 19.31 | 154.43 ± 9.60 | <0.001 | 11.61−40.22 |
| 8 | 173.04 ± 16.42 | 151.89 ± 9.19 | <0.001 | 10.35−31.94 |
表 5: Sidak の多重比較テスト: 実験 1、2、および 3 を組み合わせたものです。この表は、手術後の最初の6週間における31匹のマウスと、次の2週間で19匹のマウスのリンフ浮腫後肢と対照後肢の平均体積との統計的比較を示す。すべてのマウスは、手術前および手術後に10Gy照射の用量を受けた。値は、mm3の平均 ± SD として表示されます。P値 < 0.05は、対照後肢とリンパ浮腫後肢との有意差と考えられる。n (観測値の数) = 31。
ディスカッション
このプロトコルには、いくつかの重要な手順があります。第一に、放射能を扱う際には安全対策を講じることが重要です。第二に、このプロトコルの外科的部分の間に、マウスが麻酔された後に処置を開始し、不必要な休憩なしでそれを終わらせることが重要である。これは、動物の過度に長い手術期間を避け、麻酔が手術中に効果を失うことを防ぐために重要です。麻酔薬の1つのボーラス注射のみを投与し、1回の座席で外科的処置を完了することをお勧めします。また、過剰な特許ブルーVはリンパ管を取り囲む組織を変色するので、あまりにも多くの特許ブルーVを投与しないことは、重要なステップです。周囲の組織が変色した場合、リンパ管を可視化することはほとんど不可能であり、これは手順を損なう可能性があります。たとえリンパ管を可視化できたとしても、変色した組織は、特許青Vが合字に近似しているかどうかを評価するのが難しいでしょう。これは、処置が成功することを確実にするために、配置された合字がリンパ流を収縮していることをオペレータが確認しなければならないので、問題です。傷口を閉じるときに2-3mmの隙間を残すことも重要です。一時的な皮膚ギャップとして、ヒト創傷治癒プロセス29を模倣するためにしばしば必要とされる。
この方法の限界は顕微鏡および以前のマイクロ外科訓練へのアクセスを要求する時間のかかるプロシージャである。このプロトコルの外科的部分を実行する場合、外科的処置の間の時間を計画することが重要である。多くの時間は、動物が麻酔されるのを待ち、後肢を剃り、一般的に各外科的処置の準備をする。そのため、事前にハウジングや麻酔薬を用意しておくとお勧めします。慢性リンパ浮腫が誘発されたことを確認するためには、組織病理学を分析する必要があることに注意することが重要です。この記事には組織病理学は含まれていませんが、これは制限事項です。組織学的変化がリンパ管に起こったという事実を支持する組織病理学がなければ、後肢の体積の変化は浮腫としか言いようがない。実験126からの4匹のマウスに関するすべてのデータを含む論文は、組織病理学を含み、この技術を用いて組織病理学に有意な変化があったことを示す。この記事にはリンパイメージングも含まれています。実験2および3のマウスでも同じ手順を用いたが、組織病理学はリンパ浮腫後肢とコントロール後肢との間に有意な差を示さなかった。リンパ浮腫が組織学的レベルで誘導されるかどうかを明らかにするために、このモデルには組織病理学を含むさらなる研究が必要である。実験2と3はまだ公開されていないので、それらを参照することはできません。
μCTスキャンを使用して後肢体積を測定することは、水変位法や円周測定よりも客観的であると主張できますが、依然として限界があります。測定技術はコストがかかり、時間がかかり、μCTスキャナと分析ソフトウェアにアクセスする必要があります。
げっ歯類リンパ浮腫モデルの最大の課題の1つは、過度の放射線が25を行わない限り、自発的なリンパ浮腫分解能であった。このモデルを開発する際に、我々は重度の罹患率26を引き起こすことなく、持続的なリンパ浮腫を誘発する用量を見つけるために放射線のいくつかの異なる用量をテストした。以前は、リンパ浮腫モデルはリンパ浮腫誘導または結果評価の方法で標準化されていなかった。Oashiら20は30Gy照射の単回投与を用い、各リンパ管を3つの別々の点で連結した。その研究では、外科的処置は90分かかりました。この記事で提示する方法は時間がかかると考えることができるが、処置の外科的部分は、Oashiら20によって提示される方法の約2倍の速さで行うことができる。彼らはまた、この記事で提示された研究のどれよりもかなり長い6ヶ月のフォローアップ期間を持っていました。しかし、マウスは1匹しか含まれておらず、腫れを評価するために手足の円周を手動で測定したのに対し、この記事で紹介した体積はμCTスキャンと3D解析ソフトウェアを用いて31匹のマウスで測定した。コマツら30は、電気ナイフを用いて鼠径リンパ節及び関連する末梢リンパ管及び脂肪組織を除去した。電気ナイフを使用することは、微小外科的な訓練を必要としないより簡単なアプローチかもしれませんが、この記事で提示された方法は、少なくとも8週間持続する一貫したリンパ浮腫を提供しながら、4日目以降に解決された誘発浮腫。
このプロトコルは、研究者が改訂されたリンパ浮腫モデルの限界と利点を考慮することを可能にします。このプロトコルは、研究者がモデルを正常に複製する際にも役立つはずです。この方法は、リンパ浮腫の病態生理学を理解し、新しい治療法の選択肢を研究するために、将来の観察および介入研究に使用することができます。今後の研究では、誘発リンパ浮腫がどれくらい続くのかを観察するために8週間以上のフォローアップを行うのも興味深いでしょう。また、手術前および手術後のマウスのより標的照射を行う効果を観察することも興味深い。これは、CT スキャンを実行し、ターゲット ボリュームを計画することによって行うことができます。今後の研究では、このモデルは蛍光誘導リンパイメージング、ペロメトリーまたはバイオインピーダンス研究によってもサポートされる可能性がある。この方法は、少なくとも8週間持続する統計的に有意なリンパ浮腫を提供し、異なる鉛研究者による3つの別々の実験においてCT体積を介して直接測定された。
開示事項
著者たちは何も開示する必要はない。
謝辞
著者らは、顕微鏡を通して見た映像を記録するために必要な機器を貸し出してくれたバイオメディカル研究所のピーター・ボレン所長に感謝する。
資料
| Name | Company | Catalog Number | Comments |
| 10-0 Nylon suture | S&T | 12051-10 | |
| 6-0 Nylon suture - Dafilon | B Braun | C0933112 | |
| Coagulator - ICC 50 | ERBE | ||
| Cotton tipped applicators | Yibon medical co | ||
| Dissecting forceps | Lawton | 09-0190 | |
| Elastic retractors | Odense University Hospital | ||
| Electrical clipper | Aesculap | GT420 | |
| Fentanyl 0,315 mg/ml | Matrix | ||
| Heating pad - PhysioSuite | Kent Scientific Corp. | ||
| Isoflurane 1000mg Attane | Scan Vet | ||
| Isoflurane vaporizer - PPV | Penlon | ||
| Micro jewler forceps | Lawton | 1405-05 | |
| Micro Needle holder | Lawton | 25679-14 | |
| Micro scissors | Lawton | 10128-15 | |
| Micro tying forceps | Lawton | 43953-10 | |
| Microfine U-40 syringe 0,5ml | BD | 328821 | |
| Microlance syringe 25g | BD | ||
| Microlance syringe 27g | BD | ||
| Midazolam 5 mg/ml (hameln) | Matrix | ||
| Needle holder - Circle wood | Lawton | 08-0065 | |
| Non woven swabs | Selefa | ||
| Opmi pico microscope F170 | Zeiss | ||
| Patent blue V - 25 mg/ml | Guerbet | ||
| Scissors - Joseph | BD | RH1630 | |
| Siemens INVEON multimodality pre-clinical scanner | Siemens pre-clinical solutions | ||
| Source of radiation - D3100 | Gulmay | ||
| Stata Statistical Software: Release 15 | StataCorp LLC | ||
| Temgesic - 0,2 mg | Indivior | ||
| Vet eye ointment - viscotears | Bausch & Lomb |
参考文献
- Lawenda, B. D., Mondry, T. E., Johnstone, P. A. S. Lymphedema: a primer on the identification and management of a chronic condition in oncologic treatment. CA: A Cancer Journal for Clinicians. 59 (1), 8-24 (2009).
- Greene, A. K., Greene, A. K., Slavin, S. A., Brorson, H. Epidemiology and morbidity of lymphedema. Lymphedema: Presentation, Diagnosis, and Treatment. , 33-44 (2015).
- Hespe, G. E., Nores, G. G., Huang, J. J., Mehrara, B. J. Pathophysiology of lymphedema-Is there a chance for medication treatment?. Journal of Surgical Oncology. 115 (1), 96-98 (2017).
- Grada, A. A., Phillips, T. J. Lymphedema: Pathophysiology and clinical manifestations. Journal of the American Academy of Dermatology. 77 (6), 1009-1020 (2017).
- Chang, D. W., Masia, J., Garza, R., Skoracki, R., Neligan, P. C. Lymphedema: Surgical and Medical Therapy. Plastic and Reconstructive Surgery. 138 (3 Suppl), 209S-218S (2016).
- Carl, H. M., et al. Systematic Review of the Surgical Treatment of Extremity Lymphedema. Journal of Reconstructive Microsurgery. 33 (6), 412-425 (2017).
- DiSipio, T., Rye, S., Newman, B., Hayes, S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. The Lancet Oncology. 14 (6), 500-515 (2013).
- Douglass, J., Graves, P., Gordon, S. Self-Care for Management of Secondary Lymphedema: A Systematic Review. PLoS Neglected Tropical Diseases. 10 (6), e0004740 (2016).
- Shih, Y. C. T., et al. Incidence, treatment costs, and complications of lymphedema after breast cancer among women of working age: a 2-year follow-up study. Journal of Clinical Oncology. 27 (12), 2007-2014 (2009).
- Ridner, S. H. The psycho-social impact of lymphedema. Lymphatic Research and Biology. 7 (2), 109-112 (2009).
- Gutknecht, M., et al. Cost-of-illness of patients with lymphoedema. Journal of the European Academy of Dermatology and Venereology. 31 (11), 1930-1935 (2017).
- Hayes, S., et al. Prevalence and prognostic significance of secondary lymphedema following breast cancer. Lymphatic Research and Biology. 9 (3), 135-141 (2011).
- Danese, C. A., Georgalas-Bertakis, M., Morales, L. E. A model of chronic postsurgical lymphedema in dogs' limbs. Surgery. 64 (4), 814-820 (1968).
- Das, S. K., Franklin, J. D., O'Brien, B. M., Morrison, W. A. A practical model of secondary lymphedema in dogs. Plastic and Reconstructive Surgery. 68 (3), 422-428 (1981).
- Huang, G. K., Hsin, Y. P. An experimental model for lymphedema in rabbit ear. Microsurgery. 4 (4), 236-242 (1983).
- Tobbia, D., et al. Lymphedema development and lymphatic function following lymph node excision in sheep. Journal of Vascular Research. 46 (5), 426-434 (2009).
- Lahteenvuo, M., et al. Growth factor therapy and autologous lymph node transfer in lymphedema. Circulation. 123 (6), 613-620 (2011).
- Honkonen, K. M., et al. Lymph node transfer and perinodal lymphatic growth factor treatment for lymphedema. Annals of Surgery. 257 (5), 961-967 (2013).
- Wang, G. Y., Zhong, S. Z. A model of experimental lymphedema in rats' limbs. Microsurgery. 6 (4), 204-210 (1985).
- Oashi, K., et al. A new model of acquired lymphedema in the mouse hind limb: a preliminary report. Annals of Plastic Surgery. 69 (5), 565-568 (2012).
- Slavin, S. A., Van den Abbeele, A. D., Losken, A., Swartz, M. A., Jain, R. K. Return of lymphatic function after flap transfer for acute lymphedema. Annals of Surgery. 229 (3), 421-427 (1999).
- Cheung, L., et al. An experimental model for the study of lymphedema and its response to therapeutic lymphangiogenesis. BioDrugs : Clinical Immunotherapeutics, Biopharmaceuticals and Gene Therapy. 20 (6), 363-370 (2006).
- Rutkowski, J. M., Moya, M., Johannes, J., Goldman, J., Swartz, M. A. Secondary lymphedema in the mouse tail: Lymphatic hyperplasia, VEGF-C upregulation, and the protective role of MMP-9. Microvascular Research. 72 (3), 161-171 (2006).
- Tammela, T., et al. Therapeutic differentiation and maturation of lymphatic vessels after lymph node dissection and transplantation. Nature Medicine. 13 (12), 1458-1466 (2007).
- Frueh, F. S., et al. Animal models in surgical lymphedema research--a systematic review. Journal of Surgical Research. 200 (1), 208-220 (2016).
- Jorgensen, M. G., et al. Quantification of Chronic Lymphedema in a Revised Mouse Model. Annals of Plastic Surgery. 81 (5), 594-603 (2018).
- Frueh, F. S., et al. High-resolution 3D volumetry versus conventional measuring techniques for the assessment of experimental lymphedema in the mouse hindlimb. Scientific Reports. 6, 34673 (2016).
- Biau, D. J., Kerneis, S., Porcher, R. Statistics in brief: the importance of sample size in the planning and interpretation of medical research. Clinical Orthopaedics and Related Research. 466 (9), 2282-2288 (2008).
- Korula, P., Varma, S. K., Sunderrao, S. Inhibition of wound contraction by point-to-point adherent splintage. Plastic and Reconstructive Surgery. 95 (4), 725-730 (1995).
- Komatsu, E., et al. Lymph Drainage During Wound Healing in a Hindlimb Lymphedema Mouse Model. Lymphatic Research and Biology. 15 (1), 32-38 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved