Method Article
Rotulagem e imagem de placas amilóides no tecido cerebral usando a curcumina polifenóis naturais
Neste Artigo
Resumo
A curcumina é um fluorofifora ideal para rotulagem e imagem de placas de proteína beta amilóide no tecido cerebral devido à sua ligação preferencial à proteína beta amilóide, bem como suas semelhanças estruturais com outros corantes de ligação amilóide tradicionais. Ele pode ser usado para rotular e imagem placas de proteína beta amilóide de forma mais eficiente e barata do que os métodos tradicionais.
Resumo
A deposição da proteína beta amilóide (Aβ) em espaços extra e intracelulares é uma das patologias marcantes da doença de Alzheimer (DA). Portanto, a detecção da presença de Aβ no tecido cerebral da DA é uma ferramenta valiosa para o desenvolvimento de novos tratamentos para evitar a progressão da DA. Vários corantes clássicos de ligação amilóide, fluorocromático, sondas de imagem e anticorpos específicos de Aβ têm sido usados para detectar Aβ histoquimicamente no tecido cerebral da DA. O uso desses compostos para detecção de Aβ é caro e demorado. No entanto, devido à sua intensa atividade fluorescente, alta afinidade e especificidade para Aβ, bem como semelhanças estruturais com corantes tradicionais de ligação amilóide, a curcumina (Cur) é um candidato promissor para rotulagem e imagem de placas Aβ em pós-morte tecido cerebral. É um polifenóis natural da erva Curcuma longa. No presente estudo, Cur foi usado para rotular histoquimicamente as placas de Aβ de um modelo genético de camundongos 5x da doença de Alzheimer familiar (5xFAD) quanto do tecido humano da DA em um minuto. A capacidade de rotulagem de Cur foi comparada aos corantes de ligação amilóide convencionais, como tialavina-S (Thio-S), Congo vermelho (CR) e Fluoro-jade C (FJC), bem como anticorpos específicos de Aβ (6E10 e A11). Observamos que cur é a maneira mais barata e mais rápida de rotular e imagem placas Aβ quando comparado a esses corantes convencionais e é comparável aos anticorpos específicos aβ. Além disso, Cur se liga com a maioria das espécies aβ, como oligomers e fibrilas. Portanto, cur poderia ser usado como o mais rentável, simples e rápido agente de detecção fluorocromática para placas Aβ.
Introdução
A doença de Alzheimer (DA) é uma das mais comuns, relacionadas à idade, distúrbios neurológicos progressivos e uma das principais causas de morte em todo o mundo1,2. Aprendizagem, memória e deficiência de cognição, juntamente com distúrbios neuropsiquiátricos, são os sintomas comuns manifestados em3d.A. . Embora a etiologia da DA não tenha sido totalmente elucidada, as evidências genéticas, bioquímicas e experimentais disponíveis indicam que a deposição gradual de Aβ é um biomarcador definitivo para4dC. Esta proteína mal dobrada se acumula em espaços intracelulares e extracelulares e é pensado para estar envolvido na perda sináptica, aumento da neuroinflamação, e neurodegeneração nas regiões corticais e hipocampais no cérebro afetado sd5. Portanto, a detecção histoquímica de Aβ no tecido da DA é um primeiro passo crucial no desenvolvimento de medicamentos anti-amilóides não tóxicos para evitar a progressão da DA.
Durante as últimas décadas, vários corantes e anticorpos têm sido usados por muitos laboratórios de pesquisa para rotular e imagem placas Aβ no tecido cerebral, mas alguns desses métodos são demorados e os corantes ou anticorpos utilizados são caros, exigindo vários acessórios Produtos químicos. Portanto, o desenvolvimento de um meio barato de detecção de placas Aβ no cérebro da DA seria uma nova ferramenta bem-vinda. Muitos laboratórios começaram a utilizar cur, um promissor polifenol natural anti-amilóide, para rotulagem e imagem Aβ, bem como um agente terapêutico paraAD 6,7,8,9. Sua hidrofóbica e natureza lipofilia, semelhanças estruturais com corantes de ligação amilóide clássico, forte atividade fluorescente, bem como forte afinidade para se ligar com Aβ torna um fluorofofóbico ideal para rotulagem e imagem de placas Aβ no tecido ad10 . A coalhada se liga com placas e oligomeros aβ e sua presença também é detectada nos espaços intracelulares7,11,12,13. Além disso, tem sido demonstrado que quantidades mínimas (1-10 nM) de Cur podem rotular placas Aβ na doença de Alzheimer 5x (5xFAD) tecido cerebral7. Embora a concentração de 1 nM não forneça a intensidade ideal da fluorescência para contar de chapas de Aβ, uma concentração de 10 nM ou mais elevada de Cur faz. Ran e colegas14 relataram que doses tão baixas quanto 0,2 nM de cur derivada difluoroboron pode detectar in vivo aβ depósitos quase tão bem como uma sonda infravermelha. Se esta dose é suficiente para rotular placas Aβ no tecido ainda não está claro. A maioria dos estudos anteriores usou 20 a 30 min para colorir placas Aβ usando Cur, mas a coloração ideal pode exigir muito menos tempo.
O presente estudo foi projetado para testar o tempo mínimo exigido pela Cur para rotular placas Aβ no tecido cerebral da DA e comparar a sensibilidade para rotulagem e imagem de placas Aβ no tecido cerebral dos camundongos 5xFAD após colorir com Cur com outros Corantes de ligação a aβ, como Thioflavin-S (Thio-S), Congo vermelho (CR) e Fluoro-jade C (FJC). A capacidade de rotulagem aβ desses corantes de ligação amilóide clássicas foi comparada com a coloração de Cur em seções de cérebro coronal de parafina e criostata de camundongos 5xFAD e de dad humana com correspondência com idade e controle do tecido cerebral. Os resultados sugerem que Cur rotula as placas de Aβ de uma forma semelhante aos anticorpos específicos de Aβ (6E10) e moderadamente melhor do que Thio-S, CR ou FJC. Além disso, quando as injeções intraperitoneal de Cur para camundongos 5xFAD foram administradas por 2 a 5 dias, ela cruzou a barreira sangue-cérebro e encadernada com placas Aβ7. Curiosamente, concentrações nanomolar de Cur têm sido usados para rotular e imagem placas Aβ em 5xFAD tecido cerebral7,14. Além disso, placas aβ morfologicamente distintas, como placas de núcleo, neuritic, difusas e queimadas podem ser rotuladas por Cur de forma mais eficiente do que com qualquer uma das outras tinturas de ligação amilóide convencionais7. No geral, cur pode ser aplicado para rotular e imagem placas Aβ no tecido cerebral pós-morte de modelos animais da DA e / ou tecido da DA humana de uma forma fácil e barata, como uma alternativa confiável para anticorpos específicos Aβ.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Animal Care and Use Committee (ACUC) da Saginaw Valley State University. O tecido humano foi obtido a partir de um banco de cérebro estabelecido no Banner Sun Health Institute, no Arizona15,16.
1. Perfusão dos animais
- Prepare os amortecedores fixadores e de perfusão.
- Prepare 0,1 M tampão de fosfato de sódio adicionando 80 g de cloreto de sódio (NaCl), 2 g de cloreto de potássio (KCl), 21,7 g de fosfato de hidrogênio disódio (Na2HPO4·7H2O), 2,59 g de fosfato de dihidrogênio de potássio (KH2PO4 ), e água destilada dupla para fazer um total de 1 L.
- Prepare 4% de paraformaldeído (PFA).
- Adicione 40 g de paraformaldeído a 1 L de PBS (0,1 M, pH 7,4).
- Aqueça a solução PFA a 60 a 65 °C e misture com um agitador magnético.
NOTA: A temperatura não deve exceder 65 °C. - Adicione poucas gotas de NaOH (1 N) com um conta-gotas para dissolver completamente o PFA.
- Filtre a solução PFA com papel de filtro médio a fino e guarde a 4 °C.
NOTA: A solução é boa para um mês.
- Realizar anestesia animal e perfusão.
NOTA: Doze meses de idade B6SJL-Tg APP SwFlLon, PSEN1 *M146L*L286V, 1136799Vas/J (5×FAD) ratos controle de idade (n = 6 por grupo) foram comprados de vendedores e criados na casa animal da Universidade Estadual de Saginaw Valley. Genotyping foi confirmado pela reação em cadeia de polimerase (PCR), conforme descrito anteriormente7. O tecido cerebral humano da DA inclui tecido cerebral pós-morte e tecido de controle compatível com a idade.- Anestésico o animal com um agente anestésico adequado, como o pentobarbital de sódio (390 mg/kg de peso corporal), ou uma mistura de cetamina/xilázine (até 80 mg/kg de peso corporal quetamina e 10 mg/kg de peso corporal xylazine) por injeção intraneal peritoperito (27 G agulha e 1 seringa mL). Check the level of anesthesia by pinching a toe. Se o animal não responde, então ele está pronto para a cirurgia de perfusão.
- Coloque o animal anestesiado na posição supina na bandeja de cirurgia de perfusão e usando pequenas tesouras de íris faça uma incisão para a extremidade posterior do ventrículo esquerdo.
- Insira uma agulha de perfusão de 22 G no ventrículo esquerdo e faça uma pequena incisão no auricle direito para remover o fluido de perfusão do corpo. Use um sistema de perfusão alimentado por gravidade para permitir que o fluido de perfusão de gelo-frio (0,1 M PBS, pH 7,4) flua para 5-6 min (taxa de fluxo de 20 a 25 ml/min).
NOTA: Um fígado claro é o indicador de perfusão ideal. - Troque a válvula tampão para uma solução de paraformaldeído de 4% gelada para fixação e permita que ela flua por 8 a 10 min.
NOTA: Tremor seguido por membros endurecidos ou rígidos são indicadores de boa fixação. - Retire o cérebro do crânio usando uma tesoura. Usando uma espátula, recolher o cérebro e colocá-lo em um frasco de 4% PFA (pelo menos 10x o volume do volume cerebral) e armazenar a 4 °C até novo uso.
2. Processamento de tecidos
- Corte as seções de criostat.
- Transferir o cérebro para soluções de sacarose graduadas (10%, 20% e 30%) e guarde a 4 °C para 24 h cada, até o uso.
- Usando um criostat em -22 °C, corte 40 seções μm-grossas. Colete 10 a 20 seções por poço em uma placa de 6 poços cheia de PBS e azida de sódio (0,02%).
- Parafina incorporar as seções para o rato e tecido cerebral humano.
- Para seções de parafina, desidratar o tecido cerebral pós-fixo perfundido e 24 h com álcoois classificados (50%, 70%, 90%) para 2 h cada, seguido por 100% de álcool 2x para 1 h cada), e depois com xileno 2x para 1 h cada) à temperatura ambiente.
- Penetre o tecido com xilena-parafina (1:1) 2x para 1 h a 56 °C em um frasco cônico de vidro coberto com folha de alumínio.
- Mergulhe o tecido na parafina derretida (56 °C) por 4 a 6 h.
- Corte seções de 5 μm de espessura usando um microtome rotativo à temperatura ambiente e coloque-as em um banho de água de tecido a 45 °C.
- Histoquimicamente rotular as placas Aβ nas seções criostat com Cur.
- Lave as seções da etapa 2.1.2 com PBS (pH 7.4) 3x para 5 min cada.
- Mergulhe as seções em 70% de etanol por 2 min à temperatura ambiente.
- Dissolva o estoque Cur (1 mM) em metanol e diluir com 70% de etanol para obter uma concentração final de trabalho de 10 μM.
- Mergulhe as seções com a solução Cur de trabalho para 1-5 min à temperatura ambiente em uma coqueteleira em 150 rpm.
- Descarte a solução Cur e lave com 70% de etanol 3x por 2 min cada.
- Coloque as seções em slides de vidro revestidos de poli-L-lisina e monte com um deslizamento de cobertura usando mídia de montagem orgânica, como xileno de plásticoizador de estireno (DPX).
- Vista um microscópio de fluorescência usando filtros de excitação/emissão de 480/550 nm.
- Histoquimicamente rotular as placas Aβ no rato embutido na parafina e seções cerebrais humanas com Cur.
- Deparafinaas seções de tecido do passo 2.2.4 com xileno 2x para 5 min cada um à temperatura ambiente.
- Reidrate com soluções de álcool graduada (100%, 80%, 70%, 50% para 1 min cada) e com água destilada 2x para 5 min cada em temperatura ambiente.
- Seções de manchas com Cur (10 μM) por 10 min à temperatura ambiente no escuro, tremendo a 150 rpm. Lave com 70%, 90% e 100% de álcool por 2 min cada.
- Claro com xileno 2x para 5 min cada e escorregar cobrir com DPX.
- Visualize um microscópio de fluorescência, como mencionado na etapa 2.3.7.
- Colocalize Cur com o anticorpo Aβ em placas e oligomers Aβ.
- Lave seções criostat a partir do passo 2.1.2 com PBS 3x em uma placa de 12 poços.
- Bloqueie as seções com 10% de soro de cabra normal (NGS) dissolvido em PBS com 0,5% Triton-X-100 à temperatura ambiente por 1 h.
- Descarte a solução de bloqueio. Incubar as seções com anticorpos específicos aβ (6E10 ou A11, diluído 1:200) dissolvido em nova solução de bloqueio contendo 10% NGS e 0,5% Triton-X100 durante a noite em 4 °C em um shaker em 150 rpm.
- Descarte a solução de anticorpos e lave as seções com PBS 3x por 10 min cada.
- Incubar com a etiqueta secundária do anticorpo com fluorophore vermelho (por exemplo, Alexa 594) para 1 h na temperatura ambiente na obscuridade.
- Lave com PBS 3x por 10 min cada.
- Lave com 70% de álcool 1x.
- Incubar as seções com Cur (10 μM) por 5 min à temperatura ambiente.
- Lave com 70% de álcool 3x por 1 min cada.
- Desidratar com 90% e 100% de álcool por 1 min cada, claro com xileno 2x para 5 min cada, e montar em slides usando DPX.
- Visualize usando um microscópio de fluorescência com filtros apropriados de excitação/emissão para os sinais vermelhos e verdes.
- Para a colocalização intracelular de Aβ, manche as seções usando Aβ-anticorpo (6E10), restain com Cur à temperatura ambiente no escuro com agitação a 150 rpm, e contramancha com Hoechst-33342 (1 mg/ml) e/ou DAPI (1ug/ml) por 10 min à temperatura ambiente em o escuro com agitação em 150 rpm. Lave com PBS 3x.
- Tire imagens com filtros vermelhos, verdes e azuis com um objetivo de 100x (ampliação total 1.000x).
- Rotular placas Aβ com Thio-S, CR e FJC.
NOTA: Protocolos detalhados para rotulagem De Thio-S e CR foram relatados anteriormente7.- Para a coloração de FJC, lave as seções free-floating obtidas da etapa 2.1.2 com PBS 3x para 5 min cada.
- Coloque as seções em uma placa de 12 poços e mancha com FJC (0,001%) por 10 min no escuro à temperatura ambiente.
- Descarte a solução FJC e lave com PBS 3x por 5 min cada.
- Incubate com cloreto de amônio (NH4Cl, 50 mM dissolvido em PBS) por 10 min à temperatura ambiente.
- Descarte a solução NH4Cl e lave com PBS 3x por 5 min cada.
- Seguindo as etapas na seção 2.4, desidratar com soluções graduadas do álcool, cancelar, montar, e ver um microscópio da fluorescência usando filtros da excitação/emissão de 450/520 nm.
Resultados
Curcumina rotula placas de Aβ dentro de um minuto. Quando mantomos o tecido 5xFAD com Cur, descobrimos que cur rótulo placas Aβ dentro de 1 min. Embora o aumento do tempo de incubação com Cur tenha aumentado ligeiramente a intensidade da fluorescência das placas de Aβ, o número de placas aβ observadas não foi significativamente diferente entre 1 min e 5 minutos de tempo de coloração (Figura 1).
Cur pode rotular placas Aβ em criostato-preparado, rato embutido em parafina e tecido da DA humana que coloca com anticorpos específicos Aβ no tecido cerebral do mouse AD. Quando mantamos criosecção, seções incorporadas à parafina(Figura 2A)e tecido humano da DA(Figura 2B),observamos placas Aβ rotuladas por Cur em todos os tipos de seções de tecido. Além disso, para confirmar que Cur é vinculativo para placas Aβ, primeiro rotulado as placas com 6E10, seguido por manchas Cur. Observamos que o Cur foi completamente co-localizado com Aβ nas mesmas placas que ligavam o 6E10(Figura 2C).
Cur rotulou oligomeros Aβ e agregados intracelulares aβ. Para verificar se cur poderia rotular oligomers Aβ, seções de mouse 5xFAD foram manchadas com um anticorpo específico do oligomer Aβ (A11), seguido de coloração cur. Observamos que cur co-localizado com A11 em placas Aβ (Figura 3A). Da mesma forma, cur também co-localizado com o anticorpo 6E10 em espaços intracelulares(Figura 3B),indicando que ele pode rotular o Aβ intracelular.
Cur rotulou Aβ de forma mais proeminente do que as tinturas de ligação amilóide clássicas. A rotulagem aβ por Cur foi comparada com corantes de ligação amilóide comercialmente disponíveis Thio-S, CR, FJC. O anticorpo 6E10 específico de Aβ foi usado como controle padrão. Observamos que cur rotulado Aβ mais proeminente do que os corantes convencionais amilóide semligação (Figura 4).
Cur derivados bis-demethoxycurcumin (BDMC) e demethoxycurcumin (DMC), também presentes no extrato de açafrão, rotular placas Aβ comparativamente a Cur no tecido cerebral 5xFAD. Dois outros componentes principais, tais como BDMC e DMC, estão atuais no extrato da cúrcuma. Testamos se esses dois compostos também rotulam placas Aβ semelhantes às cur. Quando as seções cerebrais do rato 5xFAD foram manchadas com esses derivados, tanto a BDMC quanto a DMC também rotularam as placas de Aβ, paralelamente cur (Figura 5A). Diferentes meios de montagem foram investigados para verificar se havia interferência com a imagem de Aβ após colorir com Cur. O sinal fluorescente estava intacto em ambos os meios de montagem aquoso e orgânico, como DPX (Figura 5B). A coloração das placas Aβ com Cur foi apropriada após a rotulagem imunofluorescente e seguida de contramanchacom a solução Hoechst 33342 (1 mg/ml) ou 4′,6-diamidino-2-phenylindole (DAPI, 1μg/ml). Os sinais imunofluorescentes e a intensidade de contracoloração foram mantidos após a coloração de Cur (Figura 5C).

Figura 1: Curcumina rotula placas aβ dentro de um minuto. (A). Seções cerebrais de camundongos 5xFAD ou controle humano e tecido cortical da DA foram manchadas com Cur (10 μM) por 1 a 5 min e o número de placas visíveis foi contado. (B). Nenhuma diferença foi observada no número de contagens de placa de Aβ entre os tempos de coloração de 1 min e 5 min. Os dados são representados como média ± erro padrão da média (SEM). Clique aqui para ver uma versão maior deste número.
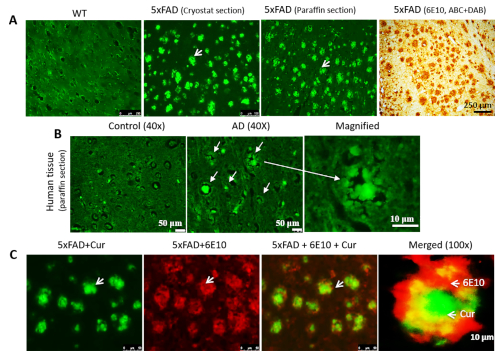
Figura 2: Colocalização de Cur com anticorpo aβ nas placas de Aβ. Cur pode rotular placas de Aβ em seções preparadas por criostato, parafina-incorporadas (A)e tecido humano da DA (B). A rotulagem de Aβ paralelo a rotulagem com anticorpos específicos Aβ (6E10, manchas DAB). (C). As seções 5xFAD foram rotuladas pela primeira vez com anticorpos Aβ (6E10), seguido scoloração com Cur. Vermelho = 6E10 vinculado por um anticorpo secundário marcado com fluorofifora Alexa 594. Verde = Cur. Cur completamente co-localizado com Aβ nas mesmas placas que ligavam a 6E10. Flechas indicam placas aβ. A barra de escala indica 50 μm (ampliação total = 400x) em todas as três imagens à esquerda, e 10 μm (ampliação total = 400x). Clique aqui para ver uma versão maior deste número.

Figura 3: Curcumina rotula oligomers Aβ e Aβ intracelular. A) Aβ-oligomer foi detectado imunohistoquimamente usando um anticorpo específico de Aβ (A11), seguido de coloração com Cur. Cur completamente colocalizada com Aβ, no mesmo oligomer onde A11 se liga. Barra de escala = 250 μm e ampliação total = 100x. (B) Da mesma forma, Aβ intracelular foi detectado imunohistoquimamente usando um anticorpo específico de Aβ (6E10), seguido de coloração com Cur. Note-se que cur completamente colocalizado com Aβ nas mesmas áreas ligadas a 6E10. Barra de escala = 50 μm e ampliação total = 1.000x. Clique aqui para ver uma versão maior deste número.

Figura 4: Comparação de diferentes corantes de ligação amilóide com Cur para rotular placas Aβ. Seções criostat (40 μm) do córtex de camundongos 5xFAD de 12 meses de idade foram manchadas com Cur, Thioflavin-S, Congo vermelho, Fluoro-jade C, e com anticorpo6E10. Cur rotulou as placas de Aβ de forma mais proeminente do que Thio-S, CR e FJC. Flechas indicam placas aβ. Clique aqui para ver uma versão maior deste número.

Figura 5: Cur-derivados bis-demethoxy curcumin e curcumina de demethoxy também rotular Aβ da mesma forma para Cur. (A) Ambas as seções criostat e parafina-encaixadas 5xFAD foram manchadas com cur-derivados bis-demethoxy curcumin e curcumina de methoxy. Ambos os derivados rotulam as placas de Aβ de uma forma semelhante à cur. (B) Ambos os meios de montagem aquosos e orgânicos (DPX) foram usados para montar seções do tecido após ter etiquetado chapas de Aβ com cur. (C)As seções imunoetiquetadas foram usadas para a rotulagem de Aβ com Cur. As setas brancas indicam placas de Aβ, a seta verde indica astrócito ativado (GFAP), e a seta amarela indica mancha nuclear (DAPI). Barras de escala = 100 μm. Por favor, clique aqui para ver uma versão maior deste número.
| Características | Aβ-anticorpo | Curcumina | Thio-S Thio-S | Vermelho de Congo | Fluoro-Jade C |
| Duração da coloração | ~24-48 h ~24-48 h | ~1-5 min ~1-5 min ~1-5 min | ~10 min ~10 min ~10 min | ~60 min ~60 min ~60 min | ~30 min ~30 min ~30 min |
| Produtos químicos acessórios | Anticorpos secundários, vários produtos químicos para fazer tampão, soro de cabra normal | Metanol | Etanol | NaOH e etanol | NaOH e etanol, permanganato de potássio |
| Custo | Caro: um frasco de anticorpos específico de Aβ requer ~$200-300 | Custo-benefício: ~$5-10/1 g Cur e pode ser aplicado para muitos tecidos | Custo-benefício: ~$5/1 g, pode ser aplicado para poucos tecidos | Custo-benefício: >$5/1 g Congo vermelho, e pode ser aplicado para vários tecidos | Caro: ~$15.500/1 g FJC pó |
| Especificidade | Diferentes anticorpos são necessários para oligomers Aβ e fibrilas | Curcumina se liga com oligomers Aβ e fibrilas | Pode ligar apenas fibrilas, não monomers, ou oligomeros | Só pode ligar-se a Aβ-protofibrils e fibrilas16,17 | Só pode ligar-se com Aβ-fibrils e neurônios degenerados |
| Estabilidade | Dependendo do tintendência ligado ao anticorpo secundário | Muito estável, mesmo à temperatura ambiente quando encadernado com Aβ | Estável em metanol | Estável em etanol | Não estável |
| Cuidado após a coloração | Precisa de cuidados extras após a coloração, como ser mantido no escuro e congelado o tempo todo | Não tão sensível à luz e mais estável à temperatura ambiente | Sensível à luz | Não sensível à luz | Sensível à luz |
| Microscópio necessário | Luz ou fluorescente composta (dependendo do uso de anticorpo secundário) | Fluorescente | Fluorescente | Microscópio de luz ou microscópio polarizado ou filtro polarizado | Fluorescente |
| Coloração de fundo | Geralmente, sem antecedentes | Fundo muito baixo | Fundo elevado devido à ligação com membrana lipída ou compostos lipídicos na célula | Fundo baixo | Fundo elevado |
| In vivo Aβ-imaging | Pode não ser aplicável | Altamente aplicável | Pode não ser aplicável | Pode não ser aplicável | Pode não ser aplicável |
Tabela 1: Comparação da rotulagem de Aβ com diferentes corantes de ligação amilóide e Cur7.
Discussão
Nossa hipótese era que cur poderia ser usado como a maneira mais rápida, mais fácil e menos cara para rotular e imagem placas Aβ no tecido cerebral pós-morte da aD quando comparado a outros corantes clássicos de ligação amilóide, bem como anticorpos específicos aβ. Os objetivos deste estudo foram determinar o tempo mínimo necessário para rotular e imagem placas Aβ por Cur no tecido cerebral pós-morte ad e determinar se Cur pode ser usado como uma alternativa ao anticorpo Aβ para rotular placas Aβ. Para este fim, a capacidade de rotulagem de Aβ de Cur foi observada em diferentes pontos de tempo. Cur foi capaz de rotular Aβ dentro de um minuto. Além disso, a rotulagem de Aβ by Cur foi maior do que outras corantes convencionais de ligação amilóide, como Thio-S (0,1%), CR (1%) e FJC (0,001%).
Cur é considerado um fluorofofóbico único e ideal para a rotulagem de Aβ, pois tem a maioria das características possuídas pela maioria dos corantes de ligação amilóide convencionais, incluindo propriedades estruturais, físicas, químicas e biológicas10. Além disso, devido à acessibilidade, a maioria dos pesquisadores estão interessados em usar este polifenóis naturais. Para mostrar a especificidade do Cur que liga às placas e aos oligomers de Aβ, nós usamos 6E10 e A11 (anticorpo Aβ-oligomer-específico). Cur mostrou colocalização quase completa com todas as diferentes espécies de Aβ presentes no tecido, o que sugere que Cur é altamente específico para Aβ7,17,18,19,20. Além disso, Cur rotulou Aβ oligomers (Figura 3A)e agregados intracelulares De Aβ(Figura 3B)e co-localizado com anticorpos Aβ (Figura 2B), sugerindo que cur pode rotular não só extracelular placas Aβ, mas também Aβ depositado em espaços intracelulares7.
Durante as últimas décadas, vários fluorofônicos e anticorpos foram desenvolvidos para rotular e imagem as placas de Aβ histoquimicamente. Sem dúvida, a maioria deles são muito específicos para as espécies aβ alvo e para detectar placas Aβ, mas estes são muito mais caros e seu uso é mais demorado do que usar Cur. Por exemplo, comparamos a placa Aβ de ligação por Cur, com outros corantes de ligação amilóide, como Thio-S, CR e FJC, onde o anticorpo específico de Aβ (6E10) foi usado como controle de referência. Estes resultados sugerem que cur rótulos placas Aβ mais fortemente do que qualquer um dos outros fluorofônicos. Mais importante ainda, em relação ao Cur, alguns dos fluorofos mais comumente usados têm desvantagens distintas em termos de rotulagem e imagem Aβ. Por exemplo, Thio-S pode produzir um fundo de distração, alta, porque se liga com membranas lipídicas ou compostos lipídicos na célula21. Da mesma forma, cr, que é comumente usado para rotular Aβ, produz maçã verde birefringence (Figura 4)um microscópio polarizado. Cr não rotula Aβ-placas tão facilmente como fazer Cur ou Thio-S, rotulando significativamente menos placas Aβ do que as detectadas pelo Cur7,22,23. Gutierrez et al. relataram que fjc, que pode ligar com Aβ e com neurônios degenerados, rótulos em uma freqüência mais baixa do que qualquer Cur ou Thio-S24. Estes resultados sugerem que estes marcadores clássicos comumente usados têm menos afinidade para a ligação às placas de Aβ do que Cur.
Além disso, a rotulagem de diferentes tipos de placa aβ (núcleo, neuritic, difuso, queimado- out) pode ser otimizada com Cur, ao invés de outros fluorofóforos de ligação amilóide, porque Cur pode ajudar a visualizar e distinguir morfologicamente diferentes placas Aβ, enquanto outras técnicas não conseguem distinguir esses subtipos morfológicos7. Da mesma forma, o uso de anticorpos específicos de Aβ, que são muito específicos para diferentes espécies de Aβ é muito caro e demorado, levando pelo menos 24 a 48h via imunohistoquímica. Além disso, a detecção de diferentes espécies de Aβ requer anticorpos diferentes, bem como vários produtos químicos acessórios, o que aumenta significativamente o custo total. Claramente, Cur é menos caro, mais facilmente disponível, e produz maior intensidade de fluorescência quando se liga a placas Aβ. Embora o CR também seja uma técnica relativamente econômica para rotulagem e imagem de placas Aβ, Cur pode ligar e rotular mais das espécies de Aβ, como oligomeros25 (Figura 3 e Figura 4),enquanto a CR só se liga a protofibrils e fibrilas23. Portanto, a rotulagem de Aβ com Cur pode ser alcançada de forma mais eficiente e econômica do que por Thio-S, CR ou FJC(Tabela 1).
Em resumo, Cur pode detectar placas e oligomeros Aβ do tecido cerebral da DA de forma eficaz, rápida e barata. Além disso, cur ligação para Aβ é muito específico e sua atividade fluorescente é muito estável. Requer quantidades mínimas (1-10 nM) para rotular Aβ. Além disso, Cur também é muito específico para diferentes espécies de Aβ, como fibrilas ou placas, bem como oligomeros7. Da mesma forma, os derivados cur demethoxycurcumin e bisdemethoxycurcumin também abrigam propriedades de ligação amilóide e c rótulo Aβ da mesma forma a Cur10 (Figura 5A). Portanto, Cur é um fluorofofóbico ideal para rotulagem e imagem de placas Aβ no tecido cerebral pós-morte. Ele pode ser usado como uma alternativa rápida e fácil para detectar a carga da placa Aβ após a terapia anti-amilóide em modelos animais experimentais de DA. Nossos resultados confirmam os relatórios da afinidade elevada de Cur a Aβ, reforçando seu uso potencial para monitorar Aβ-chapas no cérebro pós-morte e no tecido vivo.
Para rotulagem cur ideal é recomendado não rotular Aβ com Cur em tecido não permeado e evitar o armazenamento de tecido a longo prazo, pois pode produzir uma maior quantidade de fundo, mesmo quando perfundido. Para colabeling, recomenda-se para completar a imunohistoquímica primeiro com o anticorpo específico que está sendo usado antes de colorir com Cur e, em seguida, siga isso com contra-manchas usando DAPI ou Hoechst.
Possíveis modificações nesse método incluem o aumento do tempo de incubação do Cur com o tecido por até 30 min, o que não interferirá na intensidade do sinal, embora possa aumentar o contexto durante a imagem. A diminuição da concentração de Cur para menos de 10 μM não interfere na rotulagem de Aβ a um nível significativo. Para reduzir o fundo para o tecido cerebral humano, um método de preparação alternativo poderia ser aplicado. Por exemplo, as seções cerebrais poderiam ser inicialmente tratadas com 0,3% (w/v) Sudan Black B em 70% de etanol (v/v) por 10 min à temperatura ambiente. Em seguida, a seção poderia ser manchada com Cur por 10 min à temperatura ambiente, e lavado com PBS 3x por 15 min, counterstained, e montado com mídia anti-fading13. Espessuras da seção criostat também podem ser reduzidas para 20 a 25 μm.
As advertências potenciais a este método incluem o cur que liga com O aβ atual nos vasos sanguíneos, que é diferente das chapas extracelulares de Aβ. Assim, o investigador deve estar ciente da morfologia das placas e oligomeros Aβ de Aβ em vasos sanguíneos. O investigador deve estar ciente dos sinais autofluorescentes. O fundo verde adicional pode ser visto ocasionalmente após a coloração de Cur, mas isto pode ser reduzido diminuindo o tempo de mancha ou diminuindo a concentração de Cur. Finalmente, o sinal para colabeling com outros marcadores pode ser reduzido devido aos tratamentos repetidos com o agente de compensação (por exemplo, xileno).
Limitações importantes incluem a incapacidade de co-rotular com qualquer proteína marcadora usando anticorpo secundário marcado com corante fluorescente verde, como isotiocianato fluorescente (FITC). Estes não podem ser usados por causa da excitação/emissão similar de Cur. Além disso, nos estágios iniciais da DA, apenas quantidades limitadas de Aβ podem ser rotuladas pela Cur. Finalmente, há uma necessidade de fazer o trabalho no ambiente escuro como toda a tintura fluorescente.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
O apoio a este estudo veio do Instituto de Neurociências de Campo da Ascensão de Santa Maria.
Materiais
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole (DAPI) | IHC world, Woodstock, MD | ||
| Aanimal model of Alzheimer's disease | Jackson's laboratory, Bar Harbor, ME | ||
| Absolute alcohol | VWR,Radnor, PA | ||
| Alexa 594 | Santacruz Biotech, Dallas, TX | ||
| Antibody 6E10 | Biolegend, San Diego, CA | ||
| Antibody A11 | Millipore, Burlington, MA | ||
| Compound light microscope | Olympus, Shinjuku, Japan | Olympus BX51 | |
| Congo red | Sigma, St. Louis, MO | ||
| Cryostat | GMI, Ramsey, MN | LeicaCM1800 | |
| Curcumin | Sigma, St. Louis, MO | ||
| Disodium hydrogen phosphate | Sigma, St. Louis, MO | ||
| Dystyrene plasticizer xylene | BDH, Dawsonville, GA | ||
| Filter papers | Fisher scientific, Pittsburgh, PA | ||
| Hoechst-33342 | Sigma, St. Louis, MO | ||
| Inverted fluorescent microscope | Leica, Buffalo Grove, IL | Leica DMI 6000B | |
| Inverted fluorescent microscope | Olympus, Shinjuku, Japan | Olympus 1x70 | |
| Normal goat serum | Sigma, St. Louis, MO | ||
| Paraffin | Sigma, St. Louis, MO | ||
| Paraformaldehyde | Sigma, St. Louis, MO | ||
| Ploy-lysine coated charged glass slide | Globe Scientific Inc, Mahwah, NJ | ||
| Potassium chloride | Sigma, St. Louis, MO | ||
| Potassium dihydrogen phosphate | Sigma, St. Louis, MO | ||
| Sodium azide | Sigma, St. Louis, MO | ||
| Sodium chloride | Sigma, St. Louis, MO | ||
| Sodium hydroxide | EMD Millipore, Burlington, MA | ||
| Sodium pentobarbital | Vortex Pharmaceuticals limited, Dearborn, MI | ||
| Thioflavin-S | Sigma, St. Louis, MO | ||
| Triton-X-100 | Sigma, St. Louis, MO | ||
| Xylene | VWR,Radnor, PA |
Referências
- Cummings, J. L. Alzheimer's disease. New England Journal of Medicine. 351 (1), 56-67 (2004).
- Jack, C. R., Holtzman, D. M. Biomarker modeling of Alzheimer's disease. Neuron. 80 (6), 1347-1358 (2013).
- Tarawneh, R., Holtzman, D. M. The clinical problem of symptomatic Alzheimer disease and mild cognitive impairment. Cold Spring Harbor Perspectives in Medicine. 2 (5), (2012).
- Selkoe, D. J. Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature Cell Biology. 6 (11), 1054-1061 (2004).
- Hardy, J., Allsop, D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends in Pharmacological Sciences. 12 (10), 383-388 (1991).
- Chen, M., et al. Use of curcumin in diagnosis, prevention, and treatment of Alzheimer's disease. Neural Regeneration Research. 13 (4), 742-752 (2018).
- Maiti, P., et al. A comparative study of dietary curcumin, nanocurcumin, and other classical amyloid-binding dyes for labeling and imaging of amyloid plaques in brain tissue of 5x-familial Alzheimer's disease mice. Histochemistry and Cell Biology. 146 (5), 609-625 (2016).
- Maiti, P., Dunbar, G. L. Use of Curcumin, a Natural Polyphenol for Targeting Molecular Pathways in Treating Age-Related Neurodegenerative Diseases. International Journal of Molecular Sciences. 19 (6), (2017).
- Maiti, P., Dunbar, G. L. Comparative Neuroprotective Effects of Dietary Curcumin and Solid Lipid Curcumin Particles in Cultured Mouse Neuroblastoma Cells after Exposure to Abeta42. International Journal of Alzheimer's Disease. , (2017).
- den Haan, J., Morrema, T. H. J., Rozemuller, A. J., Bouwman, F. H., Hoozemans, J. J. M. Different curcumin forms selectively bind fibrillar amyloid beta in post mortem Alzheimer's disease brains: Implications for in-vivo diagnostics. Acta Neuropathologica Communications. 6 (1), 75(2018).
- Koronyo, Y., et al. Retinal amyloid pathology and proof-of-concept imaging trial in Alzheimer's disease. JCI Insight. 2 (16), (2017).
- Koronyo, Y., Salumbides, B. C., Black, K. L., Koronyo-Hamaoui, M. Alzheimer's disease in the retina: imaging retinal abeta plaques for early diagnosis and therapy assessment. Neurodegenerative Diseases. 10 (1-4), 285-293 (2012).
- Koronyo-Hamaoui, M., et al. Identification of amyloid plaques in retinas from Alzheimer's patients and noninvasive in vivo optical imaging of retinal plaques in a mouse model. NeuroImage. 54 (Suppl 1), S204-S217 (2011).
- Ran, C., et al. Design, synthesis, and testing of difluoroboron-derivatized curcumins as near-infrared probes for in vivo detection of amyloid-beta deposits. Journal of the American Chemical Society. 131 (42), 15257-15261 (2009).
- Beach, T. G. The Sun Health Research Institute Brain Donation Program: Description and Experience, 1987-2007. Cell Tissue Bank. 9 (3), 229-245 (2008).
- Green, S. J., Killiany, R. J. Subregions of the inferior parietal lobule are affected in the progression to AD. Neurobiology of Aging. 31 (8), 1304-1311 (2010).
- Ono, K., Hasegawa, K., Naiki, H., Yamada, M. Curcumin has potent anti-amyloidogenic effects for Alzheimer's beta-amyloid fibrils in vitro. Journal of Neuroscience Research. 75 (6), 742-750 (2004).
- Garcia-Alloza, M., Borrelli, L. A., Rozkalne, A., Hyman, B. T., Bacskai, B. J. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry. 102 (4), 1095-1104 (2007).
- Mutsuga, M., et al. Binding of curcumin to senile plaques and cerebral amyloid angiopathy in the aged brain of various animals and to neurofibrillary tangles in Alzheimer's brain. Journal of Veterinary Medical Science. 74 (1), 51-57 (2012).
- Tei, M., Uchida, K., Mutsuga, M., Chambers, J. K., Nakayama, H. The binding of curcumin to various types of canine amyloid proteins. Journal of Veterinary Medical Science. 74 (4), 481-483 (2012).
- Liu, L., Komatsu, H., Murray, I. V., Axelsen, P. H. Promotion of amyloid beta protein misfolding and fibrillogenesis by a lipid oxidation product. Journal of Molecular Biology. 377 (4), 1236-1250 (2008).
- Wu, C., Scott, J., Shea, J. E. Binding of Congo red to amyloid protofibrils of the Alzheimer Abeta(9-40) peptide probed by molecular dynamics simulations. Biophysical Journal. 103 (3), 550-557 (2012).
- Wu, C., Wang, Z., Lei, H., Zhang, W., Duan, Y. Dual binding modes of Congo red to amyloid protofibril surface observed in molecular dynamics simulations. Journal of the American Chemical Society. 129 (5), 1225-1232 (2007).
- Gutierrez, I. L., et al. Alternative Method to Detect Neuronal Degeneration and Amyloid beta Accumulation in Free-Floating Brain Sections With Fluoro-Jade. ASN Neuro Methods. 10, 1-7 (2018).
- Yang, F., et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo. Journal of Biological Chemistry. 280 (7), 5892-5901 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados