Method Article
使用天然多酚姜黄素对脑组织淀粉样斑块进行标记和成像
摘要
姜黄素是一种理想的荧光素,用于标记和成像脑组织中的淀粉样贝塔蛋白斑块,因为它优先结合淀粉样贝塔蛋白,并且与其他传统的淀粉样蛋白结合染料的结构相似。与传统方法相比,它可用于更高效、更廉价地标记和图像淀粉样β蛋白斑块。
摘要
淀粉样β蛋白(A+)在细胞外和细胞内空间沉积是阿尔茨海默氏病(AD)的显著疾病之一。因此,检测AD脑组织中A+的存在是开发新的治疗方法,防止AD进展的宝贵工具。几种经典的淀粉样结合染料、氟铬、成像探针和A+特异性抗体已用于检测AD脑组织中的A+组织。使用这些化合物进行A+检测既昂贵又耗时。然而,由于其强烈的荧光活性,高亲和力,和特殊性A+,以及结构相似性,传统的淀粉样结合染料,姜黄素(Cur)是一个有前途的候选标签和成像A+斑块在死后脑组织。它是来自草本姜黄龙的天然多酚。在本研究中,Cur在一分钟内从5倍家族性阿尔茨海默氏病(5xFAD)的遗传小鼠模型和人类AD组织中,用组织化学方式标记A+斑块。Cur 的标签能力与传统的淀粉样结合染料(如硫黄素-S(硫黄素-S)、刚果红 (CR) 和氟玉 C (FJC) 以及 A+ 特异性抗体 (6E10 和 A11)进行了比较。我们观察到,与这些传统染料相比,Cur 是最廉价、最快速的标记和图像 A+ 斑块的方法,与 A+ 特异性抗体相媲美。此外,Cur 与大多数 A+ 物种结合,如寡聚物和纤维蛋白。因此,Cur 可用作 A+ 斑块最经济、简单、快速的氟铬检测剂。
引言
阿尔茨海默氏病(AD)是最常见的、与年龄有关、渐进的神经系统疾病之一,也是全球1、2日死亡的主要原因之一。学习、记忆和认知障碍,以及神经精神障碍,是AD3中常见的症状。虽然AD的病因尚未完全阐明,但现有的遗传、生化和实验证据表明,A+的逐渐沉积是AD4的明确生物标志物。这种错误折叠的蛋白质积累在细胞内和细胞外空间,被认为是参与突触损失,增加神经炎症,和神经退化在受AD5影响的大脑的皮质和海马区域。因此,在AD组织中组织化学检测A+是开发无毒抗淀粉样药物以防止AD进展的关键的第一步。
在过去的几十年中,许多研究实验室使用几种染料和抗体来标记和图像脑组织中的 A+ 斑块,但其中一些方法耗时,使用的染料或抗体昂贵,需要多种附件化学品。因此,开发一种廉价的方法来检测AD大脑中的A+斑块将是一个受欢迎的新工具。许多实验室开始使用Cur,一种有前途的抗淀粉样天然多酚,用于标记和成像A+,以及AD6,7,8,9的治疗剂。其疏水性和嗜血性性质、与经典淀粉样结合染料的结构相似性、强大的荧光活性以及与 A+ 结合的强烈亲和力使其成为 AD 组织 10 中 A+ 斑块标记和成像的理想荧光素.Cur与A+斑块和寡聚物结合,其存在也在细胞内空间7,11,12,13中检测到。此外,已经表明,最小量(1⁄10 nM)的Cur可以标记A+斑块在5倍家族性阿尔茨海默氏病(5xFAD)脑组织7。虽然 1 nM 浓度不能为 A+ 斑块计数提供最佳荧光强度,但 Cur 的浓度为 10 nM 或更高。Ran和他的同事14日报告说,剂量低至0.2 nM的二氟龙衍生的Cur几乎可以检测体内A+沉积物和红外探头。此剂量是否足以标记组织中的 A+ 斑块仍不清楚。以前的大多数研究都使用 20-30 分钟使用 Cur 染色 A+ 斑块,但最佳染色可能需要的时间要少得多。
本研究旨在测试 Cur 在 AD 脑组织中标记 A+ 斑块所需的最短时间,并比较 5xFAD 小鼠在与其他常规小鼠染色后,在脑组织中标记和成像 A+ 斑块的灵敏度A+ 结合染料,如硫黄素-S(硫-S)、刚果红 (CR) 和氟-玉 C (FJC)。这些经典淀粉样结合染料的A+标记能力与5xFAD小鼠和年龄匹配的人类AD和控制脑组织的石蜡嵌入和冷冻冠状脑部分的Cur染色进行了比较。研究结果表明,Cur以类似于A+特异性抗体(6E10)的方式标记A+斑块,并比Thio-S、CR或FJC中更好。此外,当Cur到5xFAD小鼠的腹内注射被注射2~5天时,它越过了血脑屏障,并与A+斑块7结合。有趣的是,在5xFAD脑组织7,14中,纳米摩尔浓度已经被用来标记和图像A+斑块。此外,形态上截然不同的A+斑块,如核心、神经质、扩散和烧坏斑块,可以比任何其他传统的淀粉样结合染料7更高效地标记Cur。总体而言,Cur 可以以简单且廉价的方式应用于 AD 动物模型和/或人类 AD 组织死后脑组织中的 A+ 斑块的标签和图像,作为 A+ 特异性抗体的可靠替代品。
研究方案
这里描述的所有方法都已获得萨吉诺谷州立大学动物护理和使用委员会(ACUC)的批准。人体组织是从亚利桑那州班纳太阳健康研究所15、16日建立的脑库获得的。
1. 动物灌注
- 准备固定和灌注缓冲液。
- 通过加入 80 g 氯化钠 (NaCl)、2 g 氯化钾 (KCl)、21.7 g 磷酸氢钠 (Na2HPO4+7H2O)、2.59 克磷酸二氢钾(KH2PO 4)制备 0.1 M 磷酸钠缓冲液),和双蒸馏水共1升。
- 制备4%的甲醛(PFA)。
- 将40克甲醛加入1 L的PBS(0.1M,pH 7.4)。
- 将 PFA 溶液加热至 60~65 °C,并使用磁性搅拌器混合。
注:温度不应超过65°C。 - 加入几滴NaOH(1 N)与滴滴完全溶解PFA。
- 用中等到细滤纸过滤PFA溶液,并储存在4°C。
注:该解决方案适合一个月使用。
- 进行动物麻醉和灌注。
注:12个月大的B6SJL-Tg APP SwFlLon、PSEN1_M146L+L286V、1136799Vas/J(5°FAD)年龄匹配对照小鼠(n = 每组6只)从供应商处购买,并在萨吉诺谷州立大学的动物之家饲养。基因分型通过聚合酶链反应(PCR)确认,如前所述7。人类AD脑组织包括死后AD脑组织和年龄匹配的控制组织。- 用适当的麻醉剂麻醉动物,如五巴比妥钠(390毫克/千克体重),或氯胺酮/木氨酸混合物(高达80毫克/千克体重氯胺酮和10毫克/千克体重的木氨酸)通过腹内注射(27 G针和1mL 注射器)。通过捏脚趾检查麻醉水平。如果动物没有反应,那么它已经准备好进行灌注手术了。
- 将麻醉动物置于灌注手术托盘上的上部位置,并使用小虹膜剪刀对左心室的后端进行切口。
- 将 22 G 灌注针插入左心室,并在右腹膜处进行小切口,以去除体内的灌注液。使用重力灌注系统使冰冷的灌注液(0.1 M PBS,pH 7.4)流动5~6分钟(流速20~25ml/min)。
注:清晰的肝脏是最佳灌注的指标。 - 将缓冲阀切换到冰冷的 4% 甲醛溶液中进行固定,使其流动 8-10 分钟。
注: 震颤后硬化或僵硬的四肢是良好的固定指标。 - 用剪刀把大脑从头骨上取出来。使用铲子,收集大脑,并将其放入4%PFA(至少10倍于大脑体积)的瓶中,并储存在4°C,直到进一步使用。
2. 组织处理
- 切割低温部分。
- 将大脑转移到分级蔗糖溶液(10%、20%和30%)并储存在4°C,每次24小时,直到使用。
- 在-22°C下使用低温,切割40μm厚的部分。在充满PBS和钠的6个孔盘中,每口收集10~20节(0.02%)。
- 石蜡嵌入了小鼠和人类脑组织的部分。
- 对于石蜡部分,用分级酒精(50%、70%、90%)脱水渗透和24小时固定后脑组织每2小时,然后是100%酒精2倍,每次1小时),然后用二甲苯2x,每个1小时)在室温下。
- 在56°C下,在覆盖着铝箔的玻璃锥形烧瓶中,用二甲苯-石蜡(1:1)2倍2倍进入组织。
- 将组织浸入融化的石蜡(56°C)中4~6小时。
- 在室温下使用旋转微托体切割5μm厚的部分,并将其置于45°C的组织水浴中。
- 在化学上用 Cur 标记低温部分中的 A+ 斑块。
- 用 PBS (pH 7.4) 3x 冲洗步骤 2.1.2 中的部分,每次 5 分钟。
- 在室温下将部分浸入 70% 乙醇中 2 分钟。
- 将Cur(1 mM)溶解在甲醇中,用70%乙醇稀释,以获得10μM的最终工作浓度。
- 在室温下,在 150 rpm 的摇床上浸入工作 Cur 溶液的部分 1⁄5 分钟。
- 丢弃Cur溶液,用70%乙醇3倍清洗,每次2分钟。
- 将部分放在聚L-流因为层涂层玻璃玻片上,并使用有机安装介质(如脱苯增塑剂二甲苯(DPX))安装盖玻片。
- 使用 480/550 nm 激励/发射过滤器在荧光显微镜下查看。
- 在石蜡嵌入的小鼠和人类大脑部分用Cur标记A+斑块。
- 在室温下,用二甲苯2x将组织部分从步骤2.2.4中除化5分钟。
- 用分级酒精溶液(100%、80%、70%、50%各1分钟)和蒸馏水2次,每次在室温下5分钟补充水。
- 在黑暗中,在室温下,用 Cur (10 μM) 染色 10 分钟,在 150 rpm 时摇动。用70%、90%和100%酒精分别洗2分钟。
- 用二甲苯2x每片5分钟清除,用DPX盖滑。
- 如步骤 2.3.7 所述,在荧光显微镜下可视化。
- 在 A+ 斑块和寡聚物中与 A+ 抗体共同粘合 Cur。
- 在 12 孔板中用 PBS 3x 清洗步骤 2.1.2 中的低温部分。
- 用10%正常山羊血清(NGS)在PBS中溶解0.5%Triton-X-100,在室温下1小时。
- 丢弃阻塞解决方案。用A+特异性抗体(6E10或A11,稀释1:200)孵育在含有10%NGS和0.5%Triton-X100的新鲜阻断溶液中,在150rpm的摇摇器中过夜。
- 丢弃抗体溶液,用PBS 3x洗涤各10分钟。
- 在室内温度下用红色荧光素(例如 Alexa 594)孵育第二抗体标记 1 小时。
- 用PBS 3次清洗,每次10分钟。
- 用70%酒精洗1次。
- 在室温下用Cur(10 μM)孵育各部分5分钟。
- 用70%酒精洗涤3次,每次1分钟。
- 脱水90%和100%酒精各1分钟,用二甲苯2次,每次5分钟,并用DPX安装在幻灯片上。
- 使用荧光显微镜使用荧光显微镜进行可视化,该显微镜具有相应的红色和绿色信号激发/发射滤波器。
- 对于细胞内 A+ 共定位,使用 A+ 抗体 (6E10) 染色部分,在黑暗中与 Cur 一起染色,在 150 rpm 下摇动,并在室温下用 Hoechst-33342(1 mg/ml) 和/或 DAPI (1ug/ml) 进行 10 分钟的染色。在150 rpm下摇动的黑暗。用 PBS 3x 清洗。
- 使用 100 倍物镜(总放大倍数 1,000 倍)使用红色、绿色和蓝色滤镜拍摄图像。
- 使用 Thio-S、CR 和 FJC 标记 A+ 斑块。
注:Thio-S和CR标签的详细协议先前已报告7。- 对于 FJC 染色,用 PBS 3x 清洗从步骤 2.1.2 获得的游离部分,每次 5 分钟。
- 将部分放入 12 孔板中,用 FJC 染色 (0.001%)在室温下在黑暗中10分钟。
- 丢弃 FJC 溶液,用 PBS 3x 每洗涤 5 分钟。
- 在室温下用氯化铵(NH4Cl,50 mM溶解在PBS中)孵育10分钟。
- 丢弃 NH4Cl 溶液,用 PBS 3x 每块洗涤 5 分钟。
- 按照第 2.4 节中的步骤,使用 450/520 nm 激励/排放过滤器在荧光显微镜下用分级酒精溶液脱水、清除、安装和查看。
结果
姜黄素在一分钟内标记A+斑块。当我们用Cur染色5xFAD组织时,我们发现Cur标签A+斑块在1分钟内。虽然Cur的孵育时间略有增加A+斑块的荧光强度,但观察到的A+斑块数量在1分钟至5分钟的染色时间之间没有显著差异(图1)。
Cur 可以在冷冻制备的石蜡嵌入小鼠和人类 AD 组织中标记 A+ 斑块,与小鼠 AD 脑组织中 A+ 特异性抗体共同进行局部化。当我们染色低温节、石蜡嵌入部分(图2A)和人类AD组织(图2B)时,我们观察到所有类型的组织部分都有有Cur标记的A+斑块。此外,为了确认 Cur 与 A+ 斑块结合,我们首先将斑块标记为 6E10,然后标记 Cur 染色。我们观察到,Cur 与 A+ 完全结合在绑定 6E10 的相同斑块上(图 2C)。
Cur 标记 A+ 寡聚物和细胞内 A+ 聚合物。为了检查 Cur 是否可以标记 A+ 寡聚物,5xFAD 小鼠部分被 A+ 寡聚物特异性抗体 (A11) 染色,然后是 Cur 染色。我们观察到Cur与A11在A+斑块中共同就位(图3A)。同样,Cur还与细胞内空间中的6E10抗体共同位置(图3B),表明它可以标记细胞内A+。
Cur 标记 A+ 比经典淀粉样蛋白结合染料更突出。Cur 的 A+ 标签与市售淀粉样蛋白结合染料 Thio-S、CR、FJC 进行了比较。A+ 特异性抗体 6E10 用作标准控制。我们观察到Cur标记A+比传统的淀粉样蛋白结合染料更突出(图4)。
Cur 衍生物二甲氧西卡明 (BDMC) 和脱氧核糖核酸 (DMC) 也存在于姜黄提取物中,在 5xFAD 脑组织中标记与 Cur 相对的 A+ 斑块。另外两个主要组件,如BDMC和DMC,存在于姜黄提取物中。我们测试了这两种化合物是否也标记了类似于Cur的A+斑块。当5xFAD小鼠大脑部分沾染这些衍生物时,BDMC和DMC也标有A+斑块,平行Cur(图5A)。对不同的安装介质进行了研究,以检查与 Cur 染色后对 A+ 成像的干扰。荧光信号在水基和有机安装介质中均完好无损,如DPX(图5B)。在免疫荧光贴标后,用Cur染色A+斑块是适当的,然后用Hoechst 33342溶液(1毫克/毫升)或4μ,6-diamidino-2-phenylindole(DAPI,1μg/ml)进行反染色。固化染色后,免疫荧光信号和反染色强度保持不变(图5C)。

图1:姜黄素在一分钟内标记A+斑块。(A). 5xFAD 小鼠或人类控制和 AD 皮质组织的大脑部分被涂有 Cur (10 μM) 1⁄5 分钟,并计算可见斑块的数量。(B). 在 1 分钟到 5 分钟的染色次数之间,A+ 斑块计数的数量没有差异。数据表示为均值 = 均值 (SEM) 的标准误差。请点击此处查看此图的较大版本。
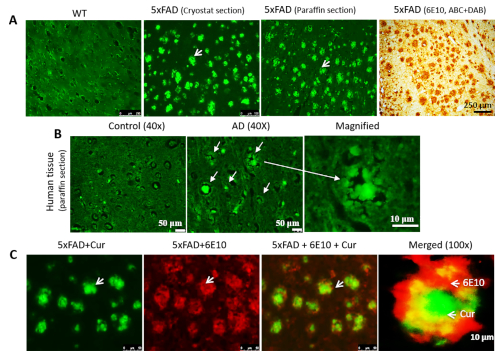
图2:在A+斑块中与A+抗体共定位。Cur 可以在冷冻制备的石蜡嵌入部分(A) 和人类 AD 组织 (B) 中标记 A+ 斑块。A+ 标签将标签与 A+ 特异性抗体(6E10,DAB 染色)平行。( C .5xFAD部分首先标有 A+ 抗体 (6E10),然后与 Cur 染色。红色 = 6E10 由标记为 Alexa 荧光团 594 的次级抗体绑定。绿色 = 曲线。在与 6E10 绑定的相同斑块上与 A+ 完全共定。箭头表示 A+ 斑块。比例尺指示左侧所有三个图像中的 50 μm(总放大倍数 = 400 倍),以及 10 μm(总放大倍数 = 400 倍)。请点击此处查看此图的较大版本。

图3:姜黄素标记A+寡聚物和细胞内A+。(A) 使用A+特异性抗体(A11)在化学上检测出A+-寡聚物,然后用Cur染色。在A11结合的同一寡头中,与A+完全结合。刻度条 = 250 μm,总放大倍数 = 100 倍。(B) 同样,使用A+特异性抗体(6E10)在免疫组织学上检测到细胞内A+,然后用Cur染色。请注意,Cur 完全与 A+ 在绑定到 6E10 的相同区域中共同本地化。刻度条 = 50 μm,总放大倍数 = 1,000 倍。请点击此处查看此图的较大版本。

图4:将不同淀粉样蛋白结合染料与Cur进行比较,以标记A+斑块。来自12个月大5xFAD小鼠皮层的冷冻部分(40μm)沾染了Cur、Thioflavin-S、刚果红、氟利昂玉C和6E10抗体。与 Thio-S、CR 和 FJC 相比,Cur 标记的 A+ 斑块更突出。箭头表示 A+ 斑块。请点击此处查看此图的较大版本。

图5:固化衍生物二氧化二氧基姜黄素和脱氧核糖核糖核糖类姜黄素也标注A+类似Cur。(A) 低温和石蜡嵌5xFAD部分都沾染了固化衍生物二氧化二氧基金和脱氧血素。这两种衍生物都以类似于 Cur 的方式标记 A+ 斑块。(B) 水基和有机安装介质 (DPX) 在用 Cur 标记 A+ 斑块后用于安装组织部分。(C) 免疫标记部分用于与 Cur 的 A+ 标签。白色箭头表示 A+ 斑块,绿色箭头表示激活的星形细胞 (GFAP),黄色箭头表示核污点 (DAPI)。比例尺 = 100 μm。请点击此处查看此图的较大版本。
| 特征 | A+ 抗体 | 姜黄素 | 蒂奥-S | 刚果红 | 氟-玉 C |
| 染色持续时间 | 约24-48小时 | ~1-5 分钟 | 约10分钟 | 约60分钟 | 约30分钟 |
| 配件化学品 | 二次抗体,几种化学物质使缓冲液,正常山羊血清 | 甲醇 | 乙醇 | NaOH 和乙醇 | 钠和乙醇,高锰酸钾 |
| 成本 | 昂贵:一个A+特异性抗体小瓶需要200-300美元 | 经济高效: ¥5-10/1 g Cur,可应用于许多组织 | 经济高效: ~5/1 g,可应用于少数组织 | 经济高效: >$5/1 g 刚果红,可应用于多个组织 | 昂贵: ¥15.500/1 g FJC 粉末 |
| 特 异性 | A+ 寡聚物和纤维蛋白需要不同的抗体 | 姜黄素与A+ 寡聚物和纤维结合 | 只能结合纤维,不能结合单体或寡聚物 | 只能与A+-原纤维和纤维结合16,17 | 只能与A+-纤维和退化神经元结合 |
| 稳定性 | 取决于附着在二次抗体上的染料 | 非常稳定,即使在室温下与 A# 绑定 | 甲醇稳定 | 乙醇稳定 | 不稳定 |
| 染色后护理 | 染色后需要格外小心,如一直被关在黑暗中,一直冷冻 | 在室温下,光敏性、稳定性也不稳定 | 光敏 | 不感光 | 光敏 |
| 需要显微镜 | 复合光或荧光(取决于二级抗体的使用) | 荧光 | 荧光 | 光学显微镜或偏振显微镜或偏振过滤器 | 荧光 |
| 背景染色 | 通常,没有背景 | 非常低的背景 | 与细胞中的脂质膜或脂质化合物结合导致背景高 | 低背景 | 高背景 |
| 体内A+成像 | 可能不适用 | 高度适用 | 可能不适用 | 可能不适用 | 可能不适用 |
表1:不同淀粉样蛋白结合染料和Cur 7的A+标签比较。
讨论
我们的假设是,与其他经典淀粉样结合染料以及 A+ 特异性抗体相比,Cur 可用作在死后 AD 脑组织中标记和图像 A+ 斑块的最快速、最简单和最便宜的方法。本研究的目的是确定Cur在死后AD脑组织中标记和图像A+斑块所需的最短时间,并确定Cur是否可以作为A+抗体的替代物来标记A+斑块。为此,在不同时间点观察到Cur的A+标记能力。Cur 能够在一分钟内将 A+ 贴上标签。此外,Cur 对 A+ 的标记大于其他常规淀粉样蛋白结合染料,如 Thio-S (0.1%)、CR (1%)和 FJC(0.001%)。
Cur被认为是A+标签中独特而理想的荧光,因为它具有大多数传统淀粉样结合染料所具备的大多数特性,包括结构、物理、化学和生物特性10。此外,由于经济性,大多数研究人员有兴趣使用这种天然多酚。为了显示 Cur 结合与 A+ 斑块和寡聚物的特异性,我们使用 6E10 和 A11(A+-寡聚物特异性抗体)。Cur显示几乎完全共定位与存在于组织中的所有不同物种的A+,这表明Cur是高度特异性的A+7,17,18,19,20。此外,Cur 标记的 A+ 寡聚物 (图 3A) 和细胞内 A+ 聚合物 (图 3B) 并与 A+ 抗体(图 2B)共同贴合,这表明 Cur 不仅可以标记细胞外A+斑块,但也A+沉积在细胞内空间7。
在过去的几十年中,已经开发出一些荧光和抗体来标记和形象A+斑块组织化。毫无疑问,它们大多非常具体地针对目标A+物种和检测A+斑块,但这些是更昂贵,他们的使用比使用Cur更耗时。例如,我们比较了 Cur 的 A+ 斑块结合与其他淀粉样结合染料(如 Thio-S、CR 和 FJC),其中 A+ 特异性抗体 (6E10) 用作参考对照。这些结果表明,Cur标签A+斑块比任何其他荧光草更强烈。最重要的是,与 Cur 相比,一些较常用的荧光荧光在标签和成像 A+ 方面有明显的缺点。例如,Thio-S可以产生一个分散注意力的高背景,因为它与细胞21中的脂膜或脂质化合物结合。同样,CR,通常用于标记A+,在偏振显微镜下产生苹果绿色双环(图4)。CR不像Cur或Thio-S那样容易标记A+斑块,其标签明显少于Cur7、22、23检测到的A+斑块。古铁雷斯等人报告说,FJC,它可以与A+和退化神经元结合,标签在较低的频率比Cur或Thio-S24。这些结果表明,这些常用的经典标记与Cur相比,对A+斑块的关联性较低。
此外,可以使用 Cur(而不是其他淀粉样结合荧光草)优化不同 A+ 斑块类型(核心、神经质、扩散、烧制)的标签,因为 Cur 可以帮助可视化和区分形态上不同的 A+ 斑块,而其他技术无法区分这些形态亚型7。同样,使用A+特异性抗体,这是非常特殊的A+物种是非常昂贵和耗时的,通过免疫组织化学至少需要24-48小时。此外,检测不同种类的A+需要不同的抗体,以及几种辅助化学品,这大大增加了总成本。显然,Cur 成本更低,更容易获得,并且当它与 A+ 斑块结合时会产生更高的荧光强度。虽然 CR 也是一种相对经济高效的 A+ 斑块标记和成像技术,但 Cur 可以结合和标记更多 A+ 物种,例如寡聚物25(图 3和图 4),而 CR 仅与原纤维蛋白和纤维23。因此,与 Thio-S、CR 或 FJC(表 1) 相比,使用 Cur 进行 A+ 标记可以更高效、更经济地实现。
总之,Cur 可以有效、快速、廉价地检测 AD 脑组织的 A+ 斑块和寡聚物。此外,Cur结合A+是非常具体的,其荧光活性是非常稳定的。它需要最少的量 (1-10 nM) 来标记 A+。此外,Cur也非常特定于不同的A+物种,如纤维或斑块,以及寡聚物7。同样,Cur 衍生物脱甲氧核糖核酸和二氧化二甲酸凝素也具有淀粉样蛋白结合特性和c标签A+类似Cur10(图5A)。因此,Cur 是一种理想的荧光荧光,用于对死后脑组织中的 A+ 斑块进行标记和成像。在AD实验动物模型中,抗淀粉样蛋白治疗后,可作为检测A+斑块负荷的快速简便替代物。我们的发现证实了Cur与A+的高亲和力的报告,加强了其在死后大脑和活组织中监测A+斑块的潜在用途。
为了获得最佳 Cur 标签,建议不要将 A+ 与 Cur 贴在未渗透的组织中,并避免长期组织存储,因为它可以产生更多的背景,即使注入。对于共同标记,建议在与 Cur 染色之前首先使用特定的抗体完成免疫组织化学,然后使用 DAPI 或 Hoechst 进行反染色。
对这种方法的可能修改包括将Cur与组织的孵育时间延长30分钟,这不会影响信号强度,尽管成像时可能会增加背景。将 Cur 的浓度降低到 10 μM 以下不会干扰 A+ 标签到显著水平。为了减少人类脑组织的背景,可以应用一种替代的制备方法。例如,在室温下,在70%乙醇(v/v)中,大脑部分最初可以用0.3%(w/v)苏丹黑B进行10分钟的治疗。然后,该部分可以在室温下用Cur染色10分钟,用PBS 3x洗涤15分钟,反污,并安装与防褪色介质13。冷冻截面厚度也可降至20~25微米。
此方法的潜在警告包括血管中存在的与 A+ 的 Cur 结合,这与细胞外 A+ 斑块不同。因此,研究者应该了解血管中A+斑块和寡聚物的形态。调查人员应注意自动荧光信号。在 Cur 染色后偶尔可以看到多余的绿色背景,但可以通过减少染色时间或降低 Cur 的浓度来减少这种背景。最后,由于使用清除剂(例如二甲苯)反复处理,与其他标记进行共标记的信号可能会减少。
重要的限制包括无法使用标有绿色荧光染料标记的二级抗体(如荧光等同酸酯 (FITC))与任何标记蛋白进行联合标记。由于 Cur 的类似激发/发射,因此无法使用。此外,在 AD 的早期阶段,只有有限数量的 A+ 可以由 Cur 标记。最后,有必要像任何荧光染料一样在黑暗的环境中工作。
披露声明
作者没有什么可透露的。
致谢
这项研究的支持来自圣玛丽阿森松的菲尔德神经科学研究所。
材料
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole (DAPI) | IHC world, Woodstock, MD | ||
| Aanimal model of Alzheimer's disease | Jackson's laboratory, Bar Harbor, ME | ||
| Absolute alcohol | VWR,Radnor, PA | ||
| Alexa 594 | Santacruz Biotech, Dallas, TX | ||
| Antibody 6E10 | Biolegend, San Diego, CA | ||
| Antibody A11 | Millipore, Burlington, MA | ||
| Compound light microscope | Olympus, Shinjuku, Japan | Olympus BX51 | |
| Congo red | Sigma, St. Louis, MO | ||
| Cryostat | GMI, Ramsey, MN | LeicaCM1800 | |
| Curcumin | Sigma, St. Louis, MO | ||
| Disodium hydrogen phosphate | Sigma, St. Louis, MO | ||
| Dystyrene plasticizer xylene | BDH, Dawsonville, GA | ||
| Filter papers | Fisher scientific, Pittsburgh, PA | ||
| Hoechst-33342 | Sigma, St. Louis, MO | ||
| Inverted fluorescent microscope | Leica, Buffalo Grove, IL | Leica DMI 6000B | |
| Inverted fluorescent microscope | Olympus, Shinjuku, Japan | Olympus 1x70 | |
| Normal goat serum | Sigma, St. Louis, MO | ||
| Paraffin | Sigma, St. Louis, MO | ||
| Paraformaldehyde | Sigma, St. Louis, MO | ||
| Ploy-lysine coated charged glass slide | Globe Scientific Inc, Mahwah, NJ | ||
| Potassium chloride | Sigma, St. Louis, MO | ||
| Potassium dihydrogen phosphate | Sigma, St. Louis, MO | ||
| Sodium azide | Sigma, St. Louis, MO | ||
| Sodium chloride | Sigma, St. Louis, MO | ||
| Sodium hydroxide | EMD Millipore, Burlington, MA | ||
| Sodium pentobarbital | Vortex Pharmaceuticals limited, Dearborn, MI | ||
| Thioflavin-S | Sigma, St. Louis, MO | ||
| Triton-X-100 | Sigma, St. Louis, MO | ||
| Xylene | VWR,Radnor, PA |
参考文献
- Cummings, J. L. Alzheimer's disease. New England Journal of Medicine. 351 (1), 56-67 (2004).
- Jack, C. R., Holtzman, D. M. Biomarker modeling of Alzheimer's disease. Neuron. 80 (6), 1347-1358 (2013).
- Tarawneh, R., Holtzman, D. M. The clinical problem of symptomatic Alzheimer disease and mild cognitive impairment. Cold Spring Harbor Perspectives in Medicine. 2 (5), (2012).
- Selkoe, D. J. Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature Cell Biology. 6 (11), 1054-1061 (2004).
- Hardy, J., Allsop, D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends in Pharmacological Sciences. 12 (10), 383-388 (1991).
- Chen, M., et al. Use of curcumin in diagnosis, prevention, and treatment of Alzheimer's disease. Neural Regeneration Research. 13 (4), 742-752 (2018).
- Maiti, P., et al. A comparative study of dietary curcumin, nanocurcumin, and other classical amyloid-binding dyes for labeling and imaging of amyloid plaques in brain tissue of 5x-familial Alzheimer's disease mice. Histochemistry and Cell Biology. 146 (5), 609-625 (2016).
- Maiti, P., Dunbar, G. L. Use of Curcumin, a Natural Polyphenol for Targeting Molecular Pathways in Treating Age-Related Neurodegenerative Diseases. International Journal of Molecular Sciences. 19 (6), (2017).
- Maiti, P., Dunbar, G. L. Comparative Neuroprotective Effects of Dietary Curcumin and Solid Lipid Curcumin Particles in Cultured Mouse Neuroblastoma Cells after Exposure to Abeta42. International Journal of Alzheimer's Disease. , (2017).
- den Haan, J., Morrema, T. H. J., Rozemuller, A. J., Bouwman, F. H., Hoozemans, J. J. M. Different curcumin forms selectively bind fibrillar amyloid beta in post mortem Alzheimer's disease brains: Implications for in-vivo diagnostics. Acta Neuropathologica Communications. 6 (1), 75(2018).
- Koronyo, Y., et al. Retinal amyloid pathology and proof-of-concept imaging trial in Alzheimer's disease. JCI Insight. 2 (16), (2017).
- Koronyo, Y., Salumbides, B. C., Black, K. L., Koronyo-Hamaoui, M. Alzheimer's disease in the retina: imaging retinal abeta plaques for early diagnosis and therapy assessment. Neurodegenerative Diseases. 10 (1-4), 285-293 (2012).
- Koronyo-Hamaoui, M., et al. Identification of amyloid plaques in retinas from Alzheimer's patients and noninvasive in vivo optical imaging of retinal plaques in a mouse model. NeuroImage. 54 (Suppl 1), S204-S217 (2011).
- Ran, C., et al. Design, synthesis, and testing of difluoroboron-derivatized curcumins as near-infrared probes for in vivo detection of amyloid-beta deposits. Journal of the American Chemical Society. 131 (42), 15257-15261 (2009).
- Beach, T. G. The Sun Health Research Institute Brain Donation Program: Description and Experience, 1987-2007. Cell Tissue Bank. 9 (3), 229-245 (2008).
- Green, S. J., Killiany, R. J. Subregions of the inferior parietal lobule are affected in the progression to AD. Neurobiology of Aging. 31 (8), 1304-1311 (2010).
- Ono, K., Hasegawa, K., Naiki, H., Yamada, M. Curcumin has potent anti-amyloidogenic effects for Alzheimer's beta-amyloid fibrils in vitro. Journal of Neuroscience Research. 75 (6), 742-750 (2004).
- Garcia-Alloza, M., Borrelli, L. A., Rozkalne, A., Hyman, B. T., Bacskai, B. J. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry. 102 (4), 1095-1104 (2007).
- Mutsuga, M., et al. Binding of curcumin to senile plaques and cerebral amyloid angiopathy in the aged brain of various animals and to neurofibrillary tangles in Alzheimer's brain. Journal of Veterinary Medical Science. 74 (1), 51-57 (2012).
- Tei, M., Uchida, K., Mutsuga, M., Chambers, J. K., Nakayama, H. The binding of curcumin to various types of canine amyloid proteins. Journal of Veterinary Medical Science. 74 (4), 481-483 (2012).
- Liu, L., Komatsu, H., Murray, I. V., Axelsen, P. H. Promotion of amyloid beta protein misfolding and fibrillogenesis by a lipid oxidation product. Journal of Molecular Biology. 377 (4), 1236-1250 (2008).
- Wu, C., Scott, J., Shea, J. E. Binding of Congo red to amyloid protofibrils of the Alzheimer Abeta(9-40) peptide probed by molecular dynamics simulations. Biophysical Journal. 103 (3), 550-557 (2012).
- Wu, C., Wang, Z., Lei, H., Zhang, W., Duan, Y. Dual binding modes of Congo red to amyloid protofibril surface observed in molecular dynamics simulations. Journal of the American Chemical Society. 129 (5), 1225-1232 (2007).
- Gutierrez, I. L., et al. Alternative Method to Detect Neuronal Degeneration and Amyloid beta Accumulation in Free-Floating Brain Sections With Fluoro-Jade. ASN Neuro Methods. 10, 1-7 (2018).
- Yang, F., et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo. Journal of Biological Chemistry. 280 (7), 5892-5901 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。