Method Article
天然ポリフェノールクルクミンを用いた脳組織におけるアミロイドプラークの標識とイメージング
要約
クルクミンは、アミロイドベータタンパク質への優先結合、ならびに他の伝統的なアミロイド結合色素との構造的類似性に起因する脳組織におけるアミロイドベータタンパク質プラークの標識およびイメージングのための理想的な蛍光色素である。これは、従来の方法よりも効率的かつ安価にアミロイドベータタンパク質プラークをラベル付けし、画像化するために使用することができます。
要約
細胞外および細胞内空間におけるアミロイドβタンパク質(Aβ)の沈着は、アルツハイマー病(AD)の顕著な病理の一つである。したがって、AD脳組織におけるAβの存在の検出は、ADの進行を防止するための新しい治療法を開発するための貴重なツールである。いくつかの古典的なアミロイド結合色素、フルオロクロム、イメージングプローブ、およびAβ特異的抗体がAD脳組織においてAβ組織化学的に検出するために使用されている。Aβ検出のためのこれらの化合物の使用は、コストと時間がかかります。しかし、その強烈な蛍光活性、高親和性、およびAβの特異性、ならびに従来のアミロイド結合色素との構造的類似性のために、クルクミン(Cur)は死後のAβプラークの標識およびイメージングのための有望な候補である脳組織。ハーブクルクマロンガから天然ポリフェノールです。本研究では、Curは、5x家族性アルツハイマー病(5xFAD)の遺伝的マウスモデルと1分以内にヒトAD組織の両方からAβプラークを組織化学的に標識するために使用された。Curの標識能力は、チオフラビン-S(チオ-S)、コンゴレッド(CR)、フルオロジェイドC(FJC)、ならびにAβ特異的抗体(6E10およびA11)などの従来のアミロイド結合色素と比較した。Curは、これらの従来の染料と比較して、Aβプラークを標識および画像化する最も安価で迅速な方法であり、Aβ特異的抗体に匹敵することを観察しました。さらに、CurはオリゴマーやフィブリルなどのほとんどのAβ種と結合する。したがって、Curは、Aβプラークの最も費用対効果が高く、シンプルで迅速なフルオロクロム検出剤として使用することができる。
概要
アルツハイマー病(AD)は、最も一般的な、年齢関連、進行性神経疾患の一つであり、世界的に死亡の主要な原因の一つである1、2。学習、記憶、認知障害は、神経精神障害と共に、AD3に現れる一般的な症状である。ADの病因は完全には解明されていないが、利用可能な遺伝的、生化学的、および実験的証拠は、Aβの段階的な沈着がAD4の決定的なバイオマーカーであることを示す。この誤った折り畳まれたタンパク質は、細胞内および細胞外空間に蓄積し、AD5の影響を受ける脳の皮質および海馬領域におけるシナプス損失、神経炎症の増加、および神経変性に関与すると考えられている。したがって、AD組織におけるAβの組織化学的検出は、ADの進行を防ぐために非毒性、抗アミロイド薬を開発する上で重要な第一歩である。
過去数十年の間に、いくつかの染料および抗体は、脳組織のAβプラークを標識および画像化するために多くの研究所で使用されてきましたが、これらの方法のいくつかは時間がかかり、使用される染料や抗体は高価であり、いくつかの付属品を必要とします化学 物質。したがって、AD脳におけるAβプラークの検出の安価な手段の開発は、歓迎される新しいツールであろう。多くの研究室は、Aβの標識およびイメージングのための有望な抗アミロイド天然ポリフェノールであるCur、ならびにAD6、7、8、9の治療薬を使用し始めました。その疎水性と好中性、古典的なアミロイド結合色素との構造的な類似性、強い蛍光活性、ならびにAβと結合する強い親和性は、AD組織10におけるAβプラークの標識およびイメージングのための理想的な蛍光色素を作る.CurはAβプラークおよびオリゴマーと結合し、その存在はまた、細胞内空間7、11、12、13においても検出される。さらに、Curの最小量(1−10nM)は、5x家族性アルツハイマー病(5xFAD)脳組織7においてAβプラークを標識できることが示されている。1nM濃度はAβプラークの計数に最適な蛍光強度を提供しないが、Curの10nM以上の濃度を有する。ランと同僚14は、ジフルオロボロン誘導体化Curの0.2 nMの低用量が、赤外線プローブとほぼ同様に生体内のAβ沈着物を検出できることを報告した。この用量が組織中のAβプラークを標識するのに十分であるかどうかはまだ明らかではない。これまでの研究のほとんどは、Curを使用してAβプラークを染色するために20−30分を使用していますが、最適な染色は、はるかに少ない時間を必要とするかもしれません。
本研究は、CURがAD脳組織のAβプラークにラベルを付け、他の従来のCurで染色した後の5xFADマウスからの脳組織におけるAβプラークの標識およびイメージングに対する感受性を比較するために必要な最小時間をテストすることを目的とした。チオフラビン-S(チオ-S)、コンゴ赤(CR)、フルオロジェイドC(FJC)などのAβ結合性染料。これらの古典的なアミロイド結合色素のAβ標識能力は、5xFADマウスおよび老化一致したヒトADおよび制御脳組織からのパラフィン埋め込みおよび凍結石コロナ脳切片における硬化染色と比較された。この知見は、CurがAβ特異的抗体(6E10)と同様の方法でAβプラークを標識し、チオS、CR、またはFJCよりも適度に優れていることを示唆している。また、5xFADマウスに対する心腹腔内注射を2〜5日間投与した場合、血液脳関門を通過し、Aβプラーク7と結合した。興味深いことに、Curのナノモル濃度は、5xFAD脳組織7、14におけるAβプラークの標識および画像に使用されている。さらに、形態学的に異なるAβプラークは、コア、神経学的、拡散、および焼失したプラークを、他の従来のアミロイド結合色素7のいずれよりも効率的にCurによって標識することができる。全体的に、Curは、Aβ特異的抗体に対する信頼性の高い代替として、AD動物モデルおよび/またはヒトAD組織からの死後脳組織における標識および画像Aβプラークに容易かつ安価な方法で適用することができる。
プロトコル
ここで説明するすべての方法は、サギノーバレー州立大学の動物ケアと使用委員会(ACUC)によって承認されています.ヒト組織は、アリゾナ州のバナーサンヘルス研究所で確立された脳バンクから得られた15,16.
1. 動物の灌流
- 固定バッファーと灌流バッファーを準備します。
- 0.1 M 塩化ナトリウム(NaCl)、塩化カリウム2g(KCl)、21.7gのリン酸水素二ナトリウム(Na2HPO 4・7H2O)、2.59gのリン酸二水素カリウム(KH2PO44)を加えて調製)、及び二重蒸留水を合計1Lにする。
- 4%パラホルムアルデヒド(PFA)を調製する。
- PBSの1L(0.1M、pH7.4)に40gのパラホルムアルデヒドを加えます。
- PFA溶液を60−65°Cに加熱し、磁気攪拌機を使用して混合します。
注:温度は65°Cを超えるべきではありません。 - PFAを完全に溶解するためにスポイトでNaOH(1 N)の数滴を追加します。
- PFA溶液を中から微細な濾紙でろ過し、4°Cで保存します。
注:解決策は1ヶ月間良いです。
- 動物性麻酔と灌流を行います。
注:12ヶ月のB6SJL-Tg APP SwFlLon、PSEN1*M146L*L286V、1136799Vas/J(5×FAD)年齢一致対照マウス(グループあたりn =6)はベンダーから購入され、サギノーバレー州立大学の動物の家で飼育されました。ジェノタイピングは、先に説明したようにポリメラーゼ連鎖反応(PCR)により確認した。ヒトAD脳組織は、死後AD脳組織および年齢一致対照組織を含む。- 腹腔内注射(27G針と1本)によるペントバルビタールナトリウム(体重390mg/kg)、ケタミン/キシラジン混合物(最大80mg/kg体重ケタミンおよび10mg/kg体重キシラジン)などの適切な麻酔薬で動物を麻酔するmLシリンジ)。つま先をつまんで麻酔のレベルを確認してください。動物が応答しない場合は、灌流手術の準備ができています。
- 麻酔をかけられた動物を灌流手術用トレイの上の上の上の上の上の位置に置き、小さい虹彩はさみを使用して、左心室の後部端に切開を行う。
- 22 Gの灌流針を左心室に挿入し、右耳介で小さな切開を行い、体外液から灌流液を除去する。重力供給灌流システムを使用して、氷冷灌流流体(0.1 M PBS、pH 7.4)を5~6分間流れるようにします(流量20−25 ml/分)。
注:明確な肝臓は、最適な灌流の指標です。 - バッファーバルブを固定用の氷冷4%パラホルムアルデヒド溶液に切り替え、8~10分間流れるようにします。
メモ:トレモルの後に硬化または硬い手足が良好な固定の指標です。 - はさみを使って頭蓋骨から脳を取り除く。へらを使用して、脳を収集し、4%PFA(脳容積の少なくとも10倍の体積)のバイアルに置き、さらに使用するまで4°Cで保存します。
2. 組織処理
- クライオスタットセクションをカットします。
- グレードのスクロース溶液(10%、20%、30%)に脳を転送使用するまで、それぞれ24時間4°Cで保管してください。
- -22°Cでクライオスタットを使用し、厚さ40μmの切片をカットします。PBSとアジ化ナトリウム(0.02%)で満たされた6ウェルプレートでウェルあたり10−20セクションを収集します。
- パラフィンは、マウスとヒトの脳組織のセクションを埋め込みます。
- パラフィン切片の場合、等級アルコールで浸透した24時間後の脳組織(50%、70%、90%)を脱水するそれぞれ2時間、次いで100%アルコール2xをそれぞれ1時間)、次いで室温でキシレン2xをそれぞれ1時間ずつ使用した。
- アルミニウム箔で覆われたガラスコニカルフラスコで、キシレンパラフィン(1:1)2xで組織を56°Cで1時間浸透させます。
- 溶かしたパラフィン(56°C)に4−6時間浸漬する。
- 室温でロータリーミクロトームを使用して厚さ5μmの切片をカットし、45°Cのティッシュウォーターバスに入れます。
- ヒスト化学的にキュリオスタットセクションのAβプラークにCurでラベルを付けます。
- ステップ 2.1.2 のセクションを PBS (pH 7.4) 3x でそれぞれ 5 分間すすいでください。
- 溶液を70%エタノールに浸し、室温で2分間浸漬する。
- ストックキュア(1mM)をメタノールに溶解し、70%エタノールで希釈し、最終作業濃度10μMを得た。
- 150 rpmのシェーカーの室温で1-5分間、作業用Cur溶液でセクションを浸します。
- 硬化液を廃棄し、70%エタノール3xでそれぞれ2分間洗浄する。
- ポリL-リジンコーティングガラススライドのセクションを置き、ディスティン可塑剤キシレン(DPX)などの有機取り付け媒体を使用してカバースリップでマウントします。
- 480/550 nm励起/発光フィルターを使用して蛍光顕微鏡で表示します。
- ヒスト化学的にパラフィン埋め込みマウスとヒト脳切片のAβプラークにCurでラベルを付ける。
- ステップ2.2.4から組織切片を室温でそれぞれ5分間キシレン2xで脱パラフィン化する。
- 等級アルコール溶液(100%、80%、70%、50%それぞれ1分間)と蒸留水2xを室温でそれぞれ5分間で補温します。
- 暗闇の中で室温で10分間硬化(10μM)で切り分け、150rpmで振る。70%、90%、100%のアルコールをそれぞれ2分間洗浄します。
- それぞれ5分間キシレン2xでクリアし、DPXでスリップをカバーします。
- ステップ2.3.7で述べたように蛍光顕微鏡で可視化します。
- Aβプラークおよびオリゴマー中のAβ抗体を用いてCurをコローカライズする。
- 12ウェルプレートにPBS 3xでステップ2.1.2からクライオスタットセクションを洗浄します。
- 1時間室温で0.5%トリトンX-100でPBSに溶解した10%の正常ヤギ血清(NGS)で切片をブロックします。
- ブロッキング ソリューションを破棄します。Aβ特異的抗体(6E10またはA11、希釈1:200)で切片をインキュベートし、10%NGSおよび0.5%Triton-X100を含む新鮮なブロッキング溶液に溶解し、150rpmでシェーカーで4°Cで一晩。
- 抗体溶液を廃棄し、各10分間PBS 3xで切片を洗浄します。
- 赤色蛍光体(例えば、Alexa 594)を有する二次抗体タグを有する二次抗体タグを有するインキュベートを、暗闇の中の室温で1時間行う。
- それぞれ10分間PBS 3xで洗浄します。
- 70%アルコール1xで洗浄します。
- 室温で5分間、Cur(10μM)でセクションをインキュベートします。
- 70%アルコール3xでそれぞれ1分間洗浄する。
- それぞれ1分間90%と100%のアルコールで脱水し、それぞれ5分間キシレン2xでクリアし、DPXを使用してスライドにマウントします。
- 赤と緑の信号に適した励起/発光フィルタを使用して蛍光顕微鏡を使用して視覚化します。
- 細胞内Aβ共振の場合、Aβ抗体(6E10)を用いて切片を染色し、暗闇の室温で150rpmで振りながらCurで再染色し、Hoechst-33342(1mg/ml)および/またはDAPI(1ug/ml)のいずれかで室温で10分間のカウンターステイン150のrpmで揺れながら暗闇。PBS 3xで洗浄します。
- 赤、緑、青のフィルターを 100 倍の目標 (合計倍率 1,000x) で画像を撮影します。
- チオS、CR、およびFJCでAβプラークにラベルを付けます。
注:Thio-SおよびCRラベリングの詳細なプロトコルは、以前に7を報告しました。- FJC染色の場合は、ステップ2.1.2から得られたフリーフローティングセクションをPBS 3xでそれぞれ5分間洗浄します。
- セクションを12ウェルプレートに入れ、FJCで染色します(0.001%)室温で暗闇の中で10分間。
- FJC溶液を廃棄し、それぞれ5分間PBS 3xで洗浄します。
- 塩化アンモニウム(NH4Cl、PBSに溶解50mM)で室温で10分間インキュベートする。
- NH4Cl溶液を捨て、それぞれ5分間PBS 3xで洗浄します。
- セクション2.4のステップに従って、450/520 nm励起/発光フィルタを使用して、等級アルコール溶液で脱水、クリア、マウント、および蛍光顕微鏡下で表示します。
結果
クルクミンは1分以内にAβプラークをラベル付けします。5xFAD組織をCurで染色したところ、1分以内にCur標識Aβプラークが見つかった。Curによるインキュベーション時間の増加はAβプラークの蛍光強度をわずかに増加させるが、観察されたAβプラークの数は1分と5分の染色時間の間で有意に異なっていなかった(図1)。
Curは、マウスAD脳組織におけるAβ特異的抗体と共在化するクライオスタット調製マウスおよびパラフィン埋め込みマウスおよびヒトAD組織においてAβプラークを標識することができる。凍結切片、パラフィン埋め込み切片(図2A)およびヒトAD組織(図2B)を染色した場合、全てのタイプの組織切片でCur標識Aβプラークを観察した。さらに、CurがAβプラークに結合していることを確認するために、まずプラークに6E10で標識し、次に硬化染色を行いました。私たちは、Curが6E10を結合した同じプラークでAβと完全に共在化していることを観察しました(図2C)。
硬化標識Aβオリゴマーおよび細胞内Aβ凝集体。CurがAβオリゴマーに標識できるかどうかを確認するために、5xFADマウス切片をAβオリゴマー特異的抗体(A11)で染色し、続いて硬化染色を行った。Aβプラーク中のA11と共在化したCurが認められた(図3A)。同様に、Curはまた、細胞内空間における6E10抗体と共在化し(図3B)、細胞内Aβに標識できることを示す。
古典的なアミロイド結合色素よりも顕著にAβを標識したカール。CurによるAβ標識は、市販のアミロイド結合染料チオ-S、CR、FJCと比較した。Aβ特異的抗体6E10を標準制御として用った。Curが従来のアミロイド結合色素よりも顕著にAβとラベル付けされたことを観察した(図4)。
Cur誘導体ビスデメトキシクルクミン(BDMC)およびデメトキシクルクミン(DMC)もウコン抽出物中に存在し、5xFAD脳組織におけるCurに対して比較的Aβプラークを標識する。BDMCおよびDMCのような他の2つの主要な成分は、ウコン抽出物中に存在する。これら2つの化合物もCurに似たAβプラークを標識するかどうかを試験した。5xFADマウス脳切片がこれらの誘導体で染色されたとき、BDMCとDMCの両方がAβプラークにも標識し、Curを並列化する(図5A)。異なる取り付け媒体を調べ、Curで染色した後にAβイメージングとの干渉をチェックした。蛍光信号は、DPXなどの水性および有機取り付け媒体の両方でそのままであった(図5B)。CurによるAβプラークの染色は、免疫蛍光標識後に適切であり、その後、Hoechst 33342溶液(1mg/ml)または4′、6-ジアミディノ-2-フェニルリンドール(DAPI、1μg/ml)で対染色した。免疫蛍光シグナルと反染色強度は、硬化後も維持した(図5C)。

図1:クルクミンは1分以内にAβプラークにラベルを付けます。(A).5xFADマウスまたはヒト対照およびAD皮質組織からの脳切片を1−5分間Cur(10μM)で染色し、目に見えるプラークの数をカウントした。(B).1分と5分の染色時間とのAβプラーク数に差は認められなかった。データは平均±平均の標準誤差(SEM)として表される。この図の大きなバージョンを表示するには、ここをクリックしてください。
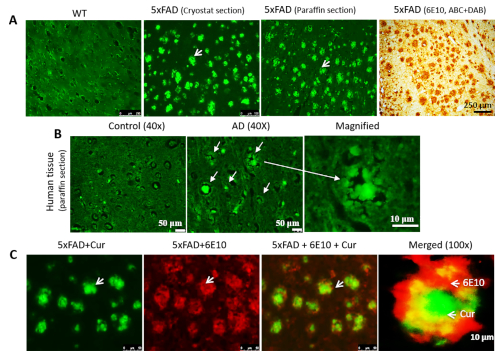
図2:Aβプラーク中のAβ抗体とのCurの共存Curは、クライオスタット調製、パラフィン埋め込み切片(A)およびヒトAD組織(B)でAβプラークを標識することができる。Aβ標識をAβ特異的抗体(6E10、DAB染色)と平行した標識。(C).5xFAD切片を最初にAβ抗体(6E10)で標識し、次いでCurによる染色を行った。赤=6E10は、Alexaフルオロフォア594でタグ付けされた二次抗体によって結合した。緑 = Cur。6E10に結合した同じプラークでAβと完全に共在化したcur。矢印はAβプラークを示す。スケール バーは、左側の 3 つのイメージすべてで 50 μm (合計倍率 = 400x) を示し、10 μm (合計倍率 = 400x) を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:クルクミン標識Aβオリゴマーおよび細胞内Aβ。(A)Aβオリゴマーは、Aβ特異的抗体(A11)を用いて免疫ヒスト化学的に検出し、続いてCurによる染色を行った。Aβと完全に共在化したcurは、A11が結合するのと同じオリゴマーで行う。スケール バー = 250 μm、合計倍率 = 100x。(B)同様に、細胞内Aβは、Aβ特異的抗体(6E10)を用いて免疫組織化学的に検出し、続いてCurによる染色を行った。なお、Curは6E10に結合した同じ領域のAβと完全に共在化した。スケール バー = 50 μm、合計倍率 = 1,000x。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:Aβプラークに標識するCurとの異なるアミロイド結合染料の比較。生後12ヶ月の5xFADマウスの皮質からクライオスタット切片(40μm)を、Cur、チオフラビン-S、コンゴレッド、フルオロジェイドC、および6E10抗体で染色した。チオS、CR、およびFJCよりも顕著に標識されたAβプラークを硬化する。矢印はAβプラークを示す。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:キュア誘導体ビスデメトキシクルクミンおよびデメトキシクルクミンも、Curと同様にAβの標識を示す。(A)クライオスタットおよびパラフィン埋め込み5xFAD切片の両方を、Cur誘導体ビスデメトキシクルクミンおよびデメトキシクルクミンで染色した。これらの誘導体はいずれもCurと同様の方法でAβプラークを標識する。(B)水性および有機取り付け媒体(DPX)の両方を使用して、CurでAβプラークを標識した後に組織切片を取り付けた。(C)免疫標識切片は、Curを用いたAβ標識に用いた。白い矢印はAβプラークを示し、緑色の矢印は活性化アストロサイト(GFAP)を示し、黄色の矢印は核染色(DAPI)を示す。スケールバー = 100μm.ここをクリックすると、この図の大きなバージョンが表示されます。
| 機能 | Aβ抗体 | クルクミン | チオ-S | コンゴ赤 | フルオロジェイドC |
| 染色の持続時間 | ~24-48時間 | ~1~5分 | ~10 分 | ~60分 | ~30分 |
| アクセサリー化学品 | 二次抗体、緩衝液を作るいくつかの化学物質、正常なヤギ血清 | メタノール | エタノール | NaOHとエタノール | NaOHとエタノール、過マンガン酸カリウム |
| コスト | 高価:1つのAβ特異的抗体バイアルは~$200-300を必要とします | 費用対効果:〜$5-10/1 gのCurと多くの組織に適用することができます | 費用対効果:~$5/1 g、少数の組織に適用可能 | 費用対効果: >$5/1 g コンゴ赤, そして、いくつかの組織に適用することができます | 高価: ~$15.500/1 g FJCパウダー |
| 特異 性 | Aβオリゴマーとフィブリルには異なる抗体が必要 | クルクミンは、Aβオリゴマーおよびフィブリルと結合する | フィブリルのみ結合でき、モノマーやオリゴマーは結合できない | Aβプロトフィブリルおよびフィブリルとの結合のみが可能16,17 | Aβ線維および退化ニューロンとのみ結合可能 |
| 安定 性 | 二次抗体に付着した色素に応じて | Aβと結合した場合、室温でも非常に安定 | メタノール中の安定 | エタノール中で安定 | 安定していない |
| 染色後のケア | 暗闇の中で常に保たれ、凍結されるなど、染色後に余分なケアが必要 | 室温で光感受性とより安定していない | 光感受性 | 光に敏感ではない | 光感受性 |
| 顕微鏡が必要 | 化合物光または蛍光(二次抗体の使用に応じて) | 蛍光 | 蛍光 | 光顕微鏡または偏光顕微鏡または偏光フィルター | 蛍光 |
| 背景染色 | 一般に、背景なし | 非常に低い背景 | 細胞内の脂質膜または脂質化合物との結合による高い背景 | 低い背景 | 高い背景 |
| インビボAβイメージング | 該当しない場合があります | 適用性の高い | 該当しない場合があります | 該当しない場合があります | 該当しない場合があります |
表1:異なるアミロイド結合色素とCur 7とのAβ標識の比較
ディスカッション
私たちの仮説は、Curが他の古典的なアミロイド結合色素と比較して、死後AD脳組織におけるAβプラークを標識し、画像化する最も速く、最も簡単で、最も安価な方法として使用することができ、Aβ特異的抗体と比較して行うことができた。本研究の目的は、死後AD脳組織におけるCurによるAβプラークの標識および画像化に要する最小時間を決定し、CurがAβプラークを標識するためのAβ抗体の代替として使用できるかどうかを決定することであった。この点に対して、CurのAβ標識能力は異なる時点で観察された。Curは1分以内にAβに標識することができた。また、CurによるAβの標識は、チオ-S(0.1%)、CR(1%)、およびFJC(0.001%)などの他の従来のアミロイド結合色素よりも大きかった。
Curは、Aβ標識のためのユニークで理想的な蛍光色素と考えられており、構造的、物理的、化学的、および生物学的特性10を含む従来のアミロイド結合色素のほとんどが有する特性を有するのでである。さらに、手頃な価格のために、ほとんどの研究者は、この天然ポリフェノールを使用することに興味を持っています。AβプラークおよびオリゴマーへのCur結合の特異性を示すために、6E10およびA11(Aβオリゴマー特異的抗体)を用った。Curは、組織中に存在するAβのすべての異なる種とのほぼ完全な共生を示し、CurがAβ7、17、18、19、20に非常に特異的であることを示唆している。また、Cur標識Aβオリゴマー(図3A)および細胞内Aβ凝集体(図3B)とAβ抗体と共局在化(図2B)は、Curが標識するだけではないことを示唆している細胞外Aβプラークは、細胞内空間に堆積したAβも7.
過去数十年の間に、いくつかの蛍光体および抗体は、Aβプラークを歴史的に標識および画像化するために開発された。間違いなく、それらのほとんどは、標的Aβ種とAβプラークを検出するために非常に固有ですが、これらははるかに高価であり、その使用はCurを使用するよりも時間がかかります。例えば、CurによるAβプラーク結合を、チオS、CR、FJCなどの他のアミロイド結合色素と比較し、そこでAβ特異的抗体(6E10)を基準制御として用いた。これらの結果は、Cur標識Aβプラークが他のどの蛍光体よりも強いことを示唆している。最も重要なことは、Curに比べて、より一般的に使用される蛍光体のいくつかは、Aβの標識およびイメージングの点で明確な欠点を有する。例えば、チオSは、細胞21内の脂質膜または脂質化合物と結合するので、気が散る、高い背景を作り出すことができる。同様に、Aβの標識に一般的に使用されるCRは、偏光顕微鏡下でリンゴ緑色複屈折(図4)を生成する。CRは、Curまたはチオ-Sのように容易にAβプラークを標識せず、Cur7、22、23によって検出されたものよりも有意に少ないAβプラークを標識する。Gutierrez et al. は、Aβおよび退化ニューロンと結合できる FJC が Cur または Thio-S 24 よりも低い頻度でラベルを付ける可能性があることを報告しました。これらの結果は、これらの一般的に使用される古典的なマーカーがCurよりもAβプラークに結合するための親和性が低いことを示唆している。
さらに、異なるAβプラークタイプ(コア、神経質、拡散、焼失)の標識は、Curが形態学的に異なるAβプラークを視覚化し、区別するのに役立つため、他のアミロイド結合フルオロフォアではなく、Curで最適化することができます。他の技術は、これらの形態学的サブタイプ7を区別することができない。同様に、Aβの異なる種に非常に特異的であるAβ特異的抗体の使用は、免疫組織化学を介して少なくとも24−48hを取り、非常にコストと時間がかかります。さらに、Aβの異なる種を検出するには、異なる抗体だけでなく、いくつかの付属化学物質が必要であり、これは総コストに大幅に追加されます。明らかに、Curはコストが低く、より容易に入手でき、Aβプラークに結合するとより高い蛍光強度を生じる。CRはAβプラークの標識とイメージングのための比較的費用対効果の高い技術でもありますが、Curはオリゴマー25(図3と図4)のようなAβ種の多くを結合して標識することができますが、CRはプロトフィブリルに結合するだけで、フィブリルス23.したがって、CurによるAβラベリングは、チオS、CR、またはFJC(表1)よりも効率的かつ費用対効果の高い方法で達成することができる。
要約すると、CurはAD脳組織からAβプラークおよびオリゴマーを効果的、迅速、かつ安価に検出することができる。さらに、AβへのCur結合は非常に特異的であり、その蛍光活性は非常に安定である。Aβにラベルを付けるためには、最小量(1~10 nM)が必要です。また、Curはまた、フィブリルやプラーク、ならびにオリゴマー7などの異なるAβ種に非常に特異的である。同様に、Cur誘導体デメトキシクルクミンおよびビスデメトキシクルクミンも、Cur10と同様にアミロイド結合特性およびc標識Aβを宿す(図5A)。したがって、Curは死後の脳組織におけるAβプラークの標識およびイメージングのための理想的な蛍光性である。ADの実験動物モデルにおける抗アミロイド療法後にAβプラーク負荷を検出するための迅速かつ容易な代替手段として使用することができる。我々の知見は、Aβに対するCurの高い親和性の報告を確認し、死後の脳および生体組織におけるAβプラークのモニタリングのための潜在的な使用を補強する。
最適なCur標識を得るには、Aβを未浸透組織のCurで標識せず、長期組織貯蔵を避けることをお勧めします。共標識の場合は、まずCurで染色する前に使用される特定の抗体で免疫組織化学を完了し、次にDAPIまたはHoechstを使用して対染色を行うことをお勧めします。
この方法に可能な改変は、最大30分間の組織とのCurのインキュベーション時間を増加させることが含まれ、これは、イメージング中に背景を増加させる可能性があるが、信号強度を妨げないだろう。Curの濃度を10μM未満に減少させることは、有意なレベルまでAβ標識に干渉しない。ヒト脳組織の背景を減らすために、代替調製方法を適用することができる。例えば、脳切片は、最初は室温で10分間、70%エタノール(v/v)で0.3%(w/v)スーダンブラックBで治療することができます。その後、セクションを室温で10分間Curで染色し、PBS 3xで15分間洗浄し、反染色し、アンチフェードメディア13で取り付けることができる。クライオスタット断面の厚さは、20-25μmに減らすこともできます。
この方法に対する潜在的な注意点は、細胞外Aβプラークとは異なる血管内に存在するAβとのCur結合を含む。したがって、研究者は、血管内のAβからのAβプラークおよびオリゴマーの形態を認識すべきである。研究者は、自動蛍光信号を認識する必要があります。余分な緑色の背景は、硬化染色後に時折見ることができますが、これは染色時間を減少させるか、Curの濃度を減少させることによって減少させることができます。最後に、他のマーカーとの共標識のためのシグナルは、クリアリング剤(例えばキシレン)との繰り返し処理のために減少し得る。
重要な制限には、蛍光イソチオシアネート(FITC)などの緑色蛍光色素でタグ付けされた二次抗体を使用して、任意のマーカータンパク質と共標識できないことが含まれます。Curの励起/放出が同様であるため、これらを使用することはできません。また、ADの初期段階では、限られた量のAβのみがCurによって標識され得る。最後に、蛍光色素のように暗い環境で作業を行う必要があります。
開示事項
著者たちは何も開示する必要はない。
謝辞
この研究のサポートは、セントメアリーズの昇天のフィールド神経科学研究所から来ました.
資料
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole (DAPI) | IHC world, Woodstock, MD | ||
| Aanimal model of Alzheimer's disease | Jackson's laboratory, Bar Harbor, ME | ||
| Absolute alcohol | VWR,Radnor, PA | ||
| Alexa 594 | Santacruz Biotech, Dallas, TX | ||
| Antibody 6E10 | Biolegend, San Diego, CA | ||
| Antibody A11 | Millipore, Burlington, MA | ||
| Compound light microscope | Olympus, Shinjuku, Japan | Olympus BX51 | |
| Congo red | Sigma, St. Louis, MO | ||
| Cryostat | GMI, Ramsey, MN | LeicaCM1800 | |
| Curcumin | Sigma, St. Louis, MO | ||
| Disodium hydrogen phosphate | Sigma, St. Louis, MO | ||
| Dystyrene plasticizer xylene | BDH, Dawsonville, GA | ||
| Filter papers | Fisher scientific, Pittsburgh, PA | ||
| Hoechst-33342 | Sigma, St. Louis, MO | ||
| Inverted fluorescent microscope | Leica, Buffalo Grove, IL | Leica DMI 6000B | |
| Inverted fluorescent microscope | Olympus, Shinjuku, Japan | Olympus 1x70 | |
| Normal goat serum | Sigma, St. Louis, MO | ||
| Paraffin | Sigma, St. Louis, MO | ||
| Paraformaldehyde | Sigma, St. Louis, MO | ||
| Ploy-lysine coated charged glass slide | Globe Scientific Inc, Mahwah, NJ | ||
| Potassium chloride | Sigma, St. Louis, MO | ||
| Potassium dihydrogen phosphate | Sigma, St. Louis, MO | ||
| Sodium azide | Sigma, St. Louis, MO | ||
| Sodium chloride | Sigma, St. Louis, MO | ||
| Sodium hydroxide | EMD Millipore, Burlington, MA | ||
| Sodium pentobarbital | Vortex Pharmaceuticals limited, Dearborn, MI | ||
| Thioflavin-S | Sigma, St. Louis, MO | ||
| Triton-X-100 | Sigma, St. Louis, MO | ||
| Xylene | VWR,Radnor, PA |
参考文献
- Cummings, J. L. Alzheimer's disease. New England Journal of Medicine. 351 (1), 56-67 (2004).
- Jack, C. R., Holtzman, D. M. Biomarker modeling of Alzheimer's disease. Neuron. 80 (6), 1347-1358 (2013).
- Tarawneh, R., Holtzman, D. M. The clinical problem of symptomatic Alzheimer disease and mild cognitive impairment. Cold Spring Harbor Perspectives in Medicine. 2 (5), (2012).
- Selkoe, D. J. Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature Cell Biology. 6 (11), 1054-1061 (2004).
- Hardy, J., Allsop, D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends in Pharmacological Sciences. 12 (10), 383-388 (1991).
- Chen, M., et al. Use of curcumin in diagnosis, prevention, and treatment of Alzheimer's disease. Neural Regeneration Research. 13 (4), 742-752 (2018).
- Maiti, P., et al. A comparative study of dietary curcumin, nanocurcumin, and other classical amyloid-binding dyes for labeling and imaging of amyloid plaques in brain tissue of 5x-familial Alzheimer's disease mice. Histochemistry and Cell Biology. 146 (5), 609-625 (2016).
- Maiti, P., Dunbar, G. L. Use of Curcumin, a Natural Polyphenol for Targeting Molecular Pathways in Treating Age-Related Neurodegenerative Diseases. International Journal of Molecular Sciences. 19 (6), (2017).
- Maiti, P., Dunbar, G. L. Comparative Neuroprotective Effects of Dietary Curcumin and Solid Lipid Curcumin Particles in Cultured Mouse Neuroblastoma Cells after Exposure to Abeta42. International Journal of Alzheimer's Disease. , (2017).
- den Haan, J., Morrema, T. H. J., Rozemuller, A. J., Bouwman, F. H., Hoozemans, J. J. M. Different curcumin forms selectively bind fibrillar amyloid beta in post mortem Alzheimer's disease brains: Implications for in-vivo diagnostics. Acta Neuropathologica Communications. 6 (1), 75(2018).
- Koronyo, Y., et al. Retinal amyloid pathology and proof-of-concept imaging trial in Alzheimer's disease. JCI Insight. 2 (16), (2017).
- Koronyo, Y., Salumbides, B. C., Black, K. L., Koronyo-Hamaoui, M. Alzheimer's disease in the retina: imaging retinal abeta plaques for early diagnosis and therapy assessment. Neurodegenerative Diseases. 10 (1-4), 285-293 (2012).
- Koronyo-Hamaoui, M., et al. Identification of amyloid plaques in retinas from Alzheimer's patients and noninvasive in vivo optical imaging of retinal plaques in a mouse model. NeuroImage. 54 (Suppl 1), S204-S217 (2011).
- Ran, C., et al. Design, synthesis, and testing of difluoroboron-derivatized curcumins as near-infrared probes for in vivo detection of amyloid-beta deposits. Journal of the American Chemical Society. 131 (42), 15257-15261 (2009).
- Beach, T. G. The Sun Health Research Institute Brain Donation Program: Description and Experience, 1987-2007. Cell Tissue Bank. 9 (3), 229-245 (2008).
- Green, S. J., Killiany, R. J. Subregions of the inferior parietal lobule are affected in the progression to AD. Neurobiology of Aging. 31 (8), 1304-1311 (2010).
- Ono, K., Hasegawa, K., Naiki, H., Yamada, M. Curcumin has potent anti-amyloidogenic effects for Alzheimer's beta-amyloid fibrils in vitro. Journal of Neuroscience Research. 75 (6), 742-750 (2004).
- Garcia-Alloza, M., Borrelli, L. A., Rozkalne, A., Hyman, B. T., Bacskai, B. J. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry. 102 (4), 1095-1104 (2007).
- Mutsuga, M., et al. Binding of curcumin to senile plaques and cerebral amyloid angiopathy in the aged brain of various animals and to neurofibrillary tangles in Alzheimer's brain. Journal of Veterinary Medical Science. 74 (1), 51-57 (2012).
- Tei, M., Uchida, K., Mutsuga, M., Chambers, J. K., Nakayama, H. The binding of curcumin to various types of canine amyloid proteins. Journal of Veterinary Medical Science. 74 (4), 481-483 (2012).
- Liu, L., Komatsu, H., Murray, I. V., Axelsen, P. H. Promotion of amyloid beta protein misfolding and fibrillogenesis by a lipid oxidation product. Journal of Molecular Biology. 377 (4), 1236-1250 (2008).
- Wu, C., Scott, J., Shea, J. E. Binding of Congo red to amyloid protofibrils of the Alzheimer Abeta(9-40) peptide probed by molecular dynamics simulations. Biophysical Journal. 103 (3), 550-557 (2012).
- Wu, C., Wang, Z., Lei, H., Zhang, W., Duan, Y. Dual binding modes of Congo red to amyloid protofibril surface observed in molecular dynamics simulations. Journal of the American Chemical Society. 129 (5), 1225-1232 (2007).
- Gutierrez, I. L., et al. Alternative Method to Detect Neuronal Degeneration and Amyloid beta Accumulation in Free-Floating Brain Sections With Fluoro-Jade. ASN Neuro Methods. 10, 1-7 (2018).
- Yang, F., et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo. Journal of Biological Chemistry. 280 (7), 5892-5901 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved