Method Article
Étiquetage et imagerie des plaques amyloïdes dans les tissus cérébraux à l'aide de la curcumine polyphénol naturelle
Dans cet article
Résumé
La curcumine est un fluorophore idéal pour l'étiquetage et l'imagerie des plaques de protéines bêta amyloïdes dans le tissu cérébral en raison de sa liaison préférentielle à la protéine bêta amyloïde ainsi que ses similitudes structurelles avec d'autres colorants de liaison amyloïdes traditionnels. Il peut être utilisé pour étiqueter et imager les plaques de protéines bêta-amyloïdes plus efficacement et à peu de frais que les méthodes traditionnelles.
Résumé
Le dépôt de la protéine bêta amyloïde (A) dans les espaces extra- et intracellulaires est l'une des pathologies caractéristiques de la maladie d'Alzheimer (MA). Par conséquent, la détection de la présence de l'A dans le tissu cérébral de la MA est un outil précieux pour le développement de nouveaux traitements pour prévenir la progression de la MA. Plusieurs colorants de liaison amyloïdes classiques, fluorochrome, sondes d'imagerie, et des anticorps spécifiques à aa ont été utilisés pour détecter ahistochimiquement dans le tissu cérébral DeA. L'utilisation de ces composés pour la détection de l'A est coûteuse et prend beaucoup de temps. Cependant, en raison de son activité fluorescente intense, de sa forte affinité et de sa spécificité pour l'A, ainsi que des similitudes structurelles avec les colorants de liaison amyloïdes traditionnels, la curcumine (Cur) est un candidat prometteur pour l'étiquetage et l'imagerie des plaques A en post mortem tissu cérébral. C'est un polyphénol naturel de l'herbe Curcuma longa. Dans la présente étude, Cur a été utilisé pour étiqueter histochimiquement plaques A à partir à la fois d'un modèle de souris génétiques de 5x maladie d'Alzheimer familiale (5xFAD) et à partir de tissu aD humain dans une minute. La capacité d'étiquetage de Cur a été comparée aux colorants de liaison amyloïdes conventionnels, tels que le thioflavine-S (Thio-S), le rouge du Congo (CR) et le Fluoro-jade C (FJC), ainsi que les anticorps spécifiques à l'A (6E10 et A11). Nous avons observé que Cur est le moyen le plus peu coûteux et le plus rapide d'étiqueter et d'imager les plaques A par rapport à ces colorants conventionnels et est comparable aux anticorps spécifiques à l'A. En outre, Cur se lie à la plupart des espèces de a, comme les oligomères et les fibrilles. Par conséquent, Cur pourrait être utilisé comme l'agent de détection fluorochrome le plus rentable, simple et rapide pour les plaques A.
Introduction
La maladie d'Alzheimer (MA) est l'un des troubles neurologiques les plus fréquents, liés à l'âge et progressifs et l'une des principales causes de décès dans le monde1,2. L'apprentissage, la mémoire, et l'affaiblissement de cognition, avec des désordres neuropsychiatriques, sont les symptômes communs manifestés dans AD3. Bien que l'étiologie de la MA n'ait pas été entièrement élucidée, les preuves génétiques, biochimiques et expérimentales disponibles indiquent que le dépôt progressif de l'A est un biomarqueur définitif pour l'AD4. Cette protéine mal repliée s'accumule dans les espaces intracellulaires et extracellulaires et est pensé pour être impliqué dans la perte synaptique, la neuroinflammation accrue, et la neurodégénérescence dans les régions corticales et hippocampal dans le cerveau affecté par AD5. Par conséquent, la détection histochimique de l'A dans le tissu de la MA est une première étape cruciale dans le développement de médicaments anti-amyloïdes non toxiques pour prévenir la progression de la MA.
Au cours des dernières décennies, plusieurs colorants et anticorps ont été utilisés par de nombreux laboratoires de recherche pour étiqueter et imager les plaques A dans les tissus cérébraux, mais certaines de ces méthodes prennent beaucoup de temps et les colorants ou anticorps utilisés sont coûteux, nécessitant plusieurs accessoires Produits chimiques. Par conséquent, le développement d'un moyen peu coûteux de détection des plaques A dans le cerveau AD serait un nouvel outil bienvenu. De nombreux laboratoires ont commencé à utiliser Cur, un polyphénol naturel anti-amyloïde prometteur, pour l'étiquetage et l'imagerie A, ainsi qu'un agent thérapeutique pour AD6,7,8,9. Son hydrophobicité et sa nature lypophile, ses similitudes structurelles avec les colorants reliure smyloïdes classiques, sa forte activité fluorescente, ainsi qu'une forte affinité pour se lier à aô en fait un fluorophore idéal pour l'étiquetage et l'imagerie des plaques Adans le tissu AD10 . Cur se lie avec des plaques aet et des oligomères et sa présence est également détectée dans les espaces intracellulaires7,11,12,13. En outre, il a été démontré que des quantités minimales (1 à 10 nM) de Cur peuvent étiqueter les plaques A dans 5x tissus cérébraux familiaux de la maladie d'Alzheimer (5xFAD)7. Bien que la concentration de 1 nM ne fournit pas l'intensité optimale de fluorescence pour le comptage des plaques de l'A, une concentration de 10 nM ou plus de Cur ne. Ran et ses collègues14 ont signalé que des doses aussi faibles que 0,2 nM de Cur dérivée du difluoroboron peuvent détecter des dépôts in vivo a presque aussi bien qu'une sonde infrarouge. Il n'est pas encore clair si cette dose est suffisante pour étiqueter les plaques Adans les tissus. La plupart des études antérieures ont utilisé 20 à 30 min pour tacher les plaques de l'A à l'aide de Cur, mais une coloration optimale peut nécessiter beaucoup moins de temps.
La présente étude a été conçue pour tester le temps minimum requis par Cur pour étiqueter les plaques A dans le tissu cérébral de l'AD et pour comparer la sensibilité à l'étiquetage et à l'imagerie des plaques A dans le tissu cérébral des souris 5xFAD après coloration avec Cur avec d'autres Les colorants liés à l'A, tels que Thioflavin-S (Thio-S), Congo red (CR) et Fluoro-jade C (FJC). La capacité d'étiquetage de l'A mD de ces colorants de liaison amyloïdes classiques a été comparée à la coloration De Cur dans les sections du cerveau coronal incorporées à la paraffine et cryostat de souris 5xFAD et de la MA humaine et du tissu cérébral de contrôle. Les résultats suggèrent que Cur étiquettes plaques A d'une manière similaire aux anticorps spécifiques à a (6E10) et modérément mieux que Thio-S, CR, ou FJC. En outre, lorsque des injections intrapéritones de souris Cur à 5xFAD ont été administrées pendant 2 à 5 jours, elle a traversé la barrière hémato-encéphalique et a été liée avec des plaquesA7. Fait intéressant, les concentrations nanomolaires de Cur ont été utilisées pour étiqueter et imager les plaques A dans le tissu cérébral 5xFAD7,14. De plus, les plaques a- morphologiquement distinctes, telles que les plaques de noyau, de neuritique, diffuses et brûlées, peuvent être étiquetées par Cur plus efficacement qu'avec n'importe lequel des autres colorants amyloïdes conventionnels7. Dans l'ensemble, la curpeut-être peut être appliquée à l'étiquette et à l'image des plaques adans le tissu cérébral post-mortem à partir de modèles animaux AD et/ou de tissus ad humains d'une manière facile et peu coûteuse, comme une alternative fiable aux anticorps spécifiques à l'A.
Protocole
Toutes les méthodes décrites ici ont été approuvées par le Comité des soins et de l'utilisation des animaux (ACUC) de l'Université d'État de Saginaw Valley. Le tissu humain a été obtenu à partir d'une banque de cerveau établie au Banner Sun Health Institute en Arizona15,16.
1. Perfusion des animaux
- Préparer les tampons de fixation et de perfusion.
- Préparer un tampon de phosphate de sodium de 0,1 M en ajoutant 80 g de chlorure de sodium (NaCl), 2 g de chlorure de potassium (KCl), 21,7 g de phosphate d'hydrogène disodium (Na2HPO4x 7H2O), 2,59 g de phosphate de potassium (KH2PO4) ), et double de l'eau distillée pour un total de 1 L.
- Préparer 4% de paraformaldéhyde (PFA).
- Ajouter 40 g de paraformaldéhyde à 1 L de PBS (0,1 M, pH 7,4).
- Chauffer la solution PFA à 60 à 65 oC et mélanger à l'aide d'un agitateur magnétique.
REMARQUE : La température ne doit pas dépasser 65 oC. - Ajouter quelques gouttes de NaOH (1 N) avec un goutte-à-goutte pour dissoudre complètement le PFA.
- Filtrer la solution PFA avec du papier filtre moyen à fin et conserver à 4 oC.
REMARQUE: La solution est bonne pour un mois.
- Effectuer l'anesthésie animale et la perfusion.
REMARQUE : Des souris témoins de b6SJL-Tg APP SwFlLon, PSEN1-M146L-L286V, 1136799Vas/J (5-FAD) souris témoins par âge (n - 6 par groupe) ont été achetées chez des vendeurs et élevées dans la maison d'animaux de l'Université d'État de Saginaw Valley. Le génotypage a été confirmé par la réaction en chaîne de polymérase (PCR) comme décrit précédemment7. Le tissu cérébral de la MA humaine comprend le tissu cérébral administre post mortem et le tissu témoin assorti à l'âge.- Anesthésiez l'animal avec un agent anesthésique approprié, comme le pentobarbital de sodium (390 mg/kg de poids corporel), ou un mélange de kétamine/xylazine (jusqu'à 80 mg/kg de kétamine et 10 mg/kg de xylazine) par injection intrapéritone (27 G aiguille et 1 seringue mL). Vérifiez le niveau d'anesthésie en pinçant un orteil. Si l'animal ne répond pas, il est prêt pour la chirurgie de perfusion.
- Placer l'animal anesthésié en position de supine sur le plateau de chirurgie de perfusion et à l'aide de petits ciseaux d'iris faire une incision à l'extrémité postérieure du ventricule gauche.
- Insérez une aiguille de perfusion de 22 G au ventricule gauche et faites une petite incision à l'oreillette droite pour enlever le liquide de perfusion du corps. Utiliser un système de perfusion alimenté par gravité pour permettre au fluide de perfusion glace-froid (0,1 M PBS, pH 7,4) de circuler de 5 à 6 min (débit de 20 à 25 ml/min).
REMARQUE : Un foie clair est l'indicateur de perfusion optimale. - Passez la soupape tampon à une solution de paraformaldéhyde de 4 % glacée pour la fixation et laissez-la couler pendant 8 à 10 minutes.
REMARQUE : Les tremblements suivis de membres durcis ou raides sont des indicateurs de bonne fixation. - Retirez le cerveau du crâne à l'aide de ciseaux. À l'aide d'une spatule, recueillir le cerveau et le placer dans une fiole de 4% de PFA (au moins 10 fois le volume du volume du cerveau) et stocker à 4 oC jusqu'à une utilisation ultérieure.
2. Traitement des tissus
- Couper les sections de cryostat.
- Transférer le cerveau vers des solutions de saccharose graduées (10 %, 20 % et 30 %) et conserver à 4 oC pendant 24 h chacun, jusqu'à utilisation.
- À l'aide d'un cryostat à -22 oC, couper des sections de 40 m d'épaisseur. Recueillir 10 à 20 sections par puits dans une assiette de 6 puits remplie de PBS et d'azide de sodium (0,02 %).
- La paraffine intègre les sections pour la souris et le tissu cérébral humain.
- Pour les sections de paraffine, déshydrater le tissu cérébral perfused et de 24 h post-fixe avec des alcools classés (50%, 70%, 90%) pour 2 h chacun, suivi de 100% alcool 2x pour 1 h chacun), puis avec xylène 2x pour 1 h chacun) à température ambiante.
- Pénétrer le tissu avec de la xylène-paraffine (1:1) 2x pendant 1 h à 56 oC dans un flacon conique en verre recouvert de papier d'aluminium.
- Immerger le tissu dans de la paraffine fondue (56 oC) pendant 4 à 6 h.
- Couper des sections de 5 m d'épaisseur à l'aide d'un microtome rotatif à température ambiante et les placer dans un bain d'eau de tissu à 45 oC.
- Étiquetez histochimiquement les plaques A dans les sections cryostat avec Cur.
- Rincer les sections de l'étape 2.1.2 avec PBS (pH 7.4) 3x pour 5 min chacune.
- Immerger les sections dans 70 % d'éthanol pendant 2 min à température ambiante.
- Dissoudre le bouillon Cur (1 mM) dans du méthanol et diluer avec 70 % d'éthanol pour obtenir une concentration de travail finale de 10 M.
- Immerger les sections avec la solution Cur de travail pendant 1 à 5 min à température ambiante sur un shaker à 150 tr/min.
- Jeter la solution Cur et laver avec 70% d'éthanol 3x pendant 2 min chacun.
- Placez les sections sur des lames de verre recouvertes de poly-L-lysine et montez à l'aide d'un support de montage organique, comme le xylène de distyrène xylène (DPX).
- Afficher sous un microscope à fluorescence à l'aide de filtres d'excitation/émission de 480/550 nm.
- Étiquetez histochimiquement les plaques Adans les sections de souris et de cerveau humain intégrées à la paraffine avec Cur.
- Déparaffiniser les sections de tissu de l'étape 2.2.4 avec xylène 2x pendant 5 min chacune à température ambiante.
- Réhydratez-vous avec des solutions d'alcool classé (100%, 80%, 70%, 50% pour 1 min chacune) et avec de l'eau distillée 2x pendant 5 min chacune à température ambiante.
- Sections de tache avec Cur (10 M) pendant 10 min à température ambiante dans l'obscurité, secouant à 150 tr/min. Laver avec 70%, 90%, et 100% d'alcool pendant 2 min chacun.
- Effacer avec xylène 2x pendant 5 min chacun et couvrir glisser avec DPX.
- Visualisez-vous sous un microscope à fluorescence tel que mentionné à l'étape 2.3.7.
- Colocalisez Cur avec l'anticorps AmD dans les plaques et les oligomères.
- Laver les sections cryostat de l'étape 2.1.2 avec PBS 3x dans une plaque de 12 puits.
- Bloquer les sections avec 10% de sérum de chèvre normal (NGS) dissous en PBS avec 0,5% Triton-X-100 à température ambiante pendant 1 h.
- Jetez la solution de blocage. Incuber les sections avec des anticorps spécifiques à l'A (6E10 ou A11, dilué 1:200) dissous dans une solution de blocage fraîche contenant 10 % de NGS et 0,5 % de Triton-X100 pendant la nuit à 4 oC dans un shaker à 150 tr/min.
- Jeter la solution d'anticorps et laver les sections avec PBS 3x pendant 10 min chacune.
- Incuber avec l'étiquette d'anticorps secondaire avec le fluorophore rouge (par exemple, Alexa 594) pendant 1 h à température ambiante dans l'obscurité.
- Laver avec PBS 3x pendant 10 min chacun.
- Laver avec 70% d'alcool 1x.
- Incuber les sections avec cur (10 m) pendant 5 min à température ambiante.
- Laver avec 70% d'alcool 3x pendant 1 min chacun.
- Déshydrater avec 90% et 100% d'alcool pendant 1 min chacun, effacer avec xylène 2x pendant 5 min chacun, et monter sur des lames à l'aide de DPX.
- Visualisez à l'aide d'un microscope à fluorescence avec des filtres d'excitation/émission appropriés pour les signaux rouges et verts.
- Pour la colocalisation intracellulaire de l'A, tacher les sections à l'aide de l'anticorps A (6E10), la restaine avec Cur à température ambiante avec des secousses à 150 tr/min, et contre-tache avec Hoechst-33342 (1 mg/ml) et/ou DAPI (1ug/ml) pendant 10 min à température ambiante l'obscurité avec des secousses à 150 tr/min. Laver avec PBS 3x.
- Prenez des images avec les filtres rouge, vert et bleu avec un objectif 100x (grossissement total 1000x).
- Étiquette plaques AmD avec Thio-S, CR et FJC.
REMARQUE : Des protocoles détaillés pour l'étiquetage Thio-S et CR ont déjà été signalés7.- Pour la coloration FJC, lavez les sections flottantes obtenues à partir de l'étape 2.1.2 avec PBS 3x pendant 5 min chacune.
- Placer les sections dans une plaque de 12 puits et la tache avec FJC (0.001%) pendant 10 min dans l'obscurité à température ambiante.
- Jeter la solution FJC et laver avec PBS 3x pendant 5 min chacun.
- Incuber avec du chlorure d'ammonium (NH4Cl, 50 mM dissous en PBS) pendant 10 min à température ambiante.
- Jeter la solution NH4Cl et laver avec PBS 3x pendant 5 min chacun.
- Après les étapes de la section 2.4, déshydrater avec des solutions d'alcool gradués, effacer, monter et voir sous un microscope à fluorescence à l'aide de filtres d'excitation/émission de 450/520 nm.
Résultats
La curcumine étiquette les plaques aïe en moins d'une minute. Lorsque nous avons taché le tissu 5xFAD avec Cur, nous avons constaté que l'étiquette Cur plaques A dans les 1 min. Bien que l'augmentation du temps d'incubation avec Cur ait légèrement augmenté l'intensité de fluorescence des plaques aao, le nombre de plaques a-A observées n'était pas significativement différent entre 1 min et 5 min de temps de coloration (Figure 1).
Cur peut étiqueter les plaques adans les tissus de la souris et de la peraffine et les tissus ad humains préparés par cryostat et les tissus ad humains qui colocalisent avec des anticorps spécifiques à l'Adans dans le tissu cérébral de la souris. Lorsque nous avons taché la cryosection, les sections incorporées à la paraffine(figure 2A) et le tissu ad humain (Figure 2B), nous avons observé des plaques A-labeld cur dans tous les types de sections de tissu. De plus, pour confirmer que Cur est lié aux plaques A, nous avons d'abord étiqueté les plaques avec 6E10, suivie s'il s'agit de taches Cur. Nous avons observé que le Cur était complètement colocalisé avec A ' aux mêmes plaques qui reliaient le 6E10 (figure 2C).
Cur étiqueté a oligomers et agrégats intracellulaires A. Pour vérifier si Cur pouvait étiqueter les oligomères de l'A, les sections de souris 5xFAD étaient tachées d'un anticorps spécifique à l'oligomère (A11), suivi de la coloration Cur. Nous avons observé que Cur colocalisé avec A11 dans les plaques A(figure 3A). De même, Cur a également colocalisé avec l'anticorps 6E10 dans les espaces intracellulaires (Figure 3B), indiquant qu'il peut étiqueter l'intracellulaire A.
Cur étiqueté A plus en évidence que les colorants de liaison amyloïde classique. L'étiquetage de l'aparis par Cur a été comparé aux colorants de liaison amyloïdes disponibles dans le commerce Thio-S, CR, FJC. L'anticorps 6E10 spécifique à l'A a été utilisé comme contrôle standard. Nous avons observé que Cur a étiqueté A plus en évidence que les colorants de liaison amyloïdes conventionnels (Figure 4).
Cur dérivés bis-demethoxycurcumin (BDMC) et demethoxycurcumin (DMC), également présent dans l'extrait de curcuma, l'étiquette plaques A comparativement à Cur dans le tissu cérébral 5xFAD. Deux autres composants majeurs, tels que BDMC et DMC, sont présents dans l'extrait de curcuma. Nous avons testé si ces deux composés étiquetent également des plaques A similaires à Cur. Lorsque les sections du cerveau de la souris 5xFAD ont été tachées de ces dérivés, BDMC et DMC ont également étiqueté les plaques A, paralliant Cur (Figure 5A). Différents supports de montage ont été étudiés pour vérifier l'interférence avec l'imagerie A après coloration avec Cur. Le signal fluorescent était intact dans les supports de montage aqueux et organiques, comme le DPX(figure 5B). La coloration des plaques A avec Cur était appropriée après l'étiquetage immunofluorescent et suivie d'une contre-coloration avec la solution Hoechst 33342 (1 mg/ml) ou 4,6-diamidino-2-phénylindole (DAPI, 1g/ml). Les signaux immunofluorescents et l'intensité de contre-coloration ont été maintenus après la coloration de La cour(figure 5C).

Figure 1 : La curcumine étiquette les plaques aoD en moins d'une minute. (A. Les sections cérébrales de souris 5xFAD ou de contrôle humain et de tissu cortical AD ont été tachées avec Cur (10 M) pendant 1 à 5 min et le nombre de plaques visibles ont été comptés. (B). Aucune différence n'a été observée dans le nombre de numérations de plaque aa entre les temps de coloration de 1 min et 5 min. Les données sont représentées comme une erreur moyenne de la moyenne (SEM). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
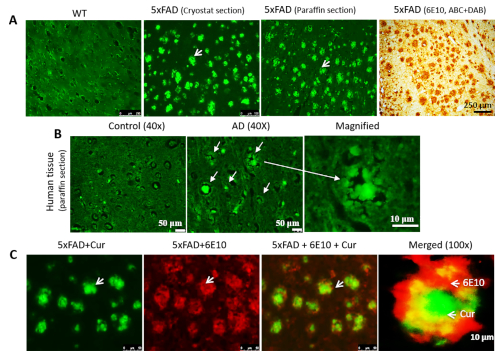
Figure 2 : Colocalisation de La curisation avec un anticorps A mD dans les plaques A. Cur peut étiqueter les plaques A dans des sections cryostat-préparées, paraffines(A) et tissu aD humain (B). L'étiquetage Aa a fait le parallèle avec l'étiquetage avec un anticorps spécifique à l'A (6E10, coloration DAB). (C). Les sections 5xFAD ont d'abord été étiquetées avec un anticorps A (6E10), suivie de taches avec Cur. Rouge 6E10 lié par un anticorps secondaire marqué avec Alexa fluorophore 594. Vert et Cur. Cur complètement colocalisé avec A 'aux mêmes plaques qui liés à 6E10. Les flèches indiquent les plaques a. La barre d'échelle indique 50 m (grossissement total 400x) dans les trois images à gauche, et 10 m (grossissement total 400x). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Étiquettes de curcumine A 'oligomers et intracellulaires A. (A) A-oligomer a été détecté immunohistochimiquement à l'aide d'un anticorps spécifique à l'A (A11), suivi d'une coloration avec Cur. Cur complètement colocalisé avec A, au même oligomère où A11 se lie. Barre d'échelle de 250 m et grossissement total 100x. (B) De même, l'intracellulaire A a été détectée immunohistochimiquement à l'aide d'un anticorps spécifique à l'A (6E10), suivi d'une coloration avec Cur. Notez que Cur a complètement colocalisé avec A dans les mêmes zones liées à 6E10. Barre d'échelle de 50 m et grossissement total 1 000x. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Comparaison de différents colorants de liaison amyloïdes avec Cur pour étiqueter les plaques A. Des sections de cryostat (40 m) du cortex des souris 5xFAD de 12 mois ont été tachées avec Cur, Thioflavin-S, Congo rouge, Fluoro-jade C, et avec l'anticorps 6E10. Cur étiqueté plaques A plus en évidence que Thio-S, CR, et FJC. Les flèches indiquent les plaques a. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Cur-dérivés bis-demethoxy curcumine et demethoxy curcumine également étiquette Ade similaire à Cur. (A) Les sections 5xFAD cryostat et paraffine ont été tachées de cur-dérivés bis-demethoxy curcumine et curcumine de demethoxy. Ces deux dérivés étiquette a plaques d'une manière similaire à Cur. (B) Les deux supports de montage aqueux et organiques (DPX) ont été utilisés pour monter des sections de tissu après l'étiquetage des plaques A avec Cur. (C) Les sections immunolabeled ont été utilisées pour l'étiquetage A avec Cur. Les flèches blanches indiquent les plaques aaètes, la flèche verte indique l'astrocyte activé (GFAP), et la flèche jaune indique la tache nucléaire (DAPI). Barres d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| fonctionnalités | Anticorps de a | Curcumine | Thio-S | Congo rouge | Fluoro-Jade C |
| Durée de la coloration | 24 à 48 h | 1-5 min | 10 min | 60 min | 30 min |
| Produits chimiques accessoires | Anticorps secondaires, plusieurs produits chimiques pour faire tampon, sérum de chèvre normal | Méthanol | alcool | NaOH et éthanol | NaOH et éthanol, permanganate de potassium |
| coût | Coûteux : un flacon d'anticorps spécifique à l'A nécessite 200 à 300 $ | Efficace sur le plan du coût : 5 à 10$/1 g de cur et peut être appliqué pour de nombreux tissus | Efficacité économique : 5/1 g de dollars, peut être appliqué pour quelques tissus | Coût efficace : 5 $/1 g rouge Congo, et peut être appliqué pour plusieurs tissus | Coûteux : 15 500 $/1 g de poudre FJC |
| Spécificité | Différents anticorps sont nécessaires pour les oligomères et les fibrilles de l'A | La curcumine se lie aux oligomères et aux fibrilles de l'A | Peut lier seulement les fibrilles, pas les monomères, ou les oligomères | Ne peut se lier qu'avec les protofibrilles et les fibrilles16,17 | Ne peut se lier qu'aux fibrilles et aux neurones dégénérés |
| stabilité | Selon le colorant attaché à l'anticorps secondaire | Très stable, même à température ambiante lorsqu'il est lié avec A | Stable en méthanol | Stable en éthanol | Pas stable |
| Soins après coloration | Besoin de soins supplémentaires après coloration, comme être maintenu dans l'obscurité et congelé tout le temps | Pas aussi sensible à la lumière et plus stable à température ambiante | Sensible à la lumière | Pas sensible à la lumière | Sensible à la lumière |
| Microscope requis | Lumière ou fluorescente composée (selon l'utilisation d'anticorps secondaires) | fluorescent | fluorescent | Microscope léger ou microscope polarisé ou filtre polariser | fluorescent |
| Coloration de fond | En général, aucun | Fond très bas | Fond élevé dû à la liaison avec la membrane de lipide ou les composés de lipide dans la cellule | Faible fond | Fond élevé |
| Imagerie in vivo de l'A | Peut ne pas être applicable | Très applicable | Peut ne pas être applicable | Peut ne pas être applicable | Peut ne pas être applicable |
Tableau 1 : Comparaison de l'étiquetage Aavec différents colorants de liaison amyloïdes et Cur7.
Discussion
Notre hypothèse était que Cur pourrait être utilisé comme le moyen le plus rapide, le plus facile et le moins coûteux d'étiqueter et d'imager les plaques A-A dans le tissu cérébral admatésique post mortem par rapport à d'autres colorants de liaison amyloïdes classiques, ainsi qu'à des anticorps spécifiques à l'A. Les objectifs de cette étude étaient de déterminer le temps minimum requis pour étiqueter et imager les plaques A par Cur dans le tissu cérébral post mortem AD et de déterminer si Cur peut être utilisé comme une alternative à l'anticorps A pour l'étiquetage des plaques A. À cette fin, la capacité d'étiquetage De Cur a été observée à différents moments. Cur a été en mesure d'étiqueter A en une minute. En outre, l'étiquetage de A par Cur était plus élevé que d'autres colorants de liaison amyloïdes conventionnels, tels que Thio-S (0,1 %), CR (1 %) et FJC (0,001 %).
Cur est considéré comme un fluorophore unique et idéal pour l'étiquetage A, car il a la plupart des caractéristiques possédées par la plupart des colorants de liaison amyloïde conventionnels, y compris les propriétés structurelles, physiques, chimiques et biologiques10. En outre, en raison de l'abordabilité, la plupart des chercheurs sont intéressés à utiliser ce polyphénol naturel. Pour montrer la spécificité de la liaison Cur aux plaques et aux oligomères de l'A, nous avons utilisé 6E10 et A11 (anticorps spécifiques à l'oligomère). Cur a montré une colocalisation presque complète avec toutes les différentes espèces de A présents dans le tissu, ce qui suggère que Cur est très spécifique à A7,17,18,19,20. De plus, Cur a étiqueté les oligomères de l'A(figure 3A) et les agrégats intracellulaires de l'A ( figure3B) et colocalisés avec des anticorps A (Figure 2B), suggérant que Cur peut étiqueter non seulement plaques extracellulaires de l'A, mais aussi a déposés dans des espaces intracellulaires7.
Au cours des dernières décennies, plusieurs fluorophores et anticorps ont été développés pour étiqueter et imager histochimiquement les plaques A. Il ne fait aucun doute que la plupart d'entre elles sont très spécifiques aux espèces ciblées de l'A et à la détection des plaques A, mais elles sont beaucoup plus coûteuses et leur utilisation est plus longue que l'utilisation de Cur. Par exemple, nous avons comparé la liaison de la plaque A par Cur, avec d'autres colorants de liaison amyloïdes, tels que Thio-S, CR et FJC, où l'anticorps spécifique à l'A (6E10) a été utilisé comme contrôle de référence. Ces résultats suggèrent que les étiquettes Cur plaques A plus fortement que n'importe lequel des autres fluorophores. Plus important encore, par rapport à Cur, certains des fluorophores les plus couramment utilisés ont des inconvénients distincts en termes d'étiquetage et d'imagerie A. Par exemple, Thio-S peut produire un arrière-plan distrayant et élevé parce qu'il se lie avec des membranes lipidiques ou des composés lipidiques dans la cellule21. De même, le CR, qui est couramment utilisé pour étiqueterl'a . CR n'étiquete pas les plaques A aussi facilement que Cur ou Thio-S, étiquetant beaucoup moins de plaques A que celles détectées par Cur7,22,23. Gutierrez et coll. ont signalé que le FJC, qui peut se lier avec a et avec des neurones dégénérés, étiquette à une fréquence inférieure à celle de Cur ou Thio-S24. Ces résultats suggèrent que ces marqueurs classiques couramment utilisés ont moins d'affinité pour la liaison aux plaques A que Cur.
En outre, l'étiquetage de différents types de plaques A (core, neuritic, diffuse, burned-out) peut être optimisé avec Cur, plutôt que d'autres fluorophores liants amyloïdes, parce que Cur peut aider à visualiser et distinguer morphologiquement différentes plaques A, tandis que d'autres techniques ne distinguent pas ces sous-types morphologiques7. De même, l'utilisation d'anticorps spécifiques à l'A, qui sont très spécifiques à différentes espèces de A est très coûteuse et prend beaucoup de temps, prenant au moins 24-48h par immunohistochimie. De plus, la détection de différentes espèces d'A nécessite différents anticorps, ainsi que plusieurs produits chimiques accessoires, ce qui augmente considérablement le coût total. De toute évidence, Cur est moins coûteux, plus facilement disponible, et produit une intensité de fluorescence plus élevée quand il se lie aux plaques A. Bien que le CR soit également une technique relativement rentable pour l'étiquetage et l'imagerie des plaques A, Cur peut lier et étiqueter davantage d'espèces de l'A, comme les oligomères25 (figure 3 et figure 4), tandis que le CR ne se lie qu'aux protofibrilles et aux protofibrilles et fibrilles23. Par conséquent, l'étiquetage aavec Cur peut être réalisé plus efficacement et plus efficacement que par Thio-S, CR, ou FJC (tableau 1).
En résumé, Cur peut détecter les plaques et les oligomères de l'AMD à partir du tissu cérébral de la MA de façon efficace, rapide et peu coûteuse. En outre, Cur liaison à A est très spécifique et son activité fluorescente est très stable. Il faut des quantités minimales (1-10 nM) pour étiqueter A. En outre, Cur est également très spécifique à différentes espèces de a, telles que les fibrilles ou les plaques, ainsi que les oligomères7. De même, Cur dérivés demethoxycurcumin et bisdemethoxycurcumin abritent également des propriétés de liaison amyloïde et c étiquette A de la même façon à Cur10 (Figure 5A). Par conséquent, Cur est un fluorophore idéal pour l'étiquetage et l'imagerie des plaques A dans le tissu cérébral post-mortem. Il peut être utilisé comme une alternative rapide et facile pour détecter la charge de plaque A après la thérapie anti-amyloïde dans les modèles animaux expérimentaux de la MA. Nos résultats confirment les rapports de l'affinité élevée de Cur à A, renforçant son utilisation potentielle pour surveiller des plaques d'A dans le cerveau post mortem et dans le tissu vivant.
Pour l'étiquetage optimal de la cur, il est recommandé de ne pas étiqueter a avec Cur dans des tissus non perfusés et d'éviter le stockage à long terme des tissus, car il peut produire une plus grande quantité de fond, même lorsqu'il est perfusé. Pour le colabeling, il est recommandé de compléter l'immunohistochimie d'abord avec l'anticorps spécifique utilisé avant de coloration avec Cur, puis de suivre cela avec contre-coloration en utilisant DAPI ou Hoechst.
Les modifications possibles à cette méthode incluent l'augmentation du temps d'incubation de Cur avec le tissu jusqu'à 30 min, ce qui n'interférera pas avec l'intensité du signal, bien qu'il puisse augmenter le fond pendant l'imagerie. La diminution de la concentration de Cur à moins de 10 m n'interfère pas dans l'étiquetage de l'A à un niveau significatif. Pour réduire le fond pour le tissu de cerveau humain, une méthode alternative de préparation pourrait être appliquée. Par exemple, les sections cérébrales pourraient être traitées au départ avec 0,3 % (w/v) Soudan Black B dans 70 % d'éthanol (v/v) pendant 10 min à température ambiante. Ensuite, la section pourrait être tachée avec Cur pendant 10 min à température ambiante, et lavé avec PBS 3x pendant 15 min, contre-taché, et monté avec des médias antifading13. L'épaisseur de la section de Cryostat pourrait également être réduite à 20 à 25 m.
Les mises en garde potentielles à cette méthode incluent la liaison de Cur avec a présent dans les vaisseaux sanguins, qui est différent des plaques extracellulaires d'A. Ainsi, l'investigateur devrait être conscient de la morphologie des plaques d'A et des oligomères de A dans les vaisseaux sanguins. L'enquêteur doit être au courant des signaux autofluorescents. L'excès de fond vert peut être vu de temps en temps après la coloration Cur, mais cela peut être réduit en diminuant le temps de coloration ou en diminuant la concentration de Cur. Enfin, le signal de colabeling avec d'autres marqueurs peut être réduit en raison de traitements répétés avec l'agent de compensation (par exemple, xylène).
Les limites importantes incluent l'incapacité de coétiquer avec n'importe quelle protéine de marqueur utilisant l'anticorps secondaire marqué avec le colorant fluorescent vert, tel que l'isothiocyanate fluorescent (FITC). Ceux-ci ne peuvent pas être utilisés en raison de l'excitation similaire / émission de Cur. En outre, dans les premiers stades de l'AD, seules des quantités limitées de A peuvent être étiquetées par Cur. Enfin, il est nécessaire de faire du travail dans un environnement sombre comme n'importe quel colorant fluorescent.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Le soutien à cette étude est venu de l'Institut de neurosciences de terrain de l'Ascension de St. Mary's.
matériels
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole (DAPI) | IHC world, Woodstock, MD | ||
| Aanimal model of Alzheimer's disease | Jackson's laboratory, Bar Harbor, ME | ||
| Absolute alcohol | VWR,Radnor, PA | ||
| Alexa 594 | Santacruz Biotech, Dallas, TX | ||
| Antibody 6E10 | Biolegend, San Diego, CA | ||
| Antibody A11 | Millipore, Burlington, MA | ||
| Compound light microscope | Olympus, Shinjuku, Japan | Olympus BX51 | |
| Congo red | Sigma, St. Louis, MO | ||
| Cryostat | GMI, Ramsey, MN | LeicaCM1800 | |
| Curcumin | Sigma, St. Louis, MO | ||
| Disodium hydrogen phosphate | Sigma, St. Louis, MO | ||
| Dystyrene plasticizer xylene | BDH, Dawsonville, GA | ||
| Filter papers | Fisher scientific, Pittsburgh, PA | ||
| Hoechst-33342 | Sigma, St. Louis, MO | ||
| Inverted fluorescent microscope | Leica, Buffalo Grove, IL | Leica DMI 6000B | |
| Inverted fluorescent microscope | Olympus, Shinjuku, Japan | Olympus 1x70 | |
| Normal goat serum | Sigma, St. Louis, MO | ||
| Paraffin | Sigma, St. Louis, MO | ||
| Paraformaldehyde | Sigma, St. Louis, MO | ||
| Ploy-lysine coated charged glass slide | Globe Scientific Inc, Mahwah, NJ | ||
| Potassium chloride | Sigma, St. Louis, MO | ||
| Potassium dihydrogen phosphate | Sigma, St. Louis, MO | ||
| Sodium azide | Sigma, St. Louis, MO | ||
| Sodium chloride | Sigma, St. Louis, MO | ||
| Sodium hydroxide | EMD Millipore, Burlington, MA | ||
| Sodium pentobarbital | Vortex Pharmaceuticals limited, Dearborn, MI | ||
| Thioflavin-S | Sigma, St. Louis, MO | ||
| Triton-X-100 | Sigma, St. Louis, MO | ||
| Xylene | VWR,Radnor, PA |
Références
- Cummings, J. L. Alzheimer's disease. New England Journal of Medicine. 351 (1), 56-67 (2004).
- Jack, C. R., Holtzman, D. M. Biomarker modeling of Alzheimer's disease. Neuron. 80 (6), 1347-1358 (2013).
- Tarawneh, R., Holtzman, D. M. The clinical problem of symptomatic Alzheimer disease and mild cognitive impairment. Cold Spring Harbor Perspectives in Medicine. 2 (5), (2012).
- Selkoe, D. J. Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature Cell Biology. 6 (11), 1054-1061 (2004).
- Hardy, J., Allsop, D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends in Pharmacological Sciences. 12 (10), 383-388 (1991).
- Chen, M., et al. Use of curcumin in diagnosis, prevention, and treatment of Alzheimer's disease. Neural Regeneration Research. 13 (4), 742-752 (2018).
- Maiti, P., et al. A comparative study of dietary curcumin, nanocurcumin, and other classical amyloid-binding dyes for labeling and imaging of amyloid plaques in brain tissue of 5x-familial Alzheimer's disease mice. Histochemistry and Cell Biology. 146 (5), 609-625 (2016).
- Maiti, P., Dunbar, G. L. Use of Curcumin, a Natural Polyphenol for Targeting Molecular Pathways in Treating Age-Related Neurodegenerative Diseases. International Journal of Molecular Sciences. 19 (6), (2017).
- Maiti, P., Dunbar, G. L. Comparative Neuroprotective Effects of Dietary Curcumin and Solid Lipid Curcumin Particles in Cultured Mouse Neuroblastoma Cells after Exposure to Abeta42. International Journal of Alzheimer's Disease. , (2017).
- den Haan, J., Morrema, T. H. J., Rozemuller, A. J., Bouwman, F. H., Hoozemans, J. J. M. Different curcumin forms selectively bind fibrillar amyloid beta in post mortem Alzheimer's disease brains: Implications for in-vivo diagnostics. Acta Neuropathologica Communications. 6 (1), 75(2018).
- Koronyo, Y., et al. Retinal amyloid pathology and proof-of-concept imaging trial in Alzheimer's disease. JCI Insight. 2 (16), (2017).
- Koronyo, Y., Salumbides, B. C., Black, K. L., Koronyo-Hamaoui, M. Alzheimer's disease in the retina: imaging retinal abeta plaques for early diagnosis and therapy assessment. Neurodegenerative Diseases. 10 (1-4), 285-293 (2012).
- Koronyo-Hamaoui, M., et al. Identification of amyloid plaques in retinas from Alzheimer's patients and noninvasive in vivo optical imaging of retinal plaques in a mouse model. NeuroImage. 54 (Suppl 1), S204-S217 (2011).
- Ran, C., et al. Design, synthesis, and testing of difluoroboron-derivatized curcumins as near-infrared probes for in vivo detection of amyloid-beta deposits. Journal of the American Chemical Society. 131 (42), 15257-15261 (2009).
- Beach, T. G. The Sun Health Research Institute Brain Donation Program: Description and Experience, 1987-2007. Cell Tissue Bank. 9 (3), 229-245 (2008).
- Green, S. J., Killiany, R. J. Subregions of the inferior parietal lobule are affected in the progression to AD. Neurobiology of Aging. 31 (8), 1304-1311 (2010).
- Ono, K., Hasegawa, K., Naiki, H., Yamada, M. Curcumin has potent anti-amyloidogenic effects for Alzheimer's beta-amyloid fibrils in vitro. Journal of Neuroscience Research. 75 (6), 742-750 (2004).
- Garcia-Alloza, M., Borrelli, L. A., Rozkalne, A., Hyman, B. T., Bacskai, B. J. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry. 102 (4), 1095-1104 (2007).
- Mutsuga, M., et al. Binding of curcumin to senile plaques and cerebral amyloid angiopathy in the aged brain of various animals and to neurofibrillary tangles in Alzheimer's brain. Journal of Veterinary Medical Science. 74 (1), 51-57 (2012).
- Tei, M., Uchida, K., Mutsuga, M., Chambers, J. K., Nakayama, H. The binding of curcumin to various types of canine amyloid proteins. Journal of Veterinary Medical Science. 74 (4), 481-483 (2012).
- Liu, L., Komatsu, H., Murray, I. V., Axelsen, P. H. Promotion of amyloid beta protein misfolding and fibrillogenesis by a lipid oxidation product. Journal of Molecular Biology. 377 (4), 1236-1250 (2008).
- Wu, C., Scott, J., Shea, J. E. Binding of Congo red to amyloid protofibrils of the Alzheimer Abeta(9-40) peptide probed by molecular dynamics simulations. Biophysical Journal. 103 (3), 550-557 (2012).
- Wu, C., Wang, Z., Lei, H., Zhang, W., Duan, Y. Dual binding modes of Congo red to amyloid protofibril surface observed in molecular dynamics simulations. Journal of the American Chemical Society. 129 (5), 1225-1232 (2007).
- Gutierrez, I. L., et al. Alternative Method to Detect Neuronal Degeneration and Amyloid beta Accumulation in Free-Floating Brain Sections With Fluoro-Jade. ASN Neuro Methods. 10, 1-7 (2018).
- Yang, F., et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo. Journal of Biological Chemistry. 280 (7), 5892-5901 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon