Method Article
Etichettatura e imaging di placche amiloidi nel tessuto cerebrale utilizzando la curcumina polifenolo naturale
In questo articolo
Riepilogo
La curcumina è un fluoroforo ideale per l'etichettatura e l'imaging di placche proteiche beta amiloidi nel tessuto cerebrale a causa del suo legame preferenziale alla proteina beta amiloide e delle sue somiglianze strutturali con altri coloranti di legame amiloidi tradizionali. Può essere utilizzato per etichettare e immagini placche proteiche beta amiloidi in modo più efficiente ed economico rispetto ai metodi tradizionali.
Abstract
La deposizione di proteine beta amiloidi (A) in spazi extra e intracellulari è una delle patologie distintive del morbo di Alzheimer (AD). Pertanto, il rilevamento della presenza di A , nel tessuto cerebrale dell'AD, è uno strumento prezioso per lo sviluppo di nuovi trattamenti per prevenire la progressione dell'AD. Diversi coloranti di legame amiloide classici, fluorocro, sonde di imaging e anticorpi specifici per l'AO sono stati utilizzati per rilevare l'A - istochimicamente nel tessuto cerebrale dell'AD. L'uso di questi composti per il rilevamento di A - è costoso e richiede molto tempo. Tuttavia, a causa della sua intensa attività fluorescente, dell'alta affinità e della specificità per l'Az, così come le somiglianze strutturali con i coloranti leganti amiloidi tradizionali, la curcumina (Cur) è un promettente candidato per l'etichettatura e l'imaging delle placche A tessuto cerebrale. È un polifenolo naturale dell'erba Curcuma longa. Nel presente studio, Cur è stato utilizzato per etichettare istochimicamente placche di Az sia da un modello murino genetico della malattia di Alzheimer familiare 5x (5xFAD) e dal tessuto umano AD entro un minuto. La capacità di etichettatura di Cur è stata confrontata con i tradizionali coloranti di legame amiloide, come thioflavin-S (Thio-S), Congo rosso (CR) e Fluoro-jade C (FJC), così come gli anticorpi specifici di Az (6E10 e A11). Abbiamo osservato che Cur è il modo più economico e più veloce per etichettare e immagini le placche DiZ rispetto a questi coloranti convenzionali ed è paragonabile agli anticorpi specifici di A . Inoltre, Cur si lega con la maggior parte delle specie di A, come oligomeri e fibrille. Pertanto, Cur potrebbe essere utilizzato come l'agente di rilevamento fluorocro più conveniente, semplice e veloce per le placche A .
Introduzione
Il morbo di Alzheimer (AD) è uno dei disturbi neurologici più comuni, legati all'età e progressivi e una delle principali cause di morte in tutto il mondo1,2. Apprendimento, memoria, e compromissione della cognizione, insieme a disturbi neuropsichiatrici, sono i sintomi comuni manifestati in AD3. Anche se l'eziologia dell'AD non è stata completamente chiarita, le prove genetiche, biochimiche e sperimentali disponibili indicano che la graduale deposizione di Ao è un biomarcatore definitivo per AD4. Questa proteina piegata male si accumula negli spazi intracellulari ed extracellulari ed è pensata per essere coinvolta nella perdita sinaptica, nell'aumento della neuroinfiammazione e nella neurodegenerazione nelle regioni corticali ed ippocampali nel cervello colpite daAD 5. Pertanto, il rilevamento istochimico di A , nel tessuto AD, è un primo passo fondamentale nello sviluppo di farmaci anti-amiloidi non tossici per prevenire la progressione dell'AD.
Nel corso degli ultimi decenni, diversi coloranti e anticorpi sono stati utilizzati da molti laboratori di ricerca per etichettare e immagini le placche A - nel tessuto cerebrale, ma alcuni di questi metodi richiedono molto tempo e i coloranti o gli anticorpi utilizzati sono costosi, richiedendo diversi accessori Prodotti chimici. Pertanto, lo sviluppo di un mezzo economico di rilevamento delle placche di AC nel cervello AD sarebbe un nuovo strumento gradito. Molti laboratori hanno iniziato a utilizzare Cur, un promettente polifenolo naturale anti-amiloide, per l'etichettatura e l'imaging di A, nonché un agente terapeutico per AD6,7,8,9. La sua idropobicità e la natura lofilica, le somiglianze strutturali con i coloranti leganti amiloidi classici, la forte attività fluorescente, così come la forte affinità da legare con l'Az lo rendono un fluoroforo ideale per l'etichettatura e l'imaging delle placche di A . Cur si lega con le placche az e oligomeri e la sua presenza viene rilevata anche negli spazi intracellulari7,11,12,13. Inoltre, è stato dimostrato che una quantità minima di Cur può etichettare le placche affar-Alzheimer familiari 5x (5xFAD)7. Anche se la concentrazione di 1 nM non fornisce l'intensità di fluorescenza ottimale per il conteggio delle placche di Ao, una concentrazione di 10 nM o superiore di Cur fa. Ran e colleghi14 hanno riferito che dosi a partire da 0,2 nM di Cur derivato da difluoroboron sono in grado di rilevare i depositi in vivo di A, quasi come una sonda a infrarossi. Non è ancora chiaro se questa dose sia sufficiente per etichettare le placche di Az nei tessuti. La maggior parte degli studi precedenti ha utilizzato 20-30 min per colorare le placche di Az usando Cur, ma la colorazione ottimale può richiedere molto meno tempo.
Il presente studio è stato progettato per testare il tempo minimo richiesto da Cur per etichettare le placche di Az nel tessuto cerebrale dell'AD e per confrontare la sensibilità per l'etichettatura e l'imaging delle placche di A, dai topi 5xFAD dopo la colorazione con Cur con altri Coloranti leganti a z, come Thioflavin-S (Thio-S), Congo rosso (CR) e Fluoro-jade C (FJC). La capacità di etichettatura di questi classici coloranti di legame amiloide è stata confrontata con la colorazione in sezioni cerebrali coronariche incorporate in paraffina e criostati da topi 5xFAD e da tessuto umano e di controllo del cervello. I risultati suggeriscono che Cur etichetta le placche di Az in modo simile agli anticorpi specifici di A - (6E10) e moderatamente migliore di Thio-S, CR o FJC. Inoltre, quando sono state somministrate iniezioni intraperiteali di topi Cur to 5xFAD per 2/5 giorni, ha attraversato la barriera emato-encefalica e legato con placche ad Ao7. È interessante notare che, le concentrazioni nanomolare di Cur sono state utilizzate per etichettare e l'immagine placche di Ao nel tessuto cerebrale 5xFAD7,14. Inoltre, le placche di A, come le placche di nucleo, neuritiche, diffuse e bruciate, possono essere etichettate da Cur in modo più efficiente rispetto a qualsiasi altro colorante di legame amiloide convenzionale7. Nel complesso, Cur può essere applicato per etichettare e immagini placche az in tessuto cerebrale post-mortem da modelli animali AD e/o tessuto AD umano in modo semplice ed economico, come alternativa affidabile agli anticorpi specifici di A.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Animal Care and Use Committee (ACUC) della Saginaw Valley State University. Il tessuto umano è stato ottenuto da una banca del cervello stabilito presso lo Banner Sun Health Institute in Arizona15,16.
1. Perfusione degli animali
- Preparare i buffer fissativi e perfusione.
- Preparare il buffer di fosfato di sodio da 0,1 M aggiungendo 80 g di cloruro di sodio (NaCl), 2 g di cloruro di potassio (KCl), 21,7 g di fosfato di idrogeno dissodico (Na2HPO4- 7H2O), 2,59 g di fosfato di diidrogeno di potassio (KH2PO4 ), e doppia acqua distillata per un totale di 1 L.
- Preparare il 4% di paraformaldeide (PFA).
- Aggiungere 40 g di paraformaldeide a 1 L di PBS (0,1 M, pH 7,4).
- Riscaldare la soluzione PFA a 60-65 gradi centigradi e mescolare utilizzando un agitatore magnetico.
N.B.: La temperatura non deve superare i 65 gradi centigradi. - Aggiungere alcune gocce di NaOH (1 N) con un contagocce per sciogliere completamente l'APIs.
- Filtrare la soluzione PFA con carta da filtro medio-fine e conservarla a 4 gradi centigradi.
NOTA: La soluzione è valida per un mese.
- Eseguire l'anestesia animale e la perfusione.
NOTA: i topi di controllo B6SJL-Tg APP SwLon, PSEN1-M146L-L286V, 1136799Vas/J (5 x FAD) abbinati all'età (n . 6 per gruppo) sono stati acquistati da venditori e allevati nella casa animali della Saginaw Valley State University. La genotipizzazione è stata confermata dalla reazione a catena della polimerasi (PCR) come descritto in precedenza7. Il tessuto cerebrale dell'AD umana include il tessuto cerebrale dell'AD e il tessuto di controllo corrispondente all'età.- Anestetizzare l'animale con un agente anestetico appropriato, come pentobarbital di sodio (390 mg/kg di peso corporeo), o una miscela di ketamina/xilarina (fino a 80 mg/kg di ketamina e 10 mg/kg di peso corporeo xylazina) per iniezione intraperitoneale (27 G di ago e 1 siringa mL). Controllare il livello di anestesia pizzicando un dito del dito del dito. Se l'animale non risponde, allora è pronto per la chirurgia perfusione.
- Posizionare l'animale anestetizzato nella posizione supina sul vassoio di chirurgia perfusione e utilizzando piccole forbici iride fare un'incisione all'estremità posteriore del ventricolo sinistro.
- Inserire un ago perfusione da 22 G sul ventricolo sinistro e fare una piccola incisione al cauricolo destro per rimuovere il liquido perfusione dal corpo. Utilizzare un sistema di perfusione alimentato a gravità per consentire al fluido di perfusione a freddo ghiaccio (0,1 M PBS, pH 7,4) di fluire per 5 x 6 min (velocità di flusso 20-25 ml/min).
NOTA: Un fegato chiaro è l'indicatore di perfusione ottimale. - Passare la valvola tampone a una soluzione di paraformaldeide 4% ghiacciata per il fissaggio e lasciarla fluire per 8-10 min.
NOTA: Il tremore seguito da arti induriti o rigidi sono indicatori di buona fissazione. - Rimuovere il cervello dal cranio con le forbici. Utilizzando una spatola, raccogliere il cervello e metterlo in una fiala di 4% PFA (almeno 10 volte il volume del volume del cervello) e conservare a 4 gradi centigradi fino a un ulteriore utilizzo.
2. Lavorazione dei tessuti
- Tagliare le sezioni criostati.
- Trasferire il cervello a soluzioni di saccarosio classificato (10%, 20% e 30%) e conservare a 4 gradi centigradi per 24 ore ciascuno, fino all'uso.
- Con un criostato a -22 gradi centigradi, tagliare sezioni spesse 40 m. Raccogliere le 10-20 sezioni per pozzo in un 6 pozzetto riempito con PBS e azide di sodio (0,02%).
- Paraffin incorporare le sezioni per il topo e tessuto cerebrale umano.
- Per le sezioni di paraffina, disidratare il tessuto cerebrale perfuso e 24 h post-fisso con alcool graduato (50%, 70%, 90%) per 2 h ciascuno, seguito da 100% alcol 2x per 1 h ciascuno), e poi con xilene 2x per 1 h ciascuno) a temperatura ambiente.
- Penetrare il tessuto con xylene-paraffina (1:1) 2x per 1 h a 56 gradi centigradi in un flacone conico di vetro ricoperto di foglio di alluminio.
- Immergi il tessuto in paraffina fusa (56 gradi centigradi) per 4/6 h.
- Tagliare 5 sezioni di spessore utilizzando un microtoma rotativo a temperatura ambiente e metterli in un bagno d'acqua di tessuto a 45 gradi centigradi.
- Etichettare istochimicamente le placche di Az nelle sezioni criostat con Cur.
- Risciacquare le sezioni dal passo 2.1.2 con PBS (pH 7.4) 3x per 5 min ciascuno.
- Immergere le sezioni nel 70% di etanolo per 2 min a temperatura ambiente.
- Sciogliere lo stock Cur (1 mM) in metanolo e diluire con il 70% di etanolo per ottenere una concentrazione di lavoro finale di 10 M.
- Immergi le sezioni con la soluzione Cur funzionante per un valore di 1/5 min a temperatura ambiente su uno shaker a 150 giri/mm.
- Scartare la soluzione Cur e lavare con 70% etanolo 3x per 2 min ciascuno.
- Mettere le sezioni su vetrini in vetro rivestito in poli-L-lisina e montare con un coverslip utilizzando supporti di montaggio organici, come distigna plasticizer xylene (DPX).
- Vista al microscopio a fluorescenza utilizzando filtri di eccitazione/emissione a 480/550 nm.
- L'etichetta istochimica delle placche di Az nelle sezioni del topo incorporato in paraffina e del cervello umano con Cur.
- Deparaffinizzare le sezioni di tessuto dal passo 2.2.4 con xilene 2x per 5 min ciascuno a temperatura ambiente.
- Reidratato con soluzioni alcoliche graduate (100%, 80%, 70%, 50% per 1 min ciascuno) e con acqua distillata 2x per 5 min ciascuna a temperatura ambiente.
- Sezioni di macchia con Cur (10m) per 10 min a temperatura ambiente al buio, agitando a 150 giri/m. Lavare con 70%, 90% e 100% alcol per 2 min ciascuno.
- Chiaro con xilene 2x per 5 min ciascuno e cover slip con DPX.
- Visualizza al microscopio a fluorescenza come menzionato al punto 2.3.7.
- Colocalizzano Cur con l'anticorpo di Az nelle placche e negli oligomeri di Ao.
- Lavare le sezioni di criostat dal passo 2.1.2 con PBS 3x in un piatto 12 po ' .
- Bloccare le sezioni con il 10% di siero di capra normale (NGS) sciolto in PBS con 0.5% Triton-X-100 a temperatura ambiente per 1 h.
- Eliminare la soluzione di blocco. Incubare le sezioni con anticorpi specifici per A- (6E10 o A11, diluiti 1:200) disciolti in soluzione di blocco fresco contenente il 10% NGS e lo 0,5% Triton-X100 durante la notte a 4 gradi centigradi in uno shaker a 150 giri/min.
- Eliminare la soluzione anticorpale e lavare le sezioni con PBS 3x per 10 min ciascuna.
- Incubare con il tag anticorpo secondario con fluoroforo rosso (ad esempio, Alexa 594) per 1 h a temperatura ambiente al buio.
- Lavare con PBS 3x per 10 min ciascuno.
- Lavare con il 70% di alcol 1x.
- Incubare le sezioni con Cur (10 M) per 5 min a temperatura ambiente.
- Lavare con 70% alcol 3x per 1 min ciascuno.
- Disidrata con alcool del 90% e 100% per 1 min ciascuno, chiaro con xilene 2x per 5 min ciascuno, e montare su vetrini utilizzando DPX.
- Visualizza utilizzando un microscopio a fluorescenza con filtri di eccitazione/emissione appropriati per i segnali rosso e verde.
- Per la co-localizzazione intracellulare di A- macchia le sezioni che utilizzano l'anticorpo A-a (6E10), il resto con Cur a temperatura ambiente al buio con agitazione a 150 rpm e il controstaina con Hoechst-33342 (1 mg/ml) e/o DAPI (1ug/ml) per 10 min a temperatura ambiente in il buio con agitazione a 150 giri/min. Lavare con PBS 3x.
- Scatta immagini con i filtri rosso, verde e blu con un obiettivo 100x (ingrandimento totale 1.000x).
- Etichettare le targhe A e FJC.
NOTA: i protocolli dettagliati per l'etichettatura Thio-S e CR sono stati precedentemente segnalati7.- Per la colorazione FJC, lavare le sezioni galleggianti libere ottenute dal passaggio 2.1.2 con PBS 3x per 5 min ciascuna.
- Collocare le sezioni in una piastra di 12 pozzetto e macchiare con FJC (0,001%) per 10 min al buio a temperatura ambiente.
- Scartare la soluzione FJC e lavare con PBS 3x per 5 min ciascuno.
- Incubare con cloruro di ammonio (NH4Cl, 50 mM disciolto in PBS) per 10 min a temperatura ambiente.
- Scartare la soluzione NH4Cl e lavare con PBS 3x per 5 min ciascuno.
- Seguendo i passaggi della sezione 2.4, disidratare con soluzioni alcoliche graduate, chiare, montate e visualizzate al microscopio a fluorescenza utilizzando filtri di eccitazione/emissione a 450/520 nm.
Risultati
La curcumina etichetta le placche di Az entro un minuto. Quando abbiamo macchiato il tessuto 5xFAD con Cur, abbiamo scoperto che le placche Cur az sono all'interno di 1 min. Anche se l'aumento del tempo di incubazione con Cur ha leggermente aumentato l'intensità di fluorescenza delle placche di Ao, il numero di placche di Az osservate non era significativamente diverso tra 1 min e 5 min di colorazione (Figura 1).
Cur è in grado di etichettare le placche di Az nel tessuto umano e del topo preparato dalla criostat e dell'AD che si colocalizza con gli anticorpi specifici di Az nel tessuto cerebrale dell'AD. Quando abbiamo macchiato la criosezione, le sezioni incorporate in paraffina (Figura 2A) e il tessuto AD umano (Figura 2B), abbiamo osservato placche di Z- con etichetta ricci in tutti i tipi di sezioni di tessuto. Inoltre, per confermare che Cur è legato alle placche di Aa, abbiamo etichettato prima le placche con 6E10, seguite da Colorazione cur. Abbiamo osservato che il Cur era completamente co-localizzato con A , alle stesse placche che legavano il 6E10 (Figura 2C).
Gli oligomeri di Ae e gli aggregati intracellulari di Ao. Per verificare se Cur potesse etichettare gli oligomeri di A- oligomeri, le sezioni del topo 5xFAD sono state macchiate con un anticorpo specifico dell'oligomero A (A11), seguito da Colorazione Cur. Abbiamo osservato che Cur colocalizzato con A11 nelle placche di A.. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Allo stesso modo, Cur ha anche colocalizzato con l'anticorpo 6E10 negli spazi intracellulari (Figura 3B), indicando che può etichettare l'As.
Cur etichettato A - più prominente di coloranti di legame amiloide classico. L'etichettatura di Ae di Cur è stata confrontata con i coloranti di rilegatura amiloide Thio-S, CR, FJC disponibili in commercio. L'anticorpo 6E10 è stato utilizzato come controllo standard. Abbiamo osservato che Cur ha etichettato l'AO in modo più prominente rispetto ai tradizionali coloranti di legame amiloide (Figura 4).
Cur derivati bis-demethoxycurcumin (BDMC) e demethoxycurcumin (DMC), presenti anche in estratto di curcuma, etichettano placche di Az comparativamente a Cur nel tessuto cerebrale 5xFAD. Altri due componenti principali, come BDMC e DMC, sono presenti nell'estratto di curcuma. Abbiamo testato se questi due composti etichettano anche le placche di Az simili a Cur. Quando le sezioni del cervello del topo 5xFAD sono state macchiate con questi derivati, sia BDMC che DMC hanno anche etichettato le placche di A, parallelamente a Cur (Figura 5A). Diversi supporti di montaggio sono stati studiati per verificare la presenza di interferenze con l'imaging A dopo la colorazione con Cur. Il segnale fluorescente era intatto sia nel supporto di montaggio acquoso che organico, come il DPX (Figura 5B). La colorazione delle placche di Az con Cur era appropriata dopo l'etichettatura immunofluorescente e seguita dalla controtendenza con la soluzione Hoechst 33342 (1 mg/ml) o 4,6-diamidino-2-phenylindole (DAPI, 1g/ml). I segnali immunofluorescenti e l'intensità di controstatura sono stati mantenuti dopo la colorazione del cur(Figura 5C).

Figura 1: La curcumina etichetta le placche di A , in un minuto. A). le sezioni cerebrali di topi 5xFAD o controllo umano e il tessuto corticale ad DiC sono stati macchiati con Cur (10 m) per 1/5 min e il numero di placche visibili è stato contato. (B). Non è stata osservata alcuna differenza nel numero di conteggi di placca A tra i tempi di colorazione di 1 min e 5 min. I dati sono rappresentati come media: errore standard di media (SEM). Fare clic qui per visualizzare una versione più grande di questa figura.
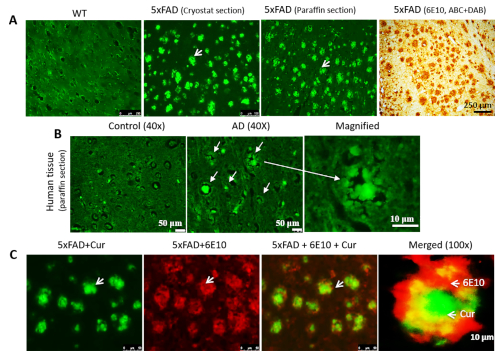
Figura 2: Colocalizzazione di Cur con anticorpo di Az nelle placche di A. Cur può etichettare le placche di Az in sezioni preparate in criostat, con paraffina incorporata (A) e nel tessuto ad Ad umano (B). L'etichettatura di Ao parallela all'etichettatura con anticorpo specifico di Az (6E10, colorazione DAB). (C). Le sezioni 5xFAD sono state etichettate per la prima volta con l'anticorpo di A-A10, seguito dalla colorazione con Cur. Rosso : 6E10 vincolato da un anticorpo secondario etichettato con Alexa fluorophore 594. Verde - Cur. Cur completamente colocalizzato con A , alle stesse placche che rilegavano a 6E10. Le frecce indicano le placche di A. La barra di scala indica 50 m (ingrandimento totale : 400x) in tutte e tre le immagini a sinistra e 10 m (ingrandimento totale: 400x). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: La curcumina etichetta gli oligomeri di Aee e l'Az intracellulare. (A) È stato rilevato immunohistochimico per l'oligomero utilizzando un anticorpo specifico per l'AA (A11), seguito dalla colorazione con Cur. Cur completamente colocalizzato con A . Barra di scala: 250 m e ingrandimento totale: 100x. (B) Allo stesso modo, è stato rilevato immunohistochimico intracellulare utilizzando un anticorpo specifico per l'AO (6E10), seguito dalla colorazione con Cur. Si noti che Cur completamente colocalizzato con A , nelle stesse aree associate a 6E10. Barra della scala: 50 m e ingrandimento totale: 1.000x. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Confronto tra diversi coloranti di legame amiloide con Cur per etichettare le placche az. Le sezioni di criostat (40 m) della corteccia di topi 5xFAD di 12 mesi erano macchiate con Cur, Thioflavin-S, Congo rosso, Fluoro-jade C, e con 6E10 anticorpi. Le targhe di Ao-S, CR e FJC hanno etichettato in modo più evidente le targhe di Ao-S. Le frecce indicano le placche di A. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Cur-derivati bis-demethoxy curcumina e curcumina demethoxy anche etichettare A , in modo simile a Cur. (A) Sia le sezioni 5xFAD criostat che di paraffina sono state macchiate con cur-derivati cur-derivati curcumina e curcumina demethoxy. Entrambi questi derivati etichettano le placche di Az in modo simile a Cur. (B) Sia il supporto di montaggio acquoso che organico (DPX) è stato utilizzato per montare sezioni di tessuto dopo l'etichettatura delle placche di Az con Cur. (C) Le sezioni immunoetichettate sono state utilizzate per l'etichettatura di Az con Cur. Le frecce bianche indicano le placche di A, la freccia verde indica l'astrocito attivato (GFAP) e la freccia gialla indica la macchia nucleare (DAPI). Barre di scala : 100 m. Fare clic qui per visualizzare una versione più grande di questa figura.
| Caratteristiche | Anticorpi a z | Curcumina | Thio-S | Rosso Congo | Fluoro-Jade C |
| Durata della colorazione | 24-48 h | 1-5 min | 10 min | 60 min | 30 dollari min |
| Prodotti chimici accessori | Anticorpi secondari, diverse sostanze chimiche per fare tampone, siero di capra normale | metanolo | alcol m etilico | NaOH ed etanolo | NaOH ed etanolo, permanganato di potassio |
| costo | Costoso: una fiala anticorpo specifica per la A | Economico: 5-10/1 g di Cur e può essere applicato per molti tessuti | Economico: 5/1 g di euro, può essere applicato per pochi tessuti | Efficace in termini di costi: > 5/1 g rosso Congo, e può essere applicato per diversi tessuti | Costoso: polvere FJC da 15,500 USD/1 g |
| Specificità | Sono necessari diversi anticorpi per oligomeri e fibrille di A | La curcumina si lega con oligomeri e fibrille di Az | Può legare solo fibrille, non monomeri, o oligomeri | Può essere legare solo con i protofibrille e le fibrille16,17 | Può legarsi solo con le fibrille a z e i neuroni degenerati |
| Stabilità | A seconda del tinrieto attaccato all'anticorpo secondario | Molto stabile, anche a temperatura ambiente quando legato con | Stabile nel metanolo | Stabile in etanolo | Non stabile |
| Cura dopo la colorazione | Ha bisogno di cure extra dopo la colorazione, come essere tenuti al buio e congelati tutto il tempo | Non così sensibile alla luce e più stabile a temperatura ambiente | Sensibile alla luce | Non sensibile alla luce | Sensibile alla luce |
| Microscopio richiesto | Luce composta o fluorescente (a seconda dell'uso di anticorpi secondari) | fluorescente | fluorescente | Microscopio luminoso o microscopio polarizzato o filtro polarizzo polarizzo | fluorescente |
| Colorazione di sfondo | In generale, nessun background | Sfondo molto basso | Elevato sfondo dovuto al legame con membrana lipidide o composti lipidici nelle cellule | Sfondo basso | Sfondo alto |
| Imaging a z in vivo | Potrebbe non essere applicabile | Altamente applicabile | Potrebbe non essere applicabile | Potrebbe non essere applicabile | Potrebbe non essere applicabile |
Tabella 1: Confronto dell'etichettatura di A-A con diversi coloranti di legame amiloide e Cur7.
Discussione
La nostra ipotesi era che Cur potesse essere usato come il modo più veloce, semplice e meno costoso per etichettare e immaginile le placche A e az nel tessuto cerebrale dell'AD postmortem rispetto ad altri coloranti di legame amiloide classici, così come gli anticorpi specifici di Az. Gli obiettivi di questo studio erano determinare il tempo minimo necessario per etichettare e immagini le placche di Az da Cur nel tessuto cerebrale post mortem AD e determinare se Cur può essere utilizzato come alternativa agli anticorpi di Az per l'etichettatura delle placche di A . A tal fine, è stata osservata la capacità di etichettatura A di Cur in diversi momenti. Cur è stato in grado di etichettare la As in un minuto. Inoltre, l'etichettatura dell'Ao da parte di Cur è stata maggiore rispetto ad altri coloranti di legame amiloide convenzionali, come Thio-S (0,1%), CR (1%) e FJC (0,001%).
Cur è considerato un fluoroforo unico e ideale per l'etichettatura di Ao, perché ha la maggior parte delle caratteristiche possedute dalla maggior parte dei coloranti di legame amiloide convenzionali, comprese le proprietà strutturali, fisiche, chimiche e biologiche10. Inoltre, a causa della convenienza, la maggior parte dei ricercatori sono interessati a utilizzare questo polifenolo naturale. Per mostrare la specificità del legame di Cur alle placche e agli oligomeri di Az, abbiamo usato 6E10 e A11 (anticorpo specifico dell'oligomero). Cur ha mostrato una co-localizzazione quasi completa con tutte le diverse specie di A, presenti nel tessuto, il che suggerisce che Cur è altamente specifico per A, 17,18,19,20. Inoltre, gli oligomeridi Cur (Figura 3A) e gli aggregati intracellulari (Figura 3B) e colocalizzati con gli anticorpi di A , suggerendo che Cur può etichettare non solo placche extracellulari di ao, ma anche depositate negli spazi intracellulari7.
Nel corso degli ultimi decenni, sono stati sviluppati diversi fluorofori e anticorpi per etichettare e immagini placche A istochetamente. Indubbiamente, la maggior parte di loro sono molto specifici per le specie di Ao mirate e per rilevare le placche di A, ma queste sono molto più costose e il loro uso è più lungo rispetto all'utilizzo di Cur. Ad esempio, abbiamo confrontato il legame della placca A-A da Cur, con altri coloranti di legame amiloide, come Thio-S, CR e FJC, dove l'anticorpo specifico dell'AA (6E10) è stato utilizzato come controllo di riferimento. Questi risultati suggeriscono che Cur etichetta le placche di Az più forte di qualsiasi altro fluoroforo. Ancora più importante, rispetto a Cur, alcuni dei fluorofori più comunemente usati hanno svantaggi distinti in termini di etichettatura e imaging a . Ad esempio, Thio-S può produrre uno sfondo alto e distratto perché si lega con membrane lipidiche o composti lipidici nella cella21. Allo stesso modo, la CR, che è comunemente usata per etichettare la ao, produce birefranazione verde mela (Figura 4) al microscopio polarizzato. Il CR non etichetta le placche A s con la stessa tempestività di Cur o Thio-S, etichettando significativamente meno placche di Ao rispetto a quelle rilevate da Cur7,22,23. Gutierrez et al. ha riferito che FJC, che può legarsi con A e con neuroni degenerati, etichette a una frequenza inferiore a Cur o Thio-S24. Questi risultati suggeriscono che questi marcatori classici comunemente usati hanno meno affinità per il legame alle placche di Az rispetto a Cur.
Inoltre, l'etichettatura di diversi tipi di placca az (core, neuritico, diffuso, bruciato) può essere ottimizzata con Cur, piuttosto che con altri fluorofori leganti amiloidi, perché Cur può aiutare a visualizzare e distinguere le placche a altre tecniche non riescono a distinguere questi sottotipi morfologici7. Allo stesso modo, l'uso di anticorpi specifici per l'AO, che sono molto specifici per le diverse specie di Ao, è molto costoso e richiede molto tempo, prendendo almeno 24-48h tramite immunosofia. Inoltre, il rilevamento di diverse specie di A, richiede diversi anticorpi, così come diverse sostanze chimiche accessorie, il che aumenta significativamente il costo totale. Chiaramente, Cur è meno costoso, più facilmente disponibile, e produce una maggiore intensità di fluorescenza quando si lega alle placche di A. Sebbene la CR sia anche una tecnica relativamente conveniente per l'etichettatura e l'imaging delle placche A, Cur può legare ed etichettare maggiormente la specie A, come gli oligomeri25 (Figura 3 e Figura 4),mentre la CR si lega solo a i protofibrile e fibrils23. Di conseguenza, l'etichettatura A - con Cur può essere ottenuta in modo più efficiente ed economico rispetto a Thio-S, CR o FJC (Tabella 1).
In sintesi, Cur è in grado di rilevare le placche di A e gli oligomeri dal tessuto cerebrale dell'AD in modo efficace, rapido ed economico. Inoltre, il legame della cur all'AA è molto specifico e la sua attività fluorescente è molto stabile. Richiede un'importo minimo (1-10 nM) per etichettare la A. Inoltre, Cur è anche molto specifico per le diverse specie di A, come fibrille o placche, così come oligomeri7. Allo stesso modo, i derivati Cur demethoxycurcumin e bisdemethoxycurcumin accorrono anche proprietà leganti amiloidi e c etichetta in modo simile a Cur10 (Figura 5A). Pertanto, Cur è un fluoroforo ideale per l'etichettatura e l'imaging di placche di Az nel tessuto cerebrale post-mortem. Può essere utilizzato come alternativa rapida e facile per rilevare il carico di placca di Ao dopo la terapia anti-amiloide in modelli animali sperimentali di AD. I nostri risultati confermano le segnalazioni dell'elevata affinità di Cur to A, rafforzando il suo potenziale utilizzo per il monitoraggio delle placche A nel cervello post-mortem e nei tessuti viventi.
Per un'etichettatura ottimale della curing si raccomanda di non etichettare la Ao con la Cur nel tessuto non perfuso e di evitare l'immagazzinamento dei tessuti a lungo termine, in quanto può produrre una maggiore quantità di sfondo, anche quando è perfuso. Per la colabeling, si raccomanda di completare l'immunohistochimica prima con l'anticorpo specifico utilizzato prima della colorazione con Cur e poi seguire questo con contro-colorazione utilizzando DAPI o Hoechst.
Possibili modifiche a questo metodo includono l'aumento del tempo di incubazione di Cur con il tessuto fino a 30 min, che non interferirà con l'intensità del segnale, anche se può aumentare lo sfondo durante l'imaging. La riduzione della concentrazione di Cur a meno di 10 m non interferisce nell'etichettatura di Aa a un livello significativo. Per ridurre lo sfondo per il tessuto cerebrale umano, potrebbe essere applicato un metodo di preparazione alternativo. Ad esempio, le sezioni cerebrali potrebbero essere inizialmente trattate con lo 0,3% (w/v) Sudan Black B nel 70% di etanolo (v/v) per 10 min a temperatura ambiente. Poi la sezione potrebbe essere macchiata con Cur per 10 min a temperatura ambiente, e lavata con PBS 3x per 15 min, controcolorato, e montato con supporti antifading13. Gli spessori della sezione Criostat potrebbero anche essere ridotti a 20-25 m.
Le potenziali avvertenze a questo metodo includono il legame cur con l'Ao presente nei vasi sanguigni, che è diverso dalle placche extracellulari di Ao. Pertanto, l'investigatore dovrebbe essere a conoscenza della morfologia delle placche e degli oligomeri di A nei vasi sanguigni. L'investigatore deve essere a conoscenza dei segnali autofluorescenti. Sfondo verde in eccesso può essere visto occasionalmente dopo la colorazione Cur, ma questo può essere ridotto diminuendo il tempo di colorazione o diminuendo la concentrazione di Cur. Infine, il segnale di coetichettatura con altri marcatori può essere ridotto a causa di ripetuti trattamenti con l'agente di compensazione (ad esempio, xilene).
Importanti limitazioni includono l'incapacità di coetichettare con qualsiasi proteina marcatore utilizzando anticorpi secondari etichettati con colorante fluorescente verde, come l'isotoniato fluorescente (FITC). Questi non possono essere utilizzati a causa della simile eccitazione/emissione di Cur. Inoltre, nelle prime fasi dell'AD, solo quantità limitate di A , possono essere etichettate da Cur. Infine, c'è la necessità di lavorare in ambiente buio come qualsiasi coloranti fluorescente.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il sostegno a questo studio è venuto dal Field Neurosciences Institute di Ascension of St. Mary's.
Materiali
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole (DAPI) | IHC world, Woodstock, MD | ||
| Aanimal model of Alzheimer's disease | Jackson's laboratory, Bar Harbor, ME | ||
| Absolute alcohol | VWR,Radnor, PA | ||
| Alexa 594 | Santacruz Biotech, Dallas, TX | ||
| Antibody 6E10 | Biolegend, San Diego, CA | ||
| Antibody A11 | Millipore, Burlington, MA | ||
| Compound light microscope | Olympus, Shinjuku, Japan | Olympus BX51 | |
| Congo red | Sigma, St. Louis, MO | ||
| Cryostat | GMI, Ramsey, MN | LeicaCM1800 | |
| Curcumin | Sigma, St. Louis, MO | ||
| Disodium hydrogen phosphate | Sigma, St. Louis, MO | ||
| Dystyrene plasticizer xylene | BDH, Dawsonville, GA | ||
| Filter papers | Fisher scientific, Pittsburgh, PA | ||
| Hoechst-33342 | Sigma, St. Louis, MO | ||
| Inverted fluorescent microscope | Leica, Buffalo Grove, IL | Leica DMI 6000B | |
| Inverted fluorescent microscope | Olympus, Shinjuku, Japan | Olympus 1x70 | |
| Normal goat serum | Sigma, St. Louis, MO | ||
| Paraffin | Sigma, St. Louis, MO | ||
| Paraformaldehyde | Sigma, St. Louis, MO | ||
| Ploy-lysine coated charged glass slide | Globe Scientific Inc, Mahwah, NJ | ||
| Potassium chloride | Sigma, St. Louis, MO | ||
| Potassium dihydrogen phosphate | Sigma, St. Louis, MO | ||
| Sodium azide | Sigma, St. Louis, MO | ||
| Sodium chloride | Sigma, St. Louis, MO | ||
| Sodium hydroxide | EMD Millipore, Burlington, MA | ||
| Sodium pentobarbital | Vortex Pharmaceuticals limited, Dearborn, MI | ||
| Thioflavin-S | Sigma, St. Louis, MO | ||
| Triton-X-100 | Sigma, St. Louis, MO | ||
| Xylene | VWR,Radnor, PA |
Riferimenti
- Cummings, J. L. Alzheimer's disease. New England Journal of Medicine. 351 (1), 56-67 (2004).
- Jack, C. R., Holtzman, D. M. Biomarker modeling of Alzheimer's disease. Neuron. 80 (6), 1347-1358 (2013).
- Tarawneh, R., Holtzman, D. M. The clinical problem of symptomatic Alzheimer disease and mild cognitive impairment. Cold Spring Harbor Perspectives in Medicine. 2 (5), (2012).
- Selkoe, D. J. Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature Cell Biology. 6 (11), 1054-1061 (2004).
- Hardy, J., Allsop, D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends in Pharmacological Sciences. 12 (10), 383-388 (1991).
- Chen, M., et al. Use of curcumin in diagnosis, prevention, and treatment of Alzheimer's disease. Neural Regeneration Research. 13 (4), 742-752 (2018).
- Maiti, P., et al. A comparative study of dietary curcumin, nanocurcumin, and other classical amyloid-binding dyes for labeling and imaging of amyloid plaques in brain tissue of 5x-familial Alzheimer's disease mice. Histochemistry and Cell Biology. 146 (5), 609-625 (2016).
- Maiti, P., Dunbar, G. L. Use of Curcumin, a Natural Polyphenol for Targeting Molecular Pathways in Treating Age-Related Neurodegenerative Diseases. International Journal of Molecular Sciences. 19 (6), (2017).
- Maiti, P., Dunbar, G. L. Comparative Neuroprotective Effects of Dietary Curcumin and Solid Lipid Curcumin Particles in Cultured Mouse Neuroblastoma Cells after Exposure to Abeta42. International Journal of Alzheimer's Disease. , (2017).
- den Haan, J., Morrema, T. H. J., Rozemuller, A. J., Bouwman, F. H., Hoozemans, J. J. M. Different curcumin forms selectively bind fibrillar amyloid beta in post mortem Alzheimer's disease brains: Implications for in-vivo diagnostics. Acta Neuropathologica Communications. 6 (1), 75(2018).
- Koronyo, Y., et al. Retinal amyloid pathology and proof-of-concept imaging trial in Alzheimer's disease. JCI Insight. 2 (16), (2017).
- Koronyo, Y., Salumbides, B. C., Black, K. L., Koronyo-Hamaoui, M. Alzheimer's disease in the retina: imaging retinal abeta plaques for early diagnosis and therapy assessment. Neurodegenerative Diseases. 10 (1-4), 285-293 (2012).
- Koronyo-Hamaoui, M., et al. Identification of amyloid plaques in retinas from Alzheimer's patients and noninvasive in vivo optical imaging of retinal plaques in a mouse model. NeuroImage. 54 (Suppl 1), S204-S217 (2011).
- Ran, C., et al. Design, synthesis, and testing of difluoroboron-derivatized curcumins as near-infrared probes for in vivo detection of amyloid-beta deposits. Journal of the American Chemical Society. 131 (42), 15257-15261 (2009).
- Beach, T. G. The Sun Health Research Institute Brain Donation Program: Description and Experience, 1987-2007. Cell Tissue Bank. 9 (3), 229-245 (2008).
- Green, S. J., Killiany, R. J. Subregions of the inferior parietal lobule are affected in the progression to AD. Neurobiology of Aging. 31 (8), 1304-1311 (2010).
- Ono, K., Hasegawa, K., Naiki, H., Yamada, M. Curcumin has potent anti-amyloidogenic effects for Alzheimer's beta-amyloid fibrils in vitro. Journal of Neuroscience Research. 75 (6), 742-750 (2004).
- Garcia-Alloza, M., Borrelli, L. A., Rozkalne, A., Hyman, B. T., Bacskai, B. J. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry. 102 (4), 1095-1104 (2007).
- Mutsuga, M., et al. Binding of curcumin to senile plaques and cerebral amyloid angiopathy in the aged brain of various animals and to neurofibrillary tangles in Alzheimer's brain. Journal of Veterinary Medical Science. 74 (1), 51-57 (2012).
- Tei, M., Uchida, K., Mutsuga, M., Chambers, J. K., Nakayama, H. The binding of curcumin to various types of canine amyloid proteins. Journal of Veterinary Medical Science. 74 (4), 481-483 (2012).
- Liu, L., Komatsu, H., Murray, I. V., Axelsen, P. H. Promotion of amyloid beta protein misfolding and fibrillogenesis by a lipid oxidation product. Journal of Molecular Biology. 377 (4), 1236-1250 (2008).
- Wu, C., Scott, J., Shea, J. E. Binding of Congo red to amyloid protofibrils of the Alzheimer Abeta(9-40) peptide probed by molecular dynamics simulations. Biophysical Journal. 103 (3), 550-557 (2012).
- Wu, C., Wang, Z., Lei, H., Zhang, W., Duan, Y. Dual binding modes of Congo red to amyloid protofibril surface observed in molecular dynamics simulations. Journal of the American Chemical Society. 129 (5), 1225-1232 (2007).
- Gutierrez, I. L., et al. Alternative Method to Detect Neuronal Degeneration and Amyloid beta Accumulation in Free-Floating Brain Sections With Fluoro-Jade. ASN Neuro Methods. 10, 1-7 (2018).
- Yang, F., et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo. Journal of Biological Chemistry. 280 (7), 5892-5901 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon