Method Article
Avaliando a viabilidade celular e morte em 3D culturas esferóides de células cancerosas
Neste Artigo
Resumo
Aqui, nós apresentamos diversos métodos simples para avaliar a viabilidade e a morte em spheroids da pilha de cancro 3D, que imitam os gradientes physico-químicos de tumores in vivo muito melhor do que a cultura 2D. O modelo esferóide, portanto, permite a avaliação da eficácia do câncer de drogas com melhor tradução para as condições in vivo.
Resumo
Os esferoides tridimensionais de pilhas de cancro são ferramentas importantes para telas da droga do cancro e para ganhar a introspecção mecanicista na biologia da pilha de cancro. O poder desta preparação encontra-se em sua habilidade de imitar muitos aspectos das condições in vivo dos tumores ao ser rápido, barato, e versátil bastante permitir a seleção relativamente high-throughput. As condições da cultura esferóide podem recapitular os gradientes físico-químicos em um tumor, incluindo a crescente acidez extracelular, o aumento do lactato e a diminuição da disponibilidade de glicose e oxigênio, da periferia esferóide ao seu núcleo. Também, as propriedades mecânicas e as interações Cell-Cell de tumores in vivo são em parte imitada por este modelo. As propriedades específicas e, consequentemente, as condições ideais de crescimento, de esferóides 3D, diferem amplamente entre diferentes tipos de células cancerosas. Além disso, a avaliação da viabilidade celular e morte em esferóides 3D requer métodos que diferem em parte daqueles empregados para culturas 2D. Aqui nós descrevemos diversos protocolos para preparar esferoides 3D de pilhas de cancro, e para usar tais culturas para avaliar a viabilidade e a morte da pilha no contexto de avaliar a eficácia de drogas anticâncer.
Introdução
O uso de modelos de esferóide multicelular na biologia do câncer é de várias décadas1,2, mas ganhou um impulso substancial nos últimos anos. Em grande parte, isso reflete o aumento da consciência de quão fortemente o fenótipo das células cancerosas é dependente do seu microambiente e condições de crescimento específicas. O microambiente em tumores sólidos é fundamentalmente diferente do que nos tecidos normais correspondentes. Isso inclui condições físico-químicas como pH, tensão de oxigênio, bem como pressão intersticial, gradientes de concentração de fatores solúveis, como nutrientes, resíduos e compostos de sinalização secretados (fatores de crescimento, citocinas). Além disso, inclui a organização da matriz extracelular (ECM), interações célula-célula e sinalização intercelular, e outros aspectos da arquitetura tridimensional (3D) particular do tumor3,4, 5,6. As condições microambientais específicas em que as células cancerosas existem, afetam profundamente seu perfil de expressão gênica e propriedades funcionais, e é claro que, em comparação com a das células cultivadas em 2D, o fenótipo de esferóides 3D muito mais estreitamente imita o dos tumores in vivo7,8,9,10,11. os modelos 2D, mesmo se empregam a hipóxia, o pH ácido, e as concentrações elevadas do lactato para imitar aspectos conhecidos do microambiente do tumor, ainda não conseguem capturar os gradientes de parâmetros physico-químicos que levantam-se dentro dos tumores, assim como seu tumor 3D Arquitetura. Por outro lado, os modelos animais são dispendiosos, lentos e eticamente problemáticos, e geralmente, também têm deficiências na sua capacidade de recapitular as condições do tumor humano. Consequentemente, os esferóides 3D têm sido aplicados como um modelo de complexidade intermediária em estudos de uma ampla gama de propriedades da maioria dos cânceres sólidos9,11,12,13, 14,15,16,17.
Um uso amplamente empregado de esferóides 3D está em ensaios de triagem da eficácia da terapia anticâncer9,18,19,20. As respostas ao tratamento são particularmente sensíveis ao microambiente tumoral, refletindo tanto o impacto da tortuosidade, a difusão restrita, a alta pressão intersticial, quanto o pH ambiental ácido na entrega de fármacos, e o impacto da hipóxia e outros aspectos do microambiente na resposta de morte celular9,17. Porque o ambiente dentro de esferoides 3D inerentemente desenvolve todas essas propriedades7,8,9,10,11, empregando culturas de células 3D pode melhorar substancialmente a tradução dos resultados para as condições in vivo, mas permitir uma triagem eficiente e acessível de alta taxa de transferência do crescimento líquido. No entanto, a grande maioria dos estudos sobre a resposta medicamentosa das células cancerosas ainda são realizadas em condições 2D. Isso provavelmente reflete que, enquanto alguns ensaios podem ser relativamente facilmente implementados para culturas de células 3D, muitos, como ensaios de viabilidade, western blotting, e análise de imunofluorescência, são muito mais convenientemente feito em 2D do que em 3D.
O objetivo do presente trabalho é fornecer ensaios facilmente amáveis e protocolos precisos para análises do efeito do tratamento com medicamentos anticancerígenos sobre a viabilidade de células cancerosas e sobrevivência em um tumor 3D que imita o ajuste. Especificamente, fornecemos e comparamos três métodos diferentes para a formação de esferóides, seguidos de métodos para análises qualitativas e quantitativas de crescimento, viabilidade e resposta a medicamentos.
Protocolo
1. geração de spheroids
- Preparando suspensões de células para formação de esferóides
Nota: as linhas celulares diferentes têm propriedades de adesão muito diferentes e o protocolo de formação de esferóide mais adequado deve ser estabelecido em cada caso. Nós encontramos que as pilhas de MCF-7 e de bxpc-3 são apropriadas para a formação esferóide espontânea, quando MDA-MB-231, skbr-3, Panc-1 e miapaca exigirem a adição de membrana reconstituída do porão para dar forma com sucesso a spheroids. Somente as pilhas de MDA-MB-231 e de BxPC-3 foram empregadas para o protocolo de gota de suspensão, porém outras linhas de pilha são certamente aplicáveis.- Cresça as células como monocamada até 70-80% de confluência.
- As células de lavagem com tampão fosfato salina (1X PBS, 5 mL para um 25 cm2 ou 10 ml para um 75 cm2 balão), adicionar a célula dissociação enzimática (0,5 ml para um 25 cm2 ou 1 ml para um 75 cm2 balão) e incubar as células para 2-5 min a 37 ° c em 5% CO2 e 95% umidade.
- Verific o destacamento da pilha um microscópio e neutralizar a enzima da dissociação da pilha adicionando o meio de crescimento (soro de 6-10% dependendo da linha de pilha) a um volume total de 5 ml em uns 25 cm2 ou 10 ml para um balão de 75 cm2 .
- Use uma câmara de Bürker para contar pilhas e para contar 8 quadrados na câmara por a preparação da pilha para obter uma reprodutibilidade elevada do tamanho dos spheroids.
Nota: Três protocolos cada um descrevendo um método diferente para a formação do esferóide são apresentados abaixo. O protocolo 1,2 e o 1,3 podem ser usados para todos os protocolos analíticos subseqüentes apresentados, visto que o protocolo 1,4 é serido melhor para preparações da incorporação e do lisado. Dependendo da linha celular, a formação de esferóides leva 2-4 dias, independentemente do método utilizado.
- Formação esferóide espontânea
- Execute etapas 1.1.1-1.1.4.
- Diluir a suspensão celular em um tubo de 15 mL para obter 0,5-2 x 104 células/ml (a densidade celular ideal precisa ser determinada para cada linha celular) (Figura 1a (II)).
- Encha o anel externo de poços com 1X PBS ou meio de crescimento para reduzir a evaporação dos poços restantes. Transfira a suspensão da célula para um reservatório estéril e, utilizando uma pipeta multicanal, dispense 200 μL/poço em placas de fundo redondo de encaixe Ultrabaixa 96-well (Figura 1a (III)).
- Incubar a placa em uma incubadora em 37 ° c com 5% CO2, 95% umidade.
- Cada 2-3 dias adquirem imagens microscópicas claras dos esferóides.
Nota: As imagens neste papel são tomadas na ampliação 11.5 x, que é apropriada para a maioria de esferoides preparados usando estes protocolos. - A cada 2-3 dias (após a aquisição de imagens) substitua 100 μL de meio (remova 100 μL do meio gasto e substitua por 100 μL de meio fresco.
Nota: Para evitar a remoção de esferóides ao substituir o meio, é aconselhável inclinar a placa um pouco enquanto lentamente removendo o meio e inspecionar o meio aspirado nas pontas para esferóides visíveis antes de descartá-lo.
- Formação esferóide membrana-negociada reconstituída do porão.
Nota: foi utilizado o vírus da lactose desidrogenase elevante (LDEV)-livre redução do fator de crescimento reconstituído de membrana basal (rBM). rBM é temperatura-sensível e deve sempre ser mantido no gelo, porque coagirá se alcanga 15 ° c. Descongelar o rBM no gelo durante a noite a 4 ° c ou 2-4 h à temperatura ambiente (RT) antes do chapeamento.- Thaw rBM no gelo (ver tabela de materiais).
- Mantenha as placas e reservatórios (se embalados individualmente) no gelo antes de usar.
- Execute etapas 1.1.1-1.1.4.
- Encha o anel externo de poços com 1X PBS ou meio de crescimento para reduzir a evaporação dos poços restantes. Diluir a suspensão celular em um tubo de 15 mL para obter 0,5-2 x 104 células/ml (a densidade celular ideal precisa ser determinada para cada linha celular) (Figura 1a (II)).
- Coloque o tubo de 15 mL contendo a suspensão celular diluída no gelo (por exemplo, na taça de vidro) (Figura 1a (IIA)).
- Transfira as placas refrigeradas e os reservatórios para o capô. Enxágüe recipientes plásticos, encha-os com o gelo e transfira-os na capa para permitir que as placas e os reservatórios sejam coloc no gelo durante o procedimento inteiro.
- Resuspend rBM suavemente para garantir um gel homogêneo.
- Adicionar 1-2% rBM (a concentração óptima precisa de ser determinada para cada linha celular) às suspensões refrigeradas da pilha (Figura 1a (IIB)).
- Inverta o tubo de 15 mL para assegurar a mistura adequada de rBM e suspensão celular antes de dispensar a suspensão na chapa.
- Transfira a suspensão de células contendo rBM para um reservatório estéril e dispense 200 μL/poço em placas refrigeradas de baixo valor 96-well com uma pipeta multicanal (Figura 1a (III)).
Nota: Se trabalhar com várias suspensões celulares (por exemplo, mais de uma linha celular), é essencial dispensar cada suspensão celular imediatamente após a adição de rBM para evitar o gelamento prematuro. - Centrifugue a placa por 15 min em 750 x g usando ' soft decente '/no travagem (se possível, centrifugar a 4 ° c para manter o fluido RBM mais longo, mas não um requisito para a formação de esferóide bem sucedido), para garantir que as células estão agrupadas quando o RBM endurece, facilitando a formação de um único esferóide.
- Incubar a placa em uma incubadora (37 ° c, 5% CO2, 95% umidade).
- Cada 2-3 dias adquirem imagens microscópicas claras para avaliação do crescimento esferóide.
- A cada 2-3 dias substitua 100 μL de meio (remova 100 μL e substitua por 100 μL de meio fresco).
- Spheroids pendurados da gota.
- Execute a etapa 1.1.1-1.1.4.
- Diluir as células para obter uma diluição adequada. Uma diluição prática é 50.000 células/mL.
- Retire a tampa de um prato de cultura de 10 cm2 células e colocá-lo para que ele enfrenta para cima. Adicionar 6 mL de 1X PBS ao prato (Figura 1B (i)).
- Despeje a suspensão celular em um reservatório estéril e coloque cuidadosamente até 30 gotas de 40 μL de suspensão celular na tampa do prato de cultura celular usando uma pipeta multicanal (Figura 1B (II)), resultando em uma concentração de 2.000 células/gota. Evite colocar as gotas muito perto da borda da tampa como estas gotas são mais propensos a perder a tensão superficial ao inverter a tampa na etapa seguinte.
- Inverta a tampa em um movimento rápido mas controlado e coloque-o em cima do prato de cultura celular contendo 1X PBS (Figura 1B (III)).
- Coloque o prato em uma incubadora a 37 ° c com 5% de CO2 e 95% de umidade sem perturbar as gotas e deixá-los crescer por 4-6 dias.
- Se a ser utilizado para a proteína lisados ou incorporação, esferoides piscina, removendo a tampa e incliná-lo, a fim de lavar as gotas com 1 ml de meio aquecido. Transfira o meio resultante contendo esferóides para um tubo de 1,5 mL e permita que eles se instalem na parte inferior do tubo. Proceder como descrito em 4,4 e 6.2.2 para proteínas lisados e incorporação, respectivamente.
2. tratamento medicamentoso de spheroids
Nota: O tratamento a longo prazo da droga pode ser aplicado aos esferoides a fim telar para efeitos de uma droga do interesse. Antes de iniciar o tratamento medicamentoso, é aconselhável realizar um experimento de resposta da dose do (s) fármaco (es), a fim de encontrar uma dose adequada para o tratamento experimental. As doses devem basear-se na determinada IC50/ki da droga e variam de cerca de 0,2 x-10x deste valor.
- Configurar 6-12 esferoides por condição desejada conforme descrito em 1,2 ou 1,3 e colocar na incubadora (37 ° c, 5% CO2, 95% umidade) por 2 dias.
- No dia 2, leve imagens microscópicas claras dos esferóides.
- Prepare as primeiras doses de tratamento (depois de adquirir imagens).
Nota: A primeira concentração de tratamento deve ser duas vezes a concentração final desejada, pois a solução será diluída 1:2 em adição ao poço contendo 100 μL de meio. Intervalos sugeridos de tratamento medicamentoso (dependerá da meia-vida da droga): dia 2, 4 e 7. - Usando uma pipeta multicanal, remova suavemente 100 μL de meio e substitua-o por 100 μL de meio contendo medicamentos.
- Coloc a placa 96-well para trás na incubadora em 37 ° c com 5% CO2 e 95% umidade e repita 2,3 e 2,4 nos dias escolhidos do tratamento mas agora sem dobrar a dose para obter a dose final correta.
- No último dia da programação do protocolo/tratamento, pode-se realizar um ou vários dos seguintes ensaios.
3. ensaio de viabilidade celular para spheroids
- Configurar 4-6 esferoides por condição desejada conforme descrito em 1,2 ou 1,3 e colocar na incubadora a 37 ° c com 5% de CO2 e 95% de umidade.
Nota: Neste caso, o ensaio de viabilidade celular foi realizado no dia 7 ou 9, após ter monitorado o crescimento esferóide a cada 2-3 dias por microscopia de luz, como descrito acima (ponto 1.2.5 e 1.3.13). - Descongele o reagente do ensaio de viabilidade (ver tabela de materiais) e deixe-o equilibrar a RT antes da utilização.
- Misture suavemente invertendo para obter uma solução homogênea.
- Antes de realizar o ensaio, retire 50% do meio de cultura dos esferóides (100 μL).
- Adicionar reagente de viabilidade celular a cada poço em uma proporção de 1:3 para a quantidade de meio presente no poço (Figura 2a (i)) para uma placa de 96 poços, adicione 50 μl de reagente a 100 μl de meio.
- Misture o conteúdo vigorosamente durante 5 min para induzir a lise celular (Figura 2a (II)).
- Incubar durante 25 min na RT para estabilizar o sinal luminescente (Figura 2a (III)).
- Registe o sinal luminescente (Figura 2a (IV)).
4. preparando lysates da proteína para o western blotting das culturas do spheroid 3D
Nota: Ao coletar os esferoides, é aconselhável usar uma pipeta P200 e cortar a extremidade da ponta para permitir uma abertura mais grande e daqui uma captação mais fácil dos esferoides sem perturbar sua estrutura.
- Para cada condição, pool de um mínimo de 12, idealmente 18-24 esferoides (dependendo do tamanho esferóide) em um tubo de 1,5 ml (Evite 2 tubos de ml, como os próximos passos se tornará mais difícil devido à sua inferior pointy menor).
Nota: Se a quantidade de meio exceder 1,5 mL antes de ter recolhido todos os esferóides, permita que os esferóides recolhidos se instalem na parte inferior (acontece muito rapidamente, centrifugação não é necessário) e descartar metade do volume do tubo antes de continuar a recolher o spheroids restantes. - Coloque os tubos no gelo e deixe que os esferóides se instalem na parte inferior do tubo de 1,5 mL.
- Mova-se do laboratório de células estéreis para o laboratório regular.
- Lave esferoides duas vezes em 1 ml de gelo-frio 1X PBS. Deixe esferoides resolver antes de remover 1X PBS entre cada etapa de lavagem.
- Aspirar o máximo de 1X PBS possível sem perturbar ou remover os esferóides.
- Adicionar 5 μL de tampão de Lise aquecida (LB) com inibidores da fosfatase e protease, por esferóide (por exemplo, 10 esferoides = 50 μL LB).
- Repita os intervalos de vórtice seguidos de girar para baixo até que os esferóides sejam dissolvidos. Realize um ciclo de vortexing por 30 s seguido por centrifugação (uma rotação rápida usando uma centrífuga de mesa é suficiente) para 10 s por aproximadamente 5-10 min, dependendo do tamanho e da compacidade dos esferóides.
Nota: O protocolo pode ser pausado aqui. Mantenha os lisados a-20 ° c até prosseguir com sonication, homogeneização e determinação da proteína como em um protocolo padrão do lisado da proteína 2D, seguido pelo western blotting usando protocolos padrão.
5. iodeto de propiídio (PI) coloração de esferóides
- Configurar 3-6 esferoides por condição desejada conforme descrito em 1,2 ou 1,3 e coloque na incubadora a 37 ° c com 5% de CO2 e 95% de umidade.
- Em um laboratório estéril da cultura da pilha, aqueça 1X PBS a 37 ° c.
- Faça uma solução de PI de 4 μM diluindo a solução de estoque em 1X PBS: dilua um estoque aquoso de 1 mg/mL de PI 1:350 em 1X PBS.
Nota: Esta concentração será ainda mais reduzida após a adição da solução aos poços que dão uma concentração final de 2 μM. 100 μL desta solução é necessária para cada poço contendo um esferóide.
Atenção: O iodeto do propidium (PI) deve ser segurado em uma capa das emanações e em luvas desgastando. PI é sensível à luz. Proteja da luz ao manusear. - Remova 100 μL do meio de cada poço na placa 96-well sem remover os esferóides.
- Lave o meio restante adicionando 100 μL de 1X PBS aquecido a todos os poços seguidos removendo 100 μL do líquido nos poços. Repita este passo de lavagem 3 vezes.
- Adicione 100 μL da solução de PI a cada poço, cubra a placa na folha de alumínio e coloque-a em uma incubadora a 37 ° c com 5% de CO2 e 95% de umidade para 10-15 min.
- Repita as 3 etapas de lavagem descritas em 4,5 para lavar para fora a solução do PI, a fim diminuir o sinal do fundo quando imagem latente.
- Use um microscópio de epifluorescência para a imagem dos esferóides. Para avaliar a viabilidade das células no núcleo esferóide tomar z-Stacks para obter imagens com diferentes profundidades do esferóide.
Nota: Um tamanho de passo em torno de 18-35 μm entre cada fatia dependendo do tamanho do esferóide é aconselhável, dando aproximadamente 11-18 pilhas por esferóide. Z-Stacks podem ser processados em ImageJ usando a função de projeção z, que pode combinar todas as pilhas z em uma imagem final, dando uma visão geral da coloração em todo o esferóide (para mais orientações sobre o uso de ImageJ para esta finalidade, ver (https://ImageJ.net/Z-Functions).
6. incorporação de spheroids 3D
-
Prepare o gel do agarose em que os esferoides são incorporados (somente a primeira vez necessária que executa o protocolo).
- Misture 1 g de bactoagar em 50 mL de ddH2O.
- Aqueça lentamente no forno de microondas até que o bactoagar se dissolveu e um gel homogêneo se formou. Não deixe ferver o gel.
- Mantenha o bactoagar aquecido num banho de água a 60 ° c.
- Manter a 4 ° c entre experimentos.
-
Incorporação de esferóides.
- No dia 1, para cada condição, pool de um mínimo de 12 esferóides em um tubo de 1,5 mL.
- Lave uma vez com 1 mL de gelo-frio 1X PBS.
- Para fixar os esferóides, adicione 1 mL de paraformaldeído a 4%.
Nota: A manipulação do paraformaldeído deve ser executada em uma capa das emanações. - Deixe-os incubar por 24 h em RT.
- No dia 2, aqueça o gel de agarose com cuidado, colocando-o em um copo cheio de água em um forno de microondas. Assegure-se de que o gel não ferva! Mantenha aquecido em uma placa de aquecimento de bancada, a 60 ° c até o uso.
- Lave esferoides duas vezes com 1 ml de gelo-frio 1X PBS.
- Aspirar a maior parte do 1X PBS (deixando aproximadamente 100 μL neste momento é prático para lidar com os esferóides).
- Prepare uma pipeta de 20 μL cortando a ponta da pipeta em uma inclinação para obter uma ponta mais pontuda com um furo maior (veja a ilustração).
Nota: A parte seguinte tem que ser feito rapidamente para assegurar a transferência ideal do esferóide e para evitar a solidificação da gota do gel. Se nenhum bloco de aquecimento está disponível, recomenda-se primeiramente travar os esferoides e então fazer a gota do agarose (isto é, comutar a ordem dos pontos 6.2.9 e 6.2.10). - Faça uma gota do gel do agarose em uma corrediça do microscópio. Coloc a corrediça em um bloco morno do aquecimento para impedir que o agarose solidificying.
- Usando a ponta modificada da pipeta (Veja 6.2.8), trave tantos como esferoides como possível em um volume de 15-20 μl.
- Injete com cuidado o 15-20 μL spheroid-contendo 1X PBS no centro da gota do gel do agarose sem tocar na corrediça do microscópio.
Nota: Este é um ponto um pouco difícil. Os esferoides serão perdidos se a ponta da pipeta tocar na corrediça do microscópio ao injetar os esferoides na gota do gel. É aconselhável praticar todo o processo de fazer a gota do agarose e injetando os esferoides injetando um líquido colorido na gota. Isto permitirá a visualização de uma penetração potencial através da gota, porque o líquido colorido estará escapando para fora na corrediça. - Deixe a gota do gel do agarose endurecer incubando por 5-10 minutos em RT ou em 4 ° c. Uma vez que a gota do gel solidificado um tanto (mas é ainda rather macia), empurre com cuidado a gota do gel da corrediça do microscópio em uma gaveta plástica do tecido com um bisturi.
- Cubra as fitas plásticas do tecido em 70% de etanol.
Nota: Neste ponto os esferoides podem ser usados diretamente ou armazenados por meses. - Incorpore o esferóide agarose-encaixado na parafina, seção em corrediças grossas da camada de 2-3 μm e mancha com hematoxilina e eosina ou sujeito à mancha immuno-histológica.
Resultados
Os ensaios de crescimento esferóide com base no protocolo de formação esferóide, ilustrados esquematicamente na Figura 1A e na Figura 1B, foram utilizados como ponto de partida para análise dos efeitos de tratamentos medicamentoso anticancerígenos em um tumor 3D imitando o ajuste. A facilidade com que os esferoides são formados é a linha celular específica, e algumas linhas celulares necessitam de suplementação com RBM, a fim de formar esferoides coerentes22. A concentração de rBM adicionado pode afetar profundamente a morfologia dos esferóides. Como mostrado na Figura 1C e Figura 1D, variando a concentração de RBM entre 0 e 4% altera a compacidade e morfologia dos esferóides em uma maneira dependente do tipo de célula. Figura 1 C demonstra como a adição de até 2,5% de RBM permite a formação de esferóides em células de câncer de mama skbr-3, sem efeito adicional em concentrações acima de 2,5% de RBM. Em contraste, as células do adenocarcinoma ductal pancreático BxPC3 (PDAC), que exibem uma morfologia epitelial, formam espontaneamente pequenos, esferóides compactos (Figura 1D, superior, painel esquerdo). Neste tipo da pilha, aumentar a concentração de RBM a 1,5% ou acima de provoca uma mudança morfológica distinta do esferóide a umas estruturas mais complicadas com protrusões e invaginations, reminiscente da formação tubular ductal da estrutura. Inversamente, a adição de rBM a duas outras linhas celulares PDAC, MiaPaCa e Panc-1, que têm um fenótipo mais mesenquimais, permite que os agregados celulares soltos se tornem mais apertados e formem esferóides mais compactos (Figura 1D, médio e inferior de painéis). Estes resultados mostram que a quantidade exata de RBM tendo por resultado a formação óptima do esferóide deve ser titulada para cada linha e circunstância de pilha.
Uma avaliação quantitativa da viabilidade celular dentro dos esferóides após o tratamento medicamentoso foi necessária para avaliar o efeito dos tratamentos antidrogas contra o câncer. O ensaio descrito aqui é um ensaio luciferin-luciferase-baseado, que mede o ATP liberado das pilhas vivos dentro dos spheroids. O princípio do ensaio é ilustrado na Figura 2a. O sinal luminescente gerado neste ensaio é facilmente gravado por um leitor de placas (Figura 2a) e correlaciona-se bem com a viabilidade medida por outros métodos23. A relação linear entre a concentração de ATP e a luminescência na faixa de concentração relevante é mostrada na Figura 2B, enquanto a Figura 2C mostra a capacidade do ensaio para avaliar a morte celular em esferóides 3D tratados com terapia anticancerígena. A fim de avaliar ainda mais a linearidade do ensaio na faixa pertinente, foram realizados experimentos para estabelecer curvas padrão do sinal luminescente em função do número de células (Figura 2D e Figura 2e ). Estes resultados indicam que o ensaio é apropriado para estimar a viabilidade da pilha em culturas do esferóide 3D e que é aplicável para investigar a perda droga-induzida da viabilidade da pilha.
Uma combinação de imagens microscópicas claras adquiridas cada dois a três dias, durante o período do tratamento e uma avaliação quantitativa final da viabilidade da pilha permite a supervisão próxima do crescimento e da morfologia esferóide assim como a avaliação do tratamento óptimo Dose. Este último é exemplificado na Figura 3a e na Figura 3B, onde foi realizado um experimento de dose-resposta para determinar a dose necessária para 50% de viabilidade celular reduzida em ESFERÓIDES de câncer de mama MDA-MB-231. Os efeitos do tratamento na morfologia esferóide são visualizados na Figura 3C e Figura 3D para MDA-MB-231 e spheroids MCF-7, respectivamente. Durante o tratamento com o coquetel quimioterápico escolhido, a compacidade dos esferóides MDA-MB-231 aumenta, enquanto durante o tratamento com tamoxifeno, os esferóides MCF-7 tornam-se cada vez mais desgastados e irregulares. Em ambos os casos, uma clara queda na viabilidade celular é visível após 7 (MDA-MB-231) ou 9 (MCF-7) dias de tratamento (Figura 3 e e Figura 3F). Isto demonstra a necessidade para uma avaliação visual e quantitativa de efeitos tratamento-negociados na viabilidade e na morfologia da pilha do esferóide assim como que estes parâmetros são altamente pilha-e tipo de tratamento específico.
Como um suplemento para o ensaio de viabilidade celular, coloração de células mortas com PI, que não pode atravessar a membrana e, portanto, apenas manchas necróticas ou células apoptóticas tardias com integridade da membrana comprometida, permite uma rápida avaliação espacial de células mortas em resposta ao tratamento, sem o protocolo demorado de incorporação, corte e IHC. Como ilustrado na Figura 4 , o arranjo espacial das células mortas em cima de uma concentração crescente de um inibidor, neste caso, o inibidor de na+/h+ 1 (NHE1) 5-(n-etil-n-ISOPROPÍLICO)-amilorido (EIPA), pode ser Visualizado. Como visto, os esferoides do controle mostram um núcleo apoptótico necrótico/atrasado limitado, visto que as pilhas inoperantes são distribuídas durante todo o esferóide enquanto a concentração de EIPA é aumentada.
A fim quantificar a indução relativa do esforço apoptóticas que segue tratamentos diferentes, os esferoides foram lisados e sujeitados à electroforese do gel de SDS-PAGE e ao blotting ocidental para o polymerase poli (ADP-ribose) de comprimento total e clivada (PARP). Os resultados representativos são mostrados na Figura 4B e Figura 4C. Neste experimento, os esferóides foram preparados a partir de células MDA-MB-231 nas quais o cotransportador de lactato-próton MCT4 ou o na+, HCO3- cotransporter NBCn1 foram derrubados usando siRNA. O knockdown foi avaliado por western blotting para MCT4 e NBCn1 (dados não publicados). Como visto, o knockdown de MCT4, mas não de NBCn1, aumenta robustamente o clivagem de PARP, consistente com nossa demonstração precedente que o knockdown estável de MCT4 em pilhas de MDA-MB-231 diminui o crescimento do tumor in vivo24.
Para analisar ainda mais os efeitos do tratamento e obter informações sobre a sinalização específica-, a parada de crescimento e as vias de morte ativadas, os esferóides podem, além da análise de Western blot, ser incorporados e submetidos à análise imuno-histoquímica (IHC). A análise de IHC das seções do esferóide permite o uso de anticorpos ou de marcadores específicos da proliferação de pilha, do ciclo da pilha e da morte programada da pilha, e facilita uma visualização do arranjo espacial de pilhas proliferative e apoptóticas no esferóide.
Uma figura esquemática do protocolo de incorporação para análise de IHC de esferóides é apresentada na Figura 5A. Uma imagem microscópica clara representativa de uma seção grossa do micrótomo de aproximadamente 3 μm de um esferóide encaixado é mostrada na Figura 5B, e uma imagem da imunofluorescência de um esferóide manchado para a proteína p53 do supressor do tumor (núcleos manchados usando DAPI), é mostrado como Figura 5C. Exemplos de DMSO e esferóides tratados com quimioterapia corados para o marcador de proliferação celular Ki-67 ou para p53 são mostrados na Figura 5D e Figura 5e, respectivamente. Consistente com o efeito antiproliferativo do tratamento quimioterápico, o número de células positivas de Ki-67 é maior no controle DMSO do que no esferóide tratado com quimioterapia (Figura 5D). Em contrapartida, a expressão da p53 é aumentada durante as condições de estresse celular, apoptose e parada de crescimento e, consequentemente, o número de células coradas por p53 é substancialmente maior nos esferóides tratados com quimioterapia em comparação aos controles DMSO (Figura 5 E).
Esses resultados ilustram exemplos de como as informações espacialmente resolvidas (coloração PI, IHC) ou quantitativas (western blotting) sobre os efeitos do tratamento medicamentoso em esferóides 3D podem ser obtidas.
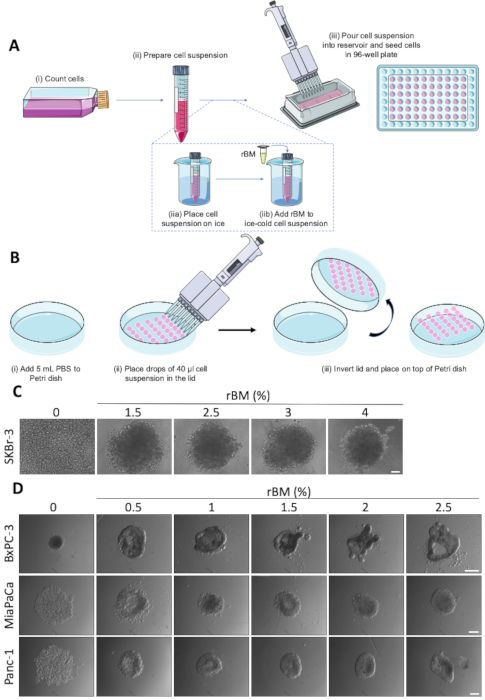
Figura 1 : Formação esferóide espontânea e RBM-negociada. (A) representação esquemática da formação de esferóides utilizando placas de fundo redondo 96-poço de fixação Ultrabaixa, com uso opcional de RBM. Passos individuais marcados por (i-III). (B) representação esquemática da formação de esferóides utilizando o método de gota suspenso. As etapas individuais são marcadas por (i-III) (C) imagens representativas da formação esferóide mediada por RBM de células skbr-3. As pilhas foram semeadas em placas inferiores redondas do acessório ultra-baixo 96-well com concentrações crescentes de rBM e crescidas por 9 dias. Barra de escala 100 μm. (n = 3). (D) imagens representativas de células BxPC-3, MiaPaCa e Panc-1 semeadas para formação de esferóides em placas inferiores redondas 96-well com concentrações de RBM de 0,5-2,5%. Os esferóides foram cultivados por 4 dias. Barra de escala = 250 μm. (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
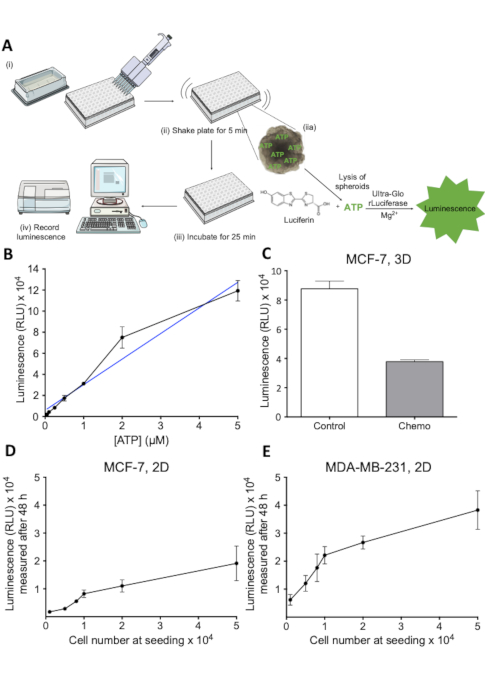
Figura 2 : Princípio e avaliação do ensaio de viabilidade celular. (A) representação esquemática do ensaio de viabilidade das células 3D. Passos individuais indicados por (i-IV). (B) sinal luminescente em função da concentração de ATP. Diluições de ATP foram chapeadas em uma placa de 96 poços e reagente de viabilidade celular adicionado a cada poço. A luminescência foi registrada após 30 min a 405 nm. 1 n. (C) viabilidade, medida como luminescência, de controle e tratamento quimioterápico MCF-7 esferóides. As pilhas MCF-7 foram semeadas em placas do redondo-fundo do acessório ultra-low e foram crescidas por 7 dias. O tratamento quimioterápico (5 μM de cisplatina, 5 μM de doxorrubicina e 30 nM 5-FU) foi aplicado nos dias 2 e 4. As barras representam valores médios com SD. 1 n. (D) sinal luminescente como função do número de células MCF-7 semeadas. As pilhas MCF-7 foram semeadas em placas 96-well no número indicado da pilha e permitidas crescer para 48 h, depois do qual a viabilidade da pilha foi medida. As barras de erro representam SD. 1 n. (E) conforme descrito em D para as células MDA-MB-231. Por favor clique aqui para ver uma versão maior desta figura.
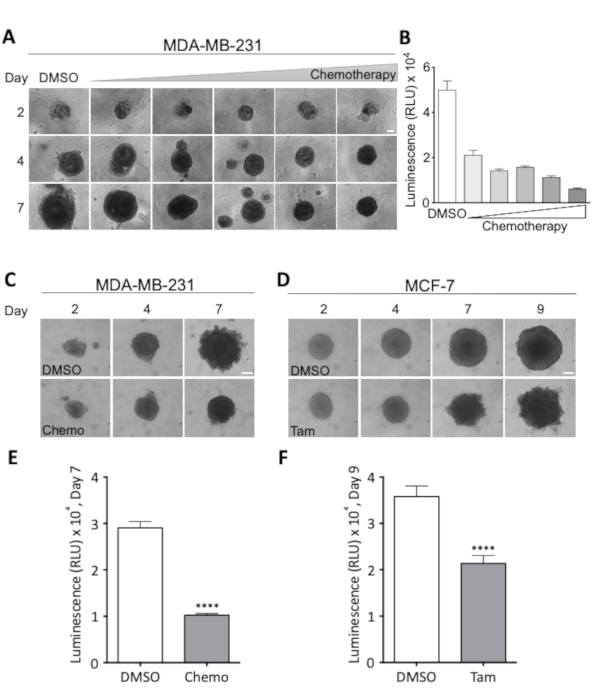
Figura 3 : Efeitos de regimes de tratamento sobre a morfologia esferóide e viabilidade celular. (A) imagens representativas de esferoides MDA-MB-231 no dia 2, 4 e 7. MDA-MB-231 células foram semeadas em ultra-baixo anexo fundo redondo 96-bem placas. O tratamento com doses crescentes da quimioterapia foi começado no dia 2, em que tempo todos os esferoides eram do tamanho similar. As fileiras mostram esferoides em doses crescentes da quimioterapia, e as colunas mostram os esferoides representativos do tamanho no dia 2, 4, e 7 na dose indicada. A dose mais baixa foi de 18,75 nM de cisplatina, 18,75 nM de doxorrubicina, 0, 625 nM 5-fluorouracil (5-FU) e esta dose foi duplicada para cada imagem mostrada, resultando em uma dose máxima de 0,3 μM de cisplatina, 0,3 μM de doxorrubicina e 2 nM 5-FU. Barra de escala = 100 μm. (2 n). (B) viabilidade de esferóides MDA-MB-231, medidos como luminescência, após 7 dias de tratamento quimioterápico. As barras representam valores médios com sem. 2 n. (c, D) imagens representativas de MDA-MB-231 (c) e de esferoides MCF-7 (D) no dia 2, 4, 7 e para os esferoides MCF-7 9. As células semeadas como em (A) e tratadas com qualquer quimioterapia (chemo, 18,75 nm cisplatina, 18,75 nm doxorrubicina, 0, 625 nm 5-FU) no dia 2 e 4 (C) ou com 2 ΜM de tamoxifeno (TAM) no dia 2, 4 e 7 (D). Barra de escala = 100 μm. (4 n e 3 n), respectivamente. (E, F) Viabilidade, medida como luminescência, no dia 7 e 9 para (C) e (D), respectivamente. Para testar a diferença estatisticamente significante entre as condições foi realizado o teste t de Student não pareado. denota p < 0, 1. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4 : Coloração do iodeto do propidium e análise ocidental do borrão dos spheroids. (A) imagens representativas de esferóides MCF-7 com coloração PI após 9 dias de tratamento. As pilhas de MCF-7 foram semeadas em placas ultra-low do acessório 96-well crescidas por 9 dias e tratadas com concentrações crescentes de EIPA nos dias 2, 4 e 7. No dia 9, os esferóides foram corados com IP e as imagens foram adquiridas em um microscópio de epifluorescência. Barra de escala = 200 μm. (1 n.) (B) borrões ocidentais representativos de células MDA-MB-231 após nocaute/knockdown de transportadores de ácido-base. NHE1 foi nocauteado por CRISPR/Cas9 em MDA-MB-231 células 12 e as células foram posteriormente transfected Transientemente com siRNA contra MCT4 ou NBCn1, e cresceu como esferóides por 9 dias antes de ser lisado e submetido a western blotting usando um anticorpo reconhecendo o total e clivada (c) PARP. (C) quantificação da razão de cparp ao nível de proteína PARP, normalizada para o controle de carga (β-actina). (1 n). Por favor clique aqui para ver uma versão maior desta figura.
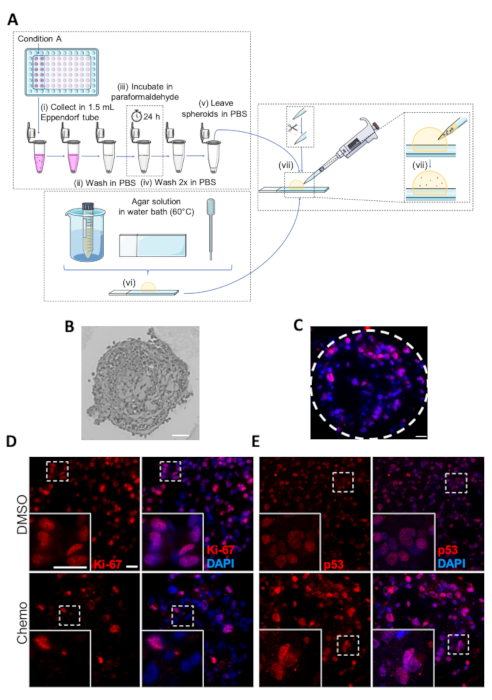
Figura 5 : Fixação, incorporação e análise imuno-histoquímica de esferóides. (A) representação esquemática do protocolo de incorporação de esferóides. As etapas individuais são marcadas como (i-VII). (B) imagem da Embedded MDA-MB-231 spheroid. Barra de escala: 50 μm. (C) imagem representativa do esferóide MDA-MB-231 tratado com quimioterapia submetido à análise de IHC com anticorpos contra p-53. Linhas tracejadas mostram a circunferência do esferóide. Barra de escala = 20 μm. (D, e) imagens representativas de DMSO-ou quimioterapia-tratadas (painéis superiores e inferiores, respectivamente) MDA-MB-231 spheroids. As pilhas de MDA-MB-231 foram semeadas em placas ultra-low do acessório 96-well, cultivadas por 7 dias e tratadas com a quimioterapia nos dias 2 e 4. No 7º dia, os esferóides foram incorporados, seguidos de análise por IHC com anticorpos primários contra Ki-67 (D) e p53 (e). As caixas brancas representam imagens de zoom. Barra de escala = 20 μm em ambas as ampliações, (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
O uso de esferoides da pilha do cancro 3D provou uma ferramenta valiosa e versátil não somente para a seleção anticâncer da droga, mas igualmente para ganhar a introspecção mecanicista na regulação da morte e da viabilidade da pilha de cancro as circunstâncias que imitam aquelas no tumor microambiente. Isto é particularmente crucial porque a acessibilidade, a captação celular, e os efeitos intracelular de drogas quimioterapêuticas são impactados profundamente pelas condições físico-químicas no tumor, incluindo o pH, a tensão do oxigênio, o tortuosity, e o físico e interações célula-célula químicas9,17. Por exemplo, a acidez do pH extracelular, que pode atingir valores tão baixos quanto 6-6,5em muitos tumores sólidos25,26,27,28,29, causa uma quimioterapia básica fraca compostos, tais como doxorrubicina, mitoxantrona e zwitterion paclitaxel, a ser carregada. Isto reduz sua captação nas pilhas do tumor e pode influenciar a atividade de proteínas da resistência do multirresistente tais como p-glycoprotein30,31,32. Também a proliferação celular, que é fundamental para o efeito da maioria dos compostos quimioterápicos, é geralmente reduzida em 3D em comparação com as condições 2D e, portanto, é provavelmente melhor imitado em esferóides tumorais do que na cultura de células 2D8,33 ,34. Finalmente, o microambiente denso do tumor é a origem de indicações físicas e solúveis numerosas da sinalização que direcionam as vias de sinalização intracelular que regulam o crescimento da pilha, a sobrevivência e a morte. Assim, ao analisar a eficácia da droga, os sistemas de cultura 3D são um passo crucial antes de embarcar em modelos in vivo. Uma grande desvantagem da cultura 3D é, no entanto, o aumento da complexidade da análise em comparação com a cultura 2D. Nós descrevemos aqui técnicas simples e relativamente baratas para a formação do esferóide usando uma variedade de tipos da pilha de cancro. Nós mostramos exemplos de como a formação do esferóide deve ser aperfeiçoada para cada tipo da pilha estudada e descreveu como obter dados quantitativos na viabilidade da pilha, na morte de pilha, e em vias de sinalização associadas, em tais spheroids. Não há diferenças óbvias de crescimento ou morfológicas entre os três modelos descritos aqui. Em nossas mãos, a variação na morfologia pode ser um pouco maior usando o método Drop pendurado, mas uma vantagem desse método é que a rBM não é necessária. Nós nos concentramos aqui em esferóides produzidos a partir de um único tipo de células cancerosas. O modelo esferóide, no entanto, também é capaz de cocultura, por exemplo, de células cancerosas com fibroblastos, monócitos/macrófagos, células endoteliais e/ou adipócitos35,36,37. Outras aplicações avançadas deste modelo incluem a combinação com os dispositivos fluídico impressos 3D que permitem a dosagem através de uma membrana semipermeável, seguido pela colheita para o perfil proteômica quantitativo38.
Enquanto, como observado acima, o fenótipo de células cultivadas em esferóides 3D geralmente imita a de tumores in vivo muito melhor do que as células cultivadas em 2D, a medida em que tais esferóides são, de fato, modelos relevantes dos tumores in vivo correspondentes é dependente de numerosos fatores e tem de ser cuidadosamente avaliados. Parâmetros que irão impactar o quão bem tais esferóides imitar a in vivo condição incluem a composição celular do tumor e sua composição ECM relativa. Por exemplo, o rBM que nós empregamos como o ECM nos protocolos forneceu aqui é uma boa escolha para imitar estágios adiantados de cancros epithelial, em torno da época de violar a membrana do porão, outras composições do ECM será mais relevante para determinado tumor tipos e estágios. Além disso, a capacidade de adesão celular difere amplamente entre as linhagens de células cancerosas, dependendo de sua expressão de proteínas de adesão celular e célula-matriz, como as cadherinas e as integrinas22.
Como descrito aqui, o crescimento e a morfologia esferóide podem facilmente e não-invasora ser monitorados cada 2-3 dias usando um microscópio claro com baixo sistema ótico da ampliação e um grande campo de visão. No entanto, como o estresse citotóxico, como o tratamento quimioterápico, afeta a morfologia esferóide de forma muito diferente e, de forma, dependendo do tipo de célula e esquema de tratamento, não é suficiente depender apenas da morfologia e da circunferência para avaliar efeito do tratamento. Por exemplo, os esferóides podem tornar-se mais frouxo com tratamento e morte celular emergente, ou toda a morte pode ocorrer no núcleo necrótico, enquanto a superfície não é detecvelmente afetada. Em ambos os casos, o resultado pode ser uma impressão errônea de que o número de células ao vivo no esferóide não é reduzido pelo tratamento. As técnicas quantitativas-e do todo-spheroid são conseqüentemente essenciais para avaliar o efeito do tratamento. Para a avaliação quantitativa da morte celular, o ensaio da fosfatase ácida, que como o nome implica medidas a atividade da fosfatase ácida citosólico foi empregado21. No entanto, em nossas mãos, enquanto este ensaio geralmente reflete bem o número de células semeadas, não captura adequadamente a morte celular induzida pelo tratamento rápido (dados não mostrados), provavelmente porque a fosfatase ácida permanece ativa por algum tempo após a morte celular. Além disso, este ensaio exige a remoção completa do meio, que aumenta o erro especial com os spheroids frágeis, quimioterapia-tratados. O ensaio de viabilidade celular descrito aqui, baseado no conteúdo de ATP celular, foi escolhido com base em seu protocolo simples e tempo eficiente e alta reprodutibilidade. Além disso, este ensaio não exige a remoção completa do meio de cultura que é uma vantagem ao trabalhar com spheroids. Como mostrado nos resultados representativos, este ensaio captura bem o número de pilha e os efeitos esperados do tratamento da quimioterapia. Entretanto, uma armadilha desta técnica é, obviamente, que as mudanças metabólicas que reduzem o índice intracelular do ATP podem erroneamente ser gravadas como um número de pilha mais baixo. Assim, a avaliação paralela do volume e da morfologia do esferóide, ou coloração do PI, é aconselhável para validar os resultados.
O lysis de spheroid seguido pela mancha ocidental pode fornecer a introspecção semiquantitativa no estado de processos da sinalização, morte da pilha-, crescimento-e caminhos da viabilidade. O uso de western blotting é complicado quando rBM é usado para preparar os esferóides, uma vez que isso irá incluir uma fração substancial do teor de proteínas de lisado, e mais importante, sua contribuição fracionária aumentará com a diminuição do conteúdo celular durante a morte da célula quimioterapêutica. É, em princípio, possível remover a rBM por centrifugação; no entanto, este é um passo crítico, pois é difícil remover completamente todos os rBM, e isso impediria a comparação quantitativa entre as condições. Para tais esferóides, e em geral para a avaliação espacialmente resolvida de caminhos de morte e parâmetros de sinalização relevantes, incorporação e IHC são ferramentas fortes. Outras abordagens podem ser consideradas: imagens confocais ao vivo de esferóides intactos (relativamente pequenos)39. Outra propriedade interessante de esferoides é que dada a sua forma bastante regular "bola", eles se prestam bem a iteração entre modelagem matemática e experimentos de laboratório molhado, para aumentar a compreensão da importância do acima mencionado gradientes de oxigênio, pH e nutrientes dentro de esferóides e, por extrapolação, tumores40,41. Assim, embora os modelos 3D importantes do tumor da complexidade muito maior estejam emergindo, incluindo uma escala larga de culturas queratinócitos e organoid baseadas em scaffolds biológicos complexos assim como inertes, e, não menos, xenoenxertos paciente-derivados42, os esferoides permanecem uma ferramenta importante por causa de sua relevância biológica superior comparada à cultura 2D, combinada com a facilidade relativa de manipulação.
Em síntese, apresentamos aqui uma série de métodos simples para análise de alterações induzidas pelo tratamento anticancerígenos na viabilidade da célula cancerosa e morte na cultura 3D. A composição dos esferóides pode ser modificada dependendo das propriedades e biologia das células empregadas, e as análises quantitativas e qualitativas apresentadas são úteis tanto para a avaliação das relações dose-resposta quanto para a obtenção de insights sobre o vias de sinalização e morte envolvidas.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Agradecemos a Katrine Franklin Mark e Annette Bartels pela excelente assistência técnica e pela Asbjørn Nøhr-Nielsen para realizar os experimentos na figura 1D. Este trabalho foi financiado pela Fundação Einar willumsen, pela Fundação Novo Nordisk e pela Fondation Juchum (tudo para SFP).
Materiais
| Name | Company | Catalog Number | Comments |
| 2-(4-amidinophenyl)-1H-indole-6-carboxamidine (DAPI) | Invitrogen | # C10595 | For staining nuclei |
| 5-Fluorouracil (5-FU) | Sigma-Aldrich | #F6627 | Component in chemotherapeutic treatment |
| 5-(N-ethyl-isopropyl) amiloride (EIPA) | Life Technologies | #E3111 | Inhibitor of NHE1 |
| Antibody against PARP and cPARP | Cell signaling | #9542 | Used in western blotting |
| Antibody against Ki-67 | Cell signaling | #9449 | Used for IHC |
| Antibody against p53 | Cell Signaling | #2524 | Used for IHC |
| Antibody against β-actin | Sigma | A5441 | Used in western blotting |
| Bactoagar | BD Bioscience | #214010 | Used for agarose gel preparation |
| Benchmark protein ladder | Invitrogen | #10747-012 | Used for SDS-PAGE |
| Bio-Rad DC Protein Assay kit | Bio-Rad Laboratories | #500-0113, #500-0114, #500-0115 | Used for protein determination from lysates |
| Bürker chamber | Marienfeld | 610311 | For cell counting |
| BX63 epifluoresence microscope | Olympus | Used for fluorescent imaging | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | #G9681 | Used for the cell viability assay |
| Cisplatin | Sigma-Aldrich | #P4394 | Component in chemotherapeutic treatment |
| Corning Spheroid Microplate, 96 well, Black with clear round bottom, Ultra-low attachment, With lid, Sterile | Corning | #4520 | Used for growing spheroids with luminescence measurements as end point |
| Corning 96 well, clear round bottom, Ultra-low attachment microplate, With lid, Sterile | Corning | #7007 | Sufficient for spheroid growth without luminescence measurements as end point |
| Criterion TGX Precast Gels | Bio-Rad | 5671025 | Used for SDS-PAGE |
| Doxorubicin | Abcam | #120629 | Component in chemotherapeutic treatment |
| FLUOStar Optima Microplate reader | BMG Labtech | Used for recording luminescence | |
| Formaldehyde | VWR Chemicals | #9713.1000 | Used for cell fixation |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Gibco | #A1413202 | Keep at 4 °C to prevent solidification. Referred to as rBM in the protocol. |
| Heat-inactivated FBS | Sigma | #F9665 | Serum for growth media |
| ImageJ | NIH | Scientific Image analysis | |
| Medim Uni-safe casette | Medim Histotechnologie | 10-0114 | Used for storage of embedded spheroids |
| Mini protease inhibitor cocktail tablets | Roche Diagnostics GmBH | # 11836153001 | Used for lysis buffer preparation |
| MZ16 microscope | Leica | Used for light microscopic images | |
| NuPAGE LDS 4x Sample Buffer | Invitrogen | #NP0007 | Used for western blotting |
| Pierce ECL Western blotting substrate | Thermo scientific | #32106 | Used for western blotting |
| Ponceau S | Sigma-Aldrich | #P7170-1L | Used for protein band staining |
| Prism 6.0 | Graphpad | Scientific graphing and statistical software | |
| Propidium iodide (1mg/ml solution in water) | Invitrogen | P3566 | Light sensitive |
| Sterile reservoirs, multichannel | SPL lifesciences | 21002 | Used for seeding cells for spheroid formation |
| Superfrost Ultra-Plus Adhesion slide | Menzel-Gläser | #J3800AMNZ | Microscope glass slide used for embedding |
| Tamoxifen | Sigma-Aldrich | #T5648 | Used as chemotherapeutic treatment |
| Trans-blot Turbo 0.2 µm nitrocellulose membranes | Bio-Rad | #170-4159 | Used for western blotting |
| Tris/Glycine/SDS running buffer | Bio-Rad | #161 0732 | Used for SDS-PAGE |
| Trypsin-EDTA solution | Sigma | #T4174 | Cell dissociation enzyme |
Referências
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W., Freyer, J. P., Sutherland, R. M. Influence of glucose and oxygen supply conditions on the oxygenation of multicellular spheroids. British Journal of Cancer. 53 (3), 345-353 (1986).
- Gaedtke, L., Thoenes, L., Culmsee, C., Mayer, B., Wagner, E. Proteomic analysis reveals differences in protein expression in spheroid versus monolayer cultures of low-passage colon carcinoma cells. Journal of Proteome Research. 6 (11), 4111-4118 (2007).
- Chen, J. L., et al. The genomic analysis of lactic acidosis and acidosis response in human cancers. PLoS Genetics. 4 (12), 1000293 (2008).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Gudjonsson, T., Ronnov-Jessen, L., Villadsen, R., Bissell, M. J., Petersen, O. W. To create the correct microenvironment: three-dimensional heterotypic collagen assays for human breast epithelial morphogenesis and neoplasia. Methods. 30 (3), 247-255 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews in Molecular and Cell Biology. 8 (10), 839-845 (2007).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jacobi, N., et al. Organotypic three-dimensional cancer cell cultures mirror drug responses in vivo: lessons learned from the inhibition of EGFR signaling. Oncotarget. 8 (64), 107423-107440 (2017).
- Rodriguez-Enriquez, S., et al. Energy metabolism transition in multi-cellular human tumor spheroids. Journal of Cell Physiology. 216 (1), 189-197 (2008).
- Kunz-Schughart, L. A. Multicellular tumor spheroids: intermediates between monolayer culture and in vivo tumor. Cell Biology International. 23 (3), 157-161 (1999).
- Andersen, A. P., et al. Roles of acid-extruding ion transporters in regulation of breast cancer cell growth in a 3-dimensional microenvironment. Molecular Cancer. 15 (1), 45 (2016).
- Swietach, P., Patiar, S., Supuran, C. T., Harris, A. L., Vaughan-Jones, R. D. The role of carbonic anhydrase 9 in regulating extracellular and intracellular ph in three-dimensional tumor cell growths. Journal of Biological Chemistry. 284 (30), 20299-20310 (2009).
- Walenta, S., Doetsch, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Metabolic imaging in multicellular spheroids of oncogene-transfected fibroblasts. Journal of Histochemistry and Cytochemistry. 48 (4), 509-522 (2000).
- Kunz-Schughart, L. A., Groebe, K., Mueller-Klieser, W. Three-dimensional cell culture induces novel proliferative and metabolic alterations associated with oncogenic transformation. International Journal of Cancer. 66 (4), 578-586 (1996).
- Feng, H., et al. Homogeneous pancreatic cancer spheroids mimic growth pattern of circulating tumor cell clusters and macrometastases: displaying heterogeneity and crater-like structure on inner layer. Journal of Cancer Research and Clinical Oncology. 143 (9), 1771-1786 (2017).
- Santini, M. T., Rainaldi, G., Indovina, P. L. Apoptosis, cell adhesion and the extracellular matrix in the three-dimensional growth of multicellular tumor spheroids. Critical Reviews in Oncology/Hematology. 36 (2-3), 75-87 (2000).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Wong, C., Vosburgh, E., Levine, A. J., Cong, L., Xu, E. Y. Human neuroendocrine tumor cell lines as a three-dimensional model for the study of human neuroendocrine tumor therapy. Journal of Visual Experiments. (66), e4218 (2012).
- Friedrich, J., et al. A reliable tool to determine cell viability in complex 3-d culture: the acid phosphatase assay. Journal of Biomolecular Screening. 12 (7), 925-937 (2007).
- Ivascu, A., Kubbies, M. Diversity of cell-mediated adhesions in breast cancer spheroids. International Journal of Oncology. 31 (6), 1403-1413 (2007).
- Crouch, S. P., Kozlowski, R., Slater, K. J., Fletcher, J. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. Journal of Immunological Methods. 160 (1), 81-88 (1993).
- Andersen, A. P., et al. The net acid extruders NHE1, NBCn1 and MCT4 promote mammary tumor growth through distinct but overlapping mechanisms. International Journal of Cancer. , (2018).
- Vaupel, P. Tumor microenvironmental physiology and its implications for radiation oncology. Seminars in Radiation Oncology. 14 (3), 198-206 (2004).
- Vaupel, P. W., Frinak, S., Bicher, H. I. Heterogeneous oxygen partial pressure and pH distribution in C3H mouse mammary adenocarcinoma. Cancer Research. 41 (5), 2008-2013 (1981).
- Helmlinger, G., Yuan, F., Dellian, M., Jain, R. K. Interstitial pH and pO2 gradients in solid tumors in vivo: high-resolution measurements reveal a lack of correlation. Nature Medicine. 3 (2), 177-182 (1997).
- Zhang, X., Lin, Y., Gillies, R. J. Tumor pH and its measurement. Journal of Nuclear Medicine. 51 (8), 1167-1170 (2010).
- Gillies, R. J., Raghunand, N., Karczmar, G. S., Bhujwalla, Z. M. MRI of the tumor microenvironment. Journal of Magnetic Resonance Imaging. 16 (4), 430-450 (2002).
- Vukovic, V., Tannock, I. F. Influence of low pH on cytotoxicity of paclitaxel, mitoxantrone and topotecan. British Journal of Cancer. 75 (8), 1167-1172 (1997).
- Song, C. W., Griffin, R., Park, H. J., Teicher, B. A. . Cancer Drug Resistance. , 21-42 (2006).
- Lotz, C., et al. Role of the tumor microenvironment in the activity and expression of the p-glycoprotein in human colon carcinoma cells. Oncology Reports. 17 (1), 239-244 (2007).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today: Technologies. 23, 27-36 (2017).
- Stratmann, A. T., et al. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Molecular Oncology. 8 (2), 351-365 (2014).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLoS One. 12 (7), 0182039 (2017).
- Bochet, L., et al. Adipocyte-derived fibroblasts promote tumor progression and contribute to the desmoplastic reaction in breast cancer. Cancer Research. 73 (18), 5657-5668 (2013).
- Amann, A., et al. Development of a 3D angiogenesis model to study tumour - endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific Reports. 7 (1), 2963 (2017).
- LaBonia, G. J., Ludwig, K. R., Mousseau, C. B., Hummon, A. B. iTRAQ Quantitative Proteomic Profiling and MALDI-MSI of Colon Cancer Spheroids Treated with Combination Chemotherapies in a 3D Printed Fluidic Device. Analytical Chemistry. 90 (2), 1423-1430 (2018).
- Hulikova, A., Vaughan-Jones, R. D., Swietach, P. Dual role of CO2/HCO3(-) formula buffer in the regulation of intracellular pH of three-dimensional tumor growths. Journal of Biological Chemistry. 286 (16), 13815-13826 (2011).
- Wallace, D. I., Guo, X. Properties of tumor spheroid growth exhibited by simple mathematical models. Frontiers in Oncology. 3, 51 (2013).
- Michel, T., et al. Mathematical modeling of the proliferation gradient in multicellular tumor spheroids. Journal of Theoretical Biology. 458, 133-147 (2018).
- Meijer, T. G., Naipal, K. A., Jager, A., van Gent, D. C. Ex vivo tumor culture systems for functional drug testing and therapy response prediction. Future Science OA. 3 (2), (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados