Method Article
Évaluation de la viabilité cellulaire et de la mort dans les cultures sphéroïdes 3D des cellules cancéreuses
Dans cet article
Résumé
Ici, nous présentons plusieurs méthodes simples pour évaluer la viabilité et la mort dans les sphéroïdes 3D de cellules cancéreuses, qui imitent les gradients physico-chimiques des tumeurs in vivo beaucoup mieux que la culture 2D. Le modèle sphéroïde permet donc d'évaluer l'efficacité du médicament contre le cancer avec une meilleure traduction aux conditions in vivo.
Résumé
Les sphéroïdes tridimensionnels des cellules cancéreuses sont des outils importants pour les deux dépistages de médicaments anticancéreux et pour obtenir un aperçu mécaniste de la biologie des cellules cancéreuses. La puissance de cette préparation réside dans sa capacité à imiter de nombreux aspects des conditions in vivo des tumeurs tout en étant rapide, bon marché, et assez polyvalent pour permettre un dépistage relativement à haut débit. Les conditions de culture sphéroïde peuvent récapituler les gradients physico-chimiques dans une tumeur, y compris l'acidité extracellulaire croissante, le lactate accru, et la disponibilité décroissante de glucose et d'oxygène, de la périphérie sphéroïde à son noyau. En outre, les propriétés mécaniques et les interactions cellule-cellule des tumeurs in vivo sont en partie imitées par ce modèle. Les propriétés spécifiques et par conséquent les conditions optimales de croissance, des sphéroïdes 3D, diffèrent considérablement entre les différents types de cellules cancéreuses. En outre, l'évaluation de la viabilité cellulaire et de la mort chez les sphéroïdes 3D nécessite des méthodes qui diffèrent en partie de celles employées pour les cultures 2D. Ici nous décrivons plusieurs protocoles pour préparer les sphéroïdes 3D des cellules cancéreuses, et pour l'utilisation de telles cultures pour évaluer la viabilité et la mort de cellules dans le contexte d'évaluer l'efficacité des drogues anticancéreuses.
Introduction
L'utilisation de modèles sphéroïdes multicellulaires en biologie du cancer est de plusieurs décennies1,2, mais a gagné un élan substantiel ces dernières années. Cela reflète en grande partie une prise de conscience accrue de la façon dont le phénotype des cellules cancéreuses dépend fortement de leur microenvironnement et de leurs conditions de croissance spécifiques. Le microenvironnement dans les tumeurs pleines est fondamentalement différent de celui dans les tissus normaux correspondants. Cela comprend les conditions physico-chimiques telles que le pH, la tension de l'oxygène, ainsi que la pression interstitielle, les gradients de concentration de facteurs solubles tels que les nutriments, les déchets et les composés de signalisation sécrétés (facteurs de croissance, cytokines). En outre, il comprend l'organisation de la matrice extracellulaire (ECM), les interactions cellulaires et la signalisation intercellulaire, et d'autres aspects de l'architecture tridimensionnelle particulière (3D) de la tumeur3,4, 5,6. Les conditions microenvironnementales spécifiques dans lesquelles les cellules cancéreuses existent, affectent profondément leur profil d'expression génique et leurs propriétés fonctionnelles, et il est clair que, par rapport à celle des cellules cultivées en 2D, le phénotype des sphéroïdes 3D imite beaucoup plus étroitement celui des tumeurs in vivo7,8,9,10,11. Les modèles 2D, même s'ils emploient l'hypoxie, le pH acide, et les concentrations élevées de lactate pour imiter des aspects connus du microenvironnement de tumeur, échouent toujours à capturer les gradients des paramètres physico-chimiques surgissant dans des tumeurs, aussi bien que leur tumeur 3D architecture. D'autre part, les modèles animaux sont coûteux, lents, et éthiquement problématiques, et généralement, ont également des lacunes dans leur capacité à récapituler les conditions tumorales humaines. Par conséquent, les sphéroïdes 3D ont été appliqués comme un modèle de complexité intermédiaire dans les études d'un large éventail de propriétés de la plupart des cancers solides9,11,12,13, 14,15,16,17.
Une utilisation largement employée des sphéroïdes 3D est dans les essais de criblage de l'efficacité de thérapie anticancéreuse9,18,19,20. Les réponses de traitement sont particulièrement sensibles au microenvironnement de tumeur, reflétant à la fois l'impact de la tortuosité, de la diffusion restreinte, de la pression interstitielle élevée, et du pH environnemental acide sur la livraison de drogue, et de l'impact de l'hypoxie et d'autres aspects du microenvironnement sur la réponse de mort cellulaire9,17. Parce que l'environnement au sein des sphéroïdes 3D développe intrinsèquement toutes ces propriétés7,8,9,10,11, en utilisant des cultures cellulaires 3D peut améliorer considérablement la traduction des résultats vers des conditions in vivo, tout en permettant un dépistage efficace et abordable de la croissance nette. Cependant, la grande majorité des études sur la réponse médicamenteuse des cellules cancéreuses sont toujours menées dans des conditions 2D. Ceci reflète probablement que, tandis que quelques essais peuvent relativement facilement être mis en œuvre pour des cultures de cellules 3D, beaucoup, tels que des essais de viabilité, le ballonnement occidental, et l'analyse d'immunofluorescence, sont beaucoup plus commodement faits en 2D qu'en 3D.
Le but du travail actuel est de fournir des essais facilement favorables et des protocoles précis pour des analyses de l'effet du traitement avec des médicaments anticancéreux sur la viabilité et la survie des cellules cancéreuses dans un cadre de tumor 3D imitant. Plus précisément, nous fournissons et comparons trois méthodes différentes pour la formation de sphéroïdes, suivies de méthodes d'analyses qualitatives et quantitatives de la croissance, de la viabilité et de la réponse aux médicaments.
Protocole
1. Génération de sphéroïdes
- Préparation des suspensions cellulaires pour la formation de sphéroïdes
REMARQUE : Différentes lignées cellulaires ont des propriétés d'adhérence très différentes et le protocole de formation sphéroïde le plus approprié doit être établi dans chaque cas. Nous avons constaté que les cellules MCF-7 et BxPC-3 conviennent à la formation spontanée de sphéroïdes, tandis que MDA-MB-231, SKBr-3, Panc-1 et MiaPaCa exigent l'addition de la membrane reconstituée de sous-sol pour former avec succès des sphéroïdes. Seulement Les cellules MDA-MB-231 et BxPC-3 ont été employées pour le protocole de chute suspendue, cependant d'autres lignes de cellules sont certainement applicables.- Cultivez les cellules en monocouche jusqu'à 70-80% d'afluence.
- Laver les cellules avec salin tamponné de phosphate (1x PBS, 5 ml pour un 25 cm2 ou 10 ml pour un flacon de 75 cm2), ajouter l'enzyme de dissociation cellulaire (0,5 ml pour un 25 cm2 ou 1 ml pour un flacon de 75 cm2) et incuber les cellules pendant 2-5 min à 37 oC 5% d'humiditéco2 et 95%.
- Vérifier le détachement cellulaire au microscope et neutraliser l'enzyme de dissociation cellulaire en ajoutant un milieu de croissance (6-10% de sérum selon la lignée cellulaire) à un volume total de 5 ml dans un 25 cm2 ou 10 ml pour un flacon de 75 cm2.
- Utilisez une chambre de B-rker pour compter les cellules et compter 8 carrés dans la chambre par préparation cellulaire pour obtenir une reproductibilité élevée de la taille des sphéroïdes.
NOTE: Trois protocoles décrivant chacun une méthode différente pour la formation de sphéroïdes sont présentés ci-dessous. Le protocole 1.2 et 1.3 peuvent être utilisés pour tous les protocoles analytiques subséquents présentés, tandis que le protocole 1.4 est le mieux adapté pour l'intégration et les préparations de lysate. Selon la lignée cellulaire, la formation de sphéroïdes prend 2-4 jours, indépendamment de la méthode utilisée.
- Formation spontanée de sphéroïdes
- Effectuer les étapes 1.1.1-1.1.4.
- Diluer la suspension cellulaire dans un tube de 15 ml pour obtenir 0,5-2 x 104 cellules/mL (la densité cellulaire optimale doit être déterminée pour chaque lignée cellulaire) (Figure 1A (ii)).
- Remplissez l'anneau extérieur des puits avec 1x PBS ou milieu de croissance pour réduire l'évaporation des puits restants. Transférer la suspension cellulaire dans un réservoir stérile et, à l'aide d'une pipette multicanal, distribuer 200 L/puits dans des plaques de fond rondes ultra-faibles de 96 puits (figure1A (iii)).
- Incuber la plaque dans un incubateur à 37 oC avec 5 % de CO2,95 % d'humidité.
- Tous les 2-3 jours, acquérez des images microscopiques légères des sphéroïdes.
NOTE: Les images de cet article sont prises à 11,5x grossissement, ce qui est approprié pour la plupart des sphéroïdes préparés à l'aide de ces protocoles. - Tous les 2-3 jours (après l'acquisition d'images) remplacez 100 L de milieu (enlevez 100 L du milieu usé et remplacez-le par 100 L de milieu frais.
NOTE: Pour éviter d'enlever les sphéroïdes lors du remplacement du milieu, il est conseillé d'incliner un peu la plaque tout en enlevant lentement le milieu et d'inspecter le milieu aspiré dans les pointes pour les sphéroïdes visibles avant de le jeter.
- Formation de sphéroïde membrane-négociée reconstituée de sous-sol.
REMARQUE : La membrane reconstituée de membrane reconstituée de sous-sol reconstituée (rBM) de virus de croissance réduit de lactose de dehydrogenase (LDEV) a été employée. le rBM est sensible à la température et doit toujours être maintenu sur la glace, car il se remanie s'il atteint 15 oC. Décongeler le rBM sur la glace pendant la nuit à 4 oC ou 2 à 4 h à température ambiante (RT) avant de plafonner.- Dégel rBM sur glace (voir Tableau des matériaux).
- Conserver les plaques et les réservoirs (si emballés individuellement) sur la glace avant de les utiliser.
- Effectuer les étapes 1.1.1-1.1.4.
- Remplissez l'anneau extérieur des puits avec 1x PBS ou milieu de croissance pour réduire l'évaporation des puits restants. Diluer la suspension cellulaire dans un tube de 15 ml pour obtenir 0,5-2 x 104 cellules/mL (la densité cellulaire optimale doit être déterminée pour chaque lignée cellulaire) (Figure 1A (ii)).
- Placez le tube de 15 ml contenant la suspension de cellules diluées sur la glace (p. ex., dans un bécher en verre) (figure1A (iia)).
- Transférer les assiettes et les réservoirs réfrigérés dans le capot. Rincer les contenants en plastique, les remplir de glace et les transférer dans le capot pour permettre aux plaques et aux réservoirs d'être placés sur la glace pendant toute la procédure.
- Resuspendre le rBM doucement pour assurer un gel homogène.
- Ajouter 1 à 2 % de rBM (la concentration optimale doit être déterminée pour chaque lignée cellulaire) aux suspensions cellulaires réfrigérées (figure1A (iib)).
- Inverser le tube de 15 ml pour assurer le bon mélange de rBM et de suspension cellulaire avant de distribuer la suspension dans la plaque.
- Transférer la suspension cellulaire contenant du rBM dans un réservoir stérile et distribuer 200 L/puits dans des plaques de 96 puits à fixation ultra-faible réfrigérée à l'aide d'une pipette multicanal (figure1A (iii)).
NOTE: Si vous travaillez avec plusieurs suspensions cellulaires (p. ex., plus d'une lignée cellulaire), il est essentiel de distribuer chaque suspension cellulaire immédiatement après l'ajout de rBM pour éviter les gélifications prématurées. - Centrifuger la plaque pendant 15 min à 750 x g en utilisant 'soft décent' /pas de freinage (si possible, centrifugeuse à 4 oC pour maintenir le liquide rBM plus longtemps, mais pas une exigence pour la formation sphéroïde réussie), pour s'assurer que les cellules sont regroupées lorsque le rBM durcit, facilitant la formation d'un seul sphéroïde.
- Incuber la plaque dans un incubateur (37 oC, 5 % de CO2, 95 % d'humidité).
- Tous les 2-3 jours acquièrent des images microscopiques légères pour l'évaluation de la croissance sphéroïde.
- Tous les 2-3 jours remplacent 100 L de milieu (enlevez 100 L et remplacez-les par 100 L de milieu frais).
- Sphéroïdes suspendus.
- Effectuer l'étape 1.1.1-1.1.4.
- Diluer les cellules pour obtenir une dilution appropriée. Une dilution pratique est de 50 000 cellules/mL.
- Retirez le couvercle d'un plat de culture cellulaire de 10 cm2 et placez-le de sorte qu'il fait face vers le haut. Ajouter 6 mL de 1x PBS au plat (Figure 1B (i)).
- Verser la suspension cellulaire dans un réservoir stérile et placer soigneusement jusqu'à 30 gouttes de 40 L de suspension cellulaire sur le couvercle du plat de culture cellulaire à l'aide d'une pipette multicanal (figure1B (ii)), ce qui entraîne une concentration de 2 000 cellules/goutte. Évitez de placer les gouttes trop près du bord du couvercle, car ces gouttes sont plus susceptibles de perdre la tension de surface lors de l'inversion du couvercle dans l'étape suivante.
- Inverser le couvercle dans un mouvement rapide mais contrôlé et le placer sur le 1x PBS-contenant plat de culture cellulaire (Figure 1B (iii)).
- Placez le plat dans un incubateur à 37 oC avec 5 % de CO2 et 95 % d'humidité sans perturber les gouttes et laissez-les pousser pendant 4 à 6 jours.
- S'il doit être utilisé pour les lysates protéiques ou l'incorporation, mettre en commun les sphéroïdes en enlevant le couvercle et l'incliner, afin de laver les gouttes avec 1 ml de milieu chauffé. Transférer le milieu résultant contenant des sphéroïdes dans un tube de 1,5 ml et leur permettre de se déposer au fond du tube. Procédez comme décrit dans 4.4 et 6.2.2 pour les lysates de protéine et l'incorporation, respectivement.
2. Traitement médicamenteux des sphéroïdes
NOTE: Le traitement médicamenteux à long terme peut être appliqué aux sphéroïdes afin de dépister les effets d'un médicament d'intérêt. Avant de commencer le traitement médicamenteux, il est conseillé d'effectuer une expérience de réponse à la dose du médicament(s), afin de trouver une dose appropriée pour le traitement expérimental. Les doses doivent être basées sur l'IC50/Ki déterminé du médicament et vont d'environ 0,2x-10x de cette valeur.
- Mettre en place 6-12 sphéroïdes par condition désirée comme décrit dans 1.2 ou 1.3 et placer dans l'incubateur (37 'C, 5% CO2, 95% d'humidité) pendant 2 jours.
- Le jour 2, prenez des images microscopiques légères des sphéroïdes.
- Préparer les premières doses de traitement (après l'acquisition d'images).
NOTE: La première concentration de traitement doit être deux fois la concentration finale désirée car la solution sera diluée 1:2 à l'ajout du puits contenant 100 L de milieu. Intervalles suggérés de traitement de drogue (dépendra de la demi-vie de drogue) : Jour 2, 4 et 7. - À l'aide d'une pipette multicanal, retirer délicatement 100 L de moyenne et la remplacer par 100 L de drogue contenant du milieu.
- Remettre la plaque de 96 puits dans l'incubateur à 37 oC avec 5 % de CO2 et 95 % d'humidité et répéter 2,3 et 2,4 les jours choisis de traitement, mais maintenant sans doubler la dose pour obtenir une dose finale correcte.
- Le dernier jour du protocole/traitement, un ou plusieurs des essais suivants peuvent être effectués.
3. L'idée de viabilité cellulaire pour les sphéroïdes
- Mettre en place 4-6 sphéroïdes par condition désirée comme décrit dans 1.2 ou 1.3 et placer dans l'incubateur à 37 'C avec 5% co2 et 95% d'humidité.
NOTE: Dans ce cas, l'analyse de viabilité de cellules a été exécutée le jour 7 ou 9, après avoir surveillé la croissance sphéroïde tous les 2-3 jours par la microscopie légère comme décrit ci-dessus (point 1.2.5 et 1.3.13). - Décongeler le réactif d'analyse de viabilité (voir Tableau des matériaux) et laisser s'équilibérer à RT avant de l'utiliser.
- Mélanger délicatement en inversant pour obtenir une solution homogène.
- Avant d'effectuer l'échec, retirez 50 % du milieu de culture des sphéroïdes (100 L).
- Ajouter le réactif de viabilité cellulaire à chaque puits à un rapport de 1:3 par rapport à la quantité de moyenne présente dans le puits (figure 2A (i)) Pour une assiette de 96 puits, ajouter 50 L de réactif à 100 L de milieu.
- Mélanger vigoureusement le contenu pendant 5 min pour induire une lyse cellulaire (figure2A (ii)).
- Incuber pendant 25 min à RT pour stabiliser le signal luminescent (figure2A (iii)).
- Enregistrez le signal luminescent (figure2A (iv)).
4. Préparation de lysates protéiques pour les ballonnements occidentaux des cultures sphéroïdes 3D
NOTE: Lors de la collecte des sphéroïdes, il est conseillé d'utiliser une pipette P200 et couper l'extrémité de la pointe pour permettre une plus grande ouverture et donc une capture plus facile des sphéroïdes sans perturber leur structure.
- Pour chaque condition, mettre en commun un minimum de 12, idéalement 18-24 sphéroïdes (selon la taille sphéroïde) dans un tube de 1,5 ml (éviter 2 tubes ml, que les prochaines étapes deviendront plus difficiles en raison de leur fond moins pointu).
NOTE: Si la quantité de milieu dépasse 1,5 ml avant d'avoir recueilli tous les sphéroïdes, permettre aux sphéroïdes collectés de s'installer au fond (se produit très rapidement, centrifugation pas nécessaire) et jeter la moitié du volume du tube avant de continuer à recueillir le sphéroïdes restants. - Placer les tubes sur la glace et permettre aux sphéroïdes de s'installer au fond du tube de 1,5 ml.
- Déplacez-vous du laboratoire de cellules stériles au laboratoire régulier.
- Laver les sphéroïdes deux fois dans 1 mL de glace-froid 1x PBS. Laisser les sphéroïdes se déposer avant d'enlever 1x PBS entre chaque étape de lavage.
- Aspirer autant 1x PBS que possible sans déranger ou enlever les sphéroïdes.
- Ajouter 5 l de tampon de lyse chauffée (LB) avec des inhibiteurs de la phosphatase et de la protéase, par sphéroïde (p. ex., 10 sphéroïdes de 50 LB).
- Répétez les intervalles de vortex suivis d'une rotation vers le bas jusqu'à ce que les sphéroïdes soient dissous. Effectuer un cycle de vortex pour 30 s suivi d'une centrifugation (une rotation rapide à l'aide d'une centrifugeuse de table est suffisante) pendant 10 s pour environ 5-10 min selon la taille et la compacité des sphéroïdes.
NOTE: Le protocole peut être mis en pause ici. Maintenez les lysates à -20 oC jusqu'à ce qu'ils procèdent à la sonication, à l'homogénéisation et à la détermination des protéines, comme dans un protocole standard de lysate protéique 2D, suivi d'un ballonnement occidental à l'aide de protocoles standard.
5. Propidium Iodide (PI) Teinture des sphéroïdes
- Mettre en place 3-6 sphéroïdes par condition désirée comme décrit dans 1.2 ou 1.3 et placer dans l'incubateur à 37 'C avec 5% co2 et 95% d'humidité.
- Dans un laboratoire de culture cellulaire stérile, chauffer 1x PBS à 37 oC.
- Faire une solution PI de 4 M en diluant la solution de stock en 1x PBS: Diluer un 1 mg/mL stock aqueux de PI 1:350 en 1x PBS.
NOTE: Cette concentration sera encore réduite de moitié à l'ajout de la solution aux puits, ce qui donnera une concentration finale de 2 M. 100 L de cette solution est nécessaire pour chaque puits contenant un sphéroïde.
ATTENTION: L'iodure de propidium (PI) doit être manipulée dans une hotte de fumée et porter des gants. PI est sensible à la lumière. Protégez-vous de la lumière lors de la manipulation. - Retirez 100 L du milieu de chaque puits dans la plaque de 96 puits sans enlever les sphéroïdes.
- Laver le milieu restant en ajoutant 100 L de 1x PBS chauffé à tous les puits, puis en enlevant 100 l de liquide dans les puits. Répétez cette étape de lavage 3 fois.
- Ajoutez 100 L de la solution PI à chaque puits, couvrez la plaque dans du papier d'aluminium et placez-la dans un incubateur à 37 oC avec 5 % de CO2 et 95 % d'humidité pendant 10 à 15 min.
- Répétez les 3 étapes de lavage décrites dans 4.5 pour laver la solution PI, afin de diminuer le signal de fond lors de l'imagerie.
- Utilisez un microscope à épifluorescence pour imager les sphéroïdes. Pour évaluer la viabilité des cellules dans le noyau sphéroïde prendre z-piles pour obtenir des images avec des profondeurs variables du sphéroïde.
NOTE: Une taille d'étape autour de 18-35 m entre chaque tranche en fonction de la taille sphéroïde est conseillé, donnant environ 11-18 piles par sphéroïde. Les piles Z peuvent être traitées dans ImageJ à l'aide de la fonction z-projection, qui peut combiner toutes les piles z en une seule image finale, donnant un aperçu de la coloration tout au long du sphéroïde (pour d'autres lignes directrices sur l'utilisation d'ImageJ à cette fin, voir (https://imagej.net/Z-functions).
6. Intégration de sphéroïdes 3D
-
Préparer le gel d'agarose dans lequel les sphéroïdes sont incorporés (seulement nécessaire première fois l'exécution du protocole).
- Mélanger 1 g de bactoagar en 50 mL de ddH2O.
- Chauffer lentement dans le four à micro-ondes jusqu'à ce que le bactoagar soit dissous et qu'un gel homogène se forme. Ne laissez pas bouillir le gel.
- Garder le bactoagar au chaud dans un bain d'eau à 60 oC.
- Conserver à 4 oC entre les expériences.
-
L'intégration des sphéroïdes.
- Le jour 1, pour chaque condition, mettre en commun un minimum de 12 sphéroïdes dans un tube de 1,5 ml.
- Laver une fois avec 1 mL de glace 1x PBS.
- Pour fixer les sphéroïdes, ajouter 1 ml de paraformaldéhyde de 4%.
NOTE: La manipulation du paraformaldéhyde doit être effectuée dans une hotte de fumée. - Laissez-les incuber pendant 24 h à RT.
- Le jour 2, chauffer soigneusement le gel d'agarose en le plaçant dans un bécher rempli d'eau dans un four à micro-ondes. Assurez-vous que le gel ne bout pas! Garder au chaud dans une plaque chauffante sur le banc, à 60 oC jusqu'à l'utilisation.
- Laver les sphéroïdes deux fois avec 1 mL de glace 1x PBS.
- Aspirer la plupart des 1x PBS (laisser environ 100 L à ce stade est pratique pour la manipulation des sphéroïdes).
- Préparer une pipette de 20 L en coupant la pointe de la pipette à une inclinaison pour obtenir une pointe plus pointu avec un trou plus grand (voir illustration).
NOTE: La partie suivante doit être faite rapidement pour assurer le transfert sphéroïde optimal et pour éviter la solidification de la goutte de gel. Si aucun bloc chauffant n'est disponible, il est recommandé d'attraper d'abord les sphéroïdes, puis de faire tomber l'agarose (c.-à-d., changer l'ordre des points 6.2.9 et 6.2.10). - Faire tomber un gel d'agarose sur une lame de microscope. Placez la glissière sur un bloc chauffant chaud pour empêcher l'agarose de se solidifier.
- À l'aide de la pointe de pipette modifiée (voir 6.2.8), attraper autant de sphéroïdes que possible dans un volume de 15-20 L.
- Injecter soigneusement le 1x PBS contenant 1x de sphéroïde de 15-20 l au centre de la goutte de gel d'agarose sans toucher la lame du microscope.
NOTE: C'est un point un peu difficile. Les sphéroïdes seront perdus si la pointe de pipette touche la glissière du microscope lors de l'injection des sphéroïdes dans la goutte de gel. Il est conseillé de pratiquer tout le processus de faire tomber l'agarose et d'injecter les sphéroïdes en injectant un liquide coloré dans la goutte. Cela permettra de visualiser une pénétration potentielle à travers la goutte, car le liquide coloré s'échappera sur la glissière. - Laisser le gel d'agarose durcir en couvant de 5 à 10 min à RT ou à 4 oC. Une fois que la goutte de gel s'est solidifiée un peu (mais est encore assez doux), poussez soigneusement la goutte de gel de la diapositive de microscope dans une cassette de tissu plastique avec un scalpel.
- Couvrez les cassettes de tissu plastique dans 70% d'éthanol.
NOTE: À ce stade, les sphéroïdes peuvent être utilisés directement ou stockés pendant des mois. - Incorporer le sphéroïde anéroïde dans la paraffine, section dans 2-3 diapositives de couche épaisse de 2-3 m et tache avec l'hématoxylin et l'éosine ou sujet à la coloration immuno-histologique.
Résultats
Les essais de croissance sphéroïdes basés sur le protocole de formation sphéroïde schématiquement illustré dans la figure 1A et la figure 1B, ont été utilisés comme point de départ pour l'analyse des effets des traitements anticancéreux dans une tumeur 3D imitant le réglage. La facilité avec laquelle les sphéroïdes sont formés est spécifique à la lignée cellulaire, et certaines lignées cellulaires nécessitent une supplémentation avec rBM afin de former des sphéroïdes cohérents22. La concentration de rBM ajouté peut profondément affecter la morphologie des sphéroïdes. Comme le montrent les chiffres 1C et 1D,la variation de la concentration de rBM entre 0 et 4 % modifie la compacité et la morphologie des sphéroïdes d'une manière dépendante du type cellulaire. Figure 1 C démontre comment l'ajout de jusqu'à 2,5% rBM permet la formation de sphéroïdes dans les cellules cancéreuses du sein SKBr-3, sans autre effet à des concentrations supérieures à 2,5% rBM. En revanche, les cellules de l'adénocarcinome canalaire pancréatique BxPC3 (PDAC), qui présentent une morphologie épithéliale, forment spontanément de petits sphéroïdes compacts (figure1D, panneau supérieur et gauche). Dans ce type de cellule, l'augmentation de la concentration de rBM à 1,5% ou plus provoque un changement morphologique distinct de sphéroïde à des structures plus alambiquées avec des protrusions et des invaginations, qui rappellent la formation de structure tubulaire canalaire. Inversement, l'ajout de rBM à deux autres lignées cellulaires PDAC, MiaPaCa et Panc-1, qui ont un phénotype plus mésenchymal, permet aux agrégats cellulaires lâches de devenir plus serrés et de former des sphéroïdes plus compacts (figure1D, moyen et inférieur panneaux). Ces résultats montrent que la quantité précise de rBM résultant de la formation optimale de sphéroïdes doit être titrée pour chaque ligne et condition cellulaire.
Une évaluation quantitative de la viabilité cellulaire dans les sphéroïdes sur le traitement de drogue était nécessaire pour évaluer l'effet des traitements anticancéreux de drogue. L'analyste décrit ici est un soudà à base de luciférane-luciferase, qui mesure l'ATP libéré des cellules vivantes dans les sphéroïdes. Le principe de l'essai est illustré dans la figure 2A. Le signal luminescent généré dans cet analyse est facilement enregistré par un lecteur de plaques (figure 2A) et correspond bien à la viabilité mesurée par d'autres méthodes23. La relation linéaire entre la concentration d'ATP et la luminescence dans la plage de concentration pertinente est indiquée dans la figure 2B, tandis que la figure 2C montre la capacité de l'analyse d'évaluer la mort cellulaire chez les sphéroïdes 3D traités par traitement anticancéreux. Afin d'évaluer davantage la linéarité de l'analyse dans la gamme pertinente, des expériences visant à établir des courbes standard du signal luminescent en fonction du nombre de cellules ont été menées (figure2D et figure 2E ). Ces résultats indiquent que l'analyse est appropriée pour estimer la viabilité cellulaire dans les cultures sphéroïdes 3D et qu'il est applicable pour étudier la perte induite par la drogue de la viabilité cellulaire.
Une combinaison d'images microscopiques légères acquises tous les deux à trois jours, au cours de la période de traitement et une évaluation quantitative finale de la viabilité cellulaire permet une surveillance étroite de la croissance et de la morphologie des sphéroïdes ainsi que l'évaluation du traitement optimal dose. Ce dernier est illustré dans la figure 3A et la figure 3B, où une expérience dose-réponse a été effectuée pour déterminer la dose nécessaire pour réduire de 50 % la viabilité cellulaire chez les sphéroïdes du cancer du sein MDA-MB-231. Les effets du traitement sur la morphologie sphéroïde sont visualisés dans les sphéroïdes de la figure 3C et 3 D pour les sphéroïdes MDA-MB-231 et MCF-7, respectivement. Pendant le traitement avec le cocktail chimiothérapeutique choisi, la compacité des sphéroïdes MDA-MB-231 augmente, tandis que pendant le traitement avec le tamoxifène, les sphéroïdes MCF-7 deviennent de plus en plus effilochés et inégaux. Dans les deux cas, une nette baisse de la viabilité cellulaire est visible après 7 jours (MDA-MB-231) ou 9 (MCF-7) (figure3E et figure 3F). Ceci démontre la nécessité d'une évaluation visuelle et quantitative des effets thérapeutiques sur la viabilité et la morphologie des cellules sphéroïdes, ainsi que du fait que ces paramètres sont très spécifiques aux cellules et au traitement.
En complément de l'examen de viabilité cellulaire, la coloration des cellules mortes avec pi, qui ne peut pas traverser la membrane et donc seulement les taches nécrotiques ou les cellules apoptotiques tardives avec l'intégrité de membrane compromise, permet une évaluation spatiale rapide des cellules mortes dans traitement, sans le protocole fastidieux d'intégration, de sectionnement et de CSI. Comme l'illustre la figure 4A, l'arrangement spatial des cellules mortes sur une concentration croissante d'un inhibiteur, dans ce cas, l'inhibiteur Na/H-1 (NHE1) 5-(N-ethyl-N-isopropyl)-amiloride (EIPA), peut être Visualisé. Comme on l'a vu, les sphéroïdes témoins montrent un noyau nécrotique/apoptotique tardif limité, tandis que les cellules mortes sont réparties dans tout le sphéroïde à mesure que la concentration de l'EIPA augmente.
Afin de quantifier l'induction relative du stress apoptotic suivant différents traitements, les sphéroïdes ont été lysed et soumis à l'électrophorèse de gel de SDS-PAGE et au ballonnement occidental pour la polytéase pleine longueur et clivée de polytée (PARP). Les résultats représentatifs sont indiqués aux chiffres 4B et 4C. Dans cette expérience, des sphéroïdes ont été préparés à partir de cellules MDA-MB-231 dans lesquelles le cotransporteur de lactate-proton MCT4 ou le Na,HCO3- cotransporteur NBCn1 ont été renversés à l'aide de siRNA. Le renversement a été évalué par l'ouest de l'aloudage pour MCT4 et NBCn1 (données non publiées). Comme on l'a vu, le knockdown de MCT4, mais pas de NBCn1, augmente robustement le clivage de PARP, compatible avec notre démonstration précédente que le renversement stable de MCT4 dans les cellules de MDA-MB-231 diminue la croissance de tumeur in vivo24.
Pour analyser davantage les effets du traitement et obtenir des informations sur la signalisation spécifique, l'arrêt de la croissance et les voies de décès activées, les sphéroïdes peuvent en plus de l'analyse de tache occidentale être intégré et soumis à l'analyse immunohistochemistry (IHC). L'analyse iHC des sections sphéroïdes permet l'utilisation d'anticorps ou de marqueurs spécifiques de la prolifération cellulaire, du cycle cellulaire et de la mort cellulaire programmée, et facilite la visualisation de l'arrangement spatial des cellules proliphétiques et apoptotiques dans le sphéroïde.
Une figure schématique du protocole d'intégration pour l'analyse IHC des sphéroïdes est présentée dans la figure 5A. Une image microscopique lumineuse représentative d'une section microtome épaisse d'environ 3 m d'épaisseur d'un sphéroïde incorporé est montrée dans la figure 5B,et une image d'immunofluorescence d'un sphéroïde taché pour la protéine suppressrice de tumeur p53 (noyaux tachés à l'aide DAPI), est représenté comme figure 5C. Des exemples de Sphéroïdes traités par chimiothérapie et DMSO tachés pour le marqueur de prolifération cellulaire Ki-67 ou pour p53 sont présentés respectivement à la figure 5D et à la figure 5E. Conformément à l'effet antiprolifératif du traitement chimiothérapeutique, le nombre de cellules positives Ki-67 est plus élevé dans le contrôle de DMSO que dans le sphéroïde traité par chimiothérapie (figure 5D). En revanche, l'expression p53 est augmentée pendant des conditions de stress cellulaire, d'apoptose et d'arrêt de croissance, et par conséquent, le nombre de cellules p53-souillées est sensiblement plus élevé dans les sphéroïdes chimiothérapie-traités comparés aux contrôles de DMSO (figure5 E).
Ces résultats illustrent des exemples de la façon dont l'information spatialement résolue (coloration de PI, IHC) ou quantitative (blotting occidental) sur des effets de traitement de drogue dans les sphéroïdes 3D peut être obtenue.
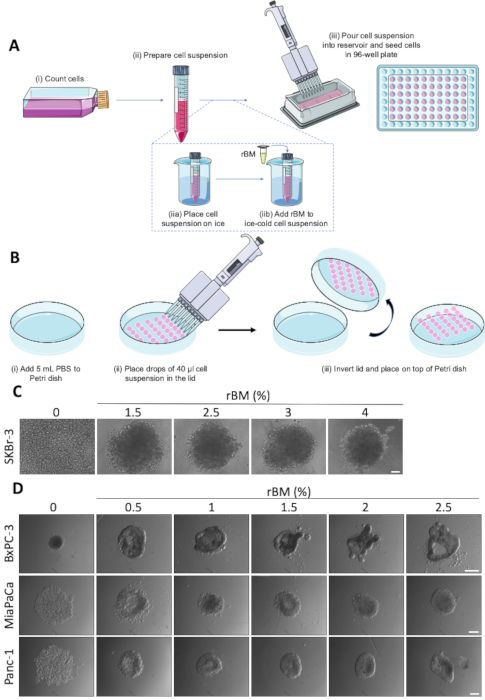
Figure 1 : Formation spontanée et rBM-négociée de sphéroïde. (A) Représentation schématique de la formation de sphéroïdes à l'aide de plaques de fond rondes ultra-faibles de 96 puits, avec utilisation facultative de rBM. Étapes individuelles marquées par (i-iii). (B) Représentation schématique de la formation de sphéroïdes à l'aide de la méthode de goutte suspendue. Les étapes individuelles sont marquées par (i-iii) (C) Images représentatives de la formation de sphéroïdes à médiation rBM des cellules SKBr-3. Les cellules ont été ensemoir dans l'attachement ultra-faible 96-puits des plaques rondes de fond avec des concentrations croissantes de rBM et cultivées pendant 9 jours. Barre d'échelle de 100 m. (n-3). (D) Images représentatives des cellules BxPC-3, MiaPaCa et Panc-1 ensemencées pour la formation de sphéroïdes dans des plaques de fond rondes ultra-faibles de 96 puits avec des concentrations de rBM de 0,5 à 2,5 %. Les sphéroïdes ont été cultivés pendant 4 jours. Barre d'échelle de 250 m. (n-3). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
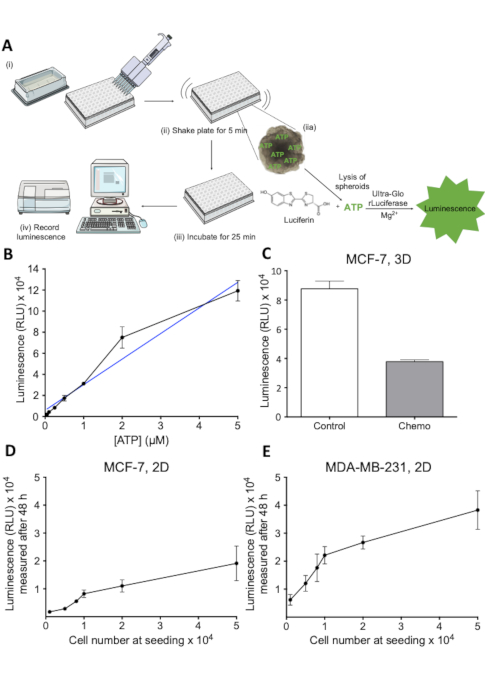
Figure 2 : Principe et évaluation de l'examen de viabilité de la cellule. (A) Représentation schématique de l'hypothèse de viabilité des cellules 3D. Étapes individuelles dénotées par (i-iv). (B) Signal luminescent en fonction de la concentration D'ATP. Les dilutions de l'ATP ont été plaquées dans une plaque de 96 puits et un réactif de viabilité cellulaire ajoutéà chaque puits. Luminescence a été enregistrée après 30 min à 405 nm. 1 n. (C) Viabilité, mesurée sous forme de luminescence, de sphéroïdes MCF-7 témoins et traités par chimiothérapie. Les cellules de MCF-7 ont été ensemoiuses dans des plaques rondes de fixation ultra-bas et ont été cultivées pendant 7 jours. Le traitement de chimiothérapie (5 Cisplatin de M, 5 'M Doxorubicin et 30 nM 5-FU) a été appliqué le jour 2 et 4. Les barres représentent des valeurs moyennes avec Le signal Luminescent SD. 1 n. (D) en fonction du nombre de cellules MCF-7 ensemoiuses. Les cellules de MCF-7 ont été ensemoiuses dans 96 plaques de puits au nombre de cellules indiqué et ont permis de se développer pendant 48 h, après quoi la viabilité de cellules a été mesurée. Les barres d'erreur représentent SD. 1 n. (E) Tel que décrit dans D pour les cellules MDA-MB-231. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
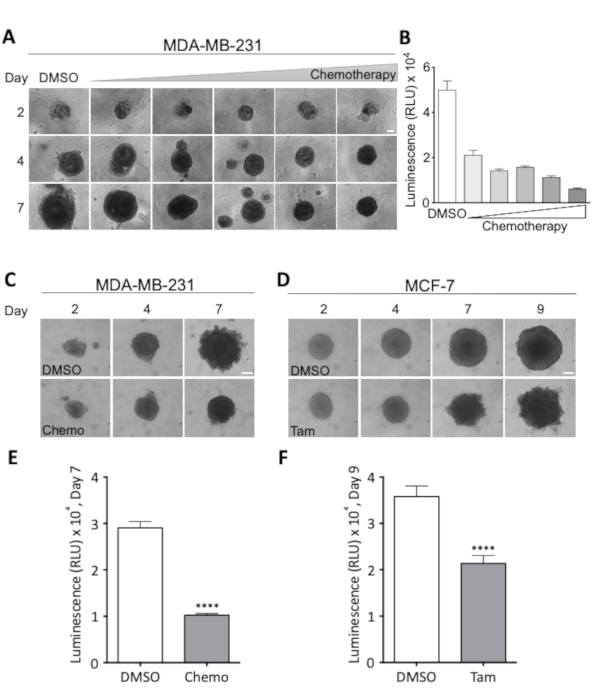
Figure 3 : Effets des schémas thérapeutiques sur la morphologie sphéroïde et la viabilité cellulaire. (A) Images représentatives de Sphéroïdes MDA-MB-231 les jours 2, 4 et 7. Les cellules MDA-MB-231 ont été ensemoir dans des plaques rondes de 96 puits de fixation ultra-faible. Le traitement avec des doses croissantes de chimiothérapie a été commencé le jour 2, auquel temps tous les sphéroïdes étaient de taille semblable. Les lignes montrent des sphéroïdes à des doses croissantes de chimiothérapie, et les colonnes montrent des sphéroïdes représentatifs de la taille au jour 2, 4, et 7 à la dose indiquée. La dose la plus faible était de 18,75 nM Cisplatin, 18,75 nM Doxorubicin, 0,0625 nM 5-Fluorouracil (5-FU) et cette dose a été doublée pour chaque image montrée, résultant en une dose maximale de 0,3 M Cisplatin, 0,3 M Doxorubiin et 2 nM 5-FU. Barre d'échelle de 100 m. (2 n). (B) Viabilité des sphéroïdes MDA-MB-231, mesurés sous forme de luminescence, après 7 jours de traitement chimiothérapeutique. Les barres représentent des valeurs moyennes avec SEM. 2 n. (C,D) Images représentatives de MDA-MB-231 (C) et MCF-7 sphéroïdes (D) le jour 2, 4, 7 et pour MCF-7 sphéroïdes 9. Cellules ensemoir comme dans (A) et traitées avec soit la chimiothérapie (Chemo, 18,75 nM Cisplatin, 18,75 nM Doxorubicin, 0,0625 nM 5-FU) le jour 2 et 4 (C) ou avec 2 M Tamoxifen (Tam) le jour 2, 4 et 7 (D). Barre d'échelle de 100 m. (4 n et 3 n), respectivement. (E,F) Viabilité, mesurée sous forme de luminescence, le jour 7 et 9 pour (C) et (D), respectivement. Pour vérifier la différence statistiquement significative entre les conditions, un test t de l'étudiant non apparié a été effectué. dénote p et lt; 0,0001. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Coloration d'iodure de Propidium et analyse occidentale de tache des sphéroïdes. (A) Images représentatives des sphéroïdes MCF-7 tachés de PI après 9 jours de traitement. Les cellules MCF-7 ont été ensemoiuses dans des plaques de 96 puits à fixation ultra-faible cultivées pendant 9 jours et traitées avec des concentrations croissantes d'EIPA les jours 2, 4 et 7. Le jour 9, les sphéroïdes ont été tachés avec PI et des images ont été acquises sur un microscope d'épifluorescence. Barre d'échelle de 200 m. (1 n.) (B) Les taches occidentales représentatives des cellules MDA-MB-231 après kok/knockdown des transporteurs acide-base. NHE1 a été assommé par CRISPR/Cas9 dans les cellules MDA-MB-231 12 et les cellules ont ensuite été transcendées par transitoire avec siRNA contre MCT4 ou NBCn1, et cultivées sous forme de sphéroïdes pendant 9 jours avant d'être lysées et soumises à des ballonnements occidentaux à l'aide d'un anticorps reconnaissance totale et clivée (c)PARP. (C) Quantification du rapport entre le niveau de protéine parPA et le niveau de protéine PARP, normalisé au contrôle de chargement (-actin). (1 n). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
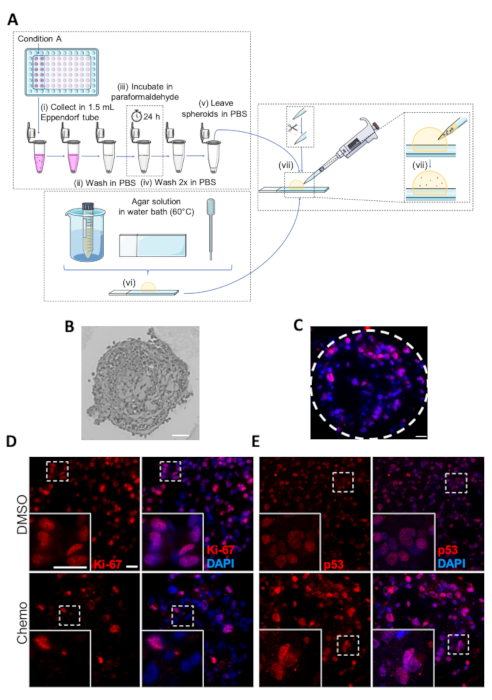
Figure 5 : Fixation, intégration et immunohistochimie des sphéroïdes. (A) Représentation schématique du protocole d'intégration des sphéroïdes. Les étapes individuelles sont marquées comme (i-vii). (B) Image de Sphéroïde MDA-MB-231 intégré. Échelle : 50 m. (C) Image représentative du sphéroïde MDA-MB-231 traité par chimiothérapie soumis à l'analyse du CSI avec des anticorps contre p-53. Les lignes pointillées montrent la circonférence du sphéroïde. Échelle de 20 m. (D,E) Images représentatives de DMSO- ou chimiothérapie traitées (panneaux supérieurs et inférieurs, respectivement) MDA-MB-231 sphéroïdes. Les cellules De MDA-MB-231 ont été ensemoir dans des plaques de 96 puits d'attachement ultra-faible, cultivées pendant 7 jours et traitées par chimiothérapie le jour 2 et 4. Le jour 7, les sphéroïdes ont été incorporés suivis par l'analyse par IHC avec des anticorps primaires contre Ki-67 (D) et p53 (E). Les boîtes blanches représentent les images de zoom. Barre d'échelle de 20 m dans les deux grossissements( n'est pas 3). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
L'utilisation des sphéroïdes de cellules cancéreuses 3D s'est avérée un outil valable et polyvalent non seulement pour le criblage de drogue anticancéreux, mais également pour gagner la perspicacité mécaniste dans la régulation de la mort et de la viabilité de cellules cancéreuses dans des conditions imitant ceux dans la tumeur microenvironnement. Ceci est particulièrement crucial car l'accessibilité, l'utilisation cellulaire, et les effets intracellulaires des drogues chimiothérapeutiques sont profondément impactés par les conditions physico-chimiques dans la tumeur, y compris le pH, la tension d'oxygène, la tortuosité, et physique et interactions cellulaires chimiques9,17. Par exemple, l'acidité du pH extracellulaire, qui peut atteindre des valeurs aussi basses que 6-6.5 dans beaucoup de tumeurs pleines25,26,27,28,29, cause la chimiothérapeutique faiblement de base composés, tels que la doxorubicine, la mitoxantrone et le zwitterion paclitaxel, à charge. Cela réduit leur prise dans les cellules tumorales et peut influencer l'activité des protéines de résistance multidrogue telles que la p-glycoprotéine30,31,32. Aussi la prolifération cellulaire, qui est essentiel à l'effet de la plupart des composés chimiothérapeutiques, est généralement réduite en 3D par rapport aux conditions 2D et est donc probablement mieux imité dans les sphéroïdes tumoraux que dans la culture cellulaire 2D8,33 ,34. Enfin, le microenvironnement dense de tumeur est l'origine de nombreux indices physiques et solubles de signalisation dirigeant les voies intracellulaires de signalisation régulant la croissance, la survie et la mort cellulaires. Ainsi, lors de l'analyse de l'efficacité des médicaments, les systèmes de culture 3D sont une étape charnière avant de se lancer dans des modèles in vivo. Un inconvénient majeur de la culture 3D est, cependant, la complexité accrue de l'analyse par rapport à celle de la culture 2D. Nous avons décrit ici des techniques simples et relativement peu coûteuses pour la formation de sphéroïdes en utilisant une variété de types de cellules cancéreuses. Nous avons montré des exemples de la façon dont la formation de sphéroïdes doit être optimisée pour chaque type de cellule étudié et avons décrit comment obtenir des données quantitatives sur la viabilité cellulaire, la mort cellulaire, et les voies de signalisation associées, dans ces sphéroïdes. Il n'y a pas de différences évidentes de croissance ou de morphologie entre les trois modèles décrits ici. Dans nos mains, la variation de la morphologie peut être légèrement plus grande en utilisant la méthode de goutte suspendue, pourtant un avantage de cette méthode est que rBM n'est pas nécessaire. Nous nous sommes concentrés ici sur les sphéroïdes produits à partir d'un seul type de cellules cancéreuses. Le modèle sphéroïde est, cependant, également favorable à la co-culture, par exemple des cellules cancéreuses avec des fibroblastes, des monocytes/macrophages, des cellules endothéliales, et/ou des adipocytes35,36,37. D'autres applications avancées de ce modèle incluent la combinaison avec les dispositifs fluides imprimés 3D permettant le dosage par une membrane semi-perméable, suivie de la récolte pour le profilage protéomique quantitatif38.
Alors que, comme indiqué ci-dessus, le phénotype des cellules cultivées en sphéroïdes 3D imite généralement celle des tumeurs in vivo beaucoup mieux que les cellules cultivées en 2D, la mesure dans laquelle ces sphéroïdes sont en fait des modèles pertinents des tumeurs in vivo correspondantes dépend de nombreux facteurs et doit être soigneusement évalué. Les paramètres qui auront un impact sur la façon dont ces sphéroïdes imitent l'état in vivo comprennent la composition cellulaire de la tumeur et sa composition relative ECM. Par exemple, le rBM que nous avons employé comme ECM dans les protocoles fournis ici est un bon choix pour imiter les premiers stades des cancers épithélial, autour du moment de la rupture de la membrane de sous-sol, d'autres compositions d'ECM seront plus pertinentes pour certaines tumeurs types et -étapes. En outre, la capacité d'adhérence cellulaire diffère considérablement entre les lignées cellulaires cancéreuses, en fonction de leur expression des protéines d'adhérence à cellule cellulaire et à la matrice cellulaire telles que les cadhérines et les intégrines22.
Comme décrit ici, la croissance et la morphologie sphéroïdes peuvent facilement et non-invasivement être surveillés tous les 2-3 jours à l'aide d'un microscope léger avec optique de grossissement faible et un grand champ de vision. Cependant, parce que le stress cytotoxique, tel que le traitement de chimiothérapie, affecte la morphologie sphéroïde très différemment et, d'une manière, selon le type de cellule et le régime de traitement, il ne suffit pas de compter sur la morphologie et la circonférence seule pour évaluer l'effet de traitement. Par exemple, les sphéroïdes peuvent devenir plus lâches avec le traitement et la mort cellulaire émergente, ou toute la mort peut se produire dans le noyau nécrotique, tandis que la surface n'est pas affectée de façon détectable. Dans les deux cas, le résultat peut être une impression erronée que le nombre de cellules vivantes dans le sphéroïde n'est pas réduit par le traitement. Les techniques quantitatives et sphéroïdes sont donc essentielles pour évaluer l'effet du traitement. Pour l'évaluation quantitative de la mort cellulaire, l'essai acide de phosphatase, qui comme son nom l'indique mesure l'activité de l'acide cytosolique phosphatase a été employé21. Cependant, dans nos mains, bien que cet analyse reflète généralement bien le nombre de cellules ensedites, il ne capture pas adéquatement la mort cellulaire rapide induite par le traitement (données non montrées), probablement parce que la phosphatase acide reste active pendant un certain temps après la mort cellulaire. En outre, cet analyse nécessite l'ablation complète du milieu, ce qui augmente l'erreur en particulier avec les sphéroïdes fragiles, traités par chimiothérapie. L'analyse de viabilité cellulaire décrite ici, qui est basée sur le contenu cellulaire d'ATP, a été choisie basée sur son protocole simple et efficace de temps et la reproductibilité élevée. En outre, cet assermentation ne nécessite pas l'élimination complète du milieu de culture qui est un avantage lorsque vous travaillez avec des sphéroïdes. Comme le montrent les résultats représentatifs, cet analyse capture bien à la fois le nombre de cellules et les effets attendus du traitement de chimiothérapie. Cependant, un piège de cette technique est, évidemment, que les changements métaboliques réduisant le contenu intracellulaire d'ATP peuvent erronément être enregistrés comme nombre inférieur de cellules. Par conséquent, l'évaluation parallèle du volume et de la morphologie sphéroïdes, ou coloration de PI, est conseillée pour valider des résultats.
La lyse sphéroïde suivie du ballonnement occidental peut fournir un aperçu semi-quantitatif de l'état des processus de signalisation, de la mort cellulaire, de la croissance et des voies de viabilité. L'utilisation du ballonnement occidental est compliquée quand rBM est employé pour préparer les sphéroïdes, puisque ceci comprendra une fraction substantielle de la teneur en protéine de lysate, et plus important encore, sa contribution fractionnaire augmentera avec la diminution du contenu cellulaire pendant la mort chimiothérapeutique de cellules. Il est en principe possible d'enlever le rBM par centrifugation; cependant, il s'agit d'une étape critique, car il est difficile d'éliminer complètement tous les rBM, ce qui empêchera la comparaison quantitative entre les conditions. Pour ces sphéroïdes, et en général pour l'évaluation spatialement résolue des voies de décès et des paramètres de signalisation pertinents, l'intégration et le CSI sont des outils solides. D'autres approches peuvent être envisagées : imagerie confocale vivante des sphéroïdes intacts (relativement petits)39. Une autre propriété intéressante des sphéroïdes est que, compte tenu de leur forme plutôt régulière "boule", ils se prêtent bien à l'itération entre la modélisation mathématique et les expériences de laboratoire humide, pour augmenter la compréhension de l'importance de la ci-dessus gradients d'oxygène, de pH et de nutriments dans les sphéroïdes, et, par extrapolation, tumeurs40,41. Ainsi, bien que d'importants modèles tumoraux 3D d'une complexité beaucoup plus grande émergent, y compris un large éventail de cultures organotypic et organoïdes basées sur des échafaudages biologiques complexes ainsi que des échafaudages inertes, et, non des moindres, des xénogreffes dérivées du patient42, Les sphéroïdes restent un outil important en raison de leur pertinence biologique supérieure par rapport à la culture 2D, combinée avec la facilité relative de manipulation.
En résumé, nous présentons ici une série de méthodes simples pour l'analyse des changements induits par le traitement anticancéreux dans la viabilité des cellules cancéreuses et la mort dans la culture 3D. La composition des sphéroïdes peut être modifiée en fonction des propriétés et de la biologie des cellules employées, et les analyses quantitatives et qualitatives présentées sont utiles à la fois pour évaluer les relations dose-réponse et pour mieux comprendre la voies de signalisation et de mort en cause.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts.
Remerciements
Nous sommes reconnaissants à Katrine Franklin Mark et Annette Bartels pour l'excellente assistance technique et à Asbjarn N'hr-Nielsen pour l'exécution des expériences dans figure 1D. Ce travail a été financé par la Fondation Einar Willumsen, la Fondation Novo Nordisk et la Fondation Juchum (tous à SFP).
matériels
| Name | Company | Catalog Number | Comments |
| 2-(4-amidinophenyl)-1H-indole-6-carboxamidine (DAPI) | Invitrogen | # C10595 | For staining nuclei |
| 5-Fluorouracil (5-FU) | Sigma-Aldrich | #F6627 | Component in chemotherapeutic treatment |
| 5-(N-ethyl-isopropyl) amiloride (EIPA) | Life Technologies | #E3111 | Inhibitor of NHE1 |
| Antibody against PARP and cPARP | Cell signaling | #9542 | Used in western blotting |
| Antibody against Ki-67 | Cell signaling | #9449 | Used for IHC |
| Antibody against p53 | Cell Signaling | #2524 | Used for IHC |
| Antibody against β-actin | Sigma | A5441 | Used in western blotting |
| Bactoagar | BD Bioscience | #214010 | Used for agarose gel preparation |
| Benchmark protein ladder | Invitrogen | #10747-012 | Used for SDS-PAGE |
| Bio-Rad DC Protein Assay kit | Bio-Rad Laboratories | #500-0113, #500-0114, #500-0115 | Used for protein determination from lysates |
| Bürker chamber | Marienfeld | 610311 | For cell counting |
| BX63 epifluoresence microscope | Olympus | Used for fluorescent imaging | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | #G9681 | Used for the cell viability assay |
| Cisplatin | Sigma-Aldrich | #P4394 | Component in chemotherapeutic treatment |
| Corning Spheroid Microplate, 96 well, Black with clear round bottom, Ultra-low attachment, With lid, Sterile | Corning | #4520 | Used for growing spheroids with luminescence measurements as end point |
| Corning 96 well, clear round bottom, Ultra-low attachment microplate, With lid, Sterile | Corning | #7007 | Sufficient for spheroid growth without luminescence measurements as end point |
| Criterion TGX Precast Gels | Bio-Rad | 5671025 | Used for SDS-PAGE |
| Doxorubicin | Abcam | #120629 | Component in chemotherapeutic treatment |
| FLUOStar Optima Microplate reader | BMG Labtech | Used for recording luminescence | |
| Formaldehyde | VWR Chemicals | #9713.1000 | Used for cell fixation |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Gibco | #A1413202 | Keep at 4 °C to prevent solidification. Referred to as rBM in the protocol. |
| Heat-inactivated FBS | Sigma | #F9665 | Serum for growth media |
| ImageJ | NIH | Scientific Image analysis | |
| Medim Uni-safe casette | Medim Histotechnologie | 10-0114 | Used for storage of embedded spheroids |
| Mini protease inhibitor cocktail tablets | Roche Diagnostics GmBH | # 11836153001 | Used for lysis buffer preparation |
| MZ16 microscope | Leica | Used for light microscopic images | |
| NuPAGE LDS 4x Sample Buffer | Invitrogen | #NP0007 | Used for western blotting |
| Pierce ECL Western blotting substrate | Thermo scientific | #32106 | Used for western blotting |
| Ponceau S | Sigma-Aldrich | #P7170-1L | Used for protein band staining |
| Prism 6.0 | Graphpad | Scientific graphing and statistical software | |
| Propidium iodide (1mg/ml solution in water) | Invitrogen | P3566 | Light sensitive |
| Sterile reservoirs, multichannel | SPL lifesciences | 21002 | Used for seeding cells for spheroid formation |
| Superfrost Ultra-Plus Adhesion slide | Menzel-Gläser | #J3800AMNZ | Microscope glass slide used for embedding |
| Tamoxifen | Sigma-Aldrich | #T5648 | Used as chemotherapeutic treatment |
| Trans-blot Turbo 0.2 µm nitrocellulose membranes | Bio-Rad | #170-4159 | Used for western blotting |
| Tris/Glycine/SDS running buffer | Bio-Rad | #161 0732 | Used for SDS-PAGE |
| Trypsin-EDTA solution | Sigma | #T4174 | Cell dissociation enzyme |
Références
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W., Freyer, J. P., Sutherland, R. M. Influence of glucose and oxygen supply conditions on the oxygenation of multicellular spheroids. British Journal of Cancer. 53 (3), 345-353 (1986).
- Gaedtke, L., Thoenes, L., Culmsee, C., Mayer, B., Wagner, E. Proteomic analysis reveals differences in protein expression in spheroid versus monolayer cultures of low-passage colon carcinoma cells. Journal of Proteome Research. 6 (11), 4111-4118 (2007).
- Chen, J. L., et al. The genomic analysis of lactic acidosis and acidosis response in human cancers. PLoS Genetics. 4 (12), 1000293 (2008).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Gudjonsson, T., Ronnov-Jessen, L., Villadsen, R., Bissell, M. J., Petersen, O. W. To create the correct microenvironment: three-dimensional heterotypic collagen assays for human breast epithelial morphogenesis and neoplasia. Methods. 30 (3), 247-255 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews in Molecular and Cell Biology. 8 (10), 839-845 (2007).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jacobi, N., et al. Organotypic three-dimensional cancer cell cultures mirror drug responses in vivo: lessons learned from the inhibition of EGFR signaling. Oncotarget. 8 (64), 107423-107440 (2017).
- Rodriguez-Enriquez, S., et al. Energy metabolism transition in multi-cellular human tumor spheroids. Journal of Cell Physiology. 216 (1), 189-197 (2008).
- Kunz-Schughart, L. A. Multicellular tumor spheroids: intermediates between monolayer culture and in vivo tumor. Cell Biology International. 23 (3), 157-161 (1999).
- Andersen, A. P., et al. Roles of acid-extruding ion transporters in regulation of breast cancer cell growth in a 3-dimensional microenvironment. Molecular Cancer. 15 (1), 45 (2016).
- Swietach, P., Patiar, S., Supuran, C. T., Harris, A. L., Vaughan-Jones, R. D. The role of carbonic anhydrase 9 in regulating extracellular and intracellular ph in three-dimensional tumor cell growths. Journal of Biological Chemistry. 284 (30), 20299-20310 (2009).
- Walenta, S., Doetsch, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Metabolic imaging in multicellular spheroids of oncogene-transfected fibroblasts. Journal of Histochemistry and Cytochemistry. 48 (4), 509-522 (2000).
- Kunz-Schughart, L. A., Groebe, K., Mueller-Klieser, W. Three-dimensional cell culture induces novel proliferative and metabolic alterations associated with oncogenic transformation. International Journal of Cancer. 66 (4), 578-586 (1996).
- Feng, H., et al. Homogeneous pancreatic cancer spheroids mimic growth pattern of circulating tumor cell clusters and macrometastases: displaying heterogeneity and crater-like structure on inner layer. Journal of Cancer Research and Clinical Oncology. 143 (9), 1771-1786 (2017).
- Santini, M. T., Rainaldi, G., Indovina, P. L. Apoptosis, cell adhesion and the extracellular matrix in the three-dimensional growth of multicellular tumor spheroids. Critical Reviews in Oncology/Hematology. 36 (2-3), 75-87 (2000).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Wong, C., Vosburgh, E., Levine, A. J., Cong, L., Xu, E. Y. Human neuroendocrine tumor cell lines as a three-dimensional model for the study of human neuroendocrine tumor therapy. Journal of Visual Experiments. (66), e4218 (2012).
- Friedrich, J., et al. A reliable tool to determine cell viability in complex 3-d culture: the acid phosphatase assay. Journal of Biomolecular Screening. 12 (7), 925-937 (2007).
- Ivascu, A., Kubbies, M. Diversity of cell-mediated adhesions in breast cancer spheroids. International Journal of Oncology. 31 (6), 1403-1413 (2007).
- Crouch, S. P., Kozlowski, R., Slater, K. J., Fletcher, J. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. Journal of Immunological Methods. 160 (1), 81-88 (1993).
- Andersen, A. P., et al. The net acid extruders NHE1, NBCn1 and MCT4 promote mammary tumor growth through distinct but overlapping mechanisms. International Journal of Cancer. , (2018).
- Vaupel, P. Tumor microenvironmental physiology and its implications for radiation oncology. Seminars in Radiation Oncology. 14 (3), 198-206 (2004).
- Vaupel, P. W., Frinak, S., Bicher, H. I. Heterogeneous oxygen partial pressure and pH distribution in C3H mouse mammary adenocarcinoma. Cancer Research. 41 (5), 2008-2013 (1981).
- Helmlinger, G., Yuan, F., Dellian, M., Jain, R. K. Interstitial pH and pO2 gradients in solid tumors in vivo: high-resolution measurements reveal a lack of correlation. Nature Medicine. 3 (2), 177-182 (1997).
- Zhang, X., Lin, Y., Gillies, R. J. Tumor pH and its measurement. Journal of Nuclear Medicine. 51 (8), 1167-1170 (2010).
- Gillies, R. J., Raghunand, N., Karczmar, G. S., Bhujwalla, Z. M. MRI of the tumor microenvironment. Journal of Magnetic Resonance Imaging. 16 (4), 430-450 (2002).
- Vukovic, V., Tannock, I. F. Influence of low pH on cytotoxicity of paclitaxel, mitoxantrone and topotecan. British Journal of Cancer. 75 (8), 1167-1172 (1997).
- Song, C. W., Griffin, R., Park, H. J., Teicher, B. A. . Cancer Drug Resistance. , 21-42 (2006).
- Lotz, C., et al. Role of the tumor microenvironment in the activity and expression of the p-glycoprotein in human colon carcinoma cells. Oncology Reports. 17 (1), 239-244 (2007).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today: Technologies. 23, 27-36 (2017).
- Stratmann, A. T., et al. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Molecular Oncology. 8 (2), 351-365 (2014).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLoS One. 12 (7), 0182039 (2017).
- Bochet, L., et al. Adipocyte-derived fibroblasts promote tumor progression and contribute to the desmoplastic reaction in breast cancer. Cancer Research. 73 (18), 5657-5668 (2013).
- Amann, A., et al. Development of a 3D angiogenesis model to study tumour - endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific Reports. 7 (1), 2963 (2017).
- LaBonia, G. J., Ludwig, K. R., Mousseau, C. B., Hummon, A. B. iTRAQ Quantitative Proteomic Profiling and MALDI-MSI of Colon Cancer Spheroids Treated with Combination Chemotherapies in a 3D Printed Fluidic Device. Analytical Chemistry. 90 (2), 1423-1430 (2018).
- Hulikova, A., Vaughan-Jones, R. D., Swietach, P. Dual role of CO2/HCO3(-) formula buffer in the regulation of intracellular pH of three-dimensional tumor growths. Journal of Biological Chemistry. 286 (16), 13815-13826 (2011).
- Wallace, D. I., Guo, X. Properties of tumor spheroid growth exhibited by simple mathematical models. Frontiers in Oncology. 3, 51 (2013).
- Michel, T., et al. Mathematical modeling of the proliferation gradient in multicellular tumor spheroids. Journal of Theoretical Biology. 458, 133-147 (2018).
- Meijer, T. G., Naipal, K. A., Jager, A., van Gent, D. C. Ex vivo tumor culture systems for functional drug testing and therapy response prediction. Future Science OA. 3 (2), (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon