Method Article
癌細胞の3Dスフェロイド培養における細胞生存率と死の評価
要約
ここでは、生体内腫瘍の物理化学勾配を2D培養よりもはるかに優れた3D癌細胞スフェロイドで生存率と死亡を評価するためのいくつかの簡単な方法を紹介する。したがって、スフェロイドモデルは、生体内条件への翻訳を改善した癌薬効の評価を可能にする。
要約
がん細胞の三次元スフェロイドは、がんの薬物スクリーンとがん細胞生物学に対する機械的な洞察を得るための重要なツールです。この調製の力は、比較的高スループットスクリーニングを可能にするのに十分な速く、安価で汎用性がある一方で、腫瘍の生体内状態の多くの側面を模倣する能力にあります。スフェロイド培養条件は、細胞外の酸性度の増加、乳酸の増加、グルコースおよび酸素の利用可能性の低下を含む腫瘍内の物理化学勾配を、スフェロイド周辺からその中心まで要約することができる。また、生体内腫瘍の機械的特性および細胞間相互作用は、このモデルによって部分的に模倣される。3Dスフェロイドの特定の特性と結果的に最適な増殖条件は、異なるタイプの癌細胞間で大きく異なります。さらに、3Dスフェロイドにおける細胞の生存率と死亡の評価には、2D培養に用いられるものとは部分的に異なる方法が必要です。ここでは、がん細胞の3Dスフェロイドを準備するためのいくつかのプロトコルを説明し、そのような培養物を使用して、抗癌剤の有効性を評価する文脈で細胞の生存率と死亡を評価する。
概要
がん生物学における多細胞スフェロイドモデルの使用は数十年前の1、2であるが、近年かなりの勢いを得た。大部分は、がん細胞の表現型が微小環境と特定の成長条件にどれだけ強く依存しているかの認識の増加を反映しています。固形腫瘍の微小環境は、対応する正常組織の微小環境とは根本的に異なる。これには、pH、酸素張力、間質圧、栄養素、廃棄物、分泌シグナル伝達化合物(成長因子、サイトカイン)などの可溶性因子の濃度勾配が含まれます。さらに、細胞外マトリックス(ECM)の組織、細胞間相互作用および細胞間シグナル伝達、および腫瘍3、4の特定の3次元(3D)アーキテクチャの他の態様を含む。 5,6.がん細胞が存在する特定の微小環境条件は、遺伝子発現プロファイルと機能性に大きく影響し、2Dで増殖した細胞の表現型と比較して、3Dスフェロイドの表現型がはるかに密接に模倣していることは明らかである。生体内腫瘍7、8、9、10、11のそれ。2Dモデルは、低酸素症、酸性pH、高乳酸濃度を用いて腫瘍微小環境の既知の側面を模倣しても、腫瘍内で生じる物理化学的パラメータの勾配や3D腫瘍を捕捉できない。アーキテクチャ。一方、動物モデルは高価で、遅く、倫理的に問題があり、一般的に、ヒト腫瘍の状態を要約する能力にも欠点があります。その結果、3Dスフェロイドは、ほとんどの固形癌9、11、12、13、および幅広い特性の研究において中間複雑性モデルとして適用されている。14,15,16,17.
3Dスフェロイドの広く採用されている使用は、抗癌治療の有効性9、18、19、20のスクリーニングアッセイにあります。治療応答は、薬物送達に対する拷問、制限拡散、高い間質圧、酸性環境pHの薬物送達への影響、低酸素症および他の影響の両方を反映して、腫瘍微小環境に特に敏感である。細胞死応答9,17に関する微小環境の態様。3Dスフェロイド内の環境は、これらの特性のすべてが本質的に発達するので、3D細胞培養物を採用し、結果を生体内条件に大幅に改善し、同時に、正味成長の効率的で手頃な価格のハイスループットスクリーニングを可能にします。しかし、癌細胞の薬物応答に関する研究の大半は、依然として2D条件下で行われている。これは、一部のアッセイが3D細胞培養に比較的容易に実装できる一方で、生存率アッセイ、ウェスタンブロッティング、免疫蛍光分析などの多くが、3Dよりも2Dではるかに便利に行われていることを反映している可能性があります。
本研究の目的は、抗癌剤による治療が癌細胞の生存率および生存に及ぼす効果を3D腫瘍模倣設定で容易に分析するための容易なアッセイと正確なプロトコルを提供することである。具体的には、スフェロイド形成に関する3つの異なる方法を提供し、比較し、続いて成長、生存率、薬物応答の定性的および定量的分析の方法を提供し、比較する。
プロトコル
1. スフェロイドの生成
- スフェロイド形成のための細胞懸濁液の準備
注:異なる細胞株は非常に異なる接着特性を有し、最も適切なスフェロイド形成プロトコルは、それぞれのケースで確立されなければならない。MCF-7およびBxPC-3細胞は自発的なスフェロイド形成に適していることが分かっていますが、MDA-MB-231、SKBr-3、Panc-1およびMiaPaCaは、スフェロイドを正常に形成するために再構成された地下膜を添加する必要があります。ぶら下がり降下プロトコルにはMDA-MB-231とBxPC-3セルのみが採用されていますが、他の細胞株は確かに適用可能です。- 70-80%の合流まで単層として細胞を成長させる。
- リン酸緩衝生理食塩水で細胞を洗浄(1x PBS、25 cm2または75cm2フラスコの場合は10mL)、細胞解離酵素(25cm 2または75cm2フラスコの場合は1mL)を追加し、37°Cで2〜5分の細胞をインキュベートします。5%のCO2および95%の湿度で。
- 顕微鏡下で細胞剥離を確認し、成長培地(細胞株に応じて6~10%血清)を25cm2または75cm2フラスコの10mLで5mLの総体積に加えて細胞解離酵素を中和します。
- 球を数え、セル調製物ごとにチャンバー内の8つの正方形を数え、スフェロイドの大きさの高い再現性を得るために、Bürkerチャンバーを使用してください。
注:スフェロイド形成のための異なる方法を記述する3つのプロトコルを以下に示す。プロトコル 1.2 および 1.3 は、提示される後続のすべての分析プロトコルに使用できますが、プロトコル 1.4 は埋め込みおよび溶解準備に最適です。細胞株に応じて、使用する方法にかかわらず、スフェロイド形成には2〜4日かかります。
- 自発的なスフェロイド形成
- 手順 1.1.1-1.1.4 を実行します。
- 15 mLチューブで細胞懸濁液を希釈し、0.5-2 x 104細胞/mL(細胞株ごとに最適な細胞密度を決定する必要がある)を得る(図1A(ii)))
- 残りのウェルからの蒸発を減らすために1x PBSまたは成長媒体で井戸の外輪を埋めます。細胞懸濁液を無菌貯留槽に移し、マルチチャンネルピペットを使用して、200 μL/ウェルを超低アタッチメント96ウェル丸底板に分配する(図1A(iii)))。
- 5%CO 2、95%の湿度で37°Cでプレートをインキュベーターでインキュベートします。
- 2~3日ごとに、スフェロイドの光顕微鏡画像を取得します。
注:このホワイトペーパーの画像は11.5倍の倍率で撮影されており、これらのプロトコルを使用して調製されたほとんどのスフェロイドに適しています。 - 2~3日ごとに(画像を取得した後)、100 μLの培地を交換します(使用済み培地の100μLを取り除き、100μLの新鮮な培地に置き換えます)。
注:媒体を交換する際にスフェロイドを取り除くことを避けるために、培地をゆっくりと取り外しながらプレートを少し傾け、それを廃棄する前に、目に見えるスフェロイドの先端にある吸引媒体を検査することをお勧めします。
- 再構成された地下膜媒介性スフェロイド形成。
注:ラクトース脱水素酵素上昇ウイルス(LDEV)フリー還元増殖因子再構成基系基体膜(rBM)を用いていた。rBMは温度に敏感であり、それが15 °Cに達した場合に凝固するように、常に氷の上に保つ必要があります。メッキの前に室温(RT)で一晩4°Cまたは2-4hで氷の上のrBMを解凍します。- 氷上でrBMを解凍する(材料の表を参照)。
- 使用前にプレートと貯水池(個別に包んだ場合)を氷の上に保管してください。
- 手順 1.1.1-1.1.4 を実行します。
- 残りのウェルからの蒸発を減らすために1x PBSまたは成長媒体で井戸の外輪を埋めます。15 mLチューブで細胞懸濁液を希釈し、0.5-2 x 104細胞/mL(細胞株ごとに最適な細胞密度を決定する必要がある)を得る(図1A(ii)))
- 希釈した細胞懸濁液を含む15mLチューブを氷上に置く(例えば、ガラスビーカー)(図1A(iia)))。
- 冷蔵プレートと貯水池をフードに移します。プラスチック容器をすすいで、氷で満たし、フードに移し、手順全体の間にプレートと貯水池を氷の上に置くことを可能にします。
- rBMを穏やかに再中断し、均質なゲルを確保します。
- チルド細胞懸濁液に1-2%rBM(各細胞株に最適な濃度を決定する必要がある)を加える(図1A(iib)))。
- 15 mLチューブを反転して、サスペンションをプレートに分配する前に、rBMとセルサスペンションの適切な混合を確認します。
- rBM含有細胞懸濁液を無菌貯留槽に移し、マルチチャンネルピペットを使用して200 μL/ウェルをチルド超低アタッチメント96ウェルプレートに分配する(図1A(iii)))
注:複数の細胞懸濁液(例えば、複数の細胞株)で作業する場合、早期ゲル化を防ぐためにrBM添加直後に各細胞懸濁液を分配することが不可欠である。 - 「ソフトまともな」/ノーブレーキ(可能であれば、rBM流体を長く保つために4°Cで遠心分離機を使用するが、スフェロイド形成を成功させるための要件ではない)を使用して、750 x gで15分間プレートを遠心分離し、rBMの際に細胞が一緒にクラスター化されることを保証する。硬化し、単一のスフェロイドの形成を容易にする。
- インキュベーター(37°C、5%CO 2、湿度95%)でプレートをインキュベートします。
- 2~3日ごとに、スフェロイド成長の評価のために光顕微鏡画像を取得します。
- 2~3日ごとに100μLの培地を交換してください(100 μLを取り外し、100μLの新鮮な培地に置き換えます)。
- ぶら下がりドロップスフェロイド。
- ステップ 1.1.1-1.1.4 を実行します。
- 細胞を希釈して、適切な希釈を得る。実用的な希釈は50,000細胞/mLである。
- 10cm2細胞培養皿の蓋を取り外し、上向きに置きます。皿に1x PBSの6 mLを加える(図1B(i)))。
- 細胞懸濁液を無菌貯留槽に注ぎ、マルチチャンネルピペット(図1B(ii))を用いて細胞培養皿の蓋に40μLの細胞懸濁液を30滴まで慎重に置き、2,000セル/ドロップの濃度を得る。これらの滴は、次のステップで蓋を反転する際に表面張力を失う可能性が高いため、滴を蓋の端に近づけないようにしてください。
- 蓋を素早く制御した動きで反転させ、1x PBS含有細胞培養皿の上に置きます(図1B(iii)))。
- 落としを妨げることなく、5%CO2と95%の湿度で37°Cのインキュベーターに皿を置き、4-6日間成長させるためにそれらを残します。
- タンパク質の分解物または埋め込みに使用する場合は、蓋を取り外して傾けてプールスフェロイドを、加熱媒体の1mLで滴を洗い流すために。得られたスフェロイドを含む培地を1.5mLチューブに移し、チューブの底部に落ち着きます。タンパク質のライサットおよび埋め込みに関しては、4.4 および 6.2.2 で説明されているように進みます。
2. スフェロイドの薬物治療
注:長期薬物治療は、目的の薬物の効果をスクリーニングするためにスフェロイドに適用することができる。薬物治療を開始する前に、実験治療のための適切な用量を見つけるために、薬物の用量応答実験を行うことをお勧めします。用量は、薬物の決定されたIC50/Kiに基づいており、この値の約0.2x-10倍の範囲である必要があります。
- 1.2または1.3に記載されているように所望の条件ごとに6-12の回転楕円体を設定し、インキュベーター(37°C、5%CO2、95%湿度)に2日間置きます。
- 2日目に、スフェロイドの光顕微鏡画像を撮ります。
- 最初の治療用量を準備する(画像を取得した後)。
注:第1の処理濃度は、溶液が100μL培地を含むウェルに加えて1:2に希釈されるので、所望の最終濃度の2倍でなければならない。推奨薬物治療間隔(薬物半減期に依存する):2日目、4日目、7日目。 - マルチチャンネルピペットを使用して、100 μLの培地を静かに取り出し、100μLの薬剤含有培地に置き換えます。
- 96ウェルプレートを5%のCO2および95%の湿度で37°Cのインキュベーターに戻し、選択した治療日に2.3と2.4を繰り返しますが、現在は正しい最終用量を得るために用量を倍増することなく行います。
- プロトコル/治療スケジュールの最終日に、以下のアッセイの1つまたは複数を行うことができる。
3. スフェロイドの細胞生存率アッセイ
- 1.2または1.3に記載されているように所望の条件ごとに4-6のスフェロイドを設定し、5%のCO2および95%の湿度で37 °Cでインキュベーターに置きます。
注:この場合、細胞生存率アッセイは、上記のように光顕微鏡検査により2〜3日ごとにスフェロイド増殖をモニタリングした後、7日目または9日目に行った(ポイント1.2.5および1.3.13)。 - 生存率アッセイ試薬(材料の表を参照)を解凍し、使用前にRTに平衡させます。
- 反転して穏やかに混合し、均質な溶液を得る。
- アッセイを行う前に、スフェロイド(100μL)から培養培地の50%を取り出します。
- ウェル内に存在する培地の量に対して1:3の比率で各ウェルに細胞生存率試薬を添加する(図2A(i))96ウェルプレートの場合は、50μLの試薬を100μLの培地に添加する。
- 細胞リシスを誘発するために5分間内容物を激しく混合する(図2A(ii))。
- RTで25分間インキュベートして発光信号を安定させる(図2A(iii)))。
- 発光信号を記録します(図2A(iv)))
4. 3Dスフェロイド培養物からの西洋ブロッティング用タンパク質リサテスの準備
注:スフェロイドを収集するときは、P200ピペットを使用し、より大きな開口部を可能にするために先端の端をカットし、したがって、その構造を妨げることなく、スフェロイドの簡単なキャプチャを行うことをお勧めします。
- 各条件について、1.5 mLチューブ内の最低12、理想的には18〜24個のスフェロイド(スフェロイドサイズに応じて)をプールします(次のステップは、その尖った底が少ないため、次のステップがより困難になるので、2 mLチューブを避けてください)。
注:培地の量がすべてのスフェロイドを収集する前に1.5 mLを超える場合は、収集したスフェロイドが底部に落ち着くことを可能にし(非常に迅速に起こり、遠心分離は必要ない)、収集を続ける前にチューブの体積を廃棄する残りのスフェロイド。 - 氷の上にチューブを置き、スフェロイドが1.5 mLチューブの底部に落ち着くようにします。
- 無菌細胞実験室から通常の実験室に移動します。
- 氷冷1x PBSの1 mLで2回スフェロイドを洗浄します。各洗浄ステップの間に1x PBSを除去する前に、スフェロイドを落ち着かせてください。
- スフェロイドを邪魔したり取り除いたりすることなく、可能な限り多くの1x PBSを吸引します。
- スフェロイド当たりホスファターゼおよびプロテアーゼ阻害剤を使用して5μLの加熱リシスバッファー(LB)を追加します(例えば、10スフェロイド=50 μL LB)。
- 渦の間隔を繰り返し、スフェロイドが溶解するまでスピンダウンします。30sのボルテックスのサイクルを実行し、その後、遠心分離(卓上遠心分離機を使用したクイックスピンで十分です)を約5〜10分間、回転体の大きさとコンパクトさに応じて約10sの間で行います。
注:プロトコルはここで一時停止できます。標準的な2Dタンパク質リサートプロトコルのように超音波処理、均質化およびタンパク質決定を進めるまで-20°Cでライサテを保ち、その後標準プロトコルを使用してウェスタンブロッティングを行います。
5. ヨウ化プロピジウム(PI)スフェロイド染色
- 1.2または1.3に記載されているように、所望の条件ごとに3-6のスフェロイドを設定し、5%のCO2および95%の湿度で37 °Cでインキュベーターに置きます。
- 無菌細胞培養ラボでは、1x PBSを37°Cに加熱します。
- 1x PBSでストック溶液を希釈することにより4 μMのPI溶液を作る:1x PBSでPI 1:350の1mg/mL水性ストックを希釈する。
注:この濃度は、この溶液の最終濃度2μM.100μLを与えるウェルに溶液を添加するとさらに半減され、スフェロイドを含む各ウェルに必要となる。
注意:ヨウ化プロピジウム(PI)は、ヒュームフードで処理し、手袋を着用する必要があります。PI は光に敏感です。取り扱い時は光から保護します。 - スフェロイドを取り除かずに、96ウェルプレートの各ウェルから100μLの培地を取り除きます。
- すべてのウェルに100 μLの加熱された1x PBSを加え、その後、ウェル内の液体の100 μLを除去することにより、残りの培地を洗い流します。この洗浄工程を3回繰り返します。
- 各井戸にPI溶液の100 μLを追加し、アルミ箔でプレートを覆い、5%CO2と95%の湿度で37°Cのインキュベーターに10〜15分間置きます。
- 4.5に記載の3回の洗浄手順を繰り返してPI溶液を洗い流し、イメージング時のバックグラウンド信号を減少させる。
- エピ蛍光顕微鏡を使用して、スフェロイドを画像化します。スフェロイドコア内の細胞の生存率を評価するには、Zスタックを取り、スフェロイドの様々な深さの画像を取得します。
注:スフェロイドサイズに応じて各スライス間の18〜35 μmの周りのステップサイズは、スフェロイドあたり約11〜18スタックを与えることをお勧めします。Z スタックは、すべての Z スタックを 1 つの最終的な画像に結合できる Z 投影関数を使用して ImageJ で処理でき、スフェロイド全体の染色の概要を説明します (この目的での ImageJ の使用に関するさらなるガイドラインについては、(https://imagej.net/Z-functions)を参照してください)。
6. 3Dスフェロイドの埋め込み
-
スフェロイドが埋め込まれているアガロースゲルを準備します(プロトコルを初めて実行する必要があります)。
- ddH2Oの50 mLにバクトーアガルの1gを混ぜます。
- バクトーガーが溶けて均質なゲルが形成されるまで、電子レンジでゆっくりと加熱します。ゲルを沸騰させないようにしてください。
- バクトーアガルは60°Cの水浴で暖かく保ちます。
- 実験の間に4 °Cに保つ。
-
スフェロイドの埋め込み。
- 1日目には、各条件について、1.5 mLチューブに最低12個のスフェロイドをプールします。
- 1mLの氷冷1x PBSで1回洗います。
- スフェロイドを固定するには、4%パラホルムアルデヒドの1 mLを追加します。
注:パラホルムアルデヒドの取り扱いは、ヒュームフードで行う必要があります。 - RTで24時間インキュベートさせてください。
- 2日目は、アガロースゲルを電子レンジで水で満たしたビーカーに入れ、注意深く加熱します。ゲルが沸騰しないことを確認してください!使用するまで60°Cでベンチトップ加熱プレートで暖かく保ちます。
- 1 mLの氷冷1x PBSでスフェロイドを2回洗います。
- 1x PBSのほとんどを吸引する(この時点で約100μLを残すことは、スフェロイドを扱う実用的である)。
- 20 μL ピペットを傾斜で切り取り、より大きな穴を持つ先端を得ます(図を参照)。
注:次の部分は、最適なスフェロイド転写を確保し、ゲルドロップの固化を避けるために迅速に行う必要があります。加熱ブロックがない場合は、まずスフェロイドをキャッチしてからアガロースドロップ(ポイント6.2.9と6.2.10の順序を切り替える)を行うことをお勧めします。 - 顕微鏡スライドにアガロースゲルを落とします。アガロースが固化するのを防ぐために、暖かい加熱ブロックにスライドを置きます。
- 修正されたピペット先端(6.2.8を参照)を使用して、15-20 μLの体積でできるだけ多くのスフェロイドをキャッチします。
- 顕微鏡スライドに触れることなく、15-20 μLスフェロイド含有1x PBSをアガロースゲルドロップの中心に慎重に注入します。
注:これは少し難しい点です。スピペットの先端がゲルドロップにスフェロイドを注入する際に顕微鏡スライドに触れると、スフェロイドは失われます。アガロースドロップを作り、ドロップに着色された液体を注入することによって、スフェロイドを注入する全体のプロセスを練習することをお勧めします。これは、着色された液体がスライドに漏れ出すように、ドロップを介して潜在的な浸透の視覚化を可能にします。 - アガロースゲルドロップは、RTまたは4°Cで5〜10分間インキュベートすることによって硬化させます。ゲル滴がいくらか固まったら(しかしまだかなり柔らかい)、慎重にメスでプラスチックティッシュカセットに顕微鏡スライドからゲルドロップをプッシュします。
- 70%エタノールでプラスチック組織カセットをカバーします。
注:この時点で、スフェロイドは直接使用することも、数ヶ月間保存することもできます。 - パラフィンにアガロース埋め込みスフェロイドを埋め込み、2-3 μmの厚い層スライドにセクションを埋め込み、ヘマトキシリンとエオシンで染色するか、または免疫組織染色の対象となる。
結果
図1A及び図1Bに概略的に示したスフェロイド形成プロトコルに基づくスフェロイド成長アッセイは、3D腫瘍における抗癌剤治療の効果を分析するための出発点として用いた。模倣設定。スフェロイドが形成される容易さは細胞株特異的であり、一部の細胞株は一貫性のあるスフェロイド22を形成するためにrBMとの補充を必要とする。添加されたrBMの濃度は、スフェロイドの形態に大きな影響を与える可能性があります。図1Cおよび図1Dに示すように、rBMの濃度を0〜4%の間で変化させることは、細胞型依存的な方法でスフェロイドのコンパクト性および形態を変化させる。図 1Cは、最大2.5%のrBMの添加により、SKBr-3乳癌細胞におけるスフェロイド形成を可能にし、2.5%rBMを超える濃度でそれ以上の効果がないことを示す。対照的に、上皮形態を示すBxPC3膵管腺癌(PDAC)細胞は、自発的に小さく、コンパクトなスフェロイドを形成する(図1D、上、左パネル)。この細胞タイプでは、rBM濃度を1.5%以上に増やすことは、突起および血管構造を伴うより複雑な構造にスフェロイドから明確な形態変化を引き起こし、管状構造形成を連想させる。逆に、他の2つのPDAC細胞株、MiaPaCaおよびPanc-1にrBMを添加することで、より間葉性表現型を有するMiaPaCaおよびPanc-1は、緩い細胞凝集体がより堅くなり、よりコンパクトなスフェロイドを形成することを可能にする(図1D、中低)。パネル)。これらの結果は、最適なスフェロイド形成をもたらすrBMの正確な量が、各細胞株および条件に対して評価されなければならないことを示している。
抗がん剤治療の効果を評価するためには、薬物治療時のスフェロイド内の細胞生存率の定量的評価が必要であった。ここで説明するアッセイは、スフェロイド内の生細胞から放出されるATPを測定するルシフェリン-ルシフェラーゼベースのアッセイである。アッセイの原理を図2Aに示す。このアッセイで生成された発光信号は、プレートリーダー(図2A)によって容易に記録され、他の方法23によって測定された生存率とよく相関する。関連する濃度範囲におけるATP濃度と発光との線形関係を図2Bに示し、図2Cは、3Dスフェロイドで処理した細胞死を評価するアッセイの能力を示す。抗がん治療。関連範囲内のアッセイの直線性をさらに評価するために、細胞数の関数として発光信号の標準曲線を確立する実験を行った(図2D及び図2E)).これらの結果は、アッセイが3Dスフェロイド培養における細胞生存率の推定に適しており、薬物による細胞生存率の損失を調査するために適用可能であることを示している。
治療期間中に2~3日ごとに取得した光顕微鏡画像の組み合わせと、細胞生存率の最終的な定量的評価により、スフェロイドの成長と形態の適切な監督と最適な治療の評価が可能線量。後者は図3Aおよび図3Bに例示され、そこで用量応答実験を行い、MDA-MB-231乳癌スフェロイドにおける細胞生存率を50%減少させるために必要な用量を決定した。スフェロイド形態に対する治療効果は、MDA-MB-231およびMCF-7スフェロイドの図3Cおよび図3Dでそれぞれ可視化される。選択された化学療法カクテルによる治療中に、MDA-MB-231スフェロイドのコンパクトさが増加し、タモキシフェンでの治療中に、MCF-7スフェロイドはますますほつれ、不均一になります。いずれの場合も、細胞生存率の明確な低下は、7(MDA-MB-231)または9(MCF-7)治療後に見える(図3Eおよび図3F)。これは、スフェロイド細胞の生存率および形態に対する治療媒介効果の視覚的および定量的評価の必要性と、これらのパラメータが非常に細胞および治療型特異的であることを示す。
細胞生存率アッセイの補足として、膜を横切ることができないPIを用いた死細胞の染色は、膜の完全性を損なった壊死細胞または後期アポトーシス細胞のみを染色し、死んだ細胞の迅速な空間評価を可能にする。埋め込み、セクション化およびIHCの時間のかかるプロトコルなしで、処置への応答。図4Aに示すように、阻害剤の濃度が上昇した場合の死細胞の空間配置は、この場合、Na+/H+交換器1(NHE1)阻害剤5-(N-エチル-N-イソプロピル)-アミロリド(EIPA)を、以下の通りすることができる。視覚化。見られるように、コントロールスフェロイドは限られた壊死性/後期アポトーシスコアを示し、死んだ細胞はEIPAの濃度が増加するにつれてスフェロイド全体に分布する。
異なる処置に続くアポトーシスストレスの相対誘導を定量化するために、スフェロイドを溶解し、全長および切り分けポリ(ADP-ribose)ポリメラーゼ(PARP)に対してSDS-PAGEゲル電気泳動およびウェスタンブロッティングを行った。代表的な結果を図4Bおよび図4Cに示す。この実験では、乳酸陽子共増殖体MCT4またはNa+、HCO3-共輸送体NBCn1をsiRNAを用いてノックダウンしたMDA-MB-231細胞からスフェロイドを調製した。 ノックダウンは、MCT4 および NBCn1 (未発表データ) のウェスタン ブロッティングによって評価されました。見られるように、MCT4のノックダウンは、NBCn1ではないが、堅牢にPARP切断を増加させ、MDA-MB-231細胞におけるMCT4の安定的なノックダウンが生体内24における腫瘍増殖を減少させるという我々の以前のデモンストレーションと一致する。
治療の効果をさらに分析し、特定のシグナル伝達、成長停止、および死の経路に関する情報を得るために、スフェロイドは、ウェスタンブロット分析に加えて、埋め込まれ、免疫組織化学(IHC)分析を受けることができます。スフェロイドセクションのIHC分析は、細胞増殖、細胞周期およびプログラムされた細胞死の特定の抗体またはマーカーの使用を可能にし、スフェロイドにおける増殖およびアポトーシス細胞の空間的配置の視覚化を容易にする。
図5 Aに、SHEROIDのIHC分析のための埋め込みプロトコルの概略図を示す。埋め込みスフェロイドの約3μm厚いマイクロトーム部の代表的な光顕微鏡画像を図5Bに示し、腫瘍抑制タンパク質p53に染色されたスフェロイドの免疫蛍光画像(核染色を用いて染色した。DAPI)を図5Cとして示す。細胞増殖マーカーKi-67またはp53用に染色されたDMSOおよび化学療法処理されたスフェロイドの例を、それぞれ図5Dおよび図5Eに示す。化学療法治療の抗増殖効果と一致して、Ki-67陽性細胞の数は、化学療法処理されたスフェロイドよりもDMSO対照において大きい(図5D)。対照的に、p53発現は細胞ストレス、アポトーシスおよび増殖停止の条件下で増加し、その結果、化学療法処理されたスフェロイドにおいてp53染色細胞の数はDMSO対照と比較して実質的に高くなる(図5)。 E)。
これらの結果は、3Dスフェロイドにおける薬物治療効果に関する空間的解決(PI染色、IHC)または定量的(ウェスタンブロッティング)情報を得ることができる方法の例を示す。
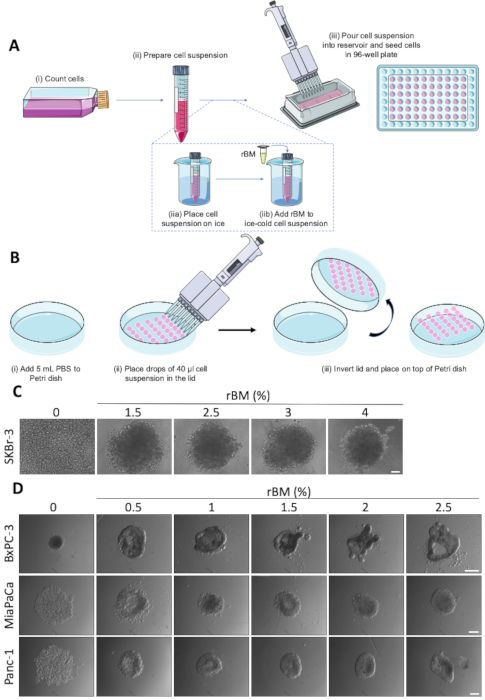
図 1: 自発的およびrBM媒介性スフェロイド形成。(A) rBMを任意に使用した超低アタッチメント96ウェル丸底板を用いた回転楕円体形成の概略表現。(i-iii)によってマークされた個々のステップ。(B) 吊り下げ法を用いたスフェロイド形成の概略表現。個々のステップは、(i-iii)(C) SKBr-3細胞のrBM媒介性スフェロイド形成の代表的な画像によってマークされる。細胞をrBMの濃度を増加させた超低アタッチメント96ウェル丸底板に播種し、9日間増殖させた。スケールバー 100 μm.(n=3)。(D) BxPC-3、MiaPaCaおよびPanc-1細胞の代表的な画像は、0.5〜2.5%からrBM濃度を有する超低アタッチメント96ウェル丸底板における回転楕円体形成のために播種した。スフェロイドを4日間増殖させた。スケールバー = 250 μm(n=3)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
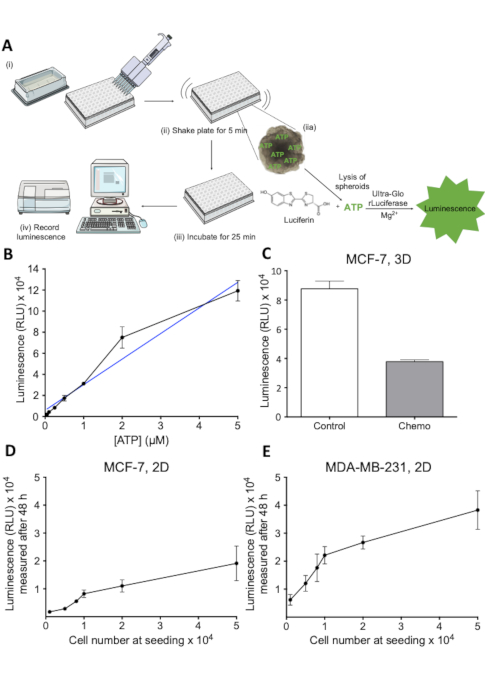
図 2:細胞生存率アッセイの原理と評価。(A) 3D細胞生存率アッセイの概略表現。(i-iv)で示される個々のステップ。(B)ATP濃度の関数としての発光信号。ATPの希釈を96ウェルプレートでめっきし、各ウェルに細胞生存率試薬を添加した。発光は405nmで30分後に記録した。1 n.(C) 生存率は、ルミネッセンスとして測定され、制御および化学療法処理されたMCF-7スフェロイドである。MCF-7細胞を超低アタッチメントラウンドボトムプレートに播種し、7日間増殖させた。化学療法治療(5 μMシスプラチン、5 μMドキソルビシンおよび30 nM 5-FU)を2日目および4日目に適用した。バーは、播種されたMCF-7細胞の数の関数としてSD. 1 n. (D) 発光信号を持つ平均値を表す。MCF-7細胞を示された細胞数で96ウェルプレートに播種し、48時間増殖させ、その後細胞生存率を測定した。誤差バーは、MDA-MB-231 セルの D で説明されているように、SD. 1 n. (E)を表します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
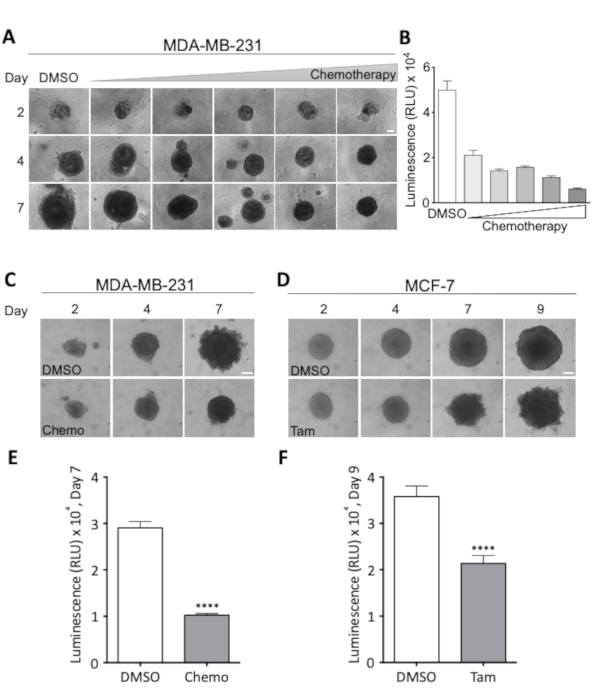
図 3: 治療レジメンが球状形態および細胞生存率に及ぼす影響(A) 2日目、4日目、7日目のMDA-MB-231スフェロイドの代表的な画像。MDA-MB-231細胞を、超低アタッチメントラウンドボトム96ウェルプレートに播種した。化学療法の用量の増加による治療は2日目に開始され、その時点ですべてのスフェロイドは同じサイズであった。行は、化学療法の増加用量でスフェロイドを示し、列は示された用量で2日目、4日目、および7日目のサイズを代表するスフェロイドを示す。最低用量は18.75 nMシスプラチン、18.75 nMドキソルビシン、0.0625 nM 5-フルオロウラシル(5-FU)であり、この用量は示す各画像に対して倍増し、0.3 μMシスプラチン、0.3 μMドキソルビシンおよび2-5-FU-5の最大用量を得た。スケールバー = 100 μm( 2 n)。(B)MDA-MB-231スフェロイドの生存率は、発光として測定され、化学療法治療の7日後に行った。バーは、2日目、4日目、7日目、MCF-7スフェロイド9のMDA-MB-231(C)およびMCF-7スフェロイド(D)の代表的な画像を持つ平均値を表します。(A)のように播種し、化学療法(ケモ、18.75 nMシスプラチン、18.75 nMドキソルビシン、0.0625 nM 5-FU)2日目および4日目(C)または2μMタモキシフェン(Tam)を2日目、4日目および7日目に処理した。スケールバー = 100 μm. (4 n および 3 n) それぞれ。(E, F)生存率は、それぞれ(C)および(D)の7日目および9日目に発光として測定される。ペアでない学生のt検定が行われた条件間の統計的に有意な差をテストするために。p < 0.0001 を示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4:ヨウ化プロピジウム染色とスフェロイドのウェスタンブロット分析。(A) 9日間の治療後のPI染色されたMCF-7スフェロイドの代表的な画像。MCF-7細胞を9日間増殖させた超低アタッチメント96ウェルプレートに播種し、2日目、4日目、7日目にEIPA濃度の上昇を伴って処理した。9日目に、スフェロイドをPIで染色し、画像をエピ蛍光顕微鏡で取得した。スケールバー = 200 μm( 1 n.(B) 酸塩基トランスポーターのノックアウト/ノックダウン後のMDA-MB-231細胞の代表的なウェスタンブロット。NHE1はMDA-MB-231細胞12でCRISPR/Cas9によってノックアウトされ、細胞はその後MCT4またはNBCn1に対してsiRNAで一過性にトランスフェクトされ、9日間スフェロイドとして増殖し、抗体を用いてウェスタンブロッティングを行った。合計と切り分け (c)PARP を認識します。(C)cPARPとPARPタンパク質レベルの比率を定量し、ロード制御(β-アクチン)に正規化した。(1 n)を使用します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
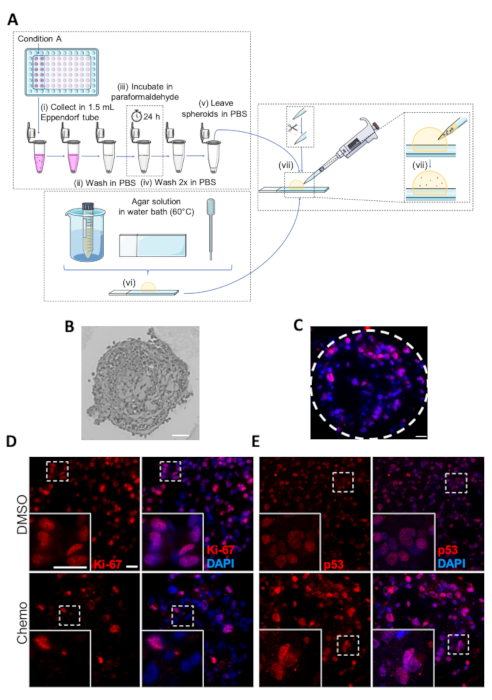
図 5: スフェロイドの固定、埋め込み、免疫組織化学分析(A) スフェロイドを埋め込むためのプロトコルの概略表現。個々のステップは(i-vii)としてマークされます。(B) 埋め込みMDA-MB-231スフェロイドの画像。スケールバー:50 μm.(C)p-53に対する抗体を使用してIHC分析を行った化学療法処理MDA-MB-231スフェロイドの代表的な画像。破線は、スフェロイドの円周を示します。スケールバー = 20 μm(D,E)DMSO-または化学療法処理(上下パネル)MDA-MB-231スフェロイドの代表的な画像。MDA-MB-231細胞を超低アタッチメント96ウェルプレートに播種し、7日間増殖させ、2日目および4日目に化学療法で治療した。7日目に、スフェロイドを埋め込み、その後、Ki-67(D)およびp53(E)に対する一次抗体を使用したIHCによる分析を行った。白いボックスはズーム画像を表します。スケールバー = 両方の倍率で 20 μm(n=3)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
3D癌細胞スフェロイドの使用は、抗癌剤スクリーニングのためだけでなく、腫瘍内のものを模倣する条件下で癌細胞死と生存率の調節に機械的な洞察を得るための貴重で汎用性の高いツールを証明しています。マイクロ環境。これは、化学療法薬のアクセシビリティ、細胞取り込み、および細胞内効果が、pH、酸素張力、拷問性、および物理的および物理的および腫瘍内の物理化学的状態によって大きく影響を受けるので、特に重要である。化学細胞相互作用9,17.例えば、多くの固形腫瘍25、26、27、28、29で6-6.5以下の値に達することができる細胞外pHの酸性度は、弱い基本的な化学療法を引き起こすドキソルビシン、ミトキサントロン、ツヴィッテリオンパクリタキセルなどの化合物を充電する。これは、腫瘍細胞への彼らの取り込みを減少させ、p-糖タンパク質30、31、32などの多剤耐性タンパク質の活性に影響を与えることができる。また、ほとんどの化学療法化合物の効果に極めて重要である細胞増殖は、一般的に2D条件と比較して3Dで減少し、したがって、2D細胞培養8、33よりも腫瘍スフェロイドで模倣される方が良い可能性が高い 、34.最後に、密な腫瘍微小環境は、細胞の成長、生存および死を調節する細胞内シグナル伝達経路を指示する多数の物理的および可溶性シグナル伝達キューの起源である。したがって、薬剤の有効性を分析する際には、3D培養システムは生体内モデルに着手する前の重要なステップです。しかし、3D カルチャの主な欠点は、2D カルチャに比べて解析の複雑さが増すことです。ここでは、様々ながん細胞型を用いたスフェロイド形成に関する簡潔かつ比較的安価な技術について述べた。我々は、研究した細胞種ごとにスフェロイド形成を最適化する方法の例を示し、そのようなスフェロイドにおける細胞生存率、細胞死、および関連するシグナル伝達経路に関する定量的データを得る方法を説明した。ここで説明する 3 つのモデルの間に明らかな成長または形態学的な違いはありません。私たちの手では、ハンギングドロップ法を用いて形態のばらつきがわずかに大きくなるかもしれませんが、この方法の利点はrBMが必要ではないことです。ここでは、単一のがん細胞型から作り出されるスフェロイドに焦点を当てています。しかし、球状モデルは、線維芽細胞、単球/マクロファージ、内皮細胞、および/または脂肪細胞35、36、37を有する癌細胞の共培養にも適している。このモデルの他の高度な適用は半透過性の膜を通しての剤を可能にする3D印刷された流動装置との組合せを含み、続いて定量的プロテオミクスプロファイリング38のための収穫を含む。
上述したように、3Dスフェロイドで増殖した細胞の表現型は、一般的に2Dで増殖した細胞よりもはるかに良い生体内腫瘍の表現型を模倣するが、そのようなスフェロイドが実際に生体内腫瘍に対応するモデルである程度は、多数に依存している。を考慮し、慎重に評価する必要があります。このようなスフェロイドが生体内状態をどの程度模倣するかに影響を与えるパラメータには、腫瘍およびその相対ECM組成物の細胞組成物が含まれる。例えば、ここで提供されるプロトコルでECMとして採用したrBMは、上皮癌の初期段階を模倣するための良い選択であり、基膜に違反する頃には、他のECM組成物は特定の腫瘍に対してより関連性が高くなります。型と -ステージ。さらに、細胞接着の容量は、カドヘリンおよびインテグリン22などの細胞細胞および細胞マトリックス接着タンパク質の発現に応じて、癌細胞株間で大きく異なる。
ここで説明するように、スフェロイドの成長および形態は、低倍率光学および大きな視野を持つ光顕微鏡を使用して2〜3日ごとに容易かつ非侵襲的に監視することができる。しかし、化学療法治療などの細胞傷害性ストレスは、スフェロイド形態に大きく異なる影響を及ぼし、細胞の種類や治療スキームによっては、形態や周囲の評価だけに頼るだけでは不十分です。治療効果。例えば、スフェロイドは治療や新たな細胞死によって緩くなったり、壊死性コアですべての死が起こることがあり、表面は検出可能な影響を受けません。いずれの場合も、結果は、治療によって球体中の生細胞の数が減少しないという誤った印象を与える可能性がある。したがって、定量的および全球体の技術は、治療効果を評価するために不可欠です。細胞死の定量的評価のために、その名の通り、シトソール酸ホスファターゼの活性を測定する酸ホスファターゼアッセイが21を採用している。しかし、我々の手の中では、このアッセイは一般的に播種された細胞の数をうまく反映しているが、細胞死後しばらくの間酸ホスファターゼが活性のままであるため、迅速な治療誘発細胞死(データは示されていない)を十分に捕捉していない。さらに、このアッセイは培地の完全な除去を必要とし、特に脆弱な化学療法処理されたスフェロイドで誤差を増加させる。ここで説明する細胞生存率アッセイは、細胞ATP含有量に基づいており、その簡素かつ時間効率の高いプロトコルおよび高い再現性に基づいて選択された。さらに、このアッセイは、スフェロイドを使用する場合に有利である培養培地の完全な除去を必要としない。代表的な結果に示すように、このアッセイは細胞数と期待される化学療法治療効果の両方をよく捕捉します。しかし、この技術の落とし穴は、明らかに、細胞内ATP含有量を減少する代謝変化が誤って低い細胞数として記録されてもよい。したがって、スフェロイド体積と形態の並列評価、またはPI染色は、結果を検証することをお勧めします。
スフェロイドリシスに続いてウェスタンブロッティングは、シグナル伝達プロセス、細胞死、増殖および生存率経路の状態に関する半定量的洞察を提供することができる。rBMを使用してスフェロイドを調べると、ウェスタンブロッティングの使用は複雑であり、これはリセートタンパク質含有量のかなりの部分を含むため、さらに重要なことに、細胞含有量の減少に伴ってその分数の寄与が増加する。化学療法細胞死の間に。遠心分離によってrBMを除去することが原則として可能である。しかし、これはすべてのrBMを完全に除去することは困難であり、条件間の定量的な比較を妨げるため、重要なステップです。このようなスフェロイドに対して、および一般に、死の経路および関連するシグナル伝達パラメータの空間的に解決された評価のために、埋め込みおよびIHCは強力なツールである。他のアプローチは考慮されうる:(比較的小さい)無傷のスフェロイド39のライブ共焦点イメージング。スフェロイドのもう一つの興味深い特性は、彼らのむしろ規則的な「ボール」形状を与えられて、彼らは数学的モデリングと湿った実験室の実験の間の反復に適し、上記の重要性の理解を高めるということですスフェロイド内の酸素、pH、および栄養素の勾配、および、外挿によって、腫瘍40、41。したがって、はるかに複雑な重要な3D腫瘍モデルが出現しているが、複雑な生物学的および不活性足場に基づく幅広い組織性およびオルガノイド培養物を含む、および、少なくとも、患者由来の異種移植片42、スフェロイドは、2D培養と比較して生物学的に優れた関連性を持ち、相対的な取り扱いの容易さと組み合わせることで、重要なツールであり続けます。
要約すると、3D培養におけるがん細胞の生存率と死亡における抗癌治療誘発変化の解析のための一連の簡単な方法を紹介する。スフェロイドの組成は、使用する細胞の性質や生物学に応じて変更することができ、提示された定量的および定性的分析は、用量応答関係を評価し、およびシグナリングと死の経路が関与する。
開示事項
著者は利益相反を宣言しない。
謝辞
私たちは、優れた技術支援を受けたカトリーヌ・フランクリン・マークとアネット・バルテルスと、図1Dで実験を行ったアスビョーン・ノハル・ニールセンに感謝しています。この作品は、アイナー・ウィラムセン財団、ノボ・ノルディスク財団、フォンダシオン・ジュチュム(すべてSFP)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 2-(4-amidinophenyl)-1H-indole-6-carboxamidine (DAPI) | Invitrogen | # C10595 | For staining nuclei |
| 5-Fluorouracil (5-FU) | Sigma-Aldrich | #F6627 | Component in chemotherapeutic treatment |
| 5-(N-ethyl-isopropyl) amiloride (EIPA) | Life Technologies | #E3111 | Inhibitor of NHE1 |
| Antibody against PARP and cPARP | Cell signaling | #9542 | Used in western blotting |
| Antibody against Ki-67 | Cell signaling | #9449 | Used for IHC |
| Antibody against p53 | Cell Signaling | #2524 | Used for IHC |
| Antibody against β-actin | Sigma | A5441 | Used in western blotting |
| Bactoagar | BD Bioscience | #214010 | Used for agarose gel preparation |
| Benchmark protein ladder | Invitrogen | #10747-012 | Used for SDS-PAGE |
| Bio-Rad DC Protein Assay kit | Bio-Rad Laboratories | #500-0113, #500-0114, #500-0115 | Used for protein determination from lysates |
| Bürker chamber | Marienfeld | 610311 | For cell counting |
| BX63 epifluoresence microscope | Olympus | Used for fluorescent imaging | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | #G9681 | Used for the cell viability assay |
| Cisplatin | Sigma-Aldrich | #P4394 | Component in chemotherapeutic treatment |
| Corning Spheroid Microplate, 96 well, Black with clear round bottom, Ultra-low attachment, With lid, Sterile | Corning | #4520 | Used for growing spheroids with luminescence measurements as end point |
| Corning 96 well, clear round bottom, Ultra-low attachment microplate, With lid, Sterile | Corning | #7007 | Sufficient for spheroid growth without luminescence measurements as end point |
| Criterion TGX Precast Gels | Bio-Rad | 5671025 | Used for SDS-PAGE |
| Doxorubicin | Abcam | #120629 | Component in chemotherapeutic treatment |
| FLUOStar Optima Microplate reader | BMG Labtech | Used for recording luminescence | |
| Formaldehyde | VWR Chemicals | #9713.1000 | Used for cell fixation |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Gibco | #A1413202 | Keep at 4 °C to prevent solidification. Referred to as rBM in the protocol. |
| Heat-inactivated FBS | Sigma | #F9665 | Serum for growth media |
| ImageJ | NIH | Scientific Image analysis | |
| Medim Uni-safe casette | Medim Histotechnologie | 10-0114 | Used for storage of embedded spheroids |
| Mini protease inhibitor cocktail tablets | Roche Diagnostics GmBH | # 11836153001 | Used for lysis buffer preparation |
| MZ16 microscope | Leica | Used for light microscopic images | |
| NuPAGE LDS 4x Sample Buffer | Invitrogen | #NP0007 | Used for western blotting |
| Pierce ECL Western blotting substrate | Thermo scientific | #32106 | Used for western blotting |
| Ponceau S | Sigma-Aldrich | #P7170-1L | Used for protein band staining |
| Prism 6.0 | Graphpad | Scientific graphing and statistical software | |
| Propidium iodide (1mg/ml solution in water) | Invitrogen | P3566 | Light sensitive |
| Sterile reservoirs, multichannel | SPL lifesciences | 21002 | Used for seeding cells for spheroid formation |
| Superfrost Ultra-Plus Adhesion slide | Menzel-Gläser | #J3800AMNZ | Microscope glass slide used for embedding |
| Tamoxifen | Sigma-Aldrich | #T5648 | Used as chemotherapeutic treatment |
| Trans-blot Turbo 0.2 µm nitrocellulose membranes | Bio-Rad | #170-4159 | Used for western blotting |
| Tris/Glycine/SDS running buffer | Bio-Rad | #161 0732 | Used for SDS-PAGE |
| Trypsin-EDTA solution | Sigma | #T4174 | Cell dissociation enzyme |
参考文献
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W., Freyer, J. P., Sutherland, R. M. Influence of glucose and oxygen supply conditions on the oxygenation of multicellular spheroids. British Journal of Cancer. 53 (3), 345-353 (1986).
- Gaedtke, L., Thoenes, L., Culmsee, C., Mayer, B., Wagner, E. Proteomic analysis reveals differences in protein expression in spheroid versus monolayer cultures of low-passage colon carcinoma cells. Journal of Proteome Research. 6 (11), 4111-4118 (2007).
- Chen, J. L., et al. The genomic analysis of lactic acidosis and acidosis response in human cancers. PLoS Genetics. 4 (12), 1000293 (2008).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Gudjonsson, T., Ronnov-Jessen, L., Villadsen, R., Bissell, M. J., Petersen, O. W. To create the correct microenvironment: three-dimensional heterotypic collagen assays for human breast epithelial morphogenesis and neoplasia. Methods. 30 (3), 247-255 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews in Molecular and Cell Biology. 8 (10), 839-845 (2007).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jacobi, N., et al. Organotypic three-dimensional cancer cell cultures mirror drug responses in vivo: lessons learned from the inhibition of EGFR signaling. Oncotarget. 8 (64), 107423-107440 (2017).
- Rodriguez-Enriquez, S., et al. Energy metabolism transition in multi-cellular human tumor spheroids. Journal of Cell Physiology. 216 (1), 189-197 (2008).
- Kunz-Schughart, L. A. Multicellular tumor spheroids: intermediates between monolayer culture and in vivo tumor. Cell Biology International. 23 (3), 157-161 (1999).
- Andersen, A. P., et al. Roles of acid-extruding ion transporters in regulation of breast cancer cell growth in a 3-dimensional microenvironment. Molecular Cancer. 15 (1), 45 (2016).
- Swietach, P., Patiar, S., Supuran, C. T., Harris, A. L., Vaughan-Jones, R. D. The role of carbonic anhydrase 9 in regulating extracellular and intracellular ph in three-dimensional tumor cell growths. Journal of Biological Chemistry. 284 (30), 20299-20310 (2009).
- Walenta, S., Doetsch, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Metabolic imaging in multicellular spheroids of oncogene-transfected fibroblasts. Journal of Histochemistry and Cytochemistry. 48 (4), 509-522 (2000).
- Kunz-Schughart, L. A., Groebe, K., Mueller-Klieser, W. Three-dimensional cell culture induces novel proliferative and metabolic alterations associated with oncogenic transformation. International Journal of Cancer. 66 (4), 578-586 (1996).
- Feng, H., et al. Homogeneous pancreatic cancer spheroids mimic growth pattern of circulating tumor cell clusters and macrometastases: displaying heterogeneity and crater-like structure on inner layer. Journal of Cancer Research and Clinical Oncology. 143 (9), 1771-1786 (2017).
- Santini, M. T., Rainaldi, G., Indovina, P. L. Apoptosis, cell adhesion and the extracellular matrix in the three-dimensional growth of multicellular tumor spheroids. Critical Reviews in Oncology/Hematology. 36 (2-3), 75-87 (2000).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Wong, C., Vosburgh, E., Levine, A. J., Cong, L., Xu, E. Y. Human neuroendocrine tumor cell lines as a three-dimensional model for the study of human neuroendocrine tumor therapy. Journal of Visual Experiments. (66), e4218 (2012).
- Friedrich, J., et al. A reliable tool to determine cell viability in complex 3-d culture: the acid phosphatase assay. Journal of Biomolecular Screening. 12 (7), 925-937 (2007).
- Ivascu, A., Kubbies, M. Diversity of cell-mediated adhesions in breast cancer spheroids. International Journal of Oncology. 31 (6), 1403-1413 (2007).
- Crouch, S. P., Kozlowski, R., Slater, K. J., Fletcher, J. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. Journal of Immunological Methods. 160 (1), 81-88 (1993).
- Andersen, A. P., et al. The net acid extruders NHE1, NBCn1 and MCT4 promote mammary tumor growth through distinct but overlapping mechanisms. International Journal of Cancer. , (2018).
- Vaupel, P. Tumor microenvironmental physiology and its implications for radiation oncology. Seminars in Radiation Oncology. 14 (3), 198-206 (2004).
- Vaupel, P. W., Frinak, S., Bicher, H. I. Heterogeneous oxygen partial pressure and pH distribution in C3H mouse mammary adenocarcinoma. Cancer Research. 41 (5), 2008-2013 (1981).
- Helmlinger, G., Yuan, F., Dellian, M., Jain, R. K. Interstitial pH and pO2 gradients in solid tumors in vivo: high-resolution measurements reveal a lack of correlation. Nature Medicine. 3 (2), 177-182 (1997).
- Zhang, X., Lin, Y., Gillies, R. J. Tumor pH and its measurement. Journal of Nuclear Medicine. 51 (8), 1167-1170 (2010).
- Gillies, R. J., Raghunand, N., Karczmar, G. S., Bhujwalla, Z. M. MRI of the tumor microenvironment. Journal of Magnetic Resonance Imaging. 16 (4), 430-450 (2002).
- Vukovic, V., Tannock, I. F. Influence of low pH on cytotoxicity of paclitaxel, mitoxantrone and topotecan. British Journal of Cancer. 75 (8), 1167-1172 (1997).
- Song, C. W., Griffin, R., Park, H. J., Teicher, B. A. . Cancer Drug Resistance. , 21-42 (2006).
- Lotz, C., et al. Role of the tumor microenvironment in the activity and expression of the p-glycoprotein in human colon carcinoma cells. Oncology Reports. 17 (1), 239-244 (2007).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today: Technologies. 23, 27-36 (2017).
- Stratmann, A. T., et al. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Molecular Oncology. 8 (2), 351-365 (2014).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLoS One. 12 (7), 0182039 (2017).
- Bochet, L., et al. Adipocyte-derived fibroblasts promote tumor progression and contribute to the desmoplastic reaction in breast cancer. Cancer Research. 73 (18), 5657-5668 (2013).
- Amann, A., et al. Development of a 3D angiogenesis model to study tumour - endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific Reports. 7 (1), 2963 (2017).
- LaBonia, G. J., Ludwig, K. R., Mousseau, C. B., Hummon, A. B. iTRAQ Quantitative Proteomic Profiling and MALDI-MSI of Colon Cancer Spheroids Treated with Combination Chemotherapies in a 3D Printed Fluidic Device. Analytical Chemistry. 90 (2), 1423-1430 (2018).
- Hulikova, A., Vaughan-Jones, R. D., Swietach, P. Dual role of CO2/HCO3(-) formula buffer in the regulation of intracellular pH of three-dimensional tumor growths. Journal of Biological Chemistry. 286 (16), 13815-13826 (2011).
- Wallace, D. I., Guo, X. Properties of tumor spheroid growth exhibited by simple mathematical models. Frontiers in Oncology. 3, 51 (2013).
- Michel, T., et al. Mathematical modeling of the proliferation gradient in multicellular tumor spheroids. Journal of Theoretical Biology. 458, 133-147 (2018).
- Meijer, T. G., Naipal, K. A., Jager, A., van Gent, D. C. Ex vivo tumor culture systems for functional drug testing and therapy response prediction. Future Science OA. 3 (2), (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved