Method Article
评估癌细胞3D球形培养中的细胞活力和死亡
摘要
在这里,我们提出了几种简单的方法来评估3D癌细胞球体的生存能力和死亡,它模仿体内肿瘤的物理化学梯度比2D培养要好得多。因此,球形模型允许评估癌症药物疗效,并改进对体内条件的翻译。
摘要
癌细胞的三维球体是癌症药物屏幕和获得对癌细胞生物学的机械洞察力的重要工具。这种制剂的力量在于它能够模仿肿瘤体内状况的许多方面,同时快速、廉价和通用,足以允许相对较高的通量筛查。球体培养条件可以重述肿瘤中的物理化学梯度,包括细胞外酸度增加、乳酸增加、葡萄糖和氧气供应减少,从球体边缘到其核心。此外,该模型部分模拟了体内肿瘤的机械特性和细胞-细胞相互作用。3D球体的具体性质和最佳生长条件在不同类型的癌细胞之间差别很大。此外,评估3D球体的细胞活力和死亡需要部分不同于2D培养方法的方法。在这里,我们描述了几种协议,用于制备癌细胞的3D球体,并在评估抗癌药物疗效的背景下利用这些培养物评估细胞的生存能力和死亡。
引言
在癌症生物学中使用多细胞球体模型已有几十年的历史,但近年来却获得了巨大的发展势头。这在很大程度上反映了人们对于癌细胞表型对其微环境和特定生长条件的依赖程度的日益提高的认识。实体肿瘤的微观环境与相应的正常组织有着根本的不同。这包括物理化学条件,如pH、氧张力,以及间质压力、可溶性因子(如营养物质、废物产品和分泌信号化合物)的浓度梯度(生长因子、细胞因子)。此外,它包括组织细胞外基质(ECM),细胞-细胞相互作用和细胞间信令,以及肿瘤的特定的三维(3D)结构的其他方面3, 5,6.癌细胞存在的特定微环境条件深刻地影响其基因表达特征和功能特性,很明显,与在二维中生长的细胞相比,3D球体的表型更接近于模仿体内肿瘤7,8,9,10,11。2D模型,即使它们采用缺氧、酸性pH值和高乳酸浓度来模拟肿瘤微环境的已知方面,仍然无法捕获肿瘤内产生的物理化学参数及其3D肿瘤的梯度建筑。另一方面,动物模型是昂贵,缓慢,道德问题,一般来说,也有缺陷,在能力,以重新报告人类肿瘤条件。因此,3D球体已作为中间复杂性模型应用于大多数固体癌症的多种特性的研究9,11,12,13, 14,15,16,17.
一种广泛使用的3D球体是筛选癌症治疗疗效9,18,19,20的筛选方法。治疗反应对肿瘤微环境特别敏感,既反映了肿瘤的侵权性、扩散受限、间隙压力高、酸性环境pH值对药物输送的影响,也反映了缺氧等的影响。微环境方面对细胞死亡反应9,17。因为3D球形内的环境本身发展了所有这些属性7,8,9,10,11,使用3D细胞培养可以大幅度提高结果在体内条件的转化,同时允许对净增长进行高效且经济实惠的高通量筛选。然而,绝大多数关于癌细胞药物反应的研究仍在二维条件下进行。这可能反映了,虽然一些检测可以相对容易地用于 3D 细胞培养,但许多,如可行性测定,西方印迹和免疫荧光分析,在 2D 比在 3D 中更容易完成。
本工作的目的是提供易于接受的测定和精确的方案,用于分析抗癌药物治疗对3D肿瘤模拟环境中癌细胞活力和存活率的影响。具体来说,我们提供和比较三种不同的球形形成方法,然后是对生长、活力和药物反应进行定性和定量分析的方法。
研究方案
1. 飞球体的生成
- 为球形形成准备细胞悬浮液
注:不同的细胞系具有非常不同的附着力,必须在每种情况下建立最合适的球形形成协议。我们发现MCF-7和BxPC-3细胞适合自发球体形成,而MDA-MB-231、SKBr-3、Panc-1和MiaPaCa需要添加重组的基体膜才能成功形成球体。只有MDA-MB-231和BxPC-3细胞用于挂降协议,但其他细胞系当然适用。- 将细胞生长为单层,直到70-80%的汇合。
- 用磷酸盐缓冲盐水清洗细胞(1x PBS,5 mL,用于 25 厘米2或 10 mL,用于 75 厘米2烧瓶),添加细胞分离酶(25 厘米2或 1 mL 的细胞,用于 75 厘米2瓶),并在 37°C 下孵育细胞 2-5 分钟在 5% CO2和 95% 湿度。
- 在显微镜下检查细胞分离,通过在 75 cm2烧瓶中将生长培养基(6-10% 血清取决于细胞系)添加到 5 mL 的总体积中,中和细胞分离酶。
- 使用 Bürker 室对每个细胞制剂的细胞计数和在腔室中计数 8 个方块,以获得球体大小的高重现性。
注:下面给出了三个协议,分别描述了球形形成的不同方法。协议 1.2 和 1.3 可用于介绍的所有后续分析协议,而协议 1.4 最适合嵌入和莱沙处理制剂。根据细胞系的不同,球形形成需要2-4天,无论使用何种方法。
- 自发球形形成
- 执行步骤 1.1.1-1.1.4。
- 在15 mL管中稀释细胞悬浮液,以获得0.5-2 x 104细胞/mL(需要为每个细胞系确定最佳细胞密度)(图1A(ii))。
- 用1x PBS或生长介质填充井外环,以减少剩余井的蒸发。将电池悬架转移到无菌储液罐,并使用多通道移液器将 200 μL/孔分配到超低附件 96 孔圆形底板中(图 1A (iii))。
- 在37°C的培养箱中孵育板,CO2为5%,湿度为95%。
- 每2-3天获得球体的光微观图像。
注:本文中的图像以11.5倍的放大倍率拍摄,适用于使用这些协议制备的大多数球体。 - 每 2-3 天(获取图像后)更换 100 μL 的介质(去除已用介质的 100 μL,用 100 μL 的新鲜介质替换)。
注:为了避免在更换介质时去除球体,建议在缓慢去除介质时稍微倾斜板,并检查吸头中的吸气介质有有可见球体,然后再丢弃。
- 重组基底膜介导球形形成。
注:使用乳糖脱氢酶提升病毒(LDEV)无生长因子重组基底膜(rBM)。rBM 对温度敏感,应始终保存在冰上,因为如果达到 15°C,就会凝固。电镀前,在室温 (RT) 下,在 4 °C 或 2-4 h 下在冰上解冻 rBM。- 在冰上解冻 rBM(参见材料表)。
- 使用前,将板和储液罐(如果单独包裹)放在冰上。
- 执行步骤 1.1.1-1.1.4。
- 用1x PBS或生长介质填充井外环,以减少剩余井的蒸发。在15 mL管中稀释细胞悬浮液,以获得0.5-2 x 104细胞/mL(需要为每个细胞系确定最佳细胞密度)(图1A(ii))。
- 将含有稀释细胞悬浮液的15 mL管放在冰上(例如,在玻璃烧杯中)(图1A(iia))。
- 将冷藏板和储液罐转移到发动机罩上。冲洗塑料容器,将其填充冰,并将其转移到发动机罩,使板和储液罐在整个过程中放在冰上。
- 轻轻重新悬浮 rBM,以确保凝胶均匀。
- 在冷冻细胞悬浮液中加入1-2%的rBM(需要为每个细胞系确定最佳浓度)(图1A(iib)。)。
- 倒置 15 mL 管,以确保在将悬浮液放入板之前正确混合 rBM 和电池悬架。
- 使用多通道移液器将含rBM的电池悬浮液转移到无菌储液罐中,并将200μL/孔分配到冷冻超低附件96孔板中(图1A(iii)。
注:如果使用多个细胞悬浮液(例如,多个细胞系),在添加 rBM 后立即分配每个细胞悬浮液,以防止过早凝胶化。 - 使用"柔软体面"/无制动(如果可能,在 4°C 下离心,使 rBM 流体保持更长时间,但不要求成功形成球体),在 750 x g下将板离心 15 分钟,以确保在 rBM 时将细胞聚集在一起硬化,促进形成一个单一的球体。
- 在培养箱中孵育板(37°C,5% CO2,95%湿度)。
- 每2-3天获取一次光显微图像,用于评估球体生长。
- 每 2-3 天更换 100 μL 的介质(取出 100 μL,用 100 μL 的新鲜介质替换)。
- 悬挂滴球体。
- 执行步骤 1.1.1-1.1.4。
- 稀释细胞以获得适当的稀释。实际稀释是50,000个细胞/mL。
- 取下 10 厘米2细胞培养盘的盖子,将其放置,使其朝上。在盘中加入 6 mL 的 1x PBS (图 1B (i))。
- 将细胞悬浮液倒入无菌储液罐中,用多通道移液器(图1B(ii)小心地将多达30滴40μL的细胞悬浮液放在细胞培养盘的盖子上(图1B(ii),从而产生2000个细胞/滴的浓度。避免将跌落太靠近盖子边缘,因为在以下步骤中反转盖子时,这些跌落更有可能失去表面张力。
- 以快速但可控的运动反转盖子,并将其放在包含 1x PBS 的细胞培养盘的顶部(图 1B (iii))。
- 将盘子置于37°C的培养箱中,其CO2和95%湿度不干扰滴液,使其生长4-6天。
- 如果用于蛋白质分解或嵌入,池球体通过取下盖子并倾斜,以便用1 mL的加热介质冲洗滴。将含有球体的培养基转移到1.5 mL管中,并使它们稳定在管的底部。分别按照4.4和6.2.2中所述进行蛋白质酸理和嵌入。
2. 类球体的药物治疗
注:长期药物治疗可应用于球体,以筛选感兴趣的药物的效果。在开始药物治疗之前,建议对药物进行剂量反应实验,以找到适合实验治疗的剂量。剂量应基于药物的确定 IC50/K i,范围约为此值的 0.2x-10x。
- 根据 1.2 或 1.3 中所述的所需条件设置 6-12 球形,并放置在培养箱中(37 °C,5% CO2,95% 湿度)2 天。
- 在第2天,拍摄球体的光微观图像。
- 准备第一个治疗剂量(获取图像后)。
注:第一次处理浓度必须达到所需最终浓度的两倍,因为当溶液在含有100μL培养基的井中后,溶液将被稀释1:2。建议的药物治疗间隔(取决于药物的半寿命):第2、4和7天。 - 使用多通道移液器,轻轻去除100μL的介质,并用含有介质的100μL药物替换。
- 将96孔板放回培养箱中,温度为37°C,具有5%的CO2和95%的湿度,并在选定的治疗日重复2.3和2.4,但现在没有加倍剂量以获得正确的最终剂量。
- 在协议/治疗计划的最后一天,可以进行以下一项或多项检测。
3. 类球体的细胞活力测定
- 按照 1.2 或 1.3 中所述的所需条件设置 4-6 球形,并在 37°C 的培养箱中放置,CO2和湿度为 95%。
注:在这种情况下,细胞活力测定在第7天或第9天进行,通过上述光显微镜监测球体生长每2-3天(点1.2.5和1.3.13)。 - 解冻可行性测定试剂(见材料表),并在使用前将其与RT平衡。
- 通过反转轻轻混合以获得均匀的溶液。
- 在进行测定之前,从球体(100 μL)中取出50%的培养基。
- 以1:3的比例将细胞活力试剂与井中存在的介质量(图2A(i))的比例添加到每口孔中(图2A(i)),对于96孔板,将50μL试剂添加到100μL的介质中。
- 大力混合内容物5分钟,诱导细胞分莱(图2A(ii))。
- 在RT孵育25分钟以稳定发光信号(图2A(iii))。
- 记录发光信号 (图 2A (iv))。
4. 从 3D 球形培养物制备蛋白质乳酸物,用于西方印迹
注:在收集球形时,建议使用 P200 移液器并切割尖端的末端,以允许更大的开口,从而在不干扰其结构的情况下更轻松地捕获球形。
- 对于每种情况,在 1.5 mL 管中至少汇集 12 个球体(取决于球形大小)(避免 2 mL 管,因为后续步骤由于底部不太尖度,因此将变得更加困难)。
注:如果介质量超过 1.5 mL,然后再收集所有球体,允许收集的球体在底部沉降(发生非常快,不需要离心),并在继续收集之前丢弃管的一半体积。剩余的球体。 - 将管子放在冰上,让球体在 1.5 mL 管的底部沉降。
- 从无菌细胞实验室移动到常规实验室。
- 在 1 mL 的冰冷 1x PBS 中洗涤球体两次。让球体稳定,然后在每个洗涤步骤之间去除1xPBS。
- 尽可能多吸1x PBS,而不干扰或去除球体。
- 每球体(例如,10个球体 = 50 μL LB)加入5μL加热解液缓冲液(LB),加入磷酸酶和蛋白酶抑制剂。
- 重复旋涡间隔,然后向下旋转,直到球体溶解。根据球体的尺寸和紧凑性,对 30 秒进行涡旋循环,然后离心(使用桌面离心机快速旋转就足够了)10 秒,约 5-10 分钟。
注:可以在此处暂停该协议。使分酶保持在-20°C,直到按照标准2D蛋白质莱酸协议进行声波、均质化和蛋白质测定,然后使用标准协议进行西方印迹。
5. 碘化物 (PI) 飞球染色
- 按照 1.2 或 1.3 中所述,在所需的条件下设置 3-6 个球体,并在 37°C 的培养箱中放置,其 CO2和湿度为 95%。
- 在无菌细胞培养实验室中,将 1x PBS 加热至 37°C。
- 通过在 1x PBS 中稀释库存溶液,制作 4 μM 的 PI 溶液:在 1x PBS 中稀释 1 mg/mL 水性 PI 1:350 的库存。
注:在井中加入溶液后,该浓度将进一步减半,每口含有球体的井需要最终浓度为2 μM. 100 μL。
警告:碘化钠 (PI) 必须在烟罩中处理,并戴上手套。PI 是光敏的。处理时防光。 - 从 96 孔板中的每个孔中取出 100 μL 的介质,而不去除球形。
- 将 100 μL 的加热 1x PBS 加入所有井中,然后清除井中 100 μL 的液体,从而洗净剩余的介质。重复此洗涤步骤 3 次。
- 在每个孔中加入100μL的PI溶液,用铝箔覆盖板,并将其置于37°C的培养箱中,温度为5%,CO2和95%湿度为10-15分钟。
- 重复 4.5 中描述的 3 个洗涤步骤以洗掉 PI 溶液,以便在成像时减少背景信号。
- 使用荧光显微镜对球体进行成像。要评估球形核心中细胞的生存能力,需要 z 堆栈来获取球体深度不同的图像。
注:建议根据球形大小,在每个切片之间增加大约 18-35 μm 的步长,每个球体大约提供 11-18 个堆栈。Z 堆栈可以使用 z 投影函数在 ImageJ 中进行处理,该函数可以将所有 z 堆栈合并为一个最终图片,从而概述整个球形的染色(有关为此目的使用 ImageJ 的进一步指南,请参阅(https://imagej.net/Z-functions)。
6. 嵌入 3D 球形
-
准备将球体嵌入的胶质凝胶(仅第一次执行协议所必需的)。
- 将 1 克细菌混合在 50 mL 的 ddH2O 中。
- 在微波炉中缓慢加热,直到细菌溶解并形成同质凝胶。不要让凝胶沸腾。
- 在60°C的水浴中保持细菌温暖。
- 实验之间保持4°C。
-
嵌入球体。
- 在第 1 天,对于每种情况,在 1.5 mL 管中至少汇集 12 个球体。
- 用 1 mL 的冰冷 1x PBS 洗涤一次。
- 要修复球体,添加 1 mL 的 4% 甲醛。
注:甲醛的处理应在烟罩中进行。 - 让他们在RT孵育24小时。
- 第 2 天,将甘蔗凝胶放入微波炉中装满水的烧杯中,仔细加热。确保凝胶不沸腾!在台式加热板中保持温暖,温度在60°C,直到使用。
- 用 1 mL 的冰冷 1x PBS 洗涤球形。
- 吸气大部分 1x PBS(此时保留约 100 μL,适用于处理球体)。
- 通过在斜坡处切割移液器尖端,获得具有较大孔的尖头,准备 20 μL 移液器(见图)。
注:下一部分必须迅速完成,以确保最佳的球体转移,并避免凝胶滴的凝固。如果没有可用的加热块,建议首先捕捉球形,然后使胶糖下降(即切换点 6.2.9 和 6.2.10 的顺序)。 - 在显微镜幻灯片上使甘蔗胶滴。将滑轨放在暖加热块上,以防止甘蔗凝固。
- 使用经过修改的移液器尖端(参见 6.2.8),在 15-20 μL 的体积中捕获尽可能多的球形。
- 在不接触显微镜滑块的情况下,小心地将含有 1x PBS 的 15-20 μL 球体注射到角糖凝胶滴的中心。
注:这是一个稍微困难的问题。如果将球形注射到凝胶滴中时,如果移液器尖端接触显微镜滑块,球形将丢失。建议通过将彩色液体注入滴中来练习使胶质滴和注入球体的整个过程。这将允许通过液滴的潜在穿透的可视化,因为彩色液体将泄漏到幻灯片上。 - 通过在RT或4°C孵育5-10分钟,让角胶凝胶滴硬化。一旦凝胶滴有些凝固(但仍相当柔软),小心地将凝胶滴从显微镜滑入带手术刀的塑料纸巾盒中。
- 用70%乙醇盖住塑料纸巾盒。
注:此时,球体可以直接使用或储存数月。 - 将甘蔗嵌入的球体嵌入石蜡中,截面至2-3 μm厚的层幻灯片中,并沾有血氧素和欧辛染色,或受免疫组织染色。
结果
基于球形形成方案的球形生长测定图1A和图1B,作为分析3D肿瘤抗癌药物治疗效果的起点模仿设置。球形的形成容易是细胞系特定的,一些细胞系需要补充rBM才能形成相干球体22。添加的rBM浓度对球体的形态有深刻的影响。如图1C和图1D所示,在0至4%之间改变rBM的浓度,以依赖细胞的方式改变球体的紧凑性和形态。图 1C演示了高达 2.5% 的 rBM 的添加如何允许 SKBr-3 乳腺癌细胞形成球体,在浓度超过 2.5% rBM 时无进一步作用。相反,BxPC3胰腺导管腺癌(PDAC)细胞,表现出上皮形态,自发地形成小,紧凑的球体(图1D,上,左面板)。在这种细胞类型中,将rBM浓度提高到1.5%或以上,导致从球形到更复杂结构的明显形态变化,具有突起和阴道,让人联想到导管结构的形成。相反,在另外两个PDAC细胞系,MiaPaCa和Panc-1中添加rBM,它们具有更间色表型,使松散的细胞聚合体变得更紧,形成更紧凑的球形(图1D,中下和下部面板)。这些结果表明,每个细胞系和条件必须对产生最佳球形形成的精确rBM量进行定子。
为了评估抗癌药物治疗的效果,有必要对球体在药物治疗时的细胞活力进行定量评估。此处描述的测定是基于荧光素-荧光酶的测定,用于测量从球体内的活细胞中释放的ATP。如图2A所示,说明了测定的原理。 此测定中产生的发光信号很容易被板读取器(图2A)记录,并且与其他方法23测量的可行性密切相关。图2B显示了ATP浓度与发光之间的线性关系,图2C显示了测定在3D球体中评估细胞死亡的能力。抗癌疗法。为了进一步评估相关范围内测定的线性度,进行了建立发光信号标准曲线的实验,作为细胞数的函数(图2D和图2EE) ).这些结果表明,该测定适用于估计3D球体培养的细胞生存能力,适用于研究药物引起的细胞活力损失。
在治疗期间每两到三天采集一次的光显微图像,以及细胞活力的最终定量评估,可以密切监督球体生长和形态,以及最佳治疗评估剂量。后者如图3A和图3B所示,其中进行了剂量反应实验,以确定MDA-MB-231乳腺癌球体细胞存活能力降低50%所需的剂量。MDA-MB-231和MCF-7球体对球形形态的处理效果分别在图3C和图3D中可视化。在使用所选化疗鸡尾酒治疗期间,MDA-MB-231球体的紧凑性增加,而在使用他莫西芬治疗期间,MCF-7球体越来越磨损和不均匀。在这两种情况下,在治疗7天(MDA-MB-231)或9天(MCF-7)后(图3E和图3F)后,细胞活力明显下降。这表明需要对球体细胞活力和形态的治疗介导效应进行视觉和定量评估,并且这些参数具有高度细胞和治疗类型的特殊性。
作为细胞可行性测定的补充,用PI染色死细胞,不能穿过膜,因此只染色坏死或晚期凋亡细胞与受损的膜完整性,允许快速的空间评估死细胞对治疗的反应,无需进行耗时的嵌入、切片和IHC协议。如图4A所示,在抑制剂浓度增加时死细胞的空间排列,在这种情况下,Na+/H+交换器 1 (NHE1) 抑制剂 5-(N-乙基-N-同丙基)-阿米洛抗 (EIPA)可视 化。如所见,对照球体显示有限的坏死/晚期凋亡核心,而死细胞分布在整个球形,因为EIPA的浓度增加。
为了量化不同处理后凋亡应激的相对诱导,对球体进行裂解,并进行SDS-PAGE凝胶电泳和西印,用于全长和裂解聚物(ADP-核糖)聚合酶(PARP)。代表性的结果如图4B和图4C所示。在这个实验中,球体是从MDA-MB-231细胞制备的,其中乳酸质子联合传输器MCT4或Na+,HCO3-共运体NBCn1被使用siRNA击倒。 MCT4和NBCn1(未公布数据)的西方印迹对击倒进行了评估。如地看到,MCT4的击倒,但不是NBCn1,有力地增加了PARP裂解,这与我们以前的证明,在MDA-MB-231细胞中MCT4的稳定击倒减少肿瘤生长在体内24。
为了进一步分析治疗的效果,并获取有关激活的特定信号、生长抑制和死亡途径的信息,球体除了可以嵌入西方印斑分析外,还可以进行免疫组织化学(IHC)分析。对球体部分的IHC分析允许使用细胞增殖、细胞周期和程序细胞死亡的特定抗体或标记物,并有助于可视化球体中增殖和凋亡细胞的空间排列。
图5A给出了用于球体的IHC分析的嵌入协议的原理图。图5B显示了嵌入球体的约3μm厚微球部分的代表性光显微图像,以及用于肿瘤抑制蛋白p53的球形体的免疫荧光图像(核染色使用DAPI),如图5C所示。DMSO和化疗处理的球体分别为细胞增殖标记Ki-67或p53染色,如图5D和图5E所示。 与化疗治疗的抗增殖效果一致,在DMSO对照中Ki-67阳性细胞的数量大于化疗治疗球体(图5D)。相反,在细胞应激、凋亡和生长抑制条件下,p53表达增加,因此,与DMSO对照组相比,在化疗治疗的球体中,p53染色细胞的数量要高得多(图5 E)
这些结果说明了如何获得关于3D球体药物治疗效果的空间解析(PI染色、IHC)或定量(西方印迹)信息的例子。
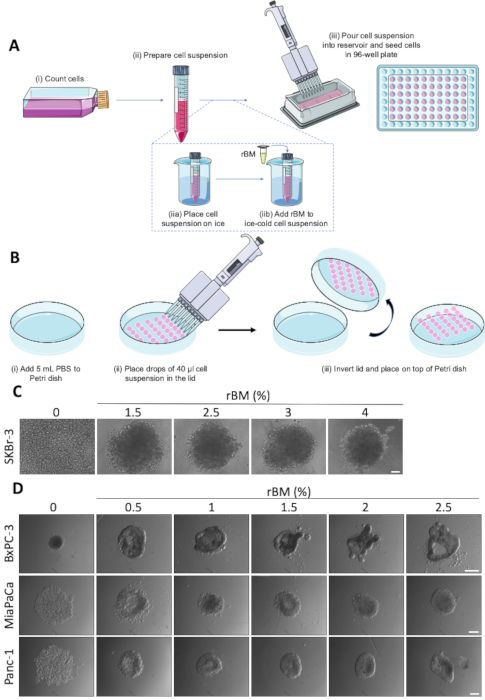
图 1:自发和rBM介导的球形形成。(A) 使用超低附件 96 孔圆形底板的球形形成图式表示,可选使用 rBM。标记 (i-iii) 的单个步骤。(B) 使用悬落法表示球形形成。单个步骤由(i-iii) (C) RBM介导的球形形成SKBr-3细胞的代表性图像标记。细胞在超低附着96孔圆底板中播种,rBM浓度增加,生长9天。刻度条 100 μm.(n=3)。(D) 在超低附着96孔圆底板上为球形形成而播种的BxPC-3、MiaPaCa和Panc-1细胞的代表性图像,其rBM浓度为0.5-2.5%。球形生长4天。刻度条 = 250 μm.(n=3)。请点击此处查看此图的较大版本。
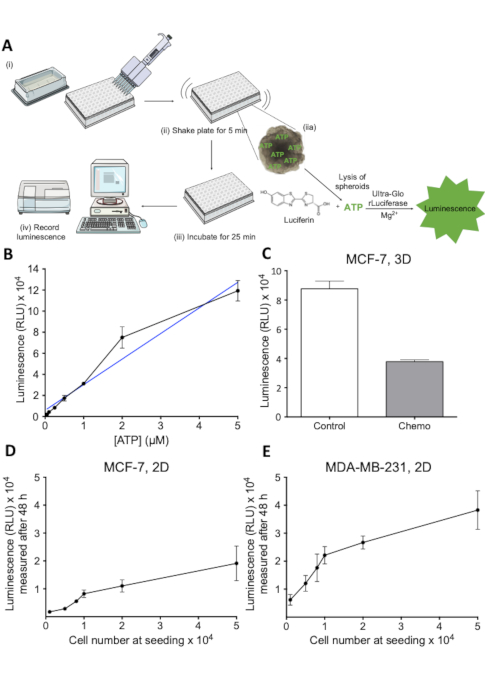
图 2:细胞活力测定原理与评价。(A) 3D细胞可行性测定的原理表。由 (i-iv) 表示的单个步骤。(B) 发光信号作为ATP浓度的函数.ATP的稀释剂被镀在96孔板中,细胞活力试剂加入每个孔。在 405 nm 时 30 分钟之后记录发光。1 n. (C) 可测量为发光、控制和化疗治疗的 MCF-7 球体。MCF-7细胞在超低附着圆底板中播种,生长7天。化疗(5 μM西斯铂、5 μM多索鲁比辛和30 nM 5-FU)在第2天和第4天应用。条形表示SD.1 n. (D) 发光信号的平均值,作为种子MCF-7细胞数的函数。MCF-7细胞以指示的细胞数在96孔板中播种,允许生长48小时,之后测量细胞活力。误差条表示 SD. 1 n. (E) 如 D 中所述的 MDA-MB-231 单元。请点击此处查看此图的较大版本。
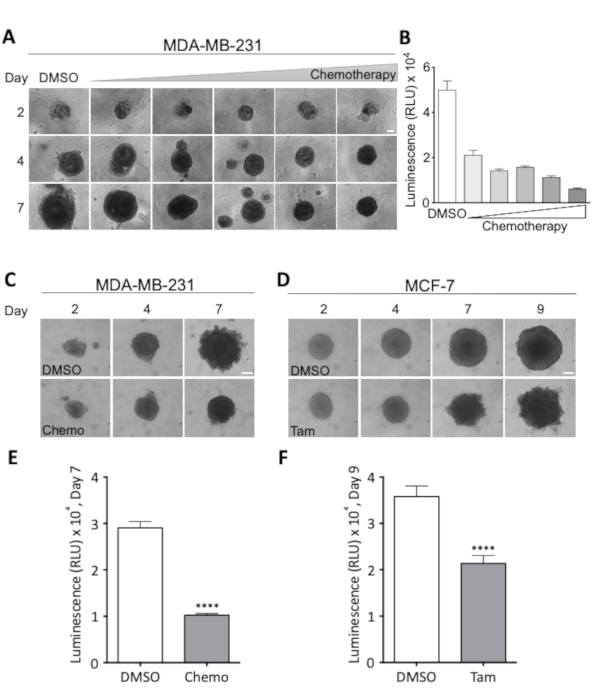
图 3:治疗方案对球体形态和细胞活力的影响。(A) 第2、4和7天MDA-MB-231球体的代表性图像。MDA-MB-231细胞在超低附件圆底96孔板中播种。化疗剂量增加的治疗在第2天开始,此时所有球形体的大小都差不多。行显示在增加剂量的化疗的球形,列显示球体代表大小在第2天,4和7在指示剂量。最低剂量为18.75 nM西斯铂、18.75 nM多索鲁比辛、0.0625 nM 5-Fluorourcil (5-FU),每张图像的剂量翻倍,最大剂量为0.3 μM西斯铂、0.3 μM多索鲁比辛和2 nM 5-FU。刻度条 = 100 μm.(2 n)。(B) 经过7天的化疗后,MDA-MB-231球体(测量为发光)的生存能力。柱线表示平均值与SEM.2 n. (C,D) 代表图像的MDA-MB-231 (C) 和MCF-7球体 (D ) 在第2天,4,7和MCF-7球形9。在第2天和第4天(C)或第2天用2μM Tamoxifen(Tam)进行化疗(Chemo,18.75 nM Cisplatin,18.75 nM多索鲁比,0.0625 nM 5-FU)的细胞,或用2μM Tamoxifen(Tam)治疗。刻度条 = 100 μm(4 n 和 3 n)。)。(E,F)在 (C) 和 (D) 第 7 天和第 9 天,以发光为单位的生存能力。为了测试条件之间的统计显著性差异,执行了未配对的学生的 t 检验。表示 p < 0.0001。请点击此处查看此图的较大版本。

图 4:碘化物的亲子化染色和球体的西印迹分析。(A) 经过9天的治疗后,PI染色MCF-7球体的代表性图像。MCF-7细胞在超低附着96孔板中播种,生长9天,并在第2、4和7天以增加的EIPA浓度进行处理。第9天,球体被PI染色,图像在荧光显微镜上采集。刻度条 = 200 μm.(1 n))(B) 在敲除/击倒酸碱运输机后,MDA-MB-231细胞的代表性西方污点。NHE1在MDA-MB-231细胞12中被CRISPR/Cas9敲除,随后细胞在MCT4或NBCn1上被暂时转染,并作为球体生长9天,然后被解除,并使用抗体进行西方印迹识别总计和已分 (c) PARP。(C) cPARP 与 PARP 蛋白水平比的量化,归一化为载荷控制 (β-actin)。(1 n)。请点击此处查看此图的较大版本。
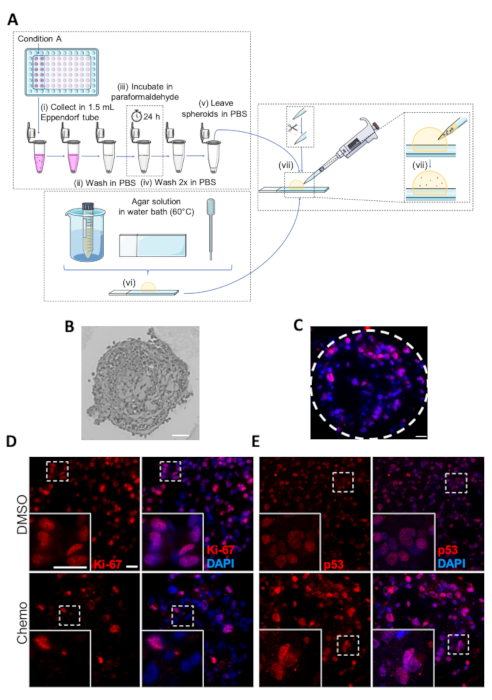
图 5:球体的固定、嵌入和免疫性化学分析。(A) 用于嵌入球体的协议的原理表示形式.单个步骤标记为 (i-vii)。(B) 嵌入式 MDA-MB-231 球形的图像。比例尺:50μm. (C) 化疗治疗的MDA-MB-231球体的代表性图像,通过针对p-53的抗体进行IHC分析。虚线显示球形的圆周。刻度条 = 20 μm. (D,E) DMSO 或化疗治疗的代表性图像(分别为上面板和下面板)MDA-MB-231 球形。MDA-MB-231细胞在超低附着96孔板中播种,生长7天,并在第2天和第4天接受化疗。在第7天,球体被嵌入,然后由IHC分析与主要抗体对Ki-67 (D )和p53 (E).白色框表示缩放图像。比例尺 = 两个放大倍数中的 20 μm(n=3)。请点击此处查看此图的较大版本。
讨论
使用3D癌细胞球体已被证明是一个有价值的和多功能的工具,不仅用于抗癌药物筛选,而且获得机械洞察力,在模拟肿瘤条件下的癌细胞死亡和生存能力的调节微。这一点尤其重要,因为化疗药物的可及性、细胞接受性和细胞内效应受到肿瘤物理化学条件(包括pH、氧张力、曲解性、物理和物理和化学细胞-细胞相互作用9,17。例如,在许多实体肿瘤25、26、27、28、29中,细胞外pH值可低至6-6.5,导致基础化疗薄弱化合物,如多索鲁比辛,线虫酮和zwitterionpaclitaxel,要充电。这减少了他们对肿瘤细胞的接受,并可能影响多药抗性蛋白质的活性,如p-糖蛋白30,31,32。此外,细胞增殖,这是大多数化疗化合物的效果的关键,一般减少在3D与2D条件相比,因此在肿瘤球体可能比在二维细胞培养8,33更好的模仿 ,34 .最后,致密肿瘤微环境是许多物理和可溶性信号线索的来源,这些信号引导细胞内信号通路调节细胞生长、生存和死亡。因此,在分析药物疗效时,3D培养系统是进入体内模型之前的关键步骤。然而,与 2D 文化相比,3D 区域性的一个主要缺点是分析的复杂性增加。我们在这里描述了使用各种癌细胞类型形成球形的简单和相对廉价的技术。我们已经展示了如何针对所研究的每个细胞类型优化球形形成的例子,并描述了如何获得关于细胞活力、细胞死亡和相关信号通路的定量数据,这些球体。此处描述的三种模型之间没有明显的生长或形态差异。在我们手中,使用悬垂法的形态变化可能稍大一些,但这种方法的优点是不需要rBM。我们在这里专注于从单个癌细胞类型产生的球体。然而,球形模型也适合共同培养,例如具有成纤维细胞的癌细胞、单核细胞/巨噬细胞、内皮细胞和/或脂肪细胞35、36、37。该模型的其他高级应用包括与3D打印流体装置的组合,允许通过半渗透膜给药,然后收获定量蛋白体分析38。
虽然,如上所述,在3D球体中生长的细胞的表型通常比在2D中生长的细胞更好地模仿体内肿瘤,但这种球体实际上与体内肿瘤相关模型的程度取决于许多因素,必须仔细评估。影响这种球体模仿体内状况的参数包括肿瘤的细胞组成及其相对ECM组成。例如,我们在此处提供的协议中用作 ECM 的 rBM 是模仿上皮癌早期阶段的最佳选择,在突破基底膜时,其他 ECM 组合物将更适用于某些肿瘤类型和阶段。此外,细胞-细胞粘附能力在癌细胞系之间差别很大,这取决于细胞细胞和细胞基质粘附蛋白(如球蛋白和整数22)的表达。
如上所述,使用具有低放大光学和大型视野的光学显微镜,每 2-3 天即可轻松、无创地监测球形生长和形态。然而,由于细胞毒性应激,如化疗治疗,对球形形态的影响非常不同,而且,从某种方式上,根据细胞类型和治疗方案,仅仅依靠形态和周长来评估是不够的治疗效果。例如,球形可能随着治疗和新兴细胞死亡而变得更加松散,或者所有死亡都可能发生在坏死核心,而表面没有明显受到影响。在这两种情况下,结果可能是一个错误的印象,即球体中的活细胞数量没有通过治疗减少。因此,定量和全球形技术对于评估治疗效果至关重要。对于细胞死亡的定量评价,酸磷酸酶测定,顾名思义测量细胞酸磷酸酶的活性已被采用21。然而,在我们的手中,虽然这种测定通常很好地反映了种子细胞的数量,但它不能充分捕获快速治疗引起的细胞死亡(数据未显示),很可能是因为酸磷酸酶在细胞死亡后一段时间内保持活跃。此外,这种测定要求完全去除介质,这增加了误差,特别是对于脆弱的化疗处理的球体。此处描述的细胞活力测定基于细胞ATP含量,基于其简单、及时的协议和高可重复性而选择。此外,这种测定不需要完全去除培养基,这是使用球体时的优势。如代表性结果所示,此测定可很好地捕获细胞数和预期的化疗治疗效果。然而,这种技术的一个缺陷是,很明显,代谢变化减少细胞内ATP含量可能错误地记录为较低的细胞数。因此,对球体体积和形态的平行评估,或PI染色,是可取的验证结果。
继西方印迹之后的类球状性变片可以半定量地洞察信号过程、细胞死亡、生长和活力途径的状态。当使用rBM来制备球体时,西方印迹的使用是复杂的,因为这将占落尿酸蛋白质含量的很大一部分,更重要的是,其分量贡献会随着细胞含量的降低而增加在化疗细胞死亡期间。原则上可以通过离心来去除rBM;但是,这是一个关键步骤,因为很难完全删除所有 rBM,这将排除条件之间的定量比较。对于此类球体,一般而言,用于空间解析的死亡途径和相关信号参数的评估,嵌入和IHC是强有力的工具。可以考虑其他方法:对(相对较小的)完整球体进行实时共聚焦成像39。球体的另一个有趣特性是,鉴于它们相当规律的"球"形,它们非常适合在数学建模和湿实验室实验之间迭代,以增进对上述重要性的理解。球体内的氧、pH和营养物质梯度,通过外推,肿瘤40,41。因此,虽然重要的3D肿瘤模型,更复杂的是正在出现,包括广泛的器官和器官培养基于复杂的生物和惰性脚手架,尤其是,患者衍生的异种移植42,球体仍然是一个重要的工具,因为它们与二维文化相比具有卓越的生物学相关性,同时具有相对易处理性。
综上所述,本文提出了一系列简单的方法,用于分析3D培养中癌细胞活力和死亡引起的抗癌治疗变化。球体的组成可以根据所使用的细胞的特性和生物学进行修改,而提出的定量和定性分析对于评估剂量-反应关系和深入了解涉及信号和死亡途径。
披露声明
提交人声明没有利益冲突。
致谢
我们感谢卡特琳·富兰克林·马克和安妮特·巴特尔斯的出色技术援助,感谢阿斯比约恩·内尔-尼尔森在图1D中执行实验。这项工作由艾纳尔·维伦森基金会、诺和诺德基金会和Juchum基金会(全部为SFP)资助。
材料
| Name | Company | Catalog Number | Comments |
| 2-(4-amidinophenyl)-1H-indole-6-carboxamidine (DAPI) | Invitrogen | # C10595 | For staining nuclei |
| 5-Fluorouracil (5-FU) | Sigma-Aldrich | #F6627 | Component in chemotherapeutic treatment |
| 5-(N-ethyl-isopropyl) amiloride (EIPA) | Life Technologies | #E3111 | Inhibitor of NHE1 |
| Antibody against PARP and cPARP | Cell signaling | #9542 | Used in western blotting |
| Antibody against Ki-67 | Cell signaling | #9449 | Used for IHC |
| Antibody against p53 | Cell Signaling | #2524 | Used for IHC |
| Antibody against β-actin | Sigma | A5441 | Used in western blotting |
| Bactoagar | BD Bioscience | #214010 | Used for agarose gel preparation |
| Benchmark protein ladder | Invitrogen | #10747-012 | Used for SDS-PAGE |
| Bio-Rad DC Protein Assay kit | Bio-Rad Laboratories | #500-0113, #500-0114, #500-0115 | Used for protein determination from lysates |
| Bürker chamber | Marienfeld | 610311 | For cell counting |
| BX63 epifluoresence microscope | Olympus | Used for fluorescent imaging | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | #G9681 | Used for the cell viability assay |
| Cisplatin | Sigma-Aldrich | #P4394 | Component in chemotherapeutic treatment |
| Corning Spheroid Microplate, 96 well, Black with clear round bottom, Ultra-low attachment, With lid, Sterile | Corning | #4520 | Used for growing spheroids with luminescence measurements as end point |
| Corning 96 well, clear round bottom, Ultra-low attachment microplate, With lid, Sterile | Corning | #7007 | Sufficient for spheroid growth without luminescence measurements as end point |
| Criterion TGX Precast Gels | Bio-Rad | 5671025 | Used for SDS-PAGE |
| Doxorubicin | Abcam | #120629 | Component in chemotherapeutic treatment |
| FLUOStar Optima Microplate reader | BMG Labtech | Used for recording luminescence | |
| Formaldehyde | VWR Chemicals | #9713.1000 | Used for cell fixation |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Gibco | #A1413202 | Keep at 4 °C to prevent solidification. Referred to as rBM in the protocol. |
| Heat-inactivated FBS | Sigma | #F9665 | Serum for growth media |
| ImageJ | NIH | Scientific Image analysis | |
| Medim Uni-safe casette | Medim Histotechnologie | 10-0114 | Used for storage of embedded spheroids |
| Mini protease inhibitor cocktail tablets | Roche Diagnostics GmBH | # 11836153001 | Used for lysis buffer preparation |
| MZ16 microscope | Leica | Used for light microscopic images | |
| NuPAGE LDS 4x Sample Buffer | Invitrogen | #NP0007 | Used for western blotting |
| Pierce ECL Western blotting substrate | Thermo scientific | #32106 | Used for western blotting |
| Ponceau S | Sigma-Aldrich | #P7170-1L | Used for protein band staining |
| Prism 6.0 | Graphpad | Scientific graphing and statistical software | |
| Propidium iodide (1mg/ml solution in water) | Invitrogen | P3566 | Light sensitive |
| Sterile reservoirs, multichannel | SPL lifesciences | 21002 | Used for seeding cells for spheroid formation |
| Superfrost Ultra-Plus Adhesion slide | Menzel-Gläser | #J3800AMNZ | Microscope glass slide used for embedding |
| Tamoxifen | Sigma-Aldrich | #T5648 | Used as chemotherapeutic treatment |
| Trans-blot Turbo 0.2 µm nitrocellulose membranes | Bio-Rad | #170-4159 | Used for western blotting |
| Tris/Glycine/SDS running buffer | Bio-Rad | #161 0732 | Used for SDS-PAGE |
| Trypsin-EDTA solution | Sigma | #T4174 | Cell dissociation enzyme |
参考文献
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W., Freyer, J. P., Sutherland, R. M. Influence of glucose and oxygen supply conditions on the oxygenation of multicellular spheroids. British Journal of Cancer. 53 (3), 345-353 (1986).
- Gaedtke, L., Thoenes, L., Culmsee, C., Mayer, B., Wagner, E. Proteomic analysis reveals differences in protein expression in spheroid versus monolayer cultures of low-passage colon carcinoma cells. Journal of Proteome Research. 6 (11), 4111-4118 (2007).
- Chen, J. L., et al. The genomic analysis of lactic acidosis and acidosis response in human cancers. PLoS Genetics. 4 (12), 1000293 (2008).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Gudjonsson, T., Ronnov-Jessen, L., Villadsen, R., Bissell, M. J., Petersen, O. W. To create the correct microenvironment: three-dimensional heterotypic collagen assays for human breast epithelial morphogenesis and neoplasia. Methods. 30 (3), 247-255 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews in Molecular and Cell Biology. 8 (10), 839-845 (2007).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jacobi, N., et al. Organotypic three-dimensional cancer cell cultures mirror drug responses in vivo: lessons learned from the inhibition of EGFR signaling. Oncotarget. 8 (64), 107423-107440 (2017).
- Rodriguez-Enriquez, S., et al. Energy metabolism transition in multi-cellular human tumor spheroids. Journal of Cell Physiology. 216 (1), 189-197 (2008).
- Kunz-Schughart, L. A. Multicellular tumor spheroids: intermediates between monolayer culture and in vivo tumor. Cell Biology International. 23 (3), 157-161 (1999).
- Andersen, A. P., et al. Roles of acid-extruding ion transporters in regulation of breast cancer cell growth in a 3-dimensional microenvironment. Molecular Cancer. 15 (1), 45 (2016).
- Swietach, P., Patiar, S., Supuran, C. T., Harris, A. L., Vaughan-Jones, R. D. The role of carbonic anhydrase 9 in regulating extracellular and intracellular ph in three-dimensional tumor cell growths. Journal of Biological Chemistry. 284 (30), 20299-20310 (2009).
- Walenta, S., Doetsch, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Metabolic imaging in multicellular spheroids of oncogene-transfected fibroblasts. Journal of Histochemistry and Cytochemistry. 48 (4), 509-522 (2000).
- Kunz-Schughart, L. A., Groebe, K., Mueller-Klieser, W. Three-dimensional cell culture induces novel proliferative and metabolic alterations associated with oncogenic transformation. International Journal of Cancer. 66 (4), 578-586 (1996).
- Feng, H., et al. Homogeneous pancreatic cancer spheroids mimic growth pattern of circulating tumor cell clusters and macrometastases: displaying heterogeneity and crater-like structure on inner layer. Journal of Cancer Research and Clinical Oncology. 143 (9), 1771-1786 (2017).
- Santini, M. T., Rainaldi, G., Indovina, P. L. Apoptosis, cell adhesion and the extracellular matrix in the three-dimensional growth of multicellular tumor spheroids. Critical Reviews in Oncology/Hematology. 36 (2-3), 75-87 (2000).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Wong, C., Vosburgh, E., Levine, A. J., Cong, L., Xu, E. Y. Human neuroendocrine tumor cell lines as a three-dimensional model for the study of human neuroendocrine tumor therapy. Journal of Visual Experiments. (66), e4218 (2012).
- Friedrich, J., et al. A reliable tool to determine cell viability in complex 3-d culture: the acid phosphatase assay. Journal of Biomolecular Screening. 12 (7), 925-937 (2007).
- Ivascu, A., Kubbies, M. Diversity of cell-mediated adhesions in breast cancer spheroids. International Journal of Oncology. 31 (6), 1403-1413 (2007).
- Crouch, S. P., Kozlowski, R., Slater, K. J., Fletcher, J. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. Journal of Immunological Methods. 160 (1), 81-88 (1993).
- Andersen, A. P., et al. The net acid extruders NHE1, NBCn1 and MCT4 promote mammary tumor growth through distinct but overlapping mechanisms. International Journal of Cancer. , (2018).
- Vaupel, P. Tumor microenvironmental physiology and its implications for radiation oncology. Seminars in Radiation Oncology. 14 (3), 198-206 (2004).
- Vaupel, P. W., Frinak, S., Bicher, H. I. Heterogeneous oxygen partial pressure and pH distribution in C3H mouse mammary adenocarcinoma. Cancer Research. 41 (5), 2008-2013 (1981).
- Helmlinger, G., Yuan, F., Dellian, M., Jain, R. K. Interstitial pH and pO2 gradients in solid tumors in vivo: high-resolution measurements reveal a lack of correlation. Nature Medicine. 3 (2), 177-182 (1997).
- Zhang, X., Lin, Y., Gillies, R. J. Tumor pH and its measurement. Journal of Nuclear Medicine. 51 (8), 1167-1170 (2010).
- Gillies, R. J., Raghunand, N., Karczmar, G. S., Bhujwalla, Z. M. MRI of the tumor microenvironment. Journal of Magnetic Resonance Imaging. 16 (4), 430-450 (2002).
- Vukovic, V., Tannock, I. F. Influence of low pH on cytotoxicity of paclitaxel, mitoxantrone and topotecan. British Journal of Cancer. 75 (8), 1167-1172 (1997).
- Song, C. W., Griffin, R., Park, H. J., Teicher, B. A. . Cancer Drug Resistance. , 21-42 (2006).
- Lotz, C., et al. Role of the tumor microenvironment in the activity and expression of the p-glycoprotein in human colon carcinoma cells. Oncology Reports. 17 (1), 239-244 (2007).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today: Technologies. 23, 27-36 (2017).
- Stratmann, A. T., et al. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Molecular Oncology. 8 (2), 351-365 (2014).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLoS One. 12 (7), 0182039 (2017).
- Bochet, L., et al. Adipocyte-derived fibroblasts promote tumor progression and contribute to the desmoplastic reaction in breast cancer. Cancer Research. 73 (18), 5657-5668 (2013).
- Amann, A., et al. Development of a 3D angiogenesis model to study tumour - endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific Reports. 7 (1), 2963 (2017).
- LaBonia, G. J., Ludwig, K. R., Mousseau, C. B., Hummon, A. B. iTRAQ Quantitative Proteomic Profiling and MALDI-MSI of Colon Cancer Spheroids Treated with Combination Chemotherapies in a 3D Printed Fluidic Device. Analytical Chemistry. 90 (2), 1423-1430 (2018).
- Hulikova, A., Vaughan-Jones, R. D., Swietach, P. Dual role of CO2/HCO3(-) formula buffer in the regulation of intracellular pH of three-dimensional tumor growths. Journal of Biological Chemistry. 286 (16), 13815-13826 (2011).
- Wallace, D. I., Guo, X. Properties of tumor spheroid growth exhibited by simple mathematical models. Frontiers in Oncology. 3, 51 (2013).
- Michel, T., et al. Mathematical modeling of the proliferation gradient in multicellular tumor spheroids. Journal of Theoretical Biology. 458, 133-147 (2018).
- Meijer, T. G., Naipal, K. A., Jager, A., van Gent, D. C. Ex vivo tumor culture systems for functional drug testing and therapy response prediction. Future Science OA. 3 (2), (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。