Method Article
암세포의 3D 스페로이드 배양에서 세포 생존력과 사망 평가
요약
여기에서, 우리는 2D 문화 보다는 생체 내 종양의 물리 화학 구배를 모방하는 3D 암 세포 스페로이드에 있는 생존과 죽음을 평가하기 위한 몇몇 간단한 방법을 제시합니다. 따라서 스페로이드 모델은 생체 내 조건으로의 번역을 개선하여 암 약물 효능의 평가를 허용합니다.
초록
암세포의 3차원 스페로이드는 암 약물 스크린과 암 세포 생물학에 대한 기계적 통찰력을 얻기 위한 중요한 도구입니다. 이 준비의 힘은 상대적으로 높은 처리량 검열을 허용하기 위하여 충분히 빠르고, 싸고, 다재다능하면서 종양의 생체 내 조건의 많은 양상을 모방하는 그것의 기능에 있습니다. 스페로이드 배양 조건은 종양에 있는 물리 화학 구배를 되풀이할 수 있습니다, 세포외 산도 증가 포함, 증가한 젖산, 및 포도당 과 산소 가용성 감소, 그것의 코어에 구형 주변에서. 또한, 생체 내 종양의 기계적 특성 및 세포-세포 상호 작용은 부분적으로 이 모델에 의해 모방된다. 특정 특성 및 결과적으로 최적의 성장 조건, 3D 스페로이드의, 암 세포의 다른 유형 사이 크게 다릅니다. 게다가, 3D 스페로이드에 있는 세포 생존성 그리고 죽음의 평가는 2D 문화를 위해 채택된 것과 부분적으로 다른 방법을 요구합니다. 여기에서 우리는 암세포의 3D 스페로이드를 준비하기 위한 몇몇 프로토콜을 기술하고, 항암제의 효험을 평가하는 맥락에서 세포 생존력 및 죽음을 평가하기 위하여 그 같은 문화를 이용하기 위한.
서문
암 생물학에서 다세포 스페로이드 모델의 사용은 수십년 된 1,2,그러나 최근 몇 년 동안 상당한 모멘텀을 얻고있다. 큰 부분에서, 이것은 암세포의 표현형이 그들의 미세 환경 및 특정 성장 조건에 얼마나 강하게 의존하는지의 증가한 의식을 반영합니다. 고형 종양의 미세 환경은 상응하는 정상 조직에서의 미세 환경과 근본적으로 다릅니다. 여기에는 pH, 산소 장력과 같은 물리 화학 적 조건뿐만 아니라 간질 압력, 영양분, 노산물 및 분비 된 신호 화합물 (성장 인자, 사이토 카인)과 같은 수용성 인자의 농도 구배가 포함됩니다. 더욱이, 종양3,4의세포외 기질(ECM), 세포-세포 상호작용 및 세포간 신호화, 및 특정 3차원(3D) 아키텍처의 다른 양상들의 조직을포함한다. 5,6. 암세포가 존재하는 특정 미세 환경 조건은 유전자 발현 프로필 및 기능적 특성에 심오하게 영향을 미치며, 2D로 자란 세포의 표현형에 비해 3D 스페로이드의 표현형이 훨씬 더 밀접하게 모방된다는 것은 분명합니다. 생체 내 종양의7,8,9,10,11. 2D 모델은 저산소증, 산성 pH 및 높은 젖산 농도를 사용하여 종양 미세 환경의 알려진 측면을 모방하더라도 종양 내에서 발생하는 물리 화학 적 매개 변수와 3D 종양의 구배를 포착하지 못합니다. 아키텍처. 다른 한편으로는, 동물 모형은 비용이 많이 들고, 느리고, 윤리적으로 문제가 있고, 일반적으로, 또한 인간 적인 종양 조건을 되풀이하는 그들의 기능에 있는 결점이 있습니다. 따라서, 3D 스페로이드는 대부분의 고형암9,11, 12,13의광범위한 특성에 대한 연구에서 중간 복잡성 모델로적용되었습니다. 14,15,16,17.
3D 스페로이드의 널리 사용되는 사용은 항암 치료 효능 9,18,19,20의스크리닝 검문 검사에 있다. 처리 반응은 종양 미세 환경에 특히 민감하며, 불법 행위의 영향, 제한된 확산, 높은 간질 압력 및 약물 전달에 대한 산성 환경 pH, 저산소증 및 기타 의 영향을 모두 반영합니다. 세포 사멸 반응에 대한미세 환경의 양상 9,17. 3D 스페로이드 내의 환경은 본질적으로 이러한 속성 7,8,9,10,11을모두 개발하기 때문에 3D 세포 배양을 채택할 수 있습니다. 결과의 결과를 생체 내 조건으로 실질적으로 향상시키면서도 순 성장의 효율적이고 저렴한 고처리량 스크리닝을 허용합니다. 그러나, 암세포의 약물 반응에 대한 연구의 대부분은 여전히 2D 조건 하에서 수행된다. 이것은 몇몇 분석실험이 3D 세포 배양을 위해 상대적으로 쉽게 구현될 수 있는 동안, 생존성 분석실험, 서쪽 blotting 및 면역형광 분석과 같은 많은 것이 3D에서 보다는 2D에서 훨씬 더 편리하게 행해질 수 있다는 것을 반영합니다.
본 연구의 목적은 암세포 생존력및 생존에 대한 항암제 치료의 효과를 분석하기 위한 용이한 분석및 정밀한 프로토콜을 3D 종양 모방 설정에서 제공하는 것이다. 구체적으로, 우리는 스페로이드 형성을 위한 3개의 다른 방법을 제공하고 비교하고, 성장, 생존력 및 약물 반응의 정성적 및 정량적 분석을 위한 방법에 선행합니다.
프로토콜
1. 스페로이드 생성
- 스페로이드 형성을 위한 세포 현탁액 준비
참고: 다른 세포주들은 매우 다른 접착 특성을 가지며, 각각의 경우에 가장 적합한 스페로이드 형성 프로토콜을 확립해야 합니다. 우리는 MCF-7과 BxPC-3 세포가 자발적인 스페로이드 형성에 적합하다는 것을 것을을 발견했습니다, MDA-MB-231, SKBr-3, Panc-1 및 MiaPaCa는 성공적으로 스페로이드를 형성하기 위하여 재구성된 지하실 막의 추가를 요구합니다. MDA-MB-231 및 BxPC-3 세포만이 매달려 있는 드롭 프로토콜에 사용되었지만 다른 세포주도 확실히 적용 가능하다.- 70-80% 합류까지 단층으로 세포를 성장.
- 인산완충식염수로 세포를 세척하고(1x PBS, 25cm2의 경우 20mL, 75cm 2플라스크의 경우 10mL), 세포 해리 효소(25cm 2의 경우 0.5 mL, 75cm 2플라스크의 경우 1mL)를 추가하고 37°C에서 2-5분 동안 세포를 배양합니다. 5%CO2 및 95% 습도.
- 현미경으로 세포 분리를 확인하고 75 cm 2 플라스크에 대해 25 cm2 또는 10 mL에서 총 부피 5 mL에 성장 배지 (세포주에 따라 6-10 % 혈청)를 추가하여 세포 해리 효소를 중화시다.
- Bürker 챔버를 사용하여 세포를 계산하고 세포 준비당 챔버내 8 제곱을 계산하여 스페로이드 크기의 높은 재현성을 얻습니다.
참고: 스페로이드 형성을 위한 다른 방법을 설명하는 3개의 프로토콜각각은 아래에 제시된다. 프로토콜 1.2 및 1.3은 제시된 모든 후속 분석 프로토콜에 사용할 수 있지만 프로토콜 1.4는 포함 및 용해 제제에 가장 적합합니다. 세포주에 따라, 스페로이드 형성은 사용되는 방법에 관계없이 2-4 일이 걸립니다.
- 자발적인 스페로이드 형성
- 단계 1.1.1-1.1.4를 수행합니다.
- 세포 현탁액을 15 mL 튜브에서 희석하여 0.5-2 x 104 세포/mL(각 세포주마다 최적의 세포 밀도를 결정할 필요가 있음)(도1A(ii))).
- 나머지 우물에서 증발을 줄이기 위해 1x PBS 또는 성장 매체로 우물의 외부 고리를 채웁니다. 셀 서스펜션을 멸균 저장소로 옮기고, 멀티채널 파이펫을 사용하여 200 μL/well을 초저 부착 96웰 라운드 바닥 판으로 분배합니다(그림1A(iii)).
- 37 °C에서 인큐베이터에서 접시를 5 %CO 2, 95 % 습도로 배양합니다.
- 매 2-3 일마다 스페로이드의 가벼운 현미경 이미지를 얻습니다.
참고: 이 백서의 이미지는 11.5배 배율로 촬영되며, 이러한 프로토콜을 사용하여 제조된 대부분의 스페로이드에 적합합니다. - 매 2-3 일 (이미지 획득 후) 매체 의 100 μL을 대체 (소비 매체의 100 μL을 제거하고 신선한 매체의 100 μL로 교체하십시오.
참고: 매체를 교체 할 때 스페로이드를 제거하지 않으려면, 천천히 매체를 제거하고 그것을 폐기하기 전에 눈에 보이는 전형에 대한 팁에 흡인 매체를 검사하면서 플레이트를 조금 기울이는 것이 좋습니다.
- 재구성 된 지하 멤브레인 매개 스페로이드 형성.
참고: 유당 탈수소효소 상승 바이러스(LDEV)-무성장 인자 재구성 지하 막(rBM)을 사용하였다. rBM은 온도에 민감하며 15 °C에 도달하면 응고되기 때문에 항상 얼음에 보관해야합니다. 도금 전에 4°C 또는 2-4시간에서 밤새 얼음에 rBM을 해동합니다.- 얼음에 rBM을 해동 (재료표참조).
- 사용하기 전에 접시와 저수지(개별적으로 포장된 경우)를 얼음 위에 보관하십시오.
- 단계 1.1.1-1.1.4를 수행합니다.
- 나머지 우물에서 증발을 줄이기 위해 1x PBS 또는 성장 매체로 우물의 외부 고리를 채웁니다. 세포 현탁액을 15 mL 튜브에서 희석하여 0.5-2 x 104 세포/mL(각 세포주마다 최적의 세포 밀도를 결정할 필요가 있음)(도1A(ii))).
- 희석된 세포 현탁액을 함유하는 15 mL 튜브를 얼음 상에 놓습니다(예를 들어, 유리 비커)(도1A(iia))).
- 차가운 접시와 저수지를 후드로 옮김. 플라스틱 용기를 헹구고 얼음으로 채우고 후드로 옮겨 전체 절차 동안 플레이트와 저수지를 얼음위에 놓습니다.
- 균일 한 젤을 보장하기 위해 rBM을 부드럽게 다시 일시 중단하십시오.
- 냉각된 세포 현탁액에 1-2% rBM(각 세포주마다 최적 농도가 결정되어야 한다)을 추가합니다(그림1A(iib))).
- 플레이트에 현탁액을 분배하기 전에 rBM 및 셀 현탁액의 적절한 혼합을 보장하기 위해 15 mL 튜브를 반전시.
- rBM 함유 셀 현탁액을 멸균 저장소로 옮기고 다중 채널 파이펫을 사용하여 냉각된 초저 부속식 96웰 플레이트에 200 μL/well을 분배합니다(도1A(iii)).
참고: 여러 세포 현탁액(예를 들어, 하나 이상의 세포주)으로 작업하는 경우, 조기 겔링을 방지하기 위해 rBM 첨가 직후에 각 세포 현탁액을 분배하는 것이 필수적입니다. - '소프트 괜찮은'/제동 없음을 사용하여 750 x g에서 15 분 동안 플레이트를 원심 분리 (가능한 경우 4 °C에서 원심 분리기로 rBM 유체를 더 오래 유지하지만 성공적인 스페로이드 형성을위한 요구 사항은 아님), rBM 시 세포가 함께 클러스터되도록합니다. 경화, 하나의 단일 스페로이드의 형성을 용이하게.
- 인큐베이터 (37 °C, 5 % CO2,95 % 습도)에서 플레이트를 배양합니다.
- 매 2-3 일 스페로이드 성장의 평가를 위한 가벼운 현미경 심상을 취득합니다.
- 매 2-3 일마다 100 μL의 매체를 대체하십시오 (100 μL을 제거하고 신선한 매체의 100 μL로 대체하십시오).
- 매달려 드롭 스페로이드.
- 1.1.1-1.1.4 단계를 수행합니다.
- 적절한 희석을 얻기 위해 세포를 희석한다. 실용적인 희석은 50,000 셀 /mL입니다.
- 10cm2 세포 배양 접시의 뚜껑을 제거하고 위쪽으로 향할 수 있도록 놓습니다. 접시에 1x PBS의 6mL를 추가합니다(그림1B(i))).
- 세포 현탁액을 멸균 저장소에 붓고 다중 채널 파이펫 (그림1B (ii))을사용하여 세포 배양 접시의 뚜껑에 40 μL의 셀 현탁액을 30 방울까지 조심스럽게 놓고 2,000 개의 세포 / 드롭의 농도를 초래합니다. 다음 단계에서 뚜껑을 뒤집을 때 표면 장력을 잃을 가능성이 높기 때문에 방울을 뚜껑 가장자리에 너무 가깝게 두지 마십시오.
- 뚜껑을 빠르지만 제어된 움직임으로 반전시키고 1x PBS 함유 세포 배양 접시 위에 놓습니다(도1B(iii)).
- 접시를 37°C에서 5%CO2 및 95% 습도의 인큐베이터에 놓고 방울을 방해하지 않고 4-6일 동안 자랍니다.
- 단백질 용해 또는 포함에 사용되는 경우, 뚜껑을 제거하고 기울여 풀 스페로이드, 가열 매체의 1 mL로 방울을 씻어하기 위해. 스페로이드를 함유한 생성된 배지를 1.5 mL 튜브로 옮기고 튜브 바닥에 정착시키십시오. 단백질 용해 및 임베딩에 대해 각각 4.4 및 6.2.2에 기재된 대로 진행한다.
2. 스페로이드의 약물 치료
참고: 관심 있는 약물의 효과를 스크리프기 위해 스페로이드에 장기 약물 치료를 적용할 수 있다. 약물 치료를 시작하기 전에, 실험 적 치료를 위한 적절한 용량을 찾기 위해 약물의 투여 반응 실험을 수행하는 것이 바람직하다. 투여량은 약물의 결정된 IC50/Ki를 기반으로 해야 하며 이 값의 약 0.2x-10x로부터 범위에 이된다.
- 1.2 또는 1.3에 기재된 바와 같이 원하는 조건당 6-12개의 스페로이드를 설정하고 인큐베이터(37°C, 5% CO2, 95% 습도)에 2일 동안 놓습니다.
- 2 일째에는 스페로이드의 가벼운 현미경 이미지를 가져 가라.
- 첫 번째 치료 용량을 준비하십시오 (이미지를 획득 한 후).
참고: 제1 처리 농도는 100 μL 배지를 함유하는 웰에 첨가하여 용액이 1:2 희석될 것이기 때문에 원하는 최종 농도의 2배여야 한다. 제안 된 약물 치료 간격 (약물 반감기에 따라 달라 집니다): 일 2, 4 그리고 7. - 다중 채널 파이펫을 사용하여 100 μL의 배지를 부드럽게 제거하고 배지를 함유 한 100 μL의 약물로 교체하십시오.
- 96웰 플레이트를 5%CO2 및 95% 습도로 37°C에서 인큐베이터에 다시 놓고, 선택한 치료 일에 2.3 및 2.4를 반복하지만, 이제 는 정확한 최종 용량을 얻기 위해 복용량을 두 배로 늘리지 않고.
- 프로토콜/치료 일정의 마지막 날에, 다음 분석중 하나 또는 여러 가지를 수행할 수 있다.
3. 스페로이드세포 생존분석
- 1.2 또는 1.3에 기재된 바와 같이 원하는 조건당 4-6개의 스페로이드를 설정하고 5% CO2 및 95% 습도로 37°C에서 인큐베이터에 놓습니다.
참고: 이 때, 세포 생존율 분석법은 상술한 바와 같은 광 현미경검사법에 의해 2-3일마다 스페로이드 성장을 모니터링한 후 7일 또는 9일에 수행하였다(점 1.2.5 및 1.3.13). - 생존율 분석 시약을 해동(재료 표참조)하고 사용하기 전에 RT와 평형화합니다.
- 균일 한 용액을 얻기 위해 반전하여 부드럽게 혼합하십시오.
- 분석을 수행하기 전에, 스페로이드(100 μL)로부터 배양 배지의 50%를 제거한다.
- 웰에 존재하는 배지의 양에 1:3 비율로 각각의 잘 에 세포 생존 성 시약을 추가 (그림2A (i)96 웰 플레이트의 경우, 배지의 100 μL에 시약의 50 μL을 추가합니다.
- 세포 용해를 유도하기 위해 5분 동안 내용물들을 힘차게 섞는다(도2A(ii)).
- RT에서 25분 동안 배양하여 발광 신호를 안정화하였다(도2A(iii)).
- 발광 신호를 기록합니다(그림2A(iv)).
4. 3D 스페로이드 배양에서 서양 블로팅을 위한 단백질 용해준비
참고: 스페로이드를 수집할 때 P200 파이펫을 사용하고 팁 끝을 잘라 더 큰 개구부를 허용하고 따라서 구조를 방해하지 않고 스페로이드를 쉽게 캡처하는 것이 좋습니다.
- 각 조건에 대해 1.5 mL 튜브에서 최소 12, 이상적으로 18-24 스페로이드 (스페로이드 크기에 따라 다름)를 풀링하십시오 (다음 단계는 덜 뾰족한 바닥으로 인해 더 어려워지기 때문에 2 mL 튜브를 피하십시오).
참고: 배지의 양이 모든 스페로이드를 수집하기 전에 1.5 mL를 초과하는 경우, 수집 된 스페로이드가 바닥에 정착 할 수 있도록 (매우 빠르게 발생, 원심 분리필요) 수집을 계속하기 전에 튜브의 절반 볼륨을 폐기 남은 스페로이드. - 얼음에 튜브를 놓고 스페로이드가 1.5 mL 튜브의 바닥에 정착 할 수 있도록.
- 멸균 세포 실험실에서 일반 실험실로 이동하십시오.
- 얼음차가운 1x PBS 1mL에 스페로이드를 두 번 씻으세요. 각 세척 단계 사이에 1x PBS를 제거하기 전에 스페로이드가 정착시키십시오.
- 스페로이드를 방해하거나 제거하지 않고 가능한 한 1x PBS를 흡인합니다.
- 스페로이드 당 인산염 및 프로테아제 억제제(예: 10개의 스페로이드 = 50 μL LB)를 가진 가열된 용해 완충제(LB)를 5 μL추가합니다.
- 와류의 반복 간격과 스페로이드가 용해 될 때까지 스핀 다운됩니다. 30초 동안 소용돌이 를 한 다음 원심 분리 (탁상 원심 분리기를 사용하는 빠른 스핀이 충분함)를 약 10 초 동안 약 5-10 분 동안 스페로이드의 크기와 소형화에 따라 수행하십시오.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. 표준 2D 단백질 용해 프로토콜에서와 같이 초음파 처리, 균질화 및 단백질 측정을 진행할 때까지 용해를 -20 °C에서 유지하고 표준 프로토콜을 사용하여 서쪽 블로팅을 합니다.
5. 스페로이드의 프로피듐 요오드화물 (PI) 염색
- 1.2 또는 1.3에 기재된 바와 같이 원하는 조건당 3-6개의 스페로이드를 설정하고 5% CO2 및 95% 습도로 37°C에서 인큐베이터에 놓습니다.
- 멸균 세포 배양 실험실에서 1x PBS를 37°C로 가열합니다.
- 1x PBS로 재고 용액을 희석하여 4 μM의 PI 솔루션을 만듭니다: 1x PBS에서 PI 1:350의 1 mg/mL 수성 재고를 희석합니다.
참고: 이러한 농도는 스페로이드를 함유하는 각각의 웰에 대해 2 μM. 100 μL의 최종 농도를 부여하는 웰에 용액을 첨가할 때 더욱 반으로 줄어들 것이다.
주의 사항: 프로피듐 요오드화물 (PI)는 연기 후드와 장갑을 착용에서 처리해야합니다. PI는 빛에 민감합니다. 취급 시 빛으로부터 보호하십시오. - 스페로이드를 제거하지 않고 96웰 플레이트에서 각각의 웰으로부터 배지의 100 μL을 제거한다.
- 모든 웰에 가열된 1x PBS 100 μL을 첨가하고 웰에서 액체의 100 μL을 제거하여 나머지 배지를 씻어낸다. 이 세척 단계를 3번 반복합니다.
- 각 우물에 PI 용액의 100 μL을 추가하고 알루미늄 호일에 플레이트를 덮고 5 % CO2 및 95 % 습도로 37 °C의 인큐베이터에 10-15 분 동안 배치하십시오.
- 이미징 시 배경 신호를 감소시키기 위해 PI 용액을 세척하기 위해 4.5에 설명된 3개의 세척 단계를 반복합니다.
- 에피플루오레전스 현미경을 사용하여 스페로이드를 이미지화합니다. 스페로이드 코어에서 세포의 생존 가능성을 평가하려면 z-stacks를 사용하여 스페로이드의 다양한 깊이를 가진 이미지를 얻습니다.
참고: 스페로이드 크기에 따라 각 슬라이스 사이에 약 18-35 μm의 스텝 크기를 제공하는 것이 좋습니다. Z-스택은 모든 z-stack을 하나의 최종 그림으로 결합할 수 있는 z-projection 함수를 사용하여 ImageJ에서 처리될 수 있으며, 스페로이드 전체에 걸쳐 염색에 대한 개요를 제공합니다(이를 위해 ImageJ 사용에 대한 추가 지침은 https://imagej.net/Z-functions 참조).
6. 3D 스페로이드 포함
-
스페로이드가 내장된 아가로즈 겔을 준비합니다 (프로토콜을 처음 수행하는 데만 필요).
- ddH2O의 50 mL에 바토아가르 1 g을 섞습니다.
- 바토아가 용해되고 균일 한 젤이 형성 될 때까지 전자 레인지에서 천천히 가열하십시오. 젤이 끓지 않도록 하십시오.
- 60 °C에서 수조에서 바토아가 따뜻하게 유지합니다.
- 실험 사이에 4 °C로 유지하십시오.
-
스페로이드 의 포함.
- 1일째, 각 조건에 대해 1.5mL 튜브에 최소 12개의 스페로이드를 풀링합니다.
- 얼음으로 차가운 1x PBS 1 mL로 한 번 씻으소서.
- 스페로이드를 고치려면 4% 파라포름알데히드 1mL를 추가합니다.
참고: 파라 포름 알데히드의 처리는 연기 후드에서 수행해야합니다. - RT에서 24 시간 동안 배양하십시오.
- 2일째에는 아가로즈 젤을 전자레인지에 물로 채워진 비커에 넣어 조심스럽게 가열합니다. 젤이 끓지 않도록 하십시오! 벤치탑 가열 플레이트에서 사용 후 60°C에서 따뜻하게 유지하십시오.
- 얼음으로 차가운 1x PBS 1 mL로 스페로이드를 두 번 씻으세요.
- 1x PBS의 대부분을 흡인합니다(이 시점에서 약 100 μL을 남기는 것은 스페로이드를 처리하는 데 실용적입니다).
- 더 큰 구멍이 있는 뾰족한 팁을 얻기 위해 경사에서 파이펫 팁을 절단하여 20 μL 파이펫을 준비합니다(그림 참조).
참고: 다음 부분은 최적의 스페로이드 전달을 보장하고 젤 드롭의 응고를 피하기 위해 신속하게 수행해야합니다. 가열 블록을 사용할 수 없는 경우 먼저 스페로이드를 잡은 다음 아가로즈 드롭(즉, 포인트 6.2.9 및 6.2.10의 순서 전환)을 만드는 것이 좋습니다. - 현미경 슬라이드에 아가로즈 젤 드롭을 확인합니다. 아가로스가 굳어지지지지 않도록 슬라이드를 따뜻한 가열 블록에 놓습니다.
- 수정된 파이펫 팁(6.2.8 참조)을 사용하여 15-20 μL의 부피에서 가능한 한 많은 스페로이드를 잡으세요.
- 현미경 슬라이드를 건드리지 않고 15-20 μL 스페로이드를 함유한 1x PBS를 아가로즈 젤 드롭의 중앙에 조심스럽게 주입합니다.
참고: 이것은 약간 어려운 점입니다. 피펫 팁이 젤 드롭에 스페로이드를 주입 할 때 현미경 슬라이드에 닿으면 스페로이드가 손실됩니다. 아가로즈 드롭을 만들고 착색 된 액체를 드롭에 주입하여 스페로이드를 주입하는 전체 과정을 연습하는 것이 좋습니다. 이렇게하면 착색 된 액체가 슬라이드에 새어 나오므로 드롭을 통해 잠재적 인 침투를 시각화 할 수 있습니다. - 아가로즈 겔을 RT 또는 4°C에서 5-10분 동안 배양하여 경화시켜 놓습니다. 젤 드롭이 다소 굳어지면 (그러나 여전히 부드럽습니다), 현미경 슬라이드에서 젤 드롭을 메스가있는 플라스틱 조직 카세트로 조심스럽게 밀어 넣습니다.
- 플라스틱 티슈 카세트를 70% 에탄올로 덮습니다.
참고: 이 시점에서 스페로이드를 직접 사용하거나 몇 달 동안 보관할 수 있습니다. - 아가로오스가 내장된 스페로이드를 파라핀에 넣고, 2-3 μm 두께의 층 슬라이드에 넣고 헤마톡신과 에오신으로 얼룩을 묻거나 면역 조직학적 염색을 받습니다.
결과
도 1A 및 도 1B에도시된 스페로이드 형성 프로토콜에 기초한 스페로이드 성장 분석은 3D 종양에서 항암 약물 치료의 효과를 분석하기 위한 출발점으로 사용되었습니다. 설정을 모방합니다. 스페로이드가 형성되는 용이성은 세포주 특이적이며, 일부 세포주는 일관된 스페로이드22를형성하기 위해 rBM을 보충해야 합니다. 추가된 rBM의 농도는 스페로이드의 형태에 심오하게 영향을 미칠 수 있습니다. 도 1C 및 도 1D에도시된 바와 같이, rBM의 농도가 0~4% 사이를 변화하면 세포 유형 의존적 방식으로 스페로이드의 소형화 및 형태가 변화한다. 그림 1 C는 최대 2.5 % rBM을 첨가하면 SKBr-3 유방암 세포에서 스페로이드 형성을 허용하는 방법을 보여 주며 2.5 % rBM 이상의 농도에서 더 이상 효과가 없습니다. 대조적으로, BxPC3 췌장 덕트 선암 (PDAC) 세포는 상피 형태를 나타내며, 자발적으로 작고 컴팩트한 스페로이드를 형성합니다 (그림1D, 위, 왼쪽 패널). 이 세포 모형에서, rBM 사격량을 1.5% 이상으로 증가시키는 것은 덕트 관 구조물 대형을 연상시키는 돌출및 invaginations를 가진 더 복잡한 구조물에 구형에서 명백한 형태학적 변화를 이끌어 내줍니다. 반대로, 두 개의 다른 PDAC 세포주에 rBM을 첨가하면 중간엽 표현형이 더 많은 MiaPaCa 및 Panc-1이 더 단단해지고 더 컴팩트한 스페로이드를 형성할 수 있습니다(그림1D,중간 및 하부 패널)을 참조하십시오. 이러한 결과는 최적의 스페로이드 형성을 초래하는 rBM의 정확한 양이 각 세포주 및 상태에 대해 적정되어야 함을 보여준다.
항암 약물 치료의 효과를 평가하기 위해서는 약물 치료 시 스페로이드 내의 세포 생존가능성에 대한 정량적 평가가 필요했다. 여기에서 기술된 분석결과는 구형 내의 살아있는 세포에서 풀어 놓인 ATP를 측정하는 luciferin luciferase 기지를 둔 분석입니다. 분석법의 원리는 그림 2A에도시되어 있습니다. 이러한 분석법에서 생성된 발광 신호는 플레이트 리더(도2A)에 의해 용이하게 기록되고 다른 방법23에의해 측정된 생존가능성과 잘 상관된다. 관련 농도 범위에서 ATP 농도와 발광 사이의 선형 관계는 그림 2B에도시된 반면, 그림 2C는 처리된 3D 스페로이드에서 세포 사멸을 평가하는 분석의 능력을 보여줍니다. 항암 치료. 관련 범위에서 분석의 선형성을 더욱 평가하기 위해, 세포 수의 함수로서 발광 신호의 표준 곡선을 확립하는 실험을 수행하였다(도2D 및 도 2E ). 이러한 결과는 분석이 3D 스페로이드 배양에서 세포 생존가능성을 추정하는 데 적합하며 약물 유발 세포 생존력 의 손실을 조사하는 데 적용가능하다는 것을 나타낸다.
치료 기간 동안 2~3일마다 획득되는 가벼운 현미경 이미지의 조합과 세포 생존가능성에 대한 최종 정량적 평가를 통해 스페로이드 성장과 형태학을 면밀히 감독할 수 있으며 최적의 치료법을 평가할 수 있습니다. 복용량. 후자는 도 3A 및 도 3B에서예시되며, 여기서 투여 량-반응 실험은 MDA-MB-231 유방암 스페로이드에서 50% 감소된 세포 생존에 필요한 용량을 결정하기 위해 수행되었다. 스페로이드 형태에 대한 치료 효과는 MDA-MB-231 및 MCF-7 스페로이드에 대한 도 3C 및 도 3D에서 각각 시각화됩니다. 선택한 화학 요법 칵테일로 치료하는 동안 MDA-MB-231 스페로이드의 컴팩트함이 증가하고 타목시펜으로 치료하는 동안 MCF-7 스페로이드는 점점 더 마모되고 고르지 않게됩니다. 두 경우 모두, 세포 생존력의 명확한 하락은 7 (MDA-MB-231) 또는 9 (MCF-7) 치료 일 후에 볼 수 있습니다 (그림3E 및 그림 3F). 이것은 스페로이드 세포 생존력 및 형태학에 대한 치료 매개 효과의 시각적 및 정량적 평가뿐만 아니라 이러한 파라미터가 고도로 세포 및 치료 유형 특이적이라는 것을 모두 입증합니다.
세포 생존 성 분석, PI로 죽은 세포의 염색, 이는 막을 교차 할 수 없습니다 따라서 손상된 막 무결성으로 괴사 또는 늦은 세포에 얼룩, 죽은 세포의 빠른 공간 평가를 허용 포함, 단면화 및 IHC의 시간 소모적인 프로토콜없이 치료에 대한 반응. 도4에 도시된 바와 같이 억제제의 증가 농도에 따라 죽은 세포의 공간 적 배열이, 이 경우, Na+ /H+ 교환기 1 (NHE1) 억제제 5-(N-에틸-N-이소프로필)-아밀로라이드(EIPA) 수 시각화. 볼 수 있듯이, 제어 스페로이드는 제한된 괴사 / 늦은 세포 사멸 코어를 보여, 죽은 세포는 EIPA의 농도가 증가함에 따라 스페로이드에 걸쳐 분포하는 반면.
상이한 처리에 따른 세포자멸 스트레스의 상대적 유도를 정량화하기 위해, 스페로이드를 용해시키고 SDS-PAGE 겔 전기영동 및 전신 및 갈라진 폴리(ADP-ribose) 폴리머라제(PARP)에 대한 서쪽 블로팅을 실시하였다. 대표적인 결과는 그림 4B 및 그림 4C에나와 있습니다. 본 실험에서, 스페로이드는 젖산 양성자 COTransportER MCT4 또는 Na+, HCO3-cotransporter NBCn1을 siRNA를 사용하여 쓰러뜨린 MDA-MB-231 세포로부터 제조되었다. 녹다운은 MCT4 및 NBCn1(미공개 데이터)에 대한 서부 블로팅에 의해 평가되었다. 볼 수 있듯이, MCT4의 녹다운, 하지만 NBCn1의, 강력 하 게 PARP 절단 증가, MDA-MB-231 세포에서 MCT4의 안정적인 녹다운 생체 내에서 종양 성장을 감소 우리의 이전 데모와 일치24.
치료의 효과를 추가로 분석하고 특정 신호, 성장 체포 및 사망 경로 활성화에 대한 정보를 얻기 위해, 스페로이드는 서양 얼룩 분석 이외에 면역 히스토화학 (IHC) 분석을 실시할 수 있습니다. 스페로이드 단면의 IHC 분석은 세포 증식, 세포 주기 및 프로그래밍된 세포 사멸의 특정 항체 또는 마커의 사용을 허용하고, 스페로이드에서 증식 및 세포 사멸 세포의 공간 적 배열의 시각화를 용이하게 한다.
스페로이드의 IHC 분석을 위한 임베징 프로토콜의 개략적 그림은 도 5A에제시되어 있다. 임베디드 스페로이드의 약 3 μm 두께의 마이크로토메 섹션의 대표적인 광 현미경 이미지도 도 5B에도시되어 있으며, 종양 억제단백질 p53에 대해 염색된 스페로이드의 면역형광 영상을 나타내고 있다(핵염색을 이용하여 염색된 핵 DAPI)는 그림5C로 도시됩니다. 세포 증식 마커 Ki-67 또는 p53에 대해 염색된 DMSO 및 화학요법 처리된 스페로이드의 예는 각각 도 5D 및 도 5E에나타내었다. 화학요법 치료의 증식 방지 효과와 일치하여, Ki-67 양성 세포의 수는 화학요법 처리된 스페로이드보다 DMSO 대조군에서 더 크다(도5D). 대조적으로, p53 발현은 세포 스트레스, 세포 자멸 및 성장 체포의 조건 동안 증가하고, 결과적으로, p53 염색 된 세포의 수는 DMSO 대조군과 비교하여 화학 요법 처리 된 스페로이드에서 실질적으로 더 높다 (그림5 E).
이러한 결과는 3D 스페로이드에서 약물 치료 효과에 대한 공간적 해결(PI 염색, IHC) 또는 정량적(western blotting) 정보를 얻을 수 있는 방법의 예를 설명한다.
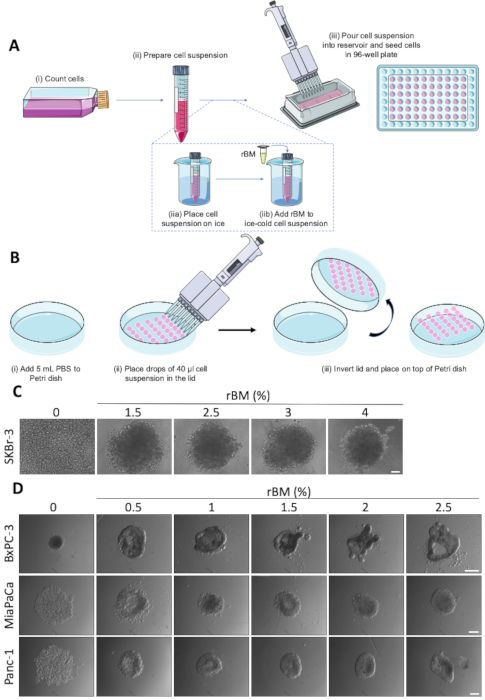
그림 1 : 자발적이고 rBM 매개 스페로이드 형성. (A) rBM을 선택적으로 사용하는 초저 부착 96 웰 라운드 바닥 플레이트를 사용하여 스페로이드 형성의 회로도 표현. (i-iii)로 표시된 개별 단계입니다. (B) 매달려 있는 드롭 방법을 사용하여 스페로이드 형성의 개략적 표현. 개별 단계는 (i-iii)(C) SKBr-3 세포의 rBM 매개 스페로이드 형성의 대표적인 이미지에 의해 표시된다. 세포는 rBM의 농도가 증가하면서 초저 부착 96웰 라운드 바닥 플레이트에 시드하고 9일 동안 성장시켰다. 배율 막대 100 μm.(n=3). (D) 0.5-2.5%에서 rBM의 농도가 있는 초저부착 96웰 라운드 바닥판에서 스페로이드 형성을 위해 시드된 BxPC-3, MiaPaCa 및 Panc-1 세포의 대표적인 이미지. 스페로이드는 4일 동안 재배되었다. 배율 막대 = 250 μm.(n=3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
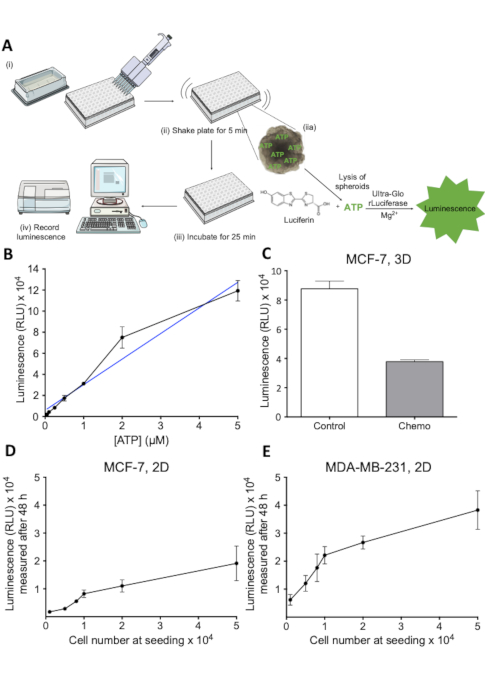
그림 2 : 세포 생존능력 분석의 원리 및 평가. (a) 3D 세포 생존성 분석법의 개략적 표현. (i-iv)로 표시된 개별 단계. (B) ATP 농도의 함수로 발광 신호. ATP의 희석은 각각의 웰에 첨가된 96웰 플레이트 및 세포 생존성 시약을 도금했다. 발광은 405 nm에서 30 분 후에 기록되었다. 1 n.(C) 발광으로 측정된 생존력, 제어 및 화학 요법 처리 MCF-7 스페로이드. MCF-7 세포를 초저 부착 원형 바닥 플레이트에 시드하고 7일 동안 재배하였다. 화학요법 치료(5 μM 시스플라틴, 5 μM 독소루비신 및 30 nM 5-FU)를 2일째및 4일에 적용하였다. 막대는 MCF-7 셀 시드수의 함수로서 SD. 1 n. (D) 발광 신호를 가진 평균 값을 나타낸다. MCF-7 세포를 표시된 세포 수에서 96 웰 플레이트에서 시드하고 48 시간 동안 성장하도록 허용한 후 세포 생존 가능성을 측정했습니다. 오류 막대는 MDA-MB-231 셀에 대해 D에 설명된 대로 SD. 1 n. (E)를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
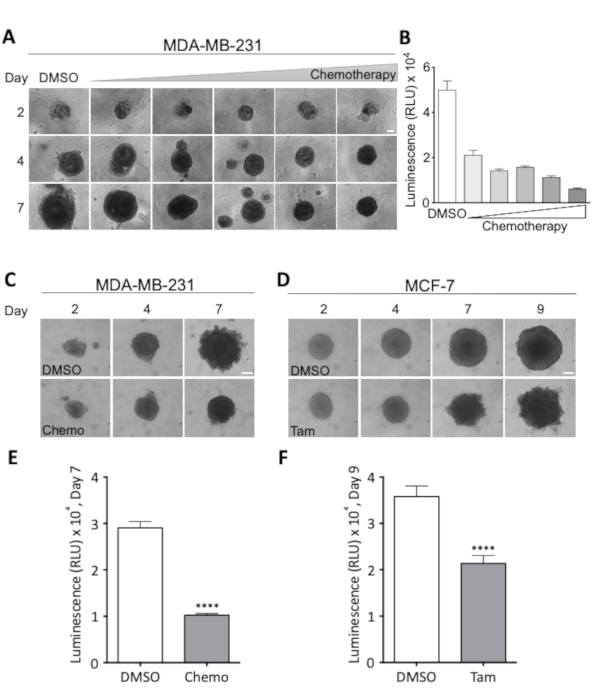
그림 3 : 스페로이드 형태와 세포 생존에 대한 치료 요법의 효과. (A) 2일, 4일, 7일차 MDA-MB-231 스페로이드의 대표적인 이미지. MDA-MB-231 세포는 초저 부착 라운드 바닥 96 웰 플레이트에 시드하였다. 화학 요법의 복용량을 증가시키는 치료는 2 일째에 시작되었으며, 그 때 모든 스페로이드는 비슷한 크기였습니다. 행은 화학 요법의 증가 복용량에서 스페로이드를 보여주고, 열은 표시된 복용량에서 2, 4 및 7일째에 크기의 스페로이드를 나타냅니다. 가장 낮은 투여량은 18.75 nM 시스플라틴, 18.75 nM 독소루비신, 0.0625 nM 5-FLUOROURacil (5-FU)이었고, 이 투여량은 표시된 각 이미지에 대해 두 배로 증가하여 0.3 μM 시스플라틴, 0.3 μM 독소루비신 및 2nM 5-FU의 최대 투여량을 초래하였다. 배율 막대 = 100 μm. (2 n). (B) MDA-MB-231 스페로이드의 생존력, 발광으로 측정, 화학 요법 치료의 7 일 후. 막대는 2일째, 4일, 7일 및 MCF-7 스페로이드 9의 경우MDA-MB-231 (C) 및 MCF-7 스페로이드(D)의 대표 이미지와 함께 평균 값을 나타냅니다. 세포는 (A)로 시드하고 화학요법(Chemo, 18.75 nM Cisplatin, 18.75 nM Doxorubicin, 0.0625 nM 5-FU)을 2일째 및 4일(C) 또는 2일째, 4일 및 7일째에 2 μM 타목시펜(Tam)으로 처리하였다. 배율 막대 = 각각 100 μm.(4 n 및 3 n). (E,F) 발광으로 측정된 생존력은 각각 7일째와9일째(C) 및 (D)에 대해 측정된다. 조건 간의 통계적으로 유의한 차이를 테스트하기 위해 짝을 이루지 않은 학생의 t-검정이 수행되었습니다. p < 0.0001을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 프로피듐 요오드 염색 및 스페로이드의 서쪽 얼룩 분석. (A) 9일 치료 후 PI 염색 MCF-7 스페로이드의 대표적인 이미지. MCF-7 세포를 9일 동안 재배한 초저부착 96웰 플레이트에서 시드하고 2일째, 4일 및 7일째에 EIPA의 농도가 증가하여 처리하였다. 9일째에, 스페로이드는 PI로 염색되었고, 이미지는 에피오레시크 현미경으로 획득되었다. 배율 막대 = 200 μm. (1 n.) (B) MDA-MB-231 세포의 대표적인 서쪽 얼룩은 산 염기 수송기의 녹아웃 /녹다운 후. NHE1은 MDA-MB-231 세포 12에서 CRISPR/Cas9에 의해 기절되었고, 세포는 MCT4 또는 NBCn1에 대하여 siRNA로 과도하게 형질감염되었고, 항체를 사용하여 용해되고 서쪽 블로팅을 행하기 전에 9 일 동안 스페로이드로 성장하였다. (c)PARP를 인식하고 있습니다. (C) cPARP 대 PARP 단백질 레벨의 비율을 정량화하고, 로딩 제어(β-액틴)로 정규화하였다. (1 n). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
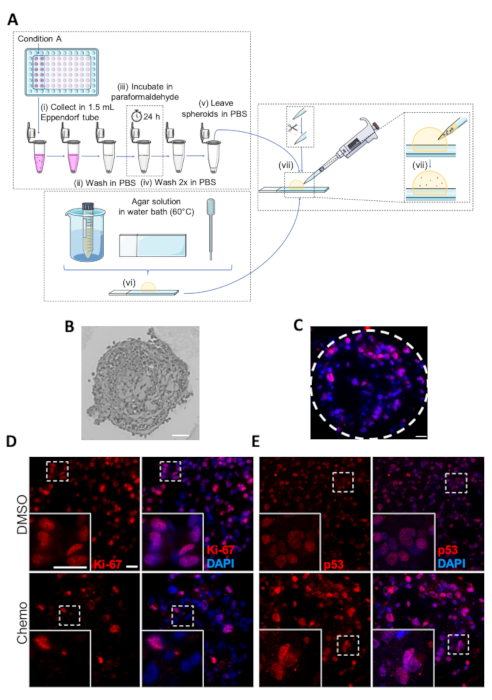
그림 5 : 스페로이드의 고정, 임베딩 및 면역화학 분석. (A) 스페로이드의 포함을 위한 프로토콜의 개략적 표현. 개별 단계는 (i-vii)로 표시됩니다. (B) 내장 MDA-MB-231 스페로이드의 이미지. 스케일 바: 50 μm. (C) p-53에 대하여 항체를 가진 IHC 분석을 행한 화학요법 처리된 MDA-MB-231 스페로이드의 대표적인 영상. 파선은 스페로이드의 둘레를 표시합니다. 스케일 바 = 20 μm.(D,E)DMSO- 또는 화학요법 처리(상부 및 하부 패널) MDA-MB-231 스페로이드의 대표적인 이미지. MDA-MB-231 세포를 초저 부착 96웰 플레이트에 시드하고, 7일 동안 재배하고 2일째와 4일째에 화학요법으로 처리하였다. 7일째에, 스페로이드를 IHC에 의해 Ki-67(D) 및 p53(E)에 대하여1차 항체를 가진 분석에 의해 삽입되었다. 흰색 상자는 확대/축소 이미지를 나타냅니다. 배율 막대 = 두 배율에서 20 μm,(n=3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
3D 암 세포 스페로이드의 사용은 항암제 스크리닝뿐만 아니라 종양을 모방한 조건하에서 암세포 사멸 및 생존가능성에 대한 기계적 통찰력을 얻기 위한 귀중하고 다양한 도구임이 입증되었습니다. 미세 환경. 이것은 화학요법 약의 접근성, 세포 장악 및 세포내 효력이 pH, 산소 긴장, tortuosity 및 물리적 인 및 종양에 있는 physico 화학 조건에 의해 심오하게 영향을 미치기 때문에 특히 중요합니다 화학 세포 세포상호 작용 9,17. 예를 들어, 많은 고형 종양25,26,27,28,29에서6-6.5의 낮은 값에 도달 할 수있는 세포 외 pH의 산도는 약한 기본 화학 요법을 일으킵니다. 독소루비신, 미톡산트론 및 zwitterion 파클리탁셀과 같은 화합물이 충전됩니다. 이는 종양 세포내의 그들의 섭취량을 감소시키고 p-당단백질30,31,32와같은 다중 약물 내성 단백질의 활성에 영향을 미칠 수 있다. 또한 대부분의 화학요법 화합물의 효과에 중추적인 세포 증식은 일반적으로 2D 조건에 비해 3D로 감소되므로 2D 세포 배양에 비해 종양스페로이드에서 모방할 가능성이 더 우수합니다 8,33 ,34. 마지막으로, 조밀한 종양 미세 환경은 세포 성장, 생존 및 죽음을 조절하는 세포 내 신호 경로를 지시하는 수많은 물리적 및 수용성 신호 신호신호의 기원이다. 따라서, 약물 효능을 분석할 때, 3D 배양 시스템은 생체 내 모델에 착수하기 전에 중추적인 단계이다. 그러나 3D 문화어의 주요 단점은 2D 문화어에 비해 분석의 복잡성이 증가한다는 것입니다. 우리는 다양한 암 세포 유형을 사용하여 스페로이드 형성을 위한 간단하고 상대적으로 저렴한 기술을 여기에 기술했습니다. 우리는 스페로이드 형성이 연구된 각 세포 모형을 위해 어떻게 최적화되어야 하는지의 보기를 보여주고 그 같은 spheroids에 있는 세포 생존성, 세포 죽음 및 관련 신호 통로에 정량적인 데이터를 얻는 방법을 기술했습니다. 여기에 설명된 세 가지 모델 사이에는 명백한 성장 또는 형태학적 차이가 없습니다. 우리의 손에, 형태에 있는 변이는 매달려 놓기 방법을 사용하여 약간 더 중대할지도 모르지만, 이 방법의 이점은 rBM이 필요하지 않다는 것입니다. 우리는 단 하나 암 세포 모형에서 생성된 스페로이드에 여기에서 집중했습니다. 스페로이드 모델은, 그러나, 또한 섬유아세포, 단핵구/대식세포, 내피 세포 및/또는 지방세포35,36,37을가진 암세포의 예를 들어, 공동 배양할 수 있다. 이 모델의 다른 고급 응용 분야는 3D 인쇄 유체 장치와의 조합을 포함하여 반투과성 멤브레인을 통해 투약할 수 있도록 하고 정량적 프로테오믹 프로파일링38을수확합니다.
위에서 언급한 바와 같이, 3D 스페로이드에서 자란 세포의 표현형은 일반적으로 2D에서 성장한 세포보다 생체 내 종양의 표현형을 훨씬 더 잘 모방하지만, 그러한 스페로이드가 실제로 생체 내 종양의 관련 모델이 되는 정도는 수많은 에 의존한다. 신중하게 평가해야 합니다. 이러한 스페로이드가 생체 내 상태를 얼마나 잘 모방하는지에 영향을 미치는 파라미터는 종양및 그의 상대적인 ECM 조성물의 세포 조성을 포함한다. 예를 들면, 우리가 여기에서 제공한 프로토콜에 있는 ECM로 채택한 rBM은 상피암의 초기 단계를 모방하기 위한 좋은 선택입니다, 지하실 막을 위반하는 시간의 주위에, 그밖 ECM 조성물은 특정 종양을 위해 더 관련성이 있을 것입니다 유형 및 -단계입니다. 더욱이, 세포-세포 접착을 위한 용량은 카데린 및 인테그린22와같은 세포 세포 및 세포 매트릭스 접착 단백질의 그들의 발현에 따라서 암 세포주 사이에서 넓게 다릅니다.
여기에 설명된 바와 같이, 스페로이드 성장 및 형태학은 저배율 광학 및 넓은 시야를 가진 가벼운 현미경을 사용하여 2-3일마다 쉽고 비침습적으로 모니터링될 수 있다. 그러나 화학요법 치료와 같은 세포 독성 스트레스는 스페로이드 형태에 매우 다르게 영향을 미치기 때문에 세포 유형 및 치료 방식에 따라 형태와 둘레에만 의존하는 것만으로는 충분하지 않습니다. 치료 효과. 예를 들면, spheroids는 처리와 신흥 세포 죽음으로 느슨해질 수 있고, 표면이 검출가능하게 영향을 받지 않는 동안, 괴사 코어에서 모든 죽음이 생길 수 있습니다. 두 경우 모두, 그 결과는 치료에 의해 스페로이드 내의 살아있는 세포의 수가 감소되지 않는다는 잘못된 인상일 수 있다. 따라서 정량및 전체 스페로이드 기술은 치료 효과를 평가하는 데 필수적입니다. 세포 사멸의 정량적 평가를 위해, 이름에서 알 수 있듯이 시토솔산 인산인산의 활성을 측정하는 산인산 분석법(21)이 채용되었다. 그러나, 우리의 손에, 이 분석제는 일반적으로 씨드 세포의 수를 잘 반영하는 반면, 산 인산 염이 세포 사멸 후 얼마 동안 활성 상태로 남아 있기 때문에 신속한 치료 유발 세포 사멸(데이터가 표시되지 않음)을 적절히 포착하지 못한다. 또한,이 분석매체의 완전한 제거가 필요하며, 이는 특히 깨지기 쉬운 화학 요법 처리 된 스페로이드에 대한 오류를 증가시킵니다. 여기에서 기술한 세포 생존성 분석, 이는 세포 ATP 함량을 기초로 하고, 그것의 간단하고 시간 효율적인 프로토콜 및 높은 재현성에 근거하여 선택되었다. 더욱이, 이 분석법은 스페로이드로 작업할 때 장점이 되는 배양 배지의 완전한 제거를 필요로 하지 않는다. 대표적인 결과에 나타난 바와 같이, 이 분석은 세포 수와 예상되는 화학요법 치료 효과를 모두 잘 포착한다. 그러나, 이 기술의 함정은, 명백하게, 세포내 ATP 내용을 감소시키는 신진 대사 변경이 잘못 더 낮은 세포 수로 기록될 수 있다는 것입니다. 따라서 스페로이드 부피와 형태 또는 PI 염색의 병렬 평가는 결과를 검증하는 것이 좋습니다.
스페로이드 용해 와 서양 블로팅 뒤에 신호 프로세스, 세포 죽음, 성장 및 생존 경로의 상태에 반 정량적 통찰력을 제공 할 수 있습니다. rBM이 스페로이드를 준비하는 데 사용될 때 서쪽 블로팅의 사용은 복잡하며, 이는 용해 단백질 함량의 실질적인 분획을 포함하기 때문에, 더 중요한 것은 세포 함량감소와 함께 분수 기여도가 증가할 것이기 때문이다. 화학 요법 세포 사멸 중. 원심분리에 의해 rBM을 제거하는 것이 원칙적으로 가능하다; 그러나 모든 rBM을 완전히 제거하기가 어렵기 때문에 이는 중요한 단계이며 조건 간의 정량적 비교를 배제합니다. 이러한 스페로이드의 경우, 일반적으로 사망 경로 및 관련 신호 매개 변수의 공간적으로 해결된 평가를 위해 포함 및 IHC는 강력한 도구입니다. 다른 접근법은 고려될 수 있다: (상대적으로 작은) 온전한스페로이드(39)의 살아있는 공초점 영상. 스페로이드의 또 다른 흥미로운 속성은 자신의 다소 일반 "공"모양을 주어진, 그들은 위에서 언급 한의 중요성의 이해를 높이기 위해, 수학적 모델링과 습식 실험실 실험 사이의 반복에 잘 빌려준다는 것입니다 산소, pH 및 스페로이드 내의 영양소의 구배, 그리고, 외삽에 의해, 종양40,41. 따라서, 훨씬 더 큰 복잡성의 중요한 3D 종양 모델이 등장하고 있지만, 복잡한 생물학적뿐만 아니라 불활성 스캐폴드에 기초한 다양한 오르노티픽 및 오르가노이드배양, 그리고 적어도 환자 유래 이종이식(42)을 포함한다. 스페로이드는 2D 배양에 비해 생물학적 관련성이 우수하고 취급의 상대적 용이성과 결합되어 중요한 도구로 남아 있습니다.
요약하자면, 우리는 3D 배양에서 암세포 생존력과 사망에 대한 항암 치료 유발 변화를 분석하기 위한 일련의 간단한 방법을 제시합니다. 스페로이드의 조성은 고용된 세포의 특성과 생물학에 따라 변형될 수 있으며, 제시된 정량적 및 정성적 분석은 투여량-반응 관계를 평가하고 에 대한 통찰력을 얻는 데 모두 유용합니다. 신호 및 사망 경로관련.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
우리는 우수한 기술 지원을 위한 캐서린 프랭클린 마크와 아네트 바텔스와 그림 1D에서 실험을 수행에 대한 Asbjørn Nøhr-닐슨에 감사드립니다. 이 작품은 에이나르 윌럼슨 재단, 노보 노디스크 재단, 주훔 재단(모두 SFP)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-(4-amidinophenyl)-1H-indole-6-carboxamidine (DAPI) | Invitrogen | # C10595 | For staining nuclei |
| 5-Fluorouracil (5-FU) | Sigma-Aldrich | #F6627 | Component in chemotherapeutic treatment |
| 5-(N-ethyl-isopropyl) amiloride (EIPA) | Life Technologies | #E3111 | Inhibitor of NHE1 |
| Antibody against PARP and cPARP | Cell signaling | #9542 | Used in western blotting |
| Antibody against Ki-67 | Cell signaling | #9449 | Used for IHC |
| Antibody against p53 | Cell Signaling | #2524 | Used for IHC |
| Antibody against β-actin | Sigma | A5441 | Used in western blotting |
| Bactoagar | BD Bioscience | #214010 | Used for agarose gel preparation |
| Benchmark protein ladder | Invitrogen | #10747-012 | Used for SDS-PAGE |
| Bio-Rad DC Protein Assay kit | Bio-Rad Laboratories | #500-0113, #500-0114, #500-0115 | Used for protein determination from lysates |
| Bürker chamber | Marienfeld | 610311 | For cell counting |
| BX63 epifluoresence microscope | Olympus | Used for fluorescent imaging | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | #G9681 | Used for the cell viability assay |
| Cisplatin | Sigma-Aldrich | #P4394 | Component in chemotherapeutic treatment |
| Corning Spheroid Microplate, 96 well, Black with clear round bottom, Ultra-low attachment, With lid, Sterile | Corning | #4520 | Used for growing spheroids with luminescence measurements as end point |
| Corning 96 well, clear round bottom, Ultra-low attachment microplate, With lid, Sterile | Corning | #7007 | Sufficient for spheroid growth without luminescence measurements as end point |
| Criterion TGX Precast Gels | Bio-Rad | 5671025 | Used for SDS-PAGE |
| Doxorubicin | Abcam | #120629 | Component in chemotherapeutic treatment |
| FLUOStar Optima Microplate reader | BMG Labtech | Used for recording luminescence | |
| Formaldehyde | VWR Chemicals | #9713.1000 | Used for cell fixation |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Gibco | #A1413202 | Keep at 4 °C to prevent solidification. Referred to as rBM in the protocol. |
| Heat-inactivated FBS | Sigma | #F9665 | Serum for growth media |
| ImageJ | NIH | Scientific Image analysis | |
| Medim Uni-safe casette | Medim Histotechnologie | 10-0114 | Used for storage of embedded spheroids |
| Mini protease inhibitor cocktail tablets | Roche Diagnostics GmBH | # 11836153001 | Used for lysis buffer preparation |
| MZ16 microscope | Leica | Used for light microscopic images | |
| NuPAGE LDS 4x Sample Buffer | Invitrogen | #NP0007 | Used for western blotting |
| Pierce ECL Western blotting substrate | Thermo scientific | #32106 | Used for western blotting |
| Ponceau S | Sigma-Aldrich | #P7170-1L | Used for protein band staining |
| Prism 6.0 | Graphpad | Scientific graphing and statistical software | |
| Propidium iodide (1mg/ml solution in water) | Invitrogen | P3566 | Light sensitive |
| Sterile reservoirs, multichannel | SPL lifesciences | 21002 | Used for seeding cells for spheroid formation |
| Superfrost Ultra-Plus Adhesion slide | Menzel-Gläser | #J3800AMNZ | Microscope glass slide used for embedding |
| Tamoxifen | Sigma-Aldrich | #T5648 | Used as chemotherapeutic treatment |
| Trans-blot Turbo 0.2 µm nitrocellulose membranes | Bio-Rad | #170-4159 | Used for western blotting |
| Tris/Glycine/SDS running buffer | Bio-Rad | #161 0732 | Used for SDS-PAGE |
| Trypsin-EDTA solution | Sigma | #T4174 | Cell dissociation enzyme |
참고문헌
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W., Freyer, J. P., Sutherland, R. M. Influence of glucose and oxygen supply conditions on the oxygenation of multicellular spheroids. British Journal of Cancer. 53 (3), 345-353 (1986).
- Gaedtke, L., Thoenes, L., Culmsee, C., Mayer, B., Wagner, E. Proteomic analysis reveals differences in protein expression in spheroid versus monolayer cultures of low-passage colon carcinoma cells. Journal of Proteome Research. 6 (11), 4111-4118 (2007).
- Chen, J. L., et al. The genomic analysis of lactic acidosis and acidosis response in human cancers. PLoS Genetics. 4 (12), 1000293 (2008).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Gudjonsson, T., Ronnov-Jessen, L., Villadsen, R., Bissell, M. J., Petersen, O. W. To create the correct microenvironment: three-dimensional heterotypic collagen assays for human breast epithelial morphogenesis and neoplasia. Methods. 30 (3), 247-255 (2003).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews in Molecular and Cell Biology. 8 (10), 839-845 (2007).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: an underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jacobi, N., et al. Organotypic three-dimensional cancer cell cultures mirror drug responses in vivo: lessons learned from the inhibition of EGFR signaling. Oncotarget. 8 (64), 107423-107440 (2017).
- Rodriguez-Enriquez, S., et al. Energy metabolism transition in multi-cellular human tumor spheroids. Journal of Cell Physiology. 216 (1), 189-197 (2008).
- Kunz-Schughart, L. A. Multicellular tumor spheroids: intermediates between monolayer culture and in vivo tumor. Cell Biology International. 23 (3), 157-161 (1999).
- Andersen, A. P., et al. Roles of acid-extruding ion transporters in regulation of breast cancer cell growth in a 3-dimensional microenvironment. Molecular Cancer. 15 (1), 45 (2016).
- Swietach, P., Patiar, S., Supuran, C. T., Harris, A. L., Vaughan-Jones, R. D. The role of carbonic anhydrase 9 in regulating extracellular and intracellular ph in three-dimensional tumor cell growths. Journal of Biological Chemistry. 284 (30), 20299-20310 (2009).
- Walenta, S., Doetsch, J., Mueller-Klieser, W., Kunz-Schughart, L. A. Metabolic imaging in multicellular spheroids of oncogene-transfected fibroblasts. Journal of Histochemistry and Cytochemistry. 48 (4), 509-522 (2000).
- Kunz-Schughart, L. A., Groebe, K., Mueller-Klieser, W. Three-dimensional cell culture induces novel proliferative and metabolic alterations associated with oncogenic transformation. International Journal of Cancer. 66 (4), 578-586 (1996).
- Feng, H., et al. Homogeneous pancreatic cancer spheroids mimic growth pattern of circulating tumor cell clusters and macrometastases: displaying heterogeneity and crater-like structure on inner layer. Journal of Cancer Research and Clinical Oncology. 143 (9), 1771-1786 (2017).
- Santini, M. T., Rainaldi, G., Indovina, P. L. Apoptosis, cell adhesion and the extracellular matrix in the three-dimensional growth of multicellular tumor spheroids. Critical Reviews in Oncology/Hematology. 36 (2-3), 75-87 (2000).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Wong, C., Vosburgh, E., Levine, A. J., Cong, L., Xu, E. Y. Human neuroendocrine tumor cell lines as a three-dimensional model for the study of human neuroendocrine tumor therapy. Journal of Visual Experiments. (66), e4218 (2012).
- Friedrich, J., et al. A reliable tool to determine cell viability in complex 3-d culture: the acid phosphatase assay. Journal of Biomolecular Screening. 12 (7), 925-937 (2007).
- Ivascu, A., Kubbies, M. Diversity of cell-mediated adhesions in breast cancer spheroids. International Journal of Oncology. 31 (6), 1403-1413 (2007).
- Crouch, S. P., Kozlowski, R., Slater, K. J., Fletcher, J. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. Journal of Immunological Methods. 160 (1), 81-88 (1993).
- Andersen, A. P., et al. The net acid extruders NHE1, NBCn1 and MCT4 promote mammary tumor growth through distinct but overlapping mechanisms. International Journal of Cancer. , (2018).
- Vaupel, P. Tumor microenvironmental physiology and its implications for radiation oncology. Seminars in Radiation Oncology. 14 (3), 198-206 (2004).
- Vaupel, P. W., Frinak, S., Bicher, H. I. Heterogeneous oxygen partial pressure and pH distribution in C3H mouse mammary adenocarcinoma. Cancer Research. 41 (5), 2008-2013 (1981).
- Helmlinger, G., Yuan, F., Dellian, M., Jain, R. K. Interstitial pH and pO2 gradients in solid tumors in vivo: high-resolution measurements reveal a lack of correlation. Nature Medicine. 3 (2), 177-182 (1997).
- Zhang, X., Lin, Y., Gillies, R. J. Tumor pH and its measurement. Journal of Nuclear Medicine. 51 (8), 1167-1170 (2010).
- Gillies, R. J., Raghunand, N., Karczmar, G. S., Bhujwalla, Z. M. MRI of the tumor microenvironment. Journal of Magnetic Resonance Imaging. 16 (4), 430-450 (2002).
- Vukovic, V., Tannock, I. F. Influence of low pH on cytotoxicity of paclitaxel, mitoxantrone and topotecan. British Journal of Cancer. 75 (8), 1167-1172 (1997).
- Song, C. W., Griffin, R., Park, H. J., Teicher, B. A. . Cancer Drug Resistance. , 21-42 (2006).
- Lotz, C., et al. Role of the tumor microenvironment in the activity and expression of the p-glycoprotein in human colon carcinoma cells. Oncology Reports. 17 (1), 239-244 (2007).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today: Technologies. 23, 27-36 (2017).
- Stratmann, A. T., et al. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Molecular Oncology. 8 (2), 351-365 (2014).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLoS One. 12 (7), 0182039 (2017).
- Bochet, L., et al. Adipocyte-derived fibroblasts promote tumor progression and contribute to the desmoplastic reaction in breast cancer. Cancer Research. 73 (18), 5657-5668 (2013).
- Amann, A., et al. Development of a 3D angiogenesis model to study tumour - endothelial cell interactions and the effects of anti-angiogenic drugs. Scientific Reports. 7 (1), 2963 (2017).
- LaBonia, G. J., Ludwig, K. R., Mousseau, C. B., Hummon, A. B. iTRAQ Quantitative Proteomic Profiling and MALDI-MSI of Colon Cancer Spheroids Treated with Combination Chemotherapies in a 3D Printed Fluidic Device. Analytical Chemistry. 90 (2), 1423-1430 (2018).
- Hulikova, A., Vaughan-Jones, R. D., Swietach, P. Dual role of CO2/HCO3(-) formula buffer in the regulation of intracellular pH of three-dimensional tumor growths. Journal of Biological Chemistry. 286 (16), 13815-13826 (2011).
- Wallace, D. I., Guo, X. Properties of tumor spheroid growth exhibited by simple mathematical models. Frontiers in Oncology. 3, 51 (2013).
- Michel, T., et al. Mathematical modeling of the proliferation gradient in multicellular tumor spheroids. Journal of Theoretical Biology. 458, 133-147 (2018).
- Meijer, T. G., Naipal, K. A., Jager, A., van Gent, D. C. Ex vivo tumor culture systems for functional drug testing and therapy response prediction. Future Science OA. 3 (2), (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유