Method Article
Identificando os produtores de aminoácidos com marcadores ricos em Codon raros
Neste Artigo
Resumo
Este estudo apresenta uma estratégia alternativa para o método convencional de base analógica tóxica na identificação de superprodutores de aminoácidos usando marcadores raros-Codon-ricos para alcançar precisão, sensibilidade e alta taxa de transferência simultaneamente.
Resumo
Para satisfazer o mercado cada vez maior de aminoácidos, são necessárias cepas de produção de alto desempenho. Os produtores de aminoácidos são identificados convencionalmente, aproveitando as competições entre os aminoácidos e seus análogos. Entretanto, este método analógico-baseado é da baixa exatidão, e os análogos apropriados para ácidos aminados específicos são limitados. Aqui, apresentamos uma estratégia alternativa que possibilita uma triagem precisa, sensível e de alta produtividade de produtores de aminoácidos que usam marcadores raros e ricos em Codon. Esta estratégia é inspirada pelo fenômeno do viés de uso de Codon na tradução de proteínas, para o qual os códons são categorizados em comum ou raros com base em suas freqüências de ocorrência no DNA de codificação. A tradução de raros códons depende de suas RNAs de transferência raras correspondentes (tRNAs), que não podem ser totalmente carregadas pelos aminoácidos cognatos a fome. Teoricamente, os raros tRNAs podem ser cobrados se houver um excedente dos aminoácidos após o carregamento dos isoaceptores comuns sinônimos. Conseqüentemente, as traduções causadas por códons raros podiam ser restauradas alimentando ou superproduçoes intracelular dos aminoácidos correspondentes. esta suposição, um sistema de seleção ou triagem para a identificação de superprodutores de aminoácidos é estabelecido através da substituição dos códons comuns dos aminoácidos alvo com suas alternativas raras sinônimos nos genes de resistência a antibióticos ou os genes codificando proteínas fluorescentes ou cromogênicas. Nós mostramos que as expressões da proteína podem extremamente ser impedidas pela incorporação de códons raros e que os níveis de proteínas correlacionam positivamente com as concentrações do ácido aminado. Usando este sistema, superprodutores de múltiplos aminoácidos podem ser prontamente selecionados a partir de bibliotecas de mutação. Esta estratégia rara-baseada em Codon exige somente um único gene modificado, e o anfitrião é menos provável escapar da seleção do que em outros métodos. Ele oferece uma abordagem alternativa para a obtenção de superprodutores de aminoácidos.
Introdução
A produção atual de aminoácidos depende muito da fermentação. No entanto, os títulos e rendimentos para a maioria das cepas de produção de aminoácidos estão abaixo das demandas crescentes do mercado global de aminoácidos que vale bilhões de dólares1,2. A obtenção de superprodutores de aminoácidos de alto desempenho é fundamental para a atualização da indústria de aminoácidos.
Estratégia tradicional para identificar produtores de aminoácidos explora as competições entre os aminoácidos e seus análogos na síntese protéica3,4. Estes análogos são capazes de carregar os tRNAs que reconhecem os aminoácidos correspondentes e, assim, inibir os alongamentos das cadeias peptídicas, levando ao crescimento preso ou morte celular5. Uma maneira de resistir às tensões analógicas é aumentar as concentrações de aminoácidos intracelulares. Os aminoácidos enriquecidos irão superar os análogos para os tRNAs finitos e garantir a correta síntese de proteínas funcionais. Conseqüentemente, as tensões que sobrevivem aos análogos podem ser selecionadas e são prováveis os overprodutores dos aminoácidos correspondentes.
Embora tenha sido bem sucedido na seleção de superprodutores de aminoácidos como L-leucina6, a estratégia baseada em analógico sofre de inconvenientes graves. Uma grande preocupação é a resistência analógica originada do processo de mutagenese ou através de mutações espontâneas. As cepas com resistência podem escapar da seleção bloqueando, exportando ou degradando os análogos5. Outra preocupação é os efeitos colaterais tóxicos dos análogos em outros processos celulares7. Como consequência, as cepas que sobrevivem à seleção analógica podem não ser os superprodutores de aminoácidos, enquanto os superprodutores desejados podem ser falsamente exterminados devido aos efeitos colaterais negativos.
Aqui, uma nova estratégia baseada na lei do viés de Codon é apresentada a fim de obter identificações precisas e rápidas de produtores de aminoácidos. A maioria de ácidos aminados são codificados por mais de um Triplet do nucleotide que seja favorecido diferentemente pelos organismos do anfitrião8,9. Alguns códons raramente são usados nas sequências de codificação e são referidos como os raros códons. Suas traduções em aminoácidos dependem dos tRNAs cognatos que carregam os aminoácidos correspondentes. Entretanto, os tRNAs que reconhecem os códons raros têm geralmente muito mais baixas abundâncias do que os tRNAs dos códons comuns10,11. Conseqüentemente, estes tRNAs raros são menos prováveis capturar os ácidos aminados livres nas competições com outros isoacceptors, e as traduções das seqüências raro-Codon-ricas começam a desacelerar ou mesmo são terminadas quando as quantidades de ácidos aminados são limitadas 10. as traduções poderiam, teoricamente, ser restauradas se houver um excedente de aminoácidos após o carregamento dos sinónimo comuns de tRNAs devido a superproduções ou a alimentações extras dos aminoácidos correspondentes12. Se o gene raro-Codon-rico codifica um marcador de seleção ou de triagem, as cepas que exibem os fenótipos correspondentes podem ser prontamente identificadas e são prováveis os superprodutores dos aminoácidos alvo.
A estratégia acima é aplicada para estabelecer uma seleção e um sistema de triagem para a identificação de superprodutores de aminoácidos. O sistema de seleção usa genes de resistência a antibióticos (por exemplo, KanR) como marcadores enquanto o sistema de triagem usa os genes que codificam as proteínas fluorescentes (por exemplo, proteína verde fluorescente [GFP]) ou cromogênica (por exemplo, prancerpurple). Os genes do marcador em ambos os sistemas são modificados substituindo números definidos dos códons comuns para o aminoácido alvejado com sua alternativa rara sinônimo. As tensões na biblioteca da mutação que abrigam o gene raro-Codon-rico do marcador são selecionadas ou examinadas circunstâncias apropriadas, e os overprodutores dos aminoácidos alvejados podem prontamente ser identificados. O fluxo de trabalho começa com a construção do raro-Codon-rico sistema de genes marcador, seguido pela otimização das condições de trabalho, e, em seguida, a identificação e verificação do aminoácido superprodutores. Esta estratégia analógico-independente é baseada no dogma na tradução da proteína e foi verificada praticamente para permitir identificações exatas e rápidas de overprodutores do ácido aminado. Teoricamente, poderia ser diretamente empregado para aminoácidos com códons raros e para todos os microrganismos. Ao todo, a estratégia rara-baseada em Codon servirá como uma alternativa eficiente à abordagem analógica convencional, quando análogos adequados para aminoácidos específicos não estão disponíveis, ou quando uma alta taxa de falsos positivos é a maior preocupação. O protocolo abaixo usa o Codon raro da leucina para demonstrar esta estratégia em identificar os superprodutores de Escherichia coli L-leucina.
Protocolo
1. construção dos plasmís expressando os genes raros-Codon-ricos do marcador
- Selecione um gene de marcador que contenha um número apropriado de códons comuns para o aminoácido alvo.
Nota: para a L-leucina, o gene de resistência à kanamicina KanR, que contém 29 códons de leucina, dos quais 27 são códons comuns, é utilizado para a construção do sistema de seleção13. O gene GFP , que contém 17 códons comuns de 19 códons de leucina, ou o gene prancerpurple (PPG), que abriga 14 codões comuns de leucina, é utilizado para o sistema de triagem (tabela complementar 1 ). - Substitua os códons comuns nos genes do marcador com o Codon raro do sinônimo. Para L-leucina, substitua seus códons em Kanr, GFP, ou PPG com o Codon CTA raro, gerando Kanr-RCS, GFP-RCou PPG-RC, respectivamente13 ( Tabela complementar 1).
Nota: a frequência do Codon raro nos genes do marcador afetará a rigor da seleção ou do sistema de triagem. Em geral, aumentar o número de códons raros aumentará a stringência do sistema de seleção ou triagem. Para alcançar a seleção adequada ou a força de triagem, projetar uma série de genes marcador que abrigam diferentes números de códons raros e comparar seus efeitos. - Gere blocos de construção dos genes marcadores raros-Codon-ricos usando ferramentas tais como GeneDesign14 (http://54.235.254.95/gd/) para a síntese do gene. Alternativamente, ordem os genes do marcador dos serviços comerciais da síntese de Gene.
- Na página GeneDesign, escolha design do bloco de construção (sobreposição de comprimento constante).
- Cole as sequências dos genes de marcadores raros-Codon-ricos na caixa de sequência .
- Definir o comprimento de sobreposição entre os oligos de montagem; tenha em mente que o padrão 40 BP funciona bem para a maioria das seqüências.
Nota: consulte o manual online para obter mais instruções sobre as definições dos outros parâmetros. - Clique no botão criar blocos de construção e encomende os oligonucleotídeos listados na página.
- Sintetizar os genes raros-Codon-modificados pela reacção em cadeia da polimerase (PCR)-baseou a síntese exata15.
- Ligate o raro-Codon-rico KanR-RC para Vector pET-28A, GFP-RC para pSB1C3, e ppg-RC para CPB-37-44116.
Nota: os mapas plasmídeo pET-28A e pSB1C3 estão disponíveis na base de dados de plasmídeo online da SnapGene (tabela complementar 1); o mapa plasmídeo CPB-37-441 está disponível no site da proteína cromogênica do ATUM.- No gelo, adicione o vetor e os fragmentos do marcador em uma relação molar de 1:1 a 7,5 μL de mistura de montagem (ver tabela de materiais) a um volume total de 10 μL. Incubar a amostra a 50 ° c por 1 h.
- Transforme 5 μL do produto de montagem em 50 μL de células competentes (ver a tabela de materiais) a 42 ° c por 30 s.
- Recupere as células em meio SOC (caldo super ótimo com repressão de Católica) a 37 ° c por 1 h, coloque-as em meio de agar lb (caldo de lisogenia) e incubar-as a 37 ° c durante a noite.
- Inocular a colônia em meio LB e incubar a 37 ° c por 8 h.
- Isole o plasmídeo usando um kit comercial preferencial.
2. otimizando as condições de seleção
- Faça a tensão do pai usada para a mutagenese em pilhas competentes17.
- Transformar 50 μL das células competentes com 1 μL de plasmídeo que transporta o Wild-Type Kanr, e transformar outro conjunto de células competentes com o plasmídeo contendo Kanr-RC29 com todo o Codon de leucina substituído pela rara Codon CTA.
- Adicionar 950 μL de meio SOC e incubar a amostra num agitador a 250 rpm a 37 ° c durante 1 h.
- Placa 100 μL da cultura celular para o meio de agar LB contendo 50 μg · mL-1 de canamicina, e incubar-o a 37 ° c por aproximadamente 8 h até que as colônias apareçam.
- Escolha as colônias que abrigam o selvagem-tipo Kanr e a leucina rara-Codon-rico Kanr-RC29 e use cada um para inocular 5 ml de meio de lb diluído com quíntuplo (0,2 x lb) contendo 50 μg · ml-1 de canamicina. Incubar as amostras numa coqueteleira a 250 rpm a 37 ° c.
Nota: o meio é crucial para o sistema de seleção. Deve conter apenas bastante carbono e nitrogênio para permitir a expressão da proteína da resistência antibiótica do gene do selvagem-tipo um pouco do que dos derivados raro-Codon-modificados. Neste caso, a concentração de L-leucina em 1x LB médio é muito alta para inibir completamente a expressão protéica do raro-Codon-rico KanR. Assim, um meio de LB diluído com um fator de diluição como 5 é usado para gerar uma diferença clara nas expressões protéicas do tipo selvagem e dos genes ricos em Codon raros. - Transferir 200 μL de cada uma das culturas de células para uma placa de 96 poços em triplicado em pontos de tempo definidos (por exemplo, 8 h, 16 h e 24 h). Meça o OD600 (densidade ótica em 600 nanômetro) usando um leitor da placa.
Nota: se uma diminuição na pilha OD600 não pode ser detectada para as tensões que abrigando os genes raros-Codon-ricos do marcador em comparação com o OD600 da tensão que abrigando os genes do selvagem-tipo marcador, tentativa para aumentar a quantidade de Codon raro no genes de marcadores ou utilizar um meio mais diluído. - Realize o ensaio de alimentação de aminoácidos para testar se as expressões dos genes de marcadores raros-Codon-ricos (por exemplo, KanR-RC29) podem ser restauradas aumentando a concentração dos aminoácidos direcionados.
Nota: para a selecção de sobreprodutores de L-leucina, a L-leucina é utilizada para a alimentação.- Inocular as estirpes que abriam o gene KanR-RC29 Marker em 5 ml de 0,2 x lb (contendo 50 μg · ml-1 de canamicina) com ou sem o fornecimento de 1 g · L-1 l-leucina. Inocular outro 5 mL do 0.2 x LB com cepas que abrigam o selvagem-tipo KanR como controle. Incubar as amostras numa coqueteleira a 250 rpm a 37 ° c.
- Meça o OD600 para cada cultura em pontos de tempo definidos (por exemplo, 15 h, 17 h, 19 h, e 22 h).
3. otimizando as condições de triagem
- Transforme 50 μL da cepa-mãe utilizada para mutagenese com 1 μL de plasmídeo (~ 50 ng · μL-1) que transporta o GFP do tipo selvagem ou o PPGdo tipo selvagem. Também, transforme a tensão do pai com os derivados raro-Codon-ricos dos genes do marcador.
- Adicionar 950 μL de meio SOC e incubar a amostra num agitador a 250 rpm a 37 ° c durante 1 h.
- Placa 100 μL da cultura celular para o meio de agar LB contendo os antibióticos apropriados (25 μg · mL-1 de cloranfenicol para o plasmídeo GFP carregando um marcador cmR , ou 50 μg · ml-1 de canamicina para o PPG plasmídeo carregando um marcador KanR ) e incubar durante a noite a 37 ° c.
- Escolha uma colônia que abriga o Wild-Type GFP ou PPG e uma colônia que abriga o derivado raro Codon-rico correspondente, e transferi-los para 5 ml do meio lb devidamente diluído individualmente. Incubar as amostras numa coqueteleira a 250 rpm a 37 ° c.
Nota: para cepas de E. coli abrigando a leucina rara-Codon-Rich GFP-RC ou PPG-RC, o meio lb não diluído (1x lb) pode ser usado para criar diferenças significativas nas expressões do Wild-Type e do marcador raro-Codon-rico Genes. Além disso, promotores induzível são usados para conduzir as expressões dos genes marcador de triagem. Comece a indução quando as células entram na fase exponencial para alcançar melhores discriminações. - Para marcadores de fluorescência, transfira 200 μL de cada uma das culturas celulares para uma placa preta de fundo transparente de 96 poços em triplicado em pontos de tempo definidos (por exemplo, 2 h, 4 h e 6 h). Meça o OD600 e a fluorescência e calcule a intensidade da fluorescência (a relação da fluorescência a OD600). Para marcadores cromogênicos, medir o desenvolvimento de cores das culturas de células.
Nota: se não for possível detectar intensidades de fluorescência inferiores para as estirpes que abriam o GFP-RC em comparação com as estirpes que abriam o GFPdo tipo selvagem, ou se não for possível detectar uma cor mais clara para as células que expressam a proteína roxa do PPG-RC do que do gene do selvagem-tipo, tentativa para aumentar o número de Codon raro nos genes do marcador ou para usar um meio mais diluído. - Realize o ensaio de alimentação (ver passos 2.7.1 e 2.7.2). Meça a intensidade da fluorescência ou o desenvolvimento da cor em pontos de tempo definidos (por exemplo, 12 h, 18 h, e 24 h).
4. identificação dos produtores de aminoácidos
- Inocular 100 μL da cultura dos mutantes em 5 mL de meio LB (2% v/v) e incubar-o num agitador a 250 rpm a 37 ° c até que os valores de OD600 alcancem 0,4.
- Torne os mutantes em células competentes17.
- Transforme 50 μL das células mutantes com 1 μL do plasmídeo (~ 50 ng · μL-1) carregando o marcador de seleção KanR-RC29 ou os marcadores de triagem GFP-RC ou PPG-RC. Adicionar 950 μL de meio SOC e rodar a amostra num agitador de 37 ° c durante 1 h.
- Selecione superprodutores de aminoácidos.
- Centrifugue a cultura da pilha em 4.000 x g por 5 minutos, descarte o sobrenadante e adicione 5 ml de meio de 0.2 x LB contendo 50 μg · ml-1 de kanamycin. Incubar a amostra num agitador de 37 ° c durante a noite.
- Placa de cultura durante a noite (por exemplo, 100 μL, depende da densidade celular da cultura) para 0,2 x LB meio agar contendo 50 μg · mL-1 canamicina e incubar a 37 ° c por 12 h.
Nota: as colônias desenvolvidas são os candidatos dos produtores de aminoácidos alvejados e, neste caso, os superprodutores de L-leucina.
- Tela dos produtores de aminoácidos.
- Placa o número adequado de células (por exemplo, 100 μL) que abrigando o marcador de triagem (conforme descrito na etapa 4,3) no meio de agar LB contendo o antibiótico apropriado (25 μg · mL-1 de cloranfenicol para triagem com GFP-RC e 50 μg · ml -1 canamicina para triagem com PPG-RC) e incubar a 37 ° c por 8 h.
- Inocular o meio LB contendo o antibiótico apropriado (ver passo 4.5.1) com cada colônia única da placa. Incubar as amostras numa coqueteleira a 250 rpm a 37 ° c.
- Meça o OD600 e a fluorescência e calcule a intensidade da fluorescência se GFP-RC é usado. Meça o desenvolvimento da cor das culturas da pilha se o PPG-RC é usado. Note-se que as estirpes que exibem uma maior intensidade de fluorescência ou uma cor mais profunda do que a estirpe dos pais são os produtores de aminoácidos candidatos e, neste caso, os superprodutores de L-leucina.
Nota: a triagem de células ativadas por fluorescência também é adequada para identificar os produtores de uma única célula quando os genes de proteínas fluorescentes ricas em Codon são usados para triagem.
- Verifique as produtividades do aminoácido das cepas candidatas.
- Inocular 5 mL de meio LB com cada uma das cepas candidatas e deixar as células crescerem durante a noite em uma coqueteleira a 250 rpm a 37 ° c.
- Colher as células a partir de 1 mL da cultura celular por centrifugação em 4.000 x g por 2 min. descarte o sobrenadante e ressuscitem o pellet com 1 ml de água estéril.
- Inocular 20 mL de meio M9 contendo 4% de glicose com 200 μL de suspensão celular e incubar num agitador de 250 mL a 250 rpm a 37 ° c durante 24 h.
- Centrifugue 1 mL do meio de cultura a 4.000 x g durante 5 min. Transfira 200 μl do sobrenadante para um tubo de 1,5 ml limpo. Preparar soluções de L-leucina (HPLC (cromatografia líquida de alta eficiência) de 0, 1, 0, 5, 0,1, 0,5 e 1 g · L-1 como padrões.
- Adicionar 100 μL de trietilamina de 1 mM e 100 μL de isotiocianato de 1 M de fenilo ao sobrenadante e os padrões, misture-os suavemente e incubar-os à temperatura ambiente durante 1 h18.
Cuidado: a trietilamina e o isotiocianato de fenilo podem causar queimaduras cutâneas graves e danos oculares e são prejudiciais se inalados. Use luvas e uma máscara e, se possível, realize esta etapa em uma capa de fumaça. - Adicionar 400 μL de n-hexano ao mesmo tubo e vórtice para 10 s. filtre a fase inferior contendo os derivados de aminoácidos através de uma membrana de politetrafluoroetileno de 0,2 μm.
PRECAUÇÃO: n-hexano pode provocar irritação cutânea. Use luvas e roupas protetoras. Se vier em contacto com a pele, enxague a pele com muita água. - Prepare a fase móvel a misturando o acetato do sódio de 0,1 M (pH 6,5) e o acetonitrila em uma relação 99.3:0.7 volumétrica. Prepare o acetonitrila (80% v/v) como a fase móvel B. filtre todas as fases móveis através das membranas do politetrafluoretileno de 0,2 μm.
Cuidado: o acetonitrila é prejudicial se inalado e pode causar irritações da pele e do olho. Use luvas e roupas protetoras e realize esta etapa em uma capa de fumaça. - Execute 1 μL da amostra em uma ultra-HPLC equipada com uma coluna C18 de acordo com o programa da eluição na tabela 1 com uma taxa de fluxo de 0,42 ml · min-1 e uma temperatura da coluna de 40 ° c. Detecte os aminoácidos direcionados em 254 nm com um detector de matriz de diodos e Calcule suas concentrações mapeando as áreas de pico para a curva padrão.
| Tempo (min) | Fase móvel A (%) | Fase móvel B (%) |
| 0 | 98 | 2 |
| 3,5 | 70 | 30 |
| 7 | 43 | 57 |
| 7,1 | 0 | 100 |
| 11 | 98 | 2 |
Tabela 1: programa de eluição para quantificação de aminoácidos.
Resultados
Para o sistema de seleção, uma diminuição acentuada no OD600 para cepas que abrigando o gene de resistência a antibióticos raro-Codon-rico deve ser observada em comparação com a cepa que abrigando o gene de resistência a antibióticos do tipo selvagem quando cultivado em um adequado médio (Figura 1a). Nas mesmas condições, a diminuição da célula OD600 torna-se mais evidente, pois o número de raros códons no gene da resistência aos antibióticos aumenta (Figura 1a). Deve-se notar que a inibição do Codon raro em expressões de proteínas ocorre principalmente condições de fome. Portanto, se o meio LB não for adequadamente diluído, não será observada diminuição significativa da célula OD600 para a cepa que abrigando o gene marcador raro-Codon-rico em comparação com a cepa que abrigando o gene do tipo selvagem (Figura 1b). Após a alimentação extra do aminoácido correspondente, o OD600 para a estirpe que abrigando o gene de resistência a antibióticos raro-Codon-rico aumentará significativamente e abordará o da estirpe que abrigando o gene do tipo selvagem (Figura 1C).
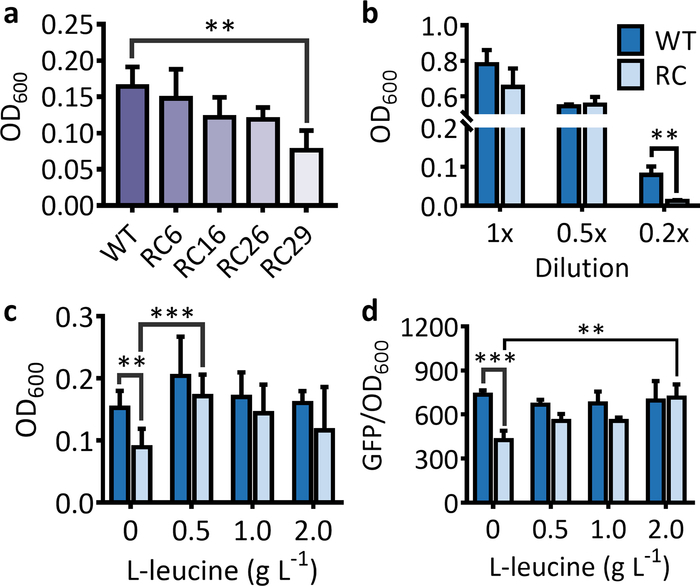
Figura 1: efeitos do códon raro sobre as expressões de genes marcadores utilizados para a seleção e os sistemas de triagem. (a) a célula OD600 para cepas de E. coli abrigando o gene de resistência a antibióticos (KanR) com 6, 16, 26 e 29 LEUCINA Rare-CODON (RC6, RC16, RC26, e RC29) substituição após 5 h de incubação. (b) a célula OD600 para uma cepa de E. coli abrigando o Wild-Type (WT) e o raro-Codon-rico KanR (RC) em 1x, 0.5 x, e 0.2 x lb mídia após 5 h de incubação. (c) efeitos da alimentação de L-leucina no crescimento celular de cepas de E. coli que abriam o gene R de leucina rara-Codon rico após 5 h de incubação. Os valores e as barras de erro representam a média e o SD (n = 6). A alimentação de L-leucina aumentou significativamente o OD600 para as células que abriam a rara-Codon-rico KanR. A única exceção foi para a alimentação de 2 g · L-1 l-leucina devido a um SD elevado no OD600 para o tratamento de alimentação. (d) efeitos do raro-Codon e da L-leucina que alimentam em expressões de GFP do selvagem-tipo (WT) e dos genes raros-Codon-ricos da LEUCINA (RC) após 16 h da incubação. A alimentação de 0,5 – 2 l-1 l-leucina aumentou significativamente a intensidade da fluorescência para as células que abriam o GFP raro-Codon-rico. Os valores e as barras de erro representam a média e o SD (n = 3). * *P < 0, 1, * * *p < 0, 1 conforme determinado pelo teste tde duas caudas, e apenas os resultados mais significativos foram mostrados. Por favor clique aqui para ver uma versão maior desta figura.
Para o sistema de triagem, a intensidade de fluorescência e o número de células fluorescentes serão significativamente menores para a cepa que expressa a proteína fluorescente do gene raro-Codon-rico do que do gene do tipo selvagem (Figura 1D e Figura 2). Ao usar a proteína roxa, a cor desenvolvida a partir do PPG raro-Codon-rico deve ser mais leve do que a do gene do tipo selvagem quando expressa as mesmas condições para o mesmo período de incubação (Figura 3). A alimentação do aminoácido correspondente restaurará as expressões proteicas dos genes ricos em Codon raros. Para as cepas que abriam o GFPraro-Codon-rico, a intensidade da fluorescência (Figura 1D) e o número de células fluorescentes (Figura 2) devem aumentar significativamente e abordar a das cepas contendo o GFP do tipo selvagem . Quando LB não diluído é usado, os aminoácidos no meio seria suficiente para permitir a expressão lenta do PPG raro-Codon-rico mesmo sem alimentação extra de L-leucina, e a proteína roxa expressa se tornaria visível uma vez que as células são peletizadas ( Figura 3). No entanto, isso não esconde o fato de que a expressão gênica do PPG raro-Codon-rico foi drasticamente reforçada pela alimentação da L-leucina para 2 g · L-1, especialmente quando observada na cultura líquida (Figura 3). Conseqüentemente, a cultura líquida é uma escolha melhor para a seleção baseada em proteínas cromogênico, e o uso do meio diluído da libra traria uma diferença mais significativa entre os fenótipos induzidos pelo selvagem-tipo e pelos genes raro-Codon-ricos.

Figura 2: O número de células fluorescentes de E. coli que abrigam o GFP do tipo selvagem ou a leucina rara GFP Codon (GFP-RC) após a adição de L-leucina. As células foram cultivadas em meio de 1x LB. Barra de escala = 20 μm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: desenvolvimento de cores para células que abriam o Wild-Type (WT) e a leucina rara-Codon-Rich (RC) PPG genes que codificam uma proteína roxa em 1x lb médio (painel esquerdo) e o efeito da L-leucina alimentação no desenvolvimento de cor de cultura celular ( painel direito). Os genes PPG foram induzidos quando as células entraram na fase exponencial e as imagens foram capturadas 3 h após a indução. A L-leucina foi adicionada ao meio junto com o indutor no ensaio de alimentação. Os círculos coloridos foram gerados escolhendo as cores das culturas da pilha e das pelotas da pilha. Por favor clique aqui para ver uma versão maior desta figura.
A estratégia rara-baseada em Codon é capaz de identificar os superprodutores dos aminoácidos alvo da biblioteca de mutação, e esses mutantes devem produzir maiores quantidades de aminoácidos direcionados do que as cepas dos pais (Figura 4).

Figura 4: aminoácidos produzidos pelo tipo selvagem e as cepas mutadas identificadas pela estratégia rara-baseada em Codon. (a) L-produções de leucina de cepas de E. coli identificadas a partir de bibliotecas de mutação pelo KanR-RC29 (El-1 a El-5) e pelo GFP-RC que abriga 29 e 19 códons raros de leucina (El-6 a El-10), respectivamente. (b) produções de L-arginina de cepas de Corynebacterium glutamicum selecionadas pelo KanR raro-Codon rico, que continha oito codões raros de arginina (Agg). O gene do marcador foi introduzido nas bibliotecas da mutação do C. glutamicum derivadas do selvagem-tipo tensão ATCC13032. O meio de seleção foi de 0,3 x CGIII fornecido com 25 μg · mL-1 de canamicina. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
O número de códons raros nos genes do marcador e o meio de seleção ou de triagem são críticos para inibir as expressões protéicas dos genes marcadores raros-Codon-modificados. Se não for detectada diferença significativa entre as expressões protéicas dos genes marcadores do tipo selvagem e seus derivados, aumentar o número de códons raros ou usar um meio limitado de nutrientes pode amplificar as diferenças. No entanto, se o efeito de inibição é muito forte, as expressões de proteínas não podem ser recuperados, mesmo por alimentação extra dos aminoácidos correspondentes. Neste caso, o número de códons raros nos genes do marcador deve ser reduzido para aliviar a parte do stress. Outra maneira de afinar a seleção ou a rigor de triagem é ajustar os números de cópia e os níveis de expressão dos genes de marcadores raros-Codon-ricos. Diminuir o número de cópia e os níveis de expressão dos genes do marcador geralmente leva a diferenciações mais fortes entre os produtores de aminoácidos e as cepas iniciais. Portanto, os vetores que contêm as origens de replicação de número de cópia baixa, como p15A ou pSC101, bem como os promotores fracos, devem ser usados. Se o gene do marcador é conduzido por um promotor induzível, a baixa indução é recomendada.
A estratégia rara-Codon-baseada para a seleção ou o exame para overprodutores do ácido aminado é uma adaptação reversa da estratégia comumente usada da "optimização do Codon", que visa facilitar as expressões de proteínas exógenas. Na optimização do Codon, os códons raros nos genes alvejados são substituídos pelos comuns os sinónimos com respeito ao anfitrião; assim, os genes de outros organismos poderiam ser traduzidos muito mais ràpida em proteínas do que aqueles genes exógenos com proporções elevadas de códons raros19. Portanto, é razoável supor que a "otimização reversa", que alterna os códons comuns para os seus sinônimos raros, deve inibir as expressões genéticas. Entretanto, as expressões do gene devem ser restauradas pelo carregamento realçado dos tRNAs raros correspondentes quando os aminoácidos alvejados se acumulam intracellularly. A incorporação de códons raros aumenta o limiar da concentração de aminoácidos em expressões proteicas, o que oferece uma estratégia potencial para selecionar ou tela para produtores de aminoácidos quando combinados com os genes de marcador adequado.
Além dos genes da resistência antibiótica, dos genes fluorescentes da proteína, e dos genes cromosgenic da proteína usados no protocolo, os vários genes do marcador podiam ser empregados para estabelecer o sistema rara-Codon-baseado da seleção ou de exame. Por exemplo, genes letais como Tolc20 e sacb21 podem ser usados para selecionar produtores de aminoácidos. Neste caso, códons comuns sobre os genes que pertencem ao sistema de antídoto devem ser substituídos pelos códons raros sinônimos dos aminoácidos alvo. Cepas que superproduzem os aminoácidos direcionados são capazes de lançar o sistema de antídoto e, assim, sobreviver aos efeitos tóxicos induzidos pelos genes letais.
Deve notar-se que os efeitos secundários podem ocorrer quando se utiliza quantidades elevadas de aminoácidos no ensaio de alimentação. Isto é porque alguns aminoácidos são tóxicos para os microrganismos. Por exemplo, uma concentração de cerca de 100 mg · L-1 para l-serina é capaz de inibir o crescimento de E. coli22. Entretanto, embora mais baixo do que aquele do selvagem-tipo Gene, nós encontramos que alimentando até 2 g · L-1 l-serina ainda poderia restaurar as expressões de genes de resistência a antibióticos que ricos em serina rara Codon13. Portanto, a toxicidade do aminoácido, pelo menos para a L-serina, não prejudicaria a confiabilidade do ensaio de alimentação. Para superar os potenciais efeitos negativos da toxicidade do aminoácido sobre as produtividades das cepas alvo, podem ser aplicadas estratégias como mutagenese aleatória e o aprimoramento das exportações de aminoácidos23 . Na verdade, o método raro-Codon-based é adequado para identificar cepas tolerantes capazes de resistir ou sobreproduzindo aminoácidos acima dos níveis tóxicos. As mutações chaves que conferem a tolerância do ácido aminado podiam ser identificadas e introduzidas nas tensões alvejadas, que seriam os anfitriões ideais para as construções de overprodutores do ácido aminado.
O sistema de seleção ou triagem com base em Codon raro garante alta fidelidade. Em outras palavras, as cepas identificadas pelo sistema são supostamente os superprodutores dos aminoácidos alvo. No entanto, em alguns casos, os candidatos que sobrevivem à seleção de antibióticos não podem produzir maiores quantidades de aminoácidos direcionados do que a cepa dos pais. Isso pode ser atribuído à resistência antibiótica adquirida pelas cepas através da mutagenese e, em seguida, à perda do plasmídeo de seleção24. Como consequência, cepas sem produtividades de aminoácidos melhoradas poderiam sobreviver ao estresse antibiótico e escapar da seleção. Essas cepas de falso positivo poderiam ser eliminadas inserindo outro marcador de seleção no plasmídeo de seleção, como um gene de tipo selvagem que confere resistência a outro antibiótico. Cepas que perderam o plasmídeo de seleção são menos propensos a obter dupla resistência aos dois antibióticos e serão eliminadas durante a seleção.
Os mutantes identificados pelo sistema raro-Codon-baseado devem poder overproduce os aminoácidos alvejados em comparação com as tensões iniciais. No entanto, as produtividades de aminoácidos para as estirpes seleccionadas podem ainda ser inferiores às exigências industriais. Isto não sugere uma falha da estratégia raro-baseada no Codon porque os desempenhos da tensão são independentes do processo da seleção ou do exame mas dependem dos fatores tais como as características da tensão inicial, a aproximação da mutagenese, o tamanho do biblioteca de mutação e as condições de fermentação. A fim de obter cepas de alta produção, deve-se prestar atenção às estratégias de engenharia de deformação, como por mutagenese aleatória ou através de um design racional das vias biossintéticas do aminoácido. Combinando a evolução adaptativa do laboratório e a estratégia rara-Codon-baseada facilitaria a obtenção de overprodutores do ácido aminado.
A metionina e o triptofano não têm códons alternativos entre os 20 aminoácidos proteinogênicos. Portanto, esta estratégia não pode ser empregada diretamente para estes aminoácidos. Uma solução possível é usar os tRNAs projetados que são capazes de reconhecer os códons de batente para transportar estes aminoácidos. Assim, os códons correspondentes do batente podiam ser adotados como os códons raros artificiais destes ácidos aminados25,26.
Uma das maiores deficiências em relação à estratégia convencional analógica para a seleção de produtores de aminoácidos é a alta taxa de falsos positivos5,27. Cepas que passam por mutagenese poderiam facilmente adquirir resistência para os análogos de aminoácidos tóxicos, e a tolerância pode até ser adquirida sem o auxílio de mutagénicos27. Essas cepas poderiam facilmente escapar das pressões de seleção dos análogos de aminoácidos e, conseqüentemente, as cepas selecionadas geralmente não são os verdadeiros produtores de aminoácidos que sacrificam grandemente a eficiência do processo de seleção.
Em contraste, a estratégia rara-baseada em Codon supera o método tradicional analógico-baseado, permitindo identificações precisas e rápidas de produtores de aminoácidos. A nosso conhecimento, esta é a primeira estratégia que adota a lei natural do viés do Codon. Confia somente em um único gene raro-Codon-rico do marcador e, assim, elimina o uso de análogos tóxicos. Os genes do marcador são geralmente nontoxic às tensões do anfitrião, e as expressões da proteína dos genes raro-Codon-ricos dependem primeiramente das concentrações intracelular dos ácidos aminados correspondentes por causa da lei universal e estrita do viés do Codon em todas as espécies. Isso impediria que as cepas escapem das pressões de seleção. Além disso, devido à grande diversidade de genes marcadores, a estratégia rara-baseada em Codon poderia oferecer várias opções tanto para a seleção quanto para a triagem de produtores de aminoácidos.
Devido ao fenômeno universal do viés de Codon em todos os organismos vivos28, a estratégia de seleção ou triagem baseada em Codon rara poderia, teoricamente, ser empregada para outros microrganismos além de E. coli, especialmente aqueles com Potenciais. Ao mudar para um hospedeiro diferente, a escolha de códons raros usados para projetar os genes do marcador deve basear-se nas frequências de uso do Codon e nas abundâncias dos tRNAs correspondentes para o hospedeiro específico. O meio utilizado para seleção ou triagem também deve ser otimizado de acordo. Um exemplo é o C. glutamicum comumente usado em fermentações de aminoácidos. Um gene do KanR raro-Codon-modificado que contem oito códons raros da arginina (Agg) foi mostrado eficaz em selecionar os overprodutores do C. glutamicum L-arginina por um estudo precedente13 (Figura 4B). As explorações da estratégia rara-Codon-baseada devem facilitar as construções e os entendimentos de overprodutores do ácido aminado. Além dos aminoácidos, a estratégia de rara Codon também pode ser empregada com isobutanol, 3-metil-1-butanol, 2-metil-1-butanol e outros produtos que compartilham os mesmos caminhos biossintéticos com certos aminoácidos29. Cepas identificadas por genes de marcadores que abrigam os raros códons destes aminoácidos são capazes de superproduzir os compostos precursores, que podem ser canalizados para a síntese dos derivados de aminoácidos. Conseqüentemente, a estratégia raro-Codon-baseada poderia serir como um método indireto contudo rápido para refletir os potenciais das tensões em acumular estes produtos químicos intra ou extracellularly. As mutações chaves que conferem produtividades aumentadas do ácido aminado dos vários overprodutores podiam ser identificadas pelo sequenciamento profundo e ser introduzidas individualmente ou simultaneamente em tensões industriais para melhorar mais as produções do aminoácido.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O trabalho foi apoiado conjuntamente pela Fundação Nacional de ciências naturais da China (Grant no. 21676026), a chave nacional R & D programa da China (Grant no. 2017YFD0201400), e da China pós-doutorado Science Foundation (Grant no. 2017M620643). Obras no Instituto de avanço da UCLA (Suzhou) foram apoiadas pelas subvenções internas da província de Jiangsu e parque industrial de Suzhou.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo | 51101 | |
| EasyPure HiPure Plasmid MiniPrep Kit | Transgen | EM111-01 | |
| EasyPure Quick Gel Extraction Kit | Transgen | EG101-01 | |
| Gibson assembly master mix | NEB | E2611S | |
| Isopropyl β-D-1-thiogalactopyranoside | Solarbio | I8070 | |
| L-leucine | Sigma | L8000 | |
| Microplate reader | Biotek | Synergy 2 | |
| n-hexane | Thermo | H3061 | |
| Phenyl isothiocyanate | Sigma | P1034 | |
| PrancerPurple CPB-37-441 | ATUM | CPB-37-441 | |
| TransStar FastPfu Fly DNA polymerase | Transgen | AP231-01 | |
| Triethylamine | Sigma | T0886 | |
| Ultra-high performance liquid chromatography | Agilent | 1290 Infinity II | |
| Wild type C. glutamicum | ATCC | 13032 | |
| XL10-Gold E. coli competent cell | Agilent | 200314 | |
| ZORBAX RRHD Eclipse Plus C18 column | Agilent | 959759-902K |
Referências
- Tatsumi, N., Inui, M. . Corynebacterium glutamicum: biology and biotechnology. , (2012).
- Tonouchi, N., Ito, H., Yokota, A., Ikeda, M. Present global situation of amino acids in industry. Amino Acid Fermentation. , 3-14 (2017).
- Gusyatiner, M., Lunts, M., Kozlov, Y., Ivanovskaya, L., Voroshilova, E. . DNA coding for mutant isopropylmalate synthase, L-leucine-producing microorganism and method for producing L-leucine. , (2005).
- Park, J. H., Lee, S. Y. Towards systems metabolic engineering of microorganisms for amino acid production. Current Opinion in Biotechnology. 19 (5), 454-460 (2008).
- Norris, R., Lea, P. The use of amino acid analogues in biological studies. Science Progress. , 65-85 (1976).
- Park, J. H., Lee, S. Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering. Applied Microbiology and Biotechnology. 85 (3), 491-506 (2010).
- Bach, T. M., Takagi, H. Properties, metabolisms, and applications of L-proline analogues. Applied Microbiology and Biotechnology. 97 (15), 6623-6634 (2013).
- Crick, F. H. C. On the genetic code. Science. 139 (3554), 461-464 (1963).
- Plotkin, J. B., Kudla, G. Synonymous but not the same: the causes and consequences of codon bias. Nature Reviews Genetics. 12 (1), 32-42 (2011).
- Dittmar, K. A., Sørensen, M. A., Elf, J., Ehrenberg, M., Pan, T. Selective charging of tRNA isoacceptors induced by amino‐acid starvation. EMBO Reports. 6 (2), 151-157 (2005).
- Elf, J., Nilsson, D., Tenson, T., Ehrenberg, M. Selective charging of tRNA isoacceptors explains patterns of codon usage. Science. 300 (5626), 1718-1722 (2003).
- Sørensen, M. A. Charging levels of four tRNA species in Escherichia coli Rel+ and Rel− strains during amino acid starvation: a simple model for the effect of ppGpp on translational accuracy. Journal of Molecular Biology. 307 (3), 785-798 (2001).
- Zheng, B., et al. Utilization of rare codon-rich markers for screening amino acid overproducers. Nature Communications. 9 (1), 3616 (2018).
- Richardson, S. M., Wheelan, S. J., Yarrington, R. M., Boeke, J. D. GeneDesign: rapid, automated design of multikilobase synthetic genes. Genome Research. 16 (4), 550-556 (2006).
- Xiong, A. -. S., et al. PCR-based accurate synthesis of long DNA sequences. Nature Protocols. 1 (2), 791-797 (2006).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Green, M. R., Sambrook, J. . Molecular cloning: a laboratory manual. , (2012).
- Cohen, S. A., Bidlingmeyer, B. A., Tarvin, T. L. PITC derivatives in amino acid analysis. Nature. 320 (6064), 769-770 (1986).
- Zhou, J., Liu, W. J., Peng, S. W., Sun, X. Y., Frazer, I. Papillomavirus capsid protein expression level depends on the match between codon usage and tRNA availability. Journal of Virology. 73 (6), 4972-4982 (1999).
- Gregg, C. J., et al. Rational optimization of tolC as a powerful dual selectable marker for genome engineering. Nucleic Acids Research. 42 (7), 4779-4790 (2014).
- Pelicic, V., Reyrat, J. M., Gicquel, B. Expression of the Bacillus subtilis sacB gene confers sucrose sensitivity on mycobacteria. Journal of Bacteriology. 178 (4), 1197-1199 (1996).
- Avcilar-Kucukgoze, I., et al. Discharging tRNAs: a tug of war between translation and detoxification in Escherichia coli. Nucleic Acids Research. 44 (17), 8324-8334 (2016).
- Mundhada, H., Schneider, K., Christensen, H. B., Nielsen, A. T. Engineering of high yield production of L-serine in Escherichia coli. Biotechnology and Bioengineering. 113 (4), 807-816 (2016).
- Makosky, P. C., Dahlberg, A. E. Spectinomycin resistance at site 1192 in 16S ribosomal RNA of E. coli: an analysis of three mutants. Biochimie. 69 (8), 885-889 (1987).
- Feng, L., Tumbula-Hansen, D., Toogood, H., Söll, D. Expanding tRNA recognition of a tRNA synthetase by a single amino acid change. Proceedings of the National Academy of Sciences of the United States of America. 100 (10), 5676-5681 (2003).
- Naganuma, M., et al. The selective tRNA aminoacylation mechanism based on a single G• U pair. Nature. 510 (7506), 507 (2014).
- Hoesl, M. G., et al. Chemical evolution of a bacterial proteome. Angewandte Chemie International Edition. 54 (34), 10030-10034 (2015).
- Hershberg, R., Petrov, D. A. Selection on codon bias. Annual Review of Genetics. 42, 287-299 (2008).
- Huo, Y. -. X., et al. Conversion of proteins into biofuels by engineering nitrogen flux. Nature Biotechnology. 29, 346 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados