Method Article
희귀 코돈이 풍부한 마커를 사용하여 아미노산 과잉 생산자 식별
요약
이 연구는 정확도, 감도 및 높은 처리량을 동시에 달성하기 위해 희귀 코돈이 풍부한 마커를 사용하여 아미노산 과잉 생산자를 식별하는 기존의 독성 아날로그 기반 방법에 대한 대체 전략을 제시합니다.
초록
아미노산에 대한 계속 성장하는 시장을 만족시키기 위해서는 고성능 생산 균주가 필요합니다. 아미노산 과잉 생산자는 아미노산과 그들의 유사체 사이 경쟁을 이용하 여 전통적으로 확인됩니다. 그러나, 이 아날로그 기반 방법은 낮은 정확도이며, 특정 아미노산에 대한 적절한 유사체는 제한된다. 여기에서는 희귀 코돈이 풍부한 마커를 사용하여 아미노산 과잉 생산자의 정확하고 민감하며 처리량이 높은 스크리닝을 가능하게 하는 대체 전략을 제시합니다. 이 전략은 코돈이 코딩 DNA에서 발생 빈도에 따라 일반적이거나 희귀 한 것으로 분류되는 단백질 번역에서 코돈 사용 편향현상에서 영감을 받습니다. 희귀 코돈의 번역은 기아하에 코그네이트 아미노산에 의해 완전히 충전 될 수없는 해당 희귀 전사 RNAs (tRNAs)에 달려 있습니다. 이론적으로, 희귀 한 tRNAs는 동의어 일반적인 이소 수용인을 충전 한 후 아미노산의 잉여가있는 경우 충전 될 수있다. 따라서, 희소한 코돈에 기인한 지체번역은 대응하는 아미노산의 공급 또는 세포내 과잉 생산에 의해 복원될 수 있었다. 이러한 가정하에, 표적 아미노산의 일반적인 코돈들을 항생제 내성 유전자 또는 유전자의 동의어드문 대안으로 대체함으로써 아미노산 과잉 생산자를 식별하기 위한 선택 또는 스크리닝 시스템이 확립된다. 형광 또는 발색성 단백질을 인코딩합니다. 우리는 단백질 발현이 희소한 코돈의 통합에 의해 크게 방해될 수 있고 단백질의 수준이 아미노산 농도와 긍정적으로 상관관계가 있다는 것을 보여줍니다. 이 시스템을 사용 하 여, 여러 아미노산의 과잉 생산자 돌연변이 라이브러리에서 쉽게 밖으로 선별 될 수 있습니다. 이 희소한 코돈 기지를 둔 전략은 단지 단 하나 수정한 유전자를 요구하고, 호스트는 그밖 방법에서 보다는 선택을 탈출하기 위하여 확률이 낮습니다. 그것은 아미노산 과잉 생산자를 얻기 위한 대체 접근 을 제안 합니다.
서문
아미노산의 현재 생산 발효에 크게 의존. 그러나, 대부분의 아미노산 생산 균주에 대한 적시및 수율은 수십억 달러의 가치가 있는 글로벌 아미노산 시장의 수요 증가에 미치지못하고1,2. 고성능 아미노산 과잉 생산자를 얻는 것은 아미노산 산업의 업그레이드에 매우 중요합니다.
아미노산 과잉 생산자를 식별하는 전통적인 전략은 단백질 합성에서 아미노산과 그유사체 사이의 경쟁을 악용 3,4. 이들 유사체는 상응하는 아미노산을 인식하고 펩티드 사슬의 연신을 억제하는 tRNAs를 충전할 수 있으며, 이는 체포된 성장 또는 세포 사멸을 초래한다5. 아날로그 응력에 저항하는 한 가지 방법은 세포 내 아미노산의 농도를 증가시키는 것입니다. 농축 된 아미노산은 유한 tRNAs에 대한 유사체를 능가하고 기능성 단백질의 올바른 합성을 보장합니다. 따라서, 유사체에서 살아남는 균주를 선택할 수 있고 상응하는 아미노산의 과잉 생산자일 가능성이 있다.
L-류신 6와 같은 아미노산에 대한 과잉 생산자를선택하는 데 성공했지만 아날로그 기반 전략은 심각한 단점을 겪고 있습니다. 한 가지 주요 관심사는 돌연변이 발생 의 과정에서 또는 자발적인 돌연변이를 통해 서 유래 아날로그 저항이다. 저항이있는 균주는 아날로그5를차단, 내보내기 또는 저하시켜 선택을 벗어날 수 있습니다. 또 다른 관심사는 다른 세포 과정에 아날로그의 독성 부작용7. 결과적으로, 아날로그 선택에서 살아남은 균주는 아미노산 과잉 생산자가 아닐 수 있으며, 원하는 과잉 생산자는 부정적인 부작용으로 인해 거짓으로 박멸 될 수 있습니다.
여기서, 코돈 편향의 법칙에 기초한 새로운 전략이 아미노산 과잉 생산자의 정확하고 신속한 식별을 달성하기 위해 제시된다. 대부분의 아미노산은 숙주 유기체8,9에의해 다르게 선호되는 하나 이상의 뉴클레오티드 삼중항에 의해 인코딩된다. 몇몇 코돈은 코딩 순서에서 드물게 사용되지 않으며 희소한 코돈으로 불립니다. 아미노산으로의 그들의 번역은 해당 아미노산을 운반하는 코그네이트 tRNAs에 의존합니다. 그러나, 희귀 코돈 인식 하는 tRNAs는 일반적으로 일반적인 코돈10,11의tRNAs 보다 훨씬 낮은 풍부. 따라서, 이러한 희귀 한 tRNAs는 다른 이소 수용자와의 경쟁에서 자유 아미노산을 포착 할 가능성이 적으며, 희귀 코돈이 풍부한 서열의 번역은 감속하기 시작하거나 아미노산의 양이 제한될 때 종료됩니다. 10. 번역은, 이론적으로, 해당 아미노산의 과잉 생산 또는 추가 공급으로 인해 동의어 일반적인 tRNAs를 충전 한 후 아미노산 잉여가있는 경우 복원 될 수있다12. 희소코돈이 풍부한 유전자가 선택 또는 스크리닝 마커를 인코딩하는 경우, 상응하는 표현형을 나타내는 균주는 쉽게 식별될 수 있으며 표적 아미노산의 과잉 생산자일 가능성이 높습니다.
상기 전략은 아미노산 과잉 생산자의 식별을 위한 선택 및 스크리닝 시스템을 확립하기 위해 적용된다. 선택 시스템은 항생 저항 유전자(예를 들어, kan R)를 마커로서 사용하며, 스크리닝 시스템은 형광(예를 들어, 녹색 형광 단백질[GFP]) 또는 염색체성(예를 들어, PrancerPurple) 단백질을 인코딩하는 유전자를 사용한다. 두 시스템의 마커 유전자는 그것의 동의어 드문 대안으로 표적 아미노산에 대한 일반적인 코돈의 정의 된 숫자를 대체하여 수정됩니다. 희귀 코돈이 풍부한 마커 유전자를 수용하는 돌연변이 라이브러리의 균주는 적절한 조건 하에서 선택되거나 스크리며, 표적 아미노산의 과잉 생산자는 쉽게 식별될 수 있다. 워크플로우는 희귀 코돈이 풍부한 마커 유전자 시스템의 구축으로 시작하여 작업 조건의 최적화를 거친 다음 아미노산 과잉 생산자의 식별 및 검증을 수행합니다. 이 아날로그 독립적 인 전략은 단백질 번역의 교리를 기반으로하며 아미노산 과잉 생산자의 정확하고 신속한 식별을 가능하게하는 실질적으로 검증되었습니다. 이론적으로, 그것은 직접 희귀 코돈과 모든 미생물 아미노산에 고용 될 수 있습니다. 대체로, 희귀 코돈 기반 전략은 특정 아미노산에 대한 적절한 유사체를 사용할 수 없거나 높은 거짓 긍정률이 주요 관심사인 경우 기존의 아날로그 기반 접근법에 대한 효율적인 대안으로 작용할 것입니다. 아래 프로토콜은 대장균 L-류신 과잉 생산자를 식별하는 이 전략을 입증하기 위해 류신 희귀 코동을 사용합니다.
프로토콜
1. 희귀 코돈이 풍부한 마커 유전자를 발현하는 플라스미드의 구축
- 표적 아미노산에 대한 적절한 수의 공통 코돈이 포함된 마커 유전자를 선택한다.
참고: L-류신의 경우, 29개의 류신 코돈이 함유된 카나마이신 내성 유전자 kanR은 27개의 일반적인 코돈이며, 선택시스템(13)의시공에 사용된다. 19개의 류신 코돈 중 17개의 일반적인 코돈, 또는 보라색 단백질 인코딩 유전자 prancerpurple (ppg)를 포함하는 gfp 유전자는, 14 leucine 일반적인 코동을 항구하는, 검열 체계를 위해 이용됩니다 (보충표 1 ). - 마커 유전자의 일반적인 코돈들을 동의어인 희귀 코돈으로 대체합니다. L-류신의 경우, 칸 R, gfp,또는 ppg에서 코동을 희귀 코돈 CTA로 교체하고, kanR-RC, gfp-RC,또는 ppg-RC를생성하며, 각각13 보충 표1).
참고: 마커 유전자에 있는 희소한 코돈의 주파수는 선택 또는 검열 시스템의 엄격성에 영향을 미칠 것입니다. 일반적으로, 희귀 코돈의 수를 증가선택 또는 선별 시스템의 엄격성을 증가시킬 것이다. 적절한 선택 또는 선별 강도를 달성하기 위해, 희귀 코돈의 다른 번호를 항구 마커 유전자의 시리즈를 설계하고 그 효과를 비교. - 유전자 합성을 위해 GeneDesign14 (http://54.235.254.95/gd/)와 같은 도구를 사용하여 희귀 코돈이 풍부한 마커 유전자의 빌딩 블록을 생성합니다. 대안적으로, 상업적 유전자 합성 서비스에서 마커 유전자를 주문한다.
- GeneDesign 페이지에서 빌딩 블록 디자인(일정한 길이 중복)을선택합니다.
- 서열 상자에 희귀 코돈이 풍부한 마커 유전자의 서열을 붙여 넣습니다.
- 어셈블리 올리고사이의 중첩 길이를 정의합니다. 기본 값 40bp는 대부분의 시퀀스에서 잘 작동합니다.
참고: 다른 매개 변수의 설정에 대한 자세한 지침은 온라인 설명서를 참조하십시오. - 디자인 빌딩 블록 버튼을 클릭하고 페이지에 나열된 올리고뉴클레오티드를 주문합니다.
- 중합효소 연쇄 반응(PCR)에 의한 희귀 코돈 변형 유전자를 합성하는 것은15.
- 희귀 코돈이 풍부한 칸 R-RC를 벡터 pET-28a, gfp-RC에서 pSB1C3으로, 및 ppg-RC를 CPB-37-44116으로리게이트한다.
참고 : pET-28a 및 pSB1C3 플라스미드지도는 SnapGene 온라인 플라스미드 데이터베이스 (보충표1)에서 사용할 수 있습니다. CPB-37-441 플라스미드 맵은 ATUM 발색 단백질 웹사이트에서 확인할 수 있습니다.- 얼음에, 어셈블리 믹스의 어금니 비 1:1 ~ 7.5 μL의 벡터와 마커 조각을 추가합니다(재료 표참조)를 총 부피 10 μL에 추가합니다. 샘플을 50°C에서 1시간 동안 배양합니다.
- 조립 제품의 5 μL을 30s용 42°C에서 50 μL의 유능한 셀(재료 표참조)으로 변환합니다.
- SOC (이화 질 억압을 가진 슈퍼 최적의 국물) 배지에서 세포를 회수하여 37 °C에서 1 시간 동안, LB (리소제니 국물) 한천 배지에 접시에 담고 밤새 37 °C에서 배양하십시오.
- 콜로니를 LB 배지로 접종하고 8 시간 동안 37 °C에서 배양합니다.
- 바람직한 상용 키트를 사용하여 플라스미드를 분리한다.
2. 선택 조건 최적화
- 유능한 세포로 돌연변이 발생에 사용되는 부모 변형을확인 17.
- 야생형 칸R을운반하는 1 μL의 플라스미드로 관할 세포의 50 μL을 변형시키고, 칸 R-RC29를 함유하는 플라스미드를 모든 류신 코돈이 희귀로 대체된 플라스미드로 다른 세트를 변형시킨다. 코돈 CTA.
- SOC 배지 950 μL을 첨가하고 37°C에서 250 rpm에서 1시간 동안 셰이커에 샘플을 인큐베이션합니다.
- 플레이트 100 μL을 LB 한천 배지 상에 50 μg/mL-1 카나마이신을 함유하고, 콜로니가 나타날 때까지 약 8시간 동안 37°C에서 배양한다.
- 야생형 칸R과 류신희귀코돈이 풍부한 칸R-RC29를 포숙하는 콜로니를 선택하고 각각 50 μg/mL-1 카나마이신을 함유한 5배 희석LB 배지(0.2x LB)의 5mL을 접종한다. 샘플을 37°C에서 250 rpm에서 셰이커로 인큐베이션합니다.
참고: 매체는 선택 시스템에 매우 중요합니다. 희귀 코돈 변형 유도체가 아닌 야생 형 유전자로부터 항생제 내성 단백질의 발현을 허용하기에 충분한 탄소 및 질소를 함유해야 한다. 이 때, 1x LB 배지에서의 L-류신 농도가 너무 높아서 희귀 코돈이 풍부한 칸R로부터의 단백질 발현을 완전히 억제한다. 따라서, 희석된 LB 배지와 같은 희석 인자를 가진 5는 야생형 및 희귀코돈이 풍부한 유전자로부터 단백질 발현에 명확한 차이를 생성하는데 사용된다. - 각 세포 배양물의 200 μL을 정의된 시점(예를 들어, 8시간, 16시간 및 24시간)에서 삼중항으로 96웰 플레이트로 이송한다. 플레이트 리더를 사용하여 OD 600(600 nm에서 광학 밀도)을 측정합니다.
참고: 야생형 마커 유전자를 포숙하는 균주의 OD600과 비교하여 희귀 코돈이 풍부한 마커 유전자를 품고 있는 균주에 대해 세포 OD600의 감소를 검출할 수 없는 경우, 마커 유전자를 사용하거나 더 희석 된 매체를 사용합니다. - 희귀 코돈이 풍부한 마커 유전자(예를 들어, kan R-RC29)의발현이 표적 아미노산의 농도를 증가시킴으로써 복원될 수 있는지 시험하기 위해 아미노산 공급 분석실험을 수행한다.
참고 : L-류신 과잉 생산자의 선택을 위해, L-류신은 먹이에 사용됩니다.- 칸 R-RC29 마커 유전자를 0.2x LB의 5 mL로 수용하는 균주를 접종 (50 μg·mL-1 카나마이신 함유)의 공급 유무에 관계없이 1 g·에 L-1 L-류신. 야생형 칸R을 대조군으로 하는 균주와 0.2x LB의 또 다른 5mL를 접종한다. 샘플을 37°C에서 250 rpm에서 셰이커로 인큐베이션합니다.
- 정의된 시점(예: 15h, 17h, 19h 및 22h)에서 각 배양권에 대해 OD600을 측정합니다.
3. 선별 조건 최적화
- 야생형 gfp 또는 야생형 ppg를운반하는 플라스미드 1 μL(~50 ngμl-1)으로 돌연변이 발생에 사용되는 모균의 50 μL을 변형시킨다. 또한, 마커 유전자의 희귀 코돈이 풍부한 유도체로 부모 균주를 변형시킨다.
- SOC 배지 950 μL을 첨가하고 37°C에서 250 rpm에서 1시간 동안 셰이커에 샘플을 인큐베이션합니다.
- 적절한 항생제를 함유하는 LB 한천 배지상에 세포 배양된 플레이트 100 μL(cm R 마커를 운반하는 gfp 플라스미드에 대한 25 μg·mL-1 클로람페니콜, 또는 ppg에 대한 50 μg·mL-1 카나마이신 칸 R 마커를 운반하는 플라스미드)를 37°C에서 밤새 배양한다.
- 야생형 gfp 또는 ppg를 품고 있는 하나의 식민지와 해당 희귀 코돈이 풍부한 유도체를 품고 있는 하나의 식민지를 선택하고, 이를 적절히 희석된 LB 배지의 5 mL로 개별적으로 옮긴다. 샘플을 37°C에서 250 rpm에서 셰이커로 인큐베이션합니다.
참고: 류신 희귀 코돈이 풍부한 gfp-RC 또는 ppg-RC를품고 있는 대장균 균주의 경우, 희석되지 않은 LB 배지(1x LB)를 사용하여 야생형 및 희귀 코돈이 풍부한 마커의 발현에 상당한 차이를 만들 수 있습니다. 유전자. 또한, 유도성 프로모터는 스크리닝 마커 유전자의 발현을 유도하는 데 사용된다. 세포가 지수 단계에 진입할 때 유도를 시작하여 더 나은 차별을 달성합니다. - 형광 마커의 경우, 각 세포 배양물의 200 μL을 정의된 시점(예: 2h, 4h 및 6시간)에서 삼중으로 96웰 의 투명한 바닥 블랙 플레이트로 옮긴다. OD600 및 형광을 측정하고 형광 강도를 계산합니다(OD600에대한 형광의 비율). 염색체 마커의 경우 세포 배양의 색상 개발을 측정합니다.
참고: 야생형 gfp를 품고 있는 균주와 비교하여 gfp-RC를 수용하는 균주에 대해 낮은 형광 강도를 검출할 수 없거나 보라색 단백질을 발현하는 세포에 대해 더 밝은 색을 검출할 수 없는 경우 ppg-RC로부터 야생형 유전자보다, 마커 유전자상에 희귀 코돈의 수를 증가시키려고 하거나 보다 희석된 배지를 사용한다. - 수유 분석(단계 2.7.1 및 2.7.2 참조)을 수행합니다. 정의된 시점(예: 12h, 18h 및 24시간)에서 형광 강도 또는 색 개발을 측정합니다.
4. 아미노산 과잉 생산자의 식별
- 돌연변이체의 배양물의 100 μL을 LB 배지(2% v/v)의 5 mL로 접종하고 OD 600의 값이 0.4에 도달할 때까지 37°C에서 250 rpm에서 250 rpm에서 쉐이커에 배양한다.
- 돌연변이를 유능한 세포로 만드십시오17.
- 플라스미드의 1 μL(~50 ng·μL-1)을 가진 돌연변이세포의 50 μL을 변형시켜 칸 R-RC29 또는 스크리닝 마커gfp-RC 또는 ppg-RC를운반하는 선택 마커를 운반한다. SOC 배지 950 μL을 넣고 37°C 셰이커에서 1시간 동안 시료를 회전시다.
- 아미노산 과잉 생산자를 선택합니다.
- 세포 배양을 4,000 x g에서 5분 동안 원심분리하고, 상판액을 버리고 50 μg·mL-1 카나마이신을 함유하는 0.2x LB 배지의 5 mL를 첨가한다. 샘플을 밤새 37°C 셰이커로 인큐베이션합니다.
- 플레이트 하룻밤 배양 (예를 들어, 100 μL, 배양된 세포 밀도에 따라 다름)을 50 μg·mL-1 카나마이신을 함유하는 0.2x LB 한천 배지 상에 12시간 동안 37°C에서 배양한다.
참고: 개발된 콜로니는 표적 아미노산 과잉 생산자의 후보이며, 이 경우 L-류신 과잉 생산자.
- 아미노산 과잉 생산자를 스크리마.
- 적절한 항생제(gfp-RC 및 50 μg/mL로 스크리닝를 위한 25 μg·mL-1 클로람페니콜)를 함유하는 LB 한천 배지상에 스크리닝 마커(예를 들어, 100 μL)를 포르팅하는 적절한 수의 세포(예를 들어, 100 μL)를 플레이트 -1 가나마이신을 ppg-RC로스크리닝하고 8시간 동안 37°C에서 배양한다.
- 적절한 항생제를 함유하는 LB 배지를 접종(단계 4.5.1 참조)을 플레이트로부터 각 단일 콜로니와 함께 접종한다. 샘플을 37°C에서 250 rpm에서 셰이커로 인큐베이션합니다.
- gfp-RC가 사용되는 경우 OD600 및 형광을 측정하고 형광 강도를 계산합니다. ppg-RC가 사용되는 경우 세포 배양의 색 개발을 측정합니다. 부모 균주의 그것보다 더 높은 형광 강도 또는 더 깊은 색상을 나타내는 균주는 후보 아미노산 과잉 생산자이며, 이 경우, L-류신 과잉 생산자.
참고: 형광 활성화 세포 선별은 희귀 코돈이 풍부한 형광 단백질 유전자가 스크리닝에 사용될 때 단일 세포 고생산자를 식별하는 데도 적합합니다.
- 후보 균주의 아미노산 생성성을 확인합니다.
- 각각의 후보 균주와 LB 배지의 5 mL을 접종하고 세포가 37°C에서 250 rpm에서 셰이커에서 밤새 성장하게 하였다.
- 세포 배양 1 mL에서 세포를 4,000 x g에서 2 분 동안 원심 분리하여 수확하십시오.
- 세포 현탁액의 200 μL로 4% 포도당을 함유하는 M9 배지의 20 mL을 접종하고 250 rpm에서 250 mL 쉐이커에서 24 시간 동안 배양한다.
- 배양 배지의 원심분리기 는 4,000 x g에서 5 분 동안. 깨끗한 1.5 mL 튜브로 상판의 200 μL을 옮긴다. 0.01, 0.05, 0.1, 0.5 및 1 g·1g~의 L-류신 용액(HPLC(고성능 액체 크로마토그래피) 등급 준비 L-1을 표준으로.
- 100 μL의 트리에틸아민과 1M 페닐 이소티오차네이트의 100 μL을 상급자 및 표준에 추가하고, 부드럽게 혼합하고, 1 시간18에대한 실온에서 배양한다.
주의: 트리에틸아민과 페닐 이소티오시오야네이트는 심한 피부 화상과 눈 손상을 일으킬 수 있으며 흡입시 유해합니다. 장갑과 마스크를 착용하고 가능하면 연기 후드에서이 단계를 수행하십시오. - 동일한 튜브에 400 μL의 n-헥산을 추가하고 10 s. 0.2 μm 폴리테트라플루오로에틸렌 막을 통해 아미노산 유도체를 포함하는 하부 상을 필터링합니다.
주의: n-헥산은 피부 자극을 일으킬 수 있습니다. 장갑과 보호복을 착용하십시오. 피부에 닿으면 충분한 물로 피부를 헹구어 주세요. - 99.3:0.7 부피비에서 0.1M 나트륨 아세테이트(pH 6.5)와 아세토니트릴을 혼합하여 이상 A를 준비한다. 아세토니트릴(80% v/v)을 이머지 B. 0.2 μm 폴리테트라플루오로에틸렌 멤브레인을 통해 모든 이동 상을 걸러내도록 준비합니다.
주의: 아세트니트릴은 흡입시 유해하며 피부와 눈의 자극을 유발할 수 있습니다. 장갑과 보호복을 착용하고 연기 후드에서 이 단계를 수행합니다. - 표 1의 용출 프로그램에 따라 C18 컬럼이 장착된 초HPLC에서 시료의 1 μL을 0.42 mL,min-1의 유속및 40°C의 컬럼 온도를 가진 실행한다. 다이오드 어레이 검출기로 254 nm에서 표적 아미노산을 검출하고 피크 영역을 표준 곡선에 매핑하여 농도를 계산합니다.
| 시간(최소) | 단계 A(%) | 이면 단계 B (%) |
| 0 | 98세 | 2개 |
| 3.5 | 70세 | 30개 |
| 7명 | 43세 | 57세 |
| 7.1 | 0 | 100개 |
| 11세 | 98세 | 2개 |
표 1: 아미노산의 정량화를 위한 용출 프로그램.
결과
선택 시스템의 경우, 희귀 코돈이 풍부한 항생 저항 유전자를 품고 있는 균주에 대한 OD600의 급격한 감소는 야생형 항생저항유전자를 배양할 때 균주에 비해 관찰되어야 한다. (그림1a)를참조하십시오. 동일한 조건하에서, 항생저항성 유전자에서 희귀 코돈의 수가 증가함에 따라 세포 OD600의 감소가 더욱 명백해진다(도1a). 단백질 발현에 대한 희귀 코돈의 억제는 대부분 굶주인 조건에서 일어난다는 점에 유의해야합니다. 따라서, LB 배지가 적절히 희석되지 않은 경우, 야생형 유전자를 항하는 균주에 비해 희귀코돈이 풍부한 마커 유전자를 항재하는 균주에 대해 세포OD(600)의 유의한 감소가 관찰되지 않을 것이다(도1b). 상응하는 아미노산의 추가 수유 후, 희귀 코돈이 풍부한 항생제 내성 유전자를 항용균을 품고 있는 균주에 대한 OD600은 야생형 유전자를 포숙하는 균주의 그 이상에 접근할 것이다(도1c).
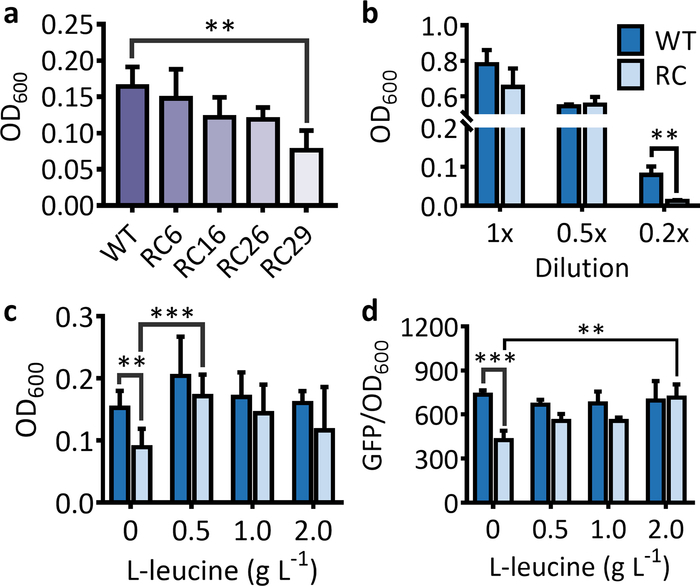
도 1: 선택 및 스크리닝 시스템에 사용되는 마커 유전자의 발현에 대한 희귀 코돈의 효과. (a) 항생저항성 유전자(kan R)를 보유한 대장균 균주에 대한 세포 OD(kan R)를6, 16, 26 및 29류신 레어코돈(RC6, RC16, RC26 및 RC29)을 5시간 후 인큐베이션 한 후 교체한다. (b) 대장균 균주에 대한 세포OD(600)는 5시간 배양 후 1x, 0.5x, 및 0.2x LB 용지로 야생형(WT) 및 희귀 코돈이 풍부한 칸 R(RC)을 포숙한다. (c) L-류신을 배양 5시간 후 류신 희귀 코돈이 풍부한 칸R 유전자를 품고 있는 대장균 균주에 대한 세포 성장에 대한 L-류신을 먹이는 효과. 값과 오류 막대는 평균과 SD(n = 6)를 나타냅니다. L-류신의 수유는 희귀 코돈이 풍부한 칸R을품고 있는 세포에 대한 OD600을 현저하게 증가시하였다. 유일한 예외는 2g·000의 먹이주기였다. L-1 L-류신은 수유 치료를 위한 OD600에서 높은 SD로 인한 것이다. (d) 16시간 배양 후 야생형(WT) 및 류신 희귀코돈 풍부(RC) 유전자로부터의 GFP 발현에 대한 희귀코돈 및 L-류신의 효과. 0.5-2L-1 L-류신의 공급은 희귀 코돈이 풍부한 gfp를 품고 있는 세포에 대한 형광 강도를 현저하게 증가시하였다. 값과 오류 막대는 평균과 SD(n = 3)를 나타냅니다. **P < 0.01, ***P < 0.001 은 2꼬리 t-test에 의해 결정된 바와 같이, 오직 가장 유의한 결과만을 나타내었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
스크리닝 시스템의 경우, 형광 강도와 형광 세포의 수는 야생형 유전자보다 희귀 코돈이 풍부한 유전자로부터 형광 단백질을 발현하는 균주에 대해 현저히 낮을 것이다(도1및 그림2). 보라색 단백질을 사용하는 경우, 희귀 코돈 풍부한 ppg로부터 개발된 색상은 동일한 배양 기간 동안 동일한 조건하에서 발현될때 야생형 유전자로부터보다 가벼워야 한다(도 3). 해당 아미노산의 먹이 희귀 코돈이 풍부한 유전자에서 단백질 발현을 복원합니다. 희귀 코돈이 풍부한 gfp를품고 있는 균주에 대해 형광 강도(도1d)와형광세포의 수(도 2)가 크게 증가하여 야생형 gfp를 함유하는 균주에 접근해야 한다. . 희석되지 않은 LB를 사용할 때, 배지내의 아미노산은 여분의 L-류신 먹이없이도 희귀 코돈이 풍부한 ppg의 느린 발현을 허용하기에 충분할 것이며, 세포가 펠릿되면 표현된 보라색 단백질이 보일 것이다( 그림3). 그러나, 이것은 희귀 코돈이 풍부한 ppg에서 유전자 발현이 2 g에 L-류신을 공급함으로써 극적으로 향상되었다는 사실을 은폐하지 않습니다· L-1,특히 액체 배양에서 관찰될 때(그림 3). 따라서, 액체 배양은 발색성 단백질에 기초한 스크리닝을 위한 더 나은 선택이고, 희석된 LB 배지의 사용은 야생형에 의해 유도된 표현형과 희소코돈이 풍부한 유전자 사이에서 더 유의한 차이를 가져올 것이다.

그림 2: L-류신을 첨가한 후 야생형 Gfp 또는 류신 희귀 코돈이 풍부한 gfp(gfp-RC)를 항하는 형광 대장균 세포의 수. 세포를 1x LB 배지에서 배양하였다. 배율 막대 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 1x LB 배지(왼쪽 패널)에서 보라색 단백질을 인코딩하는 야생형(WT) 및 류신 희귀 코돈이 풍부한(RC) ppg 유전자를 품고 있는 세포에 대한 색개발 및 세포 배양에 대한 L-류신 공급의 효과 ( 오른쪽 패널). ppg 유전자는 세포가 지수 상으로 진입했을 때 유도되었고, 이미지는 유도 후 3시간 동안 포착되었다. L-류신을 수유 분석에서 유도제와 함께 배지에 첨가하였다. 착색된 원은 세포 배양및 세포 펠릿의 색상을 선택하여 생성되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
희소코돈 기지를 둔 전략은 돌연변이 라이브러리에서 표적으로 한 아미노산의 과잉 생산자를 확인할 수 있고, 이 돌연변이체는 부모 긴장보다는 표적으로 한 아미노산의 더 높은 양을 생성해야 합니다 (그림 4).

도 4: 희귀 코돈 기반 전략에 의해 확인된 야생형 및 돌연변이 균주에 의해 생성된 아미노산. (a) 칸 R-RC29(EL-1 to EL-5)와 29및 19류신 희귀 코돈(EL-6 to EL-10)을 각각 항망에 의해 돌연변이 라이브러리로부터 확인된 대장균 균주의 L-류신 생성. (b) 8개의 아르기닌 희귀 코돈(AGG)을 함유한 희귀 코돈이 풍부한 칸R에 의해 선택된 코리네박테리움 글루타미쿰 균주의 L-아르기닌 생산. 마커 유전자는 야생형 균주 ATCC13032로부터 유래된 C. 글루타미쿰 돌연변이 라이브러리내로 도입되었다. 선택 배지는 25 μg·mL-1 카나마이신을 공급한 0.3x CGIII였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
마커 유전자및 선택 또는 스크리닝 배지에서 희귀 코돈의 수는 희귀 코돈 변형 마커 유전자로부터단백질 발현을 억제하는 데 중요하다. 야생형 마커 유전자와 이들의 유도체로부터의 단백질 발현 사이에 유의한 차이가 검출되지 않으면, 희귀 코돈의 수를 증가시키거나 영양분 제한 배지를 사용하여 차이를 증폭시킬 수 있다. 그러나, 억제 효과가 너무 강한 경우, 단백질 발현은 해당 아미노산의 추가 공급에 의해서도 회복되지 않을 수 있다. 이 경우, 마커 유전자의 희귀 코돈의 수는 스트레스의 일부를 완화하기 위해 감소되어야한다. 선택 또는 스크리닝 엄격성을 미세 조정하는 또 다른 방법은 희귀 코돈이 풍부한 마커 유전자의 카피 수 및 발현 수준을 조정하는 것입니다. 마커 유전자의 카피 수 및 발현 수준을 감소시키는 것은 일반적으로 아미노산 과잉 생산자와 초기 긴장 사이 더 강한 분화로 이끌어 냅니다. 따라서, p15A 또는 pSC101과 같은 낮은 카피 수 복제 기원뿐만 아니라 약한 프로모터를 포함하는 벡터를 사용해야 한다. 마커 유전자가 유도성 프로모터에 의해 구동되는 경우, 낮은 유도가 권장됩니다.
아미노산 과잉 생산자에 대한 선택 또는 스크리닝을 위한 희귀 코돈 기반 전략은 외인성 단백질의 발현을 촉진하는 것을 목표로 하는 "코돈 최적화"의 일반적으로 사용되는 전략의 역적응입니다. 코돈 최적화에서, 표적 유전자에 대한 희귀 코돈은 숙주와 관련하여 대명사공통으로 대체된다; 따라서, 다른 유기체에서 유전자는 희소한 코돈19의높은 비율을 가진 그 외인성 유전자 보다는 단백질로 훨씬 더 빨리 번역될 수 있었습니다. 따라서 일반적인 코돈의 동의어인 드문 코돈으로 전환하는 "역최적화"가 유전자 발현을 억제한다고 가정하는 것이 합리적입니다. 그러나, 표적 아미노산이 세포내로 축적될 때, 유전자 발현은 상응하는 희귀 tRNAs의 강화된 충전에 의해 회복되어야 한다. 희귀 코돈의 혼입은 단백질 발현에서 아미노산 농도의 임계값을 증가시켜, 적절한 마커 유전자와 결합될 때 아미노산 과잉 생산자를 선택하거나 선별하는 잠재적인 전략을 제공한다.
항생 저항 유전자, 형광 단백질 유전자 및 프로토콜에 사용된 발색성 단백질 유전자 외에, 다양한 마커 유전자를 사용하여 희귀 코돈 기반 선택 또는 스크리닝 시스템을 확립할 수 있었다. 예를 들면, tolC20 및 sacB21와 같은 치명적인 유전자는 아미노산 과잉 생산자를 선택하기 위하여 이용될 수 있었습니다. 이 경우, 해독제 시스템에 속하는 유전자에 대한 일반적인 코돈은 표적 아미노산의 동의어인 희귀 코돈으로 대체되어야 합니다. 표적 아미노산을 과잉 생산하는 균주는 해독제를 발사할 수 있으며, 따라서 치명적인 유전자에 의해 유도된 독성 효과를 생존할 수 있다.
그것은 부작용 먹이 분석 에서 아미노산의 높은 금액을 사용 하는 경우 발생할 수 있습니다 주목 해야 한다. 이것은 일부 아미노산이 미생물에 독성이 있기 때문입니다. 예를 들어, 약 의 농도 100 mg· L-세린에 대한L-1은 대장균(22)의 성장을 억제할 수 있다. 그러나, 야생 형 유전자의 그것 보다는 더 낮더라도, 우리는 2 g까지 먹이는 것을 것을을 발견했습니다· L-1 L-세린은 여전히 세린 희귀 코돈(13)이 풍부한항생제 내성 유전자의 발현을 회복시킬 수 있었다. 따라서, 아미노산 독성, 적어도 L-세린에 대 한, 공급 분석의 신뢰성을 위태롭게 하지 않을 것 이다. 표적 균주의 생성성에 대한 아미노산 독성의 잠재적 부정적인 영향을 극복하기 위해 무작위 돌연변이 발생 및 아미노산 수출 의 향상(23)과 같은 전략이 적용될 수 있습니다. 사실, 희귀 코돈 기반 방법은 독성 수준 이상의 아미노산을 견디거나 과잉 생산할 수있는 내성 균주를 식별하는 데 적합합니다. 아미노산 내성을 부여하는 주요 돌연변이는 아미노산 과잉 생산자의 구성을위한 이상적인 호스트가 될 대상 균주로 식별되고 도입 될 수 있습니다.
희귀 코돈 기반 선택 또는 스크리닝 시스템은 높은 충실도를 보장합니다. 즉, 시스템에 의해 확인 된 균주는 표적 아미노산의 과잉 생산자로 되어 있다. 그러나, 어떤 경우에는, 항생제 선택에서 살아남은 후보는 모균주보다 표적 아미노산의 더 높은 양을 생산할 수 없다. 이는 돌연변이 발생을 통해 균주에 의해 획득된 항생제 내성 및 그 후 선택플라스미드(24)의 손실에 기인할 수 있다. 결과적으로, 향상 된 아미노산 생성 성 없이 긴장 항생제 스트레스를 살아남을 수 하 고 선택을 탈출. 이러한 거짓 양성 균주는 다른 항생제에 대한 내성을 부여하는 야생형 유전자와 같은 선택 플라스미드에 다른 선택 마커를 삽입함으로써 제거될 수 있다. 선택 플라스미드를 잃은 균주는 두 항생제에 대한 이중 저항성을 얻을 가능성이 적고 선택 중에 제거될 것이다.
희귀 코돈 계 시스템에 의해 확인된 돌연변이는 초기 균주에 비해 표적 아미노산을 과잉 생산할 수 있어야 한다. 그러나, 선택된 균주에 대한 아미노산 생성성은 여전히 산업 적 요구 사항보다 낮을 수 있다. 이것은 균주 성과가 선택 또는 스크리닝 과정의 독립적이기 때문에 희소 코돈 기반 전략의 실패를 제안하지 않지만 초기 균주의 특성, 돌연변이 발생의 접근, 크기의 크기와 같은 요인에 의존합니다. 돌연변이 라이브러리, 및 발효 조건. 높은 생산 균주를 얻기 위해, 이러한 임의의 돌연변이 발생또는 아미노산 생합성 경로의 합리적인 설계를 통해 균주 공학의 전략에주의를 기울여야한다. 적응 형 실험실 진화와 희귀 코돈 기반 전략을 결합하면 아미노산 과잉 생산자를 얻는 것이 용이할 것입니다.
메티오닌과 트립토판은 20 단백질 아미노산 중 대체 코돈이 없습니다. 따라서, 이 전략은 이 아미노산에 직접 이용되지 않을 수 있습니다. 한 가지 가능한 해결책은 이러한 아미노산을 운반하기 위해 정지 코돈들을 인식할 수 있는 엔지니어링된 tRNAs를 사용하는 것입니다. 따라서, 상응하는 스톱 코돈은 이들 아미노산25,26의인공 희귀 코돈으로서 채택될 수 있었다.
아미노산 과잉 생산자의 선택을 위한 종래의 아날로그 기반 전략에 관한 가장 큰 단점중 하나는 높은 거짓 긍정율 5,27이다. 돌연변이 발생을 통과하는 균주는 독성 아미노산 유사체에 대한 저항을 쉽게 얻을 수 있으며, 내성은 돌연변이 유발 물질27의도움없이 획득 될 수도 있다. 이러한 균주는 아미노산 유사체로부터 선택 압력을 쉽게 피할 수 있으며, 결과적으로 선택된 균주는 일반적으로 선택 과정의 효율성을 크게 희생시키는 진정한 아미노산 과잉 생산자가 아닙니다.
대조적으로, 희귀 코돈 기반 전략은 아미노산 과잉 생산자의 정확하고 신속한 식별을 가능하게함으로써 기존의 아날로그 기반 방법을 능가합니다. 우리의 지식에, 이것은 코돈 편견의 자연 법칙을 채택 하는 첫 번째 전략. 그것은 단지 단 하나 희소한 코돈이 풍부한 마커 유전자에 의존하고, 그러므로, 유독한 유사체의 사용을 제거합니다. 마커 유전자는 일반적으로 숙주 균주에 무독성이며, 희귀 코돈이 풍부한 유전자의 단백질 발현은 주로 코돈 편향의 보편적이고 엄격한 법칙 때문에 해당 아미노산의 세포 내 농도에 의존합니다. 모든 종에 걸쳐. 이렇게 하면 균주가 선택 압력을 피할 수 없습니다. 게다가, 마커 유전자의 큰 다양성 때문에, 희소한 코돈 기지를 둔 전략은 아미노산 과잉 생산자의 선택 그리고 검열 둘 다를 위한 각종 선택을 제안할 수 있었습니다.
모든 살아있는 유기체에 있는 코돈 편향의 보편적인 현상 때문에28,희소한 코돈 기지를 둔 선택 또는 검열 전략은 이론적으로 대장균이외에 그밖 미생물, 특히 산업과 그 외에 채택될 수 있었습니다 잠재력. 다른 호스트로 변경할 때, 마커 유전자를 설계하는 데 사용되는 희귀 코돈의 선택은 특정 호스트에 대한 코돈 사용 빈도 및 해당 tRNAs의 풍부도에 기초해야 한다. 선택 또는 선별에 사용되는 매체도 그에 따라 최적화되어야 합니다. 한 가지 예는 아미노산 발효에서 일반적으로 사용되는 C. 글루타미쿰입니다. 8개의 아르기닌 희귀 코돈(AGG)을 함유하는 희귀 코돈 변형 칸R 유전자는 이전 연구13(그림 4b)에 의해 C. 글루타미쿰 L-아르기닌 과잉 생산자를 선택하는 데 효과적인 것으로 나타났다. 희귀 코돈 기반 전략의 탐구는 아미노산 과잉 생산자의 구성과 이해를 용이하게한다. 아미노산 외에도 희귀 코돈 기반 전략은 이소부탄올, 3-메틸-1-부탄놀, 2-메틸-1-부탄올 및 특정아미노산29와동일한 생합성 경로를 공유하는 다른 제품과 함께 사용될 수 있다. 이러한 아미노산의 희귀 코돈 항구 마커 유전자에 의해 확인 된 균주는 전구체 화합물을 과잉 생산할 수 있습니다. 따라서, 희귀 코돈 기반 전략은 이러한 화학 물질을 세포 내 또는 세포 외로 축적하는 균주의 잠재력을 반영하는 간접적이면서도 신속한 방법으로 작용할 수 있습니다. 다양한 과잉 생산자로부터 아미노산 생성성을 증가시키는 주요 돌연변이는 깊은 시퀀싱으로 식별될 수 있으며 아미노산 생산을 더욱 개선하기 위해 산업 균주에 개별적으로 또는 동시에 도입될 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 중국 국립 자연과학 재단(보조금 제21676026호), 중국 국가 핵심 R&D 프로그램(2017YFD0201400), 중국 박사후 과학 재단(2017M620643)이 공동으로 지원했습니다. UCLA 진보 연구소 (소주)의 작품은 장쑤성과 쑤저우 산업 단지의 내부 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo | 51101 | |
| EasyPure HiPure Plasmid MiniPrep Kit | Transgen | EM111-01 | |
| EasyPure Quick Gel Extraction Kit | Transgen | EG101-01 | |
| Gibson assembly master mix | NEB | E2611S | |
| Isopropyl β-D-1-thiogalactopyranoside | Solarbio | I8070 | |
| L-leucine | Sigma | L8000 | |
| Microplate reader | Biotek | Synergy 2 | |
| n-hexane | Thermo | H3061 | |
| Phenyl isothiocyanate | Sigma | P1034 | |
| PrancerPurple CPB-37-441 | ATUM | CPB-37-441 | |
| TransStar FastPfu Fly DNA polymerase | Transgen | AP231-01 | |
| Triethylamine | Sigma | T0886 | |
| Ultra-high performance liquid chromatography | Agilent | 1290 Infinity II | |
| Wild type C. glutamicum | ATCC | 13032 | |
| XL10-Gold E. coli competent cell | Agilent | 200314 | |
| ZORBAX RRHD Eclipse Plus C18 column | Agilent | 959759-902K |
참고문헌
- Tatsumi, N., Inui, M. . Corynebacterium glutamicum: biology and biotechnology. , (2012).
- Tonouchi, N., Ito, H., Yokota, A., Ikeda, M. Present global situation of amino acids in industry. Amino Acid Fermentation. , 3-14 (2017).
- Gusyatiner, M., Lunts, M., Kozlov, Y., Ivanovskaya, L., Voroshilova, E. . DNA coding for mutant isopropylmalate synthase, L-leucine-producing microorganism and method for producing L-leucine. , (2005).
- Park, J. H., Lee, S. Y. Towards systems metabolic engineering of microorganisms for amino acid production. Current Opinion in Biotechnology. 19 (5), 454-460 (2008).
- Norris, R., Lea, P. The use of amino acid analogues in biological studies. Science Progress. , 65-85 (1976).
- Park, J. H., Lee, S. Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering. Applied Microbiology and Biotechnology. 85 (3), 491-506 (2010).
- Bach, T. M., Takagi, H. Properties, metabolisms, and applications of L-proline analogues. Applied Microbiology and Biotechnology. 97 (15), 6623-6634 (2013).
- Crick, F. H. C. On the genetic code. Science. 139 (3554), 461-464 (1963).
- Plotkin, J. B., Kudla, G. Synonymous but not the same: the causes and consequences of codon bias. Nature Reviews Genetics. 12 (1), 32-42 (2011).
- Dittmar, K. A., Sørensen, M. A., Elf, J., Ehrenberg, M., Pan, T. Selective charging of tRNA isoacceptors induced by amino‐acid starvation. EMBO Reports. 6 (2), 151-157 (2005).
- Elf, J., Nilsson, D., Tenson, T., Ehrenberg, M. Selective charging of tRNA isoacceptors explains patterns of codon usage. Science. 300 (5626), 1718-1722 (2003).
- Sørensen, M. A. Charging levels of four tRNA species in Escherichia coli Rel+ and Rel− strains during amino acid starvation: a simple model for the effect of ppGpp on translational accuracy. Journal of Molecular Biology. 307 (3), 785-798 (2001).
- Zheng, B., et al. Utilization of rare codon-rich markers for screening amino acid overproducers. Nature Communications. 9 (1), 3616 (2018).
- Richardson, S. M., Wheelan, S. J., Yarrington, R. M., Boeke, J. D. GeneDesign: rapid, automated design of multikilobase synthetic genes. Genome Research. 16 (4), 550-556 (2006).
- Xiong, A. -. S., et al. PCR-based accurate synthesis of long DNA sequences. Nature Protocols. 1 (2), 791-797 (2006).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Green, M. R., Sambrook, J. . Molecular cloning: a laboratory manual. , (2012).
- Cohen, S. A., Bidlingmeyer, B. A., Tarvin, T. L. PITC derivatives in amino acid analysis. Nature. 320 (6064), 769-770 (1986).
- Zhou, J., Liu, W. J., Peng, S. W., Sun, X. Y., Frazer, I. Papillomavirus capsid protein expression level depends on the match between codon usage and tRNA availability. Journal of Virology. 73 (6), 4972-4982 (1999).
- Gregg, C. J., et al. Rational optimization of tolC as a powerful dual selectable marker for genome engineering. Nucleic Acids Research. 42 (7), 4779-4790 (2014).
- Pelicic, V., Reyrat, J. M., Gicquel, B. Expression of the Bacillus subtilis sacB gene confers sucrose sensitivity on mycobacteria. Journal of Bacteriology. 178 (4), 1197-1199 (1996).
- Avcilar-Kucukgoze, I., et al. Discharging tRNAs: a tug of war between translation and detoxification in Escherichia coli. Nucleic Acids Research. 44 (17), 8324-8334 (2016).
- Mundhada, H., Schneider, K., Christensen, H. B., Nielsen, A. T. Engineering of high yield production of L-serine in Escherichia coli. Biotechnology and Bioengineering. 113 (4), 807-816 (2016).
- Makosky, P. C., Dahlberg, A. E. Spectinomycin resistance at site 1192 in 16S ribosomal RNA of E. coli: an analysis of three mutants. Biochimie. 69 (8), 885-889 (1987).
- Feng, L., Tumbula-Hansen, D., Toogood, H., Söll, D. Expanding tRNA recognition of a tRNA synthetase by a single amino acid change. Proceedings of the National Academy of Sciences of the United States of America. 100 (10), 5676-5681 (2003).
- Naganuma, M., et al. The selective tRNA aminoacylation mechanism based on a single G• U pair. Nature. 510 (7506), 507 (2014).
- Hoesl, M. G., et al. Chemical evolution of a bacterial proteome. Angewandte Chemie International Edition. 54 (34), 10030-10034 (2015).
- Hershberg, R., Petrov, D. A. Selection on codon bias. Annual Review of Genetics. 42, 287-299 (2008).
- Huo, Y. -. X., et al. Conversion of proteins into biofuels by engineering nitrogen flux. Nature Biotechnology. 29, 346 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유