Method Article
Identifier les surproducteurs d'acides aminés à l'aide de marqueurs rares-codon-riches
Dans cet article
Résumé
Cette étude présente une stratégie alternative à la méthode analogique toxique conventionnelle en identifiant les surproducteurs d'acides aminés en utilisant des marqueurs rares-codon-riches pour atteindre la précision, la sensibilité, et le haut débit simultanément.
Résumé
Pour satisfaire le marché toujours croissant des acides aminés, des souches de production de haute performance sont nécessaires. Les surproducteurs d'acides aminés sont identifiés de façon conventionnelle en exploitant les compétitions entre les acides aminés et leurs analogues. Cependant, cette méthode à base analogique est de faible précision, et les analogues appropriés pour les acides aminés spécifiques sont limités. Ici, nous présentons une stratégie alternative qui permet un criblage précis, sensible, et à haut débit des surproducteurs d'acide aminé utilisant des marqueurs rares-codon-riches. Cette stratégie s'inspire du phénomène du biais d'utilisation du codon dans la traduction des protéines, pour lequel les codons sont classés en codons communs ou rares en fonction de leurs fréquences d'occurrence dans l'ADN codant. La traduction des codons rares dépend de leur ARN de transfert rare correspondant (TRNAs), qui ne peuvent pas être entièrement chargés par les acides aminés cognés sous la famine. Théoriquement, les ARNt rares peuvent être facturés s'il y a un surplus des acides aminés après avoir chargé les isoaccepteurs communs synonymes. Par conséquent, les traductions retardées causées par des codons rares pourraient être restaurées par l'alimentation ou la surproduction intracellulaire des acides aminés correspondants. Selon cette hypothèse, un système de sélection ou de dépistage pour identifier les surproducteurs d'acides aminés est établi en remplaçant les codons communs des acides aminés ciblés par leurs alternatives rares synonymes dans les gènes de résistance aux antibiotiques ou les gènes codage des protéines fluorescentes ou chromogéniques. Nous montrons que les expressions protéiques peuvent être grandement entravées par l'incorporation de codons rares et que les niveaux de protéines sont en corrélation positive avec les concentrations d'acides aminés. Grâce à ce système, les surproducteurs d'acides aminés multiples peuvent être facilement éliminés des bibliothèques de mutation. Cette stratégie à base de codon rare ne nécessite qu'un seul gène modifié, et l'hôte est moins susceptible d'échapper à la sélection que dans d'autres méthodes. Il offre une approche alternative pour obtenir des surproducteurs d'acides aminés.
Introduction
La production actuelle d'acides aminés repose fortement sur la fermentation. Cependant, les titers et les rendements de la plupart des souches de production d'acides aminés sont inférieurs à la demande croissante du marché mondial des acides aminés qui vaut des milliards de dollars1,2. L'obtention de surproducteurs d'acides aminés de haute performance est essentielle à la mise à niveau de l'industrie des acides aminés.
La stratégie traditionnelle pour identifier les surproducteurs d'acides aminés exploite les compétitions entre les acides aminés et leurs analogues dans la synthèse des protéines3,4. Ces analogues sont capables de charger les ARNt qui reconnaissent les acides aminés correspondants et inhibent ainsi les allongements des chaînes peptidiques, conduisant à la croissance arrêtée ou la mort cellulaire5. Une façon de résister aux contraintes analogiques est d'augmenter les concentrations d'acides aminés intracellulaires. Les acides aminés enrichis surpasseront les analogues pour les tARN finis et assureront la synthèse correcte des protéines fonctionnelles. Par conséquent, les souches qui survivent aux analogues peuvent être sélectionnées et sont probablement les surproducteurs des acides aminés correspondants.
Bien qu'elle ait réussi à sélectionner des surproducteurs pour des acides aminés tels que l'alucine6, la stratégie analogique souffre de graves inconvénients. Une préoccupation majeure est la résistance analogique provenant du processus de mutagénèse ou par des mutations spontanées. Les souches avec résistance peuvent échapper à la sélection en bloquant, en exportant ou en dégradant les analogues5. Une autre préoccupation est les effets secondaires toxiques des analogues sur d'autres processus cellulaires7. En conséquence, les souches qui survivent à la sélection analogique peuvent ne pas être les surproducteurs d'acides aminés, tandis que les surproducteurs désirés pourraient être faussement exterminés en raison des effets secondaires négatifs.
Ici, une nouvelle stratégie basée sur la loi du biais de codon est présentée afin d'obtenir des identifications précises et rapides des surproducteurs d'acides aminés. La plupart des acides aminés sont codés par plus d'un triplet nucléotide qui est favorisé différemment par les organismes hôtes8,9. Certains codons sont rarement utilisés dans les séquences de codage et sont appelés les codons rares. Leurs traductions en acides aminés s'appuient sur les tARN cognate qui portent les acides aminés correspondants. Cependant, les ARTN qui reconnaissent les codons rares ont généralement des abondances beaucoup plus faibles que les ARNt des codons communs10,11. Par conséquent, ces ARN rares sont moins susceptibles de capturer les acides aminés libres dans les compétitions avec d'autres isoacceptateurs, et les traductions des séquences rares-codon-riches commencent à décélérer ou même sont terminées lorsque les quantités d'acides aminés sont limitées 10. Les traductions pourraient, théoriquement, être restaurées s'il y a un excédent d'acide aminé après avoir chargé les ARTN communes synonymes en raison de surproductions ou d'alimentations supplémentaires des acides aminés correspondants12. Si le gène rare-codon-riche code un marqueur de sélection ou de criblage, les souches présentant les phénotypes correspondants peuvent alors être facilement identifiées et sont probablement les surproducteurs des acides aminés visés.
La stratégie ci-dessus est appliquée pour établir une sélection et un système de dépistage pour l'identification des surproducteurs d'acides aminés. Le système de sélection utilise des gènes de résistance aux antibiotiques (p. ex., kanR) comme marqueurs tandis que le système de dépistage utilise les gènes codant les protéines fluorescentes vertes (p. ex. protéines fluorescentes vertes [GFP]) ou chromogéniques (p. ex., PrancerPurple). Les gènes marqueurs dans les deux systèmes sont modifiés en remplaçant les nombres définis des codons communs pour l'acide aminé ciblé avec son alternative rare synonyme. Les souches de la bibliothèque de mutation qui abritent le gène marqueur rare-codon-riche sont sélectionnées ou examinées dans des conditions appropriées, et les surproducteurs des acides aminés ciblés peuvent être facilement identifiés. Le flux de travail commence par la construction du système génétique marqueur rare-codon-riche, suivi par l'optimisation des conditions de travail, puis l'identification et la vérification des surproducteurs d'acide aminé. Cette stratégie analogue-indépendante est basée sur le dogme dans la traduction de protéine et a été pratiquement vérifiée pour permettre l'identification précise et rapide des surproducteurs d'acide aminé. Théoriquement, il pourrait être directement utilisé pour les acides aminés avec des codons rares et à tous les micro-organismes. Dans l'ensemble, la stratégie basée sur le codon rare servira de solution de rechange efficace à l'approche analogique conventionnelle lorsque les analogues appropriés pour des acides aminés spécifiques ne sont pas disponibles, ou lorsqu'un taux de faux positifs élevé est la principale préoccupation. Le protocole ci-dessous utilise le codon rare de leucine pour démontrer cette stratégie en identifiant les surproducteurs de L-leucine d'Escherichia coli.
Protocole
1. Construction des plasmides exprimant les gènes marqueurs rares-codon-riches
- Sélectionnez un gène marqueur qui contient un nombre approprié de codons communs pour l'acide aminé ciblé.
REMARQUE: Pour l'élucine, le gène de résistance à la kanamycine kanR, qui contient 29 codons de leucine, dont 27 sont des codons communs, est utilisé pour la construction du système de sélection13. Le gène gfp, qui contient 17 codons communs sur 19 codons de leucine, ou le gène pourpre codant en protéines prancerpurple (ppg), qui abrite 14 codons communs de leucine, est utilisé pour le système de criblage (tableausupplémentaire 1 ). - Remplacez les codons communs dans les gènes marqueurs par le codon rare synonyme. Pour L-leucine, remplacer ses codons en kanR, gfp, ou ppg avec le codon rare CTA, générant kanR-Rcs, gfp-RC, ou ppg-RC, respectivement13 ( Tableau supplémentaire 1).
REMARQUE : La fréquence du codon rare dans les gènes marqueurs affectera la rigueur du système de sélection ou de dépistage. En général, l'augmentation du nombre de codons rares augmentera la rigueur du système de sélection ou de dépistage. Pour atteindre la force de sélection ou de criblage appropriée, concevez une série de gènes marqueurs qui hébergent différents nombres de codons rares et comparez leurs effets. - Générer des blocs de construction des gènes marqueurs rares-codon-riches utilisant des outils tels que GeneDesign14 (http://54.235.254.95/gd/) pour la synthèse de gène. Vous pouvez également commander les gènes marqueurs des services commerciaux de synthèse génétique.
- Sur la page GeneDesign, choisissez la conception du bloc de construction (chevauchement de longueur constante).
- Coller les séquences des gènes marqueurs rares-codon-riches dans la boîte de séquence.
- Définir la longueur de chevauchement entre les oligos d'assemblage; gardez à l'esprit que le par défaut 40 bp fonctionne très bien pour la plupart des séquences.
REMARQUE: Voir le manuel en ligne pour plus d'instructions sur les paramètres des autres paramètres. - Cliquez sur le bouton Blocs de construction Design et commandez les oligonucléotides répertoriés sur la page.
- Synthétiser les gènes modifiés par polyminase par réaction en chaîne polymérase (PCR) à base de synthèse précise15.
- Ligate le rare-codon-riche kanR-RC à vector pET-28a, gfp-RC à pSB1C3, et ppg-RC à CPB-37-44116.
REMARQUE : Les cartes plasmides pET-28a et pSB1C3 sont disponibles sur la base de données SnapGene en ligne sur le plasmide (tableausupplémentaire1); la carte du plasmide CPB-37-441 est disponible sur le site Web des protéines chromogéniques ATUM.- Sur la glace, ajouter le vecteur et les fragments de marqueur dans un rapport molaire de 1:1 à 7,5 L de mélange d'assemblage (voir Tableau des matériaux)à un volume total de 10 l. Incuber l'échantillon à 50 oC pendant 1 h.
- Transformer 5 ll du produit d'assemblage en 50 l de cellules compétentes (voir la Table des Matériaux) à 42 oC pour 30 s.
- Récupérer les cellules dans soC (super bouillon optimal avec répression catabolite) moyen à 37 oC pendant 1 h, les plaquer sur LB (bouillon de lysogénie) milieu d'agar, et les incuber à 37 oC pendant la nuit.
- Inoculer la colonie en LB moyen et incuber à 37 oC pendant 8 h.
- Isolez le plasmide à l'aide d'un kit commercial préféré.
2. Optimiser les conditions de sélection
- Faire de la souche parente utilisée pour la mutagénèse en cellules compétentes17.
- Transformez 50 L des cellules compétentes avec 1 l de plasmide qui porte le kanRsauvage, et transformez un autre ensemble de cellules compétentes avec le plasmide contenant kanR-RC29 avec tout codon de leucine remplacé par le rare codon CTA.
- Ajouter 950 oL de SOC moyen et incuber l'échantillon dans un shaker à 250 tr/min à 37 oC pendant 1 h.
- Plaque 100 l de la culture cellulaire sur le milieu d'agar LB contenant 50 'g'mL-1 kanamycin, et l'incuber à 37 oC pendant environ 8 h jusqu'à ce que des colonies apparaissent.
- Choisissez les colonies qui abritent le kanR de type sauvage et le kan R-RC29, riche en codons rares, et utilisez chacune pour inoculer 5 ml de milieu LB dilué par cinq (0,2x LB) contenant 50 'g'mL-1 kanamycine. Incuber les échantillons dans un shaker à 250 tr/min à 37 oC.
REMARQUE : Le support est crucial pour le système de sélection. Il devrait contenir juste assez de carbone et d'azote pour permettre l'expression de la protéine de résistance aux antibiotiques du gène de type sauvage plutôt que des dérivés modifiés par le codon rare. Dans ce cas, la concentration de L-leucine dans le milieu 1x LB est trop élevée pour inhiber complètement l'expression de protéine du kanRrare-codon-riche. Ainsi, un milieu LB dilué avec un facteur de dilution tel que 5 est utilisé pour générer une nette différence dans les expressions protéiques du type sauvage et les gènes rares-codon-riches. - Transférer 200 l de chacune des cultures cellulaires dans une plaque de 96 puits en triplette à des moments définis (p. ex. 8 h, 16 h et 24 h). Mesurer l'OD600 (densité optique à 600 nm) à l'aide d'un lecteur de plaque.
REMARQUE : Si une diminution de la cellule OD600 ne peut pas être détectée pour les souches hébergeant les gènes marqueurs rares-codon-riches en comparaison de l'OD600 de la souche hébergeant les gènes de marqueur sauvage-type, essayez d'augmenter la quantité de codon rare dans le gènes marqueurs ou utiliser un milieu plus dilué. - Effectuer l'analyse d'alimentation en acides aminés pour tester si les expressions des gènes marqueurs rares-codon-riches (par exemple, kanR-RC29) peuvent être restaurées en augmentant la concentration des acides aminés ciblés.
REMARQUE : Pour la sélection des surproducteurs de L-leucine, la L-leucine est utilisée pour l'alimentation.- Inoculer les souches hébergeant le gène marqueur kan R-RC29 en 5 ml de la LB de 0,2x (contenant 50 'g'mL-1 kanamycine) avec ou sans l'approvisionnement de 1 g L-1 L-leucine. Inoculer un autre 5 ml de la LB 0,2x avec des souches qui abritent le kanR de type sauvage comme contrôle. Incuber les échantillons dans un shaker à 250 tr/min à 37 oC.
- Mesurer l'OD600 pour chaque culture à des moments définis (p. ex. 15 h, 17 h, 19 h et 22 h).
3. Optimiser les conditions de dépistage
- Transformez 50 L de la souche parente utilisée pour la mutagénèse avec 1 l de plasmide (50 ng-L-1) qui porte le gfp de type sauvage ou le ppgde type sauvage. En outre, transformer la souche parente avec les dérivés rares-codon-riches des gènes de marqueur.
- Ajouter 950 oL de SOC moyen et incuber l'échantillon dans un shaker à 250 tr/min à 37 oC pendant 1 h.
- Plaque 100 l de la culture cellulaire sur le milieu d'agar LB contenant les antibiotiques appropriés (25 chloramphenicolde gfp portant un marqueur Cm R, ou 50 'g'mL-1 kanamycin pour le ppg plasmide portant un marqueur KanR) et incuber toute la nuit à 37 oC.
- Choisissez une colonie qui abrite le gfp ou le ppg de type sauvage et une colonie qui abrite le dérivé correspondant riche en codon rare, et transférez-les à 5 ml du milieu LB correctement dilué individuellement. Incuber les échantillons dans un shaker à 250 tr/min à 37 oC.
REMARQUE : Pour les souches de E. coli hébergeant la leucine gfp-RC ou ppg-RC,le milieu LB non dilué (1x LB) peut être utilisé pour créer des différences significatives dans les expressions du type sauvage et du marqueur rare-codon-riche Gènes. En outre, les promoteurs inductibles sont utilisés pour conduire les expressions des gènes marqueurs de dépistage. Commencer l'induction lorsque les cellules entrent dans la phase exponentielle pour obtenir de meilleures discriminations. - Pour les marqueurs de fluorescence, transférez 200 l l de chacune des cultures cellulaires dans une plaque noire à fond clair de 96 puits en triplette à des moments définis (p. ex. 2 h, 4 h et 6 h). Mesurer l'OD600 et la fluorescence et calculer l'intensité de fluorescence (le rapport de fluorescence à OD600). Pour les marqueurs chromogéniques, mesurez le développement des couleurs des cultures cellulaires.
REMARQUE : Si des intensités de fluorescence plus faibles ne peuvent pas être détectées pour les souches hébergeant le gfp-RC par rapport à celle des souches abritant le gfpsauvage, ou si une couleur plus claire ne peut pas être détectée pour les cellules exprimant la protéine pourpre du ppg-RC que du gène de type sauvage, essayez d'augmenter le nombre de codons rares sur les gènes marqueurs ou utilisez un milieu plus dilué. - Effectuez le résultat d'alimentation (voir les étapes 2.7.1 et 2.7.2). Mesurer l'intensité de la fluorescence ou le développement des couleurs aux points de temps définis (p. ex., 12 h, 18 h et 24 h).
4. Identification des surproducteurs d'acides aminés
- Inoculer 100 oL de la culture des mutants en 5 ml de milieu LB (2 % v/v) et l'incuber dans un shaker à 250 tr/min à 37 oC jusqu'à ce que les valeurs de l'OD600 atteignent 0,4.
- Faire les mutants dans les cellules compétentes17.
- Transformez 50 L des cellules mutantes avec 1 l du plasmide (50 ng-L-1) portant le marqueur de sélection kanR-RC29 ou les marqueurs de dépistage gfp-RC ou ppg-RC. Ajouter 950 oL de soC moyen et faire pivoter l'échantillon dans un shaker de 37 oC pendant 1 h.
- Sélectionnez les surproducteurs d'acides aminés.
- Centrifuger la culture cellulaire à 4 000 x g pendant 5 min, jeter le supernatant et ajouter 5 ml de milieu LB de 0,2 x LB contenant 50 'g'mL-1 kanamycine. Incuber l'échantillon dans un shaker de 37 oC pendant la nuit.
- Plaquer la culture de la nuit (p. ex., 100 l, dépend de la densité cellulaire de la culture) sur un milieu d'agar LB de 0,2 x LB contenant 50 'g'mL-1 kanamycine et incuber à 37 oC pendant 12 h.
REMARQUE : Les colonies développées sont les candidats des surproducteurs ciblés d'acide aminé et, dans ce cas, les surproducteurs de L-leucine.
- Filtrer les surproducteurs d'acides aminés.
- Plaquer le nombre approprié de cellules (p. ex., 100 l) hébergeant le marqueur de dépistage (tel que décrit à l'étape 4.3) sur le milieu d'agar LB contenant l'antibiotique approprié (25 'g-mL-1 chloramphenicol pour le criblage avec gfp-RC et 50 'g'mL -1 kanamycine pour le dépistage avec ppg-RC) et incuber à 37 oC pendant 8 h.
- Inoculer le milieu LB contenant l'antibiotique approprié (voir l'étape 4.5.1) avec chaque colonie de la plaque. Incuber les échantillons dans un shaker à 250 tr/min à 37 oC.
- Mesurez l'OD600 et la fluorescence et calculez l'intensité de fluorescence si le gfp-RC est utilisé. Mesurer le développement des couleurs des cultures cellulaires si ppg-RC est utilisé. Notez que les souches présentant une intensité de fluorescence plus élevée ou une couleur plus profonde que celle de la souche parente sont les surproducteurs d'acides aminés candidats et, dans ce cas, les surproducteurs de L-leucine.
REMARQUE : Le tri cellulaire activé par la fluorescence convient également à l'identification des producteurs à haute cellule unique lorsque les gènes de protéines fluorescentes riches en codon rare sont utilisés pour le dépistage.
- Vérifier les produits d'acide aminé des souches candidates.
- Inoculer 5 ml de milieu LB avec chacune des souches candidates et laisser les cellules se développer pendant la nuit dans un shaker à 250 tr/min à 37 oC.
- Récolter les cellules à partir de 1 ml de la culture cellulaire par centrifugation à 4 000 x g pendant 2 min. Jeter le supernatant et resuspendre la pastille avec 1 ml d'eau stérile.
- Inoculer 20 ml de milieu M9 contenant 4 % de glucose avec 200 l de la suspension cellulaire et couver dans un shaker de 250 ml à 250 tr/min à 37 oC pendant 24 h.
- Centrifugeuse 1 ml du milieu de culture à 4 000 x g pendant 5 min. Transférer 200 l du supernatant dans un tube propre de 1,5 mL. Préparer des solutions L-leucine (HPLC (chromatographie liquide haute performance) de 0,01, 0,05, 0,1, 0,5 et 1 g L-1 comme normes.
- Ajouter 100 l de 1 mm de triéthylamine et 100 l d'isothiocyanate de phényl à l'isothiocyanate de phényl au supernatant et aux normes, mélangez-les doucement, et incubez-les à température ambiante pendant 1 h18.
CAUTION: Triethylamine et l'isothiocyanate de phényl peuvent causer de graves brûlures de la peau et des lésions oculaires et est nocif s'il est inhalé. Portez des gants et un masque et, si possible, effectuez cette étape dans une hotte de fumée. - Ajouter 400 oL de n-hexane au même tube et le vortex pendant 10 s. Filtrer la phase inférieure contenant les dérivés de l'acide aminé à travers une membrane de polytétrafluoroéthylène de 0,2 m.
CAUTION: n-hexane peut causer une irritation de la peau. Portez des gants et des vêtements de protection. S'il entre en contact avec la peau, rincez la peau avec beaucoup d'eau. - Préparer la phase A mobile en mélangeant 0,1 M d'acétate de sodium (pH 6,5) et l'acétonitrile dans un rapport volumétrique de 99,3:0,7. Préparer l'acétonitrile (80 % v/v) en tant que phase B mobile. Filtrer toutes les phases mobiles à travers des membranes polytétrafluoroéthylène de 0,2 m.
CAUTION: L'acétonitrile est nocif s'il est inhalé et peut causer des irritations de la peau et des yeux. Portez des gants et des vêtements de protection et effectuez cette étape dans une hotte de fumée. - Exécuter 1 ll de l'échantillon sur une colonne ultra-HPLC équipée d'une colonne C18 selon le programme d'élution du tableau 1 avec un débit de 0,42 mL-min-1 et une température de colonne de 40 oC. Détecter les acides aminés ciblés à 254 nm avec un détecteur de tableau de diodes et calculer leurs concentrations en cartographiant les zones de pointe à la courbe standard.
| Temps (min) | Phase A mobile (%) | Phase B mobile (%) |
| 0 (en) | 98 Annonces | 2 (en) |
| 3,5 Annonces | 70 Ans et plus | 30 Ans, états-unis ( |
| 7 Annonces | 43 Ans, états-unis ( | 57 Annonces |
| 7,1 Annonces | 0 (en) | 100 ans |
| 11 Ans, états-unis ( | 98 Annonces | 2 (en) |
Tableau 1 : Programme d'élution pour la quantification des acides aminés.
Résultats
Pour le système de sélection, une forte diminution de l'OD600 pour les souches abritant le gène de résistance aux antibiotiques rare-codon-riche devrait être observée par rapport à la souche hébergeant le gène de résistance aux antibiotiques de type sauvage lorsqu'il est cultivé dans un approprié moyen (Figure 1a). Dans les mêmes conditions, la diminution de la cellule OD600 devient plus évidente à mesure que le nombre de codons rares dans le gène de résistance aux antibiotiques augmente (Figure 1a). Il convient de noter que l'inhibition du codon rare sur les expressions protéiques a principalement lieu dans des conditions de faim. Par conséquent, si le milieu LB n'est pas correctement dilué, aucune diminution significative de la cellule OD600 ne sera observée pour la souche hébergeant le gène marqueur rare-codon-riche en comparaison de la souche hébergeant le gène de type sauvage (figure 1b). Après l'alimentation supplémentaire de l'acide aminé correspondant, l'OD600 pour la souche hébergeant le gène de résistance aux antibiotiques rare-codon-riche augmentera de manière significative et approchera celle de la souche hébergeant le gène sauvage-type (figure 1c).
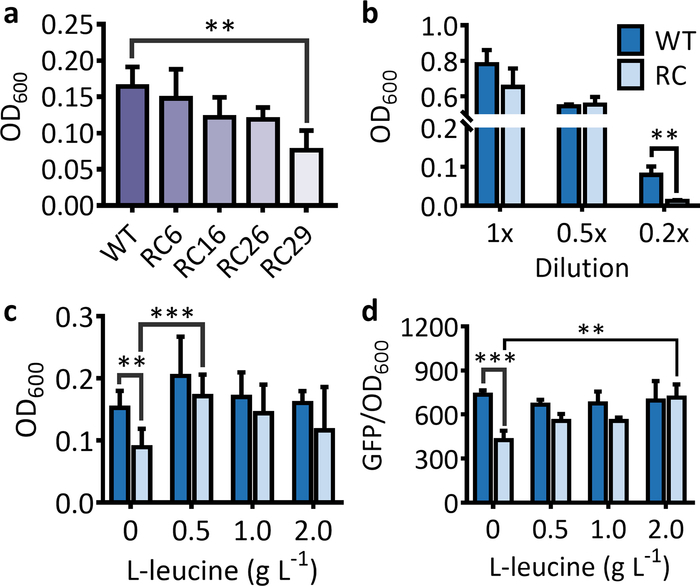
Figure 1 : Effets du codon rare sur l'expression des gènes marqueurs utilisés pour la sélection et les systèmes de dépistage. (a) La cellule OD600 pour une souche E. coli hébergeant le gène de résistance aux antibiotiques ( kanR) avec 6, 16, 26 et 29 leucine rare-codon (RC6, RC16, RC26, et RC29) remplacement après 5 h d'incubation. ( b) La cellule OD600 pour une souche E. coli abritant le type sauvage (WT) et le kan R (RC) rare-codon-riche en 1x, 0.5x, et 0.2x LB médias après 5 h d'incubation. (c) Effets de l'alimentation de L-leucine sur la croissance cellulaire des souches d'E. coli abritant le gène KanR rare-codon-riche après 5 h d'incubation. Les valeurs et les barres d'erreur représentent la moyenne et le SD (n ' 6). L'alimentation de L-leucine a considérablement augmenté l'OD600 pour les cellules abritant le kanRrare-codon-riche. La seule exception a été pour l'alimentation de 2 g L-1 L-leucine due à un SD élevé dans OD600 pour le traitement d'alimentation. d) Effets du codon rare et de la L-leucine se nourrissant des expressions gFP du type sauvage (WT) et des gènes de leucine rare-codon-riche (RC) après 16 h d'incubation. L'alimentation de 0,5 à 2 L-1 L-leucine a considérablement augmenté l'intensité de fluorescence pour les cellules hébergeant le gfp rare-codon-riche. Les valeurs et les barres d'erreur représentent la moyenne et le SD (n ' 3). P lt; 0,01,P et lt; 0,001 selon le test àdeux queues t, et seuls les résultats les plus significatifs ont été présentés. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Pour le système de criblage, l'intensité de fluorescence et le nombre de cellules fluorescentes seront significativement plus faibles pour la souche qui exprime la protéine fluorescente du gène rare-codon-riche que du gène sauvage-type (figure1d et Figure 2). Lors de l'utilisation de la protéine violette, la couleur développée à partir du ppg rare-codon-riche devrait être plus légère que celle du gène sauvage-type lorsqu'elle est exprimée dans les mêmes conditions pour la même période d'incubation (Figure 3). L'alimentation de l'acide aminé correspondant restaurera les expressions protéiques des gènes rares-codon-riches. Pour les souches hébergeant le gfprare-codon-riche, l'intensité de fluorescence (Figure 1d) et le nombre de cellules fluorescentes (figure 2) devraient augmenter de manière significative et approcher celle des souches contenant le gfp sauvage-type . Lorsque la LB non diluée est utilisée, les acides aminés dans le milieu seraient suffisants pour permettre l'expression lente de la ppg rare-codon-riche même sans alimentation supplémentaire de L-leucine, et la protéine pourpre exprimée deviendrait visible une fois que les cellules sont granulées ( Figure 3). Cependant, cela ne cache pas le fait que l'expression des gènes de la ppg rare-codon-riche a été considérablement améliorée par l'alimentation de la L-leucine à 2 g L-1, surtout lorsqu'on l'observe dans la culture liquide (figure 3). Par conséquent, la culture liquide est un meilleur choix pour le criblage basé sur les protéines chromogéniques, et l'utilisation du milieu dilué de LB apporterait une différence plus significative entre les phénotypes induits par le type sauvage et les gènes rares-codon-riches.

Figure 2 : Le nombre de cellules fluorescentes e. coli qui abritent le gfp de type sauvage ou le gfp rare riche en codons de leucine (gfp-RC) après l'ajout de L-leucine. Les cellules ont été cultivées dans le milieu 1x LB. Barre d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Développement de couleurs pour les cellules abritant le type sauvage (WT) et les gènes ppg riches en codons rares (RC) qui codent une protéine violette dans le milieu 1x LB (panneau gauche) et l'effet de l'alimentation de L-leucine sur le développement de couleur de culture cellulaire ( panneau droit). Les gènes de ppg ont été induits quand les cellules sont entrées dans la phase exponentielle et les images ont été capturées 3 h après l'induction. La L-leucine a été ajoutée au milieu avec l'inducteur dans l'alimentation. Les cercles colorés ont été générés en choisissant les couleurs des cultures cellulaires et des granulés cellulaires. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
La stratégie à base de codon rare est en mesure d'identifier les surproducteurs des acides aminés ciblés de la bibliothèque de mutation, et ces mutants devraient produire des quantités plus élevées d'acides aminés ciblés que les souches parentes (Figure 4).

Figure 4 : Les acides aminés produits par les souches de type sauvage et les souches mutées identifiées par la stratégie à base de codon rare. (a) Productions L-leucine de souches d'E. coli identifiées à partir de bibliothèques de mutation par le kan R-RC29 (EL-1 à EL-5) et le gfp-RC qui abrite 29 et 19 codons rares de leucine (EL-6 à EL-10), respectivement. (b) Productions L-arginine de souches de glutamicum De Corynebacterium sélectionnées par le kanR rare-codon-riche, qui a contenu huit codons rares d'arginine (AGG). Le gène marqueur a été introduit dans les bibliothèques de mutation de C. glutamicum dérivées de la souche sauvage ATCC13032. Le milieu de sélection était de 0,3x CGIII fourni avec 25 'g'mL-1 kanamycin. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le nombre de codons rares dans les gènes marqueurs et le milieu de sélection ou de dépistage sont essentiels pour inhiber les expressions protéiques des gènes marqueurs modifiés par le codon rare. Si aucune différence significative ne peut être détectée entre les expressions protéiques des gènes marqueurs de type sauvage et leurs dérivés, l'augmentation du nombre de codons rares ou l'utilisation d'un milieu à teneur en nutriments peut amplifier les différences. Cependant, si l'effet d'inhibition est trop fort, les expressions protéiques peuvent ne pas être récupérées même par l'alimentation supplémentaire des acides aminés correspondants. Dans ce cas, le nombre de codons rares dans les gènes marqueurs devrait être réduit pour soulager une partie du stress. Une autre façon d'affiner la rigueur de sélection ou de dépistage est d'ajuster les numéros de copie et les niveaux d'expression des gènes marqueurs rares-codon-riches. La diminution du nombre de copies et des niveaux d'expression des gènes marqueurs conduit généralement à des différenciations plus fortes entre les surproducteurs d'acides aminés et les souches initiales. Par conséquent, des vecteurs contenant les origines de réplication du nombre de copies basses telles que p15A ou pSC101, ainsi que des promoteurs faibles, devraient être utilisés. Si le gène marqueur est piloté par un promoteur inductible, une faible induction est recommandée.
La stratégie à base de codon rare pour la sélection ou le dépistage des surproducteurs d'acides aminés est une adaptation inverse de la stratégie couramment utilisée d'« optimisation du codon », qui vise à faciliter l'expression des protéines exogènes. Dans l'optimisation de codon, les codons rares sur les gènes ciblés sont remplacés par les communs synonymes en ce qui concerne l'hôte ; ainsi, les gènes d'autres organismes pourraient être traduits beaucoup plus rapidement en protéines que ces gènes exogènes avec des proportions élevées de codons rares19. Par conséquent, il est raisonnable de supposer que l'« optimisation inverse », qui passe les codons communs à leurs rares synonymes, devrait inhiber les expressions génétiques. Cependant, les expressions de gène devraient être reconstituées par la charge accrue des tRNAs rares correspondants quand les acides aminés visés s'accumulent intracellulairement. L'incorporation de codons rares augmente le seuil de la concentration d'acides aminés dans les expressions protéiques, ce qui offre une stratégie potentielle pour sélectionner ou dépister les surproducteurs d'acides aminés lorsqu'ils sont combinés avec les gènes marqueurs appropriés.
Outre les gènes de résistance aux antibiotiques, les gènes des protéines fluorescentes et les gènes de protéines chromogéniques utilisés dans le protocole, divers gènes marqueurs pourraient être utilisés pour établir le système de sélection ou de dépistage à base de codon rare. Par exemple, des gènes mortels tels que tolC20 et sacB21 pourraient être utilisés pour sélectionner les surproducteurs d'acides aminés. Dans ce cas, les codons communs sur les gènes qui appartiennent au système antidote devraient être remplacés par les codons rares synonymes des acides aminés ciblés. Les souches qui surproduisent les acides aminés ciblés sont capables de lancer le système antidote et, par conséquent, survivre aux effets toxiques induits par les gènes mortels.
Il convient de noter que les effets secondaires peuvent se produire lors de l'utilisation de grandes quantités d'acides aminés dans l'alimentation. C'est parce que certains acides aminés sont toxiques pour les micro-organismes. Par exemple, une concentration d'environ 100 mg L-1 pour la L-serine est capable d'inhiber la croissance de E. coli22. Cependant, bien que plus faible que celle du gène de type sauvage, nous avons constaté que l'alimentation jusqu'à 2 g L-1 L-serine pourrait encore restaurer les expressions des gènes de résistance aux antibiotiques qui riches en codon rare serine13. Par conséquent, la toxicité d'acide aminé, au moins pour la L-serine, ne mettrait pas en péril la fiabilité de l'alimentation. Pour surmonter les effets négatifs potentiels de la toxicité d'acide aminé sur les produits des souches ciblées, des stratégies telles que la mutagénèse aléatoire et l'amélioration des exportations d'acides aminés23 pourraient être appliquées. En fait, la méthode à base de codon rare est appropriée pour identifier les souches tolérantes capables de résister ou de surproduire des acides aminés au-dessus des niveaux toxiques. Les mutations clés qui confèrent la tolérance d'acide aminé pourraient être identifiées et introduites dans les souches visées, qui seraient les hôtes idéaux pour les constructions des surproducteurs d'acide aminé.
Le système de sélection ou de dépistage à base de codon rare assure une grande fidélité. En d'autres termes, les souches identifiées par le système sont censées être les surproducteurs des acides aminés ciblés. Cependant, dans certains cas, les candidats qui survivent à la sélection d'antibiotiques ne peuvent pas produire des quantités plus élevées d'acides aminés ciblés que la souche parente. Ceci pourrait être attribué à la résistance aux antibiotiques acquise par les souches par mutagénèse, puis une perte de la sélection plasmide24. En conséquence, les souches sans produits d'acide aminé amélioré pourraient survivre au stress antibiotique et échapper à la sélection. Ces souches faussement positives pourraient être éliminées en insérant un autre marqueur de sélection dans le plasmide de sélection, comme un gène de type sauvage qui confère une résistance à un autre antibiotique. Les souches qui ont perdu le plasmide de sélection sont moins susceptibles d'obtenir une double résistance aux deux antibiotiques et seront éliminées lors de la sélection.
Les mutants identifiés par le système à base de codon rare devraient être en mesure de surproduire les acides aminés ciblés par rapport aux souches initiales. Cependant, les produits d'acide aminé pour les souches sélectionnées peuvent encore être inférieurs aux exigences industrielles. Cela ne suggère pas un échec de la stratégie basée sur le codon rare puisque les performances de la souche sont indépendantes du processus de sélection ou de dépistage, mais dépend de facteurs tels que les caractéristiques de la souche initiale, l'approche de la mutagénèse, la taille de la bibliothèque de mutation, et les conditions de fermentation. Afin d'obtenir des souches à haute production, il convient d'accorder une attention particulière aux stratégies d'ingénierie des souches, par exemple par mutagénèse aléatoire ou par la conception rationnelle des voies biosynthétiques d'acides aminés. La combinaison de l'évolution adaptative du laboratoire et de la stratégie à base de codon rare faciliterait l'obtention de surproducteurs d'acides aminés.
La méthionine et le tryptophane n'ont pas de codons alternatifs parmi les 20 acides aminés protéinogéniques. Par conséquent, cette stratégie peut ne pas être utilisée directement à ces acides aminés. Une solution possible est d'utiliser des ARNt conçus qui sont en mesure de reconnaître les codons d'arrêt pour transporter ces acides aminés. Ainsi, les codons d'arrêt correspondants pourraient être adoptés comme codons rares artificiels de ces acides aminés25,26.
L'une des plus grandes lacunes concernant la stratégie analogique conventionnelle pour la sélection des surproducteurs d'acides aminés est le taux de faux positifs élevé5,27. Les souches qui passent par la mutagénèse pourraient facilement acquérir une résistance envers les analogues toxiques d'acide aminé, et la tolérance peut même être acquise sans l'aide de mutagènes27. Ces souches pourraient facilement échapper aux pressions de sélection des analogues de l'acide aminé et, par conséquent, les souches sélectionnées ne sont généralement pas les vrais surproducteurs d'acides aminés qui sacrifie considérablement l'efficacité du processus de sélection.
En revanche, la stratégie à base de codon rare surpasse la méthode traditionnelle basée sur l'analogique en permettant des identifications précises et rapides des surproducteurs d'acides aminés. À notre connaissance, c'est la première stratégie qui adopte la loi naturelle de la partialité codon. Il ne repose que sur un seul gène marqueur rare-codon-riche et, par conséquent, élimine l'utilisation d'analogues toxiques. Les gènes marqueurs sont généralement non toxiques pour les souches hôtes, et les expressions protéiques des gènes riches en codon rare dépendent principalement des concentrations intracellulaires des acides aminés correspondants en raison de la loi universelle et stricte du biais de codon toutes espèces. Cela empêcherait les souches d'échapper aux pressions de sélection. En outre, en raison de la grande diversité des gènes marqueurs, la stratégie à base de codon rare pourrait offrir divers choix pour la sélection et le dépistage des surproducteurs d'acides aminés.
En raison du phénomène universel de biais de codon dans tous les organismes vivants28, la stratégie de sélection ou de dépistage à base de codon rare pourrait théoriquement être utilisée à d'autres micro-organismes en plus de E. coli, en particulier ceux qui ont des Potentiels. Lors du passage à un hôte différent, le choix des codons rares utilisés pour la conception des gènes marqueurs doit être basé sur les fréquences d'utilisation du codon et l'abondance des ARNt correspondants pour l'hôte spécifique. Le support utilisé pour la sélection ou le dépistage doit également être optimisé en conséquence. Un exemple est le C. glutamicum couramment utilisé dans les fermentations d'acides aminés. Un gène kanR rare-codon-modifié contenant huit codons rares d'arginine (AGG) a été montré efficace en sélectionnant des surproducteurs de L-arginine de C. glutamicum par une étude précédente13 (figure 4b). L'exploration de la stratégie à base de codon rare devrait faciliter la construction et la compréhension des surproducteurs d'acides aminés. Outre les acides aminés, la stratégie à base de codon rare pourrait également être utilisée avec l'isobutanol, 3-méthyl-1-butanol, 2-méthyl-1-butanol, et d'autres produits qui partagent les mêmes voies biosynthétiques avec certains acides aminés29. Les souches identifiées par les gènes marqueurs qui abritent les codons rares de ces acides aminés sont capables de surproduire les composés précurseurs, qui pourraient être canalisés vers la synthèse des dérivés de l'acide aminé. Par conséquent, la stratégie à base de codon rare pourrait servir de méthode indirecte mais rapide pour refléter les potentiels des souches dans l'accumulation de ces produits chimiques soit intra- ou extracellulaire. Les mutations clés qui confèrent des produits accrus d'acide aminé de divers surproducteurs pourraient être identifiées par le séquençage profond et être introduites individuellement ou simultanément dans les souches industrielles pour améliorer davantage les productions d'acides aminés.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les travaux ont été soutenus conjointement par la National Natural Science Foundation of China (subvention no 21676026), le National Key R-D Program of China (grant no 2017YFD0201400) et la China Postdoctoral Science Foundation (subvention no 2017M620643). Les travaux de l'UCLA Institute of Advancement (Suzhou) ont été soutenus par les subventions internes de la province du Jiangsu et du parc industriel de Suzhou.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo | 51101 | |
| EasyPure HiPure Plasmid MiniPrep Kit | Transgen | EM111-01 | |
| EasyPure Quick Gel Extraction Kit | Transgen | EG101-01 | |
| Gibson assembly master mix | NEB | E2611S | |
| Isopropyl β-D-1-thiogalactopyranoside | Solarbio | I8070 | |
| L-leucine | Sigma | L8000 | |
| Microplate reader | Biotek | Synergy 2 | |
| n-hexane | Thermo | H3061 | |
| Phenyl isothiocyanate | Sigma | P1034 | |
| PrancerPurple CPB-37-441 | ATUM | CPB-37-441 | |
| TransStar FastPfu Fly DNA polymerase | Transgen | AP231-01 | |
| Triethylamine | Sigma | T0886 | |
| Ultra-high performance liquid chromatography | Agilent | 1290 Infinity II | |
| Wild type C. glutamicum | ATCC | 13032 | |
| XL10-Gold E. coli competent cell | Agilent | 200314 | |
| ZORBAX RRHD Eclipse Plus C18 column | Agilent | 959759-902K |
Références
- Tatsumi, N., Inui, M. . Corynebacterium glutamicum: biology and biotechnology. , (2012).
- Tonouchi, N., Ito, H., Yokota, A., Ikeda, M. Present global situation of amino acids in industry. Amino Acid Fermentation. , 3-14 (2017).
- Gusyatiner, M., Lunts, M., Kozlov, Y., Ivanovskaya, L., Voroshilova, E. . DNA coding for mutant isopropylmalate synthase, L-leucine-producing microorganism and method for producing L-leucine. , (2005).
- Park, J. H., Lee, S. Y. Towards systems metabolic engineering of microorganisms for amino acid production. Current Opinion in Biotechnology. 19 (5), 454-460 (2008).
- Norris, R., Lea, P. The use of amino acid analogues in biological studies. Science Progress. , 65-85 (1976).
- Park, J. H., Lee, S. Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering. Applied Microbiology and Biotechnology. 85 (3), 491-506 (2010).
- Bach, T. M., Takagi, H. Properties, metabolisms, and applications of L-proline analogues. Applied Microbiology and Biotechnology. 97 (15), 6623-6634 (2013).
- Crick, F. H. C. On the genetic code. Science. 139 (3554), 461-464 (1963).
- Plotkin, J. B., Kudla, G. Synonymous but not the same: the causes and consequences of codon bias. Nature Reviews Genetics. 12 (1), 32-42 (2011).
- Dittmar, K. A., Sørensen, M. A., Elf, J., Ehrenberg, M., Pan, T. Selective charging of tRNA isoacceptors induced by amino‐acid starvation. EMBO Reports. 6 (2), 151-157 (2005).
- Elf, J., Nilsson, D., Tenson, T., Ehrenberg, M. Selective charging of tRNA isoacceptors explains patterns of codon usage. Science. 300 (5626), 1718-1722 (2003).
- Sørensen, M. A. Charging levels of four tRNA species in Escherichia coli Rel+ and Rel− strains during amino acid starvation: a simple model for the effect of ppGpp on translational accuracy. Journal of Molecular Biology. 307 (3), 785-798 (2001).
- Zheng, B., et al. Utilization of rare codon-rich markers for screening amino acid overproducers. Nature Communications. 9 (1), 3616 (2018).
- Richardson, S. M., Wheelan, S. J., Yarrington, R. M., Boeke, J. D. GeneDesign: rapid, automated design of multikilobase synthetic genes. Genome Research. 16 (4), 550-556 (2006).
- Xiong, A. -. S., et al. PCR-based accurate synthesis of long DNA sequences. Nature Protocols. 1 (2), 791-797 (2006).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Green, M. R., Sambrook, J. . Molecular cloning: a laboratory manual. , (2012).
- Cohen, S. A., Bidlingmeyer, B. A., Tarvin, T. L. PITC derivatives in amino acid analysis. Nature. 320 (6064), 769-770 (1986).
- Zhou, J., Liu, W. J., Peng, S. W., Sun, X. Y., Frazer, I. Papillomavirus capsid protein expression level depends on the match between codon usage and tRNA availability. Journal of Virology. 73 (6), 4972-4982 (1999).
- Gregg, C. J., et al. Rational optimization of tolC as a powerful dual selectable marker for genome engineering. Nucleic Acids Research. 42 (7), 4779-4790 (2014).
- Pelicic, V., Reyrat, J. M., Gicquel, B. Expression of the Bacillus subtilis sacB gene confers sucrose sensitivity on mycobacteria. Journal of Bacteriology. 178 (4), 1197-1199 (1996).
- Avcilar-Kucukgoze, I., et al. Discharging tRNAs: a tug of war between translation and detoxification in Escherichia coli. Nucleic Acids Research. 44 (17), 8324-8334 (2016).
- Mundhada, H., Schneider, K., Christensen, H. B., Nielsen, A. T. Engineering of high yield production of L-serine in Escherichia coli. Biotechnology and Bioengineering. 113 (4), 807-816 (2016).
- Makosky, P. C., Dahlberg, A. E. Spectinomycin resistance at site 1192 in 16S ribosomal RNA of E. coli: an analysis of three mutants. Biochimie. 69 (8), 885-889 (1987).
- Feng, L., Tumbula-Hansen, D., Toogood, H., Söll, D. Expanding tRNA recognition of a tRNA synthetase by a single amino acid change. Proceedings of the National Academy of Sciences of the United States of America. 100 (10), 5676-5681 (2003).
- Naganuma, M., et al. The selective tRNA aminoacylation mechanism based on a single G• U pair. Nature. 510 (7506), 507 (2014).
- Hoesl, M. G., et al. Chemical evolution of a bacterial proteome. Angewandte Chemie International Edition. 54 (34), 10030-10034 (2015).
- Hershberg, R., Petrov, D. A. Selection on codon bias. Annual Review of Genetics. 42, 287-299 (2008).
- Huo, Y. -. X., et al. Conversion of proteins into biofuels by engineering nitrogen flux. Nature Biotechnology. 29, 346 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon