Method Article
Medições automatizadas do sono e da atividade locomotora em Cavefish mexicano
Neste Artigo
Resumo
Este protocolo detalha a metodologia para quantificar o comportamento locomotor e sono na mexicana cavefish. Análises anteriores são ampliadas para medir esses comportamentos socialmente alojados em peixes. Este sistema pode ser amplamente aplicado para estudar o sono e a atividade em outras espécies de peixes.
Resumo
Em filos, sono é caracterizado por altamente conservadas características comportamentais que incluem o limiar de excitação elevado, rebote após privação de sono e consolidaram a períodos de imobilidade comportamental. O mexicano cavefish, Astyanax mexicanus (a. mexicanus), é um modelo para estudar a evolução do traço em resposta à perturbação ambiental. A. mexicanus existir como formas de superfície-moradia olhos e várias populações de cavernas cegas que apresentam diferenças morfológicas e comportamentais robustas. Perda de sono tem ocorrido em várias populações cavefish evoluiu de modo independente. Este protocolo descreve uma metodologia para quantificação de sono e atividade locomotora na . mexicanus caverna e peixe de superfície. Um sistema de monitoramento de vídeo econômico permite comportamental de imagem de peixe de larvas ou adultos alojados individualmente por períodos de uma semana ou mais. O sistema pode ser aplicado a pescar envelhecido 4 dias pós fertilização através da vida adulta. A abordagem também pode ser adaptada para medir os efeitos de interações sociais no sono, gravando vários peixes em um único arena. Na sequência de gravações comportamentais, dados são analisados usando automated software de rastreamento e análise do sono é processada usando scripts personalizados que quantificam múltiplas variáveis de sono, incluindo duração, comprimento de tal e tal número. Este sistema pode ser aplicado a medida de sono, comportamento circadiano e atividade locomotora em quase qualquer espécie de peixe, incluindo zebrafish e famílias.
Introdução
Sono é altamente conservado em todo o reino animal nos níveis fisiológicos, funcionais e comportamentais1,2,3. Enquanto o sono em animais de laboratório mamíferos normalmente é avaliado por meio de eletroencefalogramas um e outro, gravações eletrofisiológicas são menos práticas em sistemas de pequeno modelo geneticamente favoráveis e assim o sono normalmente é medido com base no comportamento3 , 4. características comportamentais associadas com o sono são altamente conservadas em todo o reino animal e incluem o limiar de excitação aumentada, reversibilidade com estimulação e prolongada quiescência comportamental5. Estas medidas podem ser usadas para caracterizar o sono nos animais que vão desde o verme nematoide, c. elegans, através de de seres humanos6.
O uso de quiescência comportamental para caracterizar o sono requer software de rastreamento automatizado. Com software de rastreamento, períodos de actividade e imobilidade são detectados durante um número de dias, e longos períodos de inatividade são classificados como dormir7,8. Nos últimos anos, foram desenvolvidos vários sistemas de rastreamento para a aquisição de dados de atividade entre uma diversidade de sistemas de pequeno modelo geneticamente favorável; incluindo os vermes, moscas de fruta e peixe9,10,11. Estes programas são acompanhados por um software que permite o rastreamento automatizado do comportamento animal, incluindo ambos freeware de código aberto e software comercialmente disponível7,12,13,14 . Esses sistemas diferem em sua flexibilidade e permitem eficiente triagem e caracterização de fenótipos de sono em numerosos modelos geneticamente alteráveis.
Investigação genética de sono no peixe-zebra, Danio rerio, levou à identificação de vários genes e circuitos neurais que regulam o sono15,16. Enquanto isso forneceu um poderoso sistema para investigar a base neural do sono em um animal de laboratório de vertebrados, é muito menos conhecida sobre como sono evolui e como natural variação contribui para dormir o regulamento. O mexicano cavefish, Astyanax mexicanus (A. mexicanus), evoluíram dramáticas diferenças no sono, atividade locomotora e ritmos circadianos17,18. Estes peixes existem como olhos superfície peixes que habitam os rios do México e sul do Texas e pelo menos 29 da caverna das populações em torno da região de Sierra Del Abra de México nordeste19,20,21. Notavelmente, muitas diferenças comportamentais, incluindo a perda de sono, parecem ter surgido independentemente em vários cavefish populações14,22. Portanto, cavefish fornecer um modelo para investigar a evolução convergente de sono, circadiano e comportamentos sociais.
Este protocolo descreve um sistema de medição do sono e comportamento locomotor na . mexicanus larvas e adultos. Um sistema de gravação baseado em infravermelho Custom-Built permite a gravação de vídeo de animais em condições claras e escuras. Software disponível comercialmente pode ser usado para medir a atividade e macros personalizadas são usadas para quantificar os diversos aspectos de inatividade e determinar os períodos de sono. Este protocolo descreve também modificações experimentais para controlar a atividade de vários animais dentro de um tanque, fornecendo a capacidade de analisar as interações entre o sono e comportamentos sociais. Estes sistemas podem ser aplicados a medida de sono, comportamento circadiano e atividade locomotora em espécies de peixe adicionais incluindo zebrafish e famílias.
Protocolo
Nota: Criar sistemas de controle comportamental em larvas e adultos.
1. construir um sistema de sono para larvas
Nota: O sistema de monitoramento para controle larval através de juvenis com idades entre 4 dias pós fertilização (dpf) através do dpf 30 a. mexicanus requer várias peças de equipamento, incluindo iluminação infravermelha (IR), luz difusores de acrílico IR, automatizado luz controles (temporizadores), computadores, câmeras e materiais secundários, tais como a fiação e controladores de potência (figura 1A). As instruções a seguir informará como construir um sistema para controlar com precisão o comportamento locomotor para estudar o sono e os ritmos circadianos em larval a. mexicanus.
- Construir um sistema de iluminação consiste em IR e luz branca, emitindo-se diodos (LED): Coloque três luzes de IR em um triângulo aproximadamente 7,62 cm uns dos outros em uma plataforma de metal fino de 30,5 cm x 30,5 cm dissipador de calor. Luzes na série do fio com fio elétrico e se conectar a uma fonte de energia.
- Coloque uma única luz branca LED no centro das três luzes IR e anexá-los à fonte de energia.
- Conecte a fonte de energia para o LED de luz regulado para um tempo padrão circadiano.
- Construa uma plataforma para o sistema de rastreamento larval. Use o acrílico grosso branco sinal de 0,33 cm para todos os componentes da plataforma.
- Coloque a plataforma de gravação em cima do dissipador de calor quadrado iluminado no quais arenas que contenha peixes residirá durante acompanhamento comportamental.
-
Coloque um segundo acrílico dentro da caixa entre as luzes e os animais para difundir o IR para a iluminação ideal e contraste.
Nota: as dimensões para a caixa de luz larval é a seguinte: dois 18 x 8,5 cm e dois 17 x 8,5 cm LEDs que são quimicamente ligados para formar um 18 x 18 cm quadrado que é de 8,5 cm de altura. Além disso, acrílico pode ser facilmente cortado ou perfurados utilizando as ferramentas apropriadas para dimensionamento personalizado.- Coloque o palco inteiro controle larval e instalação de luz dentro de um tubo de plástico fechado e em seguida, posicione a câmera no topo do tubo.
Nota: É importante manter a reflexões de iluminação de aparecer no vídeo do rastreamento, como isto prejudicará a precisão de rastreamento. A colocação de câmeras em cima de um tubo que envolve plataforma melhora a iluminação e nitidez para as câmeras que são usados para estes experimentos.
- Coloque o palco inteiro controle larval e instalação de luz dentro de um tubo de plástico fechado e em seguida, posicione a câmera no topo do tubo.
- Manipular um webcam (ver Tabela de materiais) para gravação baseada em IR. Remover a lente do fabricante usando uma ferramenta rotativa (ver Tabela de materiais).
- Remova os parafusos pequenos prateado nas laterais traseiras da câmara para remover a carcaça interna.
- Remova os parafusos pretos pequenos dentro do corpo da câmera para soltar o restante da lente. Use uma pequena chave de fenda para remover quaisquer partes do corpo da lente que resta após o corte da lente.
- Remover o LED azul na parte superior do que o cobrado acoplado a carcaça do dispositivo (CCD).
- Colocar a câmera de volta juntos, colocando a carcaça interna voltar à sua orientação original e aparafusar os dois parafusos de prata volta para sua posição original.
- Rota do interior da câmera usando um pequeno vi para caber com um pouco de roteamento plástico arredondado. Liso para baixo o plástico extra até pode caber um adaptador de lente.
- Instale um filtro IR-pass dentro da câmera tão perto o CCD quanto possível, sem fazer contato direto com a câmera.
Nota: Tome cuidado para não danificar o chip CCD dentro da caixa da câmera. Certifique-se de manter o corte como nível possível. Sele qualquer espaço aberto entre o exterior do filtro IR e o corpo da câmera para impedir que a luz atingindo o CCD sem ser filtrado. - Anexar a câmera com uma lente de 35mm fixada (ver Tabela de materiais), enroscando o adaptador na parte da frente da câmera na parte de trás da lente.
- Coloque a câmera ea lente no buraco perfurado a tampa no topo do tubo que abriga o palco e luzes e conecte o cabo USB para o computador de que os animais serão gravados.
Nota: Coloque o peixe em um quarto de comportamento que é separado do onde peixes conservados em estoque estão alojados para garantir interferências mínimas durante gravações comportamentais. Ter cuidado para minimizar as flutuações de temperatura e ventilação que pode confundir experimentos comportamentais.
2. sistema de dormir para adultos
- Construa um sistema de iluminação IR para acompanhamento de peixe adulto por um corte tiras de IR a intervalos de aproximadamente 46 cm. Uma tira de 46 cm é suficiente para cada tanque de comportamento de 10 L.
- Cada tira juntos em uma série, cada tira de fio elétrico DC de solda do fio e conectar a uma fonte de alimentação 9 V.
- Anexe cada tira de IR a uma peça de 51 cm x 5,1 cm de alumínio que atuará como um dissipador de calor.
- Coloque uma 46 cm x 5 cm, 0,32 cm espessura 9% passa-luz branco sinal acrílico folha diretamente na frente de cada faixa de luz IR para difundir o IR luz.
- Coloque todos os tanques em uma cremalheira que ofereça suporte a iluminação de IR montado na parte traseira.
- Use divisores de plástico opacos em tanques de vidro de 10 L para criar arenas individuais.
Nota: O tamanho da arena pode ser variado com base no número de divisores usados e o tamanho do tanque. Tamanho de Arena impacto atividade locomotora e dormir na caverna e superfície peixe23. - Monte câmeras aproximadamente 4-6 m de tanques. Cada câmera pode gravar normalmente de 3 tanques de cada vez para fornecer resolução suficiente para rastreamento.
Nota: Gravações comportamentais adultas geralmente não necessitam de um sistema de iluminação branca separada para controlar alterações de dia-noite. Simplesmente utilizando padrão luzes aéreas num quarto comportamental ligado a um temporizador é provável que seja suficiente.
3. gravação atividade locomotora
Nota: Todas as gravações comportamentais são feitas usando um padrão de notebook ou desktop com uma fonte de bateria de backup. Devido ao grande tamanho do arquivo de uma gravação (60-100 GB) 24h, salve todas as gravações em discos rígidos externos.
- ACCLIMATE dpf de idades 4-30 peixes para 18-24 h antes de iniciar as gravações. Alimento larval peixe com camarão de água salgada ao vivo quando o primeiro colocado na câmara de gravação e 1h antes de começar a gravação. Aclimatar o peixe adulto 4-5 dias antes da gravação de comportamento e alimentar uma vez por dia, com comida de floco ou com blackworms ao vivo.
Nota: Certifique-se de colocar larval peixe em água doce, antes da gravação, como restos de artémia causará problemas de rastreamento durante a análise posterior. Co de cultivo com rotíferos fornece uma opção alternativa, como seu tamanho pequeno não interfere com o rastreamento. - Lugar de peixe com idades entre 4-6 dpf em placas de cultura de tecidos de 24-bem. Peixes casa com idades entre 20-30 dpf em placas de cultura de tecidos de 12 poços para gravação.
- Discos adultos em tanques de 10 L cabem com divisórias para acomodar cinco peixes alojados individualmente, ou sem divisórias para registro sono e atividade em um ambiente social.
Nota: Tome cuidado para o foco da câmera antes de iniciar a gravação, a fim de maximizar a precisão de rastreamento. Não abra a íris da lente da câmara longe demais, porque isto reduziria drasticamente a nitidez da imagem. Há um equilíbrio, no entanto; se a íris está fechada longe demais, a taxa de quadros do vídeo vai cair abaixo de 15,00 fps. É essencial para uma análise posterior, que a taxa de quadros permanece 15,00 frames por s para uso com algum sono personalizada roteiro23,24. - Conjunto de iluminação/brilho Iluminações de fundo.
- Otimize a iluminação antes do início da gravação. Sempre manter o contraste ao mais alto nível possível e usar o brilho e a Iluminação de fundo para ajustar o brilho, até os animais são mais claros.
- Registro peixe para 24 ou 48 h.
Nota: Pacotes de bateria de backup de emergência de energia toda a iluminação, computadores e câmeras devem ser comprados em caso de falta de energia. Todos os packs de bateria também devem ser ligados em tomadas de energia de emergência, se possível. Packs de bateria geralmente não irão alimentar o equipamento por mais de alguns minutos a uma hora no máximo e servir de ponte entre a perder energia principal e transferência para o sistema de energia de emergência.
4. análise da atividade locomotora em individualmente alojado peixe usando Automated Software de rastreamento
- Para começar a análise do comportamento, abra o software de rastreamento, selecionar Novo experimento do modelo, selecione aplicar um modelo de predefinidos.
- Como o programa agora vai perguntar de que espécie de rastrear, selecione peixes. Use a caixa suspensa para selecionar qualquer Zebrafish larvas de Zebrafish adulto , dependendo do paradigma experimental.
- Configure as arenas em que cada animal será rastreada. Para larvas, selecione bem a placa, bem redonda e No modelo de zona. Para adultos, use o campo aberto, Praça com Modelo de zona não. Em seguida, determine o número adequado de arenas, um para cada animal que está sendo controlado no vídeo.
- Selecione o modelo ideal de controle, clique em rastrear ponto central , e certifique-se de que a cor do animal é selecionada para ser mais escura do que o plano de fundo. Aplica a taxa de quadros em que o vídeo foi adquirido. O software de rastreamento deve detectar automaticamente isto.
- Desenhe uma escala para calibrar a distância do mundo real de um objeto para determinar com precisão o comportamento locomotor do peixe usando Configurações de Arena.
- Editar as arenas para certificar-se de que toda a área em que os peixes estão em será rastreada; caso contrário as amostras serão perdidas durante a aquisição.
Nota: Tenha cuidado ao configurar áreas. Larval peixe especialmente é sensíveis a erros de rastreamento se as arenas são demasiado grande ou pequeno. Má iluminação no experimento também pode criar sombras nas paredes de placas bem, que o programa pode pensar que é um animal, criando um falso positivo. - Clique em avançado. Em método na Deteção de configuração, selecione Subtração dinâmico, em seguida, clique em plano de fundo e selecione Iniciar aprendizagem. Ajuste a relação de sinal/ruído de contraste escuro até os animais estão sendo controlados bem, e o plano de fundo não está causando o rastreamento saltar.
Nota: Qualidade de vídeo pode variar entre experiências, assim cada julgamento pode precisar de usar configurações diferentes, nesse sentido. Usando os recursos de Assunto contorno e Tamanho do assunto pode melhorar significativamente os resultados do rastreamento. - Selecione a lista de julgamento e carregar os parâmetros adequados antes de começar a gravar os dados no programa.
- Clique na guia de aquisição , selecione Planejado todos os ensaios de pista e clique no botão gravar.
- Em Análise de perfil, certifique-se de distância e tempo e movimento são selecionados.
Nota: Em ordem para posterior análise de sono, é essencial que essas configurações estão corretas, como o .perl arquivo deve ler estes dados na ordem correta para calcular o sono. - Em exportar, selecione Dados brutos, exportar os dados como texto Unicode.
5. rastreamento socialmente alojado peixe
- Siga os passos 4,1-4,4 para configurar a experiência do software de rastreamento.
- No menu suspenso, selecione quantos animais para acompanhar o experimento.
- Em configurações de Arena , desenhe a escala correta para calibrar a distância do mundo real.
- Em configurações de deteção , usar Subtração dinâmicoe ajustar o contraste escuro para melhor controlar o animal.
- Ajuste o tamanho de tema sob as configurações de deteção, para que somente uma porção muito pequena do animal é controlada.
Nota: Seguindo apenas uma pequena parte do animal, isto irá reduzir a quantidade de comutação entre os animais quando eles cruzam durante a aquisição. - Uma vez que as faixas são adquiridas, use o Editor de pistas para corrigir manualmente vezes onde o peixe pode cruzar.
6. a extração de dados do sono de atividade locomotora
Nota: A definição comportamental de sono em larvas e adultos a. mexicanus é 1 min ou mais de quiescência. Esta definição foi determinada usando experimentos de limiar de excitação, onde um maior estímulo sensorial é necessária para iniciar uma resposta comportamental em um estado de sono (> 60 s) comparado ao acordar14,17. Conta para pequenos movimentos e deriva comum para os ciprinídeos, há limites de velocidade são aplicados para segregar o movimento real do ruído ou deriva. Estes limites são computacionalmente-derivado comparando as correlações entre distância e duração de sono para encontrar os valores de R-quadrado mais altos; desse modo, determinar a velocidade mais precisa para o movimento e sono. Para peixes larvas, os limites superiores e inferiores são ambos 12 mm/s como lá é pouca ou nenhuma tração. Para peixes adultos o limite inferior é de 2 cm/s, com um limite máximo de 4 cm/s para conta para drift.
- Instale o Cygwin ao computador para realizar a execução dos scripts personalizados para extrair locomotor e dormir comportamento análise.
- Crie uma nova pasta de experiência dentro do diretório home do Cygwin.
- Importar os dados brutos de Unicode do software de rastreamento e executar o arquivo. sh no Cygwin para converter a codificação UTF-16, UTF-8.
- Execute o arquivo .perl no Cygwin para extrair os dados do sono.
- Abra o arquivo de macro e siga as instruções dentro da planilha para finalizar a análise de dados conforme desejado.
Nota: Um nível básico de codificação de linha de comando será necessário para realizar esta parte da análise. Comandos Linux geral serão suficiente. Se houver problemas com os programas de leitura de dados corretamente, verifique os dados do software em qualquer editor de texto livremente disponível de rastreamento para verificar a codificação e ordem está correta para os executáveis escrever corretamente.
Resultados
Idades de larvas que DPF 4-30 pode confiantemente ser registados no sistema fechado personalizado-Compilação descrito na Figura 1. O sistema inclui IR e iluminação visível para permitir gravações em condições claras e escuras, sob diferentes condições de luz visíveis (figura 1A). Os vídeos são então analisaram usando software de rastreamento (figura 1BC) e pós-processados usando uma macro personalizada sono (ver Download suplementar). Larval peixes de três populações independentes cavefish exibir uma redução significativa no sono em relação ao peixe de superfície (Figura 1) e 20 dpf, e esta perda de sono é consistente em estádios de desenvolvimento. A idade do peixe analisado para dormir é muitas vezes dependente da manipulação experimental. Por exemplo, a. mexicanus não consomem alimentos em 4 dias, então experimentos examinar interações entre o sono e a alimentação normalmente ocorreria em mais velho larvas25. Por outro lado, morpholinos só são eficazes em início frite (normalmente menos de 4 dpf) para que esta idade é usado para bundas sono24,26,27.
A. mexicanus pode viver até 30 anos em laboratório, mas experimentos usando adultos normalmente são realizados em peixes, com idades entre 6 meses a 3 anos. Peixes podem ser gravadas em uma variedade de tamanhos de tanque, dependendo do experimento e iluminação IR permite gravações durante períodos de claro e escuros (Figura 2A). Arenas individuais são rotulados em rastreamento para permitir rastreamento de peixe, e pós-processamento usando uma macro personalizada fornece uma leitura de sono (Figura 2BC). Sono é significativamente reduzido no cavefish Pachón, Molino e Tinaja, comparado com peixes de superfície (Figura 2D). Além disso, este sistema permite a gravação vários peixes em um único arena (tipicamente galão 10 tanques), permitindo a análise de interações sociais como afetam o sono (Figura 2EF). Habitação social robustamente reduz o sono em peixes de superfície, sem afetar o sono em Pachón cavefish (Figura 2). A falta de efeito no cavefish é provavelmente devido a um efeito de porão, onde cavefish dormir pouco, particularmente nas maiores arenas usados para examinar o comportamento social.
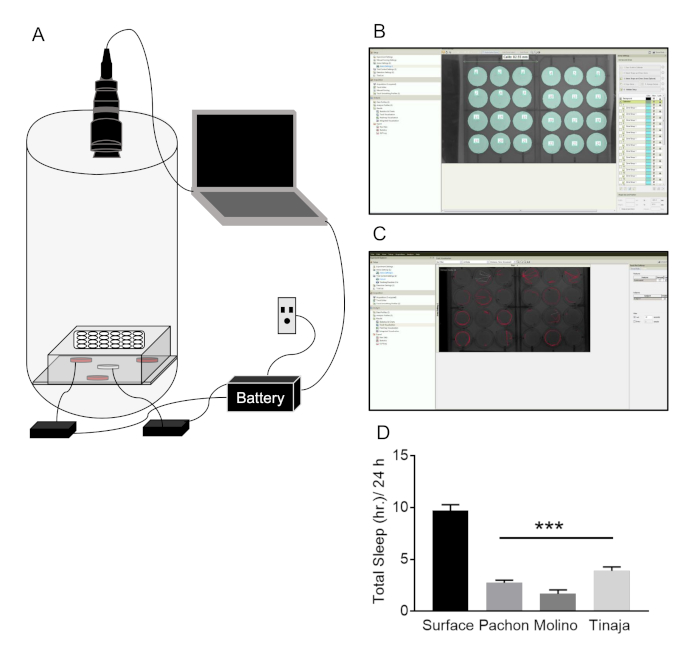
Figura 1: Comportamento de sono de gravação em larvas e juvenis a. mexicanus. (A) esquema de instalação do comportamento de sono larval: Larva são colocados em uma plataforma dentro de um tubo de luz controlada. Sistemas de iluminação de infravermelho e branco sente-se abaixo o peixe no fundo do tubo. Uma câmera IR-pass fica no topo do tubo e está conectada a um computador portátil em que o vídeo é gravado. Todos os sistemas de energia (iluminação e laptop) estão ligados à energia de reserva. (B) configurações de Arena em software de rastreamento. As larvas individuais são mantidas em poços de uma placa de cultura de tecidos, e arenas (ciano) são feitos para cada animal. (C) Aparelho Locomotor traços de comportamento locomotor do peixe após adquirir os dados no software de rastreamento. Traços vermelhos representam 10 s de atividade em peixes 20 dias de idade. (D) resultando dormir dados do software de rastreamento. Cavefish juvenil converge para comportamento de sono reduzida, comparado a peixes de superfície morfos (One-Way ANOVA F(3, 116) = 76.12; Análise post-hoc de Dunnett foi aplicado para comparar cada população cavefish com peixes de superfície, P < 0,001). Clique aqui para ver uma versão maior desta figura.

Figura 2: Sistema de adulto a. mexicanus para sono e comportamento circadiano. (A) diagrama do sistema de sono-gravação: peixes são mantidos em tanques em uma cremalheira em frente das câmeras de monitoramento. Um sistema de iluminação infravermelha é colocado atrás dos tanques de peixe, enquanto Câmeras IR-pass estão conectadas a um computador portátil para gravação de comportamento. Todos os sistemas de alimentação estão conectados a um sistema de bateria de backup em caso de flutuações de energia. Arena (B) configuração no software de rastreamento. Peixes individuais são marcados por criando arenas separados (ciano) para controlar o comportamento locomotor. (C) representante locomotoras faixas (linhas vermelhas) de peixe individual após adquirir uma gravação comportamental em software de rastreamento. Traços representam 20 s da atividade. Duração de sono Total (D) mais de 24 h é significativamente reduzida em três populações distintas de cavefish comparado a peixes de superfície (One-Way ANOVA F(3, 106) = 52.66; Testes de post-hoc de Dunnett foram aplicados entre os peixes de superfície e cada população de caverna, P < 0,001). (E) A única tanque contendo vários peixes, na qual uma arena (laranja) é feito para controlar o sono e interações sociais. (F) Aparelho Locomotor traços de vários peixes após a aquisição de dados no software (cada cor de linha representa um peixe individual) de rastreamento. (G) dados representativos da superfície e Pachón cavefish no sono social de rastreamento. Peixe de superfície reduzir significativamente o sono em tanques de 10 L comparado a arenas de 2L; Superfície peixe sono é reduzido quando peixe socialmente está alojado. Cavefish sono não é significativamente alterado em qualquer condição (Two-Way ANOVA F(2,46) = 4.545; análise post hoc foi realizada dentro de cada população para testar o efeito do tamanho do tanque e o Estado social, no total de sono 10 L single, P = 0,013; 10 L Social, P = 0.0003). Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um sistema personalizado para quantificar o sono e a atividade locomotora em cavefish larval e adulto. Cavefish têm emergido como o principal modelo para o estudo da evolução do sono que pode ser usado para investigar a base genética e neural do sono Regulamento1. Os passos críticos neste protocolo incluem a otimização da iluminação e qualidade de vídeo para garantir a precisão de rastreamento que é necessária quantificar o sono. O sistema de aquisição e análise descritos aqui são totalmente funcionais, como muitos outros sistemas, comerciais e personalizados, para quantificar a locomoção e comportamento28,29,30. O ensaio anterior, examinando o sono no único peixe pode ser estendido para permitir a análise dos peixes alojados em grupo. É uma consideração importante quando solução de problemas ou projetar os ensaios o confunde comportamento social pode ter sobre o sono de um indivíduo. Por exemplo, agressão é comum em Astyanax, e níveis de agressão diferem entre os peixes de superfície e cavefish31. Otimizando o número de peixes, tamanho da arena e proporção sexual, a fim de minimizar a agressão permitirá medições reproduzíveis do Regulamento do sono.
Uma limitação da técnica, conforme descrito, é uma falta de confiabilidade peixe individual durante todo o ensaio a seguir. Automatizado de rastreamento animal mudará frequentemente animais quando entram em contato próximo. Isto pode ser resolvido pela otimização cuidadosa dos limiares, ou corrigindo manualmente qualquer switches. Além disso, o sistema descrito não é um sistema de escoamento, e portanto, qualidade da água pode se tornar um problema depois de gravações que dura mais de alguns dias. Outro fluxo através de sistemas têm sido descritos em zebrafish13 e estas prontamente poderiam ser aplicadas para o chiqueiro de cavefish mexicano.
A metodologia descrita é significativa por causa de sua ampla aplicabilidade para medir o comportamento de espécies de peixes diversos. Sono... ainda tem que ser caracterizada em quase qualquer peixe de água doce ou marinha incluindo Sticklebacks, ciclídeos e espadas32,33,34. A versatilidade deste sistema para medir o sono na . mexicanus e outros modelos de peixe pode abordar diversas perguntas sobre a evolução e as bases genéticas da sono. O hardware associado com este sistema é altamente rentável, tornando-se altamente acessível e proporcionando potencial para análise de alta taxa de transferência de farmacológicos e análise ecotoxilogical do sono e a atividade locomotora.
Divulgações
Os autores declaram que eles têm não tem interesses concorrente.
Agradecimentos
Este trabalho foi financiado pelo prêmio NIGMS GM127872 ACK, NINDS prêmio 105072 ERD e ACK e prêmio NSF 1656574 de ACK.
Materiais
| Name | Company | Catalog Number | Comments |
| 12 V power adaptor | Environmental Lights | 24 Watt 12 VDC Power Supply | |
| Acrylic dividers (adults) | TAP Plastic | Order sheets in sizes as needed | |
| Adult infrared light power source | Environmnental Lights 24 Watt 12 VDC Power Supply | ||
| Battery pack | CyberPower | CP850PFCLCD | |
| Camera lens (adult) | Navitar Zoom 7000 | Zoom 7000 | |
| Camera lens (larval) | Fujian 35mm f/1.7 | B01CHX7668 | Purchase on Amazon |
| Camera lens adapter | d | 1524219 | |
| Camera mount | CowboyStudio Super Clamp | B002LV7X1K | Purchase on Amazon |
| Fish tank | Deep Blue Professional | ADB11006 | |
| Heat sink (adult) | M-D Building products | SKU: 61085 | Cut to fit |
| Heat sink (larval) | M-D Building products | SKU: 57000 | Cut to fit |
| Infrared lights (adults) | Environmental Lights Infrared 850 nm 5050 LED strip | irrf850-5050-60-reel | Cut to fit |
| Infrared lights (larval) | LED World | B00MO9H7H4 | Purchase on Amazon |
| IR-diffusing acrylic | TAP Plastic | Order sheets in sizes as needed | |
| Laptop/computer | N/A | N/A | Any laptop will work. |
| LED light | Chanzon 10 High Power Led Chip 3W White (6000K-6500K/600mA-700mA/DC 3V-3.4V/3 Watt) | B06XKTRSP7 | Use with Chanzon 25 pcs 1 W, 3 W, 5 W LED Heat Sink (2 pin Black) Aluminum Base Plate Panel |
| light timer | Century 24 Hour Plug-in Mechanical Timer Grounded | ||
| Plastic wall mount for IR | Everbilt Plastic pegboard | Model # 17961 | |
| Power cable | BNTECHGO 22 Gauge Silicone Wire | B01K4RPE0Y | |
| Power source | Rapid LED | MOONLIGHT DRIVER (350MA) | |
| Tissue culture plates | Fisherbrand | 12-well (FB012928) 24-well (FB012929) | |
| Tripod Ball head | Demon DB-44 | B00TQ54CZO | Purchase on Amazon |
| USB Hardrive | Seagate 3TB backup | STDT3000100 | |
| USB Webcam | Microsoft LifeCam | Q2F-00014 | Purchase on Amazon |
| Wall mount for camera | LDR Industries 1/2" Steel pipe | 307 12X36 | Mounted on wall with Flange and 90° pipe elbow. Could also use a tripod to hold camera. |
Referências
- Keene, A. C., Duboue, E. R. The origins and evolution of sleep. The Journal of Experimental Biology. , (2018).
- Joiner, W. J. Unraveling the Evolutionary Determinants of Sleep. Current Biology. 26 (20), R1073-R1087 (2016).
- Allada, R., Siegel, J. M. Unearthing the phylogenetic roots of sleep. Current biology. 18, R670-R679 (2008).
- Sehgal, A., Mignot, E. Genetics of sleep and sleep disorders. Cell. 146, 194-207 (2011).
- Campbell, S. S., Tobler, I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience and Biobehavioral Reviews. 8, 269-300 (1984).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Geissmann, Q., Rodriguez, L. G., Beckwith, E. J., French, A. S., Jamasb, A. R., Gilestro, G. Ethoscopes: An Open Platform For High-Throughput Ethomics. bioRxiv. , 113647(2017).
- Garbe, D. S., et al. Context-specific comparison of sleep acquisition systems in Drosophila. Biology Open. 4 (11), (2015).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6 (6), 451-457 (2009).
- Gilestro, G. F., Cirelli, C. PySolo: A complete suite for sleep analysis in Drosophila. Bioinformatics. 25, 1466-1467 (2009).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6, 451-457 (2009).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science (New York, N.Y.). 327, 348-351 (2010).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, (2015).
- Chiu, C. N., Prober, D. A. Regulation of zebrafish sleep and arousal states: current and prospective approaches. Frontiers in Neural Circuits. 7 (April), 58(2013).
- Elbaz, I., Foulkes, N. S., Gothilf, Y., Appelbaum, L. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish. Frontiers in Neural Circuits. 7, (2013).
- Duboué, E. R., Keene, A. C., Borowsky, R. L. Evolutionary convergence on sleep loss in cavefish populations. Current Biology. 21, 671-676 (2011).
- Beale, A., et al. Circadian rhythms in Mexican blind cavefish Astyanax mexicanus in the lab and in the field. Nature Communications. 4, 2769(2013).
- Keene, A. C., Yoshizawa, M., McGaugh, S. E. Biology and Evolution of the Mexican Cavefish. , (2015).
- Jeffery, W. R. Regressive evolution in Astyanax cavefish. Annual Review of Genetics. 43, 25-47 (2009).
- Gross, J. B. The complex origin of Astyanax cavefish. BMC Evolutionary Biology. 12, 105(2012).
- Aspiras, A., Rohner, N., Marineau, B., Borowsky, R., Tabin, J. Melanocortin 4 receptor mutations contribute to the adaptation of cavefish to nutrient-poor conditions. Proceedings of the National Academy of Sciences. 112 (31), 9688(2015).
- Jaggard, J., et al. The lateral line confers evolutionarily derived sleep loss in the Mexican cavefish. Journal of Experimental Biology. 220 (2), (2017).
- Jaggard, J. B., Stahl, B. A., Lloyd, E., Prober, D. A., Duboue, E. R., Keene, A. C. Hypocretin underlies the evolution of sleep loss in the Mexican cavefish. eLife. , e32637(2018).
- Hinaux, H., et al. A Developmental Staging Table for Astyanax mexicanus Surface Fish and Pacho ´n Cavefish. Zebrafish. 8 (4), 155-165 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., La Schimmenti,, Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Bilandzija, H., Ma, L., Parkhurst, A., Jeffery, W. A potential benefit of albinism in Astyanax cavefish: downregulation of the oca2 gene increases tyrosine and catecholamine levels as an alternative to melanin synthesis. Plos One. 8 (11), e80823(2013).
- Yokogawa, T., et al. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biology. 5, 2379-2397 (2007).
- Appelbaum, L., et al. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 106, 21942-21947 (2009).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. eLife. 4 (September), (2015).
- Elipot, Y., Hinaux, H., Callebert, J., Rétaux, S. Evolutionary shift from fighting to foraging in blind cavefish through changes in the serotonin network. Current Biology. 23 (1), 1-10 (2013).
- Bell, M. A., Foster, S. A. The evolutionary biology of the threespine stickleback. 584, Oxford University Press. Available from: http://books.google.com/books?hl=de&lr=&id=uxC0lN-Z3FIC&pgis=1 (1994).
- Seehausen, O. African cichlid fish: a model system in adaptive radiation research. Proceedings of Biological Sciences/The Royal Society. 273 (1597), 1987-1998 (1597).
- Basolo, A. L. Female preference predates the evolution of the sword in swordtail fish. Science. 250, 808-810 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados