Method Article
Mediciones automatizadas de sueño y actividad locomotriz en mexicano Cavefish
En este artículo
Resumen
Este protocolo detalla la metodología para cuantificar el comportamiento locomotor y sueño en el mexicano cavefish. Análisis anteriores se extienden para medir estos comportamientos en pescados ubicado socialmente. Este sistema puede ser ampliamente aplicado para el estudio de sueño y actividad en otras especies de peces.
Resumen
A través de phyla, sueño se caracteriza por características de comportamiento altamente conservadas que incluyen umbral de excitación elevados, rebotan tras privación de sueño y consolidaron períodos de inmovilidad conductual. El mexicano cavefish, Astyanax mexicanus (a. mexicanus), es un modelo para estudiar la evolución del rasgo en respuesta a la perturbación ambiental. A. mexicanus existen ojos formas de superficie y varias poblaciones cavernícolas ciegas que tienen diferencias morfológicas y de comportamiento robustas. La pérdida de sueño ha ocurrido en múltiples poblaciones cavefish evolucionó independientemente. Este protocolo describe una metodología para la cuantificación de sueño y actividad locomotriz en cueva a. mexicanus y peces de superficie. Un sistema de vigilancia de video rentable permite la conducta la proyección de imagen de peces adultos o larvas alojadas individualmente por períodos de una semana o más. El sistema puede aplicarse a los peces de 4 días post fertilización hasta la edad adulta. El enfoque puede ser adaptado también para medir los efectos de las interacciones sociales en sueño registrando varios peces en una sola arena. Tras grabaciones de comportamiento, datos se analizaron usando automatizado de software de seguimiento y análisis de sueño es procesado usando scripts personalizados que cuantifican variables múltiples de sueño incluyendo duración, longitud de pelea y pelea número. Este sistema puede aplicarse a medida sueño y comportamiento circadiano locomotor actividad en casi cualquier especie de peces como el pez cebra y espinosos.
Introducción
Sueño se conserva altamente en todo el reino animal en los niveles fisiológicos, funcionales y conductuales1,2,3. Mientras sueño en los animales mamíferos de laboratorio normalmente se evalúa mediante electroencefalogramas, las grabaciones electrofisiológicas son menos prácticas en sistemas pequeños modelo genéticamente susceptibles y así dormir normalmente se mide en base a comportamiento3 , 4. características de comportamiento asociadas con el sueño están muy conservadas a lo largo del reino animal e incluyen umbral de excitación creciente, reversibilidad con estimulación y prolongada inactividad conductual5. Estas medidas se pueden utilizar para caracterizar el sueño en los animales que van desde el gusano nematodo C. elegans, a través de los seres humanos6.
El uso de quietud conductual para caracterizar el sueño requiere software de rastreo automatizado. Con software de seguimiento, se determinan periodos de actividad e inmovilidad durante varios días y largos períodos de inactividad se clasifican como dormir7,8. En los últimos años se han desarrollado múltiples sistemas de seguimiento para la adquisición de datos de actividad entre una diversidad de sistemas de la pequeña modelo genéticamente susceptibles; como gusanos, moscas de la fruta y pescado9,10,11. Estos programas van acompañados de software que permite el seguimiento automatizado del comportamiento animal, incluyendo freeware de código abierto y software disponibles en el mercado7,12,13,14 . Estos sistemas difieren en su flexibilidad y permitan la eficiente detección y caracterización de los fenotipos de sueño en numerosos modelos genéticamente modificable.
Investigación genética del sueño en el pez cebra, Danio rerio, ha llevado a la identificación de numerosos genes y circuitos neuronales que regulan el sueño15,16. Mientras que esto ha proporcionado un sistema poderoso para investigar la base neural del sueño en un animal de laboratorio vertebrados, es mucho menos conocida sobre cómo evoluciona el sueño y cómo natural variación contribuye a dormir Reglamento. El mexicano cavefish, Astyanax mexicanus (A. mexicanus), han evolucionado las diferencias dramáticas en el sueño, la actividad locomotriz y ritmos circadianos17,18. Estos peces existen ojos superficie peces que habitan en los ríos de México y sur de Texas y al menos 29 cueva las poblaciones de la región de la Sierra Del Abra del noreste de México19,20,21. Notablemente, muchas diferencias conductuales, incluyendo la pérdida de sueño, parecen haber emergido independientemente en varias poblaciones de cavefish14,22. Por lo tanto, cavefish proporciona un modelo para la investigación de la evolución convergente de sueño, circadiano y comportamientos sociales.
Este protocolo describe un sistema para medir el sueño y el comportamiento locomotor en A. mexicanus de larvas y adultos. Un sistema de grabación basado en infrarrojos a la medida permite la grabación de vídeo de animales bajo condiciones de luz y oscuridad. Software disponible comercialmente puede utilizarse para medir la actividad y macros personalizadas se utilizan para cuantificar varios aspectos de inactividad y determinar periodos de sueño. Este protocolo también describe modificaciones experimentales para el seguimiento de la actividad de múltiples animales dentro de un tanque, proporcionando la capacidad de examinar las interacciones entre el sueño y comportamientos sociales. Estos sistemas pueden aplicarse a la medida de sueño y comportamiento circadiano locomotor actividad en especies de peces adicionales incluyendo el pez cebra y espinosos.
Protocolo
Nota: Establecer sistemas para el seguimiento conductual en larvas y adultos.
1. construir un sistema de descanso para las larvas
Nota: El sistema de monitoreo para seguimiento de larva a través de peces menores de edad 4 días post fecundación (dpf) a través 30 PD a. mexicanus requiere varios equipos incluyendo iluminación infrarrojos (IR), difusores de acrílico IR ligeros, automatizado luz controles (temporizadores), computadoras, cámaras y materiales secundarios como cableado y reguladores de potencia (figura 1A). Las siguientes instrucciones le informará cómo construir un sistema de seguimiento preciso comportamiento locomotor para estudio de sueño y ritmos circadianos en larvas mexicanus a.
- Construir un sistema de iluminación que consiste en IR y blanco diodos electroluminosos (LED): colocar tres luces de IR en un triángulo aproximadamente 7.62 cm unos de otros en un disipador térmico de plataforma metálica delgada de 30,5 x 30,5 cm. Luces de serie del alambre con alambre eléctrico y conectar a una fuente de energía.
- Coloque una sola luz blanca LED en el centro de las tres luces de IR y conectar a la fuente de alimentación.
- Conecte la fuente de alimentación para el LED a un temporizador de luz para un tiempo circadiano estándar.
- Construir una plataforma para el sistema de seguimiento de larvas. Utilice 0,33 cm gruesa muestra blanca de acrílico para todos los componentes de la plataforma.
- Coloque la plataforma de grabación sobre el disipador térmico del cuadrado iluminado en que arenas que contienen peces residirá durante seguimiento conductual.
-
Coloque un segundo acrílico dentro de la caja entre las luces y los animales para difundir el IR para una óptima iluminación y contraste.
Nota: las dimensiones de la caja de luz larval es el siguiente: dos de 18 x 8,5 cm y dos 17 x 8,5 cm LEDs que están químicamente enlazados juntos para formar un 18 x 18 cm cuadrados es de 8,5 cm de altura. Además, acrílico puede ser fácilmente cortado o perforado usando las herramientas adecuadas para el tamaño modificado para requisitos particulares.- Coloque el todo seguimiento larval etapa y la instalación de la iluminación dentro de un tubo de plástico cerrado y luego coloque la cámara en la parte superior del tubo.
Nota: Es importante evitar reflexiones de luz aparezcan en el video de seguimiento, como esto va afectar a la exactitud del seguimiento. La colocación de cámaras en la parte superior un tubo que rodea la plataforma mejora la iluminación y la nitidez de las cámaras que se utilizan para estos experimentos.
- Coloque el todo seguimiento larval etapa y la instalación de la iluminación dentro de un tubo de plástico cerrado y luego coloque la cámara en la parte superior del tubo.
- Manipular una webcam (véase Tabla de materiales) para la grabación basada en IR. Retirar la lente fabricante usando una herramienta giratoria (véase Tabla de materiales).
- Quite los tornillos de plata pequeñas en los lados detrás de la cámara para retirar la carcasa interior.
- Quite los tornillos negro pequeño dentro del cuerpo de la cámara para aflojar el resto de la lente. Utilice un destornillador pequeño para quitar las porciones de la cubierta de la lente que queda después de cortar la lente.
- Quitar el azul LED en la parte superior de la carga junto a viviendas de dispositivo (CCD).
- Armar la cámara hacia atrás colocando la cubierta interior a su orientación original y atornillar los dos tornillos de plata regresa a su posición original.
- Ruta del interior de la cámara con una pequeña sierra con un poco de enrutamiento plástico redondeado. Lisa hacia abajo el plástico extra hasta que puede caber un adaptador de lente.
- Instale un filtro de paso IR dentro de la cámara tan cerca de la CCD como sea posible sin hacer contacto directo con la cámara.
Nota: Tenga cuidado para no dañar el chip CCD en la carcasa de la cámara. Asegúrese de que el corte más plana posible. Selle cualquier espacio abierto entre el exterior del filtro IR y el cuerpo de la cámara para impedir que la luz de alcance CCD sin filtrarla. - Conecte la cámara a un lente de 35 mm fijada (véase Tabla de materiales) atornillando el adaptador en el frente de la cámara en la parte posterior de la lente.
- Coloque la cámara y la lente en el orificio perforado en la tapa en la parte superior del tubo que contiene el escenario y las luces y conectar el USB al PC de que se registrará a los animales.
Nota: Coloque el pescado en una sala del comportamiento que es independiente de donde se encuentran peces stock para garantizar mínimas interrupciones durante la grabaciones de comportamiento. Tenga cuidado para reducir al mínimo las fluctuaciones en la temperatura y ventilación que puede confundir los experimentos conductuales.
2. sistema de dormir para adultos
- Construir un sistema de iluminación IR para el seguimiento de peces adultos cortando tiras IR a intervalos de aproximadamente 46 cm. Una tira de 46 cm es suficiente para cada tanque de 10 L comportamiento.
- Cada tira juntos en una serie, cada tira de alambre eléctrico DC de soldadura de alambre y coloque en una fuente de alimentación de 9 V.
- Fije cada tira de IR a una pieza de 51 cm x 5,1 cm de aluminio que actúa como un disipador de calor.
- Coloque una 46 cm x 5 cm, 0,32 cm 9% muestra blanca luz paso hoja de acrílico gruesa directamente en frente de cada tira de la luz IR para difundir el IR ligero.
- Coloque todos los tanques en un rack compatible con iluminación IR montado atrás.
- Utilizar separadores de plástico opacos en tanques de cristal de 10 L para crear arenas individuales.
Nota: El tamaño de la arena puede variar basado en el número de divisores utilizados y el tamaño del tanque. Tamaño de arena impacta actividad locomotriz y el sueño en la cueva y peces superficie23. - Montaje de las cámaras aproximadamente 4-6 metros de los tanques. Cada cámara puede grabar normalmente de 3 tanques a la vez para proporcionar suficiente resolución para el seguimiento.
Nota: Grabaciones de comportamiento adulto generalmente no requieren un sistema de iluminación blanco separado para controlar cambios de día de noche. Simplemente utilizando lámparas de techo estándar en una habitación comportamiento conectado a un contador de tiempo es probable que sea suficiente.
3. registro actividad locomotriz
Nota: Todas las grabaciones del comportamiento se realizan con un ordenador estándar portátil o escritorio con una fuente de batería de respaldo. Debido al tamaño de archivo grande de un 24 h de grabación (60-100 GB), guardar todas las grabaciones en discos duros externos.
- Aclimatar los peces 4-30 años PD para 18-24 h antes de iniciar grabaciones. Alimentar larvas peces con Artemia viva estando primero en la cámara de grabación y 1 h antes de comenzar la grabación. Aclimatar a los peces adultos 4-5 días antes de la grabación de comportamiento y alimentación una vez al día con el alimento de la escama o con blackworms vivo.
Nota: Asegúrese de colocar peces larvas en agua dulce antes de la grabación, como camarón de salmuera sobrante hará seguimiento problemas durante el análisis posterior. Co-cultivo con rotíferos proporciona una opción alternativa, como su pequeño tamaño no interfiere con el seguimiento. - Coloque el pescado entre 4-6 PD en placas de cultivo de tejidos de 24 pocillos. Pescado de casa años 20-30 PD en placas de cultivo de tejidos 12-bien para la grabación.
- Adultos récords en depósitos de 10 L forma con separadores para dar cabida a cinco peces alojados individualmente, o sin división registro y actividad en un entorno social.
Nota: Tenga cuidado para enfocar la cámara antes de iniciar la grabación con el fin de maximizar la precisión de seguimiento. No abrir el diafragma de la lente de la cámara demasiado lejos, ya que al hacerlo reducirá dramaticamente la nitidez de la imagen. Hay un equilibrio, sin embargo; Si el iris se cierra demasiado, la velocidad de fotogramas del vídeo se sitúe por debajo de 15,00 fps. Es esencial para un análisis posterior que la velocidad de fotogramas sigue siendo 15,00 marcos por s para su uso con algunos script de sueño medida23,24. - Programar/brillo de iluminación iluminación de fondo.
- Optimizar la iluminación antes del comienzo de la grabación. Siempre mantener el contraste en el nivel más alto posible y usar el brillo y la Iluminación de fondo para ajustar el brillo hasta que los animales son más claros.
- Peces discos por 24 o 48 horas.
Nota: Paquetes de batería de emergencia que potencia la iluminación, Computadoras y cámaras deben comprarse en caso de cortes de energía. Todos los paquetes de batería deben también conectarse a tomas de corriente de emergencia, si es posible. Las baterías generalmente no potencia el equipo por más de unos minutos a una hora en la mayoría y servir de puente entre perder el poder principal y transferencia al sistema de energía de emergencia.
4. Análisis de la actividad locomotriz en individual encuentra peces usando automatizado de Software de seguimiento
- Para comenzar el análisis del comportamiento, abra el software de seguimiento, seleccione el Nuevo experimento de plantillay seleccione aplicar una plantilla de Pre-Defined.
- Como el programa le preguntará ahora qué especie de pista, seleccione peces. Utilice el menú desplegable para seleccionar ya sea Las larvas de pez cebra de Pez cebra adulto dependiendo el paradigma experimental.
- Establecer los ámbitos en que cada animal será rastreado. Las larvas, seleccionar bien la placa, bien redondo y Plantilla de zona No. Para adultos, uso de campo abierto, Plaza con Plantilla de zona No. Luego determinar el número apropiado de arenas, uno para cada animal que se rastrean en el video.
- Seleccione el modelo para el óptimo seguimiento, haga clic en seguimiento de punto central de , y asegúrese de que está seleccionado el color del animal a ser más oscuro que el fondo. Aplicar el tipo de marco en el que el vídeo fue adquirido. El software de seguimiento debería detectar automáticamente esto.
- Dibujar a escala para calibrar la distancia del mundo real de un objeto para determinar con precisión el comportamiento locomotor de los peces utilizando la Configuración de la Arena.
- Editar los campos para asegurarse de que toda la zona que los peces están en será rastreada; de lo contrario las muestras se perderán durante la adquisición.
Nota: Tenga cuidado al configurar zonas. Especialmente peces larvales son sensibles a errores de seguimiento si las arenas son demasiado grandes o pequeños. Mala iluminación en el experimento también puede crear sombras en las paredes de placas de pozos, que el programa puede pensar que es un animal, creando un falso positivo. - Haga clic en avanzadas. Bajo el método de Ajuste de la detección, seleccione Resta dinámica, luego haga clic en fondo y seleccione Iniciar el aprendizaje. Ajustar la relación de señal/ruido de contraste oscuro hasta los animales se rastrean bien, y el fondo no es la causa del seguimiento saltar.
Nota: Calidad de vídeo puede variar entre los experimentos, cada ensayo puede necesitar usar configuraciones diferentes, por consiguiente. Usando las características Objeto de contorno y Tamaño del sujeto puede mejorar significativamente el seguimiento de resultados. - Seleccione lista de ensayo y los parámetros apropiados de la carga antes de comenzar a grabar los datos en el programa.
- Haga clic en la ficha de adquisición , seleccione Pista de todos los ensayos previstos y haga clic en el botón de grabación.
- Bajo Perfil de análisis, asegúrese de distancia, tiempo y movimiento están seleccionadas.
Nota: En orden para su posterior análisis de sueño, es fundamental que estos ajustes son correctos, como el .perl archivo debe leer estos datos en el orden correcto para calcular el sueño. - En exportación, seleccionar Datos, exportar los datos como texto Unicode.
5. seguimiento social encuentra peces
- Siga los pasos 4.1-4.4 configurar el experimento en el software de seguimiento.
- En el menú desplegable, seleccione cuántos animales a la pista para el experimento.
- En configuración de la Arena , dibujar la escala correcta para calibrar la distancia del mundo real.
- En configuración de la detección , uso Dinámico de la substraccióny ajustar el contraste oscuro para seguir mejor el animal.
- Ajuste el tamaño del sujeto en la configuración de detección, para que sólo una porción muy pequeña del animal se realiza un seguimiento.
Nota: Mediante el seguimiento de sólo una pequeña parte del animal, esto reducirá la cantidad de conmutación entre los animales cuando cruzan durante la adquisición. - Una vez que se adquieren las pistas, utilice el Editor de pistas para fijar manualmente veces donde pueden cruzar peces.
6. extracción de los datos de sueño de la actividad locomotriz
Nota: La definición de comportamiento del sueño en larvas y adultos de a. mexicanus es 1 min o más de inactividad. Esta definición se determinó utilizando experimentos de umbral de excitación, donde un mayor estímulo sensorial es necesaria para iniciar una respuesta conductual en un estado de hibernación (> 60 s) comparado con el despertar14,17. Para tener en cuenta para que pequeños movimientos y común a la deriva para la pesca de especies, se aplican límites de velocidad para segregar el movimiento real de ruido o deriva. Estos umbrales son derivados de cómputo mediante la comparación de las correlaciones entre la distancia y duración del sueño para encontrar los valores más altos de R-squared; determinando la velocidad más exacta para el movimiento y el sueño. Peces larvales, los límites superiores e inferiores son ambos 12 mm/s ya que es poco o no deriva. Para peces adultos el límite inferior es de 2 cm/s con un límite superior de 4 cm/s a cuenta de la deriva.
- Instalar Cygwin en el equipo de análisis para llevar a cabo la ejecución de las secuencias de comandos escritas a medida para extraer el aparato locomotor y dormir comportamiento.
- Crear una nueva carpeta de experimento, dentro del directorio home de Cygwin.
- Importar los datos de Unicode sin formato de software de seguimiento y ejecutar el archivo .sh en Cygwin para convertir la codificación de UTF-16, UTF-8.
- Ejecute el archivo de .perl en Cygwin para extraer los datos de sueño.
- Abra el archivo de macro y siga las instrucciones en la hoja de cálculo para finalizar el análisis de los datos como se desee.
Nota: Un nivel básico de la codificación de línea de comandos será necesario llevar a cabo esta parte del análisis. Comandos general Linux serán suficiente. Si hay problemas con los programas de lectura de los datos correctamente, compruebe los datos de seguimiento de software en cualquier editor de texto libre para asegurarse la codificación y orden es correcta para los archivos ejecutables escribir correctamente.
Resultados
Edad de las larvas que DPF 4-30 puede ser confiablemente registrado en el sistema cerrado de la medida descrito en la figura 1. El sistema incluye IR y luz visible para permitir grabaciones en condiciones de luz y oscuridad, bajo diferentes condiciones de luz visibles (figura 1A). Los videos son luego analizan utilizando el software de seguimiento (figura 1BC) y post procesaron utilizando una macro personalizada sueño (ver Descargar suplementario). Peces larvales de tres poblaciones independientes cavefish mostrar una reducción significativa en el sueño frente a peces de superficie (figura 1) y 20 PD, y la pérdida de este sueño es consistente a través de etapas de desarrollo. La edad de los peces analizados para dormir depende a menudo la manipulación experimental. Por ejemplo, a. mexicanus no consumir alimentos en 4 días, por lo que experimentos examinando las interacciones entre el sueño y la alimentación ocurren típicamente en las larvas mayores25. Por el contrario, morfolinos sólo son eficaces en alevines temprana (típicamente menores de dpf 4) esta edad se emplea para evaluar sueño24,26,27.
A. mexicanus puede vivir hasta 30 años en el laboratorio, pero los experimentos con adultos se realizan normalmente en el pescado de 6 meses a 3 años. Peces pueden grabarse en una variedad de tamaños de tanque dependiendo el experimento e iluminación IR permite grabaciones durante los períodos de luz y oscuridad (figura 2A). Arenas individuales están marcados en seguimiento para permitir el seguimiento de los peces, y posterior procesamiento utilizando una macro personalizada proporciona una lectura de sueño (figura 2BC). Sueño se reduce significativamente en cavefish Pachón, el Molino y la Tinaja, en comparación con peces de superficie (Figura 2D). Además, este sistema permite la grabación varios peces en un solo ámbito (normalmente tanques de 10 galones), permitiendo para el análisis de las interacciones sociales cómo afectan el sueño (Figura 2EF). Vivienda social robusta reduce el sueño en los peces de superficie, sin afectar el sueño en cavefish Pachón (figura 2). La falta de efecto en cavefish es probablemente debido a un efecto del sótano, donde cavefish duermen poco, particularmente en las arenas más grandes utilizadas para examinar el comportamiento social.
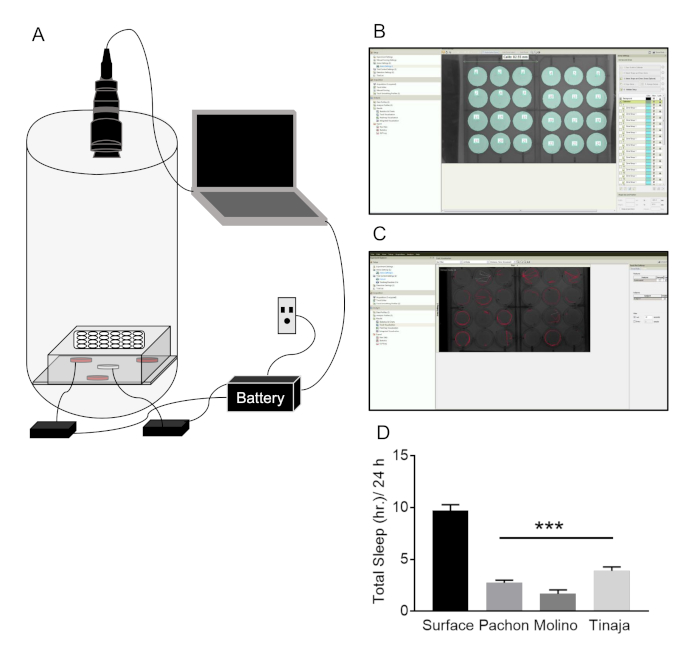
Figura 1: Comportamiento de sueño de grabación en larvas y juveniles a. mexicanus. (A) esquema de configuración de comportamiento larval del sueño: la Larva se colocan en una plataforma dentro de un tubo de luz-controlada. Sistemas de iluminación infrarroja y blanco sentarse debajo de los peces en el fondo del tubo. Una cámara IR-pass se encuentra en la parte superior del tubo y se conecta a un ordenador portátil en el que se graba el video. Todos los sistemas de potencia (iluminación y laptop) están conectados a energía de respaldo. (B) configuración de Arena en el software de seguimiento. Individuales larvas se mantienen en los pozos de una placa de cultivo de tejidos, y arenas (cian) se hacen para cada animal. (C) Aparato Locomotor rastros de comportamiento locomotor de pescado después de adquirir los datos en el software de seguimiento. Trazas rojas representan 10 s de actividad en peces de 20 días de edad. (D) resultando dormir datos de software de seguimiento. Cavefish juvenil converge sobre comportamiento de sueño reducida en comparación con peces superficie morfos (One-Way ANOVA F(3, 116) = 76.12; Se aplicación análisis post-hoc de Dunnett para comparar cada población cavefish con peces de superficie, P < 0.001). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Sistema de adultos a. mexicanus de sueño y comportamiento circadiano. (A) diagrama de sistema de grabación de sueño: pescado se llevan a cabo en tanques en un estante enfrente de las cámaras de seguimiento. Un sistema de iluminación infrarrojo se coloca detrás de los tanques de peces, mientras que las cámaras IR-pass están conectadas a un ordenador portátil para la grabación de comportamiento. Todos los sistemas de potencia están conectados a un sistema de batería de respaldo en caso de fluctuaciones de electricidad. (B) Arena de configuración en el software de seguimiento. Cada pez se marca mediante la creación de distintas arenas (cyan) para rastrear el comportamiento locomotor. (C) representante locomotor las pistas (líneas rojas) de cada pez después de adquirir una conducta grabación en el software de seguimiento. Rastros representan 20 s de actividad. Duración Total (D) más de 24 h se reduce significativamente en tres poblaciones distintas de cavefish frente a peces de superficie (One-Way ANOVA F(3, 106) = 52.66; Pruebas post-hoc de Dunnett se aplicaron entre peces de superficie y cada población de la cueva, P < 0.001). (E) A tank solo que contenga varios peces en el que se hace uno arena (naranja) de sueño y las interacciones sociales. (F) Aparato Locomotor rastros de múltiples peces después de la adquisición de datos en el seguimiento de software (cada línea de color representa un pez determinado). (G) datos representativos de la superficie y Pachón cavefish en sueño social de seguimiento. Superficie peces reducen significativamente el sueño en tanques de 10 litros en comparación con arenas de 2 L; Sueño peces de superficie se reduce más cuando socialmente se encuentran peces. Cavefish sueño no es alterado en cualquier condición (ANOVA de dos vías F(2,46) = 4.545; análisis post-hoc se realizó dentro de cada población para probar el efecto del tamaño del tanque y del estado social en solo 10 L de sueño total, P = 0,013; 10 L Social, P = 0.0003). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe un sistema de medida para cuantificar el sueño y la actividad locomotriz en larvas y adultos cavefish. Cavefish ha surgido como un líder modelo para el estudio de la evolución del sueño que se puede utilizar para investigar la base genética y de los nerviosas de sueño Reglamento1. Los pasos críticos en este protocolo incluyen la optimización de la iluminación y calidad de vídeo para asegurar un seguimiento preciso es necesaria cuantificar el sueño. El sistema de adquisición y análisis aquí descritos son totalmente funcionales, como muchos otros sistemas, comerciales y a la medida, para cuantificar la locomoción y el comportamiento28,29,30. El anterior ensayo examen de sueño en los peces solo puede ampliarse para permitir el análisis de peces ubicado en grupo. Una consideración importante cuando solución de problemas o diseñar ensayos es la confunde comportamiento social puede tener sobre el sueño de un individuo. Por ejemplo, la agresión es común en Astyanax, y niveles de agresión difieren entre los peces de superficie y cavefish31. Optimizar el número de peces, el tamaño de la arena y la sex ratio, con el fin de minimizar la agresión permitirá mediciones reproducibles de la regulación del sueño.
Una limitación de la técnica, como se describe, es la falta de fiabilidad tras cada pez a lo largo del ensayo. Automatizado seguimiento animal cambiará a menudo animales cuando entran en contacto. Esto puede abordarse por la optimización cuidadosa de los umbrales, o corrigiendo manualmente los interruptores. Además, el sistema descrito no es un sistema de flujo, y por lo tanto, la calidad del agua puede convertirse en un problema después de grabaciones duran más de unos pocos días. Se han descrito otros flujo a través de sistemas en pez cebra13 y estos podían aplicarse fácilmente a la sty de cavefish mexicano.
La metodología descrita es significativa debido a su amplia aplicabilidad para medir el comportamiento de diversas especies. Sueño aún no se ha caracterizado en casi cualquier pez de agua dulce o Marina incluyendo espinosos, cíclidos y swordtails32,33,34. La versatilidad de este sistema para medir el sueño en a. mexicanus y otros modelos de peces puede abordar diversas preguntas sobre la evolución y los fundamentos genéticos del sueño. El hardware asociado a este sistema es altamente rentable, lo que es muy accesible y ofrece potencial de análisis de alto rendimiento de farmacológico y ecotoxilogical de sueño y actividad locomotora.
Divulgaciones
Los autores declaran que no tienen intereses que compiten.
Agradecimientos
Este trabajo fue apoyado por NIGMS GM127872 ACK, NINDS Premio 105072 ERD y ACK y Premio NSF 1656574 ACK.
Materiales
| Name | Company | Catalog Number | Comments |
| 12 V power adaptor | Environmental Lights | 24 Watt 12 VDC Power Supply | |
| Acrylic dividers (adults) | TAP Plastic | Order sheets in sizes as needed | |
| Adult infrared light power source | Environmnental Lights 24 Watt 12 VDC Power Supply | ||
| Battery pack | CyberPower | CP850PFCLCD | |
| Camera lens (adult) | Navitar Zoom 7000 | Zoom 7000 | |
| Camera lens (larval) | Fujian 35mm f/1.7 | B01CHX7668 | Purchase on Amazon |
| Camera lens adapter | d | 1524219 | |
| Camera mount | CowboyStudio Super Clamp | B002LV7X1K | Purchase on Amazon |
| Fish tank | Deep Blue Professional | ADB11006 | |
| Heat sink (adult) | M-D Building products | SKU: 61085 | Cut to fit |
| Heat sink (larval) | M-D Building products | SKU: 57000 | Cut to fit |
| Infrared lights (adults) | Environmental Lights Infrared 850 nm 5050 LED strip | irrf850-5050-60-reel | Cut to fit |
| Infrared lights (larval) | LED World | B00MO9H7H4 | Purchase on Amazon |
| IR-diffusing acrylic | TAP Plastic | Order sheets in sizes as needed | |
| Laptop/computer | N/A | N/A | Any laptop will work. |
| LED light | Chanzon 10 High Power Led Chip 3W White (6000K-6500K/600mA-700mA/DC 3V-3.4V/3 Watt) | B06XKTRSP7 | Use with Chanzon 25 pcs 1 W, 3 W, 5 W LED Heat Sink (2 pin Black) Aluminum Base Plate Panel |
| light timer | Century 24 Hour Plug-in Mechanical Timer Grounded | ||
| Plastic wall mount for IR | Everbilt Plastic pegboard | Model # 17961 | |
| Power cable | BNTECHGO 22 Gauge Silicone Wire | B01K4RPE0Y | |
| Power source | Rapid LED | MOONLIGHT DRIVER (350MA) | |
| Tissue culture plates | Fisherbrand | 12-well (FB012928) 24-well (FB012929) | |
| Tripod Ball head | Demon DB-44 | B00TQ54CZO | Purchase on Amazon |
| USB Hardrive | Seagate 3TB backup | STDT3000100 | |
| USB Webcam | Microsoft LifeCam | Q2F-00014 | Purchase on Amazon |
| Wall mount for camera | LDR Industries 1/2" Steel pipe | 307 12X36 | Mounted on wall with Flange and 90° pipe elbow. Could also use a tripod to hold camera. |
Referencias
- Keene, A. C., Duboue, E. R. The origins and evolution of sleep. The Journal of Experimental Biology. , (2018).
- Joiner, W. J. Unraveling the Evolutionary Determinants of Sleep. Current Biology. 26 (20), R1073-R1087 (2016).
- Allada, R., Siegel, J. M. Unearthing the phylogenetic roots of sleep. Current biology. 18, R670-R679 (2008).
- Sehgal, A., Mignot, E. Genetics of sleep and sleep disorders. Cell. 146, 194-207 (2011).
- Campbell, S. S., Tobler, I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience and Biobehavioral Reviews. 8, 269-300 (1984).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Geissmann, Q., Rodriguez, L. G., Beckwith, E. J., French, A. S., Jamasb, A. R., Gilestro, G. Ethoscopes: An Open Platform For High-Throughput Ethomics. bioRxiv. , 113647(2017).
- Garbe, D. S., et al. Context-specific comparison of sleep acquisition systems in Drosophila. Biology Open. 4 (11), (2015).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6 (6), 451-457 (2009).
- Gilestro, G. F., Cirelli, C. PySolo: A complete suite for sleep analysis in Drosophila. Bioinformatics. 25, 1466-1467 (2009).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6, 451-457 (2009).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science (New York, N.Y.). 327, 348-351 (2010).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, (2015).
- Chiu, C. N., Prober, D. A. Regulation of zebrafish sleep and arousal states: current and prospective approaches. Frontiers in Neural Circuits. 7 (April), 58(2013).
- Elbaz, I., Foulkes, N. S., Gothilf, Y., Appelbaum, L. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish. Frontiers in Neural Circuits. 7, (2013).
- Duboué, E. R., Keene, A. C., Borowsky, R. L. Evolutionary convergence on sleep loss in cavefish populations. Current Biology. 21, 671-676 (2011).
- Beale, A., et al. Circadian rhythms in Mexican blind cavefish Astyanax mexicanus in the lab and in the field. Nature Communications. 4, 2769(2013).
- Keene, A. C., Yoshizawa, M., McGaugh, S. E. Biology and Evolution of the Mexican Cavefish. , (2015).
- Jeffery, W. R. Regressive evolution in Astyanax cavefish. Annual Review of Genetics. 43, 25-47 (2009).
- Gross, J. B. The complex origin of Astyanax cavefish. BMC Evolutionary Biology. 12, 105(2012).
- Aspiras, A., Rohner, N., Marineau, B., Borowsky, R., Tabin, J. Melanocortin 4 receptor mutations contribute to the adaptation of cavefish to nutrient-poor conditions. Proceedings of the National Academy of Sciences. 112 (31), 9688(2015).
- Jaggard, J., et al. The lateral line confers evolutionarily derived sleep loss in the Mexican cavefish. Journal of Experimental Biology. 220 (2), (2017).
- Jaggard, J. B., Stahl, B. A., Lloyd, E., Prober, D. A., Duboue, E. R., Keene, A. C. Hypocretin underlies the evolution of sleep loss in the Mexican cavefish. eLife. , e32637(2018).
- Hinaux, H., et al. A Developmental Staging Table for Astyanax mexicanus Surface Fish and Pacho ´n Cavefish. Zebrafish. 8 (4), 155-165 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., La Schimmenti,, Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Bilandzija, H., Ma, L., Parkhurst, A., Jeffery, W. A potential benefit of albinism in Astyanax cavefish: downregulation of the oca2 gene increases tyrosine and catecholamine levels as an alternative to melanin synthesis. Plos One. 8 (11), e80823(2013).
- Yokogawa, T., et al. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biology. 5, 2379-2397 (2007).
- Appelbaum, L., et al. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 106, 21942-21947 (2009).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. eLife. 4 (September), (2015).
- Elipot, Y., Hinaux, H., Callebert, J., Rétaux, S. Evolutionary shift from fighting to foraging in blind cavefish through changes in the serotonin network. Current Biology. 23 (1), 1-10 (2013).
- Bell, M. A., Foster, S. A. The evolutionary biology of the threespine stickleback. 584, Oxford University Press. Available from: http://books.google.com/books?hl=de&lr=&id=uxC0lN-Z3FIC&pgis=1 (1994).
- Seehausen, O. African cichlid fish: a model system in adaptive radiation research. Proceedings of Biological Sciences/The Royal Society. 273 (1597), 1987-1998 (1597).
- Basolo, A. L. Female preference predates the evolution of the sword in swordtail fish. Science. 250, 808-810 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados