Method Article
Automatisierte Messungen des Schlafes und Bewegungsorgane Aktivität im mexikanischen Cavefish
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Methodik zur Quantifizierung der Bewegungsorgane Verhalten und Schlaf in der mexikanischen Cavefish. Frühere Analysen werden erweitert, um diese Verhaltensweisen in sozial untergebracht Fisch zu messen. Dieses System kann weit angewendet werden, um Schlaf und Aktivität in anderen Fischarten zu studieren.
Zusammenfassung
Über Stämme zeichnet sich Schlaf durch hoch konservierte Verhaltensmerkmale, die gehören erhöhte Erregung Schwelle, rebound nach Schlafentzug und Perioden des Verhaltens Unbeweglichkeit konsolidiert. Die mexikanische Cavefish Astyanax Mexicanus (A. Mexicanus),, ist ein Modell für Studium Merkmal Evolution als Reaktion auf ökologische Störung. A. Mexicanus vorhanden wie Augen Oberfläche Wohnformen und mehrere blinde höhlenbewohnenden Bevölkerungen, die robuste morphologischen und verhaltensbezogene Unterschiede aufweisen. Schlafmangel ist in mehrere, unabhängig voneinander entwickelt Cavefish Bevölkerungen aufgetreten. Dieses Protokoll beschreibt eine Methodik zur Quantifizierung der Schlaf und Bewegungsorgane Aktivität in A. Mexicanus Höhle und Oberfläche Fisch. Eine kostengünstige Videoüberwachungssystem ermöglicht Verhaltens Bildgebung einzeln untergebracht Larven oder Erwachsene Fische über einen Zeitraum von einer Woche oder länger. Das System kann angewendet werden, um im Alter von 4 Tagen Post Befruchtung bis ins Erwachsenenalter zu fischen. Der Ansatz kann auch zur Messung der Auswirkungen sozialer Interaktionen auf den Schlaf durch Aufnahme mehrere Fische in einer einzigen Arena angepasst werden. Nach behavioral Aufnahmen Daten werden analysiert, mit tracking-Software automatisiert und Schlafanalyse ist mit benutzerdefinierte Skripts, die mehrere Schlaf Variablen einschließlich Dauer, Kampf und Kampf Anzahl quantifizieren verarbeitet. Dieses System kann auf Maß Schlaf, circadiane Verhalten und Bewegungsorgane Tätigkeit in fast alle Fischarten, darunter Zebrafisch und Stichlinge angewendet werden.
Einleitung
Schlaf ist im gesamten Tierreich auf der physiologischen, funktionellen und verhaltensbezogenen Ebene1,2,3hoch konserviert. Während Schlaf bei Säugetieren Versuchstieren in der Regel Elektroenzephalogramme anhand ist, elektrophysiologische Aufnahmen sind weniger praktisch in kleinen genetisch zugänglich Modellsystemen und somit Schlaf ist in der Regel gemessen basierend auf Verhalten3 , 4. Verhaltensmerkmale Schlaf zugeordnet sind hoch konserviert im gesamten Tierreich und erhöhte Erregung Schwelle, Reversibilität mit Stimulation und anhaltenden Verhaltensstörungen Ruhe5enthalten. Diese Maßnahmen können verwendet werden, um Schlaf bei Tieren von der Nematoden Wurm, C. Elegans, durch Menschen6bis hin zu charakterisieren.
Die Verwendung von Verhaltensstörungen Ruhe, Schlaf zu charakterisieren erfordert automatisierte Tracking-Software. Mit tracking-Software, Perioden von Aktivität und Unbeweglichkeit sind bestimmt über mehrere Tage und lange Perioden der Inaktivität werden eingestuft, wie schlafen7,8. In den letzten Jahren wurden mehrere Tracking-Systeme für den Erwerb von Aktivitätsdaten unter eine Vielfalt an kleinen genetisch zugänglich Modellsysteme entwickelt; auch Würmer, Fruchtfliegen und Fisch9,10,11. Diese Programme werden durch die Software begleitet, die ermöglicht die automatische Verfolgung des tierischen Verhaltens, einschließlich der open-Source-Freeware und kommerziell verfügbare Software7,12,13,14 . Diese Systeme unterscheiden sich in ihrer Flexibilität und ermöglichen eine effiziente Sortierung und Charakterisierung von Schlaf Phänotypen in zahlreichen genetisch amendable Modelle.
Genetische Untersuchung des Schlafes in den Zebrafish Danio Rerio, führte zur Identifizierung von zahlreichen Genen und neuronale Schaltkreise, die Schlaf15,16Regeln. Dies hat ein leistungsfähiges System zur Erforschung der neuronalen Grundlagen des Schlafes in einem Wirbeltier Labortier, viel weniger ist bekannt über wie Schlaf entwickelt und wie natürliche trägt Variation Verordnung schlafen. Die mexikanische Cavefish, Astyanax Mexicanus (A.) Mexicanus), dramatische Unterschiede in den Schlaf, lokomotorischen Tätigkeit und Tagesrhythmus17,18entwickelt haben. Diese Fische gibt es Augen Oberfläche Fische, die die Flüsse von Mexiko und Süd-Texas und mindestens 29 bewohnen Populationen in der Sierra Del Abra-Region des nordöstlichen Mexiko19,20,21Höhle. Bemerkenswert ist, scheinen viele Verhaltensunterschiede, einschließlich Schlafverlust, unabhängig voneinander in mehreren Cavefish Populationen14,22entstanden sind. Cavefish bieten daher ein Modell für die Untersuchung die konvergente Entwicklung des Schlafes, circadiane, und Sozialverhalten.
Dieses Protokoll beschreibt ein System zur Messung von Schlaf und Bewegungsorgane Verhalten in A. Mexicanus Larven und Erwachsene. Eine maßgeschneiderte Infrarot-basierte Aufnahme-System ermöglicht video-Aufzeichnung von Tieren unter hellen und dunklen Bedingungen. Kommerziell verfügbare Software kann verwendet werden, um die Aktivität zu messen und benutzerdefinierte Makros werden verwendet, um verschiedene Aspekte der Inaktivität zu quantifizieren und Perioden des Schlafes zu bestimmen. Dieses Protokoll beschreibt auch experimentelle Änderungen für die Verfolgung der Aktivitäten von mehreren Tieren in einem Tank, die Möglichkeit bietet, die Wechselwirkungen zwischen Schlaf und Sozialverhalten zu untersuchen. Diese Systeme können auf Maß Schlaf, circadiane Verhalten und Bewegungsorgane Aktivität in zusätzliche Fischarten, darunter Zebrafisch und Stichlinge angewendet werden.
Protokoll
Hinweis: Richten Sie Systeme für Verhaltens-Tracking bei Larven und Erwachsenen.
1. bauen ein Schlafsystem für Larven
Hinweis: Das monitoring-System für das Tracking durch Jungfische im Alter von 4 Tagen Post Befruchtung (Dpf) durch 30 Dpf A. Mexicanus Larven erfordert, dass mehrere Stücke Ausrüstung inklusive Infrarot (IR) Beleuchtung, Acryl IR Licht Diffusoren, Licht automatisiert Kontrollen (Timer), Computer, Kameras und Sekundärrohstoffe wie Verkabelung und Leistungssteller (Abbildung 1A). Die folgenden Hinweise informieren wie Sie bauen ein System um genau verfolgen lokomotorische Verhalten um Schlaf und zirkadiane Rhythmen im Larvenstadium zu studieren A. Mexicanus.
- Konstruieren ein Beleuchtungssystem bestehend aus IR und weiße Leuchtdioden (LED): Legen Sie drei IR-Licht in ein Dreieck ca. 7,62 cm voneinander auf 30,5 x 30,5 cm dünnen Metallplattform Kühlkörper. Lichter in Reihe mit elektrischen Draht Draht und an eine Stromquelle anschließen.
- Legen Sie ein einzelnes weißes Licht LED in der Mitte der drei IR-Beleuchtung und bringen Sie sie an die Stromquelle angeschlossen.
- Verbinden Sie die Stromquelle für die LED einen leichten Timer auf eine circadiane Standardzeit festgelegt.
- Konstruieren Sie eine Plattform für Larven Tracking-System. Verwenden Sie 0,33 cm dicken weißen Schild Acryl für alle Komponenten der Plattform.
- Legen Sie die Aufnahme-Plattform auf den beleuchteten Quadrat Kühlkörper auf die, den Arenen mit Fischen befinden soll, während behavioral Tracking.
-
Legen Sie eine zweite Acryl im Inneren der Box zwischen den Lichtern und den Tieren, die IR für optimale Beleuchtung und Kontrast zu verbreiten.
Hinweis: die Maße für die Larven Lichtkasten ist wie folgt: zwei 18 cm x 8,5 cm und zwei 17 x 8,5 cm LEDs, die chemisch miteinander, in Form einer 18 x 18 cm verklebt werden im Quadrat d. h. 8,5 cm hoch. Darüber hinaus möglicherweise Acryl leicht Ausschneiden "oder" gebohrt mit die richtigen Werkzeuge für individuelle Größenanpassung.- Legen Sie die gesamte Larven Tracking-Bühne und Licht-Setup innerhalb einer geschlossenen Kunststoff-Rohr, und positionieren Sie die Kamera auf das Rohr.
Hinweis: Es ist wichtig, dass Beleuchtung Reflexionen erscheinen auf dem Video Tracking, Trackinggenauigkeit beeinträchtigen wird. Die Platzierung der Kameras über einen Schlauch, der Plattform umgibt verbessert Beleuchtung und Schärfe für die Kameras, die für diese Experimente verwendet werden.
- Legen Sie die gesamte Larven Tracking-Bühne und Licht-Setup innerhalb einer geschlossenen Kunststoff-Rohr, und positionieren Sie die Kamera auf das Rohr.
- Eine Webcam zu manipulieren (siehe Tabelle der Materialien) für IR-basierte Aufzeichnung. Entfernen Sie die Hersteller-Linse mit einem rotierenden Werkzeug (siehe Tabelle der Materialien).
- Entfernen Sie die kleinen silbernen Schrauben auf der Rückseite der Kamera, um das innere Gehäuse zu entfernen.
- Entfernen Sie die kleinen schwarzen Schrauben im Inneren des Körpers der Kamera, den Rest des Objektivs zu lösen. Verwenden Sie einen kleinen Schraubenzieher, um keine Teile der Linse Gehäuse zu entfernen, was übrig bleibt, nach dem Schneiden der Linse.
- Entfernen Sie die blaue an der Oberseite von der geladenen LED gekoppelt Gerätegehäuse (CCD).
- Legen Sie die Kamera wieder zusammen indem du das Innengehäuse zurück zu der ursprünglichen Ausrichtung und verschrauben die beiden silbernen Schrauben wieder in ihre ursprüngliche Position.
- Strecke das Innere der Kamera mit einem kleinen sah, mit abgerundeten Kunststoff routing etwas passen. Glatt nach unten zusätzliche Kunststoff bis es einen Objektiv-Adapter passen.
- Installieren Sie einen IR-Pass-Filter im Inneren der Kamera so nah an der CCD möglichst ohne direkten Kontakt mit der Kamera.
Hinweis: Achten Sie darauf, nicht den CCD-Chip im Inneren des Gehäuses der Kamera beschädigen. Achten Sie darauf, den Schnitt so waagerecht wie möglich zu halten. Jede Freifläche zwischen der Außenseite des IR-Filter und den Körper der Kamera zu verhindern, dass Licht die CCD zu erreichen, ohne gefiltert zu versiegeln. - Befestigen Sie die Kamera zu einem Objektiv 35 mm fixiert (siehe Tabelle der Materialien) durch Einschrauben des Adapters an der Vorderseite der Kamera auf der Rückseite des Objektivs.
- Legen Sie die Kamera und Objektiv in das Loch in den Deckel auf die Röhre, die die Bühne und Licht Häuser gebohrt und schließen Sie den USB am Computer, die, dem von die Tieren aufgenommen werden.
Hinweis: Legen Sie Fisch in einem Verhalten Raum, getrennt von dem Lager Fische untergebracht sind, um minimale Störungen bei Verhaltensstörungen Aufnahmen zu gewährleisten. Achten Sie darauf, um zu minimieren Schwankungen in Temperatur und Belüftung der Verhaltensexperimente verwirren kann.
(2) Schlaf-System für Erwachsene
- Konstruieren Sie eine IR-Beleuchtung für die Verfolgung von ausgewachsenen Fischen von ca. 46 cm Abständen IR Streifen schneiden. Ein Streifen von 46 cm ist ausreichend für jeden Tank 10 L Verhalten.
- Jeder Streifen zusammen in einer Reihe, jeder Streifen zu DC elektrischen Draht Löten Draht und befestigen Sie mit einer 9 V-Stromquelle.
- Ein 51 cm x 5,1 cm-Stück aus Aluminium, die als Kühlkörper fungiert zuordnen Sie jeder IR-Streifen.
- Legen Sie ein 46 cm x 5 cm, 0,32 cm dicken 9 % Licht-Pass weißes Schild Acryl Blatt direkt vor jeder IR-LED-Streifen, die IR zu verbreiten Licht.
- Platzieren Sie alle Panzer auf eine Zahnstange, die hinten angebrachte IR Beleuchtung unterstützt.
- Verwenden Sie opaken Kunststoff Teiler in 10 L-Glas-Tanks, um einzelnen Arenen zu erstellen.
Hinweis: Die Arena-Größe kann je nach der Anzahl der Teiler verwendet und die Größe des Tanks variiert werden. Arena Größe wirkt lokomotorische Aktivität und Schlaf in Höhle und Oberfläche Fisch23. - Montieren Sie Kameras ca. 4-6 m vom Panzer. Jede Kamera kann in der Regel von 3 Panzer gleichzeitig bereitstellen ausreichenden Auflösung für die Verfolgung aufnehmen.
Hinweis: Erwachsenen Verhaltens Aufnahmen erfordern in der Regel keine separate weiße Beleuchtung, Tag-Nacht-Änderungen zu kontrollieren. Einfach mit standard Deckenbeleuchtung in einem Verhaltens-Raum an eine Zeitschaltuhr angeschlossen ist ausreichend.
3. Aufnahme lokomotorischen Tätigkeit
Hinweis: Alle Verhaltensstörungen Aufnahmen erfolgt über eine standard Laptop oder Desktop mit einer Pufferbatterie Quelle. Aufgrund der großen Dateigröße einer 24 h Aufnahme (60-100 GB) speichern Sie alle Aufnahmen auf externe Festplatten.
- Fische zwischen 4-30 Dpf für 18-24 h vor Beginn der Aufnahmen zu akklimatisieren. Füttern Sie Larven Fische mit live Artemia wenn zuerst in der Aufnahme-Kammer und 1 h vor Beginn der Aufnahme gelegt. 4-5 Tage vor Aufnahme Verhalten geschlechtsreifer Fische zu akklimatisieren und einmal täglich mit Flockenfutter oder mit live Blackworms zu ernähren.
Hinweis: Achten Sie darauf, Larven Fische im Süßwasser vor der Aufnahme, platzieren, da übrig gebliebenen Artemia Tracking-Probleme bei der späteren Analyse führt. Gemeinsam mit Rädertierchen Kultivierung bietet eine alternative Möglichkeit, ihrer geringen Größe mit Tracking nicht stört. - Statt Fisch im Alter von 4-6 Dpf in 24-Well-Zellkultur-Platten. Haus Fisch im Alter von 20-30 Dpf in 12-Well-Zellkultur-Platten für die Aufnahme.
- Rekord Erwachsene in 10 L Tanks passen mit Teilern, fünf individuell untergebracht Fisch unterzubringen oder ohne Trennwände zum Rekord schlafen und Tätigkeit in einem sozialen Umfeld.
Hinweis: Achten Sie darauf, die Kamera vor dem Einleiten der Aufnahme um Trackinggenauigkeit zu maximieren. Öffnen Sie die Blende der Kameralinse nicht zu weit, da dies die Schärfe des Bildes drastisch verringert wird. Allerdings gibt es ein Gleichgewicht; Wenn die Iris zu weit geschlossen ist, wird die Bildrate des Videos unter 15,00 fps fallen. Es ist wichtig für die spätere Analyse, dass die Framerate 15,00 Frames pro s für den Einsatz mit einigen Schlaf individuell geschriebenen Skript23,24 bleibt. - Hintergrund-Beleuchtung Beleuchtung/Helligkeit einstellen.
- Optimierung der Beleuchtung vor Beginn der Aufnahme. Immer den Kontrast auf höchstem Niveau möglich und verwenden Sie Helligkeit und Hintergrundbeleuchtung , um die Helligkeit zu justieren, bis die Tiere am klarsten sind.
- Rekord Fisch für 24 oder 48 Stunden.
Hinweis: Notfall backup-Batterie-Packs, die Macht der Beleuchtung, Computer und Kameras sollten bei Stromausfällen gekauft werden. Alle Akku-Packs sollte wenn möglich auch in Notfall-Steckdosen angeschlossen werden. Akku-Packs werden in der Regel nicht macht das Gerät für mehr als ein paar Minuten bis zu einer Stunde höchstens und dienen zur Brücke zwischen Hauptstrom zu verlieren und in die Notstrom-System zu übertragen.
4. Analyse der motorischen Aktivität in einzeln untergebracht Fisch mit automatisierten tracking-Software
- Um zu Beginn der Analyse des Verhaltens-Tracking-Software zu öffnen, wählen Sie Neues Experiment aus Vorlageund dann eine Pre-Defined Vorlage anwenden.
- Da das Programm nun welche Arten verfolgen aufgefordert werden, wählen Sie Fisch. Verwenden Sie die Dropdown-Box, um entweder Zebrafisch-Larven Zebrafish Erwachsenen je der experimentellen Paradigma auszuwählen.
- Richten Sie den Arenen, in denen jedes Tier verfolgt werden. Wählen Sie für Larven gut Platte, Runde gut und Nein Zonenvorlage. Verwenden Sie für Erwachsene Freiland, Quadrat mit No Zonenvorlage. Dann bestimmen Sie die richtige Anzahl von Arenen, eine für jedes Tier, in dem Video verfolgt.
- Wählen Sie das Modell für die optimale Überwachung, klicken Sie auf verfolgen Mittelpunkt, und achten Sie darauf, dass die tierische Farbe dunkler als der Hintergrund ausgewählt ist. Wenden Sie die Frame-Rate, mit der das Video übernommen wurde. Die Tracking-Software sollte dies automatisch erkennen.
- Zeichnen Sie eine Waage, um die reale Entfernung eines Objektes genau zu bestimmen, das lokomotorische Verhalten der Fische mit Arena-Einstellungenzu kalibrieren.
- Bearbeiten Sie die Arenen um sicherzustellen, dass die gesamte Fläche, die die Fische in verfolgt werden; Ansonsten werden Proben während der Akquisition verloren gehen.
Hinweis: Vorsicht beim Bereiche einrichten. Larven Fische sind besonders anfällig für Fehler verfolgen, wenn die Arenen entweder zu groß oder klein sind. Schlechter Beleuchtung im Experiment kann auch Schatten an den Wänden der well-Platten, erstellen, die das Programm ein Tier vorstellen kann, erstellen einen Fehlalarm ist. - Klicken Sie auf Erweiterte. Unter Methode in Erkennung Einstellungwählen Sie Dynamische Subtraktion, dann klicken Sie auf Hintergrund und Lernen beginnen. Einstellen Sie Dunkel-Kontrast Signal-/Rauschverhältnis, bis die Tiere gut nachverfolgt sind und Hintergrund nicht die Verfolgung verursacht zu springen.
Hinweis: Videoqualität kann variieren zwischen Experimente, so jeder Prüfung unter verschiedene Einstellungen entsprechend zu verwenden muss Umständen. Mit dem Thema Kontur und Motivgröße Funktionen kann Tracking-Ergebnisse deutlich verbessern. - Wählen Sie Test-Liste und laden Sie die richtigen Parametern zu, bevor Sie beginnen, die Daten in das Programm aufzunehmen.
- Klicken Sie in der Registerkarte " Erwerb ", wählen Sie Track alle geplanten Testversionen und klicken Sie auf die Aufnahmetaste.
- Sicherzustellen Sie unter Analyse Profil, Distanz und Zeit & Bewegung sind ausgewählt.
Hinweis: In Reihenfolge für die spätere Schlafanalyse ist es wichtig, dass diese Einstellungen korrekt sind, als die .perl Datei muss lesen diese Daten in der richtigen Reihenfolge um Schlaf zu berechnen. - Wählen Sie Rohdatenunter exportieren, exportieren Sie die Daten als Unicode-Text.
(5) Tracking untergebracht sozial Fisch
- Führen Sie die Schritte 4.1-4.4 das Experiment in der Tracking-Software einrichten.
- Wählen Sie im Dropdown-Menü wie viele Tiere, für das Experiment zu verfolgen.
- Zeichnen Sie im Arena -Einstellungen den richtigen Maßstab um den realen Abstand zu kalibrieren.
- In Erkennung Einstellungen verwenden Dynamische Subtraktionund den dunklen Kontrast um das Tier am besten zu verfolgen.
- Einstellen Sie die Motivgröße unter den Einstellungen Erkennung so, dass nur ein sehr kleiner Teil des Tieres verfolgt wird.
Hinweis: Verfolgen nur einen kleinen Teil des Tieres, wird dadurch verringert sich die Menge des Umschaltens zwischen den Tieren, wenn sie während der Akquisition kreuzen. - Sobald die Spuren gesammelt sind, mithilfe des Track-Editor manuell mal fix wo Fische kreuzen können.
(6) Gewinnung von Schlafdaten aus lokomotorischen Tätigkeit
Hinweis: Die Behaviorale Definition des Schlafes in Larven und Erwachsenen A. Mexicanus ist 1 min oder mehr Ruhe. Diese Definition wurde anhand Erregung Schwelle Experimente, wo eine größere Sinnesreiz benötigt wird, um eine Verhaltensreaktion in einem schlafenden Zustand zu initiieren (> 60 s) im Vergleich zum Aufwachen14,17. Um kleine Bewegungen und driften gemeinsame Arten, dort zu Fischen zu berücksichtigen sind Geschwindigkeit Schwellenwerte angewendet, um wirkliche Bewegung durch Lärm oder Drift zu trennen. Diese Schwellen sind rechnerisch abgeleitet, durch den Vergleich der Korrelationen zwischen Distanz und Schlafdauer, die höchsten R-squared-Werte zu finden; Dabei bestimmen die genaueste Geschwindigkeit für Bewegung und Schlaf. Für Larven Fische die oberen und unteren Grenzwerte sind beide 12 mm/s da ist wenig bis keine Drift. Die untere Grenze ist für Erwachsene Fische 2 cm/s mit einer Obergrenze von 4 cm/s, für Drift zu berücksichtigen.
- Installieren Sie Cygwin auf den Analyse-Computer, die Ausführung von individuell geschriebenen Skripten zu extrahieren Bewegungsorgane und schlafen Verhalten durchzuführen.
- Erstellen Sie einen neuen Experiment-Ordner in das Cygwin home-Verzeichnis.
- Importieren Sie die unformatierten Unicode-Daten aus tracking-Software und führen Sie die .sh-Datei im Cygwin, die Codierung von UTF-16, UTF-8 zu konvertieren.
- Führen Sie die .perl Datei in Cygwin, die Schlafdaten extrahieren.
- Öffnen Sie die Makrodatei und folgen Sie den Anweisungen in der Tabelle um die Datenanalyse wie gewünscht abzuschließen.
Hinweis: Ein Mindestmaß an Kommandozeilen-Codierung werden notwendig, diesen Teil der Analyse durchzuführen. Allgemeine Linux-Befehle ist ausreichend. Wenn es Probleme mit den Programmen die Daten richtig zu lesen sind, überprüfen Sie die Daten aus tracking-Software in einem frei verfügbaren Texteditor um sicher zu sein, die Codierung und Reihenfolge ist richtig für die ausführbaren Dateien richtig schreiben.
Ergebnisse
Larven im Alter von die 4-30 Dpf zuverlässig in den Custom-Build geschlossenen System in Abbildung 1beschriebenen aufgezeichnet werden kann. Das System beinhaltet IR und sichtbare Beleuchtung ermöglicht Aufnahmen unter hellen und dunklen Bedingungen unter verschiedenen Lichtverhältnissen sichtbar (Abb. 1A). Die Videos sind dann mit Tracking-Software (Abbildung 1 bC) analysiert und nachbearbeitet mit einem benutzerdefinierten Schlaf-Makro (siehe Ergänzende herunterladen). Larven, Fische aus drei unabhängigen Cavefish Populationen zeigen eine signifikante Reduktion in Schlaf im Vergleich zur Oberfläche Fisch (Abbildung 1) und 20 Dpf, und dieser Schlafmangel ist in Entwicklungsstadien einheitlich. Das Alter der Fische für den Schlaf analysiert ist oft abhängig von der experimentellen Manipulation. Z. B. verbrauchen A. Mexicanus nicht Nahrung an 4 Tagen so Experimente untersuchen Wechselwirkungen zwischen Schlaf und Ernährung in der Regel bei älteren Larven25auftreten würde. Umgekehrt sind Morpholinos nur wirksam bei der frühen Bundesrepublik Jugoslawien (in der Regel jünger als 4 Dpf), so dass diesem Alter Esel Schlaf24,26,27verwendet wird.
A. Mexicanus kann bis zu 30 Jahre lang im Labor Leben, aber Experimente mit Erwachsenen sind in der Regel bei Fischen im Alter von 6 Monaten bis 3 Jahren durchgeführt. Fische können in einer Vielzahl von Tankgrößen, je nach dem Experiment aufgezeichnet werden und IR Beleuchtung ermöglicht Aufnahmen in hellen und dunklen Zeiten (Abbildung 2A). Einzelnen Arenen sind bei der Verfolgung um Verfolgung der Fische zu ermöglichen, und Nachbearbeitung mithilfe eines benutzerdefinierten Makros bietet eine Auslesen des Schlafes (Abb. 2 bC). Schlaf ist in Pachón, Molino und Tinaja Cavefish, im Vergleich zur Oberfläche Fisch (Abb. 2D) deutlich reduziert. Darüber hinaus ermöglicht dieses System für die Aufzeichnung, dass mehrere Fische in einer einzigen Arena (in der Regel 10 Gallonen-Tanks), Analyse der wie soziale Interaktionen, zulassend Schlaf (Abbildung 2EF) beeinflussen. Sozialen Wohnungsbaus robust reduziert Schlaf Oberfläche Fisch ohne Schlaf in Pachón Cavefish (Abbildung 2). Die fehlende Wirkung in Cavefish ist wahrscheinlich auf einen Keller-Effekt, wo schlafen Cavefish wenig, besonders in den größeren Arenen verwendet, um soziales Verhalten zu untersuchen.
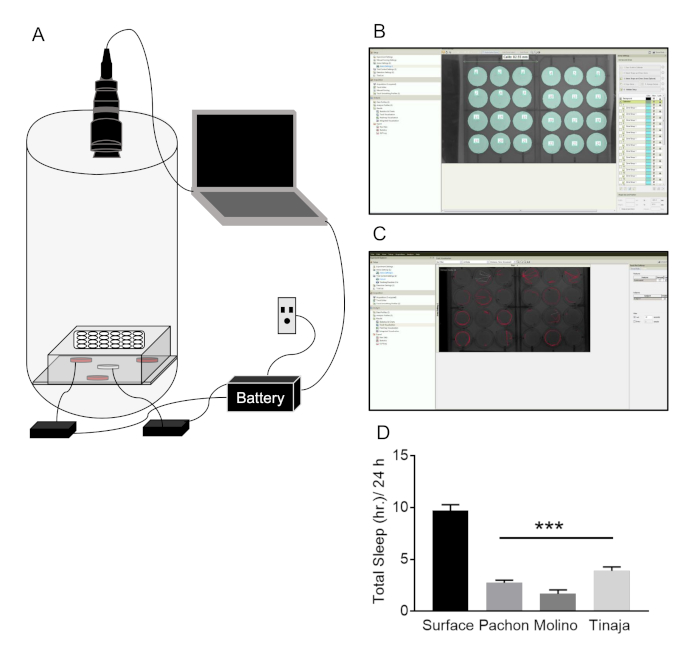
Abbildung 1: Aufnahme Schlafverhalten in Larven- und juvenile A. Mexicanus. (A) schematische Darstellung der Larven Schlaf Verhalten Setup: Larve befinden sich auf einer Plattform in einem lichtgesteuerten Rohr. Infrarot- und weißen Beleuchtungssysteme sitzen unter den Fisch an der Unterseite des Rohres. Eine IR-Pass-Kamera sitzt an der Spitze des Rohres und ist an einen Laptop, auf dem das Video aufgenommen wurde. Alle angetriebenen Systeme (Beleuchtung und Laptop) sind an backup-Stromversorgung angeschlossen. (B) Arena Einstellungen im tracking-Software. Einzelne Larven befinden sich im Brunnen in einer Gewebekultur-Platte und die Arenen (Cyan) erfolgen für jedes Tier. (C) Bewegungsorgane Spuren von Fisch lokomotorische Verhalten nach der Übernahme von Daten in tracking-Software. Rote Spuren repräsentieren 10 s Aktivität in 20 - Tage alten Fisch. (D) resultierende schlafen Daten aus tracking-Software. Juvenile Cavefish konvergieren auf reduzierte Schlafverhalten im Vergleich zur Oberfläche Fisch Morphen (One-Way ANOVA F(3, 116) = 76.12; Dunnett Post-hoc-Analyse wurde angewandt, um jede Cavefish Bevölkerung mit Oberfläche Fischen, P vergleichen < 0,001). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Erwachsene A. Mexicanus System für Schlaf und circadiane Verhalten. (A) Darstellung der Schlaf-Aufnahme-System: Fisch in Tanks auf einem Rack gegenüber von tracking-Kameras gehalten werden. Ein Infrarot-Beleuchtung-System befindet sich hinter der Aquarien, während IR-Pass-Kameras an einen Laptop für Aufzeichnungsverhalten angebracht sind. Alle angetriebenen Systeme sind an eine backup-Batterie-System im Falle von Stromschwankungen angeschlossen. (B) Arena setup im tracking-Software. Einzelne Fische zeichnen sich durch Erstellen von separaten Arenen (Cyan) um lokomotorische Verhalten zu verfolgen. (C) repräsentative Bewegungsorgane Spuren (rote Linien) der einzelnen Fische nach dem Erwerb einer verhaltensbedingten Aufnahme auf tracking-Software. Spuren sind 20 s Aktivität. (D) Gesamt-Schlafdauer über 24 h ist in drei unterschiedlichen Populationen von Cavefish im Vergleich zur Oberfläche Fische deutlich reduziert (One-Way ANOVA F(3, 106) = 52.66; Dunnett Post-hoc-Tests galten zwischen Oberfläche Fisch und jede Höhle Bevölkerung, P < 0,001). (E) A Tankfüllung mit mehreren Fischen in denen Arena (Orange) gemacht wird, um soziale Interaktionen und Schlaf verfolgen. (F) Bewegungsorgane Spuren von mehreren Fischen nach Datenerfassung im tracking-Software (jede Farbe steht für einen einzelnen Fisch). (G) repräsentative Daten von Oberfläche und Pachón Cavefish in sozialen Schlaf-tracking. Oberfläche Fisch senken Schlaf in 10 L Becken im Vergleich zu 2 L Arenen; Oberfläche Fische schlafen wird weiter gesenkt, wenn Fisch sozial untergebracht sind. Cavefish Schlaf ist nicht wesentlich verändert, in jedem Zustand (Two-Way ANOVA F(2,46) = 4.545; post-hoc-Analyse wurde durchgeführt in jeder Bevölkerung um die Wirkung der Tankgröße und Sozialstaat auf total Schlaf 10 L, P = 0,013; 10 L soziale, P = 0,0003). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Protokoll beschreibt ein maßgeschneidertes System zur Quantifizierung der Schlaf und Bewegungsorgane Aktivität bei Larven und adulten Cavefish. Cavefish entstanden als führende Modell für das Studium der Evolution des Schlafes, die verwendet werden kann, um die genetischen und neuronalen Grundlagen der Schlaf Verordnung1zu untersuchen. Die entscheidenden Schritte in dieses Protokoll gehören Optimierung der Beleuchtung und Videoqualität um genaues tracking zu gewährleisten ist notwendig, um Schlaf zu quantifizieren. Das System zur Erfassung und Analyse, die hier beschrieben sind voll funktionsfähig, wie vielen anderen Systemen, sowohl kommerzielle als auch Spezialanfertigungen, Fortbewegung und Verhalten28,29,30quantifizieren. Der vorherige Test Prüfung in einzelne Fische schlafen kann erweitert werden, um eine Analyse der Gruppe untergebracht Fisch ermöglichen. Ein maßgeblicher Aspekt bei der Fehlersuche oder der Gestaltung Assays ist die verwirrt Sozialverhalten auf den Schlaf des Individuums haben kann. Zum Beispiel Aggression ist häufig bei Astyanax, und Aggression Ebenen Oberfläche Fisch und Cavefish31unterschiedlich. Optimierung der Anzahl der Fische, Größe der Arena und Geschlechterverhältnis, ermöglichen um Aggressionen zu minimieren für reproduzierbare Messungen der Schlafregulation.
Eine Einschränkung der Technik, ist wie beschrieben, ein Mangel an Zuverlässigkeit nach einzelnen Fische während des Tests. Automatisierte Tier-Tracking werden Tiere oft wechseln, wenn sie in engen Kontakt kommen. Dies kann durch sorgfältige Optimierung der Schwellenwerte oder manuell korrigieren alle Schalter behoben werden. Darüber hinaus das beschriebene System ist kein Durchfluss-System, und daher Wasserqualität kann zu einem Problem werden nach mehr als ein paar Tage dauernden Aufnahmen. Anderen Durchströmung Systeme wurden im Zebrafisch13 beschrieben und diese leicht auf den Stall des mexikanischen Cavefish angewendet werden.
Die beschriebene Methode gilt wegen seiner breiten Anwendbarkeit auf Verhalten in unterschiedlichen Fischarten zu messen. Schlaf ist noch in fast jedem marine oder Süßwasser-Fische, darunter Stichlinge, Cichliden, Swordtails32,33,34charakterisiert werden. Die Vielseitigkeit dieses Systems, Schlaf in A. Mexicanus und anderen Fisch-Modellen messen kann verschiedenes über die Evolution und genetischen Grundlagen des Schlafes richten. Die Hardware, die verbunden sind mit diesem System ist sehr kostengünstig, so dass es sehr zugänglich und bietet Potenzial für Hochdurchsatz-Analyse der pharmakologischen und Ecotoxilogical Analyse von Schlaf und motorischen Aktivität.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Diese Arbeit wurde von NIGMS GM127872 ACK, NINDS Award 105072 ERD und ACK, und NSF Award 1656574, ACK unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12 V power adaptor | Environmental Lights | 24 Watt 12 VDC Power Supply | |
| Acrylic dividers (adults) | TAP Plastic | Order sheets in sizes as needed | |
| Adult infrared light power source | Environmnental Lights 24 Watt 12 VDC Power Supply | ||
| Battery pack | CyberPower | CP850PFCLCD | |
| Camera lens (adult) | Navitar Zoom 7000 | Zoom 7000 | |
| Camera lens (larval) | Fujian 35mm f/1.7 | B01CHX7668 | Purchase on Amazon |
| Camera lens adapter | d | 1524219 | |
| Camera mount | CowboyStudio Super Clamp | B002LV7X1K | Purchase on Amazon |
| Fish tank | Deep Blue Professional | ADB11006 | |
| Heat sink (adult) | M-D Building products | SKU: 61085 | Cut to fit |
| Heat sink (larval) | M-D Building products | SKU: 57000 | Cut to fit |
| Infrared lights (adults) | Environmental Lights Infrared 850 nm 5050 LED strip | irrf850-5050-60-reel | Cut to fit |
| Infrared lights (larval) | LED World | B00MO9H7H4 | Purchase on Amazon |
| IR-diffusing acrylic | TAP Plastic | Order sheets in sizes as needed | |
| Laptop/computer | N/A | N/A | Any laptop will work. |
| LED light | Chanzon 10 High Power Led Chip 3W White (6000K-6500K/600mA-700mA/DC 3V-3.4V/3 Watt) | B06XKTRSP7 | Use with Chanzon 25 pcs 1 W, 3 W, 5 W LED Heat Sink (2 pin Black) Aluminum Base Plate Panel |
| light timer | Century 24 Hour Plug-in Mechanical Timer Grounded | ||
| Plastic wall mount for IR | Everbilt Plastic pegboard | Model # 17961 | |
| Power cable | BNTECHGO 22 Gauge Silicone Wire | B01K4RPE0Y | |
| Power source | Rapid LED | MOONLIGHT DRIVER (350MA) | |
| Tissue culture plates | Fisherbrand | 12-well (FB012928) 24-well (FB012929) | |
| Tripod Ball head | Demon DB-44 | B00TQ54CZO | Purchase on Amazon |
| USB Hardrive | Seagate 3TB backup | STDT3000100 | |
| USB Webcam | Microsoft LifeCam | Q2F-00014 | Purchase on Amazon |
| Wall mount for camera | LDR Industries 1/2" Steel pipe | 307 12X36 | Mounted on wall with Flange and 90° pipe elbow. Could also use a tripod to hold camera. |
Referenzen
- Keene, A. C., Duboue, E. R. The origins and evolution of sleep. The Journal of Experimental Biology. , (2018).
- Joiner, W. J. Unraveling the Evolutionary Determinants of Sleep. Current Biology. 26 (20), R1073-R1087 (2016).
- Allada, R., Siegel, J. M. Unearthing the phylogenetic roots of sleep. Current biology. 18, R670-R679 (2008).
- Sehgal, A., Mignot, E. Genetics of sleep and sleep disorders. Cell. 146, 194-207 (2011).
- Campbell, S. S., Tobler, I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience and Biobehavioral Reviews. 8, 269-300 (1984).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Geissmann, Q., Rodriguez, L. G., Beckwith, E. J., French, A. S., Jamasb, A. R., Gilestro, G. Ethoscopes: An Open Platform For High-Throughput Ethomics. bioRxiv. , 113647(2017).
- Garbe, D. S., et al. Context-specific comparison of sleep acquisition systems in Drosophila. Biology Open. 4 (11), (2015).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6 (6), 451-457 (2009).
- Gilestro, G. F., Cirelli, C. PySolo: A complete suite for sleep analysis in Drosophila. Bioinformatics. 25, 1466-1467 (2009).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6, 451-457 (2009).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science (New York, N.Y.). 327, 348-351 (2010).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, (2015).
- Chiu, C. N., Prober, D. A. Regulation of zebrafish sleep and arousal states: current and prospective approaches. Frontiers in Neural Circuits. 7 (April), 58(2013).
- Elbaz, I., Foulkes, N. S., Gothilf, Y., Appelbaum, L. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish. Frontiers in Neural Circuits. 7, (2013).
- Duboué, E. R., Keene, A. C., Borowsky, R. L. Evolutionary convergence on sleep loss in cavefish populations. Current Biology. 21, 671-676 (2011).
- Beale, A., et al. Circadian rhythms in Mexican blind cavefish Astyanax mexicanus in the lab and in the field. Nature Communications. 4, 2769(2013).
- Keene, A. C., Yoshizawa, M., McGaugh, S. E. Biology and Evolution of the Mexican Cavefish. , (2015).
- Jeffery, W. R. Regressive evolution in Astyanax cavefish. Annual Review of Genetics. 43, 25-47 (2009).
- Gross, J. B. The complex origin of Astyanax cavefish. BMC Evolutionary Biology. 12, 105(2012).
- Aspiras, A., Rohner, N., Marineau, B., Borowsky, R., Tabin, J. Melanocortin 4 receptor mutations contribute to the adaptation of cavefish to nutrient-poor conditions. Proceedings of the National Academy of Sciences. 112 (31), 9688(2015).
- Jaggard, J., et al. The lateral line confers evolutionarily derived sleep loss in the Mexican cavefish. Journal of Experimental Biology. 220 (2), (2017).
- Jaggard, J. B., Stahl, B. A., Lloyd, E., Prober, D. A., Duboue, E. R., Keene, A. C. Hypocretin underlies the evolution of sleep loss in the Mexican cavefish. eLife. , e32637(2018).
- Hinaux, H., et al. A Developmental Staging Table for Astyanax mexicanus Surface Fish and Pacho ´n Cavefish. Zebrafish. 8 (4), 155-165 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., La Schimmenti,, Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Bilandzija, H., Ma, L., Parkhurst, A., Jeffery, W. A potential benefit of albinism in Astyanax cavefish: downregulation of the oca2 gene increases tyrosine and catecholamine levels as an alternative to melanin synthesis. Plos One. 8 (11), e80823(2013).
- Yokogawa, T., et al. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biology. 5, 2379-2397 (2007).
- Appelbaum, L., et al. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 106, 21942-21947 (2009).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. eLife. 4 (September), (2015).
- Elipot, Y., Hinaux, H., Callebert, J., Rétaux, S. Evolutionary shift from fighting to foraging in blind cavefish through changes in the serotonin network. Current Biology. 23 (1), 1-10 (2013).
- Bell, M. A., Foster, S. A. The evolutionary biology of the threespine stickleback. 584, Oxford University Press. Available from: http://books.google.com/books?hl=de&lr=&id=uxC0lN-Z3FIC&pgis=1 (1994).
- Seehausen, O. African cichlid fish: a model system in adaptive radiation research. Proceedings of Biological Sciences/The Royal Society. 273 (1597), 1987-1998 (1597).
- Basolo, A. L. Female preference predates the evolution of the sword in swordtail fish. Science. 250, 808-810 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten