Method Article
Mesures automatisées de sommeil et de l’activité locomotrice dans Agassizii mexicain
Dans cet article
Résumé
Ce protocole décrit en détail la méthodologie utilisée pour quantifier le comportement locomoteur et dormir dans l’agassizii mexicain. Les analyses antérieures sont étendues pour mesurer ces comportements chez les poissons socialement logés. Ce système peut être largement appliqué pour étudier le sommeil et l’activité chez d’autres espèces de poissons.
Résumé
À travers des phylums, sommeil se caractérise par des caractéristiques comportementales hautement conservées qui incluent le seuil d’excitation élevé, rebondissement après privation de sommeil et consolidés des périodes d’immobilité comportementale. Le mexicain spelaea, Astyanax mexicanus (a. mexicanus), est un modèle pour l’étude de l’évolution du trait en réponse aux perturbations environnementales. A. mexicanus existe comme dans eyed surface vivant dans les formes et de multiples populations cavernicoles aveugles qui ont des différences morphologiques et comportementales robustes. La perte de sommeil s’est produite dans les populations multiples, agassizii évolué indépendamment. Ce protocole décrit une méthode pour quantifier le sommeil et l’activité locomotrice dans a. mexicanus grotte et poissons de surface. Un système de vidéosurveillance rentable permet l’imagerie comportementale de poissons larvaires ou adultes hébergés individuellement pour des périodes d’une semaine ou plus. Le système peut être appliqué pour des poissons âgés de 4 jours après la fécondation à l’âge adulte. L’approche peut aussi être adaptée pour mesurer les effets d’interactions sociales sur le sommeil en enregistrant plusieurs poissons dans une arène unique. Suite à des enregistrements comportements, données sont analysées à l’aide automatique de logiciel de suivi et analyse de sommeil est traitée à l’aide de scripts personnalisés qui quantifient les multiples variables de sommeil, y compris la durée, la longueur de bout et nombre de combat. Ce système peut être appliqué à la mesure de sommeil, le comportement circadienne et l’activité locomotrice dans presque toute espèce de poissons dont le poisson-zèbre et les épinoches.
Introduction
Sommeil est hautement conservée tout au long du règne animal à des niveaux physiologiques, fonctionnelle et comportementale1,2,3. Tandis que le sommeil chez les animaux de laboratoire chez les mammifères est généralement évaluée au moyen des électroencéphalogrammes, des enregistrements électrophysiologiques sont moins pratiques dans des systèmes modèles génétiquement prêtent petit et donc sommeil est généralement mesurée selon le comportement3 , 4. caractéristiques comportementales associées au sommeil sont fortement conservés dans tout le règne animal et inclure le seuil d’excitation accrue, réversibilité avec stimulation et prolongée de quiescence comportementale5. Ces mesures peuvent servir à caractériser le sommeil chez les animaux allant de la ver nématode, c. elegans, à travers les humains6.
L’utilisation de quiescence comportementale pour caractériser le sommeil nécessite le logiciel de suivi automatisé. Avec le logiciel de suivi, des périodes d’activité et d’immobilité sont déterminées pendant plusieurs jours, et longues périodes d’inactivité sont classées comme dormir7,8. Ces dernières années, plusieurs systèmes de suivi ont été développés pour l’acquisition des données d’activité parmi une diversité de systèmes de petits modèles génétiquement susceptibles ; y compris les vers, les mouches des fruits et poisson9,10,11. Ces programmes sont accompagnés d’un logiciel qui permet un suivi automatisé du comportement animal, y compris les freeware open source et des logiciels disponibles dans le commerce7,12,13,14 . Ces systèmes se distinguent par leur souplesse et permettant un dépistage efficace et caractérisation des phénotypes de sommeil dans les nombreux modèles génétiquement amendables.
Une enquête génétique du sommeil dans le poisson-zèbre, Danio rerio, a abouti à l’identification de nombreux gènes et des circuits neuronaux qui régulent le sommeil15,16. Tandis que ceci a fourni un système puissant pour étudier les bases neurales de sommeil chez des animaux vertébrés de laboratoire, est beaucoup moins connu sur la façon dont le sommeil évolue et comment naturel variation contribue règlement de sommeil. Le mexicain spelaea, Astyanax mexicanus (A. mexicanus), ont évolué des différences spectaculaires dans le sommeil, l’activité locomotrice et rythmes circadiens17,18. Ces poissons existent comme les poissons de surface eyed qui peuplent les rivières du Sud du Texas et le Mexique et au moins 29 cave les populations autour de la région de la Sierra Del Abra du Nord-est du Mexique19,20,21. Remarquablement, les nombreuses différences de comportement, y compris la perte de sommeil, semblent sont apparues indépendamment dans plusieurs agassizii populations14,22. Par conséquent, agassizii fournit un modèle pour l’étude de l’évolution convergente du sommeil, rythme circadien et des comportements sociaux.
Ce protocole décrit un système pour mesurer le sommeil et le comportement locomoteur a. mexicanus larves et les adultes. Un système d’enregistrement infrarouge sur mesure permet pour l’enregistrement vidéo des animaux dans des conditions claires et foncées. Logiciel disponible dans le commerce peut être utilisé pour mesurer l’activité et des macros personnalisées sont utilisées pour quantifier plusieurs aspects d’inactivité et de déterminer les périodes de sommeil. Ce protocole décrit également les modifications expérimentales pour le suivi de l’activité de plusieurs animaux dans un réservoir, permettant d’examiner les interactions entre le sommeil et les comportements sociaux. Ces systèmes peuvent servir à mesure sommeil, le comportement de rythme circadien et l’activité locomotrice chez les espèces de poissons supplémentaires y compris le poisson-zèbre et les épinoches.
Protocole
Remarque : Mettre en place les systèmes pour le suivi comportemental chez les larves et les adultes.
1. construction d’un système de sommeil pour les larves
Remarque : Le système de surveillance pour le suivi des larve à travers les poissons juvéniles âgés de 4 jours après la fécondation (dpf) par le biais de dpf 30 a. mexicanus nécessite automatisé de multiples pièces d’équipement, y compris l’éclairage infrarouge (IR), diffuseurs de lumière acrylique IR, lumière contrôles (timers), ordinateurs, caméras et matières secondaires telles que le câblage et les contrôleurs de puissance (Figure 1 a). Les instructions suivantes vont informe comment construire un système permettant de suivre avec précision le comportement locomoteur pour étudier le sommeil et les rythmes circadiens en larves a. mexicanus.
- Construire un système d’éclairage composé d’IR et de la lumière blanche des diodes électroluminescentes (LED) : placer les trois lumières de IR dans un triangle environ 7,62 de cm les uns des autres sur un radiateur de plate-forme métallique mince de 30,5 cm x 30,5 cm. Lumières dans la série de fil avec fil électrique et se connecter à une source d’alimentation.
- Placez une seule lumière blanche LED au centre des trois lampes IR et joignez-les à la source d’alimentation.
- Se connecter à la source de courant pour la LED à un temporisateur léger réglé pour une durée standard de rythme circadienne.
- Construire une plate-forme pour le système de suivi des larves. Utiliser 0,33 cm épaisseur panneau blanc acrylique pour tous les composants de la plate-forme.
- Placez la plateforme d’enregistrement sur le dessus du dissipateur de chaleur carré lumineux sur quelles arènes contenant du poisson résidera durant le suivi comportemental.
-
Placer un deuxième acrylique à l’intérieur de la boîte entre les lumières et les animaux pour diffuser l’IR pour un éclairage optimal et le contraste.
Remarque : les dimensions de la boite à lumière larvaire se présente comme suit : deux 18 x 8,5 cm et deux 17 cm x 8,5 cm LEDs qui sont liés chimiquement ensemble pour former un 18 cm x 18 cm carré qui est de 8,5 cm de haut. En outre, acrylique peut être facilement coupés ou percés en utilisant les outils appropriés pour le dimensionnement sur mesure.- Placez le stade entier suivi larvaire et installation d’éclairage dans un tube en plastique joint et puis placez la caméra sur le dessus du tube.
Remarque : Il est important de conserver les reflets de lumière apparaissent sur la vidéo de suivi, car cela gênera la précision de suivi. Le placement des caméras au sommet d’un tube qui entoure la plateforme améliore l’éclairage et la netteté pour les caméras qui sont utilisés pour ces expériences.
- Placez le stade entier suivi larvaire et installation d’éclairage dans un tube en plastique joint et puis placez la caméra sur le dessus du tube.
- Manipuler une webcam (voir Table des matières) pour enregistrement sur IR. Retirez la lentille du fabricant à l’aide d’un outil rotatif (voir Table des matières).
- Retirez les petites vis argentées sur les côtés arrière de l’appareil photo pour enlever l’intérieur du logement.
- Enlever les petites vis noires à l’intérieur du corps de la caméra pour desserrer le reste de la lentille. Utilisez un petit tournevis pour enlever toutes les portions du boîtier objectif qui reste après avoir coupé la lentille.
- Supprimer le LED bleu sur la partie supérieure de l’accusé couplée logement du périphérique (CCD).
- Mis en place le dos de l’appareil en plaçant l’intérieur du logement à son orientation initiale et visser les deux vis argentées à leur position d’origine.
- Route de l’intérieur de la caméra à l’aide d’un petit vu adaptée avec un peu de routage en plastique arrondi. Lissent le plastique supplémentaire jusqu'à ce qu’il peut s’adapter à un adaptateur d’objectif.
- Installer un filtre IR passe à l’intérieur de la caméra au plus près le CCD que possible sans faire un contact direct avec l’appareil photo.
Remarque : Prendre soin de ne pas pour endommager la puce CCD dans le boîtier de la caméra. N’oubliez pas de garder la coupe une surface aussi plate que possible. Sceller n’importe quel espace vide entre l’extérieur du filtre IR et le corps de l’appareil photo pour garder la lumière d’atteindre le capteur CCD sans être filtré. - Fixer la caméra à un objectif de 35 mm fixée (voir Table des matières) en vissant l’adaptateur sur le devant de la caméra à l’arrière de la lentille.
- Placez l’appareil et l’objectif dans le trou percé dans le couvercle sur le dessus du tube qui abrite la scène et les lumières et branchez la clé USB sur l’ordinateur de que les animaux seront enregistrées.
Remarque : Placer le poisson dans une pièce de comportement distinct abritant des poissons stocks afin d’assurer des perturbations minimes durant les enregistrements comportements. Prendre soin de réduire les fluctuations de température et de ventilation qui peut confondre les expériences comportementales.
2. sommeil système pour adultes
- Construire un système d’éclairage IR pour le suivi des poissons adultes en coupant des bandes IR à intervalles d’environ 46 cm. Une bande de 46 cm est suffisante pour chaque réservoir de comportement de 10 L.
- Chaque bande ensemble dans une série, chaque bande à fil électrique DC de soudure de fil et attacher à une source d’alimentation 9 V.
- Fixer chaque bande IR à une pièce de 51 cm x 5,1 cm d’aluminium qui agira comme un dissipateur de chaleur.
- Placez une 46 cm x 5 cm, 0,32 cm épaisseur 9 % panneau blanc lumière-pass acrylique feuille directement en face de chaque bande de lumière IR pour diffuser l’IR lumière.
- Placez tous les réservoirs sur une grille qui prend en charge l’éclairage de IR monté à l’arrière.
- Utilisez intercalaires en plastique opaques dans les réservoirs de verre de 10 L pour créer différents arénas.
Remarque : La taille de l’arène peut varier selon le nombre de diviseurs utilisés et la taille du réservoir. Taille de l’arène un impact sur l’activité locomotrice et dormir dans la cave et de poissons de surface23. - Monter les caméras environ 4 à 6 m de réservoirs. Chaque appareil peut généralement enregistrer de 3 réservoirs à la fois de fournir une résolution suffisante pour le suivi.
Remarque : Enregistrements comportementales adultes ne nécessitent généralement un système d’éclairage blanc séparé pour contrôler les changements de jour comme de nuit. Utilisant simplement standards plafonniers en chambre comportemental relié à une minuterie est susceptible d’être suffisant.
3. enregistrement activité locomotrice
Remarque : Tous les enregistrements comportements sont réalisés à l’aide d’un ordinateur portable standard ou bureau avec une source de la batterie de secours. En raison de la taille de fichier volumineux d’un 24 heures d’enregistrement (60-100 GB), enregistrer tous les enregistrements sur disques durs externes.
- Acclimater les poissons entre 4 et 30 ans dpf pendant 18 à 24 heures avant l’ouverture des enregistrements. Se nourrissent de larves de poissons avec artémias vivants lorsqu’il est tout d’abord placé dans la chambre d’enregistrement et 1 h avant de commencer l’enregistrement. Acclimater les poissons adultes 4-5 jours avant enregistrement comportement et nourrir une fois par jour avec de la nourriture de flocon ou avec direct donné.
Remarque : N’oubliez pas de placer des larves de poissons en eau douce avant enregistrement, restes d’artémia qui provoquerait des questions de suivi au cours de l’analyse ultérieure. Co-culture avec des rotifères fournit une option alternative, que leur petite taille n’interfère pas avec le suivi. - Place poissons âgés de 4-6 dpf en plaques 24 puits vitroplants. Poisson maison âgés de 20 à 30 dpf en plaques de culture de tissu de 12 puits pour l’enregistrement.
- Records adultes dans des réservoirs de 10 L ajustement PeliCase pour accueillir cinq poissons individuellement logés avec ou sans séparateurs pour dormir record et une activité dans un contexte social.
Remarque : Prendre soin de se concentrer la caméra avant de lancer l’enregistrement afin de maximiser la précision de suivi. Ne pas ouvrir le diaphragme de l’objectif trop loin, car cela réduira considérablement la netteté de l’image. Il y a un équilibre, cependant ; Si le diaphragme est fermé trop loin, la cadence de la vidéo sera inférieure à 15,00 fps. Il est essentiel pour une analyse ultérieure que la cadence reste 15,00 images / s pour une utilisation avec une écriture personnalisée sommeil script23,24. - Set d’éclairage/luminosité illuminations de fond.
- Optimiser l’éclairage avant le début de l’enregistrement. Toujours garder le contraste du plus haut niveau possible et utiliser la luminosité et Rétroéclairage pour régler la luminosité jusqu'à ce que les animaux sont plus claires.
- Poissons record pour 24 ou 48 heures.
Remarque : Packs batterie de secours d’urgence qui équipent tous l’éclairage, les ordinateurs et les caméras doivent être achetés en cas de pannes d’électricité. Toutes les batteries doivent également être branchés dans les prises d’alimentation électrique de secours, si possible. Accus ne seront généralement pas alimenter les équipements pendant plus de quelques minutes à une heure au plus et servir de pont entre la perte de puissance principal et transférer vers le système d’alimentation électrique de secours.
4. analyse de l’activité locomotrice dans individuellement logés poisson utilisant automatisé dépistant le logiciel
- Pour commencer l’analyse du comportement, ouvrez le logiciel de suivi, sélectionnez Nouvelle expérience de modèle, puis sélectionnez appliquer un modèle de pre-defined.
- Comme le programme va maintenant demander quelle espèce de suivre, de sélectionner des poissons. Utilisez la liste déroulante pour sélectionner soit Des larves de poisson zèbre Poisson-zèbre adulte selon le paradigme expérimental.
- Mettre en place des arènes où chaque animal est suivi. Pour les larves, sélectionnez bien plat, bien rond et le Modèle de Zone No. Pour les adultes, utilisez Square en plein champ, avec le Modèle de Zone No. Ensuite, déterminer le nombre approprié d’arènes, un pour chaque animal suivi dans la vidéo.
- Sélectionnez le modèle pour un suivi optimal, cliquez sur suivre centre-point de , et n’oubliez pas que la couleur de l’animale est sélectionnée pour être plus foncée que le fond. Appliquer la cadence à laquelle la vidéo a été acquise. Le logiciel de suivi devrait détecter automatiquement cela.
- Dessiner une échelle permettant de calibrer la distance réelle d’un objet pour déterminer avec précision le comportement locomoteur des poissons à l’aide de Paramètres de l’arène.
- Modifier l’échelle pour s’assurer que toute la zone que les poissons sont en assurera le suivi ; sinon les échantillons seront perdues lors de l’acquisition.
Remarque : Soyez prudent lorsque vous configurez les zones. Larves de poissons en particulier sont sensibles aux suivi des erreurs si les arènes sont trop gros ou trop petit. Mauvais éclairage dans l’expérience peut également créer des ombres sur les murs des plaques bien, le programme peut pense que c’est un animal, créant un faux positif. - Cliquez sur avancé. En vertu de la méthode dans Le paramètre de détection, sélectionner Soustraction dynamique, cliquez sur arrière-plan , puis sélectionnez Démarrer apprentissage. Ajuster le ratio signal/bruit de contraste foncé jusqu'à ce que les animaux sont bien suivis, et l’arrière-plan n’est pas causer le suivi sauter.
Remarque : Qualité vidéo peut varier entre les expériences, chaque essai devrez peut-être utiliser des paramètres différents, en conséquence. En utilisant les fonctionnalités de la Taille du sujet et du Contour de l’objet peut améliorer considérablement les résultats de suivi. - Sélectionnez liste des procès et charger les paramètres appropriés avant de commencer à enregistrer les données dans le programme.
- Cliquez dans l’onglet Acquisition , sélectionnez Track tous les essais prévus et cliquez sur le bouton d’enregistrement.
- Sous Profil analyse, assurez-vous de Distance, temps et mouvement sont sélectionnés.
Remarque : Pour une analyse ultérieure de sommeil, il est essentiel que ces paramètres sont corrects, comme la .perl fichier doit lire ces données dans l’ordre correct pour calculer le sommeil. - Sous exporter, sélectionnez les Données brutes, exporter les données sous forme de texte Unicode.
5. suivi socialement abrité au poisson
- Suivez les étapes 4.1 à 4.4 pour entamer l’expérience dans le logiciel de suivi.
- Dans le menu déroulant, sélectionnez le nombre d’animaux à suivre pour l’expérience.
- Dans paramètres de l’Arena , dessiner la bonne échelle pour étalonner la distance réelle.
- Dans paramètres de détection , utilisez la Soustraction dynamiqueet régler le contraste sombre pour mieux suivre l’animal.
- Ajuster la taille de l’objet sous les paramètres de détection, alors que seulement une infime partie de l’animal est suivie.
Remarque : Grâce au suivi qu’une petite partie de l’animal, cela réduira la quantité de commutation entre les animaux quand ils croisent lors de l’acquisition. - Une fois que les titres sont acquis, utilisez l' Éditeur de piste pour fixer manuellement les fois où le poisson peut croiser.
6. extraction des données de sommeil de l’activité locomotrice
Remarque : La définition de comportementale de sommeil chez les larves et les adultes a. mexicanus est 1 min ou plus silencieuse. Cette définition a été déterminée à l’aide d’expériences de l’excitation de seuil, où un stimulus sensoriel supérieur est nécessaire pour enclencher une réponse comportementale dans un état de sommeil (> 60 s) par rapport à la veille de14,17. Pour tenir compte des petits mouvements et dérive commun de pêcher des espèces, il les seuils de vitesse sont appliquées afin de séparer le mouvement réel de bruit ou de la dérive. Ces seuils sont mathématiquement dérivée en comparant les corrélations entre la distance et la durée du sommeil pour trouver les valeurs les plus élevées R-carré ; déterminant ainsi la vitesse plus précis pour le mouvement et le sommeil. Pour les larves de poissons, les limites supérieures et inférieures sont les deux 12 mm/s car il y a peu à aucune dérive. Pour les poissons adultes, la limite inférieure est 2 cm/s avec une limite supérieure de 4 cm/s pour tenir compte de la dérive.
- Installer Cygwin à l’ordinateur d’analyse pour procéder à l’exécution des scripts pour extraire locomotrice et sommeil comportement écriture personnalisée.
- Créez un nouveau dossier d’expérience dans le répertoire Cygwin.
- Importer les données Unicode brutes du logiciel de suivi et d’exécuter le fichier .sh dans Cygwin pour convertir l’encodage UTF-16 en UTF-8.
- Exécutez le fichier .perl dans Cygwin pour extraire les données de sommeil.
- Ouvrez le fichier de macro et suivez les instructions dans la feuille de calcul pour finaliser l’analyse des données comme vous le souhaitez.
Remarque : Un niveau de base du codage de ligne de commande seront nécessaire pour exécuter cette partie de l’analyse. Commandes général Linux suffira. S’il y a des problèmes avec les programmes de lecture des données correctement, vérifier les données du logiciel dans n’importe quel éditeur de texte disponible gratuitement de suivi pour s’assurer l’encodage et commande est correcte pour les fichiers exécutables d’écrire correctement.
Résultats
Âge des larves que DPF 4-30 peut être enregistrées de façon fiable dans le système fermé de mesure décrit à la Figure 1. Le système comprend deux IR et l’éclairage visible permettant des enregistrements dans des conditions claires et foncées, dans diverses conditions de lumière visibles (Figure 1 a). Les vidéos sont ensuite analysées à l’aide du logiciel de suivi (Figure 1 bC) et traitement à l’aide d’une macro de sommeil personnalisé (voir Téléchargement supplémentaire). Larves de poissons provenant de trois populations indépendantes agassizii affichent une réduction significative en sommeil par rapport aux poissons de surface (Figure 1) et 20 dpf, et cette perte de sommeil est constante dans les stades de développement. L’âge des poissons analysés pour sommeil dépend souvent de la manipulation expérimentale. Par exemple, a. mexicanus ne pas consommer d’aliments à 4 jours, donc l’examen des interactions entre le sommeil et d’alimentation des expériences se produirait généralement de larves âgées25. À l’inverse, les morpholinos ne sont efficaces chez les alevins au début (en général moins de 4 dpf) cet âge est utilisé à ânes sommeil24,26,27.
A. mexicanus peuvent vivre jusqu'à 30 ans en laboratoire, mais les expériences utilisant des adultes sont habituellement effectuées chez les poissons âgés de 6 mois à 3 ans. Poisson peut être enregistrées dans une variété de tailles de réservoir selon l’expérience et éclairage IR permet des enregistrements pendant les périodes de lumière et l’obscurité (Figure 2 a). Arénas individuels sont marquées dans le suivi afin de permettre le repérage du poisson, et post-traitement à l’aide d’une macro personnalisée fournit une lecture de sommeil (Figure 2 bC). Sommeil est significativement réduite dans agassizii Pachón, Molino et – Tinaja, par rapport aux poissons de surface (Figure 2D). En outre, ce système permet pour l’enregistrement de plusieurs poissons dans une arène unique (généralement des réservoirs de 10 gallons), permettant une analyse des interactions sociales affectent le sommeil (Figure 2EF). Logement social robuste réduit le sommeil chez les poissons de surface, sans affecter le sommeil en Pachón agassizii (Figure 2). L’absence d’effet en agassizii est probablement due à un effet de sous-sol, où agassizii dort peu, particulièrement dans les plus grandes arènes utilisés pour étudier le comportement social.
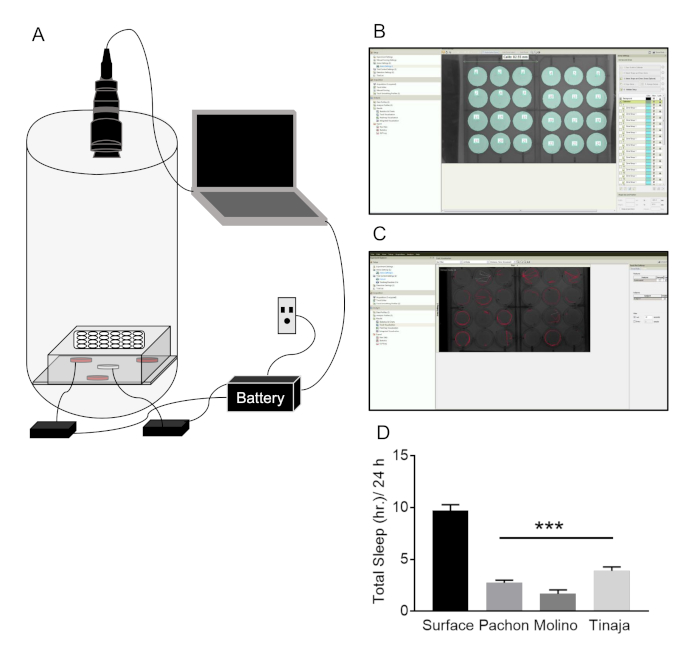
Figure 1 : Comportement de sommeil enregistrement de larves et de jeunes a. mexicanus. (A) schéma de configuration de comportement de sommeil larvaire : larve sont placés sur une plate-forme dans un tube de lumière contrôlée. Systèmes d’éclairage infrarouge et blanc s’asseoir sous le poisson au fond du tube. Une caméra IR-pass se trouve dans la partie supérieure du tube et est connectée à un ordinateur portable sur lequel est enregistrée la vidéo. Tous les systèmes d’alimentation (éclairage et portables) sont branchés sur une alimentation de secours. (B) les paramètres Arena en dépistant le logiciel. Larves individuels sont conservés dans les puits dans une plaque de culture de tissus, et les arènes (cyan) sont faites pour chaque animal. (C) traces locomotrice du comportement locomoteur après l’acquisition des données dans le logiciel de suivi du poisson. Traces rouges représentent 10 s d’activité chez les poissons 20 vieux jours. (D) résultant de sommeil données du logiciel de suivi. Agassizii juvénile convergence sur le comportement de sommeil réduit par rapport aux poissons de surface morphes (unidirectionnel ANOVA F(3, 116) = 76.12 ; Analyse post-hoc Dunnett a été appliqué pour comparer chaque population agassizii avec poissons de surface, P < 0,001). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Adulte a. mexicanus système pour le sommeil et le comportement circadienne. (A) schéma du système de sommeil-enregistrement : poissons sont contenues dans les réservoirs sur une grille en face des caméras de suivi. Un système d’éclairage infrarouge est placé derrière les réservoirs à poisson, tandis que les caméras IR-pass sont attachés à un ordinateur portable pour l’enregistrement de comportement. Tous les systèmes d’alimentation sont branchés sur un système de batterie de secours en cas de fluctuations du courant. Arena (B) installation en dépistant le logiciel. Chaque poisson est marqués en créant des arènes distinctes (cyan) pour suivre le comportement locomoteur. (C) représentant titres locomotrices (lignes rouges) des poissons après avoir acquis un enregistrement comportemental sur le logiciel de suivi. S représentent 20 de traces d’activité. Durée totale du sommeil de (D) sur une période de 24 h est significativement réduite dans trois populations distinctes d’agassizii par rapport aux poissons de surface (unidirectionnel ANOVA F(3, 106) = 52,66 ; Les tests post hoc Dunnett ont été appliqués entre les poissons de surface et de la population de chaque cave, P < 0,001). (E) A un réservoir unique contenant plusieurs poissons dans lequel une arène (orange) est faite pour suivre les interactions sociales et sommeil. (F) locomotrice traces de plusieurs poissons après l’acquisition de données en dépistant le logiciel (la couleur de chaque ligne représente un poisson donné). (G) les données représentatives de la surface et Pachón agassizii en sommeil social suivi. Poissons de surface réduisent le sommeil dans des réservoirs de 10 L par rapport aux arènes 2 L ; Sommeil de poissons de surface est plus réduite lorsque les poissons sont logés socialement. Agassizii sommeil n’est pas significativement altérée dans toutes les conditions (Two-Way ANOVA F(2,46) = 4.545 ; analyse post-hoc a été réalisée au sein de chaque population pour tester l’effet de la taille du réservoir et l’État social sur sommeil total 10 L single, P = 0,013 ; 10 L Social, P = 0,0003). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole décrit un système personnalisé pour quantifier le sommeil et l’activité locomotrice dans agassizii larvaire et adulte. Agassizii ont émergé comme un modèle pour l’étude de l’évolution du sommeil qui peut être utilisé pour étudier le fondement génétique et les neurones du sommeil règlement1. Les étapes critiques de ce protocole comprennent l’optimisation de l’éclairage et la qualité vidéo afin d’assurer un suivi précis qui est nécessaire pour quantifier le sommeil. Le système d’acquisition et d’analyse décrites ici sont entièrement fonctionnelles, comme beaucoup d’autres systèmes, tant commerciaux que sur mesure, pour quantifier la locomotion et comportement28,29,30. Le test précédent examen de sommeil chez le poisson unique peut être étendu pour permettre une analyse des poissons logés en groupe. Une considération importante lors de dépannage ou de conception d’épreuves est la confond comportements sociaux peuvent avoir sur le sommeil d’un individu. Par exemple, l’agression est fréquente chez les Astyanax, et agression niveaux diffèrent entre les poissons de surface et agassizii31. Optimiser le nombre de poissons, de la taille de l’arène et le sex-ratio, afin de minimiser l’agression permettra des mesures reproductibles du règlement de sommeil.
Une limitation de la technique, tel que décrit, est un manque de fiabilité après chaque poisson tout au long de l’essai. Suivi automatisé des animaux passera souvent animaux lorsqu’ils entrent en contact étroit. Cela peut être résolu en optimisation minutieuse des seuils ou en correction manuelle de tous les commutateurs. En outre, le système décrit n’est pas un système d’écoulement, et par conséquent, qualité de l’eau peut devenir un problème après enregistrements durant plus de quelques jours. Autre flux par le biais de systèmes ont été décrits dans le poisson-zèbre13 et ceux-ci pourraient s’appliquer facilement à la porcherie d’agassizii mexicain.
La méthode décrite est importante en raison de son applicabilité large pour mesurer le comportement chez les espèces de poissons divers. Sommeil doit encore être caractérisée dans presque n’importe quel poisson d’eau douce ou marine notamment des épinoches et cichlidés xiphophore32,33,34. La polyvalence de ce système pour mesurer le sommeil dans a. mexicanus et autres modèles de poissons peut aborder diverses questions au sujet de l’évolution et les fondements génétiques du sommeil. Le matériel associé à ce système est hautement rentable, ce qui en fait un potentiel très accessible et fournir pour analyse à haut débit de pharmacologique et ecotoxilogical analyse du sommeil et de l’activité locomotrice.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt concurrentes.
Remerciements
Ce travail a été soutenu par NIGM prix GM127872 ACK, NINDS prix 105072 ERD et ACK et NSF prix 1656574 d’accusé de réception.
matériels
| Name | Company | Catalog Number | Comments |
| 12 V power adaptor | Environmental Lights | 24 Watt 12 VDC Power Supply | |
| Acrylic dividers (adults) | TAP Plastic | Order sheets in sizes as needed | |
| Adult infrared light power source | Environmnental Lights 24 Watt 12 VDC Power Supply | ||
| Battery pack | CyberPower | CP850PFCLCD | |
| Camera lens (adult) | Navitar Zoom 7000 | Zoom 7000 | |
| Camera lens (larval) | Fujian 35mm f/1.7 | B01CHX7668 | Purchase on Amazon |
| Camera lens adapter | d | 1524219 | |
| Camera mount | CowboyStudio Super Clamp | B002LV7X1K | Purchase on Amazon |
| Fish tank | Deep Blue Professional | ADB11006 | |
| Heat sink (adult) | M-D Building products | SKU: 61085 | Cut to fit |
| Heat sink (larval) | M-D Building products | SKU: 57000 | Cut to fit |
| Infrared lights (adults) | Environmental Lights Infrared 850 nm 5050 LED strip | irrf850-5050-60-reel | Cut to fit |
| Infrared lights (larval) | LED World | B00MO9H7H4 | Purchase on Amazon |
| IR-diffusing acrylic | TAP Plastic | Order sheets in sizes as needed | |
| Laptop/computer | N/A | N/A | Any laptop will work. |
| LED light | Chanzon 10 High Power Led Chip 3W White (6000K-6500K/600mA-700mA/DC 3V-3.4V/3 Watt) | B06XKTRSP7 | Use with Chanzon 25 pcs 1 W, 3 W, 5 W LED Heat Sink (2 pin Black) Aluminum Base Plate Panel |
| light timer | Century 24 Hour Plug-in Mechanical Timer Grounded | ||
| Plastic wall mount for IR | Everbilt Plastic pegboard | Model # 17961 | |
| Power cable | BNTECHGO 22 Gauge Silicone Wire | B01K4RPE0Y | |
| Power source | Rapid LED | MOONLIGHT DRIVER (350MA) | |
| Tissue culture plates | Fisherbrand | 12-well (FB012928) 24-well (FB012929) | |
| Tripod Ball head | Demon DB-44 | B00TQ54CZO | Purchase on Amazon |
| USB Hardrive | Seagate 3TB backup | STDT3000100 | |
| USB Webcam | Microsoft LifeCam | Q2F-00014 | Purchase on Amazon |
| Wall mount for camera | LDR Industries 1/2" Steel pipe | 307 12X36 | Mounted on wall with Flange and 90° pipe elbow. Could also use a tripod to hold camera. |
Références
- Keene, A. C., Duboue, E. R. The origins and evolution of sleep. The Journal of Experimental Biology. , (2018).
- Joiner, W. J. Unraveling the Evolutionary Determinants of Sleep. Current Biology. 26 (20), R1073-R1087 (2016).
- Allada, R., Siegel, J. M. Unearthing the phylogenetic roots of sleep. Current biology. 18, R670-R679 (2008).
- Sehgal, A., Mignot, E. Genetics of sleep and sleep disorders. Cell. 146, 194-207 (2011).
- Campbell, S. S., Tobler, I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience and Biobehavioral Reviews. 8, 269-300 (1984).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Geissmann, Q., Rodriguez, L. G., Beckwith, E. J., French, A. S., Jamasb, A. R., Gilestro, G. Ethoscopes: An Open Platform For High-Throughput Ethomics. bioRxiv. , 113647 (2017).
- Garbe, D. S., et al. Context-specific comparison of sleep acquisition systems in Drosophila. Biology Open. 4 (11), (2015).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6 (6), 451-457 (2009).
- Gilestro, G. F., Cirelli, C. PySolo: A complete suite for sleep analysis in Drosophila. Bioinformatics. 25, 1466-1467 (2009).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6, 451-457 (2009).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science (New York, N.Y.). 327, 348-351 (2010).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, (2015).
- Chiu, C. N., Prober, D. A. Regulation of zebrafish sleep and arousal states: current and prospective approaches. Frontiers in Neural Circuits. 7 (April), 58 (2013).
- Elbaz, I., Foulkes, N. S., Gothilf, Y., Appelbaum, L. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish. Frontiers in Neural Circuits. 7, (2013).
- Duboué, E. R., Keene, A. C., Borowsky, R. L. Evolutionary convergence on sleep loss in cavefish populations. Current Biology. 21, 671-676 (2011).
- Beale, A., et al. Circadian rhythms in Mexican blind cavefish Astyanax mexicanus in the lab and in the field. Nature Communications. 4, 2769 (2013).
- Keene, A. C., Yoshizawa, M., McGaugh, S. E. . Biology and Evolution of the Mexican Cavefish. , (2015).
- Jeffery, W. R. Regressive evolution in Astyanax cavefish. Annual Review of Genetics. 43, 25-47 (2009).
- Gross, J. B. The complex origin of Astyanax cavefish. BMC Evolutionary Biology. 12, 105 (2012).
- Aspiras, A., Rohner, N., Marineau, B., Borowsky, R., Tabin, J. Melanocortin 4 receptor mutations contribute to the adaptation of cavefish to nutrient-poor conditions. Proceedings of the National Academy of Sciences. 112 (31), 9688 (2015).
- Jaggard, J., et al. The lateral line confers evolutionarily derived sleep loss in the Mexican cavefish. Journal of Experimental Biology. 220 (2), (2017).
- Jaggard, J. B., Stahl, B. A., Lloyd, E., Prober, D. A., Duboue, E. R., Keene, A. C. Hypocretin underlies the evolution of sleep loss in the Mexican cavefish. eLife. , e32637 (2018).
- Hinaux, H., et al. A Developmental Staging Table for Astyanax mexicanus Surface Fish and Pacho ´n Cavefish. Zebrafish. 8 (4), 155-165 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., La Schimmenti, ., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Bilandzija, H., Ma, L., Parkhurst, A., Jeffery, W. A potential benefit of albinism in Astyanax cavefish: downregulation of the oca2 gene increases tyrosine and catecholamine levels as an alternative to melanin synthesis. Plos One. 8 (11), e80823 (2013).
- Yokogawa, T., et al. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biology. 5, 2379-2397 (2007).
- Appelbaum, L., et al. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 106, 21942-21947 (2009).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. eLife. 4 (September), (2015).
- Elipot, Y., Hinaux, H., Callebert, J., Rétaux, S. Evolutionary shift from fighting to foraging in blind cavefish through changes in the serotonin network. Current Biology. 23 (1), 1-10 (2013).
- Bell, M. A., Foster, S. A. . The evolutionary biology of the threespine stickleback. 584, (1994).
- Seehausen, O. African cichlid fish: a model system in adaptive radiation research. Proceedings of Biological Sciences/The Royal Society. 273 (1597), 1987-1998 (1597).
- Basolo, A. L. Female preference predates the evolution of the sword in swordtail fish. Science. 250, 808-810 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon