Method Article
睡眠とメキシコの血脈の自発運動の自動測定
要約
このプロトコルは、歩行動作とメキシコの血脈睡眠を定量化するための方法論を詳しく説明します。前の分析は、これら社会的収容魚の動作を測定するため拡張されています。このシステムは、睡眠と他の魚種の活動に関する研究に広く適用できます。
要約
門、全体睡眠は高い覚醒のしきい値が含まれます、次の睡眠不足を回復、行動不動の期間を連結する非常に節約された行動特性が特徴です。メキシコの血脈アステュアナクス メキシコ(A. メキシコ),は、環境の摂動応答の形質の進化を研究するためのモデルです。A. メキシコは目をした表面住居形態と堅牢な形態および行動の違いがある複数の盲目の洞窟住居集団のように存在しています。睡眠の損失は、複数の独立して進化した血脈集団で発生しました。このプロトコルでは、睡眠とA. メキシコ洞窟と魚の表面の自発運動の定量化の方法論について説明します。コスト効率の高いビデオ監視システムは、一週間以上の期間にわたってそれぞれ収容の幼虫や大人の魚の行動のイメージングが可能です。システムは、魚の成人高齢者 4 日間ポスト受精に適用できます。アプローチは、一つの舞台で複数の魚を記録して睡眠に社会的な相互作用の効果を測定する合わせることができます。次の行動の記録、データの分析を使用して自動的にソフトウェアを追跡して睡眠解析が期間、試合の長さ、試合数など複数の睡眠変数を定量化するカスタマイズされたスクリプトを使用して処理されます。このシステムは、測定睡眠、行動の日周性とゼブラフィッシュ、イトヨなどあらゆる魚種ほとんど運動に適用できます。
概要
睡眠は、全体の生理学的・機能・行動レベル1,2,3動物王国保存性が高い。哺乳類実験動物の睡眠は、脳波を用いた評価、通常、電気生理学的記録は、遺伝的影響を受けやすい小型システムより少なく実用的なこうして睡眠は通常動作3に基づいて計測は,4. 睡眠に関連する行動特徴動物界全体保存性が高いと増加覚醒しきい値、刺激、長時間行動活動の静穏化5と可逆性があります。これらの措置は、人間6では、線虫C. elegansに至る動物の睡眠の特性評価に使用できます。
睡眠を特徴付ける行動活動の静穏化の使用には、自動トラッキング ソフトウェアが必要です。ソフトウェアを追跡するには、活動と不動の期間は数日間以上によって決まります、非アクティブの長い期間は、7、8をスリープとして分類されます。近年、複数のトラッキング システムは、遺伝的影響を受けやすい小型システムの多様性の間でアクティビティ データを取得するため開発されています。ワーム、ショウジョウバエや魚9,10,11を含みます。これらのプログラムはオープン ソース フリーウェアや市販のソフトウェア7,12,13,14 を含む動物の行動の自動追跡を可能にするソフトウェアを同伴します。.これらのシステムは彼らの柔軟性が異なります、効率的探索と遺伝的 2次元モデル多数で睡眠表現型の解析を可能にします。
ゼブラフィッシュ、動脈分布における睡眠の遺伝の調査は多数の遺伝子と睡眠15,16を調節する神経回路の同定につながっています。これは脊椎動物研究室動物の睡眠の神経基盤を調査するための強力なシステムははるかに少ない睡眠の進化について知られており、自然が変化は睡眠調節に貢献します。メキシコの血脈、アステュアナクス メキシコ(A。メキシコ)、睡眠、運動と概日リズム17,18の劇的な違いを進化しています。これらの魚では、メキシコとテキサス南部や、少なくとも 29 の川に生息する目の表層魚群洞窟北東メキシコ19,20,21シエラ ・ デル ・ アブラ地域個体群としても存在しています。驚くことに、睡眠の損失を含む多くの行動の違いは複数血脈人口14,22で独立して浮上したと表示されます。したがって、血脈は、概日リズム、睡眠と社会的行動の収斂進化を調査するためのモデルを提供します。
このプロトコルでは、睡眠とAの行動を測定するシステムについて説明します。メキシコの幼虫と大人。特注赤外線ベースのレコーディング システムは、光と暗い条件下での動物のビデオ録画のためことができます。市販のソフトウェアを使用して、アクティビティを測定でき、カスタム マクロを使用して非アクティブのいくつかの側面を定量化および睡眠の期間を決定します。このプロトコルには、睡眠と社会的行動間の相互作用を検証する機能を提供し、タンクの中で複数の動物の活動を追跡するための実験的変更もについて説明します。これらのシステムは、測定睡眠、行動の日周性とゼブラフィッシュ、イトヨなどその他魚種で自発運動に適用できます。
プロトコル
注: 幼虫と大人の行動追跡のシステムを設定します。
1. 幼虫の睡眠システムの構築
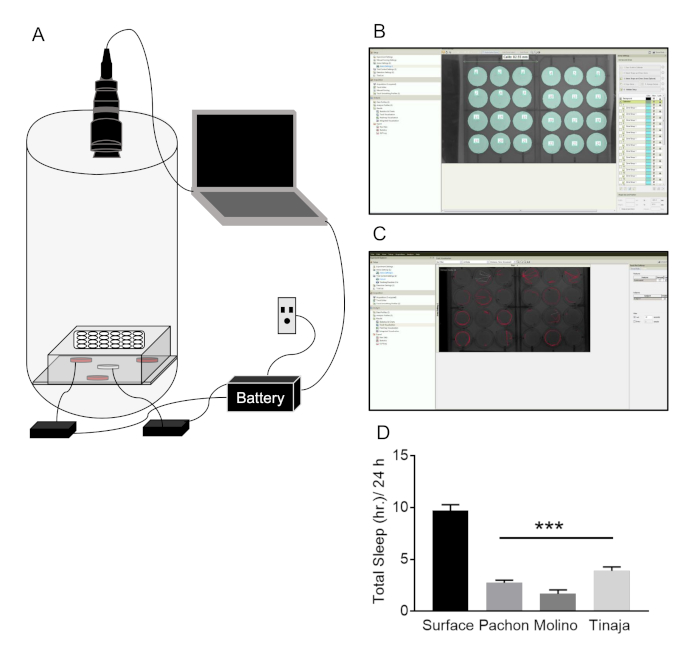
注:赤外線 (IR) 照明、アクリル IR 光の拡散を含む機器の複数の部分は光を自動仔稚魚の高齢者 4 日間ポスト受精 (dpf) 30 dpf A. メキシコを介してを介して追跡の監視システムが必要です。コントロール (タイマー)、コンピューター、カメラ、および配線と電源コント ローラー (図 1 a) などの副資材。次の手順は、睡眠と幼虫の概日リズムを勉強する行動を正確に追跡できるシステムを構築する方法が通知されますA. メキシコ。
- IR と白色発光ダイオード (LED) で構成される照明システムの構築: 30.5 cm × 30.5 cm 薄い金属のプラットフォーム ヒートシンクに互いから三角形約 7.62 cm で 3 つの IR ライトを配置します。シリーズのライトを電線で配線し、電源ソースに接続します。
- 3 つの IR ライトの中心に単一の白色 LED を置き、動力源に取り付けます。
- Led ライト タイマー標準概時刻に設定する電源ソースに接続します。
- 幼虫追跡システムのためのプラットフォームを構築します。すべてのプラットフォームのコンポーネント 0.33 cm 厚白サイン アクリルを使用します。
- 行動追跡時にどのアリーナで魚を含んでいるが置かれる明るい正方形ヒートシンクの上部に記録プラットフォームを配置します。
-
ライトと最適な照明とコントラストの IR を拡散する動物間のボックス内 2 番目のアクリルを配置します。
注:幼虫のライト ボックスの寸法は以下のとおりです: 2 18 × 8.5 cm と 2 つ 17 cm × 8.5 cm、18 cm × 18 cm のフォームに化学結合が Led スクエアは 8.5 cm 背の高い。また、アクリルがあります簡単にカットまたはカスタマイズされたサイズの適切なツールを使用してドリル。- 全体の幼虫追跡ステージと同封のプラスチック製のチューブ内の照明のセットアップの場所、チューブの上にカメラを配置します。
注:これがトラッキング精度が損なわれると追跡ビデオに表示されるからの照明の反射を保つために重要です。プラットフォームを囲むチューブの上にカメラの配置は、照明、これらの実験に使用されるカメラのシャープネスを向上させます。
- 全体の幼虫追跡ステージと同封のプラスチック製のチューブ内の照明のセットアップの場所、チューブの上にカメラを配置します。
- ウェブカメラの操作 (材料表参照) IR ベースの録音のため。回転ツールを使用してメーカーのレンズを取り外す (材料の表を参照してください)。
- 内部ハウジングを削除するカメラの背面の両側に小さな銀色のネジを取り外します。
- レンズの残りの部分を緩めるにカメラのボディの中の小さな黒いネジを取り外します。レンズを切削した後に残るレンズ住宅の任意の部分を削除するのにには、小型ドライバーを使用します。
- チャージの上の部分の青色 LED 削除結合素子 (CCD) の住宅です。
- 元の向きに戻る内側住宅を配置し、元の位置に戻って 2 つの銀色のネジをねじ込む、バックカメラを一緒に入れてください。
- 小さなを使用してカメラの内部のルートは、丸みを帯びたプラスチック ルーティング ビットに合うように見た。スムーズ ダウン余分なプラスチック レンズ アダプターを合うことができるまで。
- 近い可能な限り CCD カメラと直接接触することがなくカメラ内部の IR - パスフィルターをインストールします。
注:カメラのハウジング内 CCD チップを損傷しないように注意してください。必ずカットを可能な限りレベルに維持してください。IR フィルターの外側とフィルタ リングされず、CCD に達することからのライトを保つためにカメラのボディの間の任意のオープン スペースをシールします。 - 35 mm 固定レンズにカメラを接続 (材料の表を参照) によってレンズの背面にカメラの前部アダプターをねじ込みます。
- ステージとライトを収容する管の上にふたに穴のカメラとレンズ、動物から記録されるコンピューターに USB を取り付けます。
注:行動記録の中に混乱を最小限を確保する在庫魚が収容されている場所とは別行動部屋に魚を置きます。温度と行動実験を混同することができます換気の変動を最小限に抑えるように注意します。
2. 大人の睡眠システム
- 約 46 cm 間隔に IR のストリップを切断することによって大人の魚を追跡するための赤外線照明システムを構築します。1 つの 46 cm 帯で動作する各 10 L のタンクに十分です。
- シリーズ、DC の電気配線を各ストリップをはんだ付けで一緒に各ストリップをワイヤー、9 V の電源に取り付けます。
- 各 IR のストリップをヒートシンクとして機能するアルミの 51 cm × 5.1 cm 部分に取り付けます。
- 46 cm × 5 cm、0.32 cm 厚 9% 光パス白サイン アクリル シート配置各 IR の光ストリップ IR を拡散する前に直接光。
- リアに IR のライティングをサポートするラックにすべての戦車を配置します。
- 10 L ガラス水槽で不透明なプラスチックの分周器を使用すると、個々 のアリーナを作成できます。
注:アリーナ サイズは仕切り使用数と水槽のサイズに基づいて様々 なことができます。アリーナ サイズは、自発運動と洞窟で表層魚群23睡眠に影響します。 - タンクから約 4-6 m のカメラをマウントします。各カメラは、追跡のための十分な解像度を提供するために一度に 3 タンクから通常記録できます。
注:一般的に、成人の行動記録には昼夜の変化を制御する別の白い照明システムは不要です。単にタイマーに接続して行動部屋で標準的な天井の照明を活用は十分でしょうです。
3. 記録運動
注:すべての行動の記録は、バックアップ バッテリ ソースと標準的なノート パソコンやデスクトップを使用して作られています。(60-100 GB) の記録 24 h の大きなファイル サイズのため外付けハード ドライブにすべての録音を保存します。
- 録音を開始する前に 18-24 h の魚 4 30 年代 dpf を順応させます。ライブ ブラインシュリンプ録音室で、録音を開始する前に 1 h を最初に配置するときに仔魚をフィードします。記録動作の前に 4-5 日の成魚を順応し、一度薄片の食糧やライブ blackworms 毎日を送り。
注:余ったブラインシュリンプは後の分析中に懸案を原因として記録、前に新鮮な水に仔魚を配置することを確認してあります。その小さなサイズが追跡を妨害しないよう、代わりのオプションを提供します共同ワムシの培養します。 - 場所の魚では、4-6 dpf 24 ウェル培養プレートの高齢者。家魚では、20-30 dpf 記録 12 ウェル培養プレートの高齢者。
- 10 L タンクでレコード大人適合 5 個別に収容された魚を収容する仕切り付きレコード睡眠と社会的な設定で活動するディバイダー無し。
注:追尾精度を最大化するために記録を開始する前にカメラの焦点を注意してください。カメラのレンズの絞りを開いていないあまりにも遠く、画像のシャープネスを大幅に削減します。ただし、バランスがあります。虹彩が余りにずっと閉じている場合、ビデオのフレーム レートは 15.00 fps 下回るものになります。いくつかカスタム書かれた睡眠スクリプト23,24用 s あたり 15.00 フレームをフレーム レートに残る後で分析のために不可欠です。 - 背景のイルミネーション照明/明るさを設定します。
- 録画の開始前に照明を最適化します。常に可能な最高レベルのコントラストを維持し、動物が最もクリアまで明るさを調整する明るさと背景照明を使用します。
- 24 または 48 時間の記録魚は。
注:すべての照明、コンピューター、およびカメラの電源を緊急時のバックアップ バッテリー パックを購入して、停電ください。すべての電池パックは、可能な場合にも緊急電源コンセントに接続必要があります。バッテリー パックはない時間に数分以上のための機器の電源を最も一般と主電源を失うことと、緊急時の電源システムへの転送間のブリッジを提供します。
4. 個別に収容魚を使用しての自動トラッキング ソフトウェア ロコモータ活性の解析
- 動作の分析を開始するには、テンプレートから新しい実験をトラッキング ソフトウェアを開き、[定義済みのテンプレートを適用するを選択します。
- プログラムは今を追跡するどのような種を求める、魚を選択します。ゼブラフィッシュ大人によって実験パラダイムのいずれかのゼブラフィッシュ幼虫を選択するのにドロップダウン リスト ボックスを使用します。
- それぞれの動物を追跡するアリーナを設定します。幼虫は、ウェル プレート、ラウンドも、いいえゾーン テンプレートを選択します。大人のためのゾーン テンプレートでオープン フィールド、正方形を使用します。アリーナのビデオで追跡されている各動物の 1 つの適切な数を決定します。
- 最適な追跡のためのモデルを選択しをクリックして中心点を追跡背景よりも暗い動物の色が選択されているを必ず。ビデオを集録するフレーム レートを適用します。トラッキング ソフトウェアは自動的にこれを検出する必要があります。
- アリーナの設定を使用して魚の歩行動作を正確に判断するオブジェクトの実際の距離を調整するスケールを描画します。
- 魚は、全体の領域が追跡されることを確認するアリーナを編集します。それ以外の場合サンプルは集録時に失われます。
注:エリアを設定するときは、注意をしてください。仔魚は特にアリーナが大きすぎるか小さい場合エラーの追跡に敏感です。実験で悪い照明は、プログラムは、偽陽性を作成、動物と思うかもしれませんウェル プレートの壁に影を作成することも。 - 高度なをクリックします。検出設定の方法、動的減算、背景をクリックし、学習の開始を選択します。動物は、追跡されているし、背景が原因でないジャンプに追跡まで濃いコントラスト信号/雑音比を調整します。
注:ビデオの品質は、各試行がそれに応じて、異なる設定を使用する必要がありますので、実験によって異なります。被写体の輪郭と被写体サイズ機能を使用と、追跡結果が大幅に向上します。 - 試験一覧を選択し、プログラムにデータを記録するために開始する前に適切なパラメーターをロードします。
- [取得] タブをクリックして、トラックすべての計画の試験を選択し、レコード ボタンをクリックします。
- 分析プロファイルの下運動時間・距離が選択されていることを確認します。
注:後の睡眠解析のための順序でこれらの設定が正しいこと、ファイル、.perl として睡眠の計算に正しい順序でこれらのデータを読み取る必要がありますが重要です。 - エクスポート、[ Raw データを選択、データを Unicode テキストとしてエクスポートします。
5. 追跡社会的収容魚
- 4.1-4.4 トラッキング ソフトウェアで実験を設定する手順に従います。
- ドロップ ダウン メニューでどのように多くの動物実験の追跡するを選択します。
- アリーナの設定で実際の距離を調整する正しいスケールを描画します。
- 検出設定の動的減算を使用する、最高動物を追跡する暗闇のコントラストを調整します。
- 動物の非常に小さい部分だけが追跡されるので、検出設定の下で被写体サイズを調整します。
注:動物の小さな部分のみを追跡することによって動物集録時にパスを渡る時の切り替えの量を減らす、これ。 - トラックを買収、トラックエディターを使用して魚が行き交う時間を手動で修正します。
6. 自発運動から睡眠データを抽出
注:幼虫及び成虫A. メキシコの睡眠の行動の定義は 1 分以上の静止です。この定義より感覚的な刺激は眠っている状態で行動を開始するために必要な覚醒閾値実験を使用して決定された (> 60 s)14,17目を覚ますと比較して。小さな動きと魚類が一般的なドリフトを考慮して実際の動きや、ノイズやドリフトを分離する速度しきい値が適用されます。これらのしきい値は、計算から派生した距離と最高 R 二乗値を見つけるための睡眠の持続期間間の相関関係を比較することによって運動と睡眠のための最も正確な速度を決定します。仔魚の上下限値が両方 12 mm/s にはほとんど変動がないです。成魚の下限はドリフトを考慮して 4 cm/s の上限値を 2 cm/s です。
- 歩行を抽出し、動作をスリープ状態にカスタム作成されたスクリプトの実行を遂行する分析コンピューターに Cygwin をインストールします。
- Cygwin のホーム ディレクトリ内に新しい実験フォルダーを作成します。
- トラッキング ソフトウェアから生の Unicode データをインポートし、UTF-16 からエンコードを utf-8 に変換する Cygwin で .sh ファイルを実行します。
- 睡眠データを抽出する Cygwin で .perl ファイルを実行します。
- マクロ ファイルを開き、必要に応じて、データの分析を完了するスプレッドシート内の指示に従ってください。
注:コマンド ライン符号化の基本的なレベルは、分析のこの部分を実行する必要があります。一般的な Linux コマンドで十分です。データを正しく読み取るプログラムに問題がある場合は、エンコーディングを確認することを確認任意の自由に利用できるテキスト エディターのソフトウェアを追跡するからデータと順序が適切に記述する実行可能ファイルの正しい。
結果
幼虫の年齢 4-30 dpf を図 1に示したカスタム ビルドのクローズド システムで確実に記録できます。システムには、IR と可視照明の両方を可能にする様々 な可視光条件 (図 1 a) の下で、明るい部分と暗い条件下で録音が含まれています。動画は、(図 1 b、C) のトラッキング ソフトウェアを使用して分析し、(見なさい補足ダウンロード) 睡眠のカスタム マクロを使用して処理後。3 つの独立した血脈集団から仔魚は表層魚群 (図 1) と 20 dpf に比べて睡眠の大幅な削減を表示、この睡眠の損失は、発達段階を通じて一貫しています。魚の睡眠を分析の時代は実験操作に依存して多くの場合です。たとえば、 A. メキシコ食品を摂取しなければ、4 日間で睡眠と栄養の相互作用を調べる実験高齢幼虫25に通常発生するので。逆に、morpholinos は、この時代を使用してロバ睡眠24,26,27初期フライ (通常 4 dpf 未満) で効果的なのみです。
A. メキシコの所 30 年間住むことができるが、大人を用いた実験は通常 3 年間に 6 ヶ月熟成の魚で実行されます。魚は様々 な実験によってタンクのサイズで記録できる、赤外線照明できます録音明暗期 (図 2 a)。ラベルにトラッキングできるように、魚の追跡のための個々 のアリーナです、カスタム マクロを使用して後処理が睡眠 (図 2 b, C) の読み出しを提供しています。睡眠は、表層魚群 (図 2 D) と比較して、Pachón、モリノ、および Tinaja の血脈が削減します。さらに、このシステムは (通常 10 ガロン タンク)、一つの舞台でどのように社会的な相互作用の解析を可能にする複数の魚に影響を与える (図 2 e, F) の睡眠記録できます。Pachón 血脈 (図 2) で睡眠に影響を与えずに表面の魚で睡眠を減らし確実に社会の住宅します。毒の効果の欠乏は、血脈が少し、特に社会的行動を調べるために使用大きなアリーナを睡眠地下効果による可能性が高いです。
仔稚魚の図 1: 記録睡眠行動A. メキシコ。幼虫のスリープ動作設定の (A) 回路図: 幼虫が光制御管内でプラットフォームに配置されます。チューブの下部に魚の下に赤外線と白の照明システムが座っています。IR 峠カメラ チューブの上部に座っているし、ビデオを記録したノート パソコンに接続されています。すべての動力を与えられたシステム (照明やノート パソコン) はバックアップ電源に接続します。(B) アリーナ トラッキング ソフトウェアで設定します。個々 の幼虫は組織培養プレートの井戸で保持され、アリーナ (シアン) は、各動物のため作られています。(C) 魚行動トラッキング ソフトウェアでデータの集録後の歩行跡。20 日間の古い魚の活動の赤い痕跡表す 10 s。(D) 結果は、トラッキング ソフトウェアからデータをスリープ状態します。表層魚群モーフと比較して減少睡眠行動に収束する少年の血脈 (一方向分散 F(3, 116) = 76.12;表面の魚、P と各の血脈の人口を比較するのに適事後解析を適用した < 0.001)。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 大人A. メキシコシステム睡眠と行動の日周性。睡眠記録システムの (A) 図: 追跡カメラの反対側ラック上のタンクに魚を開催。IR 峠カメラが動作を記録するためのノート パソコンに接続されている間、赤外線照明システムは、水槽の後ろに配置されます。すべての動力を与えられたシステムは、電力の変動の場合のバックアップ バッテリー システムに差し込まれて。(B) アリーナは、トラッキング ソフトウェアでセットアップします。個々 の魚は、自発行動を追跡する別のアリーナ (シアン) を作成することによってマークされます。(C) 代表的な自発トラック (赤い線) ソフトウェアを追跡の行動記録を取得した後個々 の魚の。アクティビティのトレース表す 20 s。(D) 総睡眠時間 24 時間以上は表面の魚に比べて毒の 3 つの異なる集団が大幅に削減 (一方向分散 F(3, 106) = 52.66;Dunnett 事後テストが表面の魚と各洞窟の人口、P の間適用された < 0.001)。(E) A 1 つのタンクの 1 つアリーナ (オレンジ) がされる社会的相互作用と睡眠を追跡する複数の魚を含んでいます。(F) ソフトウェア (それぞれの線の色を表す個々 の魚) の追跡にデータ集録後複数の魚の歩行跡。(G) 表面と追跡社会の睡眠 Pachón 血脈の代表的なデータです。表層魚群が 10 L タンク 2 L アリーナ; に比べて睡眠を大幅に削減します。魚が収容されている社会的表層魚群睡眠はさらに縮小します。毒睡眠はどんな条件で大幅変更されません (双方向分散 F(2,46) = 4.545; P、総睡眠 10 L シングルにタンクのサイズおよび社会状態の効果をテストする各集団内における事後分析を行った = 0.013; 10 L 社会、P = 0.0003)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
このプロトコルでは、睡眠と幼生及び成体の血脈の自発運動を定量化するためのカスタム システムについて説明します。血脈は睡眠睡眠規則1の遺伝学的および神経の基礎を調査するための進化の過程の主要なモデルとして浮上しています。このプロトコルの重要なステップには、照明の最適化、正確な追跡を保証するためにビデオの品質が睡眠を定量化する必要があります。取得および解析をここで説明したシステムは、多くの他のシステム、両方の商業および特注、歩行や動作の28,29,30を定量化する完全に機能する。1 つの魚の睡眠を調べる前のアッセイは、群飼育魚の分析を許可する拡張できます。トラブルシューティングまたはアッセイを設計するときの重要な考慮事項は、混同する社会的行動が個々 の睡眠にあります。たとえば、侵略はアステュアナクスで一般的な表面の魚と血脈31の侵略のレベルが異なります。魚の数、アリーナと性比のサイズを最適化する、攻撃を最小限に抑えるためになります睡眠調節の再現性のある測定のため。
テクニックの制限前述のようは、次の分析を通して個々 の魚の信頼性の欠如です。自動化された動物の追跡はしばしば密接な接触に入ってきた動物に切り替えます。これは、しきい値の慎重に最適化することによって、スイッチを手動で修正するに対処できます。さらに、記述されているシステムはフローをシステムではありません、したがって、水質が問題になるよりも数日を持続させる録音後。システムを他のフローは、ゼブラフィッシュ13に記載されている、これらは容易にメキシコの血脈のものもらいに適用することができます。
方法論は多様な魚種での動作を測定するための幅広い適用性のため重要です。睡眠は、イトヨ、シクリッド、swordtails32,33,34などほぼすべての海洋や新鮮な水の魚で特徴付けられるまだ。A. メキシコと他魚モデルで睡眠を測定するこのシステムの汎用性は、進化と睡眠の遺伝的素因に関する多様な質問をアドレスがあります。このシステムに関連付けられているハードウェアはことが薬理学の高いスループット分析と睡眠と運動の ecotoxilogical 解析のアクセス性の提供する可能性が高いです。
開示事項
著者は、彼らが競合する利益あるを宣言します。
謝辞
この作品は、日の出賞 GM127872 ACK、NINDS 賞 105072 ERD と ACK と検知する NSF 賞 1656574 に支えられ
資料
| Name | Company | Catalog Number | Comments |
| 12 V power adaptor | Environmental Lights | 24 Watt 12 VDC Power Supply | |
| Acrylic dividers (adults) | TAP Plastic | Order sheets in sizes as needed | |
| Adult infrared light power source | Environmnental Lights 24 Watt 12 VDC Power Supply | ||
| Battery pack | CyberPower | CP850PFCLCD | |
| Camera lens (adult) | Navitar Zoom 7000 | Zoom 7000 | |
| Camera lens (larval) | Fujian 35mm f/1.7 | B01CHX7668 | Purchase on Amazon |
| Camera lens adapter | d | 1524219 | |
| Camera mount | CowboyStudio Super Clamp | B002LV7X1K | Purchase on Amazon |
| Fish tank | Deep Blue Professional | ADB11006 | |
| Heat sink (adult) | M-D Building products | SKU: 61085 | Cut to fit |
| Heat sink (larval) | M-D Building products | SKU: 57000 | Cut to fit |
| Infrared lights (adults) | Environmental Lights Infrared 850 nm 5050 LED strip | irrf850-5050-60-reel | Cut to fit |
| Infrared lights (larval) | LED World | B00MO9H7H4 | Purchase on Amazon |
| IR-diffusing acrylic | TAP Plastic | Order sheets in sizes as needed | |
| Laptop/computer | N/A | N/A | Any laptop will work. |
| LED light | Chanzon 10 High Power Led Chip 3W White (6000K-6500K/600mA-700mA/DC 3V-3.4V/3 Watt) | B06XKTRSP7 | Use with Chanzon 25 pcs 1 W, 3 W, 5 W LED Heat Sink (2 pin Black) Aluminum Base Plate Panel |
| light timer | Century 24 Hour Plug-in Mechanical Timer Grounded | ||
| Plastic wall mount for IR | Everbilt Plastic pegboard | Model # 17961 | |
| Power cable | BNTECHGO 22 Gauge Silicone Wire | B01K4RPE0Y | |
| Power source | Rapid LED | MOONLIGHT DRIVER (350MA) | |
| Tissue culture plates | Fisherbrand | 12-well (FB012928) 24-well (FB012929) | |
| Tripod Ball head | Demon DB-44 | B00TQ54CZO | Purchase on Amazon |
| USB Hardrive | Seagate 3TB backup | STDT3000100 | |
| USB Webcam | Microsoft LifeCam | Q2F-00014 | Purchase on Amazon |
| Wall mount for camera | LDR Industries 1/2" Steel pipe | 307 12X36 | Mounted on wall with Flange and 90° pipe elbow. Could also use a tripod to hold camera. |
参考文献
- Keene, A. C., Duboue, E. R. The origins and evolution of sleep. The Journal of Experimental Biology. , (2018).
- Joiner, W. J. Unraveling the Evolutionary Determinants of Sleep. Current Biology. 26 (20), R1073-R1087 (2016).
- Allada, R., Siegel, J. M. Unearthing the phylogenetic roots of sleep. Current biology. 18, R670-R679 (2008).
- Sehgal, A., Mignot, E. Genetics of sleep and sleep disorders. Cell. 146, 194-207 (2011).
- Campbell, S. S., Tobler, I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience and Biobehavioral Reviews. 8, 269-300 (1984).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Geissmann, Q., Rodriguez, L. G., Beckwith, E. J., French, A. S., Jamasb, A. R., Gilestro, G. Ethoscopes: An Open Platform For High-Throughput Ethomics. bioRxiv. , 113647(2017).
- Garbe, D. S., et al. Context-specific comparison of sleep acquisition systems in Drosophila. Biology Open. 4 (11), (2015).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6 (6), 451-457 (2009).
- Gilestro, G. F., Cirelli, C. PySolo: A complete suite for sleep analysis in Drosophila. Bioinformatics. 25, 1466-1467 (2009).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nature Methods. 6, 451-457 (2009).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science (New York, N.Y.). 327, 348-351 (2010).
- Yoshizawa, M., et al. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 13, (2015).
- Chiu, C. N., Prober, D. A. Regulation of zebrafish sleep and arousal states: current and prospective approaches. Frontiers in Neural Circuits. 7 (April), 58(2013).
- Elbaz, I., Foulkes, N. S., Gothilf, Y., Appelbaum, L. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish. Frontiers in Neural Circuits. 7, (2013).
- Duboué, E. R., Keene, A. C., Borowsky, R. L. Evolutionary convergence on sleep loss in cavefish populations. Current Biology. 21, 671-676 (2011).
- Beale, A., et al. Circadian rhythms in Mexican blind cavefish Astyanax mexicanus in the lab and in the field. Nature Communications. 4, 2769(2013).
- Keene, A. C., Yoshizawa, M., McGaugh, S. E. Biology and Evolution of the Mexican Cavefish. , (2015).
- Jeffery, W. R. Regressive evolution in Astyanax cavefish. Annual Review of Genetics. 43, 25-47 (2009).
- Gross, J. B. The complex origin of Astyanax cavefish. BMC Evolutionary Biology. 12, 105(2012).
- Aspiras, A., Rohner, N., Marineau, B., Borowsky, R., Tabin, J. Melanocortin 4 receptor mutations contribute to the adaptation of cavefish to nutrient-poor conditions. Proceedings of the National Academy of Sciences. 112 (31), 9688(2015).
- Jaggard, J., et al. The lateral line confers evolutionarily derived sleep loss in the Mexican cavefish. Journal of Experimental Biology. 220 (2), (2017).
- Jaggard, J. B., Stahl, B. A., Lloyd, E., Prober, D. A., Duboue, E. R., Keene, A. C. Hypocretin underlies the evolution of sleep loss in the Mexican cavefish. eLife. , e32637(2018).
- Hinaux, H., et al. A Developmental Staging Table for Astyanax mexicanus Surface Fish and Pacho ´n Cavefish. Zebrafish. 8 (4), 155-165 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., La Schimmenti,, Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Bilandzija, H., Ma, L., Parkhurst, A., Jeffery, W. A potential benefit of albinism in Astyanax cavefish: downregulation of the oca2 gene increases tyrosine and catecholamine levels as an alternative to melanin synthesis. Plos One. 8 (11), e80823(2013).
- Yokogawa, T., et al. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biology. 5, 2379-2397 (2007).
- Appelbaum, L., et al. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 106, 21942-21947 (2009).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. eLife. 4 (September), (2015).
- Elipot, Y., Hinaux, H., Callebert, J., Rétaux, S. Evolutionary shift from fighting to foraging in blind cavefish through changes in the serotonin network. Current Biology. 23 (1), 1-10 (2013).
- Bell, M. A., Foster, S. A. The evolutionary biology of the threespine stickleback. 584, Oxford University Press. Available from: http://books.google.com/books?hl=de&lr=&id=uxC0lN-Z3FIC&pgis=1 (1994).
- Seehausen, O. African cichlid fish: a model system in adaptive radiation research. Proceedings of Biological Sciences/The Royal Society. 273 (1597), 1987-1998 (1597).
- Basolo, A. L. Female preference predates the evolution of the sword in swordtail fish. Science. 250, 808-810 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved