Method Article
Fluorimétrica técnicas para a avaliação das membranas de esperma
Neste Artigo
Resumo
Aqui, apresentamos metodologias para avaliar a integridade de membrana spermatozoan, uma celular característica associada com a competência de fertilização do espermatozoide. Nós descrevemos três técnicas para a avaliação de fluorimétrica de membranas de esperma: coloração simultânea com sondas fluorescentes específicas, microscopia de fluorescência e citometria de fluxo avançado dedicada ao esperma. Também são apresentados exemplos de combinar as metodologias.
Resumo
Spermiograms padrão, descrevendo a qualidade do esperma baseiam-se principalmente os parâmetros fisiológicos e visuais, tais como o volume de ejaculação e concentração, motilidade e motilidade progressiva e morfologia do esperma e viabilidade. No entanto, nenhuma destas avaliações é bom o suficiente para prever a qualidade do sêmen. Dado que a manutenção da viabilidade do esperma e fertilização potencial depende da integridade de membrana e funcionalidade intracelular, avaliação desses parâmetros poderá permitir uma melhor previsão de competência de fertilização do espermatozoide. Aqui, descrevemos três métodos viáveis para avaliar a qualidade do esperma utilizando sondas fluorescentes específicas, combinadas com análises de citometria de fluxo ou microscopia de fluorescência. Análises avaliaram integridade de membrana plasmática usando 4' 6-diamidino-2-phenylindole (DAPI) e iodeto de propidium (PI), integridade da membrana acrossomal usando conjugada com isotiocianato de fluoresceína aglutininas Pisum sativum (FITC-PSA) e integridade de membrana mitocondrial usando 5, 5', 6, 6-tetra-chloro-1, 1', 3, 3'-tetraethylbenzimidazolyl carbocyanine iodeto (JC-1). Combinações destes métodos também são apresentadas. Por exemplo, uso de anexina V combinado com ativa de fluorochromes PI avaliar apoptose e calcular a proporção de espermatozoides apoptotic (índice apoptótico). Acreditamos que essas metodologias, que são baseadas em examinar as membranas do espermatozoide, são muito úteis para a avaliação da qualidade do esperma.
Introdução
Integridade e funcionalidade de membranas de esperma são alguns dos fatores indicando a viabilidade do esperma e fertilização potencial. A membrana plasmática funciona como uma barreira entre os compartimentos intracelulares e extracelulares, mantendo assim o equilíbrio osmótico celular1. Qualquer estresse que induz os danos para a integridade da membrana plasmática pode prejudicar a homeostase, reduzir a capacidade de viabilidade e fertilização e aumentar a morte celular. Por exemplo, criopreservação reduz viabilidade de esperma devido a danos a sua membrana plasmática, como resultado de mudanças de temperatura e estresse osmótico2. Informamos anteriormente que expondo o esperma de touro a baixas concentrações de contaminantes de origem alimentar como o pesticida atrazine, diaminochlorotriazine seu metabolito principal ou a aflatoxina micotoxina B1, reduz a viabilidade de esperma1,3 . Isso foi determinado pela rotulagem o DNA de cadeia dupla com DAPI em combinação com PI, que se liga ao DNA de células com uma membrana plasmática danificada.
Reacção acrossómica (AR) envolve a fusão da membrana externa do acrossoma e membrana plasmática sobrejacente, resultando na liberação de enzimas acrossomal4,5. Estes são eventos essenciais para a penetração da zona pelúcida e ainda mais a fusão do espermatozoide com o oócito6. Portanto, a avaliação da integridade da membrana acrossomal constitui um parâmetro útil para avaliar a qualidade do sêmen e a fertilidade masculina7,8,9. Várias técnicas fluorescentes são adequadas para a verificação de integridade do acrossoma, FITC-PNA ou FITC-PSA8,10. Em nossos estudos anteriores, usando os padrões de FITC-PSA coloração1,3, desde as definições precisas para (i) acrossoma intacta, (ii) danificado da membrana do acrossoma e (iii) reagiu acrossoma. No relatório atual, podemos avaliar o status de acrossoma usando citometria de fluxo de esperma-dedicado e comparar os resultados com aqueles usando microscopia de fluorescência.
As mitocôndrias são organelas multifuncionais envolvido em, entre outras coisas, ATP síntese, produção de espécies reactivas de oxigénio, sinalização de cálcio e apoptose. Disfunções fisiológicas, incluindo a infertilidade masculina e feminina, estão associadas com alteração da função mitocondrial11. Mitocôndrias de esperma são arranjadas na peça intermediária e desempenham um papel crucial no esperma motilidade12. É bem aceite que o elevado potencial de membrana mitocondrial (ΔΨm) está associado a motilidade normal e alta fertilização capacidade13. Em contraste, ΔΨm baixo está associado um nível elevado de espécies reativas de oxigênio e reduzida taxa de fertilização14. Não obstante, vários compostos ambientais, por exemplo, desreguladores endócrinos, podem induzir estresse celular e levar a um aumento transiente da hiperpolarização1,3, ΔΨm, aumento da produção de radicais livres e, eventualmente, apoptose,15. A sonda fluorescente 5, 5', 6, 6-tetra-chloro-1, 1', 3, 3'-tetraethylbenzimidazolyl carbocyanine iodeto (JC-1) permite por exemplo, examinando os efeitos de toxinas de origem alimentar no esperma ΔΨm1,3.
Spermiograms padrão, com base nos parâmetros fisiológicos e morfológicos, não são bons o suficiente para prever a qualidade do sêmen. Métodos mais precisos são necessários para assegurar a qualidade do esperma. Aqui, nós fornecemos dois métodos viáveis para determinar a qualidade do esperma com base em avaliações de membranas de esperma: coloração quádruplo simultânea com sondas fluorescentes específicas e microscopia de fluorescência, descrito em nossos estudos1,3 e citometria de fluxo avançado dedicada ao esperma, recentemente utilizado em nosso laboratório e já está sendo usado por outros16,17,18.
Protocolo
Todos os experimentos foram realizados em conformidade com as orientações de 1994 israelense para o bem-estar animal. Esperma de bovina foi fornecida pela empresa israelense comercial para inseminação artificial e reprodução. Ejacula de 11 touros foram avaliadas neste estudo.
1. preparação da amostra esperma
Nota: O procedimento baseia-se protocolo1,3 no laboratório Roth.
- Obter cerca de 1 – 6 mL de sêmen de touro em um tubo de 15 mL à temperatura ambiente.
- Para cada 1 mL de sémen, adicionar 6 mL de tampão NKM escaldada (a 37 ° C) (110 mM de NaCl, 5 mM KCl, MOPS 20 mM [ácido 3-N-morphilino; pH 7,4]) e centrifugar para 8 min a 600 x g, 1-2 vezes até que o sobrenadante é claro.
Nota: Se a concentração de espermatozoides ou o volume inicial é muito elevado, dividida em dois tubos na lavagem de primeira. - Imediatamente remover e descartar o sobrenadante claro e deixar cerca de 1 cm do líquido sobrenadante acima a pelota.
- Inclinar-se cuidadosamente os tubos em um ângulo de 30° para aumentar a área de superfície para que o esperma nadar e esperar 20 a 30 min para permitir que os espermatozoides a nadar até a 37 ° C.
Nota: Turbidez pode ser vista. - Utilizando uma micropipeta cuidadosamente, remova o superior 1 mL do sobrenadante contendo os espermatozoides móveis para um novo tubo de 1,5 mL.
- Manter o esperma a 37 ° C até o uso.
- Estime a contagem de esperma, usando um hemocytometer de Neubauer.
Nota: Uma câmara de contagem diferente pode ser usada em vez disso, mas a contagem é diferente.- Para evitar o movimento do espermatozoide, diluir 100 µ l dos espermatozoides móveis com 10 mL de água bidestilada (DDW) (diluição de 1: 100) em um tubo de 15 mL e misture delicadamente.
- Carrega 10 µ l da amostra em cada lado da hemocytometer e da lamela. Certifique-se de evitar formação de bolhas no interior da câmara, pois isto pode resultar em uma contagem de esperma imprecisas.
- Observe ao microscópio composto com um objetivo X 20.
Nota: A grade completa em um hemocytometer contém 9 quadrados grandes, cada 1mm2, e a lamela repousa 0,1 mm acima do piso da câmara. Assim, o volume sobre a área central de contagem é de 0,1 mm3 ou 0,1 µ l. A área central do hemocytometer contém 25 quadrados médios e cada quadrado médio possui 16 quadrados menores com linhas simples. - Conte o número total de células encontradas em 4 quadrados de canto médio e da praça central. Para maior precisão, contar duas câmaras (ambos os lados do hemocytometer de Neubauer) e usar a média para calcular a concentração de células.
- Calcule a contagem de esperma, multiplicando o número médio obtido por 5 (para obter o número de células por área de contagem), por 10.000 (para obter o número de células por 1 mL da amostra diluída). Então, multiplique a contagem obtida pelo factor de diluição (1: 100).
Nota: Por exemplo, um número médio de espermatozoides contados em 5 dos 25 quadrados médios dentro da área central de contagem de duas câmaras é 150 ([152 + 148] / 2). Assim, o número médio de espermatozoides por câmara (ou 0,1 µ l) é 150 x 5 = 750. Multiplica 750 por 10.000 para obter o número de células por 1 mL da amostra diluída (7.500.000) e então multiplicar por 100 (fator de diluição), para obter 75 x 107 células por mL de amostra de sêmen original.
2. técnica #1: Avaliação simultânea das membranas de esperma usando vários fluorescente sondas
Nota: Membranas de esperma (plasma, acrossomal e mitocondrial) foram avaliadas conforme descrito por Celeghini et al.10, com algumas modificações. Utilizou-se microscopia epifluorescente, combinado com uma câmera digital com excitação em 450-490 nm e emissão a 515-565 nm, usando um filtro triplo.
-
Prepare soluções estoque.
- Prepare a 0,1 mg/mL solução stock de DAPI dissolvendo-se 5 mg de DAPI em 50 mL de soro de tampão fosfato (PBS). Preparar 50 alíquotas µ l e armazenar a-20 ° C. Antes de usar, dilua a solução estoque com PBS em 01:10 (solução de trabalho; 10 µ g/mL).
- Prepare-se 1 mg/mL solução FITC-PSA dissolvendo-se 1 mg de FITC-PSA em 1 mL de PBS. Preparar 50 alíquotas µ l e armazenar a-20 ° C. Antes de usar, dilua a solução estoque com PBS em 01:10 (solução de trabalho; 100 µ g/mL).
- Prepare o JC-1 de 1 mg/mL de solução dissolvendo-se 1 mg de JC-1 em 1 mL de Dimetilsulfóxido (DMSO). Prepare-se 10 alíquotas µ l e armazenar a-20 ° C. Antes de usar, dilua a solução estoque com DMSO às 01:10 (solução de trabalho; 0,1 mg/mL).
- Prepare a solução-mãe PI dissolvendo-se 10 mg de PI em 400 µ l de PBS (dando 2,5 mg/mL). Loja em + 4 ° C. Dilua 1 de estoque com PBS em 01:20 (solução de trabalho; 0,125 mg/mL). Armazenar a + 4 ° C como uma solução.
Atenção: O PI é um potencial mutagênico e deve ser manuseado com cuidado. O corante deve ser feito de forma segura e em conformidade com os regulamentos locais aplicáveis.
- Transferi µ l 133 dos espermatozoides móveis (passo 1.5) para um novo tubo de 1,5 mL (25 x 106 espermatozoides/mL).
Nota: Se a concentração da amostra é maior, diluí-lo no buffer NKM para obter a concentração necessária; se a concentração da amostra de natação da amostra é menor, centrifugar o sobrenadante obtido após nadar até a 1.000 x g por 5 min, retire a 0,5 mL do sobrenadante e contar o esperma novamente. - Adicionar 17 µ l de DAPI (solução de trabalho) e incubar durante 10 minutos a 37 ° C.
- Centrifugar a 1.000 x g por 5 min e descartar o sobrenadante.
- Ao pellet, adicione 100 µ l de tampão NKM.
- Adicionar 50 µ l de FITC-PSA, 2 µ l de JC-1 e 3 µ l de PI (soluções de trabalho) e incubar durante 10 minutos a 37 ° C.
- Centrifugar a 1.000 x g por 5 min e retirar o sobrenadante.
- Ao pellet, adicionar 40 µ l de tampão NKM e ressuspender pipetando.
- Transferi 10 µ l da amostra para uma lâmina de vidro, esfregaço e lamela.
-
Visualizar imediatamente por microscopia de epifluorescência (uso 40 x objetivo) com um filtro triplo, equipado com uma câmera digital e capturar uma imagem separada para cada filtro.
Nota: Não há nenhum significado na ordem dos filtros visualizado.- Visualizar sob canal DAPI com excitação em 358 nm e emissão na 461 nm.
- Visualize sob canal FITC para monômeros verdes com excitação em 450-490 nm e emissão a 515 – 565 nm.
- Visualizar sob canal de PI para agregados vermelhos com excitação em 488 nm e emissão a 590 nm.
- Visualizar com JC-1 vermelhos agregados com excitação em 559 nm e emissão na faixa de 574-627 nm; JC-1 verdes monômeros com excitação em 488 nm e emissão na faixa de 500-535 nm.
- Mescle as três imagens que recebeu os filtros em formato JPG/JPEG, usando a opção "Mesclar" do software da câmera.
- Abra a imagem mesclada com a ferramenta "Paint" e usar a opção de escova para marcar a contagem de espermatozoides.
-
Classifica o espermatozoide baseada a fluorescência emitida por cada sonda:
- Em geral, avaliar pelo menos 200 espermatozoides por slide — todas as células aparecem azuis (DAPI).
- Avaliar a viabilidade pela contagem de células mortas, que aparecem roxo (PI [vermelho] + [azul] DAPI) e calcular a percentagem de células mortas (células morta/total contado células x 100).
- Avalie o status de acrossoma usando os padrões de coloração fluorescente (FITC-PSA). Calcule as porcentagens dos diferentes padrões (acrossoma intacto, danificados ou reagiram células/total contado células x 100).
Nota: Membrana acrossomal danificada aparece como um tampão de acrossoma totalmente manchadas, verde; membrana acrossomal reagiram mostra residual verde equatorial ou superior mancha; células contendo membrana acrossomal intacta não exibirá qualquer coloração verde da região acrossomal. - Avalie ΔΨm distinguindo espermatozoides com alta ΔΨm, que exibem uma peça intermediária manchados de vermelho e espermatozoides com baixa ΔΨm, que exibem uma peça intermediária manchado de verde. Conta vermelha e verde midpieces separadamente e calcular sua relação (vermelho/verde).
3. técnica #2: Avaliação das membranas de esperma com Kits prontos para uso e citometria de fluxo
Nota: Avaliação de integridade de membrana plasmática, integridade de membrana acrossomal e potencial de membrana mitocondrial foi feita com kits de citometria de fluxo de ready-to-use contendo liofilizados fluorochromes em cada poço. O procedimento foi realizado de acordo com os fabricantes, com algumas modificações.
-
Avaliação de integridade de membrana plasmática
- Pegue o número desejado de poços da embalagem do kit de viabilidade e concentração (PI e SYbr14), transferi-los para a base de trabalho e cubra com uma tampa flexível (proteger da luz).
- Adicione 199 µ l de solução tamponada para citometria por bem.
- Adicionar 1 µ l de sêmen homogênea em 57 x 106/mL (57.000 células por poço) e homogeneizar por pipetagem.
- Cubra o prato com a tampa preta.
- Incube durante 10 minutos a 37 ° C, protegido da luz.
- Execute a amostra através do citômetro de fluxo com a viabilidade' configuração'.
-
Potencial de membrana mitocondrial
- Pegue o número desejado de poços da embalagem do kit atividade mitocondrial (JC-1), transferi-los para a base de trabalho e cubra com uma tampa flexível (proteger da luz).
- Adicionar 10 µ l de etanol absoluto por alvéolo e pipetar para Ressuspender o pó presente dentro do poço.
- Adicione 190 µ l de PBS por alvéolo e homogeneizar por pipetagem.
- Adicione 0,75 µ l de sêmen homogênea em 57 x 106/mL (50.000 células por poço) e homogeneizar por pipetagem.
- Cubra o prato com a tampa preta.
- Incube durante 30 min a 37 ° C, protegido da luz.
- Executar a amostra através do citômetro de fluxo com a atividade de ʽmitochondrial de configuração '.
-
Integridade da membrana acrossomal
Nota: FITC-PSA coloração (veja técnica #1) permite a avaliação de 3 categorias de acrossoma (acrossoma intacta, acrossoma reagiram e acrossoma danificada). Usando o citômetro de fluxo e kit de integridade do acrossoma (PI e FITC-PNA) e viabilidade, os espermatozoides são separados nestas 3 categorias.- Pegue o número desejado de poços da embalagem do kit de integridade de viabilidade & acrossoma, transferi-los para a base de trabalho e cubra com uma tampa flexível (proteger da luz).
- Adicione 200 µ l de solução tamponada para citometria por bem.
- Adicionar 0,7 µ l de sêmen homogênea em 57 x 106/mL (40.000 células por poço) e homogeneizar por pipetagem.
- Cubra o prato com a tampa preta.
- Incube durante 45 min a 37 ° C, protegido da luz.
- Executar a amostra através do citômetro de fluxo com o ʽInCyte de configuração '.
- Analisar o histograma resultante por retenção de três áreas de marcador de acordo com a intensidade da fluorescência, que representa células insignificantes, baixo fluoresce com acrossoma intacta, Imaculada (R1), baixa fluoresce células com residual manchado parte do acrossoma (R2) e células altamente fluorescentes com acrossoma interrompida (R3).
Nota: Use a seção "Analisando arquivos adquiridos usando outros módulos" no guia do usuário do instrumento a fim de criar as três regiões (R1, R2, R3).
4. técnica #3: Avaliação das membranas do espermatozoide utilizando sondas fluorescentes e citometria de fluxo
Nota: Uso da anexina V combinado com ativa de fluorochromes PI avaliar apoptose e calcular a proporção de espermatozoides apoptotic (índice apoptótico).
- Prepare 1 x anexina tampão de ligação V de 20 x solução estoque (diluir 500 µ l de tampão de ligação V 20 x solução estoque com 9,5 mL de água destilada estéril de anexina).
- Estime a contagem de esperma, usando um hemocytometer Neubauer, conforme descrito na seção 1.7.
- Lave 106 espermatozoides em 1 mL de 1x anexina V ligação buffer e centrifugar 300 x g por 10 min.
- Aspire o sobrenadante completamente.
- Resuspenda o pellet em 100 µ l de 1x anexina tampão de ligação V.
- Adicione 10 µ l da anexina V, conjugado com FITC.
- Misture bem e incube por 15 min no escuro à temperatura ambiente.
- Lave os espermatozoides, adicionando 1 mL de 1 x anexina V ligação buffer por 106 células e centrifugar a 300 x g durante 10 minutos.
- Aspire o sobrenadante completamente.
- Ressuspender as células em 500 µ l de 1 x anexina V ligação buffer por 106 células total.
- Adicione 1 µ g/mL PI imediatamente antes da análise com um citômetro de fluxo.
- Executar a amostra através do citômetro de fluxo definido na ʽInCyte'.
Resultados
A Figura 1 mostra simultânea fluorimétrica avaliação das membranas de esperma (plasma, acrossomal e mitocondrial) usando PI, DAPI, FITC-PSA e JC-1. Avaliação das membranas de esperma usando coloração simultânea com quatro sondas fluorescentes, por exemplo, permite avaliar a proporção de espermatozoides em cada categoria — live vs mortos; alta vs baixa ΔΨm; intacta vs. danificado o acrossoma — simultaneamente para cada espermatozoide.
A Figura 2 apresenta os resultados de esperma avaliação de membrana utilizando sondas fluorimétrica. Só o sémen que continha pelo menos 80% de espermatozoides móveis foram usados no experimento. Pelo menos 200 células foram examinadas por touro. Foi possível avaliar as diferenças na qualidade da amostra de esperma em termos de integridade de membrana. Por exemplo, a ejaculação de touro n º 7 tinha um percentual relativamente baixo de células mortas, uma percentagem baixa de espermatozoides com pseudo reagiu acrossoma e maior potencial, em comparação com o esperma de touro n º 1 de membrana mitocondrial.
A Figura 3 mostra a amostras representativas avaliadas para a actividade mitocondrial (Figura 3D–3F) e viabilidade (Figura 3A–3C). As intensidades de fluorescência das amostras foram avaliadas por um citômetro de fluxo de esperma de conta dedicado, com software dedicado. Este citômetro de fluxo contém um laser azul de fase sólida (448 nm) e dois fotodiodos: encaminhar a dispersão e a dispersão de lado. Mede especificamente Propriedades de emissão de esperma com três tubos fotomultiplicadores (verde: 525/30 nm, amarelo: 583/26 nm; vermelho: 655/50 nm) e acomoda de filtros e divisores óticos16. Permite avaliação de 5.000 espermatozoides por análise.
O kit de avaliação de viabilidade contém uma sonda com permeabilidade diferencial viável (membrana plasmática intacta) e espermatozoides mortos (a membrana plasmática danificada) (Figura 3). ΔΨm de esperma foi avaliada usando um kit que distingue entre polarizada membrana mitocondrial (fluorescência aparecendo em laranja) e despolarizada membrana mitocondrial (fluorescência aparecem em verde) (Figura 3F).
A Figura 4 apresenta uma avaliação da integridade do acrossoma realizada com o kit de ready-to-use, leia com a citometria de fluxo (figuras 4A–4C), dividindo o histograma resultante de espermatozoides fechados em três áreas de marcador, representando células insignificantes baixo fluoresce com acrossoma intacta, Imaculada (R1), baixa fluoresce células com residual manchado parte do acrossoma (R2), e altamente fluoresce células com acrossoma interrompida (R3).
A tabela 1 apresenta uma comparação das duas técnicas fluorimétrica para avaliação das membranas de esperma. As mesmas amostras de esperma de três touros diferentes foram avaliadas para a viabilidade, o potencial de membrana mitocondrial (ΔΨm) e integridade do acrossoma usando coloração quádruplo simultânea, bem como citometria de fluxo. Esta comparação é altamente importante, que mostra os resultados correspondentes usando cada uma das duas técnicas. Os dados foram analisados por uma análise e teste t de Student. Não há diferenças estatisticamente significativas foram observadas.
A Figura 5 mostra uma amostra representativa, avaliada por apoptose usando anexina V (AV) e propidium fluorochromes de iodeto (PI). O uso destas duas sondas permite distinguir entre quatro padrões indicando células viáveis (AV-, PI-), primeiras pilhas apoptotic (AV +, PI-), células apoptóticas (AV +, PI +) e células necróticas (AV-, PI +).
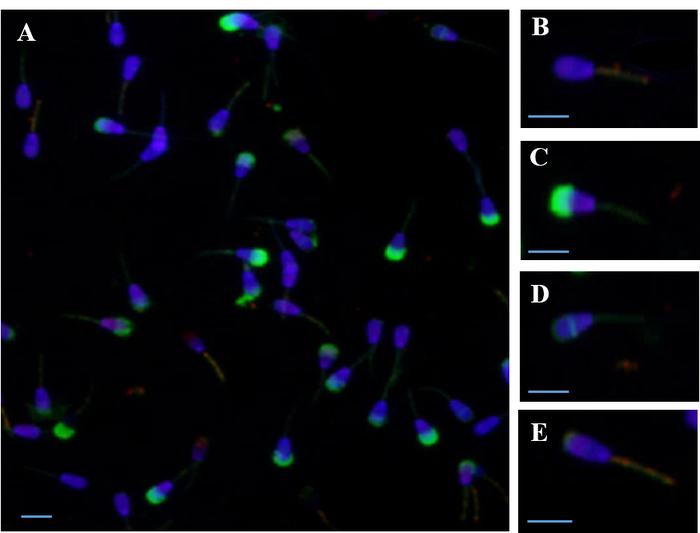
Figura 1: Fotomicrografia de epifluorescência de espermatozoides corados simultaneamente com várias sondas fluorescentes. (A) simultânea de coloração com quatro sondas PI, DAPI, FITC-PSA e JC-1) (B) espermatozoide vivo com DAPI coloração de núcleo e elevado potencial de membrana mitocondrial (ΔΨm), corados com sonda de JC-1. (C) morto espermatozoide com a membrana plasmática danificada manchado com sonda de PI, danificado acrossoma manchada com sonda FITC-PSA e baixa ΔΨm. (D) Live, espermatozoide acrossoma-reagiu com mancha equatorial residual e baixa ΔΨm. (E) Live, espermatozoide acrossoma-reagiu com coloração superior residual e alta ΔΨm. Barras de escala = 10 µm. clique aqui para ver uma versão maior desta figura.

Figura 2: avaliação das membranas de esperma de touro usando sondas fluorimétrica. Esperma (A) viabilidade foi determinada com sondas fluorescentes 4' 6-diamidino-2-phenylindole (DAPI) e iodeto de propidium (PI). (B) acrossoma status foi determinado de acordo com padrões de coloração FITC-PSA. Apresentados são a proporção de espermatozoides com acrossoma reagiram. (C) potencial de membrana mitocondrial (ΔΨm) foi avaliada usando com JC-1 sonda fluorescente e apresentado como o rácio entre a proporção média de manchados de vermelho (alto potencial) e manchado de verde esperma (baixo potencial). Os dados são apresentados como % de células de células avaliadas totais. Pelo menos 200 espermatozoides foram analisadas por touro. Clique aqui para ver uma versão maior desta figura.

Figura 3: avaliação de fluorescência atividade mitocondrial (D-F) de amostras representativas e viabilidade (A-C), medido pelo citômetro de fluxo EasyCyte. Histogramas representam ungated espermatozoides e espermatozoides de detritos (A, D), condomínio fechado (B, E), distribuição de espermatozoides viável (verde) e células de mortos (vermelho) (C) e a distribuição de espermatozoides para polarizada (amarelo) e (despolarizada membrana mitocondrial verde) (F). Barras de escala = 10 µm. clique aqui para ver uma versão maior desta figura.

Figura 4: avaliação de fluorescência da integridade do acrossoma de amostras representativas, medido pelo citômetro de fluxo EasyCyte. (A) histograma de espermatozoides ungated e detritos. (B, C) Histogramas de espermatozoides fechados com avaliação da integridade do acrossoma executada com o kit pronto para usar, leia com configuração adaptada 'Directora', dividindo-se o histograma resultante de espermatozoides condomínio fechado em três áreas de marcador, representando insignificante, células de baixa fluoresce com acrossoma intacta, Imaculada (R1), células de baixa fluoresce com residual manchado parte do acrossoma (R2) e células altamente fluorescentes com interrompido acrossoma (R3). Barras de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
| N. médio de células | Vialbility | Potencial de membrana mitocondrial | Integridade do acrossoma | ||||||
| Viável | Mortos | Despolarizada | Polarizado | Proporção de vermelho/verde | Acrossoma intacta | Acrossoma reagiram | Acrossoma interrompida | ||
| Coloração quádruplo | 253 | 32,7 ± 1,53% | 67,3 ± 1,53% | 65,7 ± 2.25% | 34,3 ± 2,52% | 0,5 ± 0,06 | 37,3 ± 7,2% | 38,0 ± 5,7% | 24,3 ± 3,0% |
| Cytomtery de fluxo | 5.000 | 32,3 ± 2,08% | 67,7 ± 2,08% | 65,0 ± 1,00% | 35,0 ± 1,00% | 0,5 ± 0,02 | 39,5 ± 5,7% | 39,5 ± 6,5% | 21,0 ± 8,0% |
Tabela 1: comparação de duas técnicas para a avaliação das membranas de esperma fluorimétrica. As mesmas amostras de esperma foram avaliadas para viabilidade, potencial de membrana mitocondrial e integridade do acrossoma usando coloração quádruplo simultânea e citometria de fluxo. Os dados são apresentados como média proporção ± DP das células examinadas, calculado para 3 repetições.

Figura 5: anexina V e PI fluorescência de uma amostra representativa medido por um citômetro de fluxo. Representam histogramas (A) ungated espermatozoides e detritos e (B) distribuição de espermatozoides fechados para início apoptotic (AV +, PI-), apoptose (AV +, PI +), viável (AV-, PI-) e necrótico (AV-, PI +) células. Clique aqui para ver uma versão maior desta figura.
Discussão
Fecundação do esperma potencial depende de múltiplos fatores, refletindo sua qualidade. Uma alta concentração de espermatozoides e uma elevada proporção de espermatozoides móveis altamente progressivamente podem ser considerados o sêmen de alta qualidade. No entanto, essa avaliação não leva em conta outros parâmetros celulares e funcionais. O uso de 'bancada' conta citômetro de fluxo pode ser facilmente adaptado para avaliação de várias estruturas de esperma utilizando sondas fluorescentes, como mostrado anteriormente por outros17 e demonstrado neste documento (técnica #3). Por exemplo, a integridade do acrossoma do esperma é altamente importante para a ocorrência de fecundação natural bem sucedida e, portanto, uma avaliação precisa do status acrossomal é garantida. Essa avaliação pode ser facilmente executada pela classificação do status do acrossoma usando os padrões de fluorescente coloração (FITC-PSA, FITC-PNA, i.e., técnica #1, como descrito anteriormente)1,3. Em particular, é altamente importante determinar a proporção de espermatozoides com acrossoma intacta (ou seja, exibe uma imaculado acrossoma) em relação aqueles com acrossoma danificada. Com respeito a último, espermatozoides com acrossoma danificada pode exibir PAC acrossomal (i) um totalmente manchada, que indica que a membrana está danificada, permitindo que a tinta flua através da membrana da vesícula de acrossoma; (ii) acrossoma-reagiu o esperma que exibem apenas residual acrossoma conteúdo, indicando que o AR já ocorreu (ou seja, pseudo AR). Note-se que essa avaliação também pode ser realizada com o citômetro de fluxo dedicado.
O kit de integridade de ready-to-use viabilidade & acrossoma define ambos viabilidade do esperma (viáveis ou morto) e integridade acrossomal (intacta ou rompida). Aqui, nós sugerimos usar o citômetro de fluxo dedicado para definir os três status acrossomal acima mencionados (i.e., intacta, danificados, reagiu). Adaptamos a plataforma de citômetro de fluxo conta para avaliação mais precisa, que identifica o acrossoma-reagiu esperma (i.e., baixa fluorescência) enquanto excluindo-os de aqueles com acrossoma interrompida (alta fluorescência), ao invés de incluí-los com aqueles que têm uma acrossoma intacta. Isto dá uma exata proporção de espermatozoides com acrossoma funcional ou não funcional. Espermatozoides com acrossoma reagiram bem como membrana acrossomal interrompida perderam sua capacidade de fertilizar o oócito. Além disso, a análise precisa pode lançar luz sobre o mecanismo subjacente alteração de acrossoma, ou seja, danificado a membrana do acrossoma vs pseudo ativação de acrossoma.
Temos comparado os resultados obtidos com a técnica #1 e #2 de técnica e encontrou grande compatibilidade entre eles, em particular na avaliação da viabilidade e ΔΨm (tabela 1). Dentre as principais vantagens de usar o o citômetro de fluxo dedicado é o grande número de espermatozoides avaliadas em relação ao pequeno número de espermatozoides que são avaliados na prática por microscopia de fluorescência e sondas (milhares vs centenas, respectivamente ). Além disso, o último procedimento é demorada e subjetiva, mesmo quando realizada por um observador experiente. Como citometria de fluxo só detecta fluorescência partícula associada, não há nenhuma necessidade de lavar a sonda desvinculada da solução, que é uma etapa demorada17. Por outro lado, a avaliação fluorimétrica de membranas de esperma descrito na técnica #1 permite a avaliação simultânea de várias membranas. Fomos capazes de usar até quatro sondas fluorescentes juntos1,3.
Finalmente, note que o citômetro de fluxo dedicado foi desenvolvido como um módulo de ensaio aberto, fornecendo todas as ferramentas básicas para amostra aquisição e análise de dados. A função aquisição permite a recolha de vários tipos de informações de uma amostra de células e, portanto, permite a adaptação para uma avaliação mais precisa, como mostrado aqui para índice de status e apoptotic acrossoma.
Em conclusão, as metodologias descritas neste documento são muito úteis para a avaliação da qualidade do sêmen. Examinar as membranas do espermatozoide é altamente importante para determinar a competência de fertilização do espermatozoide.
Divulgações
Os autores declaram que não há nenhum conflito de interesses.
Agradecimentos
Os autores gostaria de agradecer sua ajuda e cooperação e MS. Li Na (IMV Technologies, L'Aigle, França) para obter assistência com a instalação do instrumento e formação empresa israelense "SION" para inseminação artificial e reprodução (Hafetz-Haim, Israel).
Materiais
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| MOPS [3-N-morphilino propanesulfonic acid] | Sigma | M1254 | |
| PBS | Sigma | P5493 | |
| DMSO | Sigma | D2438 | |
| Ethanol absolute | Sigma | 64-17-5 | |
| Hemacytometer | Neubauer Germany | hemocytometer | |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma | D9542 | fluorescent probe |
| PI (propidium iodide ) | Sigma | P4170 | fluorescent probe |
| FITC-PSA (fluorescein isothiocyanate-conjugated Pisum sativum agglutinin ) | Sigma | L0770 | fluorescent probe |
| JC-1 (5,5',6,6'-tetra-chloro-1,1',3,3'-tetraethylbenzimidazolyl carbocyanine iodide) | ENZOBiochem, New York, NY, USA | ENZ52304 | fluorescent probe |
| Annexin V conjugated to FITC | MACS, Miltenyi Biotec | 130-093-060 | fluorescent probe |
| Annexin V binding buffer 20x stock solution | MACS, Miltenyi Biotec | 130-092-820 | buffer |
| Nikon Eclipse, TE-2000-u | Nikon, Tokyo, Japan | inverted fluorescence microscope | |
| Nis Elements | Nikon, Tokyo, Japan | software | |
| Nikon DXM1200F | Nikon, Tokyo, Japan | digital camera | |
| Guava EasyCyte Plus | IMV Technologies, L'Aigle, France | microcapillary sperm flow cytometer | |
| CytoSoft | Guava Technologies Inc., Hayward, CA, USA; distributed by IMV Technologies | software | |
| Buffered solution for cytometry | IMV Technologies, L'Aigle, France | 023862 | buffer |
| Viability and concentration kit | IMV Technologies, L'Aigle, France | 024708 | kit for viability assessment |
| Mitochondrial activity kit | IMV Technologies, L'Aigle, France | 024864 | kit for mitochondrial activity assessment |
| Viability & acrosome integrity kit | IMV Technologies, L'Aigle, France | 025293 | kit for acrosome integrity assessment |
| JMP-13 | SAS Institute Inc., 2004, ary, NC, USA | software | |
| Bovine sperm | "SION", Israeli company for artificial insemination and dreeding, Hafetz-Haim, Israel |
Referências
- Komsky-Elbaz, A., Roth, Z. Effect of the herbicide atrazine and its metabolite DACT on bovine sperm quality. Reprod Toxicol. 67, 15-25 (2016).
- Gürler, H., et al. Effects of cryopreservation on sperm viability, synthesis of reactive oxygen species, and DNA damage of bovine sperm. Theriogenology. 86 (2), 562-571 (2016).
- Komsky-Elbaz, A., Saktsier, M., Roth, Z. Aflatoxin B1 impairs sperm quality and fertilization competence. Toxicology. 393, 42-50 (2018).
- Beltrán, C., et al. Role of Ion Channels in the Sperm Acrosome Reaction. Adv Anat Embryol Cell Biol. 220, 35-69 (2016).
- Breitbart, H. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol (Noisy-le-grand). 49 (3), 321-327 (2003).
- Almadaly, E., et al. Methodological factors affecting the results of staining frozen-thawed fertile and subfertile Japanese Black bull spermatozoa for acrosomal status. Anim Reprod Sci. 136 (1-2), 23-32 (2012).
- Jankovicová, J., Simon, M., Antalíková, J., Horovská, L. Acrosomal and viability status of bovine spermatozoa evaluated by two staining methods. Vet Hung. 56 (1), 133-138 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histol Histopathol. 24 (8), 999-1007 (2009).
- Whitfield, C. H., Parkinson, T. J. Relationship between fertility of bovine semen and in vitro induction of acrosome reactions by heparin. Theriogenology. 38 (1), 11-20 (1992).
- Celeghini, E. C. C., de Arruda, R. P., de Andrade, A. F. C., Nascimento, J., Raphael, C. F. Practical Techniques for Bovine Sperm Simultaneous Fluorimetric Assessment of Plasma, Acrosomal and Mitochondrial Membranes. Reprod Domest Anim. 42 (5), 479-488 (2007).
- Ramalho-Santos, J., Varum, S., Amaral, S., Mota, P. C., Sousa, A. P., Amaral, A. Mitochondrial functionality in reproduction: from gonads and gametes to embryos and embryonic stem cells. Hum Reprod. 15 (5), 553-572 (2009).
- Eddy, E. M., O’Brien, A. The spermatozoon. , Raven Press. New York, USA. Knobil and Neill's Physiology of Reproduction; Volume 1 (1994).
- Gallon, F., Marchetti, C., Jouy, N., Marchetti, P. The functionality of mitochondria differentiates human spermatozoa with high and low fertilizing capability. Fertil Steril. 86 (5), 1526-1530 (2006).
- Espinoza, J. a, Paasch, U., Villegas, J. V. Mitochondrial membrane potential disruption pattern in human sperm. Hum Reprod. 24 (9), 2079-2085 (2009).
- Hüttemann, M., Lee, I., Pecinova, A., Pecina, P., Przyklenk, K., Doan, J. W. Regulation of oxidative phosphorylation, the mitochondrial membrane potential, and their role in human disease. J Bioenerg Biomembr. 40 (5), 445-456 (2008).
- Sellem, E., et al. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology. 84 (9), 1447-1454 (2015).
- Odhiambo, J. F., Sutovsky, M., DeJarnette, J. M., Marshall, C., Sutovsky, P. Adaptation of ubiquitin-PNA based sperm quality assay for semen evaluation by a conventional flow cytometer and a dedicated platform for flow cytometric semen analysis. Theriogenology. 76 (6), 1168-1176 (2011).
- Barrier Battut, I., Kempfer, A., Becker, J., Lebailly, L., Camugli, S., Chevrier, L. Development of a new fertility prediction model for stallion semen, including flow cytometry. Theriogenology. 86 (4), 1111-1131 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados