Method Article
Fluorimétrica de técnicas para la evaluación de las membranas del esperma
En este artículo
Resumen
Aquí, presentamos a metodologías para evaluar la integridad de la membrana de spermatozoan, una característica celular asociada con la capacidad de fertilización del esperma. Se describen tres técnicas para la evaluación de fluorimétrico de las membranas del esperma: coloración simultánea con sondas fluorescentes específicas, microscopía de fluorescencia y citometría de flujo avanzada dedicado de esperma. También se presentan ejemplos de la combinación de las metodologías.
Resumen
Espermogramas estándar que describe la calidad del esperma se basan principalmente en los parámetros fisiológicos y visuales, como el volumen de eyaculado y concentración, motilidad y motilidad progresiva, morfología espermática y viabilidad. Sin embargo, ninguna de estas evaluaciones es suficiente predecir la calidad del semen. Dado que el mantenimiento de viabilidad espermática y la fertilización potencial depende de la integridad de la membrana y función intracelular, evaluación de estos parámetros puede permitir una mejor predicción de la capacidad de fertilización del esperma. Aquí, Describimos tres métodos posibles para evaluar la calidad del esperma mediante sondas fluorescentes específicas combinadas con análisis de citometría de flujo o microscopia de fluorescencia. Análisis evaluaron la integridad de la membrana plasmática con 4', 6-diamidino-2-phenylindole (DAPI) y yoduro de propidio (PI), integridad de la membrana acrosómica usando conjugados con isotiocianato de fluoresceína aglutinina de Pisum sativum (PSA-FITC) y integridad de la membrana mitocondrial con 5, 5', 6, 6'-tetra-cloro-1, 1', 3, 3'-tetraethylbenzimidazolyl carbocyanine yoduro (JC-1). También se presentan combinaciones de estos métodos. Por ejemplo, el uso de anexina V combinado con PI fluorocromos permite evaluar apoptosis calcular la proporción de espermatozoides apoptóticos (índice de apoptosis). Creemos que estas metodologías, que se basan en el examen de las membranas del espermatozoide, son muy útiles para la evaluación de la calidad del esperma.
Introducción
Integridad y funcionalidad de las membranas del esperma son algunos de los factores que indica viabilidad espermática y la fertilización posible. La membrana plasmática actúa como una barrera entre los compartimientos intracelulares y extracelulares, manteniendo así el equilibrio osmótico celular1. Cualquier estrés que induce daño en la integridad de la membrana plasmática pueden la homeostasis, reducen la capacidad de viabilidad y fertilización e incrementar la muerte celular. Por ejemplo, criopreservación reduce la viabilidad espermática debido al daño a la membrana plasmática, como resultado de los cambios de temperatura y estrés osmótico2. Hemos divulgado previamente que exponer los espermatozoides de Toro para bajas concentraciones de contaminantes de los alimentos tales como la plaguicidas atrazina, su metabolito principal diaminochlorotriazine o la aflatoxina de micotoxina B1, reduce el esperma viabilidad1,3 . Esto fue determinado por el ADN de doble hebra con DAPI de etiquetado en combinación con PI, que se une al ADN de las células con una membrana de plasma dañada.
Reacción acrosómica (RA) consiste en la fusión de la membrana acrosómica externa y la membrana plasmática suprayacente resultando en la liberación de enzimas acrosómica4,5. Estos son eventos esenciales para la penetración de la zona pelúcida y fusión del espermatozoide con el ovocito6más. Por lo tanto, la evaluación de la integridad de la membrana acrosómica constituye un parámetro útil para evaluar la calidad del semen y la fertilidad masculina7,8,9. Varias técnicas fluorescentes son convenientes para la verificación de integridad del acrosoma, FITC-PNA o FITC-PSA8,10. En nuestros estudios anteriores, utilizando los patrones de FITC-PSA tinción1,3, proporciona las definiciones precisas para (i) acrosoma intacto, (ii) dañar la membrana del acrosoma y (iii) reacción acrosómica. En el informe actual, evaluar el estado del acrosoma mediante citometría de flujo de esperma dedicado y comparar los resultados a aquellos que utilizan la microscopía de fluorescencia.
Las mitocondrias son organelos multifuncionales involucrada en, entre otras cosas, ATP síntesis, producción de especies reactivas del oxígeno, señales de calcio y apoptosis. Disfunciones fisiológicas, incluyendo la infertilidad masculina y femenina, se asocian con alteración de la función mitocondrial11. Las mitocondrias del espermatozoide se arreglan en la midpiece y desempeñan un papel crucial en el esperma motilidad12. Es bien aceptado que el alto potencial de membrana mitocondrial (ΔΨm) se asocia con motilidad normal y fertilización alta capacidad13. En cambio, ΔΨm bajo se asocia con un nivel elevado de especies reactivas de oxígeno y reducción de la tasa de fertilización14. Sin embargo, varios compuestos ambientales, por ejemplo los disruptores endocrinos, pueden inducir estrés celular y conducir a un aumento transitorio en hiperpolarización1,3, ΔΨm, aumento de la producción de radicales libres y eventualmente, 15de la apoptosis. La sonda fluorescente 5, 5', 6, 6'-tetra-cloro-1, 1', 3, 3'-tetraethylbenzimidazolyl carbocyanine yoduro (JC-1) permite examinar por ejemplo, los efectos de las toxinas transmitidas por los alimentos en esperma ΔΨm1,3.
Espermogramas estándar, basadas en parámetros morfológicos y fisiológicos, no son lo suficientemente buenas como predecir la calidad del semen. Se requieren métodos más precisos para asegurar la calidad del esperma. Presentamos dos métodos posibles para determinar la calidad del esperma basada en evaluaciones de las membranas del esperma: coloración cuádruple simultánea con sondas fluorescentes específicas y microscopía de fluorescencia, descrito en nuestros estudios1,3 y citometría de flujo de esperma dedicado avanzado recientemente en nuestro laboratorio y ya siendo utilizado por otros16,17,18.
Protocolo
Todos los experimentos fueron realizados siguiendo las directrices israelíes de 1994 para el bienestar animal. Espermatozoides bovinos fue suministrado por empresa comercial israelí para la inseminación artificial y cría. Eyaculados de 11 toros fueron evaluados en este estudio.
1. preparación de muestras de esperma
Nota: El procedimiento se basa en protocolo1,3 del laboratorio Roth.
- Obtener aproximadamente de 1 a 6 mL de semen de toro en un tubo de 15 mL a temperatura ambiente.
- Cada 1 ml de semen, añadir 6 mL de tampón NKM precalentado (a 37 ° C) (110 mM NaCl, KCl, de 5 mM 20 mM fregonas [ácido propanesulfonic 3-N-morphilino; pH 7.4]) y centrifugar para 8 min a 600 x g, 1 – 2 veces hasta que el sobrenadante esté claro.
Nota: Si la concentración espermática o el volumen inicial es muy alto, dividida en dos tubos en el primer lavado. - Quitar inmediatamente y desechar el sobrenadante y dejar aproximadamente 1 cm del sobrenadante por encima de la pelotilla.
- Lean cuidadosamente los tubos en un ángulo de 30 º para aumentar la superficie de los espermatozoides nadar hacia arriba y esperar 20-30 min para permitir que los espermatozoides a nadar hasta a 37 ° C.
Nota: Se observa turbidez. - Con una micropipeta con cuidado, retire la parte superior 1 mL del sobrenadante que contiene los espermatozoides móviles a un nuevo tubo de 1,5 mL.
- No el esperma a 37 ° C hasta su uso.
- Estiman que el conteo de espermatozoides utilizando un hemocitómetro de Neubauer.
Nota: Puede utilizar una cámara de conteo diferente, pero la cuenta es diferente.- Para evitar el movimiento del espermatozoide, diluir 100 μl de los espermatozoides móviles con 10 mL de agua bidestilada (DDW) (dilución 1: 100) en un tubo de 15 mL y mezclar suavemente.
- Cargar 10 μl de la muestra en cada lado del hemocitómetro y el cubreobjetos. Asegúrese de evitar formación de burbujas dentro de la cámara como esto puede resultar en un conteo de esperma inexacta.
- Observar bajo un microscopio compuesto con el objetivo 20 X.
Nota: La red completa en un hemocitómetro contiene 9 cuadrados grandes, cada 1 mm2, y el cubreobjetos basa 0,1 mm por encima del piso de la cámara. Así, el volumen sobre el área central de la cuenta es de 0.1 mm3 o 0.1 μl. La zona central del hemocitómetro contiene 25 cuadrados medianos y cada cuadrado mediano tiene 16 plazas más pequeñas con líneas simples. - Contar el número total de células que se encuentran en 4 cuadrados de la esquina del medio y la plaza central. Para mayor precisión, contar dos cámaras (ambos lados del hemocitómetro de Neubauer) y utilizar la media para calcular la concentración de células.
- Multiplicar al número obtenido por 5 (para obtener el número de células por conteo de área) y 10.000 (para obtener el número de células por 1 mL de la muestra diluida) para calcular el conteo de espermatozoides. Luego multiplique el recuento obtenido por el factor de dilución (1: 100).
Nota: Por ejemplo, un número promedio de espermatozoides contados en 5 de las 25 plazas medio dentro de la zona central de la cuenta de dos compartimientos es de 150 ([152 + 148] / 2). Así, el número promedio de espermatozoides por cámara (o 0,1 μl) es 150 x 5 = 750. Multiplicar 750 por 10.000 para obtener el número de células por 1 mL de muestra diluida (7.500.000) y luego multiplicar por 100 (factor de dilución) para obtener 75 x 107 células por mL de muestra de semen original.
2. técnica #1: Evaluación simultánea de las membranas de espermatozoides utilizando fluorescentes múltiples sondas
Nota: Membranas del esperma (plasma y acrosómica y mitocondrial) se evaluaron como se ha descrito por Celeghini et al10, con algunas modificaciones. Se utilizó la microscopía epifluorescente, combinado con una cámara digital con excitación a 450-490 nm y emisión a 515 565 nm con un filtro triple.
-
Preparar soluciones madre.
- Prepare a 0,1 mg/mL solución DAPI disolviendo 5 mg de DAPI en 50 mL de tampón fosfato salino (PBS). Preparar 50 alícuotas de μl y almacenar a-20 ° C. Antes del uso diluir la solución madre con PBS en 1:10 (solución de trabajo; 10 μg/mL).
- Prepare 1 mg/mL PSA-FITC solución disolviendo 1 mg de PSA-FITC en 1 mL de PBS. Preparar 50 alícuotas de μl y almacenar a-20 ° C. Antes del uso diluir la solución madre con PBS en 1:10 (solución de trabajo, 100 μg/mL).
- Preparar solución stock de 1 mg/mL 1 JC disolviendo 1 mg de JC-1 en 1 mL de dimetilsulfóxido (DMSO). Preparar 10 alícuotas μl y almacenar a-20 ° C. Antes del uso diluir la solución con DMSO en 1:10 (solución de trabajo; 0,1 mg/mL).
- Disolver 10 mg de PI en 400 μL de PBS (dando 2,5 mg/mL) para preparar la solución madre de PI. Tienda a + 4 ° C. Diluir el caldo 1 con PBS a 1:20 (solución de trabajo; 0,125 mg/mL). Almacenar a 4 ° C como una solución de reserva.
PRECAUCIÓN: PI es un mutágeno potencial y debe ser manejado con cuidado. El tinte debe eliminarse de forma segura y según la normativa local aplicable.
- Transferencia 133 μl de espermatozoides móviles (criterio 1.5) a un nuevo tubo de 1,5 mL (25 x 106 espermatozoides/mL).
Nota: Si la concentración de la muestra es mayor, diluirlo en buffer NKM para lograr la concentración requerida; Si la concentración de la muestra de la natación por ejemplo es menor, centrifugar el sobrenadante obtenido después de nadar hasta a 1.000 x g durante 5 min, retirar 0.5 mL del sobrenadante y contar otra vez los espermatozoides. - Añadir 17 μl de DAPI (solución de trabajo) e incubar 10 min a 37 ° C.
- Centrifugar a 1.000 x g durante 5 min y descarte el sobrenadante.
- A la pelotilla, añadir 100 μl de buffer NKM.
- Añadir 50 μl de PSA-FITC, 2 μl de JC-1 y 3 μl de PI (soluciones de trabajo) e incubar 10 min a 37 ° C.
- Centrifugar a 1.000 x g durante 5 minutos y retirar el sobrenadante.
- El precipitado, agregar 40 μl de tampón NKM y resuspender mediante pipeteo.
- Transferir 10 μl de la muestra a un portaobjetos de vidrio, el borrón de transferencia y el cubreobjetos.
-
Visualizar inmediatamente por microscopía de epifluorescencia (uso 40 x objetivo) con un triple filtro, equipado con una cámara digital y capturar una imagen por separado para cada filtro.
Nota: No hay ninguna importancia a la orden de filtros visualizado.- Visualizar en el canal DAPI con excitación a 358 nm y emisión a 461 nm.
- Visualizar bajo canal FITC para monómeros verdes con excitación a 450 – 490 nm y emisión a 515 – 565 nm.
- Visualizar bajo canal de PI para hacer rojo con excitación de 488 nm y emisión a 590 nm.
- Visualizar según JC-1 rojo agregados con excitación a 559 nm y emisión en el rango de 574 – 627 nm; JC-1 verdes monómeros con excitación de 488 nm y emisión en el rango de 500-535 nm.
- Unir las tres imágenes que recibió de los filtros en formato JPG/JPEG, usando la opción "merge" de software de la cámara.
- Abra la imagen fusionada con la herramienta "Paint" y utilice la opción de pincel para marcar espermatozoides contados.
-
Clasificar basados en la fluorescencia emitida por cada sonda de espermatozoides:
- En general evaluar al menos 200 espermatozoides por diapositiva, todas las células aparecen azul (DAPI).
- Evaluar la viabilidad por recuento de células muertas, que aparecen púrpura (PI [rojo] + [blue] DAPI) y calcular el porcentaje de células muertas (células muerta contado total células x 100).
- Evaluar el estado del acrosoma con los patrones de tinción fluorescente (FITC-PSA). Calcular los porcentajes de los diferentes patrones (acrosoma intacto, dañados o reaccionado células total contado células x 100).
Nota: Membrana acrosómica dañada aparece como una gorra de acrosoma totalmente barnizado, verde; membrana acrosómica reaccionada muestra residual verde ecuatorial o superior coloración; las células que contienen intacta membrana acrosómica no exhibirán ninguna coloración verde de la región acrosómica. - Evaluar la ΔΨm distinción de espermatozoides con alta ΔΨm, que exhiben un midpiece teñido de rojo y los espermatozoides con baja ΔΨm que exhiben un midpiece teñido de verde. Cuenta roja y verde midpieces por separado y calcular su cociente (rojo/verde).
3. técnica #2: Evaluación de las membranas de espermatozoides listos para usar y citometría de flujo
Nota: Evaluación de la integridad de la membrana plasmática, integridad de la membrana acrosómica y potencial de membrana mitocondrial se realizó con kits de citometría de flujo lista para usar que contiene liofilizados fluorocromos en cada pozo. El procedimiento se realizó según los fabricantes con algunas modificaciones.
-
Evaluación de integridad de membrana plasmática
- Tome el número deseado de pocillos del paquete del kit de viabilidad y concentración (PI y SYbr14), transferencia a la base de trabajo y cubierta con una tapa flexible (proteger de la luz).
- Añadir 199 μl de solución tampón para citometría por pozo.
- Añadir 1 μl de semen homogénea en 57 x 106/ml (57.000 células por pocillo) y homogeneizar por pipeteo.
- Cubra la placa con la tapa negra.
- Incubar 10 min a 37 ° C, protegido de la luz.
- Ejecutar la muestra por el citómetro de flujo con la 'viabilidad' de configuración.
-
Potencial de membrana mitocondrial
- Tome el número deseado de pocillos del paquete del kit de actividad mitocondrial (JC-1), transferencia a la base de trabajo y cubierta con una tapa flexible (proteger de la luz).
- Añadir 10 μl de etanol absoluto por pozo y pipeta para Resuspender el polvo presente en el pozo.
- Añadir 190 μl de PBS por pozo y homogeneizar mediante pipeteo.
- Añadir 0,75 μl de semen homogénea en 57 x 106/ml (50.000 células por pocillo) y homogeneizar por pipeteo.
- Cubra la placa con la tapa negra.
- Incubar durante 30 min a 37 ° C, protegido de la luz.
- Ejecutar la muestra por el citómetro de flujo con la actividad de ʽmitochondrial de ajuste '.
-
Integridad de la membrana acrosómica
Nota: PSA-FITC tinción (ver técnica de #1) permite la evaluación de las 3 categorías de acrosoma (acrosoma intacto, acrosoma reaccionado y acrosoma dañado). Uso del citómetro de flujo y viabilidad y kit de integridad del acrosoma (PI y FITC-PNA), los espermatozoides son separados en estas 3 categorías.- Tomar el número de pozos el paquete de kit de integridad viabilidad y acrosoma, transferirlos a la base de trabajo y cubierta con una tapa flexible (proteger de la luz).
- Añadir 200 μL de solución tampón para citometría por pozo.
- Añadir 0,7 μl de semen homogénea en 57 x 106/ml (40.000 células por pocillo) y homogeneizar por pipeteo.
- Cubra la placa con la tapa negra.
- Incubar durante 45 min a 37 ° C, protegido de la luz.
- Ejecutar la muestra por el citómetro de flujo con la ʽInCyte de ajuste '.
- Analizar el histograma resultante por bloquear tres áreas de marcador según la intensidad de fluorescencia, en representación de insignificantes, baja fluorescencia células con acrosoma intacto, sin manchas (R1), baja fluorescencia células con residual manchado parte del acrosoma (R2) y células altamente fluorescentes con acrosoma interrumpida (R3).
Nota: Utilice la sección "analizar archivos adquiridos mediante otros módulos" en la guía del usuario del instrumento para crear las tres regiones (R1, R2, R3).
4. técnica #3: Evaluación de las membranas de espermatozoides mediante sondas fluorescentes y citometría de flujo
Nota: Uso de anexina V combinado con PI fluorocromos permite evaluar apoptosis calcular la proporción de espermatozoides apoptóticos (índice de apoptosis).
- Preparar 1 x annexin tampón de Unión V de 20 x solución (diluido 500 μl de tampón de Unión V 20 x solución con 9,5 mL de agua destilada estéril de anexina).
- Estiman que el conteo de espermatozoides utilizando un hemocitómetro de Neubauer como se describe en la sección 1.7.
- Lavar 106 espermatozoides en 1 mL de 1 x anexina V enlace buffer y centrifugar a 300 x g durante 10 minutos.
- Aspire completamente el sobrenadante.
- Resuspender el sedimento en 100 μl de 1 x annexin tampón de unión de V.
- Añadir 10 μl de anexina V conjugada con FITC.
- Mezclar bien e incubar durante 15 min en oscuridad a temperatura ambiente.
- Lavar espermatozoides mediante la adición de 1 mL de 1 x anexina V enlace tampón por 106 células y centrifugar a 300 x g durante 10 minutos.
- Aspire completamente el sobrenadante.
- Resuspender el precipitado de células en 500 μl de 1 x anexina V enlace tampón por 106 células totales.
- Añadir 1 μg/mL PI inmediatamente antes del análisis con un citómetro de flujo.
- Ejecutar la muestra por el citómetro de flujo en ʽInCyte'.
Resultados
Figura 1 muestra fluorimétrico simultánea evaluación de membranas del esperma (plasma y acrosómica y mitocondrial) usando PI, DAPI y FITC-PSA JC-1. Evaluación de las membranas de espermatozoides utilizando tinción simultánea con cuatro puntas de prueba fluorescentes permite, por ejemplo, evaluar la proporción de espermatozoides en cada categoría: vivo y muerto; alta vs baja ΔΨm; intactos vs. dañado el acrosoma, simultáneamente para cada espermatozoide.
Figura 2 presenta los resultados de esperma evaluación de membrana usando puntas de prueba fluorimétrico. Sólo el semen que contiene por lo menos 80% de espermatozoides móviles se utilizaron en el experimento. Por lo menos 200 células fueron examinadas por Toro. Fue posible evaluar las diferencias en la calidad de la muestra de esperma en cuanto a la integridad de la membrana. Por ejemplo, el eyaculado del Toro Nº 7 tenía un porcentaje relativamente bajo de células muertas, una baja proporción de espermatozoides con pseudo reaccionó acrosoma y mayor potencial, en comparación con el eyaculado del toro no. 1 de membrana mitocondrial.
La figura 3 muestra representativas muestras evaluadas para la actividad mitocondrial (figura 3D–3F) y viabilidad (Figura 3A–3 C). Intensidades de fluorescencia de las muestras fueron evaluadas por un citómetro de flujo de esperma microcapillary dedicado, con software dedicado. Este citómetro de flujo contiene un láser azul de la fase sólida (448 nm) y dos: adelante de dispersión y dispersión lateral. Específicamente mide propiedades de emisión de esperma con tres tubos de fotomultiplicador (verde: 525/30 nm, amarillo: 583/26 nm; rojo: 655/50 nm) y cuenta con filtros y splitters ópticos16. Permite evaluación de 5.000 espermatozoides por análisis.
El kit de evaluación de viabilidad contiene una sonda de permeabilidad diferencial viable (membrana plasmática intacta) y espermatozoides muertos (membrana de plasma dañada) (figura 3). ΔΨm espermática se evaluó mediante un kit que distingue entre polarización de membrana mitocondrial (fluorescencia que aparecen en naranja) y despolarizado de membrana mitocondrial (fluorescencia que aparecen en verde) (figura 3F).
Figura 4 se presenta una evaluación de integridad del acrosoma con el kit listo para su uso, leer con la citometría de flujo (figuras 4A–4 C), dividiendo el histograma resultante de espermatozoides cerradas en tres áreas de marcador, representación insignificantes baja fluorescencia células con acrosoma intacto, sin manchas (R1), baja fluorescencia células con residual manchado parte del acrosoma (R2), y altamente fluorescencia células con acrosoma interrumpida (R3).
Tabla 1 presenta una comparación de las dos técnicas fluorimétrico para la evaluación de las membranas de los espermatozoides. Las mismas muestras de esperma de tres toros diferentes evaluaron viabilidad, potencial de membrana mitocondrial (ΔΨm) y la integridad acrosómica usando tinción cuádruple simultáneas así como la citometría de flujo. Esta comparación es muy importante, ya que muestra los resultados coincidentes con cada una de las dos técnicas. Datos se analizaron mediante un análisis y prueba de t de Student. Se observó ninguna diferencia estadísticamente significativa.
La figura 5 muestra una muestra representativa evaluada apoptosis con anexina V (AV) y fluorocromos (PI) el yoduro de propidio. Uso de estos dos sondas permite distinguir entre cuatro patrones indicando las células viables (AV-, PI-), células apoptóticas tempranas (AV +, PI-), células apoptóticas (AV +, PI +) y células necróticas (AV-, PI +).
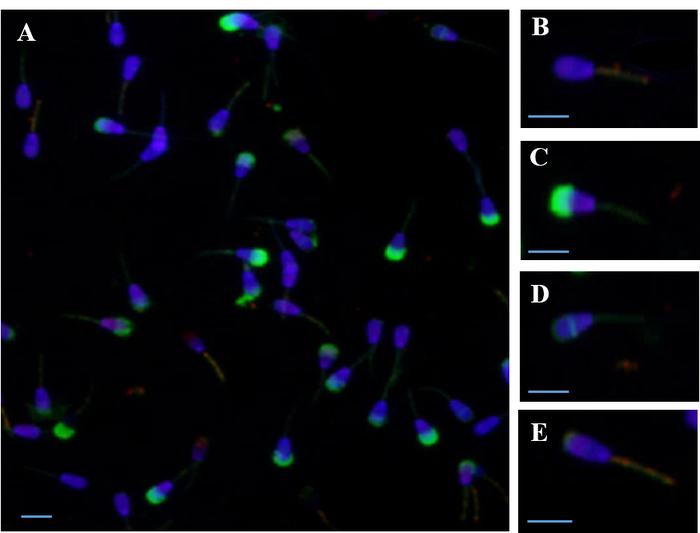
Figura 1: microfotografía de epifluorescencia de espermatozoides teñidos simultáneamente con varias sondas fluorescentes. (A) simultánea coloración con cuatro puntas de prueba PI, DAPI y FITC-PSA JC-1) (B) espermatozoide vivo con DAPI tinción de núcleo y alto potencial de membrana mitocondrial (ΔΨm), con sonda JC-1. Espermatozoide muerto (C) con la membrana de plasma dañada había teñido con sonda de PI, dañado acrosoma teñido con sonda de FITC-PSA y baja ΔΨm. (D) Live, espermatozoide acrosoma reaccionado con tinción Ecuatorial residual y baja ΔΨm. (E) Live, espermatozoide acrosoma reaccionado con coloración superior residual y la alta ΔΨm. Barras de la escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: evaluación de las membranas de espermatozoides de Toro utilizando sondas fluorimétrico. (A) esperma viabilidad se determinó con sondas fluorescentes 4', 6-diamidino-2-phenylindole (DAPI) y yoduro de propidio (PI). Acrosoma (B) estado se determinó según patrones de tinción FITC-PSA. Se presentan la proporción de espermatozoides con acrosoma reaccionado. (C) potencial de membrana mitocondrial (ΔΨm) se evaluó utilizando con JC-1 sonda fluorescente y presentado como el cociente entre proporción media de teñido de rojo (alto potencial) y manchadas de verde esperma (potencial bajo). Datos se presentan como porcentaje de células de células totales evaluadas. Al menos 200 espermatozoides se analizaron por Toro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: actividad mitocondrial (D-F) evaluación de fluorescencia de muestras representativas y viabilidad (A-C) medición por citometría de flujo de EasyCyte. Histogramas representan espermatozoides ungated y espermatozoides de desechos (A, D), cerrada (B, E), distribución de espermatozoides viable (verde) y las células muertos (rojo) (C) y distribución de los espermatozoides (despolarizado y polarizado (amarillo) membrana mitocondrial verde) (F). Barras de la escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 4: evaluación de la fluorescencia de la integridad acrosómica de muestras representativas medido por citometría de flujo de EasyCyte. (A) histograma de espermatozoides ungated y escombros. (B, C) Histogramas de espermatozoides cerradas con la evaluación de la integridad del acrosoma con kit listo para su uso, lea con ajuste adaptado 'InCyte', dividiendo el histograma resultante del terreno espermatozoides en tres áreas de marcador, representación insignificante, bajo fluorescencia células con acrosoma intacto, sin manchas (R1), baja fluorescencia células con residual manchado parte del acrosoma (R2) y de células altamente fluorescentes con interrumpen acrosoma (R3). Barras de la escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.
| Promedio del Nº de células | Vialbility | Potencial de membrana mitocondrial | Integridad del acrosoma | ||||||
| Viable | Muertos | Despolarizado | Polarizadas | Proporción de rojo y verde | Acrosoma intacto | Acrosoma reaccionado | Acrosoma interrumpida | ||
| Tinción de cuádruple | 253 | 32,7 ± 1,53% | 67,3 ± 1,53% | 65,7 ± 2,25% | 34,3 ± 2.52% | 0,5 ± 0.06 | 37,3 ± 7,2% | 38,0 ± 5.7% | 24,3 ± 3.0% |
| Cytomtery de flujo | 5.000 | 32,3 ± 2.08% | 67,7 ± 2.08% | 65,0 ± 1.00% | 35.0 ± 1.00% | 0,5 ± 0,02 | 39,5 ± 5.7% | 39,5 ± 6.5% | 21,0 ± 8.0% |
Tabla 1: comparación de las dos técnicas fluorimétrico para la evaluación de las membranas de los espermatozoides. Las mismas muestras de semen fueron evaluadas para la viabilidad, el potencial de membrana mitocondrial y la integridad acrosómica usando tinción cuádruple simultánea y citometría de flujo. Los datos se presentan como media proporción ± SD de las células examinadas, calculado para 3 repeticiones.

Figura 5: anexina V y PI la fluorescencia de una muestra representativa medido por un citómetro de flujo. Representan histogramas (A) efectos espermatozoides y residuos y (B) distribución de los espermatozoides cerrados a apoptotic temprana (AV +, PI-), apoptosis (AV +, PI +), viable (AV-, PI-) y necrótica (AV-, PI +) las células. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Potencial de fecundación de espermatozoides depende de múltiples factores que refleja su calidad. Una alta concentración de espermatozoides y una alta proporción de espermatozoides móviles altamente progresivamente podrían considerarse semen de alta calidad. Sin embargo, esa evaluación no toma en cuenta otros parámetros celulares y funcionales. El uso de la 'bancada' microcapillary citometría de flujo puede ser fácilmente adaptado a la evaluación de diferentes estructuras de esperma mediante sondas fluorescentes, como demostrado previamente por otros17 y demostrado en el presente (técnica #3). Por ejemplo, integridad del acrosoma de esperma es muy importante para la ocurrencia de la exitosa fertilización natural y por lo tanto, se justifica la evaluación precisa del estado acrosómica. Esa evaluación se puede realizar fácilmente por la clasificación del estado de acrosoma usando los patrones de fluorescente (FITC-PSA, FITC-PNA, es decir, técnica #1, como se describió anteriormente) la coloración1,3. En particular, es muy importante determinar la proporción de espermatozoides con acrosoma intacto (es decir, exhibe un acrosoma sin manchas) en relación a los con acrosoma dañado. Con respecto a los últimos, espermatozoides con acrosoma dañado puede exhibir casquillo acrosómica (i) totalmente manchada, que indica que la membrana está dañada, lo que permite el tinte del que fluyen a través de la membrana de la vesícula acrosómica; (ii) el acrosoma reaccionado espermatozoides que presentan sólo acrosoma residual contenido, indicando que ya se ha producido la AR (es decir, pseudo AR). Cabe señalar que dicha evaluación puede realizarse también con el citómetro de flujo dedicado.
El kit listo para su uso de integridad de viabilidad y acrosoma define tanto viabilidad espermática (viables o muertas) y la integridad acrosómica (intacta o interrumpida). Aquí, le sugerimos utilizar el citómetro de flujo dedicado a definir los tres Estados mencionados acrosómica (es decir, intacto, dañado, reaccionó). Adaptamos la plataforma de citometría de flujo de microcapillary para la evaluación más precisa, que identifica a los espermatozoides con acrosoma reaccionado (es decir, baja fluorescencia) mientras que la exclusión de aquellos con alteración acrosoma (alta fluorescencia), en lugar de incluirlos con los que tienen un acrosoma intacto. Esto da una exacta proporción de espermatozoides con acrosoma funcional o no funcional. Espermatozoides con acrosoma reaccionado así como alteración de la membrana acrosómica han perdido su capacidad de fertilizar el ovocito. Además, análisis podría arrojar luz sobre el mecanismo subyacente alteración del acrosoma, es decir, daña la membrana del acrosoma vs pseudo activación de acrosoma.
En comparación con los resultados obtenidos con la técnica #1 y #2 de técnica y encontró gran compatibilidad entre ellos, en particular en la evaluación de la viabilidad y ΔΨm (tabla 1). Una de las principales ventajas de usar el el citómetro de flujo dedicada es la gran cantidad de los espermatozoides evaluados en relación con el escaso número de espermatozoides que son evaluadas en la práctica por microscopía de fluorescencia y sondas (miles contra cientos, respectivamente ). Además, el último procedimiento es lento y subjetiva, incluso cuando es realizada por un observador experimentado. Como citometría de flujo sólo detecta fluorescencia asociada a la partícula, no hay necesidad de lavar la sonda no unida de la solución, que es un paso lento17. Por otra parte, la evaluación fluorimétrico de las membranas del esperma descrito en la técnica #1 permite la evaluación simultánea de múltiples membranas. Hemos sido capaces de utilizar hasta cuatro sondas fluorescentes junto1,3.
Por último, debe señalarse que el citómetro de flujo dedicado fue desarrollado como un módulo de ensayo abierto, proporcionando todas las herramientas básicas para el análisis de datos y adquisición de la muestra. La función de adquisición permite recoger diversos tipos de información de una muestra de células y por tanto permite adaptación para una evaluación más precisa, como se muestra aquí para el índice de estatus y apoptotic de acrosoma.
En conclusión, los métodos descritos en este documento son muy útiles para la evaluación de la calidad del semen. Examinar las membranas del espermatozoide es muy importante para determinar la capacidad de fertilización del esperma.
Divulgaciones
Los autores declaran que no hay ningún conflicto de intereses.
Agradecimientos
Los autores desean agradecer a compañía israelí "SION" para la inseminación artificial y cría (Hafetz Haim, Israel) por su ayuda y cooperación y la Sra. Li Na (IMV Technologies, L'Aigle, Francia) para obtener ayuda con la configuración del instrumento y entrenamiento.
Materiales
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| MOPS [3-N-morphilino propanesulfonic acid] | Sigma | M1254 | |
| PBS | Sigma | P5493 | |
| DMSO | Sigma | D2438 | |
| Ethanol absolute | Sigma | 64-17-5 | |
| Hemacytometer | Neubauer Germany | hemocytometer | |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma | D9542 | fluorescent probe |
| PI (propidium iodide ) | Sigma | P4170 | fluorescent probe |
| FITC-PSA (fluorescein isothiocyanate-conjugated Pisum sativum agglutinin ) | Sigma | L0770 | fluorescent probe |
| JC-1 (5,5',6,6'-tetra-chloro-1,1',3,3'-tetraethylbenzimidazolyl carbocyanine iodide) | ENZOBiochem, New York, NY, USA | ENZ52304 | fluorescent probe |
| Annexin V conjugated to FITC | MACS, Miltenyi Biotec | 130-093-060 | fluorescent probe |
| Annexin V binding buffer 20x stock solution | MACS, Miltenyi Biotec | 130-092-820 | buffer |
| Nikon Eclipse, TE-2000-u | Nikon, Tokyo, Japan | inverted fluorescence microscope | |
| Nis Elements | Nikon, Tokyo, Japan | software | |
| Nikon DXM1200F | Nikon, Tokyo, Japan | digital camera | |
| Guava EasyCyte Plus | IMV Technologies, L'Aigle, France | microcapillary sperm flow cytometer | |
| CytoSoft | Guava Technologies Inc., Hayward, CA, USA; distributed by IMV Technologies | software | |
| Buffered solution for cytometry | IMV Technologies, L'Aigle, France | 023862 | buffer |
| Viability and concentration kit | IMV Technologies, L'Aigle, France | 024708 | kit for viability assessment |
| Mitochondrial activity kit | IMV Technologies, L'Aigle, France | 024864 | kit for mitochondrial activity assessment |
| Viability & acrosome integrity kit | IMV Technologies, L'Aigle, France | 025293 | kit for acrosome integrity assessment |
| JMP-13 | SAS Institute Inc., 2004, ary, NC, USA | software | |
| Bovine sperm | "SION", Israeli company for artificial insemination and dreeding, Hafetz-Haim, Israel |
Referencias
- Komsky-Elbaz, A., Roth, Z. Effect of the herbicide atrazine and its metabolite DACT on bovine sperm quality. Reprod Toxicol. 67, 15-25 (2016).
- Gürler, H., et al. Effects of cryopreservation on sperm viability, synthesis of reactive oxygen species, and DNA damage of bovine sperm. Theriogenology. 86 (2), 562-571 (2016).
- Komsky-Elbaz, A., Saktsier, M., Roth, Z. Aflatoxin B1 impairs sperm quality and fertilization competence. Toxicology. 393, 42-50 (2018).
- Beltrán, C., et al. Role of Ion Channels in the Sperm Acrosome Reaction. Adv Anat Embryol Cell Biol. 220, 35-69 (2016).
- Breitbart, H. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol (Noisy-le-grand). 49 (3), 321-327 (2003).
- Almadaly, E., et al. Methodological factors affecting the results of staining frozen-thawed fertile and subfertile Japanese Black bull spermatozoa for acrosomal status. Anim Reprod Sci. 136 (1-2), 23-32 (2012).
- Jankovicová, J., Simon, M., Antalíková, J., Horovská, L. Acrosomal and viability status of bovine spermatozoa evaluated by two staining methods. Vet Hung. 56 (1), 133-138 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histol Histopathol. 24 (8), 999-1007 (2009).
- Whitfield, C. H., Parkinson, T. J. Relationship between fertility of bovine semen and in vitro induction of acrosome reactions by heparin. Theriogenology. 38 (1), 11-20 (1992).
- Celeghini, E. C. C., de Arruda, R. P., de Andrade, A. F. C., Nascimento, J., Raphael, C. F. Practical Techniques for Bovine Sperm Simultaneous Fluorimetric Assessment of Plasma, Acrosomal and Mitochondrial Membranes. Reprod Domest Anim. 42 (5), 479-488 (2007).
- Ramalho-Santos, J., Varum, S., Amaral, S., Mota, P. C., Sousa, A. P., Amaral, A. Mitochondrial functionality in reproduction: from gonads and gametes to embryos and embryonic stem cells. Hum Reprod. 15 (5), 553-572 (2009).
- Eddy, E. M., O’Brien, A. The spermatozoon. , Raven Press. New York, USA. Knobil and Neill's Physiology of Reproduction; Volume 1 (1994).
- Gallon, F., Marchetti, C., Jouy, N., Marchetti, P. The functionality of mitochondria differentiates human spermatozoa with high and low fertilizing capability. Fertil Steril. 86 (5), 1526-1530 (2006).
- Espinoza, J. a, Paasch, U., Villegas, J. V. Mitochondrial membrane potential disruption pattern in human sperm. Hum Reprod. 24 (9), 2079-2085 (2009).
- Hüttemann, M., Lee, I., Pecinova, A., Pecina, P., Przyklenk, K., Doan, J. W. Regulation of oxidative phosphorylation, the mitochondrial membrane potential, and their role in human disease. J Bioenerg Biomembr. 40 (5), 445-456 (2008).
- Sellem, E., et al. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology. 84 (9), 1447-1454 (2015).
- Odhiambo, J. F., Sutovsky, M., DeJarnette, J. M., Marshall, C., Sutovsky, P. Adaptation of ubiquitin-PNA based sperm quality assay for semen evaluation by a conventional flow cytometer and a dedicated platform for flow cytometric semen analysis. Theriogenology. 76 (6), 1168-1176 (2011).
- Barrier Battut, I., Kempfer, A., Becker, J., Lebailly, L., Camugli, S., Chevrier, L. Development of a new fertility prediction model for stallion semen, including flow cytometry. Theriogenology. 86 (4), 1111-1131 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados