Method Article
精子膜评价的荧光技术
摘要
在这里, 我们提出的方法来评估精子细胞膜的完整性, 一个细胞特征与精子受精能力。我们描述了精子膜荧光测量评估的三种技术: 与特定荧光探针同时染色, 荧光显微镜, 和先进的精子专用流式细胞仪。还介绍了合并这些方法的实例。
摘要
描述精子质量的标准精子图主要基于生理和视觉参数, 如射精体积和浓度、运动和渐进运动、精子形态和活力。然而, 这些评估都不足以预测精液质量。鉴于维持精子的活力和受精潜力取决于细胞膜的完整性和细胞内的功能, 对这些参数的评估可能有助于更好地预测精子受精能力。在这里, 我们描述了三种可行的方法来评估精子质量使用特定的荧光探针结合荧光显微镜或流式细胞仪分析。使用 4 ', 6-二胺-2-苯丙二醇 (dapi) 和碘化物 (pi) 和顺丁烯 (pi) 评估了评估的质膜完整性, 使用荧光素异硫氰酸酯结合化皮素凝集素 (fitc-sa) 和线粒体膜完整性使用 5, 5 ', 6, 6 '-四氯-1, 1 ', 3, 3 '-四乙基苯并咪唑基卡宾氰酸酯 (jc-1)。还介绍了这些方法的组合。例如, 使用环素 v 与 pi 荧光结合, 可以评估细胞凋亡和计算凋亡精子的比例 (凋亡指数)。我们认为, 这些方法, 这是基于检查精子膜, 是非常有用的精子质量的评估。
引言
精子膜的完整性和功能是表明精子活力和受精潜力的几个因素。质膜作为细胞内和细胞外隔间之间的屏障, 从而保持细胞渗透平衡1。任何导致对质膜完整性的损害的压力都可能损害体内平衡, 降低生存能力和受精能力, 并增加细胞死亡。例如, 冷冻保存降低精子的生存能力, 由于其质膜的损害, 由于温度变化和渗透应力2。我们以前报告说, 将公牛精子暴露在低浓度的食源性污染物中, 如农药阿特拉津、其主要代谢物二胺氯水嗪或霉菌毒素黄曲霉毒素 b1, 降低精子的生存能力1,3.这是通过用 dapi 与 pi 组合标记双链 dna 来确定的, pi 与受损质膜的细胞 dna 结合在一起。
伴随反应 (ar) 包括外顶膜和覆盖质膜的融合, 导致顶体酶4,5的释放。这些都是重要的事件, 为氧化锆渗透和进一步合并的精子与卵母细胞6。因此, 对顶体膜完整性的评价是评价精液质量和男性生育力的一个有用参数, 7,8,9。几种荧光技术适用于对丙烯酸的完整性验证, fitc-pna 或 fitc-psc8,10。在我们以前的研究中, 利用 fitc-sa 染色1,3 的模式, 我们提供了准确的定义, (i) 完整的顶体, (ii) 受损的尖锐湿疣膜和 (iii) 反应的顶体。在本报告中, 我们使用精子专用流式细胞仪评估顶体状态, 并将结果与荧光显微镜的结果进行比较。
线粒体是参与 atp 合成、活性氧生产、钙信号转导和凋亡等方面的多功能细胞器。生理功能障碍, 包括男性和女性不育, 与线粒体功能改变11。精子线粒体排列在中段, 在精子活力12中发挥着至关重要的作用。人们普遍认为, 高线粒体膜电位 (m) 与正常运动和高施肥能力有关。相反, 低 m 与活性氧物种水平升高和受精率降低14有关.尽管如此, 各种环境化合物, 例如内分泌干扰物, 可以诱导细胞压力, 并导致短暂增加的 m, 超极化1,3, 自由基的生产增加, 并最终,细胞凋亡15。荧光探针 5, 5 ', 6, 6 '-四氯-1, 1 ', 3, 3 '-四乙基苯并咪唑基碘化物 (jc-1), 使检查例如, 食源性毒素对精子的影响 m1,3。
标准的精原图, 基于生理和形态学参数, 是不够好预测精液质量。需要更准确的方法来确保精子质量。在这里, 我们提供了两种可行的方法来确定精子质量的基础上, 精子膜的评估: 同时四染色与特定的荧光探针和荧光显微镜, 在我们的研究1,3中描述和先进的精子专用流式细胞仪, 最近在我们的实验室使用, 并已被其他人使用 16,17,18。
研究方案
所有实验都是根据1994年以色列动物福利准则进行的。牛精子由以色列商业公司提供, 用于人工授精和繁殖。本研究对11只公牛的射精进行了评估。
1. 精子样品制备
请注意:该程序是基于罗斯实验室的协议1,3。
- 在室温下, 在15毫升管中获得大约1-6 毫升的公牛精液。
- 在每1毫升精液中, 加入6毫升预热 (在37°c 时) 的 nkm 缓冲液 (110 mm 氯化钠, 5 mL kcl, 20 mm mL [3-n-吗啡丙磺酸; ph 7.4]) 和离心机 8分钟, 在 600 x克,1-2 倍, 直到上清液被清除。
请注意:如果精子浓度或初始体积非常高, 在第一次清洗时分成两管。 - 立即取出并丢弃清除的上清液, 并将约1厘米的上清液留在颗粒上方。
- 在30°角仔细倾斜管, 以增加精子向上游动的表面积, 等待 20-30分钟, 让精子在37°c 下向上游动。
请注意:可以看到浊度。 - 小心使用微移液器, 将含有运动精子的上清液的上1毫升取出到新的 1.5 ml 管中。
- 将精子保持在 37°c, 直到使用。
- 使用 neubauer 血细胞仪估计精子数量。
请注意:可以使用不同的计数室, 但计数是不同的。- 为了防止精子运动, 用10毫升的双蒸馏水 (ddw) (1: 100 稀释) 将运动精子的100μl 稀释在15毫升的管中, 轻轻搅拌。
- 将10μl 的样品装入血细胞计和盖板的每一侧。确保避免在腔内形成气泡, 因为这可能会导致精子计数不准确。
- 观察在具有20x 目标的复合显微镜下。
请注意:血细胞计上的完整栅格包含9个大方块, 每个1毫米2, 覆盖玻璃位于房间地板上方0.1 毫米处。因此, 中央计数区域的体积为 0.1 mm3或0.1μl。血细胞仪的中心区域包含25个中等方块, 每个中等正方形有16个较小的正方形和单线。 - 计算在4个中等角方块和中心方块中发现的单元格总数。为了获得更高的精度, 计算两个腔 (neubauer 血细胞计两侧), 并使用平均值计算细胞浓度。
- 通过将获得的平均数量乘以 5 (以获得每个计数区域的细胞数量) 和 10, 000 (以获得稀释样品的每1毫升的细胞数量) 来计算精子数量。然后将得到的计数乘以稀释系数 (1:100)。
请注意:例如, 在两个房间的中央计数区域内的25个中等方块中, 平均有5个精子被计算为 150个 ([152 + 148]/2)。因此, 每个腔的平均精子数 (或每 0.1μl) 为 150 x 5 = 750。将750乘以 10, 000, 以获得稀释样品 (7, 500, 000) 每1毫升的细胞数, 然后乘以 100 (稀释系数), 以获得每个 ml 的原始精液样品的 75 x 10 7个细胞.
2. 技术 #1: 利用多荧光探针同时评估精子膜
请注意:精子膜 (血浆、顶体和线粒体) 如 celeghini 等人10人先前描述的那样进行了评估, 并作了一些修改。使用 epi荧光显微镜, 结合数码相机, 激发在 450-490 nm, 发射在515-565 纳米, 使用三重过滤器。
-
准备库存解决方案。
- 在50毫升磷酸盐缓冲盐水 (pbs) 中溶解5毫克的 dapi, 制备 0.1 mgmml dapi 库存溶液。准备50μl 的等价物, 并储存在-20°c。使用前, 用 pbs 在 1:10 (工作溶液; 10μg/ml) 稀释库存溶液。
- 通过在1毫升的 pbs 中溶解1毫克的 fitc–psa, 准备 1 mgml fitc– psa 库存解决方案。准备50μl 的等价物, 并储存在-20°c。使用前, 用 pbs 在 1:10 (工作溶液; 100μg/ml) 稀释库存溶液。
- 通过将1毫克的 jc-1 jc-1 溶解在1毫升的二甲基亚硫醚 (dmso) 中制备 1 mgmml jc-1 库存溶液。准备10μl 的等价物, 并储存在-20°c。使用前, 用 dmso 在 1:10 (工作溶液; 0.1 mg/ml) 稀释库存溶液。
- 在400μl 的 pbs 中溶解10毫克的 pi (给予 2.5 mgml), 准备 pi 库存溶液。存放在 + 4°c。在 1:20 (工作溶液; 0.125 mg/ml) 用 pbs 稀释库存1。存放在 + 4°c 作为库存解决方案。
注意: pi 是一种潜在的诱变剂, 应小心处理。染料必须按照适用的当地法规安全处置。
- 将运动精子的 133μl (步骤 1.5) 转移到新的 1.5 ml 管 (25 x10 6 精子)。
请注意:如果样品浓度较高, 则在 nkm 缓冲液中稀释, 以达到所需的浓度;如果游泳样品的样品浓度较低, 离心所获得的上清液在 1, 000 x g后 5分钟, 取出 0.5 ml 的上清液, 然后再次计数精子。 - 加入17μl 的 dapi (工作溶液), 在37°c 下孵育10分钟。
- 以 1, 000 x克离心 5分钟, 并丢弃上清液。
- 在颗粒中加入100μl 的 nkm 缓冲液。
- 加入 50μl fitc–psa、2μl 的 jc-1 和 3μl pi (工作解决方案), 在37°c 下孵育10分钟。
- 以 1, 000 x克离心 5分钟, 并去除上清液。
- 在颗粒中加入40μl 的 nkm 缓冲液, 然后通过移液重新悬浮。
- 将样品的10μl 转移到玻璃滑梯、涂片和覆盖片上。
-
通过荧光显微镜 (使用40x 目标) 立即显示, 带有三重滤光片, 配备数码相机, 并为每个滤镜分别拍摄图像。
请注意:可视化滤波器的顺序没有意义。- 在 dapi 通道下可视化, 激发在 358 nm, 发射在 461 nm。
- 在 fitc 通道下可视化激发在 450–490 nm、排放在 515–565 nm 的绿色单体。
- 在 pi 通道下可视化红色集料, 激发在 488 nm, 发射在 590 nm。
- 在 jc-1 红色聚集体下可视化, 激发在 559 nm, 排放在 574-627 nm 之间;jc-1 绿色单体, 激发功率为 488 nm, 排放量在 500–535 nm 左右。
- 使用相机软件的 "合并" 选项, 以 jpg/jpeg 格式合并从过滤器接收的三个图像。
- 使用 "画图" 工具打开合并后的图像, 并使用画笔选项标记计数的精子。
-
根据每个探针发出的荧光对精子进行分类:
- 一般情况下, 每张幻灯片至少评估200个精子-所有细胞显示为蓝色 (dapi)。
- 通过计数显示为紫色的死细胞 (pi [红色] + dapi [蓝色]) 来评估生存能力, 并计算死细胞的百分比 (死细胞/总计数细胞 x100)。
- 使用荧光染色模式 (fitit–psa) 评估顶体状态。计算不同模式的百分比 (完整的, 损坏的或反应的顶体细胞/总计数细胞 x 100)。
请注意:受损的顶体膜呈完全染色的绿色顶盖;反应顶体膜显示残余绿色赤道或上染色;含有完整的顶体膜的细胞不会显示出任何绿色染色的顶体区域。 - 评价 m 通过区分精子与高 m, 陈列红色染色的中间件, 和精子与低 m 陈列绿色染色的中间件。分别计算红色和绿色的碎片, 并计算它们的比例 (红/绿色)。
3. 技术 #2: 用现成的套件和流式细胞仪对精子膜进行评估
请注意:利用每口井中含有冻干荧光的现成流式细胞仪对细胞膜完整性、线粒体膜电位和顶体膜完整性进行评估。该程序是根据制造商进行的, 并进行了一些修改。
-
等离子膜完整性评估
- 从可行性和浓度套件 (pi 和 sybr14) 包中取出所需数量的井, 将其转移到工作基地, 并盖上灵活的盖子 (防止光线照射)。
- 加入199μl 缓冲溶液, 每口都要进行细胞术。
- 在 57 x 10 6/毫升 (每口 57, 000细胞) 处加入1μl 的均匀精液, 并通过移液进行均质化。
- 用黑色盖子盖上盘子。
- 在37°c 下培养 10分钟, 不受光线影响。
- 运行样品通过流式细胞仪设置为 "活力"。
-
线粒体膜电位
- 从线粒体活性试剂盒 (jc-1) 包中取出所需数量的井, 将其转移到工作基地, 并盖上灵活的盖子 (防止光线照射)。
- 在每口井中加入10μl 的绝对乙醇和移液器, 以重新悬浮井内的粉末。
- 每口加入190μl 的 pbs, 并通过移液进行均质化。
- 在 57 x 10 6/ml(每口 50, 000 细胞) 处加入0.75μl 的均匀精液, 并通过移液进行均质化。
- 用黑色盖子盖上盘子。
- 在37°c 下培养 30分钟, 不受光线影响。
- 运行样品通过流式细胞仪的设置ʽmitochondrial 活动 '。
-
亚体膜完整性
请注意:fitc–sa 染色 (见技术 #1) 可评估3个顶位类别 (完整的顶体, 反应尖锐碱和损坏的尖锐发体)。使用流式细胞仪和活力和顶体完整性试剂盒 (pi 和 fitc–pna), 精子分为这3个类别。- 从可生存能力和顶体完整性套件的包中获取所需数量的井, 将其转移到工作基地, 并盖上灵活的盖子 (防止光线照射)。
- 添加200μl 缓冲溶液, 用于每口井的细胞术。
- 在 57 x 10 6/ml(每口 40, 000 细胞) 处加入0.7μl 均匀精液, 并通过移液进行均质化。
- 用黑色盖子盖上盘子。
- 在37°c 下培养 45分钟, 不受光线影响。
- 运行样品通过流式细胞仪与设置ʽInCyte '。
- 分析由此产生的直方图 , 根据荧光强度对三个标记区域进行门控 , 代表可忽略不计的低荧光细胞 , 具有完整的、未染色的 ( r1 ) 、低荧光细胞 , 其残余染色部分的顶部 ( r2 ) 和高度荧光细胞, 具有破坏的顶体 (r3)。
请注意:使用仪器用户指南中的 "分析使用其他模块获取的文件" 部分, 以创建三个区域 (r1、r2、r3)。
4. 技术 #3: 荧光探针和流式细胞仪对精子膜进行评估
请注意:使用环氧素 v 与 pi 荧光结合, 可以评估细胞凋亡和计算凋亡精子的比例 (凋亡指数)。
- 从20x 库存溶液中制备1x 亚非素 v 结合缓冲液 (用 9.5 ml 无菌蒸馏水稀释500μl 的环素 v 结合缓冲液20x 库存溶液)。
- 使用第1.7 节所述的 neubauer 血细胞仪估计精子数量。
- 在1x 亚诺辛 v 结合缓冲液的1毫升中清洗 10个6个精子, 并在 300 x克清洗离心机 10分钟.
- 完全吸收上清液。
- 在1x 亚非素 v 结合缓冲液100μl 中重新使用颗粒。
- 加入10μl 的附件 v 共轭到 fitc。
- 在室温下, 在黑暗中混合15分钟。
- 每 10个6个细胞加入1毫升的1x 亚非素 v 结合缓冲液, 并在 300 x克的情况下加入离心机 10分钟, 清洗精子。
- 完全吸收上清液。
- 在每 10个6个总细胞中, 在500μl 的1x 亚非素 v 结合缓冲液中重新移植细胞颗粒。
- 在分析前立即使用流式细胞仪加入 1μgl pi。
- 通过ʽInCyte "上设置的流式细胞仪运行样品。
结果
图 1显示了使用 pi、dapi、fitc-psa 和 jc-1 同时对精子膜 (血浆、顶体和线粒体) 进行荧光评估的情况。使用四个荧光探针同时染色来评估精子膜, 例如, 可以评估精子在每一类中的比例--活的与死的;高与低 m;完好无损vs受损的精子--同时为每个精子。
图 2显示了使用荧光探针进行精子膜评估的结果。实验中只使用了含有至少80% 运动精子的精液。每头公牛至少检查了200个细胞。有可能从膜完整性的角度来评估精子样本质量的差异。例如, 与1号公牛射精相比, 7号公牛的射精率相对较低, 具有伪反应的精子中的比例较低, 线粒体膜电位较高。
图 3显示了评估的代表性样本 (图 3a-3c) 和线粒体活性 (图33-3f)。用专用的微细管精子流式细胞仪和专用软件对样品的荧光强度进行了评估。这种流式细胞仪包含一个固相蓝色激光器 (448 nm) 和两个光电二极管: 正向散射和侧向散射。它专门测量三个光电倍增管 (绿色: 2525 纳米, 黄色: 58"/26 纳米; 红色: 655/50 纳米) 的精子发射特性, 并可容纳光学滤光片和分片 16.它可以评估 5, 000个精子每次分析。
可行性评估试剂盒包含一个探针与活 (完整的质膜) 和死 (受损质膜) 精子有不同的渗透率 (图 3c)。精子的评估使用试剂盒区分了偏振线粒体膜 (荧光出现在橙色) 和去极化线粒体膜 (荧光出现在绿色) (图 3f)。
图 4显示了对使用即用试剂盒执行的顶体完整性的评估, 用流式细胞术 (图 4a-4c) 阅读, 将门控精子的直方图划分为三个标记区域,代表可忽略不计的低荧光细胞与完整的, 未染色的顶体 (r1), 低荧光细胞与残余染色部分的顶体 (r2), 和高度荧光细胞与中断的顶体 (r3)。
表 1比较了两种用于评估精子膜的荧光技术。使用同时四片染色和流式细胞术, 对三种公牛的相同精子样本进行了活力、线粒体膜电位和顶体完整性的评估。这种比较非常重要, 因为它使用这两种技术中的每一种都显示了匹配的结果。通过分析和学生的 t 测试对数据进行分析。未观察到统计学上的显著性差异。
图 5显示了使用环素 v (av) 和碘化物 (pi) 荧光色素评估细胞凋亡的代表性样本。使用这两个探针可以区分四种模式, 表明可行的细胞 (av-, pi)、早期凋亡细胞 (av +, pi)、凋亡细胞 (av +, pi +) 和坏死细胞 (av-, pi +)。
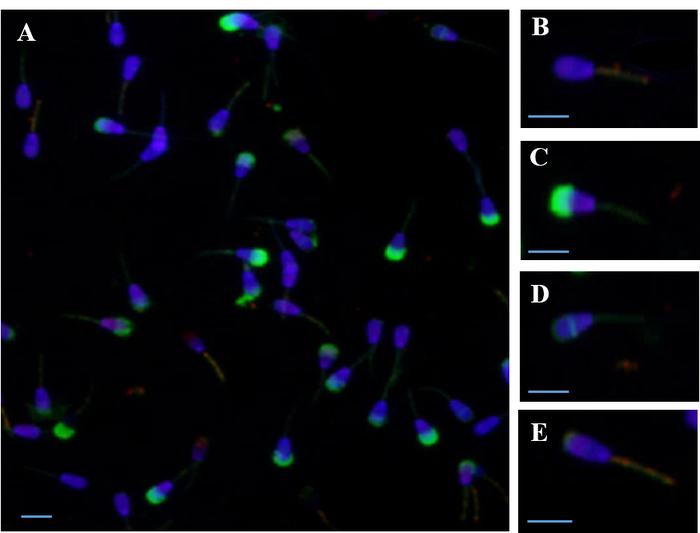
图 1: 与几个荧光探针同时染色的精子的荧光显微摄影.(a) 用四个探针 pi、dapi、fitc-psa 和 jc-1 同时染色) (b) 用 dapi 染色细胞核和高线粒体膜电位 (m), 用 jc-1 探针染色。(c) 用 pi 探针染色的质膜受损、用 fitc-psa 探针染色的角膜受损、米低。(d) 活的, 阵体反应精子, 残留赤道染色和低 m。(e) 活体, 交肌反应精子, 残留的上染色和高 m。刻度条 = 10μm. 请点击这里查看此图的较大版本.

图 2: 使用荧光探针评估公牛精子膜.(a) 用荧光探针 4 '、6-二胺-2-苯并酮 (dapi) 和碘化物 (pi) 测定精子的活力。(b) 根据 fitc-sa 染色模式确定了丙烯酸状态。提交的是精子与反应体的比例。(c) 用 jc-1 荧光探针对线粒体膜电位进行了评价, 并将其作为红染色 (高电位) 精子平均比例与绿染 (低电位) 精子的比例。数据显示为总评估细胞中的百分比。每头公牛至少分析了200只精子。请点击这里查看此图的较大版本.

图 3: 由 easycyte 流式细胞仪测量的代表性样品的活力 (a-c) 和线粒体活性 (d-f) 荧光评估.直方图代表未门精子和碎片 (a, d)、门控精子 (b, e)、精子分布到可行的 (绿色) 和死亡 (红色) 细胞 (c), 以及精子分布到极化 (黄色) 和去极化 (黄色) 和去极化 (黄色)绿色) 线粒体膜 (f)。刻度条 = 10μm. 请点击这里查看此图的较大版本.

图 4: 由 easycyte 流式细胞仪测量的代表性样品的顶体完整性的荧光评估.(a) 未打开的精子和碎片的直方图。(B、 C)门控精子的直方图, 用现成的试剂盒进行顶体完整性评估, 使用适应设置 "incyte" 阅读, 将门控精子的直方图划分为三个标记区域, 代表可以忽略不计,低荧光细胞, 具有完整的、未染色的顶体 (r1), 低荧光细胞, 具有残余染色部分的顶体 (r2) 和高度荧光细胞与破坏的顶体 (r3)。刻度条 = 10μm. 请点击这里查看此图的较大版本.
| 细胞平均数目 | 活力 | 线粒体膜电位 | 诚信为本 | ||||||
| 可行 | 死 | 去极化 | 极化 | 红绿比 | 完整的 Acrosome | 反应性的反应 | 损坏的重音 | ||
| 四体染色 | 253 | 32.7±1.53% | 677±1.53% | 657±2.25% | 34.4±2.52% | 0.5±0.06 | 37.3±7.2% | 38.0±5.7% | 24.3±00% |
| 流式细胞术 | 5, 000 | 32.3±2.08% | 677±2.08% | 65±1.00% | 35.0±1.00% | 0.5±0.02 | 39.5±5.7% | 39.5±6.5% | 27.0±8.0% |
表 1: 两种用于精子膜评估的荧光技术的比较.使用同时四片染色和流式细胞术对相同的精子样本进行了活力、线粒体膜电位和顶体完整性的评估。数据以被检测单元的平均比例±sd 表示, 计算为3个复制项。

图 5: 由流式细胞仪测量的代表性样品的附件素 v 和 pi 荧光.直方图代表 (a) 未门化精子和碎片, (b) 门控精子向早期凋亡 (av +, pi-)、凋亡 (av +, pi +)、可行 (av-i-) 和坏死 (av-, pi +) 细胞。请点击这里查看此图的较大版本.
讨论
精子受精的可能性取决于反映其质量的多种因素。高浓度的精子和高比例的高度运动精子可能被认为是高质量的精液。然而, 这种评价没有考虑到其他细胞和功能参数。使用 "台式" 微毛细管流细胞仪可以很容易地适应评估各种精子结构使用荧光探针, 如前面的其他17和演示 (技术 #3)。例如, 精子顶体完整性对于成功的自然受精的发生是非常重要的, 因此, 准确的评估顶体状态是必要的。这种评估可以很容易地通过使用荧光染色模式 (fitc-psa, fitc-pna, 即技术 #1, 如前面所述)1, 3,对顶体状态进行分类来进行。特别是, 确定精子与完整的顶体 (即, 表现出未染色的顶体) 相对于那些受损的顶体的比例是非常重要的。关于后者, 精子与损坏的顶体可以表现出 (i) 一个完全染色的顶体帽, 这表明膜受损, 使染料通过膜流入顶囊;(ii) 仅表现出残留顶体含量的共生体反应精子, 表明 ar 已经发生 (即伪 ar)。需要注意的是, 这种评估也可以用专门的流式细胞仪进行。
现成的可用的生存能力 & amp; 顶体完整性套件定义了精子的活力 (生存能力或死亡) 和顶体完整性 (完整或中断)。在这里, 我们建议使用专用的流式细胞仪来定义上述三个顶体状态 (即完整, 损坏, 反应)。我们调整了微毛细管流细胞仪平台进行更准确的评估, 确定顶部反应精子 (即低荧光), 同时将其排除在有松弛 (高荧光) 的精子之外, 而不是将其包括在内和那些有完整的顶体的人在一起这给出了一个准确比例的精子与功能或非功能性顶体。有反应性腺膜和被破坏的顶体膜的精子已经失去了使卵母细胞受精的能力。此外, 准确的分析可能会揭示顶体改变的机制, 即受损的顶膜与假顶层激活。
我们将所得结果与技术 #1 和技术 #2 进行了比较, 发现它们之间有很大的兼容性, 特别是在可行性和 m 的评价方面 (表 1)。使用专用流式细胞仪的主要优点之一是, 相对于荧光显微镜和探针在实践中评估的少量精子, 有大量的被评估精子 (分别为数千次对数百种)).此外, 后一种程序既耗时又主观, 即使由有经验的观察者进行。由于流式细胞术只检测颗粒相关的荧光, 因此无需将未绑定的探针从溶液中清洗, 这是一个耗时的步骤17。另一方面, 技术 #1 中描述的精子膜的荧光评估可以同时评估多个膜。我们能够使用多达四个荧光探针在一起1,3。
最后, 应当指出的是, 专用流式细胞仪是作为一个开放的检测模块开发的, 为样品采集和数据分析提供了所有基本工具。采集功能可以从细胞样本中收集各种类型的信息, 因此可以进行更准确的评估, 如此处所示, 用于顶体状态和凋亡指数。
总之, 本文所描述的方法对精液质量的评价是非常有用的。精子膜的检查对确定精子受精能力具有重要意义。
披露声明
提交人声明不存在利益冲突。
致谢
作者感谢 "sion" 以色列公司的人工授精和育种 (以色列 Hafetz-Haim) 的帮助与合作, 并感谢 li na 女士 (imv technologies, l ' aigle, 法国) 在仪器设置和培训方面提供的协助。
材料
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| MOPS [3-N-morphilino propanesulfonic acid] | Sigma | M1254 | |
| PBS | Sigma | P5493 | |
| DMSO | Sigma | D2438 | |
| Ethanol absolute | Sigma | 64-17-5 | |
| Hemacytometer | Neubauer Germany | hemocytometer | |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma | D9542 | fluorescent probe |
| PI (propidium iodide ) | Sigma | P4170 | fluorescent probe |
| FITC-PSA (fluorescein isothiocyanate-conjugated Pisum sativum agglutinin ) | Sigma | L0770 | fluorescent probe |
| JC-1 (5,5',6,6'-tetra-chloro-1,1',3,3'-tetraethylbenzimidazolyl carbocyanine iodide) | ENZOBiochem, New York, NY, USA | ENZ52304 | fluorescent probe |
| Annexin V conjugated to FITC | MACS, Miltenyi Biotec | 130-093-060 | fluorescent probe |
| Annexin V binding buffer 20x stock solution | MACS, Miltenyi Biotec | 130-092-820 | buffer |
| Nikon Eclipse, TE-2000-u | Nikon, Tokyo, Japan | inverted fluorescence microscope | |
| Nis Elements | Nikon, Tokyo, Japan | software | |
| Nikon DXM1200F | Nikon, Tokyo, Japan | digital camera | |
| Guava EasyCyte Plus | IMV Technologies, L'Aigle, France | microcapillary sperm flow cytometer | |
| CytoSoft | Guava Technologies Inc., Hayward, CA, USA; distributed by IMV Technologies | software | |
| Buffered solution for cytometry | IMV Technologies, L'Aigle, France | 023862 | buffer |
| Viability and concentration kit | IMV Technologies, L'Aigle, France | 024708 | kit for viability assessment |
| Mitochondrial activity kit | IMV Technologies, L'Aigle, France | 024864 | kit for mitochondrial activity assessment |
| Viability & acrosome integrity kit | IMV Technologies, L'Aigle, France | 025293 | kit for acrosome integrity assessment |
| JMP-13 | SAS Institute Inc., 2004, ary, NC, USA | software | |
| Bovine sperm | "SION", Israeli company for artificial insemination and dreeding, Hafetz-Haim, Israel |
参考文献
- Komsky-Elbaz, A., Roth, Z. Effect of the herbicide atrazine and its metabolite DACT on bovine sperm quality. Reprod Toxicol. 67, 15-25 (2016).
- Gürler, H., et al. Effects of cryopreservation on sperm viability, synthesis of reactive oxygen species, and DNA damage of bovine sperm. Theriogenology. 86 (2), 562-571 (2016).
- Komsky-Elbaz, A., Saktsier, M., Roth, Z. Aflatoxin B1 impairs sperm quality and fertilization competence. Toxicology. 393, 42-50 (2018).
- Beltrán, C., et al. Role of Ion Channels in the Sperm Acrosome Reaction. Adv Anat Embryol Cell Biol. 220, 35-69 (2016).
- Breitbart, H. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol (Noisy-le-grand). 49 (3), 321-327 (2003).
- Almadaly, E., et al. Methodological factors affecting the results of staining frozen-thawed fertile and subfertile Japanese Black bull spermatozoa for acrosomal status. Anim Reprod Sci. 136 (1-2), 23-32 (2012).
- Jankovicová, J., Simon, M., Antalíková, J., Horovská, L. Acrosomal and viability status of bovine spermatozoa evaluated by two staining methods. Vet Hung. 56 (1), 133-138 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histol Histopathol. 24 (8), 999-1007 (2009).
- Whitfield, C. H., Parkinson, T. J. Relationship between fertility of bovine semen and in vitro induction of acrosome reactions by heparin. Theriogenology. 38 (1), 11-20 (1992).
- Celeghini, E. C. C., de Arruda, R. P., de Andrade, A. F. C., Nascimento, J., Raphael, C. F. Practical Techniques for Bovine Sperm Simultaneous Fluorimetric Assessment of Plasma, Acrosomal and Mitochondrial Membranes. Reprod Domest Anim. 42 (5), 479-488 (2007).
- Ramalho-Santos, J., Varum, S., Amaral, S., Mota, P. C., Sousa, A. P., Amaral, A. Mitochondrial functionality in reproduction: from gonads and gametes to embryos and embryonic stem cells. Hum Reprod. 15 (5), 553-572 (2009).
- Eddy, E. M., O’Brien, A. . The spermatozoon. , (1994).
- Gallon, F., Marchetti, C., Jouy, N., Marchetti, P. The functionality of mitochondria differentiates human spermatozoa with high and low fertilizing capability. Fertil Steril. 86 (5), 1526-1530 (2006).
- Espinoza, J. a., Paasch, U., Villegas, J. V. Mitochondrial membrane potential disruption pattern in human sperm. Hum Reprod. 24 (9), 2079-2085 (2009).
- Hüttemann, M., Lee, I., Pecinova, A., Pecina, P., Przyklenk, K., Doan, J. W. Regulation of oxidative phosphorylation, the mitochondrial membrane potential, and their role in human disease. J Bioenerg Biomembr. 40 (5), 445-456 (2008).
- Sellem, E., et al. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology. 84 (9), 1447-1454 (2015).
- Odhiambo, J. F., Sutovsky, M., DeJarnette, J. M., Marshall, C., Sutovsky, P. Adaptation of ubiquitin-PNA based sperm quality assay for semen evaluation by a conventional flow cytometer and a dedicated platform for flow cytometric semen analysis. Theriogenology. 76 (6), 1168-1176 (2011).
- Barrier Battut, I., Kempfer, A., Becker, J., Lebailly, L., Camugli, S., Chevrier, L. Development of a new fertility prediction model for stallion semen, including flow cytometry. Theriogenology. 86 (4), 1111-1131 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。