Method Article
Fluorimetrischen Techniken für die Beurteilung der Spermien Membranen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen Methoden zur Spermatozoan Membran Integrität, eine zelluläre Funktion verbunden mit Sperma Befruchtung Kompetenz zu bewerten. Wir beschreiben drei Techniken für die fluorimetrischen Beurteilung der Spermien Membranen: gleichzeitige Färbung mit spezifischen fluoreszierende Sonden, Fluoreszenz-Mikroskopie und erweiterte Spermien gewidmet Durchflusszytometrie. Beispiele für die Kombination der Methoden werden ebenfalls vorgestellt.
Zusammenfassung
Standard Spermiograms beschreiben Spermienqualität basieren meist auf die physiologischen und visuelle Parameter wie Ejakulatvolumen und Konzentration, Motilität und progressive Motilität und Morphologie der Spermien und Lebensfähigkeit. Keiner dieser Bewertungen ist jedoch gut genug, um die Qualität des Spermas vorherzusagen. Da die Aufrechterhaltung der Lebensfähigkeit der Spermien und potenzielle Befruchtung Membran Integrität und intrazellulären Funktionalität abhängt, könnte Bewertung dieser Parameter eine bessere Vorhersage der Spermien Befruchtung Kompetenz ermöglichen. Hier beschreiben wir drei machbare Methoden zur Beurteilung der Spermienqualität mit spezifischen fluoreszierende Sonden kombiniert mit Fluoreszenz-Mikroskopie oder Flow-Zytometrie-Analysen. Analysen beurteilt Plasmamembran Integrität mit 4', 6-Diamidino-2-Phenylindole (DAPI) und Propidium Jodid (PI), acrosomal Membran Integrität mit Fluorescein erfolgt konjugiert Pisum Sativum Agglutinin (FITC-PSA) und Mitochondrien-Membran Integrität mit 5, 5', 6, 6'-Tetra-Chloro-1, 1', 3, 3'-Tetraethylbenzimidazolyl Carbocyanine Jodid (JC-1). Kombinationen dieser Methoden werden ebenfalls vorgestellt. Zum Beispiel kombinierten Einsatz von annexin V mit PI Fluorochromes ermöglicht Apoptose Bewertung und Berechnung des apoptotischen Spermien (Apoptose-Index). Wir glauben, dass diese Methoden, die bei der Prüfung der Samenzelle Membranen basieren, sehr nützlich für die Bewertung der Qualität der Spermien sind.
Einleitung
Integrität und Funktionalität der Spermien Membranen sind einige der Angabe Lebensfähigkeit der Spermien und Befruchtung mögliche Faktoren. Die Plasmamembran wirkt wie eine Barriere zwischen den intrazellulären und extrazellulären Abteilen, damit Aufrechterhaltung der zellulären osmotische Gleichgewicht1. Stress, die Schäden an der Plasmamembran Integrität induziert möglicherweise beeinträchtigen Homöostase, Lebensfähigkeit und Düngung Kapazität reduzieren und Zelltod zu erhöhen. Beispielsweise reduziert Kryokonservierung Lebensfähigkeit der Spermien durch zu Schäden an der Plasmamembran infolge Temperaturänderungen und osmotischen Stress2. Wir berichteten bereits, dass auszusetzen Bullensperma niedrigen Konzentrationen von lebensmittelbedingten Schadstoffe wie Pestizide Atrazin, seine wichtigsten Metaboliten Diaminochlorotriazine oder Mykotoxine Aflatoxin B1, reduziert Spermien Rentabilität1,3 . Dies wurde durch Kennzeichnung der doppelsträngigen DNS mit DAPI in Kombination mit PI, die bindet an die DNA von Zellen mit einer beschädigten Plasmamembran bestimmt.
Akrosom Reaktion (AR) beinhaltet Verschmelzung der äußeren Akrosom Membran und die darüber liegende Plasmamembran, was die Auflösung von acrosomal Enzymen4,5. Dies sind wesentliche Ereignisse für die Zona Pellucida eindringen und weitere Zusammenführung der Samenzellen mit der Eizelle6. Bewertung der acrosomal Membran Integrität somit einen nützlichen Parameter zur Bewertung der Qualität des Spermas und männliche Ergiebigkeit7,8,9. Verschiedene fluoreszierende Techniken eignen sich für die Überprüfung der Integrität von Akrosom, FITC-PNA oder FITC-PSA8,10. In unseren früheren Studien mit den Mustern der FITC-PSA Färbung1,3wir versehen genaue Definitionen für (i) intakt Akrosom, (Ii) Akrosom Membran beschädigt und (Iii) reagierten Akrosom. Im aktuellen Bericht wir bewerten Akrosom Status mithilfe von Spermien gewidmet Durchflusszytometrie und vergleichen Sie die Ergebnisse mit denen mit Fluoreszenz-Mikroskopie.
Die Mitochondrien sind multifunktionale Organellen beteiligt, unter anderem ATP Synthese, reaktiven Sauerstoff-Spezies-Produktion, Kalzium-Signalisierung und Apoptose. Physiologische Störungen, einschließlich der männlichen und weiblichen Unfruchtbarkeit sind veränderte Funktion der Mitochondrien11zugeordnet. Spermien Mitochondrien sind in der Midpiece angeordnet und spielen eine entscheidende Rolle in der Spermien-Motilität-12. Es wird gut angenommen, dass hohe mitochondriale Membranpotential (ΔΨm) normale Motilität und hoher Düngung Kapazität13zugeordnet ist. Im Gegensatz dazu niedrig ΔΨm ist verbunden mit einer erhöhten Niveau von reaktiven Sauerstoffspezies und Befruchtung Rate14reduziert. Dennoch können verschiedene ökologische Verbindungen, z.B. endokrine Disruptoren zellulären Stress auslösen und führen zu einem vorübergehenden Anstieg der ΔΨm, Hyperpolarisation1,3, erhöhte Produktion von freien Radikalen und schließlich, Apoptose-15. Die fluoreszierende Sonde 5, 5', 6, 6'-Tetra-Chloro-1, 1', 3, 3'-Tetraethylbenzimidazolyl Carbocyanine Jodid (JC-1) ermöglicht die Untersuchung beispielsweise die Auswirkungen der Foodborne Giftstoffe auf Sperma ΔΨm1,3.
Standard Spermiograms, basierend auf physiologische und morphologische Parameter sind nicht gut genug, um die Qualität des Spermas vorherzusagen. Genauere Methoden sind erforderlich, um Spermien-Qualität zu gewährleisten. Hier bieten wir zwei praktikable Methoden zur Bestimmung Spermienqualität basierend auf Bewertungen von Spermien Membranen: gleichzeitige vierfach Färbung mit speziellen fluoreszierenden Sonden und Fluoreszenz-Mikroskopie, beschrieben in unserem Studien-1,-3 und erweiterte Spermien gewidmet Durchflusszytometrie, vor kurzem in unserem Labor und bereits von anderen verwendet16,17,18.
Protokoll
Alle Experimente wurden durchgeführt in Übereinstimmung mit den israelischen Leitlinien von 1994 für den Tierschutz. Bovine Sperma geliefert wurde von israelischen Handelsgesellschaft für künstliche Befruchtung und Zucht. Ejakuliert 11 Bullen wurden in dieser Studie ausgewertet.
1. Sperma Probenaufbereitung
Hinweis: Das Verfahren basiert auf der Roth Labor Protokoll1,3.
- Erhalten Sie ca. 1 – 6 mL von Rindersperma in einer 15 mL Tube bei Raumtemperatur.
- Zu je 1 mL des Samens 6 mL (bei 37 ° C) vorgewärmte NKM Puffer (110 mM NaCl, KCl, 5 mM 20 mM MOPS [3-N-Morphilino-Propanesulfonic Säure; pH 7.4]) zugeben und Zentrifugieren für 8 min bei 600 X g, 1 – 2 Mal bis der Überstand ist klar.
Hinweis: Wenn Samenzellenkonzentration oder des Ausgangsvolumens aufgeteilt in zwei Rohre bei der ersten Wäsche sehr hoch sind. - Sofort entfernen und entsorgen des klare Überstands und lassen Sie etwa 1 cm Überstand über die Pellets.
- Lehnen Sie sich sorgfältig die Röhren in einem 30°-Winkel erhöhen die Fläche für Spermien schwimmen und warten 20-30 min um Spermien schwimmen Sie bei 37 ° c zu ermöglichen
Hinweis: Trübung kann gesehen werden. - Mit einer Mikropipette sorgfältig entfernen der oberen 1 mL der Überstand enthält die bewegliche Spermien zu einem neuen 1,5 mL-Tube.
- Halten Sie das Sperma bei 37 ° C bis zur Verwendung.
- Schätzen Sie die Anzahl der Spermien mit einem Neubauer Hemocytometer.
Hinweis: Stattdessen ein anderes Zählkammer verwendet werden, aber die Zählung ist anders.- Um Samenzelle Bewegung zu verhindern, 100 µL der bewegliche Spermien mit doppelt destilliertem Wasser (DDW) (1: 100 Verdünnung) in einem 15 mL Röhrchen 10 mL verdünnen und vorsichtig mischen.
- Laden Sie 10 µL der Probe in jeder Seite des Hemocytometer und Deckglas. Achten Sie darauf, Blasenbildung im Inneren der Kammer zu vermeiden, da dies zu einer ungenauen Spermienzahl führen kann.
- Unter einem Compound Mikroskop mit einem 20 X Objektiv beobachten.
Hinweis: Das vollständige Raster auf eine Hemocytometer enthält 9 große Quadrate, jeweils 1 mm2und das Deckglas liegt 0,1 mm über dem Boden der Kammer. So ist das Volumen über Zählung Zentralbereich 0,1 mm3 oder 0,1 µL. Der zentrale Bereich des die Hemocytometer enthält 25 mittlere Plätze und jedes mittlere Quadrat hat 16 kleinere Quadrate mit Einzelleitungen. - Zählen Sie die Gesamtzahl der Zellen in 4 mittlere Eckquadrate und dem zentralen Platz gefunden. Zählen Sie für höhere Präzision zwei Kammern (beidseitig Neubauer Hemocytometer) und mit dem Durchschnitt Zellkonzentration berechnen.
- Berechnen Sie die Anzahl der Spermien durch Multiplikation der durchschnittlichen Anzahl erhalten durch 5 (um die Anzahl der Zellen pro Bereich zählen zu erhalten) und 10.000 (um die Anzahl der Zellen pro 1 mL der verdünnten Probe zu erhalten). Dann multiplizieren Sie die Anzahl die erhaltenen mit den Verdünnungsfaktor (1: 100).
Hinweis: Zum Beispiel ist eine durchschnittliche Anzahl von Spermien gezählt in 5 der 25 mittlere Plätze innerhalb des zentralen zählen zwei Kammern 150 ([152 + 148] / 2). So ist die mittlere Anzahl der Spermien pro Kammer (oder 0,1 µL) 150 x 5 = 750. Multiplizieren Sie 750 von 10.000 um zu erhalten die Anzahl der Zellen pro 1 mL der verdünnten Probe (7.500.000) und multiplizieren Sie dann mit 100 (Verdünnungsfaktor), 75 x 107 Zellen pro mL original Samenprobe zu erhalten.
(2) Technik #1: Gleichzeitige Beurteilung der Spermien Membranen mit mehreren fluoreszierende Sonden
Hinweis: Sperma-Membranen (Plasma, acrosomal und Mitochondrien) wurden bewertet, wie oben beschrieben durch Celeghini Et Al.10, mit einigen Änderungen. Epifluorescent Mikroskopie wurde verwendet, kombiniert mit einer Digitalkamera mit Erregung bei 450-490 nm und Emission bei 515-565 nm mit einem dreifach-Filter.
-
Stammlösungen vorzubereiten.
- Bereiten Sie 0,1 mg/mL Stammlösung DAPI durch Auflösen von 5 mg DAPI in 50 mL Phosphat gepufferte Kochsalzlösung (PBS vor). 50 µL-Aliquots Vorbereitung und Lagerung bei-20 ° C. Vor Gebrauch Verdünnen der Stammlösung mit PBS bei 01:10 (Arbeitslösung; 10 µg/mL).
- Bereiten Sie 1 mg/mL Stammlösung FITC – PSA durch Auflösung 1 mg FITC – PSA in 1 mL PBS vor. 50 µL-Aliquots Vorbereitung und Lagerung bei-20 ° C. Vor Gebrauch Verdünnen der Stammlösung mit PBS bei 01:10 (Arbeitslösung; 100 µg/mL).
- Bereiten Sie 1 mg/mL JC-1-Vorratslösung durch Auflösen von 1 mg JC-1 in 1 mL Dimethyl Sulfoxid (DMSO vor). 10 µL-Aliquots Vorbereitung und Lagerung bei-20 ° C. Vor Gebrauch Verdünnen der Stammlösung mit DMSO bei 01:10 (Arbeitslösung; 0,1 mg/mL).
- Bereiten Sie die PI-Stammlösung durch 10 mg PI in 400 µL PBS (mit 2,5 mg/mL) auflösen. Bei + 4 ° C. Lager 1 mit PBS bei 01:20 (Arbeitslösung, 0,125 mg/mL) verdünnen. Als eine Stammlösung bei + 4 ° C lagern.
Achtung: PI ist ein potenzieller Mutagen und sollten mit Vorsicht behandelt werden. Der Farbstoff muss sicher und entsprechend den geltenden örtlichen Vorschriften entsorgt werden.
- 133 µL bewegliche Spermien (Schritt 1.5) auf eine neue 1,5 mL Tube (25 x 106 Spermien/mL) übertragen.
Hinweis: Wenn die Probenkonzentration höher ist, verdünnen Sie es im Puffer, NKM um die gewünschte Konzentration zu erreichen; Wenn die Probenkonzentration die Swim-up Probe niedriger ist, Zentrifugieren Sie die erhaltenen überstand nach dem Schwimmen bis 1.000 x g für 5 min, entfernen Sie 0,5 mL des Überstands zu und zählen Sie das Sperma wieder. - 17 µL DAPI (Arbeitslösung) hinzufügen und 10 Minuten bei 37 ° c inkubieren
- Bei 1.000 X g für 5 min Zentrifugieren und den Überstand verwerfen.
- Das Pellet fügen Sie 100 µL NKM Puffer hinzu.
- Fügen Sie 50 µL FITC-PSA, 2 µL des JC-1 und 3 µL von PI (funktionierende Lösungen) und 10 min bei 37 ° c inkubieren
- Bei 1.000 X g für 5 min Zentrifugieren und den Überstand zu entfernen.
- Das Pellet 40 µL NKM Puffer hinzugeben und Aufschwemmen durch pipettieren.
- Übertragen Sie 10 µL der Probe auf einem Objektträger, Abstrich und Deckglas.
-
Visualisieren Sie sofort durch Epifluoreszenz Mikroskopie (Nutzung 40 X Objektiv) mit einem dreifachen Filter, ausgestattet mit einer digitalen Kamera und Aufnehmen eines Bildes separat für jeden Filter.
Hinweis: Es gibt keine Bedeutung Reihenfolge Filter visualisiert.- Visualisieren Sie unter DAPI Kanal mit Erregung bei 358 nm und Emission bei 461 nm.
- Unter FITC Kanal für grüne Monomere mit Erregung bei 450-490 nm und Emission bei 515 – 565 nm zu visualisieren.
- Visualisieren Sie unter PI-Kanal für rote Aggregate mit Erregung bei 488 nm und Emission bei 590 nm.
- Visualisieren Sie unter JC-1 rote Aggregate mit Erregung bei 559 nm und Emissionen im Bereich von 574 – 627 nm; JC-1 grüne Monomere mit Erregung bei 488 nm und Emissionen im Bereich von 500 – 535 nm.
- Verbinden Sie die drei Bilder von den Filtern im JPG/JPEG-Format, mit der Option "Zusammenführen" der Kamerasoftware erhalten.
- Das zusammengefügte Bild mit "Paint" Werkzeug zu öffnen und die Option Pinsel gezählte Spermien zu markieren.
-
Spermien, die basierend auf der von jeder Sonde emittierte Fluoreszenz zu klassifizieren:
- In der Regel mindestens 200 Spermien pro Folie zu bewerten – alle Zellen erscheinen blau (DAPI).
- Bewertung die Tragfähigkeit durch abgestorbene Zellen zählen, die erscheinen violett (PI [rot] + [blau] DAPI) und Berechnung des Prozentsatzes von abgestorbenen Zellen (Tote Zellen/Gesamt gezählt Zellen X 100).
- Werten Sie Akrosom Status mit den Mustern der fluoreszierende Färbung (FITC – PSA aus). Berechnen Sie die Prozentsätze der unterschiedlichen Muster (intakt, beschädigten oder reagierte Akrosom Zellen/Gesamt gezählt Zellen X 100).
Hinweis: Beschädigte acrosomal Membran wirkt wie eine Kappe voll gefärbt, grüne Akrosom; reagierte acrosomal Membran zeigt verbleibende grünen äquatorialen oder oberen Färbung; Zellen mit intakten acrosomal Membran werden nicht aufweisen, eine grüne Färbung der acrosomal Region. - Bewerten Sie ΔΨm durch die Unterscheidung von Spermien mit hohen ΔΨm, die einen rot gefärbten Midpiece aufweisen und Spermien mit niedrigen ΔΨm, die einen grün gefärbten Midpiece aufweisen. Zählen, rot und grün Midpieces separat und berechnen ihre Ratio (rot/grün).
3. Technik #2: Beurteilung der Spermien Membranen mit Ready-To-Use-Kits und Durchflusszytometrie
Hinweis: Beurteilung der Widerstandsfähigkeit gegen Plasmamembran, Mitochondrien-Membran Potenzial und acrosomal Membran Integrität wurde mit Ready-to-Use Flow Cytometry Bausätze mit lyophilisierten Fluorochromes in jede Vertiefung durchgeführt. Der Eingriff war nach Angaben der Hersteller mit einigen Änderungen durchgeführt.
-
Plasmamembran Integrität Bewertung
- Nehmen Sie die gewünschte Anzahl von Brunnen aus dem Paket der Lebensfähigkeit und Konzentration-Kit (PI und SYbr14), übertragen Sie sie auf die Arbeitsgrundlage und die Abdeckung mit einem flexiblen Deckel (vor Licht schützen).
- Fügen Sie 199 µL gepufferten Lösung für Zytometrie pro Bohrloch.
- Fügen Sie 1 µL homogene Sperma am 57 x 106/mL (57.000 Zellen pro Well) und Homogenisieren von pipettieren.
- Die Platte mit den schwarzen Deckel abdecken.
- Inkubieren Sie für 10 min bei 37 ° C, vor Licht geschützt werden.
- Führen Sie das Beispiel mit der Einstellung "Lebensfähigkeit" durch das Durchflusszytometer.
-
Mitochondriale Membranpotential
- Nehmen Sie die gewünschte Anzahl von Brunnen aus dem Paket der mitochondrialen Aktivität Kit (JC-1), übertragen Sie sie auf die Arbeitsgrundlage und die Abdeckung mit einem flexiblen Deckel (vor Licht schützen).
- Fügen Sie 10 µL von absoluten Ethanol pro Bohrloch und pipette, um das Pulver vorhanden innerhalb der Brunnen aufzuwirbeln.
- Fügen Sie 190 µL PBS pro Bohrloch und Homogenisieren von pipettieren.
- Fügen Sie 0,75 µL homogene Sperma am 57 x 106/mL (50.000 Zellen pro Well) und Homogenisieren von pipettieren.
- Die Platte mit den schwarzen Deckel abdecken.
- Inkubieren Sie für 30 min bei 37 ° C, vor Licht geschützt werden.
- Führen Sie das Beispiel durch das Durchflusszytometer mit der Einstellung ʽmitochondrial Tätigkeit ".
-
Acrosomal Membran Integrität
Hinweis: FITC – PSA Färbung (siehe Technik #1) ermöglicht die Bewertung der 3 Akrosom Kategorien (intakt Akrosom, reagierte Akrosom und beschädigte Akrosom). Mit dem Durchflusszytometer und Lebensfähigkeit & Akrosom Integrität Kit (PI und FITC-PNA), sind die Spermien in diesen 3 Kategorien unterteilt.- Nehmen Sie die gewünschte Anzahl von Brunnen aus dem Paket der Lebensfähigkeit & Akrosom Integrität Kit, übertragen Sie sie auf die Arbeitsgrundlage und die Abdeckung mit einem flexiblen Deckel (vor Licht schützen).
- Fügen Sie 200 µL der gepufferten Lösung für Zytometrie pro Bohrloch.
- Fügen Sie 0,7 µL homogene Sperma am 57 x 106/mL (40.000 Zellen pro Well) und Homogenisieren von pipettieren.
- Die Platte mit den schwarzen Deckel abdecken.
- Inkubieren Sie für 45 min bei 37 ° C, vor Licht geschützt werden.
- Führen Sie das Beispiel durch das Durchflusszytometer mit der Einstellung ʽInCyte ".
- Analysieren das resultierende Histogramm durch drei Marker-Bereiche nach Fluoreszenzintensität gating, stellvertretend für vernachlässigbar, niedrig-fluoreszierenden Zellen mit intakten, ungefärbten Akrosom (R1), niedrig-fluoreszierenden Zellen mit Restwert gebeizt Bestandteil der Akrosom (R2) und stark fluoreszierende Zellen mit gestörten Akrosom (R3).
Hinweis: Verwenden Sie den "Analyse von Dateien mit anderen Modulen erworbenen" Abschnitt im Benutzerhandbuch Instrument um die drei Regionen (R1, R2, R3) zu schaffen.
4. Technik #3: Beurteilung der Spermien Membranen mit fluoreszierenden Sonden und Durchflusszytometrie
Hinweis: Nutzung von annexin V kombiniert mit PI Fluorochromes ermöglicht Apoptose Bewertung und Berechnung des apoptotischen Spermien (Apoptose-Index).
- Bereiten Sie 1 x annexin V Bindung Puffer von 20 x Stammlösung (verdünnte 500 µL annexin V Bindung Puffer 20 x Stammlösung mit 9,5 mL sterilem destilliertem Wasser vor).
- Schätzen Sie die Anzahl der Spermien mit einem Neubauer Hemocytometer, wie in Abschnitt 1.7 beschrieben.
- Waschen Sie 106 Spermien in 1 mL 1 x annexin V Bindung Puffer und Zentrifuge bei 300 X g für 10 min.
- Den Überstand vollständig abzusaugen.
- Aufzuwirbeln Sie das Pellet in 100 µL 1 x annexin V Bindung Puffer.
- Fügen Sie 10 µL annexin V, FITC konjugiert.
- Gut mischen und 15 Minuten im Dunkeln bei Raumtemperatur inkubieren.
- Waschen Sie Spermien durch Zugabe von 1 mL 1 X annexin V Bindung Puffer pro 106 Zellen und Zentrifuge bei 300 X g für 10 Minuten.
- Den Überstand vollständig abzusaugen.
- Aufschwemmen der Zelle Pellet in 500 µL 1 X annexin V Bindung Puffer pro 106 total Zellen.
- Fügen Sie 1 µg/mL PI unmittelbar vor der Analyse mit einem Durchflusszytometer.
- Führen Sie das Beispiel durch das Durchflusszytometer am ʽInCyte ".
Ergebnisse
Abbildung 1 zeigt simultan fluorimetrischen Beurteilung der Spermien Membranen (Plasma, acrosomal und Mitochondrien) mithilfe von PI, DAPI, FITC-PSA und JC-1. Beurteilung der Spermien Membranen mit gleichzeitiger Färbung mit vier fluoreszierende Sonden ermöglicht beispielsweise Bewertung des Anteils der Spermien in den einzelnen Kategorien – Leben vs. tot; hohe vs. niedrige ΔΨm; intakte Vs. Akrosom beschädigt – gleichzeitig für jedes Spermium.
Abbildung 2 zeigt Ergebnisse von Spermien Membran Bewertung mit fluorimetrischen Sonden. Nur die Samen, die mindestens 80 % bewegliche Spermien enthalten dienten im Experiment. Mindestens 200 Zellen wurden pro Bull untersucht. Es war möglich, die Qualitätsunterschiede Sperma Probe in Bezug auf die Membran Integrität zu bewerten. Zum Beispiel das Ejakulat Bull Nr. 7 hatte einen relativ geringen Prozentsatz von abgestorbenen Zellen, ein geringer Anteil der Spermien mit Pseudo Akrosom und höhere mitochondriale Membranpotential, verglichen mit dem Ejakulat von Bull Nr. 1 reagiert.
Abbildung 3 zeigt repräsentative Proben für Lebensfähigkeit (Abbildung 3A–3 C) und mitochondriale Aktivität (Abbildung 3D–3F) ausgewertet. Fluoreszenz-Intensitäten der Proben wurden durch eine dedizierte Microcapillary Sperma Durchflusszytometer mit entsprechender Software ausgewertet. Das Durchflusszytometer enthält ein Festphasen-blauen Laser (448 nm) und zwei Fotodioden: forward Scatter und Side Scatter. Er misst speziell Sperma Emission Eigenschaften mit drei Photomultiplier Tubes (grün: 525/30 nm, gelb: 583/26 nm; rot: 655/50 nm) und bietet Platz für optische Filter und Verteiler16. Es ermöglicht die Auswertung von 5.000 Spermien pro Analyse.
Die Rentabilität-Evaluation-Kit enthält eine Sonde mit differentielle Permeabilität für tragfähige (intakte Plasmamembran) und Toten (beschädigte Plasmamembran) Spermien (Abbildung 3). Sperma ΔΨm wurde anhand ein Set, das unterscheidet zwischen polarisiert Mitochondrien-Membran (Fluoreszenz in Orange angezeigt) und Mitochondrien-Membran (Fluoreszenz erscheinen in grün) depolarisiert (Abbildung 3F).
Abbildung 4 zeigt eine Bewertung von Akrosom Integrität durchgeführt mit dem Ready-to-Use-Kit, lesen mit der Durchflusszytometrie (Abbildungen 4A–4 C), das resultierende Histogramm der gated Spermien in drei Marker-Bereiche aufzuteilen, Vertretung vernachlässigbare niedrig fluoreszierenden Zellen intakt, ungefärbten Akrosom (R1), Low-fluoreszierenden Zellen mit Restwert gebeizt Bestandteil der Akrosom (R2), mit stark fluoreszierende Zellen mit gestörten Akrosom (R3).
Tabelle 1 zeigt einen Vergleich der beiden fluorimetrischen Techniken zur Beurteilung der Spermien Membranen. Die gleichen Spermaproben von drei verschiedenen Bullen wurden für Lebensfähigkeit, mitochondriale Membranpotential (ΔΨm) und Akrosom Integrität mit gleichzeitigen vierfachen Färbung sowie Durchflusszytometrie ausgewertet. Dieser Vergleich ist sehr wichtig, da es die passenden Ergebnisse mit jedem der beiden Techniken zeigt. Durch eine Analyse und Studenten t-Test wurden ausgewertet. Keine statistisch signifikanten Unterschiede beobachtet.
Abbildung 5 zeigt eine repräsentative Stichprobe für die Apoptose mittels annexin V (AV) und Propidium Jodid (PI) Fluorochromes ausgewertet. Verwendung der beiden Sonden ermöglicht Unterscheidung zwischen vier Muster zeigt lebensfähige Zellen (AV, PI), frühen Apoptotic Zellen (AV +, PI-), Apoptotic Zellen (AV +, PI +) und nekrotischen Zellen (AV-, PI +).
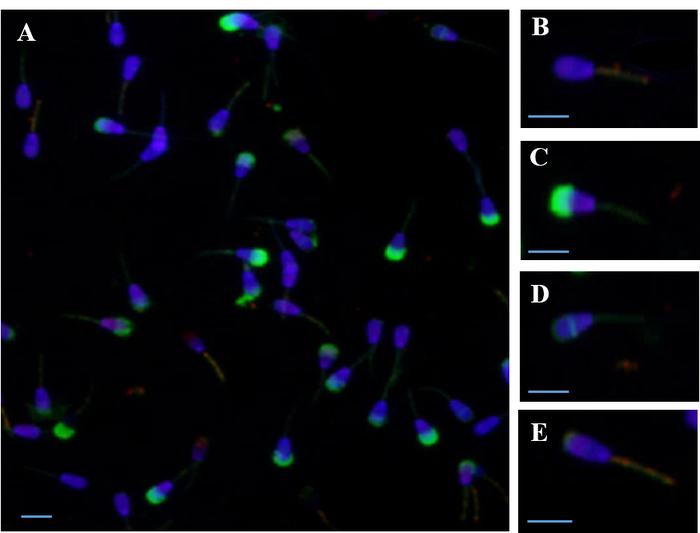
Abbildung 1: Epifluoreszenz Mikrofotografie von Spermien gleichzeitig mit mehreren fluoreszierende Sonden befleckt. (A) gleichzeitige Färbung mit vier Sonden, PI, DAPI, FITC-PSA und JC-1) (B) Live Samenzelle mit DAPI Färbung des Kerns und hohe mitochondriale Membranpotential (ΔΨm), befleckt mit JC-1 Sonde. (C) tot Samenzelle mit beschädigten Plasmamembran gebeizt mit PI-Sonde, beschädigte Akrosom gebeizt mit FITC-PSA-Sonde und niedrigen ΔΨm. (D) Live, Akrosom reagierte Samenzelle mit Rest äquatorialer Färbung und geringen ΔΨm. (E) Live, Akrosom reagierte Samenzelle mit verbleibenden oberen Färbung und hohe ΔΨm. Skalieren von Balken = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Bewertung von Bull Sperma Membranen mit fluorimetrischen Sonden. (A) Spermien Rentabilität wurde mit fluoreszierenden Sonden 4', 6-Diamidino-2-Phenylindole (DAPI) und Propidium Jodid (PI) bestimmt. (B) Akrosom Status war nach Färbung Mustern FITC-PSA bestimmt. Der Anteil von Spermien mit reagierte Akrosom werden vorgestellt. (C) mitochondriale Membranpotential (ΔΨm) wurde evaluiert, mit mit fluoreszierenden Sonde JC-1 und präsentiert als das Verhältnis zwischen mittleren Anteil der rot gefärbten (hohes Potential) und grün gefärbt (low-Potential) Spermien. Daten werden als Prozentsatz der Zellen aus insgesamt ausgewerteten Zellen dargestellt. Mindestens 200 Spermien wurden pro Bull analysiert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Rentabilität (A-C) und mitochondriale Aktivität (D-F) Fluoreszenz Bewertung von repräsentativen Proben gemessen EasyCyte Durchflusszytometer. Histogramme vertreten ungated Spermatozoa und Schutt (A, D), gated Spermien (B, E), Verteilung von Spermien lebensfähig (grün) und Toten (rot) Zellen (C) und Verteilung von Spermien zu polarisierten (gelb) und depolarisiert ( grün) Mitochondrien-Membran (F). Skalieren von Balken = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Fluoreszenz-Beurteilung der Widerstandsfähigkeit gegen Akrosom von repräsentativen Proben gemessen EasyCyte Durchflusszytometer. (A) Histogramm der ungated Spermatozoa und Schutt. (B, C) Histogramme von gated Spermien mit Bewertung von Akrosom Integrität ausgeführt mit Ready-to-Use-Kit, mit angepassten Einstellung "InCyte", teilt das resultierende Histogramm lesen gated Spermien in drei Marker Bereiche repräsentieren vernachlässigbar, niedrig-fluoreszierenden Zellen mit intakten, ungefärbten Akrosom (R1), niedrig-fluoreszierenden Zellen mit Restwert gebeizt Bestandteil der Akrosom (R2) und stark fluoreszierenden Zellen mit gestört Akrosom (R3). Skalieren von Balken = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Durchschnittliche Anzahl der Zellen | Vialbility | Mitochondrialen Membran-Potenzial | Akrosom Integrität | ||||||
| Tragfähige | Toten | Depolarisiert | Polarisiert | Rot/Grün-Verhältnis | Intakte Akrosom | Reagierte Akrosom | Gestörten Akrosom | ||
| Vierfach Färbung | 253 | 32.7 ± 1,53 % | 67.3 ± 1,53 % | 65,7 ± 2,25 % | 34,3 ± 2,52 % | 0,5 ± 0,06 | 37,3 ± 7,2 % | 38,0 ± 5,7 % | 24,3 ± 3,0 % |
| Fließen Cytomtery | 5.000 | 32,3 ± 2,08 % | 67,7 ± 2,08 % | 65,0 ± 1,00 % | 35.0 ± 1,00 % | 0,5 ± 0,02 | 39,5 ± 5,7 % | 39,5 ± 6,5 % | 21,0 ± 8,0 % |
Tabelle 1: Vergleich der beiden fluorimetrischen Techniken zur Beurteilung der Spermien Membranen. Die gleichen Spermaproben wurden für Lebensfähigkeit, mitochondriale Membranpotential und Akrosom Integrität mit gleichzeitigen vierfachen Färbung und Durchflusszytometrie ausgewertet. Daten werden dargestellt, wie Anteil ± SD der untersuchten Zellen, berechnet für 3 Wiederholungen bedeuten.

Abbildung 5: Annexin V und PI Fluoreszenz bei einer repräsentativen Stichprobe gemessen an einem Durchflusszytometer. Histogramme stellen (A) ungated Spermien und Schmutz und (B) Vertrieb von geschlossenen Spermien zu frühen Apoptotic (AV + PI-), Apoptose (AV + PI +), tragfähige (AV-PI-) und nekrotische (AV-PI +) Zellen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Sperma Befruchtung potenzielle hängt von mehrere Faktoren die Qualität widerspiegelt. Eine hohe Konzentration der Spermien und einen hohen Anteil an sehr progressiv bewegliche Spermien könnte qualitativ hochwertige Samen betrachtet werden. Dennoch, eine solche Bewertung nicht berücksichtigt andere zelluläre und funktionelle Parameter. Die Verwendung von "Bench-Top" Microcapillary Durchflusszytometer kann zur Bewertung der verschiedenen Spermien Strukturen mit fluoreszierenden Sonden, wie zuvor von anderen17 gezeigt und hier demonstriert (Technik #3) leicht angepasst werden. Z. B. Sperma Akrosom Integrität ist sehr wichtig für das Vorkommen der erfolgreiche natürliche Befruchtung und daher präzise Einschätzung der acrosomal gerechtfertigt ist. Eine solche kann einfach durchgeführt werden, durch Klassifizierung von Akrosom Status mit den Mustern der fluoreszierende Färbung (FITC-PSA, FITC-PNA, d. h. Technik #1, wie zuvor beschrieben)1,3. Vor allem ist es sehr wichtig zu bestimmen, den Anteil der Spermien mit intakten Akrosom (d. h. Exponate einem ungefärbten Akrosom) im Vergleich zu denen mit beschädigten Akrosom. Mit Bezug auf das letztere, Sperma mit beschädigten Akrosom kann (i) eine komplett gebeizt acrosomal GAP, ausstellen, gibt an, dass die Membran beschädigt ist, ermöglicht des Farbstoffs durch die Membran in das Akrosom Vesikel fließen; (Ii) Akrosom reagierte Spermien, die nur passives Akrosom Inhalt, darauf hinweist, dass die AR bereits stattgefunden hat (d. h. Pseudo AR) aufweisen. Es sei darauf hingewiesen, dass eine solche Bewertung auch mit der dedizierten Durchflusszytometer durchgeführt werden kann.
Das Ready-to-Use Lebensfähigkeit & Akrosom Integrität Kit definiert sowohl Sperma Lebensfähigkeit (lebensfähigen oder Toten) und acrosomal Integrität (intakt oder gestört). Hier, wir empfehlen die Verwendung der engagierten Durchflusszytometer, um die drei oben genannten acrosomal Status zu definieren (d.h., intakt, beschädigt, reagiert). Wir die Microcapillary Flow Cytometer Plattform für genauere Bewertung, die das Akrosom reagierte Sperma (d. h. geringe Fluoreszenz) identifiziert beim Ausschluss von Menschen mit gestörten Akrosom (hohe Fluoreszenz), anstatt sie auch angepasst mit denen, die eine intakte Akrosom. Dies gibt einen genaue Anteil der Spermien mit funktionalen oder nicht funktionsfähige Akrosom. Spermien mit reagierte Akrosom sowie gestörten acrosomal Membran verloren haben ihre Fähigkeit, die Eizelle zu befruchten. Darüber hinaus genaue Analyse kann Aufschluss über den Mechanismus Akrosom Veränderung, d. h., Akrosom Membran vs. Pseudo Akrosom Aktivierung beschädigt.
Wir verglichen die Ergebnisse mit Technik #1 und #2 Technik und fanden große Kompatibilität zwischen ihnen, insbesondere bei der Bewertung der Tragfähigkeit und ΔΨm (Tabelle 1). Einer der wichtigsten Vorteile der Verwendung der engagierten Durchflusszytometer ist die große Anzahl der ausgewerteten Spermien im Verhältnis zu der geringen Anzahl von Spermien, die in der Praxis durch Fluoreszenz-Mikroskopie und Sonden ausgewertet werden (vs. Hunderte, Tausende bzw. ). Darüber hinaus ist das letztere Verfahren zeitaufwendig und subjektiv, selbst wenn von einem erfahrenen Beobachter durchgeführt. Wie Durchflusszytometrie nur Partikel-assoziierten Fluoreszenz erkennt, gibt es keine Notwendigkeit, die ungebundene Sonde aus der Lösung zu waschen ist eine zeitaufwendige Schritt17. Auf der anderen Seite ermöglicht die fluorimetrischen Beurteilung der Spermien Membranen in Technik #1 beschriebenen gleichzeitige Beurteilung der mehrere Membranen. Wir waren in der Lage, so viele wie vier fluoreszierende Sonden zusammen1,3zu verwenden.
Schließlich ist darauf hinzuweisen, dass die engagierten Durchflusszytometer als offene Assay-Modul, bietet alle grundlegenden Werkzeuge für die Probenanalyse Erwerb und Daten entwickelt wurde. Die Übernahme-Funktion ermöglicht es, verschiedene Arten von Informationen aus einer Zellprobe sammeln und daher ermöglicht eine Anpassung für genauere Bewertung, wie hier gezeigt für Akrosom Status und Apoptotic Index.
Im Ergebnis sind die in diesem Artikel beschriebenen Methoden sehr nützlich für die Bewertung der Qualität des Spermas. Prüfung der Samenzelle Membranen ist sehr wichtig für die Bestimmung der Spermien Befruchtung Kompetenz.
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte gibt.
Danksagungen
Die Autoren möchten "SION" israelische Gesellschaft für künstliche Befruchtung und Zucht (Hafetz-Haim, Israel) Danke für ihre Hilfe und Zusammenarbeit und Frau Li Na (IMV Technologies, L'Aigle, Frankreich) für die Unterstützung bei der Inbetriebnahme und Schulung.
Materialien
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| MOPS [3-N-morphilino propanesulfonic acid] | Sigma | M1254 | |
| PBS | Sigma | P5493 | |
| DMSO | Sigma | D2438 | |
| Ethanol absolute | Sigma | 64-17-5 | |
| Hemacytometer | Neubauer Germany | hemocytometer | |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma | D9542 | fluorescent probe |
| PI (propidium iodide ) | Sigma | P4170 | fluorescent probe |
| FITC-PSA (fluorescein isothiocyanate-conjugated Pisum sativum agglutinin ) | Sigma | L0770 | fluorescent probe |
| JC-1 (5,5',6,6'-tetra-chloro-1,1',3,3'-tetraethylbenzimidazolyl carbocyanine iodide) | ENZOBiochem, New York, NY, USA | ENZ52304 | fluorescent probe |
| Annexin V conjugated to FITC | MACS, Miltenyi Biotec | 130-093-060 | fluorescent probe |
| Annexin V binding buffer 20x stock solution | MACS, Miltenyi Biotec | 130-092-820 | buffer |
| Nikon Eclipse, TE-2000-u | Nikon, Tokyo, Japan | inverted fluorescence microscope | |
| Nis Elements | Nikon, Tokyo, Japan | software | |
| Nikon DXM1200F | Nikon, Tokyo, Japan | digital camera | |
| Guava EasyCyte Plus | IMV Technologies, L'Aigle, France | microcapillary sperm flow cytometer | |
| CytoSoft | Guava Technologies Inc., Hayward, CA, USA; distributed by IMV Technologies | software | |
| Buffered solution for cytometry | IMV Technologies, L'Aigle, France | 023862 | buffer |
| Viability and concentration kit | IMV Technologies, L'Aigle, France | 024708 | kit for viability assessment |
| Mitochondrial activity kit | IMV Technologies, L'Aigle, France | 024864 | kit for mitochondrial activity assessment |
| Viability & acrosome integrity kit | IMV Technologies, L'Aigle, France | 025293 | kit for acrosome integrity assessment |
| JMP-13 | SAS Institute Inc., 2004, ary, NC, USA | software | |
| Bovine sperm | "SION", Israeli company for artificial insemination and dreeding, Hafetz-Haim, Israel |
Referenzen
- Komsky-Elbaz, A., Roth, Z. Effect of the herbicide atrazine and its metabolite DACT on bovine sperm quality. Reprod Toxicol. 67, 15-25 (2016).
- Gürler, H., et al. Effects of cryopreservation on sperm viability, synthesis of reactive oxygen species, and DNA damage of bovine sperm. Theriogenology. 86 (2), 562-571 (2016).
- Komsky-Elbaz, A., Saktsier, M., Roth, Z. Aflatoxin B1 impairs sperm quality and fertilization competence. Toxicology. 393, 42-50 (2018).
- Beltrán, C., et al. Role of Ion Channels in the Sperm Acrosome Reaction. Adv Anat Embryol Cell Biol. 220, 35-69 (2016).
- Breitbart, H. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol (Noisy-le-grand). 49 (3), 321-327 (2003).
- Almadaly, E., et al. Methodological factors affecting the results of staining frozen-thawed fertile and subfertile Japanese Black bull spermatozoa for acrosomal status. Anim Reprod Sci. 136 (1-2), 23-32 (2012).
- Jankovicová, J., Simon, M., Antalíková, J., Horovská, L. Acrosomal and viability status of bovine spermatozoa evaluated by two staining methods. Vet Hung. 56 (1), 133-138 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histol Histopathol. 24 (8), 999-1007 (2009).
- Whitfield, C. H., Parkinson, T. J. Relationship between fertility of bovine semen and in vitro induction of acrosome reactions by heparin. Theriogenology. 38 (1), 11-20 (1992).
- Celeghini, E. C. C., de Arruda, R. P., de Andrade, A. F. C., Nascimento, J., Raphael, C. F. Practical Techniques for Bovine Sperm Simultaneous Fluorimetric Assessment of Plasma, Acrosomal and Mitochondrial Membranes. Reprod Domest Anim. 42 (5), 479-488 (2007).
- Ramalho-Santos, J., Varum, S., Amaral, S., Mota, P. C., Sousa, A. P., Amaral, A. Mitochondrial functionality in reproduction: from gonads and gametes to embryos and embryonic stem cells. Hum Reprod. 15 (5), 553-572 (2009).
- Eddy, E. M., O’Brien, A. . The spermatozoon. , (1994).
- Gallon, F., Marchetti, C., Jouy, N., Marchetti, P. The functionality of mitochondria differentiates human spermatozoa with high and low fertilizing capability. Fertil Steril. 86 (5), 1526-1530 (2006).
- Espinoza, J. a., Paasch, U., Villegas, J. V. Mitochondrial membrane potential disruption pattern in human sperm. Hum Reprod. 24 (9), 2079-2085 (2009).
- Hüttemann, M., Lee, I., Pecinova, A., Pecina, P., Przyklenk, K., Doan, J. W. Regulation of oxidative phosphorylation, the mitochondrial membrane potential, and their role in human disease. J Bioenerg Biomembr. 40 (5), 445-456 (2008).
- Sellem, E., et al. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology. 84 (9), 1447-1454 (2015).
- Odhiambo, J. F., Sutovsky, M., DeJarnette, J. M., Marshall, C., Sutovsky, P. Adaptation of ubiquitin-PNA based sperm quality assay for semen evaluation by a conventional flow cytometer and a dedicated platform for flow cytometric semen analysis. Theriogenology. 76 (6), 1168-1176 (2011).
- Barrier Battut, I., Kempfer, A., Becker, J., Lebailly, L., Camugli, S., Chevrier, L. Development of a new fertility prediction model for stallion semen, including flow cytometry. Theriogenology. 86 (4), 1111-1131 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten