Method Article
Fluorimetrica tecniche per la valutazione delle membrane degli spermatozoi
In questo articolo
Riepilogo
Qui, presentiamo le metodologie per valutare l'integrità della membrana di spermatozoan, una cellulare caratteristica associata con competenza di fertilizzazione dello sperma. Descriviamo tre tecniche per la valutazione di fluorimetrico delle membrane degli spermatozoi: macchiatura simultanea con sonde fluorescenti specifiche, microscopia a fluorescenza e citometria a flusso di sperma-dedicato avanzate. Inoltre vengono presentati esempi di combinazione delle metodologie.
Abstract
Spermiograms standard che descrivono la qualità dello sperma sono principalmente basati sui parametri fisiologici e visual, come il volume di liquido seminale e concentrazione, motilità e motilità progressiva e morfologia degli spermatozoi e vitalità. Tuttavia, nessuna di queste valutazioni è abbastanza buona per predire la qualità dello sperma. Dato che il mantenimento della vitalità degli spermatozoi e fecondazione potenziale dipende dalla funzionalità intracellulare e l'integrità della membrana, la valutazione di questi parametri potrebbe consentire una migliore previsione di competenza di fertilizzazione dello sperma. Qui, descriviamo tre possibili metodi per valutare la qualità dello sperma usando sonde fluorescenti specifiche combinate con analisi di citometria a flusso o microscopia di fluorescenza. Analisi ha valutato l'integrità della membrana del plasma utilizzando 4', 6-diamidino-2-phenylindole (DAPI) e ioduro di propidio (PI), l'integrità della membrana acrosomiale utilizzando fluoresceina isotiocianato-coniugato dell'agglutinina Pisum sativum (FITC-PSA) e l'integrità della membrana mitocondriale usando 5, 5', 6, 6'-tetra-chloro-1, 1', 3, 3'-tetraethylbenzimidazolyl ioduro di carbocyanine (JC-1). Combinazioni di questi metodi inoltre sono presentati. Per esempio, uso di annessina V combinato con consente di fluorocromi PI apoptosi di valutare e calcolare la percentuale di spermatozoi apoptotici (indice apoptotico). Crediamo che queste metodologie, che si basano sull'esame di membrane di spermatozoo, sono molto utili per la valutazione della qualità dello sperma.
Introduzione
L'integrità e la funzionalità delle membrane degli spermatozoi sono alcuni dei fattori che indica la vitalità degli spermatozoi e potenziale di fecondazione. La membrana plasmatica agisce come una barriera tra compartimenti intracellulari ed extracellulari, mantenendo l' equilibrio osmotico cellulare1. Qualsiasi stress che induce il danno all'integrità della membrana plasmatica potrebbe alterare l'omeostasi, ridurre la capacità di fertilizzazione e redditività e aumentare la morte delle cellule. Per esempio, crioconservazione riduce la vitalità degli spermatozoi causa danni alla sua membrana plasmatica, a seguito di variazioni di temperatura e stress osmotico2. Precedentemente abbiamo segnalato che esponendo lo sperma di Toro a basse concentrazioni di contaminanti di origine alimentare come i pesticidi atrazina, suo principale metabolita diaminochlorotriazine o l'aflatossina B1, la micotossina riduce sperma attuabilità1,3 . Questo è stato determinato dall'etichettatura il DNA double-stranded con DAPI in combinazione con PI, che si lega al DNA delle cellule con una membrana plasmatica danneggiata.
Reazione acrosomiale (AR) comporta la fusione della membrana acrosomiale esterna e la membrana di plasma sovrastante conseguente rilascio di enzimi acrosomiali4,5. Questi sono eventi da non mancare per penetrazione della zona pellucida e ulteriormente l'Unione dello sperma con l' ovocita6. Pertanto, la valutazione dell'integrità della membrana acrosomiale costituisce un parametro utile per valutare la qualità dello sperma e la fertilità maschile7,8,9. Parecchie tecniche fluorescenti sono utilizzabili per la verifica di integrità acrosomiale, FITC-PNA o FITC-PSA8,10. Nei nostri studi precedenti, utilizzando i modelli di FITC-PSA colorazione1,3, abbiamo fornito le definizioni precise per (i) acrosomiale intatta, (ii) danneggiato della membrana acrosomiale e (iii) ha reagito acrosomiale. Nel rapporto corrente, valutiamo lo stato acrosomiale mediante citometria a flusso di sperma-dedicato e confrontare i risultati con quelli utilizzando la microscopia a fluorescenza.
I mitocondri sono organelli multifunzionali coinvolti in, tra le altre cose, ATP sintesi, produzione di specie reattive dell'ossigeno, segnalazione del calcio e apoptosi. Disfunzioni fisiologiche, tra cui l'infertilità maschile e femminile, sono associate con la funzione mitocondriale alterata11. I mitocondri dello sperma sono disposti nel midpiece e svolgono un ruolo cruciale in spermatozoi motilità12. È ben accettato che potenziale di membrana mitocondriale alta (ΔΨm) è associata con normale motilità e fertilizzazione alta capienza13. Al contrario, ΔΨm basso è associato con un livello elevato di specie reattive dell'ossigeno e ridotto tasso di fertilizzazione14. Tuttavia, vari composti ambientali, per esempio gli interferenti endocrini, possono indurre stress cellulare e portare a un aumento transitorio nel ΔΨm, hyperpolarization1,3, aumentata produzione di radicali liberi e, infine, apoptosi15. La sonda fluorescente 5, 5', 6, 6'-tetra-chloro-1, 1', 3, 3'-tetraethylbenzimidazolyl ioduro di carbocyanine (JC-1) consente, ad esempio, esaminare gli effetti delle tossine di origine alimentare sul sperma ΔΨm1,3.
Spermiograms standard, basato su parametri fisiologici e morfologici, non sono abbastanza buone predire la qualità dello sperma. Metodi più accurati sono tenuti a garantire la qualità dello sperma. Qui, forniamo fattibile due metodi per determinare la qualità dello sperma sulla base delle valutazioni delle membrane degli spermatozoi: colorazione quadrupla simultanea con sonde fluorescenti specifiche e microscopia a fluorescenza, descritto nei nostri studi1,3 e citometria a flusso di sperma-dedicato avanzate, recentemente utilizzato nel nostro laboratorio e già utilizzato da altri16,17,18.
Protocollo
Tutti gli esperimenti sono stati effettuati conformemente agli orientamenti israeliano 1994 per il benessere animale. Sperma di bovini è stato fornito da società commerciale israeliana per inseminazione artificiale e l'allevamento. Eiacula di 11 tori sono stati valutati in questo studio.
1. preparazione del campione di sperma
Nota: La procedura è basata sul protocollo1,3 di laboratorio Roth.
- Prelevare circa 1 – 6 mL di sperma del Toro in una provetta da 15 mL a temperatura ambiente.
- Per ogni 1 mL di liquido seminale, aggiungere 6 mL di tampone NKM preriscaldata (a 37 ° C) (110 mM NaCl, 5 mM KCl, MOPS 20 mM [acido 3-N-morphilino propansolfonico; pH 7.4]) e centrifugare per 8 min a x 600 g, 1 – 2 volte fino a quando il surnatante è chiara.
Nota: Se la concentrazione dello sperma o il volume iniziale è molto elevato, diviso in due tubi al primo lavaggio. - Immediatamente rimuovere e scartare il supernatante chiaro e lasciare circa 1 cm del surnatante sopra il pellet.
- Appoggiare con cura i tubi ad un angolo di 30° per aumentare la superficie per gli spermatozoi di nuotare fino e attendere 20-30 min per consentire gli spermatozoi di nuotare fino a 37 ° C.
Nota: Torbidità può essere visto. - Utilizzando una micropipetta con attenzione, rimuovere il superiore 1 mL del surnatante contenente gli spermatozoi mobili in una nuova provetta da 1,5 mL.
- Mantenere lo sperma a 37 ° C fino all'utilizzo.
- Stimare il numero di spermatozoi utilizzando un emocitometro Neubauer.
Nota: È invece possibile utilizzare una camera di conteggio differente, ma il conteggio è diverso.- Per evitare qualsiasi movimento dello spermatozoo, diluire 100 µ l degli spermatozoi motili con 10 mL di acqua distillata doppia (DDW) (diluizione 1: 100) in una provetta da 15 mL e mescolare delicatamente.
- Caricare 10 µ l di campione in ciascun lato dell'emocitometro e vetrino coprioggetti. Assicurarsi di evitare la formazione di bolle all'interno della camera come questo può provocare un numero di spermatozoi imprecise.
- Osservare sotto un microscopio con un obiettivo X 20.
Nota: La griglia completa su un emocitometro contiene 9 grandi piazze, ciascuna di 1 mm2, e il coprioggetto riposa 0,1 mm sopra il pavimento della camera. Così, il volume sopra la zona centrale di conteggio è di 0,1 mm3 o 0,1 µ l. Zona centrale dell'emocitometro contiene 25 quadrati medi e ogni quadrato medio ha 16 piazze più piccole con linee singole. - Contare il numero totale di cellule che si trovano in 4 quadrati di angolo medio e la piazza centrale. Per una maggiore precisione, conta due camere (entrambi i lati dell'emocitometro Neubauer) e utilizzare la media per calcolare la concentrazione cellulare.
- Calcolare il numero di spermatozoi moltiplicando il numero medio ottenuto da 5 (per ottenere il numero di cellule per la zona di conteggio) e da 10.000 (per ottenere il numero di cellule per 1 mL del campione diluito). Quindi moltiplicare il numero ottenuto per il fattore di diluizione (1: 100).
Nota: Ad esempio, un numero medio di spermatozoi contati in 5 dei 25 quadrati medi all'interno dell'area centrale di conteggio di due alloggiamenti è 150 ([152 + 148] / 2). Così, il numero medio di spermatozoi per camera (o per 0,1 µ l) è 150 x 5 = 750. Moltiplicare 750 di 10.000 per ottenere il numero di cellule per 1 mL del campione diluito (7.500.000) e poi moltiplicare per 100 (fattore di diluizione) per ottenere 75 x 107 cellule per mL di campione di seme originale.
2. tecnica #1: Valutazione simultanea delle membrane degli spermatozoi utilizzando più fluorescente sonde
Nota: Membrane degli spermatozoi (plasma, acrosomale e mitocondriale) sono state valutate come precedentemente descritto da Celeghini et al.10, con alcune modifiche. Epifluorescente microscopia è stata usata, combinato con una videocamera digitale con eccitazione a 450-490 nm ed emissione a 515-565 nm utilizzando un triplo filtro.
-
Preparare soluzioni di riserva.
- Preparate 0,1 mg/mL soluzione stock DAPI sciogliendo 5 mg di DAPI in 50 mL di tampone fosfato salino (PBS). Aliquote di 50 µ l di preparare e conservare a-20 ° C. Prima dell'uso, diluire la soluzione di riserva con PBS alle 01:10 (soluzione di lavoro; 10 µ g/mL).
- Preparare 1 mg/mL soluzione stock FITC – PSA sciogliendo 1mg di FITC – PSA in 1 mL di PBS. Aliquote di 50 µ l di preparare e conservare a-20 ° C. Prima dell'uso, diluire la soluzione di riserva con PBS alle 01:10 (soluzione di lavoro; 100 µ g/mL).
- Preparare soluzione madre 1 mg/mL JC-1 sciogliendo 1 mg di JC-1 in 1 mL di solfossido dimetilico (DMSO). Aliquote di 10 µ l di preparare e conservare a-20 ° C. Prima dell'uso, diluire la soluzione di riserva con DMSO alle 01:10 (soluzione di lavoro; 0,1 mg/mL).
- Preparare la soluzione di riserva di PI sciogliendo 10 mg di PI in 400 µ l di PBS (dando 2,5 mg/mL). Conservare a + 4 ° C. Diluire il magazzino 1 con PBS alle 01:20 (soluzione di lavoro; 0,125 mg/mL). Conservare a + 4 ° C come una soluzione di riserva.
Attenzione: PI è un potenziale mutageno e deve essere maneggiato con cura. Il colorante deve essere smaltito in modo sicuro e in conformità alle normative locali vigenti.
- Trasferire 133 µ l degli spermatozoi mobili (passo 1.5) in una nuova provetta da 1,5 mL (25 x 106 spermatozoi/mL).
Nota: Se la concentrazione del campione è superiore, diluirlo nel buffer NKM per raggiungere la concentrazione necessaria; Se la concentrazione del campione delle swim up campione è inferiore, centrifugare il sopranatante ottenuto dopo il nuoto fino a 1.000 x g per 5 min, rimuovere 0,5 mL del surnatante e contare di nuovo lo sperma. - 17 µ l di DAPI (soluzione di lavoro) e incubare per 10 min a 37 ° C.
- Centrifugare a 1.000 x g per 5 min e scartare il surnatante.
- Per il pellet, aggiungere 100 µ l di tampone NKM.
- Aggiungere 50 µ l di coniugato – PSA, 2 µ l di JC-1 e 3 µ l di PI (soluzioni di lavoro) e incubare per 10 min a 37 ° C.
- Centrifugare a 1.000 x g per 5 min e rimuovere il surnatante.
- Per il pellet, aggiungere 40 µ l di tampone NKM e risospendere pipettando.
- Trasferire 10 µ l di campione a un vetrino, sbavatura e il vetrino coprioggetti.
-
Visualizzare immediatamente di epifluorescenza (uso obiettivo 40x) con un triplo filtro, dotato di una fotocamera digitale e acquisire un'immagine separatamente per ciascun filtro.
Nota: Non c'è alcun significato all'ordine dei filtri visualizzati.- Visualizzare sotto il canale DAPI con eccitazione a 358 nm ed emissione a 461 nm.
- Visualizzare sotto canale FITC per verde monomeri con eccitazione a 450-490 nm ed emissione a 515 – 565 nm.
- Visualizzare sotto il canale di PI per aggregati rossi con eccitazione a 488 nm ed emissione a 590 nm.
- Visualizzare sotto JC-1 rossi aggregati con eccitazione a 559 nm e delle emissioni nella gamma di 574 – 627 nm; JC-1 verde monomeri con eccitazione a 488 nm ed emissione nel range di 500 – 535 nm.
- Unire le tre immagini ricevute dai filtri in formato JPG/JPEG, utilizzando l'opzione "Unisci" del software della fotocamera.
- Aprire l'immagine unita con lo strumento "Paint" e utilizzare l'opzione pennello per contrassegnare gli spermatozoi contati.
-
Classificare gli spermatozoi basati sulla fluorescenza emessa da ogni sonda:
- In generale valutare almeno 200 spermatozoi per vetrino — tutte le cellule appaiono blue (DAPI).
- Valutare la fattibilità contando le cellule morte, che appaiono viola (PI [rosso] + [Blu] DAPI) e calcolare la percentuale di cellule morte (dead cellule/totale contato cellule x 100).
- Valutare lo stato acrosomiale utilizzando il pattern di colorazione fluorescente (FITC – PSA). Calcolare le percentuali dei modelli differenti (acrosoma intatto, danneggiate o reagito cellule/totale contato cellule x 100).
Nota: Membrana acrosomiale danneggiata viene visualizzato come un cappuccio acrosomiale completamente macchiati, verde; ha reagita membrana acrosomiale Mostra residuo verde equatoriale o superiore colorazione; celle contenenti membrana acrosomiale intatta non esporrà qualsiasi colorazione verde della regione acrosomiale. - Valutare ΔΨm distinguendo gli spermatozoi con alta ΔΨm, che esibiscono un midpiece macchiato di rosso e gli spermatozoi con basso ΔΨm che esibiscono un midpiece macchiato di verde. Conte Rosso e verde midpieces separatamente e calcolare il loro rapporto (rosso/verde).
3. tecnica #2: Valutazione delle membrane degli spermatozoi con kit pronti per l'uso e citometria a flusso
Nota: Valutazione dell'integrità della membrana plasmatica, l'integrità di membrana acrosomiale e potenziale di membrana mitocondriale è stato effettuato con kit di citometria a flusso di ready-to-use contenenti liofilizzati fluorocromi in ciascun pozzetto. La procedura è stata eseguita secondo i costruttori con alcune modifiche.
-
Valutazione dell'integrità della membrana plasmatica
- Prendere il numero desiderato di pozzetti dal pacchetto del kit vitalità e concentrazione (PI e SYbr14), trasferiscili sulla base di lavoro e coprire con un coperchio flessibile (proteggere dalla luce).
- 199 µ l di soluzione tamponata per citometria per pozzetto.
- Aggiungere 1 µ l di liquido seminale omogeneo a 57 x 106/ml (57.000 cellule per pozzetto) e omogeneizzare pipettando.
- Coprire la piastra con il coperchio nero.
- Incubare per 10 min a 37 ° C al riparo dalla luce.
- Eseguire l'esempio attraverso il citometro a flusso con la 'vitalità' impostazione.
-
Potenziale di membrana mitocondriale
- Prendere il numero desiderato di pozzetti dal pacchetto di attività mitocondriale kit (JC-1), trasferiscili sulla base di lavoro e coprire con un coperchio flessibile (proteggere dalla luce).
- Aggiungere 10 µ l di etanolo assoluto per pozzetto e pipettare per risospendere la polvere presente all'interno del pozzo.
- Aggiungere 190 µ l di PBS e omogeneizzare pipettando.
- Aggiungere 0,75 µ l di sperma omogeneo a 57 x 106/ml (50.000 cellule per pozzetto) e omogeneizzare pipettando.
- Coprire la piastra con il coperchio nero.
- Incubare per 30 min a 37 ° C al riparo dalla luce.
- Eseguire l'esempio attraverso il citometro a flusso con l'attività di ʽmitochondrial di impostazione '.
-
Integrità della membrana acrosomiale
Nota: FITC – PSA colorazione (Vedi tecnica #1) consente la valutazione delle 3 categorie acrosomiale (acrosoma intatto, reazione acrosomiale e danneggiato acrosomiale). Utilizzando il kit di integrità di acrosomiale (PI e FITC – PNA) e di attuabilità & citometro a flusso, gli spermatozoi sono separati in queste 3 categorie.- Prendere il numero desiderato di pozzetti dal pacchetto di attuabilità & acrosomiale kit di integrità, trasferiscili sulla base di lavoro e coprire con un coperchio flessibile (proteggere dalla luce).
- Aggiungere 200 µ l di soluzione tamponata per citometria per pozzetto.
- Aggiungere 0,7 µ l di sperma omogeneo a 57 x 106/ml (40.000 cellule per pozzetto) e omogeneizzare pipettando.
- Coprire la piastra con il coperchio nero.
- Incubare per 45 min a 37 ° C al riparo dalla luce.
- Eseguire l'esempio attraverso il citometro a flusso con l'impostazione ʽInCyte'.
- Analizzare l'istogramma risultante di gating tre aree del marcatore secondo l'intensità di fluorescenza, che rappresentano le cellule trascurabile, che reagiscono basso con acrosoma intatto, senza macchia (R1), che reagiscono basso cellule con residuo macchiato parte del acrosomiale (R2) e cellule altamente fluorescenti con acrosoma perturbato (R3).
Nota: Utilizzare la sezione "analisi dei file acquisiti utilizzando altri moduli" nella Guida dell'utente di strumento al fine di creare le tre regioni (R1, R2, R3).
4. tecnica #3: Valutazione delle membrane degli spermatozoi, utilizzando sonde fluorescenti e citometria a flusso
Nota: Uso di annessina V combinato con consente di fluorocromi PI apoptosi di valutare e calcolare la percentuale di spermatozoi apoptotici (indice apoptotico).
- Preparare 1 x Annessina V associazione buffer da 20x soluzione madre (diluire 500 µ l di tampone di associazione V 20 x soluzione di riserva con 9,5 mL di acqua distillata sterile di annexin).
- Stimare il numero di spermatozoi utilizzando un emocitometro Neubauer come descritto nella sezione 1.7.
- Lavare 106 spermatozoi in 1 mL di 1x Annessina V associazione buffer e centrifugare a 300 x g per 10 min.
- Aspirare il supernatante completamente.
- Risospendere il pellet in 100 µ l di 1x annessina buffer obbligatorio V.
- Aggiungere 10 µ l di annessina V coniugato di FITC.
- Mescolare bene e incubare per 15 minuti al buio a temperatura ambiente.
- Lavare gli spermatozoi aggiungendo 1 mL di buffer obbligatorio 1 x Annessina V per 106 cellule e centrifugare a 300 x g per 10 min.
- Aspirare il supernatante completamente.
- Risospendere il pellet cellulare in 500 µ l di buffer obbligatorio 1 x Annessina V per 106 cellule totale.
- Aggiungere 1 µ g/mL PI immediatamente prima dell'analisi con un citometro a flusso.
- Eseguire l'esempio attraverso il citometro a flusso impostato su ʽInCyte'.
Risultati
Figura 1 spettacoli fluorimetrica simultanea valutazione delle membrane degli spermatozoi (plasma, acrosomale e mitocondriale) usando PI, DAPI, FITC-PSA e JC-1. Valutazione delle membrane dello sperma usando la macchiatura simultanea con quattro sonde fluorescenti permette, ad esempio, valutare la percentuale di spermatozoi in ogni categoria — live vs morti; alta vs bassa ΔΨm; intatto vs. danneggiato acrosomiale — contemporaneamente per ogni spermatozoo.
Figura 2 presenta risultati di sperma membrana valutazione usando le sonde fluorimetrico. Solo lo sperma che conteneva almeno 80% di spermatozoi mobili sono stati usati nell'esperimento. Almeno 200 cellule sono state esaminate al toro. È stato possibile valutare le differenze nella qualità di campione dello sperma in termini di integrità della membrana. Ad esempio, il liquido seminale del Toro n. 7 aveva una percentuale relativamente bassa di cellule morte, una bassa percentuale di spermatozoi con pseudo reagito acrosomiale e più alta potenziale, rispetto al liquido seminale di bull n. 1 di membrana mitocondriale.
La figura 3 Mostra campioni rappresentativi valutati per redditività (Figura 3A–3C) e l'attività mitocondriale (Figura 3D–3F). Intensità di fluorescenza dei campioni sono stati valutati da un citometro a flusso sperma microcapillary dedicato, con software dedicato. Questo citometro a flusso contiene un laser blu di fase solida (448 nm) e due fotodiodi: forward scatter e dispersione laterale. Esso misura in particolare proprietà di emissione di sperma con tre tubi di fotomoltiplicatore (verde: 525/30 nm, giallo: 583/26 nm; rosso: 655/50 nm) ed accoglie ottiche filtri e splitter16. Permette la valutazione di 5.000 spermatozoi per analisi.
Il kit di valutazione di attuabilità contiene una sonda con permeabilità differenziale praticabile (membrana plasmatica intatta) e sugli spermatozoi morti (membrana plasmatica danneggiata) (Figura 3). ΔΨm di sperma è stata valutata utilizzando un kit che consente di distinguere tra polarizzati membrana mitocondriale (fluorescenza che appare in arancione) e depolarizzate membrana mitocondriale (fluorescenza che appaiono in verde) (Figura 3F).
Figura 4 presenta una valutazione dell'integrità acrosomiale eseguita con il kit di ready-to-use, leggere con la citometria di flusso (figure 4A–4C), dividendo l'istogramma risultante degli spermatozoi con cancello in tre aree del marcatore, che rappresenta le cellule che reagiscono basso trascurabile con acrosoma intatto, senza macchia (R1), che reagiscono bassa delle cellule con residuo macchiato parte del acrosomiale (R2) e altamente che reagiscono cellule con acrosoma perturbato (R3).
La tabella 1 presenta un confronto tra le due tecniche fluorimetriche per valutazione delle membrane degli spermatozoi. Gli stessi campioni di sperma da tre diversi tori sono stati valutati per vitalità, potenziale di membrana mitocondriale (ΔΨm) e l'integrità di acrosomiale utilizzando simultanea colorazione quadruple nonché citometria a flusso. Questo confronto è molto importante, come dimostra i risultati corrispondenti utilizzando ciascuna delle due tecniche. I dati sono stati analizzati da un'analisi e test t di Student. Sono state osservate differenze statisticamente significative.
La figura 5 Mostra un campione rappresentativo valutato per apoptosi utilizzando Annessina V (AV) e fluorocromi di propidio ioduro (PI). Uso di questi due sonde consente di distinguere tra quattro modelli che indica cellule vitali (AV-, PI-), in cellule apoptotiche precoci (AV +, PI-), cellule apoptotiche (AV +, PI +) e cellule necrotiche (AV-, PI +).
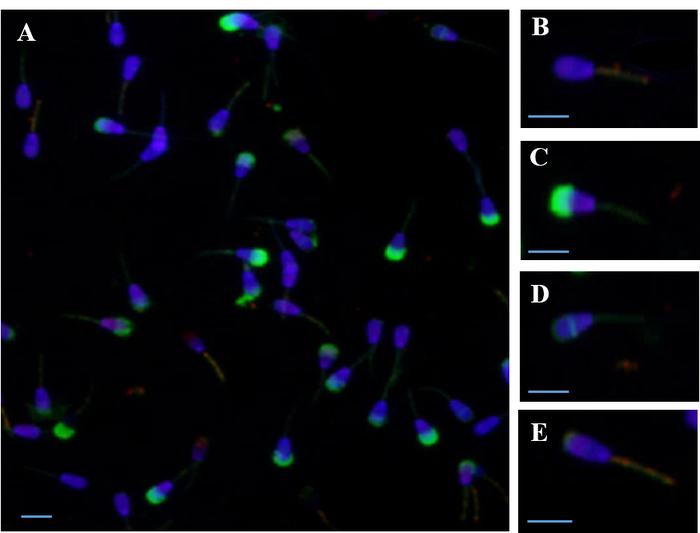
Figura 1: la fotomicrografia epifluorescenza degli spermatozoi macchiato simultaneamente con diverse sonde fluorescenti. (A) simultanee macchiatura con quattro sonde in PI, DAPI, FITC-PSA e JC-1) (B) spermatozoo Live con DAPI la colorazione del nucleo e potenziale di membrana mitocondriale alta (ΔΨm), macchiato con JC-1 sonda. (C) morto spermatozoo con membrana plasmatica danneggiata macchiato con sonda PI, danneggiato acrosomiale macchiato con sonda di FITC-PSA e ΔΨm basso. (D) Live, ha reagito acrosoma spermatozoo con residuo di macchiatura equatoriale e bassa ΔΨm. (E) Live, ha reagito acrosoma spermatozoo con colorazione superiore residua e alta ΔΨm. Barre di scala = 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: valutazione delle membrane di sperma di Toro usando le sonde fluorimetrica. (A) sperma attuabilità è stata determinata con sonde fluorescenti 4', 6-diamidino-2-phenylindole (DAPI) e ioduro di propidio (PI). Acrosoma (B) lo stato è stato determinato secondo modelli di macchiatura FITC-PSA. La percentuale di spermatozoi con reazione acrosomiale sono presentati. (C) potenziale di membrana mitocondriale (ΔΨm) è stata valutata usando con sonda fluorescente JC-1 e presentato come il rapporto tra la percentuale media dei rosso-macchiato (alto potenziale) e macchiato di verde dello sperma (basso potenziale). I dati sono presentati come percentuale delle cellule fuori cellule totali valutate. Almeno 200 spermatozoi sono stati analizzati al toro. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: redditività (A-C) e valutazione di fluorescenza di attività mitocondriale (D-F) di campioni rappresentativi misurata dal cytometer di flusso EasyCyte. Gli istogrammi rappresentano gli spermatozoi ungated e spermatozoi di detriti (A, D), all'ingresso (B, E), distribuzione degli spermatozoi vitali (verde) e cellule morte (rosso) (C) e distribuzione degli spermatozoi a polarizzata (giallo) e depolarizzate ( membrana mitocondriale verde) (F). Barre di scala = 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: valutazione di fluorescenza dell'integrità acrosomiale di campioni rappresentativi misurata dal cytometer di flusso EasyCyte. (A) istogramma di spermatozoi ungated e detriti. (B, C) Istogrammi di spermatozoi gated con valutazione di integrità acrosomiale eseguita con kit di ready-to-use, leggere con impostazione adattata 'InCyte', dividendo l'istogramma risultante di gated spermatozoi in tre aree del marcatore, che rappresenta trascurabile, cellule che reagiscono basso con acrosoma intatto, senza macchia (R1), cellule che reagiscono basso con residuo macchiato parte del acrosomiale (R2) e cellule altamente fluorescenti con interrotto acrosomiale (R3). Barre di scala = 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.
| N ° medio di cellule | Vialbility | Potenziale di membrana mitocondriale | Acrosomiale integrità | ||||||
| Vitali | Morti | Depolarizzato | Polarizzato | Rapporto di rosso/verde | Acrosoma intatto | Reazione acrosomiale | Acrosomiale interrotte | ||
| Macchiatura Quadrupla | 253 | 32,7 ± 1,53% | 67,3 ± 1,53% | 65,7 ± 2,25% | 34,3 ± 2,52% | 0,5 ± 0,06 | 37,3 ± 7,2% | 38,0 ± 5,7% | 24,3 ± 3,0% |
| Flusso Cytomtery | 5.000 | 32,3 ± 2,08% | 67,7 ± 2,08% | 65,0 ± 1,00% | 35.0 ± 1,00% | 0,5 ± 0.02 | 39,5 ± 5,7% | 39,5 ± 6,5% | 21,0 ± 8.0% |
Tabella 1: confronto tra le due tecniche fluorimetriche per valutazione delle membrane degli spermatozoi. Gli stessi campioni di sperma sono stati valutati per la vitalità economica, potenziale di membrana mitocondriale e l'integrità acrosomiale utilizzando macchiatura quadrupla simultanea e citometria a flusso. I dati sono presentati come media ± DS di proporzione delle cellule esaminate, calcolata per 3 repliche.

Figura 5: Annessina V e PI di un campione rappresentativo di fluorescenza misurata da un citofluorimetro. Ungated rappresentano gli istogrammi (A) gli spermatozoi e detriti e (B) distribuzione degli spermatozoi con cancello per primo apoptotica (AV +, PI-), apoptotico (AV +, PI +), vitali (AV-, PI-) e necrotiche (AV-, PI +) cellule. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Potenziale di fertilizzazione dello sperma dipende da molteplici fattori che riflettono la sua qualità. Un'alta concentrazione di spermatozoi e un'alta percentuale di spermatozoi mobili altamente progressivamente potrebbe essere considerati la qualità dello sperma. Tuttavia, tale valutazione non prendere in considerazione altri parametri cellulari e funzionali. L'uso di 'Banco' microcapillary citometro a flusso può essere facilmente adattato alla valutazione delle varie strutture di sperma usando sonde fluorescenti, come precedentemente indicato da altri17 e dimostrato nel presente documento (tecnica n. 3). Ad esempio, sperma acrosomiale integrità è molto importante per l'avvenimento di fecondazione naturale e pertanto, precisa valutazione dello status acrosomale è autorizzata. Tale valutazione può essere eseguita facilmente da classificazione dello stato acrosomiale utilizzando i modelli di colorazione (FITC-PSA, FITC-PNA, vale a dire, tecnica n. 1, come descritto in precedenza) fluorescente1,3. In particolare, è molto importante determinare la percentuale di spermatozoi con acrosoma intatto (cioè, esibisce un innocente acrosomiale) riguardante quelli con acrosoma danneggiato. Con rispetto per lo sperma di quest'ultimo, con acrosoma danneggiato può esibire cap acrosomiali (i) un completamente macchiato, che indica che la membrana sia danneggiata, consentendo la tintura a fluire attraverso la membrana della vescicola acrosomiale; (ii) ha reagito acrosomiale spermatozoi che presentano solo acrosomiale residuo contenuto, che indica che l'AR è già verificato (cioè, pseudo AR). Si deve osservare che tale valutazione può essere eseguita anche con il citofluorimetro dedicato.
Il kit di integrità ready-to-use vitalità & acrosomiale definisce sia la sopravvivenza degli spermatozoi (praticabile o morti) e l'integrità acrosomale (intatto o perturbato). Qui, si consiglia di utilizzare il citometro a flusso dedicato per definire i tre stati di acrosomiali sopraccennati (cioè, intatto, danneggiato, ha reagito). Abbiamo adattato la piattaforma cytometer di flusso microcapillary per la valutazione più accurata, che identifica lo sperma ha reagito acrosomiale (cioè, bassa fluorescenza) mentre loro esclusione da quelli con acrosoma perturbato (alta fluorescenza), piuttosto che la loro inclusione con quelli che hanno un acrosomiale intatta. Questo dà una precisa proporzione di sperma con acrosoma funzionale o non funzionali. Sperma con reazione acrosomiale, nonché a membrana acrosomiale interrotta hanno perso la loro capacità fecondante. Inoltre, un'analisi accurata potrebbe far luce sul meccanismo sottostante alterazione acrosomiale, vale a dire, danneggiato la membrana acrosomiale vs attivazione acrosomiale pseudo.
Abbiamo confrontato i risultati ottenuti con tecnica 1 e tecnica n. 2 e trovato grande compatibilità tra di loro, in particolare nella valutazione della vitalità e ΔΨm (tabella 1). Uno dei vantaggi principali di usando il citofluorimetro dedicato è il gran numero di spermatozoi valutati rispetto al piccolo numero di spermatozoi che vengono valutati in pratica da microscopia di fluorescenza e sonde (migliaia vs centinaia, rispettivamente ). Inoltre, la procedura di quest'ultima è che richiede tempo e soggettivo, anche quando eseguita da un osservatore esperto. Come flusso cytometry rileva solo la fluorescenza delle particelle-collegato, non c'è nessuna necessità di lavare la sonda non associata dalla soluzione, che è una perdita di tempo17. D'altra parte, la valutazione di fluorimetrico delle membrane degli spermatozoi descritto nella tecnica #1 consente valutazione simultanea di più membrane. Siamo stati in grado di utilizzare fino a quattro sonde fluorescenti insieme1,3.
Infine, si noti che il citometro a flusso dedicato è stato sviluppato come un modulo di analisi aperto, fornendo tutti gli strumenti di base per esempio acquisizione e analisi dei dati. La funzione di acquisizione consente la raccolta di vari tipi di informazioni da un campione di cellule e quindi permette un adattamento per una valutazione più accurata, come mostrato qui per indice di status e apoptotici acrosomiale.
In conclusione, le metodologie descritte in questo documento sono molto utili per la valutazione della qualità dello sperma. Esaminando le membrane dello spermatozoo è estremamente importante per determinare la competenza di fertilizzazione dello sperma.
Divulgazioni
Gli autori dichiarano che non esistono senza conflitti di interesse.
Riconoscimenti
Gli autori vorrei ringraziare la società israeliana "SION" per inseminazione artificiale e l'allevamento (Hafetz Haim, Israele) per il loro aiuto e la cooperazione e la sig. ra Li Na (IMV Technologies, L'Aigle, Francia) per assistenza con la messa in funzione e la formazione.
Materiali
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| MOPS [3-N-morphilino propanesulfonic acid] | Sigma | M1254 | |
| PBS | Sigma | P5493 | |
| DMSO | Sigma | D2438 | |
| Ethanol absolute | Sigma | 64-17-5 | |
| Hemacytometer | Neubauer Germany | hemocytometer | |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma | D9542 | fluorescent probe |
| PI (propidium iodide ) | Sigma | P4170 | fluorescent probe |
| FITC-PSA (fluorescein isothiocyanate-conjugated Pisum sativum agglutinin ) | Sigma | L0770 | fluorescent probe |
| JC-1 (5,5',6,6'-tetra-chloro-1,1',3,3'-tetraethylbenzimidazolyl carbocyanine iodide) | ENZOBiochem, New York, NY, USA | ENZ52304 | fluorescent probe |
| Annexin V conjugated to FITC | MACS, Miltenyi Biotec | 130-093-060 | fluorescent probe |
| Annexin V binding buffer 20x stock solution | MACS, Miltenyi Biotec | 130-092-820 | buffer |
| Nikon Eclipse, TE-2000-u | Nikon, Tokyo, Japan | inverted fluorescence microscope | |
| Nis Elements | Nikon, Tokyo, Japan | software | |
| Nikon DXM1200F | Nikon, Tokyo, Japan | digital camera | |
| Guava EasyCyte Plus | IMV Technologies, L'Aigle, France | microcapillary sperm flow cytometer | |
| CytoSoft | Guava Technologies Inc., Hayward, CA, USA; distributed by IMV Technologies | software | |
| Buffered solution for cytometry | IMV Technologies, L'Aigle, France | 023862 | buffer |
| Viability and concentration kit | IMV Technologies, L'Aigle, France | 024708 | kit for viability assessment |
| Mitochondrial activity kit | IMV Technologies, L'Aigle, France | 024864 | kit for mitochondrial activity assessment |
| Viability & acrosome integrity kit | IMV Technologies, L'Aigle, France | 025293 | kit for acrosome integrity assessment |
| JMP-13 | SAS Institute Inc., 2004, ary, NC, USA | software | |
| Bovine sperm | "SION", Israeli company for artificial insemination and dreeding, Hafetz-Haim, Israel |
Riferimenti
- Komsky-Elbaz, A., Roth, Z. Effect of the herbicide atrazine and its metabolite DACT on bovine sperm quality. Reprod Toxicol. 67, 15-25 (2016).
- Gürler, H., et al. Effects of cryopreservation on sperm viability, synthesis of reactive oxygen species, and DNA damage of bovine sperm. Theriogenology. 86 (2), 562-571 (2016).
- Komsky-Elbaz, A., Saktsier, M., Roth, Z. Aflatoxin B1 impairs sperm quality and fertilization competence. Toxicology. 393, 42-50 (2018).
- Beltrán, C., et al. Role of Ion Channels in the Sperm Acrosome Reaction. Adv Anat Embryol Cell Biol. 220, 35-69 (2016).
- Breitbart, H. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol (Noisy-le-grand). 49 (3), 321-327 (2003).
- Almadaly, E., et al. Methodological factors affecting the results of staining frozen-thawed fertile and subfertile Japanese Black bull spermatozoa for acrosomal status. Anim Reprod Sci. 136 (1-2), 23-32 (2012).
- Jankovicová, J., Simon, M., Antalíková, J., Horovská, L. Acrosomal and viability status of bovine spermatozoa evaluated by two staining methods. Vet Hung. 56 (1), 133-138 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histol Histopathol. 24 (8), 999-1007 (2009).
- Whitfield, C. H., Parkinson, T. J. Relationship between fertility of bovine semen and in vitro induction of acrosome reactions by heparin. Theriogenology. 38 (1), 11-20 (1992).
- Celeghini, E. C. C., de Arruda, R. P., de Andrade, A. F. C., Nascimento, J., Raphael, C. F. Practical Techniques for Bovine Sperm Simultaneous Fluorimetric Assessment of Plasma, Acrosomal and Mitochondrial Membranes. Reprod Domest Anim. 42 (5), 479-488 (2007).
- Ramalho-Santos, J., Varum, S., Amaral, S., Mota, P. C., Sousa, A. P., Amaral, A. Mitochondrial functionality in reproduction: from gonads and gametes to embryos and embryonic stem cells. Hum Reprod. 15 (5), 553-572 (2009).
- Eddy, E. M., O’Brien, A. . The spermatozoon. , (1994).
- Gallon, F., Marchetti, C., Jouy, N., Marchetti, P. The functionality of mitochondria differentiates human spermatozoa with high and low fertilizing capability. Fertil Steril. 86 (5), 1526-1530 (2006).
- Espinoza, J. a., Paasch, U., Villegas, J. V. Mitochondrial membrane potential disruption pattern in human sperm. Hum Reprod. 24 (9), 2079-2085 (2009).
- Hüttemann, M., Lee, I., Pecinova, A., Pecina, P., Przyklenk, K., Doan, J. W. Regulation of oxidative phosphorylation, the mitochondrial membrane potential, and their role in human disease. J Bioenerg Biomembr. 40 (5), 445-456 (2008).
- Sellem, E., et al. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology. 84 (9), 1447-1454 (2015).
- Odhiambo, J. F., Sutovsky, M., DeJarnette, J. M., Marshall, C., Sutovsky, P. Adaptation of ubiquitin-PNA based sperm quality assay for semen evaluation by a conventional flow cytometer and a dedicated platform for flow cytometric semen analysis. Theriogenology. 76 (6), 1168-1176 (2011).
- Barrier Battut, I., Kempfer, A., Becker, J., Lebailly, L., Camugli, S., Chevrier, L. Development of a new fertility prediction model for stallion semen, including flow cytometry. Theriogenology. 86 (4), 1111-1131 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon