Method Article
蛍光光度法による精子膜評価技術
要約
精子膜の完全性、精子の受精能力に関連付けられている携帯電話の機能を評価する方法論を紹介します。精子の膜の蛍光光度法による評価のための 3 つの技術について述べる: 高度な精子専用フローサイトメトリー、蛍光顕微鏡、特定の蛍光プローブの同時染色します。方法論を組み合わせることの紹介も。
要約
精子の質を記述する標準的な spermiograms 主、射精量、濃度、運動と進歩的な運動と精子形態の生存率など、生理学的および視覚的パラメーターに基づいています。しかし、これらの評価なしは精液の品質を予測するのに十分です。精子の生存率及び受精可能性の維持は、膜の完全性および細胞内の機能に依存することを考えるこれらのパラメーターの評価は、精子受精能力のより良い予測を可能にするかもしれない。ここでは、蛍光顕微鏡やフローのフローサイトメトリー解析と組み合わせて特定の蛍光プローブを用いた精子の質を評価する 3 つの可能な方法をについて説明します。解析評価 4', 6-diamidino-2-phenylindole を使用して細胞膜の整合性 (DAPI) とヨウ化 propidium (PI)、イソチオ シアン酸共役フルオレスセインを使用して整合性を先膜エンドウ凝集素 (FITC PSA) と5, 5', を使用してミトコンドリア膜の完全性 6、6'-テトラ-クロロ-1, 1', 3, 3'-tetraethylbenzimidazolyl carbocyanine ヨウ化 (JC-1)。また、これらの方法の組み合わせを提示します。例えば、アネキシン V の使用は PI 蛍光色素によりアポトーシスを評価およびアポトーシス精子 (アポトーシス インデックス) の割合を計算すると組み合わせます。精子膜の検討に基づいて、これらの方法論は精子の質を評価するために非常に有用と考えます。
概要
整合性と精子の膜の機能は、精子の生存率と潜在的な受精を示す要因の一部です。細胞膜は、細胞浸透圧平衡1維持、細胞内と細胞外のコンパートメント間の障壁として機能します。プラズマ膜の完全性への損傷を誘発するストレスが恒常性を損なう、生存率及び受精能力削減および細胞死を増やします。例えば、凍結保存は温度変化と浸透圧ストレス2の結果としてその原形質膜への損傷をによる精子の生存率を低減します。我々 は以前報告公開農薬アトラジン、その主要代謝物 diaminochlorotriazine カビ毒アフラトキシン B1 など食品由来汚染物質の低濃度に雄牛の精液精子生存率1,3 を減少させること.これは、破損した細胞膜と細胞の DNA に結合する PI との組み合わせで DAPI で二本鎖 DNA を標識によって決定されました。
精子先体反応 (AR) は、外側の精子膜と先酵素4、5の解放に終って覆う膜の融合を含まれます。これらは、透明帯の浸透とさらに6卵と精子の結合の重要なイベントです。したがって、先膜の完全性の評価は、精液性状と男性の生殖能力7,8,9評価に有用なパラメーターを構成します。いくつかの蛍光灯のテクニックは、精子の整合性、FITC PNA または FITC PSA8,10の検証に適しています。FITC PSA 染色1,3パターンを使用して私たちの以前の研究で、(i) の正確な定義をそのまま精子提供、(ii) 精子膜を破損しているし、(iii) 精子先体反応します。現在のレポートでは、精子専用フローサイトメトリーを使用して精子の状態を評価し、蛍光顕微鏡を使用して、結果を比較します。
ミトコンドリアは、多機能の細胞小器官で、他のもの、ATP 合成、活性酸素種の生産、カルシウム シグナル伝達とアポトーシスの関与です。生理学的な機能不全、男性と女性の不妊を含む変更されたミトコンドリア機能11に関連付けられます。精子のミトコンドリアは、midpiece に配置され、精子運動12で重要な役割を果たします。高のミトコンドリア膜電位 (ΔΨm) は通常の運動性と高い受精能力13に関連付けられてそれをよく受け入れられています。対照的に、低 ΔΨm は活性酸素種の高いレベルに関連付けられてし、受精率14を削減します。それにもかかわらず、様々 な環境物質、例えば内分泌かく乱物質を細胞ストレスを誘発でき、ΔΨm、過分極1,3フリーラジカルと最終的には、生産の増加の一時的な増加につながるアポトーシス15。蛍光プローブ 5, 5', 6, 6'-テトラ-クロロ-1, 1', 3, 3'-tetraethylbenzimidazolyl carbocyanine ヨウ化 (JC-1) により、たとえば、精子 ΔΨm1,3食中毒の毒素の影響を調べること。
生理学的および形態学的パラメーターに基づく標準の spermiograms は精液の品質を予測するのに十分ではありません。正確な方法は、精子の質を確保するため必要があります。ここで、精子の膜の評価に基づく精子の質を決定する 2 つの可能な方法を提供: 特定の蛍光プローブと蛍光顕微鏡、私たち研究1,3に記載されている同時 4 人染色最近既に他のユーザーによって使用されている当研究室において利用される高度な精子専用フローサイトメトリー、16,17,18。
プロトコル
動物福祉のため 1994 イスラエル ガイドラインに従ってすべての実験を行った。牛の精子が人工授精と繁殖のための商業のイスラエルの会社によって提供されました。本研究では 11 の雄牛の射精を行った。
1. 精子サンプル準備
注:手順は、ロス研究室のプロトコル1,3に基づいています。
- 室温で 15 mL チューブに牛精液の約 1-6 mL を取得します。
- 精液の各 1 ml、6 mL の prewarmed (37 ° C) で NKM バッファー (110 mM NaCl、KCl、5 mM 20 mM モップ [3 N morphilino propanesulfonic 酸; pH 7.4]) を追加し、クリアまで上清は 600 x gで 8 分 1-2 回の遠心。
注:場合は精子の濃度または最初のボリュームが非常に高い、最初の洗浄で 2 つの管に分割です。 - すぐに削除しクリアの上澄みを廃棄し、ペレットの上清を約 1 cm を残してください。
- 精子が泳ぐし、精子を 37 ° C で泳ぐことを許可するように 20-30 分を待っての表面積を増やすに 30 ° の角度で管を慎重に傾く
注:濁度を見ることができます。 - 慎重にマイクロ ピペットを使用して、新しい 1.5 mL チューブに運動精子を含む上清の上部 1 mL を削除します。
- 37 ° C で使用するまで精子を維持します。
- ノイバウアー検定を使用して精子の数を推定します。
注:別カウント商工会議所を代わりに、使用できますが、カウントが違います。- 精子の動きを防ぐためには、10 mL の 15 mL チューブの二重蒸留水 (DDW) (1: 100 希釈) 運動性の精子の 100 μ L を希釈、軽く混ぜます。
- 検定と coverslip のそれぞれの側に 10 μ L のサンプルをロードします。不正確な精子数がありますので、チャンバー内の気泡を避けるためにことを確認します。
- 20 X 目的化合物顕微鏡下で観察します。
注:診断上におけるグリッドを含む 9 の大きな正方形、各 1 mm2と、coverglass 0.1 mm の部屋の床の上にかかっています。したがって、中央のカウント領域にボリュームは 0.1 mm3または 0.1 μ L です。中央部、検定を含む 25 の中の正方形でそれぞれの中の正方形、単一行と小さな正方形 16。 - 4 中型角広場、中央広場で見つかった細胞の総数を数えます。高精度、2 つの部屋 (ノイバウアー検定の両側) をカウントし、細胞濃度を計算する平均を使用します。
- (カウント領域あたりのセル数を取得) する 5、(希釈サンプルの 1 ミリリットルあたりのセル数を取得) に 10,000 を得られる平均の数値を乗算することによって精子の数を計算します。希釈倍率 (1: 100) 得られた数を乗算します。
注:たとえば、2 つの部屋の中央のカウント領域内 25 の中の正方形の 5 カウント精子の数の平均値は 150 ([152 + 148]/2)。したがって、商工会議所あたり (または 0.1 μ L あたり) の精子の平均数は 150 x 5 = 750 です。希釈サンプル (7,500,000) の 1 mL あたりのセル数を取得して、元の精液サンプルの mL あたり 75 × 107セルを取得する 100 (希釈倍率) を乗算する 10,000 で 750 を乗算します。
2. テクニック 1: 複数蛍光を用いた精子膜の同時評価プローブします。
注:精子膜 (プラズマ、先とミトコンドリア) Celeghini ら10、いくつかの変更と前述のように評価されました。450-490 nm の励起とトリプル フィルターを用いた 515 565 nm 発光とデジタル カメラと組み合わせて Epifluorescent 顕微鏡が使用されました。
-
貯蔵液を準備します。
- リン酸緩衝生理食塩水 (PBS) の 50 mL の DAPI の 5 mg を溶解して DAPI 原液 0.1 mg/mL を準備します。50 μ L の因数を準備し、-20 ° C で保存使用する前に 1:10 (実用的なソリューション; 10 μ G/ml) に PBS で原液を希釈します。
- 1 mL の PBS の FITC-PSA の 1 mg を溶解して FITC-PSA 原液を 1 mg/mL を準備します。50 μ L の因数を準備し、-20 ° C で保存使用する前に 1:10 (実用的なソリューション; 100 μ g/mL) で PBS で原液を希釈します。
- JC 1 ジメチルスルホキシド (DMSO) 1 mL に 1 mg を溶解して 1 mg/mL JC 1 原液を準備します。10 μ L の因数を準備し、-20 ° C で保存使用する前に 1:10 (実用的なソリューション; 0.1 mg/mL) に DMSO を原液を希釈します。
- PI の原液を準備するには、400 μ L の PBS (2.5 mg/mL を与える) で円周率の 10 mg を溶解します。店で + 4 ° C1:20 (実用的なソリューション; 0.125 mg/mL) で PBS で 1 ストックを希釈します。在庫ソリューションとして +4 ° C で保存します。
注意: PI は、潜在的な変異原物質注意して処理する必要があります。染料は、安全かつ適用される規定に従って処分する必要があります。
- (ステップ 1.5) の運動性の精子の 133 μ L を新しい 1.5 mL チューブ (25 x 106精子/mL) に転送します。
注:サンプル濃度が高い場合、必要な濃度を達成するために NKM バッファーで希釈してサンプルを泳ぐのサンプル濃度が低い場合 1,000 x gで 5 分でを水泳の後得られた上清を遠心分離機、上澄みの 0.5 mL を削除し、再度精子をカウントします。 - DAPI (作業ソリューション) の 17 μ L を追加し、37 ° C で 10 分間インキュベート
- 1,000 x gで 5 分で遠心し、上清を捨てます。
- ペレット、NKM バッファーの 100 μ L を追加します。
- FITC-PSA の 50 μ L、JC 1 の 2 μ L と PI (ソリューションの作業) の 3 μ L を追加し、37 ° C で 10 分間インキュベート
- 1,000 x gで 5 分遠心し、上清を除去します。
- ペレットに NKM バッファーの 40 μ L を追加し、ピペッティングで再懸濁します。
- スライド ガラス、塗抹標本、coverslip に 10 μ L のサンプルを転送します。
-
トリプル フィルター、デジタル ・ カメラで装備と落射蛍光顕微鏡 (使用 40 × 対物) によるすぐに視覚化し、フィルターごとに個別に画像をキャプチャします。
注:可視化フィルターの順序に意味はありません。- 358 nm 励起と 461 放出 DAPI チャネルの下で視覚化する nm。
- 450-490 nm の励起と 515-565 nm 発光緑モノマーの FITC チャンネル下を視覚化します。
- 488 nm で励起と放射 590 赤集計の PI チャネルの下で視覚化する nm。
- JC 1 の下で視覚化 559 nm で 574-627 nm; の範囲で発光の励起と赤の集計JC 1 緑モノマー 488 nm と 500-535 nm の範囲における放射で励起。
- カメラのソフトウェアの「マージ」オプションを使用して、JPG/JPEG 形式でフィルターから受け取った 3 つの画像をマージします。
- 「ペイント」ツールでマージされた画像を開き、ブラシ オプションを使用して、カウント精子をマークします。
-
各プローブの蛍光に基づく精子を分類します。
- スライドごとの少なくとも 200 の精子を一般的に評価 — すべてのセルは青色 (DAPI)。
- 生存率を評価する死んだ細胞をカウントすることによって表示される紫色の (PI 【 レッド 】 + 【 ブルー 】 DAPI) と (死んだ細胞/総カウント セル x 100) 死んだ細胞の割合を計算します。
- 蛍光染色 (FITC-PSA) のパターンを使用して精子の状態を評価します。(そのまま、破損または反応精子細胞/総カウント セル x 100) 別のパターンの割合を計算します。
注:破損した先の膜のように完全に汚された、緑の精子キャップ。反応先膜を示します残留緑赤道または上部の汚損;そのまま先膜を含む細胞の先領域の任意の緑色染色が起きません。 - ΔΨm を評価するには、特徴的な赤いステンド グラス midpiece を表わす高 ΔΨm と精子と緑色に塗られた midpiece を表わす低 ΔΨm と精子。赤と緑の midpieces を個別と (赤/緑) の比率を計算する.
3. すぐに使用できるキットとフローサイトメトリー精子膜テクニック #2: 評価
注:使える - フロー フローサイトメトリー キットを各ウェルに凍結乾燥螢光色素を含む膜の整合性、ミトコンドリアの膜電位と先膜の完全性の評価を行った。プロシージャは、いくつかの変更とメーカーによると行った。
-
膜性評価法
- 生存率と濃度のキット (PI と SYbr14) のパッケージから井戸の必要な数を取る、作業ベースと柔軟なふた付きカバーに転送 (光から保護する)。
- 199 μ L/ウェル フローサイトメトリーのバッファリングされたソリューションを追加します。
- 57 x 106/mL (ウェルあたり 57,000 細胞) で均質な精液の 1 μ L を追加し、ピペッティングによる均質化します。
- 黒ふた付きプレートをカバーします。
- 光から保護されている 37 ° C で 10 分間インキュベートします。
- 流れの cytometer を通じて設定 '生存' のサンプルを実行します。
-
ミトコンドリアの膜電位
- ミトコンドリア活性キット (JC-1) のパッケージから井戸の適切な数を取る、作業ベースと柔軟なふた付きカバーに転送 (光から保護する)。
- ウェルあたりエタノールの 10 μ L を追加し、井戸の内で現在の粉を再懸濁しますにピペットします。
- ウェルあたり 190 μ L の PBS を追加し、ピペッティングにより均質化します。
- 57 x 106/mL (ウェルあたり 50,000 セル) で均質な精液の 0.75 μ L を追加し、ピペッティングにより均質化します。
- 黒ふた付きプレートをカバーします。
- 光から保護されている 37 ° C で 30 分間インキュベートします。
- 設定 ʽmitochondrial 活動の流れの cytometer を介してサンプルを実行 '。
-
先膜の完全性
注:3 精子カテゴリ (そのまま精子、精子先体反応と破損した精子) の評価が可能で FITC-PSA 染色 (テクニック #1 を見る)。フローサイト ・生存精子整合性キット (PI と FITC-PNA) を使用すると、精子は、これらの 3 つのカテゴリーに分かれています。- 生存率・精子の整合性キットのパッケージから井戸の必要な数を取る、作業ベースと柔軟なふた付きカバーに転送 (光から保護する)。
- 200 μ L/ウェル フローサイトメトリーのバッファリングされたソリューションに追加します。
- 57 x 106/mL (ウェルあたり 40,000 セル) で均質な精液の 0.7 μ L を追加し、ピペッティングによる均質化します。
- 黒ふた付きプレートをカバーします。
- 光から保護されている 37 ° C で 45 分間インキュベートします。
- 設定 ʽInCyte の流れの cytometer を介してサンプルを実行 '。
- 蛍光強度に応じて 3 つのマーカー領域をゲーティングによる結果のヒストグラムを分析、残留精子 (R2) の部分を染色と細胞低蛍光そのまま、無染色の精子 (R1) を無視できる、低蛍光セルを表すと高い蛍光セル中断精子 (R3)。
注:(R1、R2、R3) の 3 つの領域を作成するために楽器ユーザー ガイド 』 の「他のモジュールを使用して取得したファイルの分析」セクションを使用します。
4. テクニック 3: 蛍光プローブとフローサイトメトリーを用いた精子膜の評価
注:アネキシン V の使用は、PI 蛍光色素によりアポトーシスを評価およびアポトーシス精子 (アポトーシス インデックス) の割合を計算すると組み合わせます。
- アネキシン V 結合バッファー原液 (アネキシン V 結合バッファー 20 x 9.5 ml の滅菌蒸留水の貯蔵液の希釈 500 μ L) x 20 x 1 を準備します。
- 1.7 のセクションで説明されているようにノイバウアー検定を使用して精子の数を推定します。
- アネキシン V 結合バッファーと 300 x gで 10 分間遠心 x 1 の 1 mL で 106精子を洗浄します。
- 上清を完全に吸引します。
- アネキシン V 結合バッファー x 1 の 100 μ L にペレットを再懸濁します。
- FITC 標識アネキシン V の 10 μ L を追加します。
- よく混合し、室温で暗闇の中で 15 分間インキュベートします。
- 300 × g 10 分間で 1 mL あたり 10 の6セルおよび遠心分離機の x、アネキシン V の結合バッファー 1 を追加することによって精子を洗います。
- 上清を完全に吸引します。
- 1 x アネキシン V 結合バッファー 106合計セルごとの 500 μ L の細胞ペレットを再懸濁します。
- 流れの cytometer で分析の前にすぐに 1 μ g/mL PI を追加します。
- ʽInCyte on 流れの cytometer を介してサンプルを実行 '。
結果
精子膜 (プラズマ、先とミトコンドリア)図 1番組同時蛍光光度法による評価は、PI、DAPI、FITC PSA と JC 1 を使用します。4 つの蛍光プローブの同時染色を用いた精子膜の評価により、たとえば、各カテゴリにおける精子の割合を評価-ライブ対死者;高対低 ΔΨm;そのまま対。精子を破損した — 各精子を同時に。
図 2は、膜評価蛍光プローブを用いた精子の結果を示します。少なくとも 80% の運動精子を含む精液だけは実験で使用されました。ブルあたり少なくとも 200 細胞を調べた。膜の完全性の面で精子サンプルの質の違いを評価することが可能だった。たとえば、雄牛号 7 の射精があった割合が比較的低い精子先体と高いミトコンドリア膜電位、牛第 1 の射精に比べて死んだ細胞の擬似で精子の低い割合が反応しました。
図 3は、生存率 (図 3 a-3 C) およびミトコンドリア活性 (図 3 D-3 f) に評価される代表的なサンプルを示しています。サンプルの蛍光強度は、専用ソフトウェア、専用のマイクロキャピ ラリーの精子流れの cytometer によって評価されました。この流れの cytometer には 1 固相青色レーザーが含まれています (448 nm) および 2 つのフォト ダイオード: 前方散乱、側方散乱。それは具体的には 3 つの光電子増倍管で精子放出特性を測定 (緑: 525/30 nm、黄色: 583/26 nm; 赤: 655/50 nm)、光学フィルターとスプリッター16を収容します。分析あたり 5,000 精子の評価をできます。
生存評価キットには、実行可能な (そのまま膜) と死者 (破損したプラズマ膜) 精子 (図 3) 透水性の差分とプローブが含まれています。精子 ΔΨm は区別するキットを使用して査定されたミトコンドリア膜 (蛍光オレンジで表示される) を偏光し、ミトコンドリア膜 (緑色の蛍光) を脱分極 (図 3 f)。
図 4提案フローサイトメトリー (図 4 a-4 C) と読んですぐ使えるキットで精子整合性の評価 3 つのマーカー領域分割ゲート精子の結果のヒストグラム無視できる低蛍光セルを表すそのまま、無染色の精子 (R1) で残留精子 (R2) の部分を染色と細胞低蛍光と中断精子 (R3) と細胞の高い蛍光を発するします。
表 1は、精子の膜の評価のための 2 つの蛍光光度法による方法の比較を示します。3 つの異なる牛から同じ精子サンプル生存率、ミトコンドリア膜電位 (ΔΨm) および精子整合性同時 4 人染色としてフローサイトメトリーを使用して評価されました。この比較は、2 つの方法のそれぞれを使用して一致する結果を示して、非常に重要です。データは、分析とスチューデントの t 検定で分析しました。統計的に有意な差は認められなかった。
図 5は、アネキシン V (AV) と propidium (PI) ヨウ化蛍光色素を用いたアポトーシスの評価の代表的なサンプルを示しています。これらの 2 つの使用プローブにより早期アポトーシス (AV +、PI-)、(AV +、PI +) 細胞のアポトーシスと壊死細胞 (AV-, π +) (AV-、PI-)、実行可能なセルを示す 4 つのパターンの間で区別します。
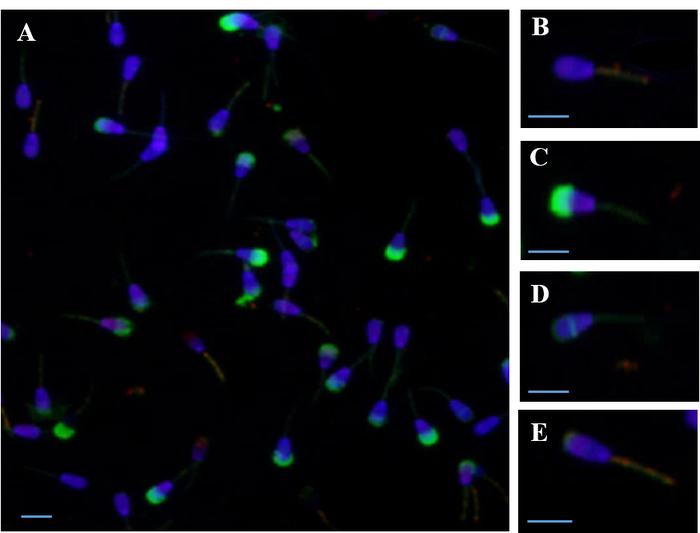
図 1: 精子の落射蛍光ただしは複数の蛍光プローブで同時に染色します。(A) 同時染色 4 プローブ PI、DAPI、FITC PSA と JC 1) JC 1 プローブに染まった核と高のミトコンドリア膜電位 (ΔΨm) の DAPI 染色 (B) ライブ精子。(C) 損傷を受けた細胞膜と死んだ精子は PI のプローブを用いた染色、精子 FITC PSA プローブと低 ΔΨm ステンド グラスを破損します。(D) ライブ、残留赤道染色と低 ΔΨm の精子の先体反応します。(E) ライブ、残留上部染色と高 ΔΨm の精子の先体反応します。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 2: 雄牛の精子の膜の蛍光プローブを用いた評価します。(A) 精子の生存率を明らかにする蛍光プローブ 4', 6-diamidino-2-phenylindole (DAPI) とヨウ化 propidium (PI)。(B) 精子の状態は、FITC PSA 染色パターンに基づいて決定しました。提示は、精子先体反応の割合を占めています。(C) ミトコンドリア膜電位 (ΔΨm) を行った JC 1 蛍光プローブを使用して、赤染色 (可能性が高い) の平均割合比として提示と緑色に塗られた (低電位) 精子。データは、合計評価セルからセルのパーセントとして表されます。ブルあたり少なくとも 200 精子を行った。この図の拡大版を表示するのにはここをクリックしてください。

図 3: EasyCyte フローサイト メーターによる測定 (A ~ C) の生存率と代表的なサンプルのミトコンドリア活性 (D-F) 蛍光評価します。フリンジング精子およびゲートの破片 (A, D)、精子 (B, E)、実行可能な (グリーン) と死者 (赤) 細胞 (C) 精子の分布偏光 (黄色) と脱分極 (精子の分布を表すヒストグラム緑) ミトコンドリア膜 (F)。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 4: 代表的なサンプルの精子整合性の蛍光評価 EasyCyte フローサイト メーターによる測定します。(A) ヒストグラム ungated 精子の残骸。(B、 C)適応設定 'InCyte' は、分割の結果のヒストグラムを読む準備ができて使用するキットで精子整合性の評価とゲートの精子のヒストグラムは、無視できる程度を表す 3 つのマーカー領域に精子をゲートそのまま、無染色精子 (R1) 残留精子 (R2) と高い蛍光セルの部分を染色と低蛍光細胞低蛍光細胞は精子 (R3) を中断しました。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
| 平均のないセルの | Vialbility | ミトコンドリアの膜電位 | 精子の整合性 | ||||||
| 実行可能です | 死者 | 脱分極 | 偏波 | 赤/緑比 | そのまま精子 | 精子先体反応 | 混乱した精子 | ||
| 4 人部屋を汚す | 253 | 32.7 ± 1.53% | 67.3 ± 1.53% | 65.7 ± 2.25% | 34.3 ± 2.52% | 0.5 ± 0.06 | 37.3 ± 7.2% | 38.0 ± 5.7% | 24.3 ± 3.0% |
| Cytomtery を流れ | 5,000 | 32.3 ± 2.08% | 67.7 ± 2.08% | 65.0 ± 1.00% | 35.0 ± 1.00% | 0.5 ± 0.02 | 39.5 ± 5.7% | 39.5 ± 6.5% | 21.0 ± 8.0% |
表 1: 精子の膜の評価のための 2 つの蛍光光度法による手法の比較。同じ精子サンプル生存率、ミトコンドリアの膜電位及び精子整合性同時 4 人染色およびフローサイトメトリーを使用して評価されました。3 複製の計算、検査された細胞の割合 ± SD を意味として、データが掲載されています。

図 5: アネキシン V と PI 蛍光代表的なサンプルのフローサイト メーターで測定します。ヒストグラムを表す (A) アンゲート精子と破片、早期アポトーシス (AV + PI-)、アポトーシス (AV +、PI +) にゲートの精子 (B) 配布可能な (AV-、PI)、壊死 (AV、PI +) 細胞。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
精子の受精の可能性は、その品質を反映した複数の要因に依存します。精子の高濃度と徐々 に高運動性の精子の割合が高い高品質の精液を考慮可能性があります。それにもかかわらず、このような評価、アカウントにとらない他の携帯電話と機能パラメーター。'卓上' マイクロキャピ ラリー流れの cytometer の使用はで先ほど他17本 (法 #3) 蛍光プローブを用いた様々 なの精子構造の評価に容易に適応することができます。たとえば、精子の先体の整合性は非常に成功した自然受精の発生の重要な先の状態の正確な評価を保証するためと。このような評価を蛍光染色 (FITC PSA、FITC PNA、すなわち、技術 #1、前述のよう) のパターンを使用して精子の状態の分類が簡単に実行できる1,3。特に、それはそのまま精子と精子の割合を決定する非常に重要な (すなわち、無染色の精子を展示) 破損した精子とのそれらを基準にしています。破損した精子で後者は、精子に敬意と膜の損傷精子先体小胞の膜を通して流れ込むに染料を有効にすることを示します (i) 完全に汚された先キャップを表わすことができます。(残留精子コンテンツのみ、AR が既に発生したことを示す (すなわち、擬似 AR) を展示 ii) 精子先体反応の精子。それは、このような評価が専用の流れの cytometer で実行することも注意してください。
すぐ使える生存率 & 精子整合性キット (実行可能または死んだ) 両方の精子の生存率を定義しますと先の整合性 (そのまままたは中断)。ここでは、私達は専用フローサイトを使用して 3 つの前述の先ステータスを定義する提案する (すなわち、そのまま、破損している、反応)。我々 はそれらを含むではなく乱れた精子 (高蛍光) とのそれらからそれらを排除しながらより正確な評価に精子先体反応精子 (すなわち、低い蛍光性) を識別するマイクロキャピ ラリー流れの cytometer プラットフォームを適応そのまま精子を持つと。これは、機能または機能しない精子と精子の正確な割合を与えます。精子先体反応として中断先膜と精子は、卵子を受精する能力を失っています。さらに、正確な分析はすなわち精子先体変化の基になるメカニズムに光を当てる可能性があります、擬似精子活性化対精子膜を破損します。
技術 #1 とテクニック #2 で得られた結果を比較し、生存率および ΔΨm (表 1) の評価は特に、それらの間の偉大な互換性を見つけた。使用しての主な利点の 1 つ、専用の流れの cytometer は蛍光顕微鏡とプローブによって実際に評価される精子の数が少ないを基準にして評価した精子の数が多い (対何百、何千人もそれぞれ).また、後者の手順は時間がかかり、主観的経験豊かな観察者によって実行されるときにも。フローサイトメトリーのみ粒子による蛍光を検出する、時間のかかる手順17であるソリューションからバインドされていないプローブを洗浄する必要はありません。その一方で、法 #1 で説明した精子膜の蛍光光度法による評価は、複数膜の同時評価できます。最大で 4 つの蛍光プローブまとめ1,3を使用することができました。
最後に、専用フローサイト サンプル集録とデータ分析のためのすべての基本的なツールを提供するオープン試験モジュールとして開発されたことに注意してください。取込機能細胞サンプルから様々 な種類の情報を収集でき、したがってより正確な評価のための適応精子状態とアポトーシス インデックスのとおり。
結論として、この紙に記載されている方法論、精液性状の評価のため非常に便利です。精子膜を調べることは、精子の受精能力を決定するために非常に重要です。
開示事項
著者は、利害の対立がないことを宣言します。
謝辞
著者は、彼らの助けと協力、計測器のセットアップとトレーニングの支援の李娜 (IMV 技術、l ' aigle、フランス) さんの「シオン」人工授精と繁殖 (Hafetz、イスラエル共和国) のためのイスラエルの会社を感謝したいです。
資料
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| MOPS [3-N-morphilino propanesulfonic acid] | Sigma | M1254 | |
| PBS | Sigma | P5493 | |
| DMSO | Sigma | D2438 | |
| Ethanol absolute | Sigma | 64-17-5 | |
| Hemacytometer | Neubauer Germany | hemocytometer | |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma | D9542 | fluorescent probe |
| PI (propidium iodide ) | Sigma | P4170 | fluorescent probe |
| FITC-PSA (fluorescein isothiocyanate-conjugated Pisum sativum agglutinin ) | Sigma | L0770 | fluorescent probe |
| JC-1 (5,5',6,6'-tetra-chloro-1,1',3,3'-tetraethylbenzimidazolyl carbocyanine iodide) | ENZOBiochem, New York, NY, USA | ENZ52304 | fluorescent probe |
| Annexin V conjugated to FITC | MACS, Miltenyi Biotec | 130-093-060 | fluorescent probe |
| Annexin V binding buffer 20x stock solution | MACS, Miltenyi Biotec | 130-092-820 | buffer |
| Nikon Eclipse, TE-2000-u | Nikon, Tokyo, Japan | inverted fluorescence microscope | |
| Nis Elements | Nikon, Tokyo, Japan | software | |
| Nikon DXM1200F | Nikon, Tokyo, Japan | digital camera | |
| Guava EasyCyte Plus | IMV Technologies, L'Aigle, France | microcapillary sperm flow cytometer | |
| CytoSoft | Guava Technologies Inc., Hayward, CA, USA; distributed by IMV Technologies | software | |
| Buffered solution for cytometry | IMV Technologies, L'Aigle, France | 023862 | buffer |
| Viability and concentration kit | IMV Technologies, L'Aigle, France | 024708 | kit for viability assessment |
| Mitochondrial activity kit | IMV Technologies, L'Aigle, France | 024864 | kit for mitochondrial activity assessment |
| Viability & acrosome integrity kit | IMV Technologies, L'Aigle, France | 025293 | kit for acrosome integrity assessment |
| JMP-13 | SAS Institute Inc., 2004, ary, NC, USA | software | |
| Bovine sperm | "SION", Israeli company for artificial insemination and dreeding, Hafetz-Haim, Israel |
参考文献
- Komsky-Elbaz, A., Roth, Z. Effect of the herbicide atrazine and its metabolite DACT on bovine sperm quality. Reprod Toxicol. 67, 15-25 (2016).
- Gürler, H., et al. Effects of cryopreservation on sperm viability, synthesis of reactive oxygen species, and DNA damage of bovine sperm. Theriogenology. 86 (2), 562-571 (2016).
- Komsky-Elbaz, A., Saktsier, M., Roth, Z. Aflatoxin B1 impairs sperm quality and fertilization competence. Toxicology. 393, 42-50 (2018).
- Beltrán, C., et al. Role of Ion Channels in the Sperm Acrosome Reaction. Adv Anat Embryol Cell Biol. 220, 35-69 (2016).
- Breitbart, H. Signaling pathways in sperm capacitation and acrosome reaction. Cell Mol Biol (Noisy-le-grand). 49 (3), 321-327 (2003).
- Almadaly, E., et al. Methodological factors affecting the results of staining frozen-thawed fertile and subfertile Japanese Black bull spermatozoa for acrosomal status. Anim Reprod Sci. 136 (1-2), 23-32 (2012).
- Jankovicová, J., Simon, M., Antalíková, J., Horovská, L. Acrosomal and viability status of bovine spermatozoa evaluated by two staining methods. Vet Hung. 56 (1), 133-138 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histol Histopathol. 24 (8), 999-1007 (2009).
- Whitfield, C. H., Parkinson, T. J. Relationship between fertility of bovine semen and in vitro induction of acrosome reactions by heparin. Theriogenology. 38 (1), 11-20 (1992).
- Celeghini, E. C. C., de Arruda, R. P., de Andrade, A. F. C., Nascimento, J., Raphael, C. F. Practical Techniques for Bovine Sperm Simultaneous Fluorimetric Assessment of Plasma, Acrosomal and Mitochondrial Membranes. Reprod Domest Anim. 42 (5), 479-488 (2007).
- Ramalho-Santos, J., Varum, S., Amaral, S., Mota, P. C., Sousa, A. P., Amaral, A. Mitochondrial functionality in reproduction: from gonads and gametes to embryos and embryonic stem cells. Hum Reprod. 15 (5), 553-572 (2009).
- Eddy, E. M., O’Brien, A. The spermatozoon. , Raven Press. New York, USA. Knobil and Neill's Physiology of Reproduction; Volume 1 (1994).
- Gallon, F., Marchetti, C., Jouy, N., Marchetti, P. The functionality of mitochondria differentiates human spermatozoa with high and low fertilizing capability. Fertil Steril. 86 (5), 1526-1530 (2006).
- Espinoza, J. a, Paasch, U., Villegas, J. V. Mitochondrial membrane potential disruption pattern in human sperm. Hum Reprod. 24 (9), 2079-2085 (2009).
- Hüttemann, M., Lee, I., Pecinova, A., Pecina, P., Przyklenk, K., Doan, J. W. Regulation of oxidative phosphorylation, the mitochondrial membrane potential, and their role in human disease. J Bioenerg Biomembr. 40 (5), 445-456 (2008).
- Sellem, E., et al. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology. 84 (9), 1447-1454 (2015).
- Odhiambo, J. F., Sutovsky, M., DeJarnette, J. M., Marshall, C., Sutovsky, P. Adaptation of ubiquitin-PNA based sperm quality assay for semen evaluation by a conventional flow cytometer and a dedicated platform for flow cytometric semen analysis. Theriogenology. 76 (6), 1168-1176 (2011).
- Barrier Battut, I., Kempfer, A., Becker, J., Lebailly, L., Camugli, S., Chevrier, L. Development of a new fertility prediction model for stallion semen, including flow cytometry. Theriogenology. 86 (4), 1111-1131 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved