Method Article
Como quantificar a fração de proteínas fluorescentes fotoativo a granel e em células vivas
Neste Artigo
Resumo
Aqui, apresentamos um protocolo que envolve photoactivatable espectralmente distinto geneticamente acoplado e proteínas fluorescentes. Estas quimeras de proteína fluorescente permitam a quantificação da fração de PA-FP que é fotoativo ser fluorescente, ou seja, a eficiência de fotoativação. O protocolo revela que diferentes modos de fotoativação produzem photoactivation diferentes eficiências.
Resumo
Photoactivatable e - proteínas fluorescentes conversíveis (PA-FPs) têm sido utilizadas em microscopia de fluorescência viver-pilha para analisar a dinâmica das células e conjuntos de proteína. Até agora, nenhum método esteve disponível para quantificar a granel e em vivo células expressaram como muitos dos PA-FPs são fotoativo de fluorescência.
Aqui, apresentamos um protocolo envolvendo governantes internos, ou seja, geneticamente acoplado a proteínas fluorescentes espectralmente distintos (photoactivatable), a ratiometrically quantificar a fração de todos os PA-FPs expresso em uma célula que está ligado ao ser fluorescentes. Usando este protocolo, mostramos que os diferentes modos de fotoativação renderam photoactivation diferentes eficiências. Curto photoactivation de alta potência com um laser confocal microscópio (CLSM) resultou em até quatro vezes menor photoactivation eficiência do que centenas de exposições de baixo nível aplicadas por CLSM ou um pulso curto aplicado por widefield iluminação. Enquanto o protocolo tem sido exemplificado aqui para GFP (PA-) e Cherry (PA-), pode em princípio ser aplicado a qualquer par de proteína fluorescente de photoactivatable ou photoconvertible espectralmente distintas e qualquer montagem experimental.
Introdução
Em 2002, o primeiro photoactivatable amplamente aplicável (PA-GFP1) e photoconvertible (Kaede2) proteínas fluorescentes foram descritas. Estas proteínas fluorescentes marcador óptico alterar suas propriedades espectrais após irradiação com luz UV, ou seja, eles tornam-se brilhantes (proteínas fluorescentes photoactivatable, i.e., PA-FPs), ou alterar sua cor (photoconvertible FPs). Até à data, vários reversíveis e irreversíveis photoactivatable e photoconvertible proteínas fluorescentes foram desenvolvidos3,4. Em estudos de conjunto ou a granel, marcadores ópticos têm sido utilizados para estudar a dinâmica de células inteiras ou proteínas e a conectividade dos compartimentos subcellular. Além disso, único-molécula de marcadores ópticos habilitados com base superresolution de imagens técnicas como o PALM5 e FPALM6.
Embora a fotografiaquímica processa durante photoactivation ou - conversão foram descritos para muitos marcadores ópticos e estruturas cristalográficas mesmo antes e após a fotoativação / - conversão foram feitas disponíveis7 , 8, o mecanismofísico subjacente de foto de fotoativação e - conversão não é completamente compreendido. Além disso, até agora só brutas estimativas existem da eficiência de fotoativação e - conversão, ou seja, a fração de proteínas fluorescentes expressado ou seja realmente photoconverted ou fotoativados ser fluorescente. Foram relatados em vitro estudos ensemble quantificar a mudança em espectros de absorção e a quantidade de nativo e ativou a proteína em um gel de9,10,11.
Aqui, apresentamos um protocolo envolvendo quimeras de proteína fluorescente para avaliar a fração de proteínas fluorescentes fotoativo a granel e em células vivas. Sempre que trabalhar com proteínas fluorescentes geneticamente codificadas, a quantidade absoluta de proteínas expressada varia de célula para célula e é desconhecida. Se uma célula expressando um PA-FP mostra um sinal brilhante após a fotoativação do que outra célula, não podem ser diferenciado se este sinal mais brilhante é devido a maior expressão de PA-FP ou uma fotoativação mais eficiente do PA-FP. Para padronizar o nível de expressão nas células, nós introduzimos governantes internos de proteínas fluorescentes espectralmente distintas geneticamente acopladas. Por acoplamento a informação genética de uma proteína fluorescente photoactivatable para um espectralmente distintas sempre-em proteínas fluorescentes, governantes internos são criados que será ainda expressa para um total desconhecido, mas em uma fixa e conhecida a quantidade relativa de 1:1. essa estratégia permite a caracterização quantitativa da luz UV photoactivation esquemas, ou seja, a avaliação da quantidade relativa de PA-FPs, que pode ser fotoativados com diferentes modos de fotoativação e desse modo permite para definir o photoactivation regimes que são mais eficazes do que outros. Além disso, esta estratégia permite em princípio, a avaliação da quantificação absoluta da fração fotoativados PA-FP. Para este fim, é importante perceber que os estudos apresentados ensemble são baseados em intensidade o que torna a análise mais complexos, como previsto no presente protocolo. Parâmetros para determinar a intensidade fluorescente medida, ou seja, brilho molecular diferente, absorvância e espectros de emissão e FRET efeitos, precisam ser considerados ao comparar as intensidades de fluorescência das diferentes proteínas fluorescentes.
Ratiometric apresentado com base em intensidade quantificação dos photoactivation eficiência é exemplificada por PA-GFP e PA-cereja em células vivas, mas em princípio amplamente aplicável e pode ser usada para qualquer proteína fluorescente photoactivatable sob qualquer condição experimental.
Protocolo
1. plasmídeo construção
- Gere a fusão de duas cores sondas. Usar um vetor de expressão de células de mamíferos (ver Tabela de materiais) em que mCherry112 e PA-mCherry113 foram inseridos com a restrição de sites AgeI e BsrGI.
- Ordem personalizada oligo-nucleotídeos para amplificar as variantes monoméricas de eGFP e PA-eGFP contendo a mutação A206K, i.e., mEGFP e PA-mEGFP14 sem um códon de parada como um fragmento BamHI-SalI . Usar o primer do N-terminal 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC mordaça G 3' e o C-terminal da primeira demão 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3' e inserir este fragmento BamHI-SalI o local múltiplo do clonagem do vetor de expressão. Isso criará o vinculador de cinco aminoácidos RNPPV entre a proteína fluorescente verde e vermelho. Vamos nos referir às quimeras fluoróforo como GFP — cereja, PA-GFP — cereja e GFP — PA-cereja para o restante deste artigo.
Nota: O acoplamento de fluorophores e criação de réguas internas para avaliar a eficiência de fotoativação podem ser feitos com qualquer par de fluoróforo espectralmente distintas, por exemplo, superfolder PA-GFP 15/ PA-TagRFP 16, etc. Muitas das proteínas fluorescentes photoactivatable são derivadas de GFP. Portanto, a sequência da primeira demão fornecida acima pode ser usada para muitas proteínas fluorescentes para construir uma fluoróforo Quimera em um vetor de expressão de células de mamíferos.
2. cultura e transfecção de células
- Use qualquer linha de célula padrão tais como HeLa, NRK, Cos-7 ou uma linha celular específico a ser usado para experimentos photoactivation específico. Use DMEM (suplementado com 10% de soro fetal bovino e glutamina 2 mM) e tripsina sem vermelho de fenol (consulte Tabela de materiais) para reduzir a fluorescência de fundo.
- Retirar as células de uma cultura confluente com tripsina, contar o número de células em suspensão de células utilizando uma câmara de Neubauer e semente de 5.000-10.000 células por poço. Alternativamente, use 1 gota de uma pipeta 2 mL de uma suspensão de células de 10 mL de uma cultura de pilha confluentes crescida num frasco de cultura 25-célula T ou 3 gotas de uma suspensão de células de 5 mL de uma cultura confluente crescida num frasco de cultura celular de 12,5 T.
- Desenvolvem-se células em câmaras de 8 poços com tampa #1.0 (ver Tabela de materiais) de vidro para microscopia de fluorescência viver-pilha.
- Transfect células 24h após chapeamento usando reagentes comerciais (ver Tabela de materiais) acordo com o protocolo do distribuidor com o GFP — cereja, PA-GFP — cereja e GFP — quimeras PA-cereja.
- Células de imagem depois de um total de 20 h postar transfeccao para permitir a expressão da proteína, dobramento e maturação.
3. imagem latente e fotoativação
- Células de imagem em uma câmara ambiental umidificada e aquecida a 37 graus Celsius. Para a mídia de célula de buffer no pH fisiológico e renderizá-lo CO2-independente, adicionar 20 mM HEPES, ou usar gás de CO2 conjunto para fluxo de 5%.
- Primeiro, imagem de células expressando o GFP — construção de cereja. Definir parâmetros que definem a intensidade do laser integrado tempo por pixel em uma imagem confocal, ou seja, tempo de interrupção pixel em microssegundos, óptico-acústico sintonizável filtro (AOTF) transmissão em por cento e zoom digital.
Nota: Usar uma objetiva de 60 x e um zoom digital de 3x permite que imagens de uma célula em sua totalidade, proporcionando ampliação suficiente. Definir o tempo de interrupção de pixel para 2-4 μs e AOTF transmissão do laser de 488 nm e 561-nm tal que imagens mostram uma boa relação sinal-ruído sem qualquer branqueamento e nenhum pixel indicando saturação de intensidade de fluorescência. - Imagem, usando o poder do laser conjunto, transmissão de AOTF, tempo de permanência de pixel e zoom digital, 15-20 células expressando GFP — cereja.
- Em seguida, a imagem com o mesmo poder de conjunto do laser, tempo de interrupção de pixel, transmissão AOTF e zoom digital de células expressando GFP — PA-cereja e PA-GFP — cereja. Busca por expressar as células no canal verde ou no canal vermelho, respectivamente. Evite exposição prolongada das células durante a pesquisa para expressar as células para não descorar as proteínas fluorescentes.
- Configure uma série de mini tempo com uma imagem de pré-ativação e três imagens pós-ativação. As imagens pós-ativação ajudará a identificar potenciais Estados escuros transitórios devido a exposição à luz UV.
Nota: Em nossas mãos, mudanças na intensidade de fluorescência detectada devido transientes escuros Estados foram < 1% e pode ser negligenciada, mas esses Estados escuros devem ser avaliados para cada montagem experimental. - Para determinar a eficiência de fotoativação, ou seja, a fração de PA-FPs, que é ligado ao ser fluorescente, nas experiências de fotoativação específicos que já foram criadas, aplicar as mesmas configurações de fotoativação para 15-20 células que estão expressando os governantes internos introduzidos aqui e prosseguir com a análise de imagem (secção 4). Se começar a realizar experiências de fotoativação, encontrar aqui algumas configurações diferentes, com base na nossa experiência experimental com PA-GFP e PA-cereja; Modifique conforme necessário.
- Para photoactivation instantânea de PA-GFP e PA-cereja usando um laser confocal microscópio (CLSM), aplica-se 90 μW de 405 nm laser em 3 ou 5 iterações, respectivamente.
Nota: Com a nossa instalação microscópica, usando uma transmissão AOTM de 38% e um tempo de interrupção de pixel 2 μs, medimos este poder de 405 nm do laser no modo de linha-faça a varredura com a lente objetiva. Com essas configurações, cerca de 8% e 16% dos PA-GFP e PA-cereja expressada podem ser fotoativados ser fluorescente. A série toda titulação usando CLSM para photoactivation instantânea foi anteriormente publicado17. - Se uma fração maior de fotoativados PA-GFP e PA-cereja fluorophores é vantajosa , por exemplo, para alcançar uma maior relação sinal-ruído e photoactivation não tem que ser imediata, aplicar 40 μW de 405 nm laser com um tempo de interrupção μs pixel 2 e 6% Transmissão de AOTF para 450 iterações. Em seguida, photoactivation levará até 4 min em vez de apenas 1-2 segundos, mas eficiência photoactivation para PA-GFP será 29% em vez dos 8%, permitindo uma maior taxa de sinal-ruído.
- Para photoactivation instantânea de PA-GFP e PA-cereja usando um laser confocal microscópio (CLSM), aplica-se 90 μW de 405 nm laser em 3 ou 5 iterações, respectivamente.
- Se um sistema de iluminação digital de mosaico que contém micro espelho matrizes em um modulador espacial de luz disponível, luz laser 405 nm pode ser usado para widefield-photoactivation. Isto permite eficiente photoactivation dentro milissegundos.
Nota: Com 1,6 mW potência do laser, medida na lente objetiva e um tempo de exposição de 250 ms, 29% de PA-GFP pode ser fotoativados ser fluorescente. - Imagem com quaisquer parâmetros de fotoativação conjunto 15-20 células expressando GFP-PA — cereja e GFP — PA-cereja, respectivamente.
- Como pH, espécies reativas de oxigênio e outros fatores ambientais podem influenciar o photoactivation eficiência, pode ser importante avaliar o photoactivation eficiências da PA-FPs no respectivo micromilieu subcellular onde a proteína de interesse é localizado. Por acoplamento as quimeras fluoróforo à proteína de interesse, como os autores têm feito com a membrana plasmática da proteína VSVG 18, photoactivation eficiência pode ser avaliada no compartimento subcelular específico de interesse.
4. análise e algoritmo de imagem para Ratiometric baseado em intensidade quantificação da eficiência Photoactivation
- Análise de imagens pode ser feita com a plataformas ImageJ ou Fiji de processamento de imagem de código aberto. Determine a intensidade de fluorescência do fundo em células não transfectadas no canal vermelho (B2) e verde (B1). Evite perinuclear ou quaisquer áreas mostrando aumento da autofluorescência.
- Para determinar a intensidade de fluorescência em uma célula transfectada, delinear o corpo da célula com a ferramenta de seleções à mão livre. Novamente, evite perinuclear ou quaisquer outras áreas mostrando autofluorescência.
- Subtrai o fundo da intensidade da fluorescência medidos em cada canal.
EuG = IGreen_measured – B1
QueR = IRed_measured – B2 - Use o GFP — construção de cereja para calcular a proporção de vermelho-verde (RtoGr) e corrigir para doador-têmpera devido a transferência de energia de ressonância de fluorescência (FRET). A eficiência FRET E estava determinada a ser 0.3 em experiências anteriores para o GFP — cereja construção usando o mesmo aminoácido vinculador entre os dois fluorophores18.
RtoGr = (euRed_measured – B2) / (euGreen_measured – B1)
RtoGrcorr = RtoGr * (1 – E)
Nota: Nesta abordagem baseada em intensidade, doador têmpera para mEGFP e PA-mGFP pode ser diferente tendo em conta possíveis Propriedades espectrais distintas que não foram caracterizadas. A taxa de FRET (kET) e a distância de Foerster (R0) dependem do rendimento quântico do doador que ainda não foi determinado por mEGFP e PA-mGFP. - Use o GFP — construção de PA-cereja para avaliar a fração de fotoativados PA-cereja. Determinar a intensidade de fluorescência esperado de PA-cereja multiplicando a intensidade de fluorescência verde unquenched medido da GFP — PA-cereja construir prévia de fotoativação com o corrigido vermelho-verde-relação / (RtoGrcorr ).
EuRed_expected = (IGreen_measured – B1) * RtoGrcorr
Nota: Como indicado acima, o brilho molecular o FP sempre-em e o photoactivatable FP pode ser diferente. Consulte a discussão para mais informações sobre como explicar essas diferenças. - Calcule a eficiência de fotoativação de PA-cereja como uma fração do intensidade de fluorescência vermelha medido depois photoactivation e a intensidade de fluorescência esperado no canal vermelho.
(FPA-cereja) = (euRed_measured – B2) / euRed_expected - Use o PA-GFP — construção cereja para avaliar a fração de fotoativados PA-GFP. Determinar a intensidade de fluorescência esperado de PA-GFP, dividindo-se a intensidade de fluorescência vermelha medido do PA-GFP — cereja construir prévia a fotoativação pelo vermelho-verde-relação / (RtoGr). Aqui, o RtoGr não precisa ser corrigido para doador extingue, porque GFP e PA-GFP estão sujeitos a têmpera para a mesma quantidade de doadores.
EuGreen_expected = (euRed_measured – B2) / RtoGr - Calcule a eficiência de fotoativação de PA-GFP como uma fração da fluorescência verde medido intensidade após fotoativação e a intensidade de fluorescência esperado em canal verde.
(FPA-GFP) = (euGreen_measured – B1) / euGreen_expected
Resultados
O protocolo aqui apresentado mostra a ratiometric a quantificação da fração de proteínas fluorescentes que são fotoativados ser fluorescente (Figura 1). Esta fração difere dependendo do modo de fotoativação.
Um resultado típico usando pouco tempo photoactivation de alta potência com um laser confocal microscópio (CLSM) é mostrado na Figura 2C. Depois titulada a potência do laser, medida na lente objetiva pelo pixel habitam tempo e ATOF transmissão, a eficiência máxima photoactivation para PA-GFP foi cerca de 8% e para PA-cereja cerca de 16%. A photoactivation comparativamente baixa eficiência de PA-GFP e PA-cereja pode ser explicada pelo photoactivation simultânea e - destruição quando exposto a um fluxo contínuo de deterministico de fótons por CLSM. A menor vida útil da fluorescência e os espectros de absorção diferentes, direito-deslocados do vermelho PA-FPs pode contribuir para a maior eficiência de fotoativação de PA-cereja comparado ao GFP-PA.
Uso do laser de baixa potência e centenas de iterações, uma maior eficiência de fotoativação pode ser alcançada. 450 iterações da UV-luz entregado um total de 4 min por um CLSM renderam uma eficiência de fotoativação de 29% para PA-GFP (Figura 3C). A maior eficiência de fotoativação com exposição repetitiva fótons de luz UV pode sugerir um processo de várias etapas de fotoativação. Alternativamente, aplicada a luz UV é suficientemente forte para Fotoativar mas não o suficiente para photodestruct que leva cumulativo ao longo do tempo a uma fração maior de proteínas fluorescentes fotoativados.
Com iluminação widefield, os fluorophores são estocàstica e repetidamente expostos a 405 nm os fótons. Aqui, a exposição para apenas 250 ms rendeu uma eficiência de fotoativação de 29% para PA-GFP.

Figura 1: conceito de como determinar a eficiência photoactivation a granel e em pilhas vivas. Por acoplamento a proteínas fluorescentes espectralmente distintas, governantes internos são criados que permitem a ratiometric intensidade avaliação de eficiência de fotoativação. Intensidades medidas de PA-cereja e PA-GFP estavam relacionadas com intensidades esperadas. Esperado de intensidades foram derivadas de determinar a intensidade da fluorescência das sempre-em proteínas fluorescentes no GFP-cereja, cereja-GFP-PA ou quimeras PA-GFP-cereja antes da fotoativação. Figura modificada de Téo e Wunder 201717. Clique aqui para ver uma versão maior desta figura.

Figura 2: a granel photoactivation de PA-GFP-cereja (a) e GFP-PA-cereja (b) como instantaneamente e completamente quanto possível, usando um microscópio confocal de varredura a laser em células vivas. 8% de PA-GFP expressada foi fotoativados com um tempo de interrupção de pixel de 2 μs e uma transmissão de AOTF de 38%, que resultam em poder do laser de 90 μW, medida na lente objetiva e 3 iterações (c). Aumentando a potência do laser 405 nm não aumentar a eficiência de fotoativação. Figura modificada de Téo e Wunder 201717. Clique aqui para ver uma versão maior desta figura.
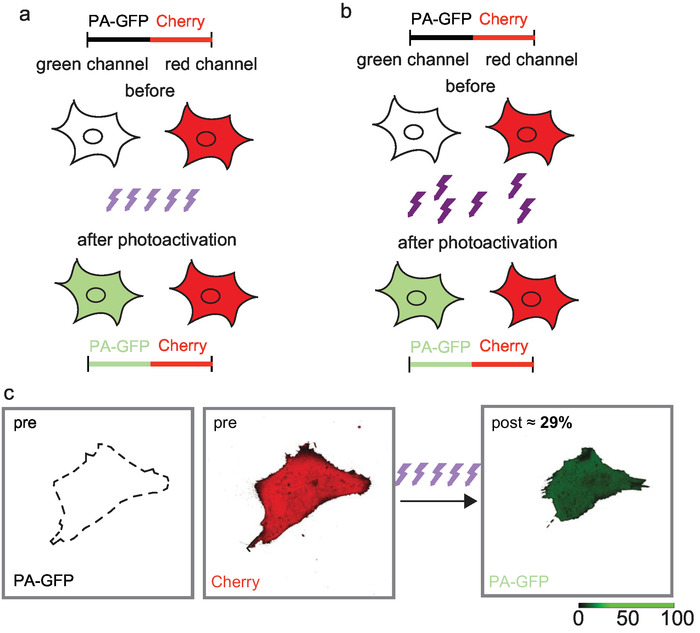
Figura 3: iterativo photoactivation de baixa potência com um microscópio confocal de varredura a laser (a) e curto de alta potência widefield maior photoactivation eficiência de iluminação (b) rendimento. 29% de PA-GFP foi fotoativados com um tempo de interrupção de pixel de 2 μs e uma transmissão de AOTF de 6%, o que resulta em poder do laser de 40 μW, medida na lente objetiva e 450 iterações (c). Figura modificada de Téo e Wunder 201717. Clique aqui para ver uma versão maior desta figura.
Discussão
Até agora, nenhum método existia para determinar a granel a fração de PA-FPs expressado em células vivas que é fotoativo ser fluorescente. O protocolo apresentado pode ser usado para qualquer par de proteína fluorescente espectralmente distintas. Enquanto aqui exemplificada para o irreversível FPs PA PA-GFP e PA-cereja, esta abordagem é, em princípio aplicável às proteínas photoconvertible também. A proteína fluorescente espectralmente distinta, no entanto, deve ser selecionada cuidadosamente para minimizar a sobreposição espectral, dado que photoconvertible proteínas fluorescentes mudar sua absorvância e espectros de emissão, por exemplo, de verde para fluorescência vermelha.
Conforme descrito acima, é importante frisar que a abordagem apresentada é ratiometric e baseada em intensidade. Ele pode ser usado para padronizar o nível de expressão desconhecida nas células e definir as diferenças relativas na eficiência de fotoativação por diferentes modos de fotoativação. O protocolo também pode ser usado para avaliar a fração absoluta de fotoativados PA-FPs. Em seguida, diferentes propriedades espectrais de FPs diferentes precisam ser tomadas em conta.
O brilho molecular (MB) é o produto do rendimento quântico (QY), coeficiente de extinção (CE) e porcentagem absorvância no comprimento de onda de excitação determinado em relação ao pico de absorbância. Para12 de cereja e cereja PA13, respectivos valores de QY e CE foram publicados. Por cento ao valor da absorvância no comprimento de onda de excitação determinado de 543 nm em relação ao pico de absorbância é 0,5 e 0,7, respectivamente.
MBcereja = 0.22 * 72.000 * 0.5 = 7.920
MBCereja PA = 0,46 * 18.000 * 0,7 = 5.796
Assim, o menor brilho molecular de PA-cereja em comparação com cereja pode ter em conta, dividindo euRed_expected por 1,37 (derivado de 7.920/5.796).
No entanto, é desconhecido em que condições photoactivation determinou-se o brilho molecular publicado de PA-cereja. Isto é importante, desde que mostramos aqui que altera o modo de fotoativação medida fração de fotoativados PA-FPs. Além disso, para as versões monoméricas, compreendendo a mutação A206K. ou seja, mEGFP e PA-mEGFP, sem brilho molecular foi publicado.
Nesta abordagem do ratiometric baseado em intensidade, o brilho molecular da PA-FPs e as contrapartes FP sempre-em uma primeira aproximação foram considerados idênticos. Decidimos sobre esta abordagem, desde que (i) para alguns FPs sem brilho molecular tem sido relatado, e (ii) desconhece-se até agora em como distante diferentes modos de fotoativação podem afetar o brilho molecular da PA-FPs relatados na literatura. Além disso, (iii) para uma análise comparativa, o conhecimento do brilho molecular não é necessária; Só é necessário para a determinação baseada na intensidade da fração absoluta de fotoativados PA-FPs, que pode ser calculada como mostrado acima.
Nossa abordagem envolvendo quimeras de proteína fluorescente como governantes internos mostra que diferentes exposição a luz UV produz photoactivation diferentes eficiências. Desse modo, define opções como how to Fotoativar uma maior PA-FP fração e alcançar uma melhor relação sinal-ruído. Além disso, abre-se oportunidades para diferencialmente Fotoativar PA-FPs diferentes na mesma cela dada sua resposta diferencial à luz UV ou a diferencialmente Fotoativar o mesmo PA-FP em diferentes compartimentos subcellular por expô-lo Diferentemente a luz UV. Em resumo, nosso protocolo vai ajudar ainda mais a compreensão quantitativa dos processos celulares usando PA-FPs em microscopia de viver-pilha.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer o laboratório Dorigo e o serviço de Imaging neurociência na faculdade de medicina da Universidade de Stanford para fornecimento de equipamento e espaço para este projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| pEGFP-N1 mammalian cell expression vector | Clontech | ||
| DMEM w/o phenol red | Thermo Fisher Scientific | 11054020 | |
| Trypsin w/o phenol red | Thermo Fisher Scientific | 15400054 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| Fugene 6 | Promega | E2691 |
Referências
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science. 297 (5588), 1873-1877 (2002).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Renz, M., Lippincott-Schwartz, J. Ch. 9. The Fluorescent Protein Revolution Series in Cellular and Clinical Imaging. Day, R. N., Davidson, M. W. , CRC Press. 201-228 (2014).
- Shcherbakova, D. M., Sengupta, P., Lippincott-Schwartz, J., Verkhusha, V. V. Photocontrollable fluorescent proteins for superresolution imaging. Annual Review of Biophysics. , 303-329 (2014).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophysical Journal. 91 (11), 4258-4272 (2006).
- Henderson, J. N., et al. Structure and mechanism of the photoactivatable green fluorescent protein. Journal of the American Chemical Society. 131 (12), 4176-4177 (2009).
- Subach, F. V., et al. Photoactivation mechanism of PAmCherry based on crystal structures of the protein in the dark and fluorescent states. Proceedings of the National Academy of Sciences of the United States of America. 106 (50), 21097-21102 (2009).
- Wiedenmann, J., et al. EosFP, a fluorescent marker protein with UV-inducible green-to-red fluorescence conversion. Proceedings of the National Academy of Sciences of the United States of America. 101 (45), 15905-15910 (2004).
- Habuchi, S., Tsutsui, H., Kochaniak, A. B., Miyawaki, A., van Oijen, A. M. mKikGR, a monomeric photoswitchable fluorescent protein. PLoS One. 3 (12), e3944(2008).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nature Methods. 6 (2), 153-159 (2009).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- Slocum, J. D., Webb, L. J. A Double Decarboxylation in Superfolder Green Fluorescent Protein Leads to High Contrast Photoactivation. Journal of Physical Chemistry Letters. 8 (13), 2862-2868 (2017).
- Subach, F. V., Patterson, G. H., Renz, M., Lippincott-Schwartz, J., Verkhusha, V. V. Bright monomeric photoactivatable red fluorescent protein for two-color super-resolution sptPALM of live cells. Journal of the American Chemical Society. 132 (18), 6481-6491 (2010).
- Renz, M., Wunder, C. Internal rulers to assess fluorescent protein photoactivation efficiency. Cytometry A. , (2017).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Sciences of the United States of America. 109 (44), E2989-E2997 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados