Method Article
如何定量光活化荧光蛋白在大容量和活细胞中的分数
摘要
在这里, 我们提出了一个协议, 涉及基因耦合光谱不同的光可激活和荧光蛋白。这些荧光蛋白嵌合体允许定量的 pa-fp 分数是光活化的荧光,即光活化效率。该协议揭示了不同的光活化模式产生不同的光活化效率。
摘要
荧光和可转换荧光蛋白 (pa-fp) 已被用于荧光活细胞显微镜分析细胞和蛋白质组合的动力学。到目前为止, 还没有方法可以在体积和活细胞中量化有多少 pa-fp 表示的光活化荧光。
在这里, 我们提出了一个涉及内部标尺的协议,即基因耦合光谱分辨 (可光能) 荧光蛋白, 以物理方式量化在被打开的细胞中表达的所有 pa-fp 的分数。荧光。利用该协议, 我们证明了不同的光活化模式产生了不同的光活化效率。利用共聚焦激光扫描显微镜 (clsm) 进行短的大功率光激活, 其光活化效率比 clsm 应用的数百次低电平曝光或宽场照明应用的短脉冲低四倍。虽然该协议已在这里为 (pa-) gfp 和 (pa-) cherry 提供了实例, 但它原则上可以应用于任何光谱上不同的可激活或光可转换荧光蛋白对和任何实验设置。
引言
2002年, 介绍了第一种广泛适用的光致可激活 (pa-gfp1) 和光可转换 (kaede2) 荧光蛋白。这些光学荧光笔荧光蛋白在用 uv 光照射时改变光谱特性,即它们变得明亮 (可发光荧光蛋白,即pa-fp), 或改变其颜色 (可转换光(fp)。到目前为止, 已经开发出了一些可逆和不可逆的光活性和可光可维化荧光蛋白。在集成或体积研究中, 光学荧光笔被用来研究整个细胞或蛋白质的动态, 以及亚细胞隔间的连接性。此外, 光学荧光笔支持基于单分子的超分辨率成像技术, 如 palm5和 fpalm6.
虽然在光活化或转换过程中的光化学过程已经描述了许多光学荧光笔,甚至在光电激活/转换之前和之后的晶体结构已经提供了7,8、光激活和转换的底层照片物理机制尚不完全清楚。此外, 到目前为止, 只有粗略的估计存在光活化和转换的效率, 即实际表示的光转换或光活化为荧光的荧光蛋白的分数。体外整合研究已报告定量的变化, 在一个凝胶9,10,11的吸收光谱和原生和活化蛋白的数量。
在这里, 我们提出了一个协议, 涉及荧光蛋白嵌合体, 以评估光激活荧光蛋白在体积和活细胞中的分数。每当使用基因编码的荧光蛋白时, 所表达的蛋白质的绝对数量因细胞而异, 是未知的。如果一个表示 pa-fp 的单元在光激活后显示出比另一个单元更明亮的信号, 则如果这种更明亮的信号是由于 pa-fp 的更高表达或 pa-fp 的更有效的光激活而导致的, 则无法区分该信号。为了规范细胞中的表达水平, 我们引入了基因耦合光谱不同荧光蛋白的内部规则。通过将光可激活荧光蛋白的遗传信息与光谱上的始终在线荧光蛋白耦合, 生成了仍可表示为未知总量的内部标尺, 但其相对数量固定在一个固定的和已知的相对数量中。1. 这一战略允许对不同的紫外光光活化方案进行定量表征,即评估可以用不同光活化模式进行光活化的 pa-fp 的相对数量, 从而允许定义比其他方案更有效的光激活方案。此外, 这一战略原则上允许对光激活的 pa-fp 分数的绝对量化进行评估。为此, 重要的是要认识到, 所提出的集成研究是基于强度的, 这使得本协议所规定的分析更加复杂。在比较不同荧光蛋白的荧光强度时, 需要考虑确定测量荧光强度的参数,即不同的分子亮度、吸收率和发射光谱以及 fret 效应。
以比例强度为基础的光活化效率定量为例, 说明了在活细胞中的 pa-gfp 和 pa-cherry, 但原则上广泛适用, 可用于任何光活化荧光蛋白。实验条件。
研究方案
1. 质粒结构
- 生成双色融合探头。使用哺乳动物细胞表达载体 (见材料表), 其中 mCherry1和pa-mcherry113 与限制位点 agei 和 bsrgi 一起插入.
- 订购定制寡核苷酸, 以放大含有 a206k 突变的 egfp 和 pa-egfp 的单体变异,即megfp 和 pa-magfp14 , 而没有停止密码子作为sali-bamhi片段。使用 n 端引物 5 '-aat tag tcg acg atg ggg agc agc ggc ggg 3 ' 和 c 端子底漆 5 '-aat ata tgg atc ccg gta cta cag ctc gct gct gct gc 3 ', 并将此sali-bahi片段插入表达载体的多个克隆位点。这将在绿色和红色荧光蛋白之间产生五种氨基酸链剂 rnppv。在本文的其余部分中, 我们将把荧光体嵌合体称为 gfp-chericher-chep-cherichery 和 gfp-cheriry。
注: 荧光耦合和创建内部标尺以评估光激活效率可以通过任何光谱不同的荧光组分对完成,例如超级文件夹 pa-gfp 15/pa-tagrfp 16等. 许多光可活荧光蛋白来源于 gfp。因此, 上面提供的引物序列可用于许多荧光蛋白在哺乳动物细胞表达载体中构建荧光体嵌合体。
2. 细胞培养和转染
- 使用任何标准细胞系, 如 hela、nrk、cos-7 或特定细胞系, 用于特定的光激活实验。使用 dmem (补充10% 的胎牛血清和 2 mm 谷氨酰胺) 和不含苯酚红色的胰蛋白酶 (见材料表) 来减少背景荧光。
- 用胰蛋白酶分离融合培养物的细胞, 用 neubauer 室计算细胞悬浮液中的细胞数量, 每口井播种 5, 000-10, 000个细胞。或者, 使用从一个10-ml 细胞悬浮液的2毫升移液器从一个融合细胞培养生长在 t 25 细胞培养瓶或3滴从5毫升细胞悬浮液从生长在 t 12.5 细胞培养瓶中的融合培养。
- 在8孔室中生长细胞, #1. 0 盖板玻璃 (见材料表), 用于荧光活细胞显微镜。
- 使用商业试剂 (见材料表) 在电镀24小时后通过 gfp-chery-chep-cheriey、pa-gfp-cherry 和 gfp-chepa-cherry 嵌合体协议转染电池。
- 图像细胞经过20小时后转染, 以允许蛋白质表达, 折叠和成熟。
3. 成像和光激活
- 在37摄氏度的加湿和加热的环境室中的图像细胞。要在生理 ph 值下缓冲电池介质并使其与 co2无关, 请添加 20 mm hepes, 或使用 co2 气体设置为5% 的流量.
- 首先, 图像单元表示 gfp-chery 构造。设置参数, 以定义共聚焦图像中每个像素的时间集成激光强度,即微秒像素停留时间、声光可调谐滤波器 (aotf) 传输百分比和数字变焦。
注意: 使用60x 目标和3倍的数字变焦可对整个单元进行成像, 同时提供足够的放大倍率。将488纳米和561纳米激光的像素停留时间设置为2-4 μs 和 aotf 传输, 使图像显示良好的信噪比, 且没有任何漂白, 也没有像素显示荧光强度饱和度。 - 图像, 使用设置激光功率, aotf 传输, 像素停留时间和数字变焦, 15-20 个细胞表示 gfp-chry。
- 然后, 图像具有相同的设置激光功率, 像素停留时间, aotf 传输和数字变焦单元表示 gfp-pa-cherry 和 pa-gfp-chery。分别搜索绿色通道或红色通道中的表达单元格。避免长时间暴露细胞在寻找表达细胞, 以不漂白荧光蛋白。
- 设置一个小型时间序列, 其中包含一个预激活图像和三个激活后图像。激活后的图像将有助于识别由于暴露在紫外光中的潜在瞬态暗态。
注: 在我们手中, 由于瞬态暗态引起的检测到的荧光强度的变化是 & lt;1%, 可以忽略, 但每个实验设置都应评估这些黑暗状态。 - 为了确定光活化效率,即在已经建立的特定光活化实验中, 被打开为荧光的 pa-fp 的分数, 将相同的光活化设置应用于15-20 个细胞,表示此处介绍的内部标尺, 并进行图像分析 (第4节)。如果开始建立光激活实验, 在这里找到一些不同的设置, 基于我们的实验经验, 我们与 pa-gfp 和 pa-cherry;根据需要进行修改。
- 对于使用共聚焦激光扫描显微镜 (clsm) 对 pa-gfp 和 pa-chry 进行瞬时光激活, 分别在3次或5次迭代中应用90μw 的405纳米激光。
注: 通过我们的微观设置, 使用38% 的 aotm 传输和2μs 像素停留时间, 我们在物镜上测量了这种405nm 的线扫描模式下的激光功率。有了这些设置, 大约8% 和16% 的 pa-gfp 和 pa-cherry 表达可以光激活为荧光。使用 clsm 进行瞬时光激活的整个滴定系列此前已发布 17. - 如果较高比例的光激活 pa-gfp 和 pa-chery 荧光灯是有利的,例如, 以实现较高的信噪比, 并且光激活不需要立即, 应用40μw 的405纳米激光与2μs 像素停留时间和6%450个迭代的 aotf 传输。然后, 光激活将需要 4分钟, 而不是只有 1-2秒, 但 pa-gfp 的光激活效率将是 29%, 而不是 8%, 允许更高的信噪比。
- 对于使用共聚焦激光扫描显微镜 (clsm) 对 pa-gfp 和 pa-chry 进行瞬时光激活, 分别在3次或5次迭代中应用90μw 的405纳米激光。
- 如果在空间光调制器中提供包含微反射镜阵列的马赛克数字照明系统, 则可以使用405纳米激光进行宽场光激活。这允许在毫秒内实现高效的光激活。
注: 在物镜上测量 1.6 mw 激光功率, 曝光时间为250毫秒, 29% 的 pa-gfp 可被光激活为荧光灯。 - 具有任何设置光激活参数的图像15-20 个细胞, 分别表示 pa-gfp-chery 和 gfp-chery。
- 由于 ph 值、活性氧种类和其他环境因素可能会影响光活化效率, 因此评估 pa-fp 在各自的亚细胞微环境中的光活化效率可能很重要, 因为这些细胞中的蛋白质是感兴趣的蛋白质。位于。通过将荧光体嵌合体与感兴趣的蛋白质耦合, 就像作者对质膜蛋白 vsvg18所做的那样, 可以在感兴趣的特定亚细胞间中评估光活化效率。
4. 基于比率度的光活化效率量化图像分析与算法
- 图像分析可以通过开源图像处理平台 imagej 或斐济进行。确定绿色 (b1) 和红色 (b2) 通道中非转染细胞的背景荧光强度。避免核外或任何显示增加的自动荧光的区域。
- 要确定转染细胞中的荧光强度, 请使用徒手选择工具勾勒出细胞体的轮廓。同样, 避免核外或任何其他显示自动荧光的区域。
- 从每个通道中测量的荧光强度中减去背景。
ig = i绿色 _ 测量–b1
ir = i红色 _ 测量–b2 - 使用 gfp-cherriy 结构计算红绿比 (rtogr), 并纠正由于荧光共振能量转移 (fret) 而引起的供人淬火。在以前的 gfp-cherry 结构实验中, fret 效率 e 被确定为 0.3, 在两个荧光18之间使用相同的氨基酸链接器.
rtogr = (i红色 _ 测量–b2)/(i绿色 _ 测量–b1)
rtogrcorr = rtogr * (1–e)
注: 在这种基于强度的方法中, 鉴于没有表征的可能不同的光谱特性, megfp 和 pa-mgfp 的供体淬火可能会有所不同。fret (ket) 和 foerster 距离 (r0) 的比率取决于没有确定的 megfp 和 pa-mgfp 供体的量子产率。 - 使用 gfp-pa-cherry 结构来评估光激活 pa-cherry 的分数。通过将 gfp-pa-cherry 结构的测量未淬火绿色荧光强度乘以校正红绿比 (rtogrcorr), 确定 pa-cherry 的预期荧光强度).
i红色预期= (i绿色 _ 测量–b1) * rtogrcorr
注意: 如上所述, 始终在线 fp 和可激活 fp 的分子亮度可能不同。有关如何考虑这些差异的详细信息, 请参阅讨论。 - 计算 pa-cherry 光活化效率, 将其计算为光活化后测量的红色荧光强度和红通道中预期荧光强度的一小部分。
(fpa-樱桃) = (i红色 _ 测量–b2)/i红色 _ 预期 - 使用 pa-gfp-chery 构造来评估光激活 pa-gfp 的比例。通过将 pa-gfp-樱桃结构的测量红色荧光强度除以红绿比 (rtogr) 之前的光活化来确定 pa-gfp 的预期荧光强度。在这方面, rtogr 不需要纠正供体淬火, 因为 gfp 和 pa-gfp 的供体淬火量相同。
i绿色预期= (i红色测量–b2)/rtogr - 计算 pa-gfp 光活化效率, 作为光活化后测量的绿色荧光强度和绿色通道中预期荧光强度的一小部分。
(fpa-gfp) = (i绿色 _ 测量–b1)/i绿色 _ 预期
结果
这里介绍的协议显示了光激活为荧光的荧光蛋白分数的比例定量 (图 1)。此分数因光激活模式的不同而不同。
图 2c显示了利用共聚焦激光扫描显微镜 (clsm) 进行短时间大功率光激活的典型结果。通过像素停留时间和 atof 传输对物镜上测量的激光功率进行滴定后, pa-gfp 的最大光激活效率约为 8%, pa-chry 的最大光激活效率约为16%。pa-gfp 和 pa-cherry 的光活化效率相对较低, 可以用 clsm 在连续确定的光子流中同时进行光活化和破坏来解释。与 pa-gfp 相比, 红色 pa-fp 的荧光寿命较短, 不同的右移吸收光谱可能有助于提高 pa-chery 的光活化效率。
使用低激光功率和数百次迭代, 可以实现更高的光激活效率。由 clsm 在总共4分钟内提供的450次紫外光的迭代, 使 pa-gfp 的光激活效率达到 29% (图 3c)。重复暴露于紫外光光子的光活化效率较高, 可能意味着一种多步骤的光活化过程。或者, 应用的紫外光足够强, 可以进行光激活, 但还不足以进行光毁, 随着时间的推移, 会导致累积到光激活荧光蛋白的更高比例。
通过宽场照明, 荧光体随机和重复地暴露在405nm 光子中。在这里, 仅有250毫秒的曝光对 pa-gfp 产生了29% 的光激活效率。

图 1: 如何确定散装和活细胞中的光活化效率的概念.通过耦合光谱不同的荧光蛋白, 建立了内部标尺, 从而能够对光活化效率进行基于比例强度的评估。pa-cherry 和 pa-gfp 的测量强度与预期强度有关。在光活化之前, 通过测定 gfp-cherry、gfp-pa-cherry 或 pa-gfp-樱桃嵌合时代中始终在线的荧光蛋白的荧光强度, 得出了预期的强度。图从 renz 和 w算第二2.2017 w算. 17.请点击这里查看此图的较大版本.

图 2: 在活细胞中使用共聚焦激光扫描显微镜, 尽可能即时和完全地对 pa-gfp-cherry (a) 和 gfp-pa-cherry (b) 进行批量光激活.8% 的 pa-gfp 表达是光激活的像素停留时间为 2μs, aotf 传输的传输时间为 38%, 导致激光功率为 90μw, 在物镜和3次迭代 (c) 处测量。增加405nm 激光功率并没有提高光激活效率。图从 renz 和 w算第二2.2017 w算. 17.请点击这里查看此图的较大版本.
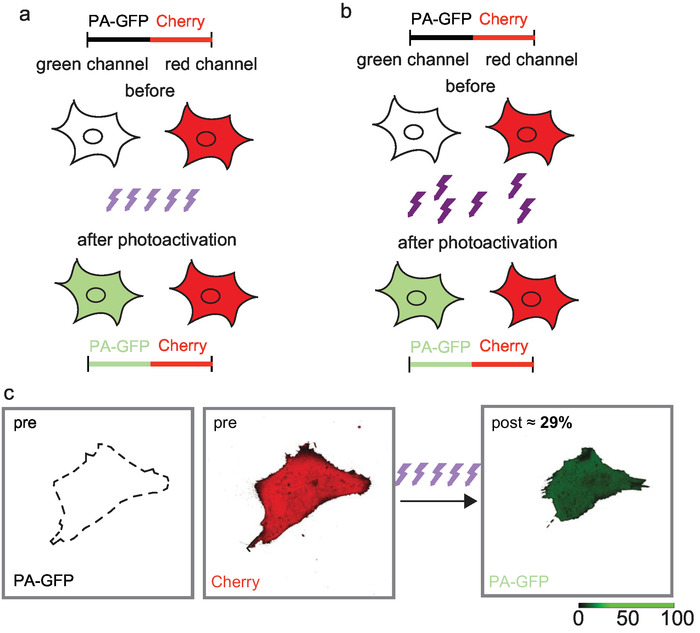
图 3: 迭代低功耗光激活与共聚焦激光扫描显微镜 (a) 和短大功率宽场照明 (b) 产生更高的光激活效率.29% 的 pa-gfp 被光激活, 像素停留时间为 2μs, aotf 传输时间为 6%, 这导致在物镜和450个迭代 (c) 测量的激光功率为40μw。图从 renz 和 w算第二2.2017 w算. 17.请点击这里查看此图的较大版本.
讨论
到目前为止, 还没有方法来批量测定在光活化为荧光的活细胞中表达的 pa-fp 的分数。该协议可用于任何光谱不同的荧光蛋白对。虽然这里的例子是不可逆转的 pa-fp pa-gfp 和 pa-cherry, 但这种方法原则上也适用于光可转换蛋白。然而, 必须仔细选择光谱不同的荧光蛋白, 以最大限度地减少光谱重叠, 因为光可转换荧光蛋白会将其吸收光谱和发射光谱从绿色转移到红色荧光。
如上所述, 必须指出, 所提出的方法是比率和基于强度的。它可以用来规范细胞中的未知表达水平, 并通过不同的光活化模式来定义光活化效率的相对差异。该协议还可用于评估光激活 pa-fp 的绝对分数。然后, 需要考虑不同 fp 的不同光谱特性。
分子亮度 (mb) 是量子产率 (qy)、消光系数 (ec) 和相对于吸收峰的给定激发波长的百分比吸收率的乘积。对于 cherry12和 pa-cherry13, qy 和 ec 的分别值已经公布。相对于吸收峰, 给定激发波长 543 nm 的吸收率分别为0.5 和0.7。
mb 樱桃 = 0.22 * 72, 000 * 0.5 = 7 920
mb pa-cherry = 0.46 * 18, 000 * 0.7 = 5, 796
因此, pa-cherry 与樱桃相比的分子亮度较低, 可以通过将 ired _ 除以1.37 (来自 7920/5796) 来考虑。
然而, 目前尚不清楚在什么光活化条件下已经确定了 pa-cherry 公布的分子亮度。这一点很重要, 因为我们在这里展示了光激活模式改变了光激活 pa-fp 的测量分数。此外, 对于包含 a206k 突变的单体版本。即, megfp 和 pa-megfp, 没有公布分子亮度。
在这种基于比率强度的方法中, pa-fp 的分子亮度与第一近似的始终在线的 fp 对应的分子亮度被认为是相同的。我们决定采用这种方法, 因为 (i) 对于某些 fp, 没有报告分子亮度, (ii) 目前尚不清楚不同的光激活模式在多大程度上可能会影响文献中报告的 pa-fp 的分子亮度。此外, (三) 为了进行比较分析, 不需要对分子亮度的了解;它只需要在强度的基础上确定光激活的 pa-fp 的绝对分数, 可以如上图所示计算。
我们的方法涉及荧光蛋白嵌合体作为内部统治者表明, 不同的暴露于紫外线产生不同的光活化效率。因此, 它将选项定义为如何拍摄更大的 pa-fp 分数, 并实现更好的信噪比。此外, 它还提供了在同一细胞中不同光激活不同 pa-fp 的机会, 因为它们对紫外线的不同响应, 或者通过暴露不同的亚细胞隔间来不同地光激活同一 pa-fp不同的紫外线。总之, 我们的协议将有助于进一步定量了解细胞过程中使用 pa-fp 的活细胞显微镜。
披露声明
作者没有什么可透露的。
致谢
我们要感谢斯坦福大学医学院的多罗实验室和神经科学成像服务机构为这一项目提供了设备和空间。
材料
| Name | Company | Catalog Number | Comments |
| pEGFP-N1 mammalian cell expression vector | Clontech | ||
| DMEM w/o phenol red | Thermo Fisher Scientific | 11054020 | |
| Trypsin w/o phenol red | Thermo Fisher Scientific | 15400054 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| Fugene 6 | Promega | E2691 |
参考文献
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science. 297 (5588), 1873-1877 (2002).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Renz, M., Lippincott-Schwartz, J. Ch. 9. The Fluorescent Protein Revolution Series in Cellular and Clinical Imaging. Day, R. N., Davidson, M. W. , CRC Press. 201-228 (2014).
- Shcherbakova, D. M., Sengupta, P., Lippincott-Schwartz, J., Verkhusha, V. V. Photocontrollable fluorescent proteins for superresolution imaging. Annual Review of Biophysics. , 303-329 (2014).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophysical Journal. 91 (11), 4258-4272 (2006).
- Henderson, J. N., et al. Structure and mechanism of the photoactivatable green fluorescent protein. Journal of the American Chemical Society. 131 (12), 4176-4177 (2009).
- Subach, F. V., et al. Photoactivation mechanism of PAmCherry based on crystal structures of the protein in the dark and fluorescent states. Proceedings of the National Academy of Sciences of the United States of America. 106 (50), 21097-21102 (2009).
- Wiedenmann, J., et al. EosFP, a fluorescent marker protein with UV-inducible green-to-red fluorescence conversion. Proceedings of the National Academy of Sciences of the United States of America. 101 (45), 15905-15910 (2004).
- Habuchi, S., Tsutsui, H., Kochaniak, A. B., Miyawaki, A., van Oijen, A. M. mKikGR, a monomeric photoswitchable fluorescent protein. PLoS One. 3 (12), e3944(2008).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nature Methods. 6 (2), 153-159 (2009).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- Slocum, J. D., Webb, L. J. A Double Decarboxylation in Superfolder Green Fluorescent Protein Leads to High Contrast Photoactivation. Journal of Physical Chemistry Letters. 8 (13), 2862-2868 (2017).
- Subach, F. V., Patterson, G. H., Renz, M., Lippincott-Schwartz, J., Verkhusha, V. V. Bright monomeric photoactivatable red fluorescent protein for two-color super-resolution sptPALM of live cells. Journal of the American Chemical Society. 132 (18), 6481-6491 (2010).
- Renz, M., Wunder, C. Internal rulers to assess fluorescent protein photoactivation efficiency. Cytometry A. , (2017).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Sciences of the United States of America. 109 (44), E2989-E2997 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。