Method Article
センサー蛍光蛋白質生きているセルおよびバルク量を定量化する方法
要約
遺伝的結合スペクトルの光活性化・蛍光タンパク質を含むプロトコルを紹介します。これらの蛍光タンパク質のキメラは photoactivation 効率すなわち、蛍光、するセンサーは、PA FP 端数の数量を許可します。プロトコルでは、光の異なるモードが異なる光効率をもたらすことを明らかにします。
要約
光活性化・転換蛍光タンパク質 (PA FPs) は、細胞やタンパク質のアンサンブルのダイナミクスを分析するため生細胞の蛍光顕微鏡に使用されています。これまでのところ、方法がない一括で定量化されているし、ライブで PA FPs の数を表明した細胞が蛍光を発するにセンサー。
ここでは、内部の支配者を含むプロトコルを提案する、すなわち、遺伝子 ratiometrically に異なるスペクトル (活性型) 蛍光蛋白質を結合するをオンにセルで表されるすべての PA-FPs の割合を数値化蛍光。Photoactivation の異なるモードが異なる光効率を得られたことを示すこのプロトコルを使用して、.共焦点レーザー走査顕微鏡 (CLSM) で短いハイパワー光と CLSM で適用される低レベルの曝露や広視野照明によって適用される短パルスの数百人よりも 4 倍低い光効率までなりました。プロトコルは GFP (PA-) と (PA-) 桜のここで例示していて、間それ原則的に適用できます任意のスペクトルの異なる活性型または蛍光蛍光タンパク質ペアとすべての実験の設定。
概要
2002 年に、最初に広く適用光活性化 (PA GFP1) ・蛍光 (楓2) 蛍光タンパク質が記述されていた。これら光蛍光蛍光タンパク質 UV 光、すなわち照射時にそのスペクトル特性を変更彼らが明るいになる (活性型蛍光蛋白質、すなわち、 PA FPs)、または (蛍光色を変更します。FPs)。日には、いくつか可逆・不可逆的な光活性化・光変換蛍光蛋白質は開発3,4をされています。アンサンブルや一括学全体の細胞やタンパク質のダイナミクスと細胞内コンパートメントの接続を勉強する光蛍光ペンを使用されています。さらに、単一分子光蛍光ペンを有効に基づく超解像イメージング技術のパーム5 FPALM6などです。
中に、写真化学処理が photoactivation の前後には、photoactivation または変換には多くの光の蛍光ペンとも結晶構造について記載されている/- 変換を行われているご利用いただけます7,8、光変換の基になる写真物理機構が完全に理解されていません。さらに、これまでだけ粗見積もり存在の photoactivation、変換の効率は、つまり蛍光タンパク質の割合実際に photoconverted または蛍光するセンサー。吸収スペクトルとネイティブの量の変化を定量化し、ゲル9,10,11にタンパク質を活性化、アンサンブルin vitro研究が報告されています。
ここでは、蛍光タンパク質センサー蛍光タンパク質一括と生きている細胞の割合を評価するためにキメラを含むプロトコルを提案する.遺伝子符号化された蛍光蛋白質を使用、必ずタンパク質の絶対量は細胞から細胞への変化し、は知られています。PA FP を表現する 1 つのセルは他のセルよりも光後明るい信号を示している場合、この明るい信号 PA FP の高い表現や PA FP のより効率的な photoactivation のためが場合区別することはできません。細胞で発現レベルを標準化するには、遺伝子結合スペクトルの異なる蛍光蛋白質の内部支配者を紹介します。カップリング、スペクトルの異なる常に蛍光蛋白質、内部支配者活性型蛍光タンパク質の遺伝情報が作成されますが、まだ表現される未知の合計量ですが固定かつ知られている相対的な量1:1. この方法により別紫外線 photoactivation のスキーム、すなわち定量化の photoactivation、異なるモードでセンサーをすることができます、それによって許可 PA FPs の相対的な量の評価他の人よりも効果的 photoactivation スキームを定義します。さらに、この戦略は、原則として、センサー PA FP の端数の絶対定量評価をできます。このためには、実現するために提示されたアンサンブル研究強度に基づくこのプロトコルより複雑な解析になる重要です。蛍光強度、すなわち、別の分子の明るさ、吸光度発光スペクトルとフレットの効果を決定するパラメーターは、異なる蛍光タンパク質の蛍光強度を比較するときに考慮する必要があります。
光効率の提示のレシオ メトリック強烈さベース定量化 PA GFP および生きているセルの PA 桜の例示しますが、原則として広く適用といずれかに任意の活性型蛍光タンパク質に使用できます。実験の条件。
プロトコル
1. プラスミド構築
- 2 色のフュージョン プローブを生成します。哺乳動物細胞発現ベクターを使用 (材料の表を参照) を mCherry112と PA mCherry113制限に挿入されているサイトの上井とBsrGI 。
- EGFP と A206K の突然変異、すなわちmEGFP、 SalI 病原フラグメントとして停止コドンせず PA mEGFP14を含む PA eGFP の単量体のバリエーションを増幅するためのカスタムのオリゴヌクレオチドを注文します。5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC ギャグ G 3' と C 末端プライマー 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC 猫 GC 3' N 末端のプライマーを使用し、このサリ病原発現ベクターの多重クローニング サイトに挿入します。赤と緑の蛍光蛋白質間の 5 アミノ酸リンカー RNPPV が作成されます。GFP として fluorophore キメラを我々 が参照してください-桜、PA GFP-チェリーおよび GFP-PA-桜この記事の残りのため。
注: fluorophores の結合と光効率を評価するために内部の支配者の作成することができる、任意の波長の異なる蛍光体のペア、例えばsuperfolder PA GFP 15/ PA TagRFP 16等活性型蛍光タンパク質の多くは、GFP から派生します。したがって、多くの蛍光蛋白質の場合、哺乳動物細胞発現ベクターの fluorophore キメラを作成する前述のプライマー シーケンスを使用できます。
2. 細胞培養とトランスフェクション
- Hela 細胞の NRK、Cos 7 または特定のセル行特定 photoactivation の実験に使用されるなどどちらか任意の標準的な細胞ラインを使用します。DMEM (10% 牛胎児血清と 2 mM グルタミン) およびトリプシンなければフェノールレッドを使用 (材料の表を参照) バック グラウンド蛍光を抑える。
- トリプシンと合流文化の細胞をデタッチ、ウェルあたりノイバウアー チャンバーと 5,000-10,000 の種細胞を使用して細胞懸濁液内のセルの数をカウントします。また、T 25 細胞培養フラスコまたは T 12.5 細胞培養フラスコ栽培合流文化から 5 mL 細胞懸濁液から 3 滴成長してコンフルエントの細胞培養から懸濁液 10 mL セル 2 mL ピペットの 1 滴を使用します。
- #1.0 カバーが付いている 8 よく部屋のセルを育てる生細胞の蛍光顕微鏡用ガラス (材料の表を参照してください)。
- GFP とディストリビューターのプロトコルごと (材料の表を参照してください), 市販試薬を使用してめっき後 24 時間のセルを transfect、チェリー、PA GFP-チェリーおよび GFP-PA チェリー キメラ。
- 20 h の合計後イメージ セルの記事を可能にする蛋白質の表現, 折りたたみ, 成熟トランスフェクション。
3. イメージングと光
- 摂氏 37 度で加湿と加熱環境区域の画像セル。生理的 pH で携帯メディアをバッファーし、それに CO2をレンダリングする-独立、20 ミリメートル、HEPES を追加または CO2ガス 5% フロー設定を使用します。
- 最初、GFP を発現する細胞のイメージ-桜の構築。コンフォーカル画像、すなわち、マイクロ秒単位での滞留時間をピクセル、% とデジタル ズームで音響光学波長可変フィルター (AOTF) 伝送ピクセルあたり時間集積レーザの強度を定義するパラメーターを設定します。
注: 60 x 目的と 3 倍のデジタル ズームを使用して十分な倍率を提供しながらそのままの状態で細胞のイメージングが可能します。画像は、任意の漂白なし良い信号対雑音比を表示するよう、蛍光強度の飽和を示すないピクセル 2-4 μ s と 488 nm および 561 nm レーザー AOTF 伝送するピクセルのドウェル時間を設定します。 - 画像、細胞が gfp 15 ~ 20 個セット レーザー パワー、AOTF 伝送、ピクセル滞留時間、デジタル ズームを使用して-チェリー。
- その後、同じセット レーザー パワー、ピクセル滞留時間、AOTF 伝送とデジタル ズーム細胞が gfp とのイメージ-PA チェリーと GFP の PA-チェリー。緑のチャネルまたは赤のチャネル内のセルをそれぞれ表現するを検索します。蛍光タンパク質を漂白するために細胞を表現するため検索時にセルの長い露出を避けてください。
- ミニ時系列事前ライセンス認証イメージが 1 つと 3 つのアクティブ化後の画像を設定します。ライセンス認証後の画像は、紫外線への露出のための潜在的な一時的な暗い状態を特定しやすくなります。
注: 私たちの手で一時的な暗い状態により検出された蛍光強度の変化は、< 1% かもしれないと放置が、すべての実験の設定のそれらの暗い状態が評価されるべき。 - 光効率を決定するなどが既に確立されている、特定の photoactivation の実験で、蛍光するつけ PA-FPs の割合 15-20 のセルに同じの photoactivation 設定を適用します。ここで紹介した内部の支配者を表現しているし、画像解析 (セクション 4) に進みます。Photoactivation の実験を設定する場合は、ここで見つけるいくつかの異なる設定の実験的経験に基づいて PA GFP と PA の桜。必要に応じてを変更します。
- PA GFP と PA チェリー共焦点レーザ走査顕微鏡 (CLSM) の瞬時 photoactivation の 405 nm レーザ 3 または 5 のイテレーションで光の 90 μ W をそれぞれ適用されます。
注: 私達の顕微鏡のセットアップと 38% だめ伝送と 2 μ s 画素のドウェル時間を使用して測定したこの 405 nm レーザー出力の対物レンズでライン スキャン モードで。これらの設定で約 8% と 16% PA GFP と PA-チェリーを表明したは、蛍光するセンサーをすることができます。瞬時の photoactivation をされている共焦点レーザー顕微鏡を使用して全体の滴シリーズは以前17公開。 - 場合はセンサー PA GFP と PA 桜 fluorophores の高い割合は、有利であるなど高い信号対雑音比を達成するために、即時に光はありません適用 405 nm レーザ光 2 μ s 画素の滞留時間と 6% の 40 μ WAOTF 450 イテレーション用トランス ミッション。それから、photoactivation は 1-2 秒だけではなく最大 4 分かかりますが PA GFP の photoactivation 効率 8% より高い信号対雑音比を可能にするのではなく 29% となります。
- PA GFP と PA チェリー共焦点レーザ走査顕微鏡 (CLSM) の瞬時 photoactivation の 405 nm レーザ 3 または 5 のイテレーションで光の 90 μ W をそれぞれ適用されます。
- 空間光変調器のマイクロ ミラー アレイを含むモザイク デジタル照明システムが利用可能な場合、405 nm レーザー光は広視野 photoactivation を使用できます。ミリ秒以内で効率的な光が可能になります。
注: 1.6 mW レーザーの力で対物レンズおよび 250 ms の露光時間を基準として、PA GFP の 29% は蛍光するセンサーをすることができます。 - 任意設定の photoactivation パラメーターと PA GFP を発現する 15-20 細胞のイメージ-桜と GFP-PA-桜、それぞれ。
- PH、活性酸素種および他の環境要因は、光効率に影響を与える可能性があります、ためにことがありますそれぞれの細胞 micromilieu の PA FPs の光効率を評価するために重要な興味の蛋白質があります。位置しています。Fluorophore キメラを興味の蛋白質に結合して、細胞膜タンパク質 VSVG 18著者らが行っているよう、興味の特定の細胞内コンパートメントに光効率を評価できます。
4. 光効率レシオ メトリック強度に基づく定量化の画像解析とアルゴリズム
- オープン ソース画像処理 ImageJ やフィジーのプラットフォームと画像解析を行うことができます。緑 (B1) と赤 (B2) チャネルの非 transfected セル背景の蛍光強度を決定します。核や高められた自動蛍光を示す任意の領域を避けるため。
- Transfected セルで蛍光強度を決定するには、フリーハンド選択ツールと細胞体の概要します。もう一度、核や自動蛍光性を示す他のエリアを避けてください。
- 各チャンネルで測定した蛍光強度から背景を減算します。
私はG =Green_measured -B1
私はR =Red_measured -B2 - GFP を使用 — 桜構造を赤緑の比 (RtoGr) を計算し、蛍光共鳴エネルギー移動 (FRET) のためのドナー-焼入に修正します。FRET 効率 E は、GFP の前の実験で 0.3 に決定された-2 フルオロ18間同じアミノ酸のリンカーを使用して桜の構築。
RtoGr = (私Red_measured -B2)/(私Green_measured -B1)
RtoGrcorr RtoGr を = * (1-E)
注: この強度ベース アプローチで mEGFP の PA mGFP 焼入れドナー異なる場合があります特徴付けされていない可能の異なるスペクトル特性を与えられました。フレット (kET) 率とフォースター距離 (R0) は、mEGFP と PA mGFP の決定されていないドナーの量子収率に依存します。 - GFP を使用 — センサー PA チェリーの割合を評価するために PA チェリー構築。GFP の測定消されていない緑色の蛍光強度を乗じて PA チェリーの期待される蛍光強度を決定する — PA 桜を前に、修正された赤に緑-比の photoactivation 構築 (RtoGrコアー).
私はRed_expected = (IGreen_measured -B1) * RtoGrコアー
注: 前述のように、常に FP、FP 活性型の分子の明るさが異なる場合があります。これらの違いを考慮する方法の詳細については、ディスカッションを参照してください。 - 測定赤蛍光強度後photoactivation と赤のチャンネルに期待される蛍光強度の一部として PA 桜光効率を計算します。
(FPA チェリー) = (私Red_measured -B2)/私Red_expected - PA GFP を使用 — センサー PA GFP の割合を評価するために桜の構築。PA GFP の測定の赤蛍光強度で割って PA GFP の予想される蛍光強度を決定-チェリーを構築、赤に緑-比 (RtoGr) によって事前に光。ここで、RtoGr は、GFP と PA GFP 焼入同量をドナーの対象となりますので、焼入れ、ドナーに修正する必要はありません。
私Green_expected = (私Red_measured -B2)/RtoGr - 測定された緑の蛍光性の強度後光と緑のチャンネルで予想される蛍光強度の一部として PA GFP 光効率を計算します。
(FPA GFP) = (私Green_measured -B1)/私Green_expected
結果
ここで提示されたプロトコルは、センサー蛍光する蛍光タンパク質の分画のレシオ メトリック定量化を示しています (図 1)。この画分は、光のモードによって異なります。
共焦点レーザー走査顕微鏡 (CLSM) で短時間高出力の photoactivation を使用して典型的な結果を図 2 cに示します。レーザー出力のピクセルで対物レンズにて測定を滴定した後に住む最大の photoactivation 効率、ATOF 伝送時間 PA GFP は約 8%、PA-さくらんぼの約 16%。PA GFP と PA チェリーの比較的低い光効率は、同時の photoactivation と CLSM で光子の連続的な確定的なストリームに露出されたときの破壊によって説明されるかもしれない。短い蛍光寿命と赤、右シフトの異なる吸収スペクトル PA FPs PA チェリー PA GFP と比較しての高い光効率に貢献するかもしれない。
低いレーザー力およびイテレーションの数百を使用して、高い光効率を実現できます。紫外線 4 分の合計で、CLSM で配信の 450 イテレーション PA GFP (図 3 c) の 29% の光効率が得られました。紫外線光子への反復暴露で高い光効率は多段光プロセスを提案するかもしれない。また、応用の紫外線は十分な photoactivate が photodestruct センサー蛍光蛋白質の高い割合を時間の経過と共に累積的なリードをするには不十分に強い。
広視野照明、405 nm 光子に、フルオロを確率的繰り返し公開します。ここでは、250 ms のみの露出 PA GFP の 29% の光効率が得られました。

図 1: 生きているセルおよびバルク光効率を決定する方法の概念。スペクトルの異なる蛍光蛋白質を結合することによって光効率のレシオ メトリック強度に基づく評価を可能にする、内部支配者が作成されます。PA チェリーと GFP の PA の測定強度期待強度に関連していた。予想される強度由来 GFP チェリー、GFP PA チェリー、PA GFP チェリー キメラ photoactivation の前に常に蛍光タンパク質の蛍光強度を決定します。図レンツ ・ ヴィンダー 2017年17からに変更されました。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 一括 PA-GFP-桜 (、) の photoactivation および GFP PA チェリー (b) と瞬時に、完全に生きているセルの共焦点のレーザー スキャンの顕微鏡を使用して可能な限りします。PA GFP 発現の 8% は 2 μ s のピクセルの滞留時間と対物レンズおよび 3 イテレーション (c) を基準として 90 μ W のレーザは、38% の AOTF トランス ミッション センサーだった405 nm レーザー パワーを増加しても、光効率は増加しなかった。図レンツ ・ ヴィンダー 2017年17からに変更されました。この図の拡大版を表示するのにはここをクリックしてください。
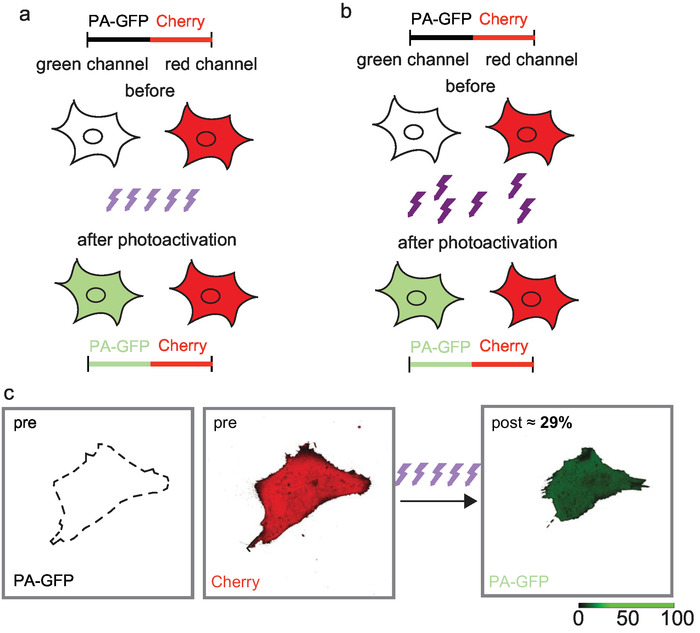
図 3: 共焦点レーザー走査顕微鏡 (a) と短い高出力広視野照明 (b) 収量高い光効率で反復的な低消費電力の photoactivation 。PA GFP の 29% は 2 μ s のピクセルの滞留時間と 40 μ W のレーザは、対物レンズおよび 450 イテレーション (c) を基準として、6% の AOTF トランス ミッション センサーだった図レンツ ・ ヴィンダー 2017年17からに変更されました。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
これまでのところ、PA-FPs の生きている細胞に発現する蛍光センサーである分数を一括で確認する方法は存在しません。提案するプロトコルは、任意の波長の異なる蛍光タンパク質ペアに対して使用できます。PA FPs PA GFP と PA 桜の不可逆的にここで代表される、このアプローチは、蛍光タンパク質を同様に適用可能な原則です。しかし、波長の異なる蛍光タンパク質はことを考えると光変換蛍光タンパク質シフト吸光度、発光スペクトル、例えば緑から赤の蛍光スペクトルの重複を最小限に抑えるため慎重に選択する必要があります。
上述のように、それは提示されたアプローチがレシオ メトリックであることを明記することが重要と強烈さベースです。Photoactivation の異なるモードがセルで未知の表現レベルを標準化および光効率の相対的な違いを定義する使用できます。プロトコルは、PA FPs センサーの絶対の割合を評価するためにも使用できます。その後、異なる FPs の異なるスペクトル特性は考慮する必要があります。
分子の明るさ (MB) は、量子収率 (QY)、消散係数 (EC) およびパーセント吸光度吸光度のピークを基準にして指定された励起波長の製品です。桜12と PA 桜13QY と EC の各値が公開されています。543 nm 吸光度のピークに対する特定の励起波長でパーセントの吸光度は、それぞれ 0.5 と 0.7、です。
MBチェリー = 0.22 * 72,000 * 0.5 = 7,920
MBPA チェリー = 0.46 * 18,000 * 0.7 = 5,796
したがって、PA チェリー チェリーと比較しての低分子明るさアカウントに私を割ることによってRed_expectedでとれる 1.37 (7,920/5,796 から派生)。
ただし、PA 桜の公開された分子の明るさを決定光条件の下で知られているがないです。Photoactivation のモード変更センサー PA FPs の測定の一部で、ここで示すので、これは重要です。さらに、単量体の A206K 突然変異を含みます。すなわちmEGFP、PA-mEGFP 分子の明るさが公開されています。
このレシオ メトリックの強烈さベース アプローチで PA FPs の分子の明るさと最初の近似で常に FP 対応検討されている同一。このアプローチにしましたのでいくつかの FPs のために (i) 分子の明るさは報告されていないと (ii) はこれまで不明だ方法まで photoactivation の異なるモードが分子の明るさに影響文献で報告された PA FPs。さらに、(iii) の比較解析分子の明るさの知識は必要ありません。それは強度に基づくセンサー PA - 上記のように計算することができます FPs の絶対割合の決定にのみ必要です。
内部支配者として蛍光タンパク質キメラを含む我々 のアプローチは、UV ライトに異なる露出が異なる光の効率をもたらすことを示しています。これにより、photoactivate 大きい PA-FP 分画する方法としてオプションを定義しより良い信号対雑音比を達成するため。さらに、それは特異的 photoactivate する機会を開きますそれを公開することにより紫外線にまたは差動 photoactivate 別の細胞レベル下コンパートメントに同じ PA FP の反応の差を与えられます同じセル異なる PA FPs別様に紫外線。要約すると、我々 のプロトコルが PA FPs を使用して顕微鏡による生細胞の細胞プロセスの定量的理解を深めます。
開示事項
著者が明らかに何もありません。
謝辞
我々 はこのプロジェクトの設備やスペースを提供するため Dorigo 研究所、スタンフォード大学医学部で神経イメージング サービスを感謝したいです。
資料
| Name | Company | Catalog Number | Comments |
| pEGFP-N1 mammalian cell expression vector | Clontech | ||
| DMEM w/o phenol red | Thermo Fisher Scientific | 11054020 | |
| Trypsin w/o phenol red | Thermo Fisher Scientific | 15400054 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| Fugene 6 | Promega | E2691 |
参考文献
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science. 297 (5588), 1873-1877 (2002).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Renz, M., Lippincott-Schwartz, J. Ch. 9. The Fluorescent Protein Revolution Series in Cellular and Clinical Imaging. Day, R. N., Davidson, M. W. , CRC Press. 201-228 (2014).
- Shcherbakova, D. M., Sengupta, P., Lippincott-Schwartz, J., Verkhusha, V. V. Photocontrollable fluorescent proteins for superresolution imaging. Annual Review of Biophysics. , 303-329 (2014).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophysical Journal. 91 (11), 4258-4272 (2006).
- Henderson, J. N., et al. Structure and mechanism of the photoactivatable green fluorescent protein. Journal of the American Chemical Society. 131 (12), 4176-4177 (2009).
- Subach, F. V., et al. Photoactivation mechanism of PAmCherry based on crystal structures of the protein in the dark and fluorescent states. Proceedings of the National Academy of Sciences of the United States of America. 106 (50), 21097-21102 (2009).
- Wiedenmann, J., et al. EosFP, a fluorescent marker protein with UV-inducible green-to-red fluorescence conversion. Proceedings of the National Academy of Sciences of the United States of America. 101 (45), 15905-15910 (2004).
- Habuchi, S., Tsutsui, H., Kochaniak, A. B., Miyawaki, A., van Oijen, A. M. mKikGR, a monomeric photoswitchable fluorescent protein. PLoS One. 3 (12), e3944(2008).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nature Methods. 6 (2), 153-159 (2009).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- Slocum, J. D., Webb, L. J. A Double Decarboxylation in Superfolder Green Fluorescent Protein Leads to High Contrast Photoactivation. Journal of Physical Chemistry Letters. 8 (13), 2862-2868 (2017).
- Subach, F. V., Patterson, G. H., Renz, M., Lippincott-Schwartz, J., Verkhusha, V. V. Bright monomeric photoactivatable red fluorescent protein for two-color super-resolution sptPALM of live cells. Journal of the American Chemical Society. 132 (18), 6481-6491 (2010).
- Renz, M., Wunder, C. Internal rulers to assess fluorescent protein photoactivation efficiency. Cytometry A. , (2017).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Sciences of the United States of America. 109 (44), E2989-E2997 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved