Method Article
Um método de Micro-CT-baseado para caracterizar as lesões e localização de eletrodos nos cérebros de animais pequenos
Neste Artigo
Resumo
Este artigo descreve um método simples para preparar pequenos cérebros de animais para a imagem latente de micro-CT, nas quais as lesões podem ser quantificadas e eletrodos localizados com elevada precisão no contexto do cérebro inteiro.
Resumo
Verificação de localização de lesão e eletrodo são, tradicionalmente, feito através de exame histológico de fatias de cérebro coradas, um procedimento demorado que requer avaliação manual. Aqui, descrevemos um método simples, direto para quantificar as lesões e localização de eletrodos no cérebro que é menos trabalhoso e gera resultados mais detalhados. Todo cérebro é manchado com tetróxido de ósmio, em resina e fotografado com um scanner de micro-CT. Os exames resultam em 3D Digitas volumes dos cérebros com resoluções e espessuras de seção virtual dependentes do tamanho da amostra (12 – 15 e 5-6 µm por voxel para rato e zebra finch cérebros, respectivamente). Lesões superficiais e profundas podem ser caracterizadas e único tetrodes, matrizes tetrode, lesões eletrolíticos, e sondas de silicone também podem ser localizadas. Software livre e proprietário permite experimentadores examinar o volume da amostra de qualquer avião e segmento o volume manualmente ou automaticamente. Porque esse método gera volume todo cerebral, lesões e eletrodos podem ser quantificados para um grau muito maior do que nos métodos atuais, que vai ajudar a padronizar as comparações dentro e através de estudos.
Introdução
Os neurocientistas têm confiado em lesões por um longo tempo para entender a relação entre função e localização no cérebro. Por exemplo, nosso entendimento de como sendo indispensável para a aprendizagem e memória hipocampo e do córtex pré-frontal como sendo a chave para controlar os impulsos eram ambos os produtos de lesões acidentais em seres humanos1,2. O uso de modelos animais, no entanto, permitiu que os neurocientistas aproveitar o poder das lesões, indo além da serendipidade, e a função de inúmeras áreas do cérebro tem sido elucidada através de estudos sistemáticos das relações estrutura-função através lesões de3,4.
Para atribuir corretamente a função para uma estrutura, no entanto, estudos de lesão exigem procedimentos de quantificação exacta, que é uma área que tem faltado. O atual padrão de ouro para quantificar as lesões é a seção, montagem e cérebros de imagem com um microscópio de luz. As fatias de imagens são então combinadas para as seções mais próximas em um atlas, e as coordenadas aproximadas das lesões através de assuntos são relatadas indiretamente, muitas vezes através do uso de imagens de camera lucida ou exemplo histológica fatias3,4 ,5,6,7,8,9,10.
Além a imprecisão dos procedimentos de quantificação de lesão atual, estas técnicas são demorado e sujeito a falhas. Pequenas mudanças na temperatura, nitidez da lâmina e rigidez do cérebro pode levar a seções fracassadas, entortadas ou rasgadas. As seções também podem manchar de forma desigual e impropriamente ser fotografadas por causa de bolhas no meio de montagem. Importante, após o corte, o contexto tridimensional da localização da lesão no cérebro é perdido, fazendo reconstrução 3D precisa da lesão em desafiar o cérebro.
Outra aplicação comum para lesões tem sido para determinar a localização do único e várias gravações de eletrodos no cérebro. No final da sessão de gravação final, pesquisadores induzem pequenas lesões eletrolíticos na ponta do eletrodo e processam o cérebro histologicamente como feito em um experimento de lesão convencional11. Esta técnica sofre as mesmas desvantagens descritas acima, com problemas adicionais, sendo que as lesões eletrolíticos são geralmente maiores que os eléctrodos costumávamos fazê-las, mas são geralmente muito pequenas que eles são um desafio para encontrar histologicamente. Quando vários eletrodos são inseridos, como no caso de uma matriz de tetrode verificação através de lesões eletrolíticos é ainda mais desafiador. Uma alternativa para lesões eletrolíticos é o uso de um corante no eléctrodo para depois verificar histologicamente12, mas esta técnica sofre os mesmos inconvenientes que vêm com histologia convencional.
Aqui, descrevemos em profundidade um método descrito recentemente13 baseado na coloração das técnicas de microscopia eletrônica (EM) e radiografia computadorizada (micro-CT) que quantifica a lesões e localiza eletrodos no cérebro de animais pequeno melhor que corrente métodos. Micro-CT é uma técnica de imagem em que raios-x são um tiro uma amostra que é girada 360°, enquanto um cintilador coleta os raios-x não é desviados pela amostra. O resultado é uma reconstrução 3D digital de alta resolução da amostra que pode ser visualizada em qualquer orientação e quantificar precisamente. Muitas instituições acadêmicas tem micro-CT scanners, que também estão disponíveis comercialmente.
Protocolo
Todo cuidado e manipulação experimental de animais foram revistos e aprovados pelo Comitê de utilização e cuidados Animal institucionais de Harvard. A perfusão descrito aqui é específico para ratos, mas o procedimento é aplicável a todos os animais com cérebros menores ou similarmente feito sob medidos.
1. perfusão
- Prepare 1 x tampão fosfato salino (PBS). Para um rato (idade: 0,5-1,5 anos de idade, peso: 250-600 g), 800 – 1.000 mL deve ser suficiente. Use 400 mL para perfundir o animal e um adicional de 400 mL para diluir o fixador.
- Prepare o fixador consistindo de 2% (p/v) paraformaldeído (PFA) e 2,5% (p/v) de glutaraldeído (GA) em PBS 1x. Para um rato, 400 mL é suficiente. Salve 50 mL em um tubo cônico de 50 mL para pós-fixação do cérebro após a perfusão.
- Anestesia o rato com 4 – 5% de gás de isoflurano (a 0,8 L/min O2 1,0 bar a 21 ° C) por 15 min.
- Injetar uma dose letal de pentobarbital de sódio intraperitonealmente (180 mg/kg).
- Teste para a perda de reflexo no animal através da realização de um exame de reflexo de dedo-pinch. Espere para começar a perfusão, até que o animal perdeu sua resposta reflexa.
- Siga o descrito anteriormente intracardíaca perfusão e cérebro extração protocolo14 com as seguintes soluções: perfundir o animal com 400 mL de 1X PBS a 125 mm Hg para remover o sangue. Uma vez que todo o sangue foi removido e substituído com 1X PBS, começa perfusing com 400 mL de uma solução de 2%, PFA e 2,5% GA dissolvido em 1X PBS em 125 mm Hg.
Nota: Se o procedimento está sendo realizado em um animal que não é um rato, os componentes apenas importantes do processo de perfusão são o uso de 1X PBS e 2% PFA, GA de 2,5% em PBS 1x. Os volumes de solução e pressão de perfusão podem ser ajustados de acordo com a espécie.
2. pós-fixação
- Coloque o cérebro extraído em 2% PFA, GA de 2,5% em 1 x solução de PBS (mesma solução usada para perfundir o animal anteriormente). Certifique-se de que o volume de solução é pelo menos 10x o volume do cérebro. Para os ratos, coloca o cérebro em um tubo cónico de 50 mL com 50 mL de solução. Armazenar a amostra no pós-fixação por 2 – 3 dias, agitando levemente a 4 ° C.
Nota: Se a amostra for em um tubo cónico de 50 mL, colocando-o horizontalmente em um agitador orbital irá garantir os melhores resultados. - Depois que a amostra foi pós-fixada por muito tempo suficiente, lavar a amostra em água bidestilada (ddH2O), água deionizada (diH2O) ou água ultrapura (ver Tabela de materiais) quatro vezes para as seguintes durações: 1, 1, 1 e 15 min.
Nota: Para este protocolo, ddH2O, diH2O ou água ultrapura deve ser intercambiável. Para simplificar, ddH2O será usado para se referir a água purificada de agora em diante.
3. coloração
Atenção: Para esta etapa, realizar todas as preparações de solução debaixo de um carro enquanto estiver usando luvas.
- Prepare pelo menos 10x o volume do cérebro de coloração de solução. Cérebro de rato, preparar 50 mL de tetróxido de ósmio de 2% (p/v) (OsO4) em ddH2O combinando-se 25 mL de solução 4% OsO4 e 25 mL de DDQ2O.
Cuidado: tetróxido de ósmio é volátil e pode causar cegueira temporária e problemas respiratórios se não tratada adequadamente. Descarte todos os materiais que entre em contato com o tetróxido de ósmio em um recipiente apropriado risco químico dentro de um recipiente secundário. - Coloque o cérebro em um novo tubo cónico de 50 mL e adicionar a solução de4 OsO. O cérebro deve começar a virar marrom como OsO4 reage com lipídios no tecido.
- Fechar o tubo e selá-lo completamente com parafina de cinema (ver Tabela de materiais) para garantir que ela não vaza durante a incubação.
Nota: O ósmio é volátil e reagirá levemente com o plástico do tubo, então o tubo a isolar correctamente é muito importante. O tubo pode ser embrulhado com papel de alumínio para proteção adicional. - Armazene o tubo fechado a 4 ° C, agitando levemente em um agitador orbital a 50 rpm por 2 semanas. Coloca o tubo na horizontal para assegurar a melhor mistura. Certifique-se de que a amostra é totalmente submersa na solução, agitando.
Nota: Se o ósmio não é permitido a circulação continuamente, ele pode não totalmente penetrar a amostra, pelo posicionamento horizontal no agitador é muito importante.
4. incorporação
- Depois que a amostra tem sido incubada no OsO4 por 2 semanas, lave-o com o ddH2O 5 vezes à temperatura ambiente (RT) para as seguintes durações: 1, 1, 1, 15 e 60 min para remover todos os desvinculado de OsO4 na amostra.
Nota: As múltiplas trocas, incluindo a última troca de 60 min, são necessárias para permitir que todo o ósmio no sistema circulatório de difundir para fora. - Lavar a amostra com o ddH2O por 30 min a 4 ° C.
Nota: Ósmio pode continuar a difundir-se fora da amostra, mas sua quantidade deve ser muito reduzida da etapa anterior. - Desidrate a amostra com etanol para eventualmente infiltrar com resina. Para desidratar, substitua o ddH2O 10-20 mL das seguintes diluições de etanol (por 30 min cada a 4 ° C): 20% (v/v) de etanol e 80% (v/v) ddH2O; etanol a 50% (v/v) e 50% (v/v) ddH2O; etanol a 70% (v/v) e 30% (v/v) ddH2O; etanol a 90% (v/v) e 10% (v/v) ddH2O; 100% de etanol.
- Prepare as diluições de acetona/resina como segue.
- Prepare 100 mL da resina para incorporação (ver Tabela de materiais) conforme as instruções do fabricante.
- Para tornar a 33% (v/v) da resina - 67% solução de acetona, despeje 15 mL de resina em um tubo cónico de 50 mL e adicionar 30 mL de acetona de vidro-destilada 100%.
- Para tornar a acetona de resina - 50% de 50% (v/v), despeje 22,5 mL de resina em um tubo cónico de 50 mL e adicionar 22,5 mL de acetona de vidro-destilada 100%.
- Para tornar a 67% (v/v) da resina - 33% solução de acetona, despeje 30 mL de resina em um tubo cónico de 50 mL e adicionar 15 mL de acetona de vidro-destilada 100%.
- Use o restante 32,5 mL de resina como a primeira solução de resina 100% abaixo.
- Iniciar o processo de infiltração de resina, deslocando a amostra através de 10-20 mL de acetona e acetona/resina seguintes diluições: acetona 100% por 30 min a 4 ° C; acetona 100% por 30 min a 4 ° C; e 100% de acetona por 30 min à temperatura ambiente (RT).
Nota: O resto do processo de infiltração terá lugar no RT - Mergulhar a amostra em 33% (v/v) acetona de 67% de resina para 3h no RT e, em seguida, 50% (v/v) da resina - 50% de acetona para 3h no RT, acetona de 33% 67% (v/v) de resina para 3h no RT e 100% de resina para 12 horas a RT
- Fazer um lote de fresco 50 mL de resina, seguindo as instruções na embalagem. Transferir a amostra para o recipiente em que vai ser curado (ex., os moldes descartáveis, descritos na Tabela de materiais). Infundir a amostra com resina fresca de 100% por 4 horas no RT
Nota: Se não for usada a resina fresca, feita no dia anterior a resina vai começar a endurecer-se prematuramente, e a amostra será difícil de manipular. - Degas a amostra em um forno a vácuo para 15 min a 45 ° C.
Nota: Este passo irá ajudar a remover quaisquer bolhas de ar aprisionado dentro da amostra, mas é não-essenciais e não afetará a qualidade dos dados. - Finalmente, curar a amostra em um forno por 48 h a 60 ° C.
5. micro-CT
- Uma vez que a amostra foi curada, Descole o molde descartável e digitalizá-lo com a máquina de micro-CT.
Nota: Dependendo da máquina usada, as configurações será diferentes. Para o scanner utilizado pelos autores constantes da Tabela de materiais, as configurações recomendadas são 130 kV, 135 µA com um filtro de 0,1 mm de cobre e uma fonte de molibdênio, uma exposição de 1 segundo e uma média de 4 quadros por projeção. No entanto, experimentadores devem calibrar o scanner individualmente, como muitos fatores afetará as configurações ideais durante uma determinada sessão. - Uma vez que a varredura for concluída, reconstrua a amostra com os parâmetros recomendados para a combinação de software do scanner do experimentador em um computador com o software do scanner.
- Finalmente, Visualizar e analisar o volume digital reconstruído usando o software do experimentador de escolha (consulte Tabela de materiais para exemplos).
Resultados
Tradicionalmente, cérebros são seccionados e manchados para quantificar as lesões e localizar os eléctrodos, mas esse método é propenso, trabalhoso e normalmente requer a estimativa dos resultados. Preparando o cérebro inteiro para a imagem latente de micro-CT, a probabilidade de danificar as amostras é muito reduzida, características de interesse podem ser analisadas no contexto do cérebro inteiro e o método presta-se para processamento paralelo de muitas amostras, consideravelmente acelerar a preparação da amostra.
O método envolve quatro etapas principais: (1) coloração um cérebro perfundido com tetróxido de ósmio, (2) a incorporação do cérebro em resina, (3) da imagem latente do cérebro com um scanner de micro-CT e (4) analisando o volume digital resultante (Figura 1). Neste artigo, apenas as etapas 1-3 são descritas, como etapa 4 (a análise) irá variar consideravelmente, dependendo das necessidades específicas do projeto.
Considerando que no tradicional corte em que uma orientação de corte deve ser escolhida previamente, o volume digital resultante deste método pode ser manipulado em três dimensões e praticamente cortado em qualquer orientação (Fig. 2a-2b). O usuário também pode digitalizar uma subseção da amostra com uma resolução mais alta, se desejado, tais como o bulbo olfativo de um cérebro de rato, onde as fibras nervosas e glomérulos individuais são visíveis (Figura 2c). O método também é amplamente aplicável para pequenos cérebros de animais. Para verificar isso, um cérebro de zebra finch foi preparado usando o mesmo protocolo usado para o cérebro de rato e resultou em um volume digital bem sucedido (Figura 2e). Microscopia eletrônica (MEV) de uma amostra preparada para micro-CT confirmou que o tecido não foi danificado até uma ordem de magnitude na resolução além da resolução do micro-CT (Figura 2d). No entanto, deve notar-se que não havia danos consideráveis ultra-estruturais, tornando esta técnica inadequada para microscopia de elétron (EM).
A técnica pode ser usada para encontrar lesões superficiais (Figura 3) e lesões profundas dentro do cérebro (Figura 4). A técnica também permite a localização de tetrodes único em situ, lesões eletrolíticos, faixas de eletrodo de diâmetro suficiente, tetrode matrizes em situ e silício sondas em situ (Figura 5).
Preparações sem sucesso incluirá incompleta mineralização do tecido, que também pode ocorrer se incorreto buffers são usados (Figura 6). No entanto, se apenas características de superfície são necessárias, por exemplo, então somente superfície coloração da amostra pode ser suficiente para o experimentador.
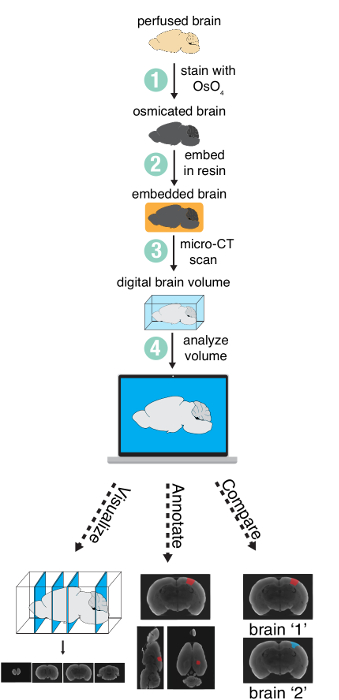
Figura 1 : Visão geral do método. Visão geral das etapas necessárias para preparar e analisar um cérebro inteiro utilizando imagens de micro-CT. Figura usada com permissão do autores13. Clique aqui para ver uma versão maior desta figura.
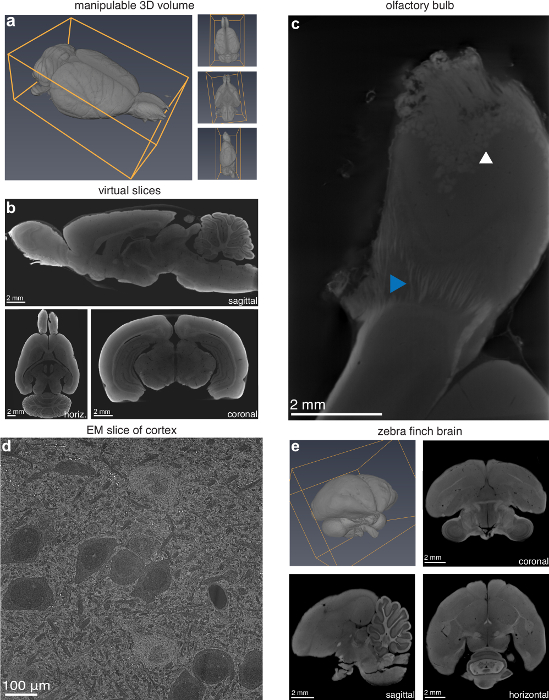
Figura 2 : Recursos da caracterização da lesão através de imagens de micro-CT. (um) Manipulatable 3D volume e (b) virtuais fatias (13,9 µm voxels) em orientações arbitrárias de uma microtomografia computadorizada de um rato de Long-Evans. (c) bulbo Olfactory digitalizado em alta resolução (4,9 µm voxels) revelando glomérulos (seta branca) e fibras nervosas individuais (seta azul). (d), microscópio eletrônico de varredura (MEV) imagem (10 nm/pixel) do córtex visual de um cérebro de rato, preparado para a imagem latente de micro-CT. (e), mandarim (Taeniopygia guttata) cérebro preparado para o micro-CT de imagem; Volume 3D e 2D fatias (5,6 µm voxels) no coronal, sagital e horizontal. Figura usada com permissão do autores13. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Caracterização de lesão do córtex visual usando micro-CT. (um) visualização 3D de um cérebro de rato lesionado no córtex visual com ácido quinolinic. O painel esquerdo mostra lesão volume no contexto do cérebro (cérebro ligeiramente transparente para permitir o acesso visual à lesão). O painel direito mostra o volume de lesão isolada. (b) fatias 2D de lesão no coronal, horizontal e sagital (12,8 µm voxels). Os top 3 painéis mostram as seções não segmentadas, e os painéis de fundo 3 mostram seções com anotação de lesão sobreposta. Esta lesão foi manualmente anotados na orientação coronal cada 2 fatias. Em seguida, o volume foi criado através de interpolação. Figura usada com permissão do autores13. Clique aqui para ver uma versão maior desta figura.
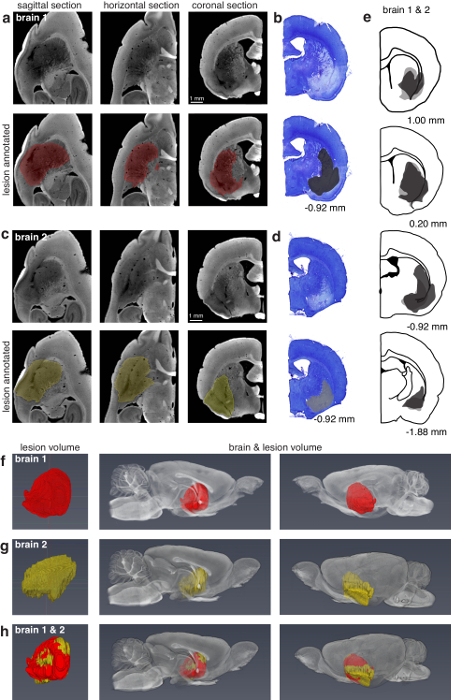
Figura 4: comparação da caracterização de lesão do corpo estriado dorso-lateral usando micro-CT e histologia. (um) sagital, horizontal e coronal vistas à esquerda metade do "cérebro 1" processadas por micro-CT imaging (13,5 µm voxels). Os top 3 painéis mostram seções não segmentadas, e os painéis de fundo 3 mostram a lesão anotada nas mesmas seções. A lesão foi manualmente segmentado no plano sagital cada 2 seções e posteriormente interpolados. (b) mais próxima correspondente seção coronal do direito metade do "cérebro 1" processadas histologicamente para microscopia de luz. Painéis (c, d) são semelhantes (a, b), mas correspondem ao "cérebro 2". A lesão cerebral 2 foi segmentada manualmente no plano coronal cada 8 seções. (e) caracterização de lesão tratada com histologia certo das metades do cérebro 1 (cinza escuro) e 2 (cinza claro). Os números em (b, d, e) por baixo dos painéis correspondem às posições em relação ao bregma. (f), caracterização de lesão da esquerda metade do cérebro 1 processada para micro-CT. O primeiro painel mostra a lesão isolada. Os segundo e terceiros painéis mostram a lesão no contexto do cérebro de dois pontos de vista. (g) correspondente ao cérebro 2 mas mesmo como (f). (h), uma sobreposição das lesões em (f, g) ilustrando a capacidade para comparação da caracterização de lesão com volumes de cérebro digital. A lesão em (f) foi registrada com a lesão em (g), e ambos são mostrados no contexto da metade esquerda do cérebro 2. Figura usada com permissão do autores13. Clique aqui para ver uma versão maior desta figura.
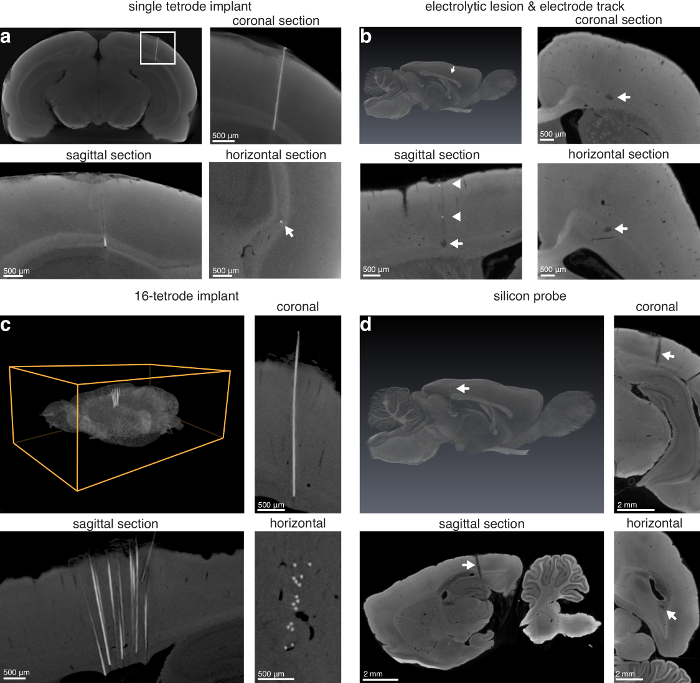
Figura 5 : Localização do eletrodo através de imagens de micro-CT. (um) único tetrode esquerdo em situ (14,0 µm voxels). Painel superior esquerdo: projeção de max-intensidade das secções coronais virtuais, mostrando a localização de um tetrode nicromo viajando pelo córtex visual em corpo caloso de um rato; superior direito: close-up de uma imagem mostrada no painel superior esquerdo de (um) (retângulo branco). Inferior esquerdo: sagital; canto inferior direito: vista horizontal para o eletrodo implantado (seta branca indica a localização do tetrode). eletrodo e (b) eletrolítica lesão faixa na região anterior de um cérebro de rato (13,9 µm voxels). Superior esquerda: renderização em 3D de um cérebro com lesão eletrolítica segmentado (seta branca indicando lesão roxo); superior direito: coronal. Inferior esquerdo: sagital; canto inferior direito: seções horizontais, indicando lesão eletrolítica (setas brancas), produzido com um eletrodo de tungstênio 75 µm de diâmetro. Além disso, algum metal depositado por eléctrodo com retração é visível ao longo da trilha na vista sagital (setas brancas). (c) implante de 16-tetrode deixada em situ no córtex anterior de um cérebro de rato. Superior esquerda: renderização em 3D de um cérebro inteiro com uma matriz de 16-tetrode deixou implantada; superior direito: coronal. Inferior esquerdo: sagital; canto inferior direito: seções horizontais, indicando um implante 16-tetrode (8,9 µm voxels). sonda (d), silício (haste de 10mm, 32 sites) deixou em situ viajando através do córtex posterior, hipocampo e estruturas subcorticais (voxels 13.9 µm). Superior esquerda: renderização em 3D de um cérebro inteiro com um silicone segmentado sonda (seta branca indicando verde); superior direito: coronal. Inferior esquerdo: sagital; canto inferior direito: vista horizontal de um silício sonda no cérebro. Além disso, o site de referência sobre a sonda de silicone é visível nas secções coronais e sagitais (ponta das setas brancas). Figura usada com permissão do autores13. Clique aqui para ver uma versão maior desta figura.
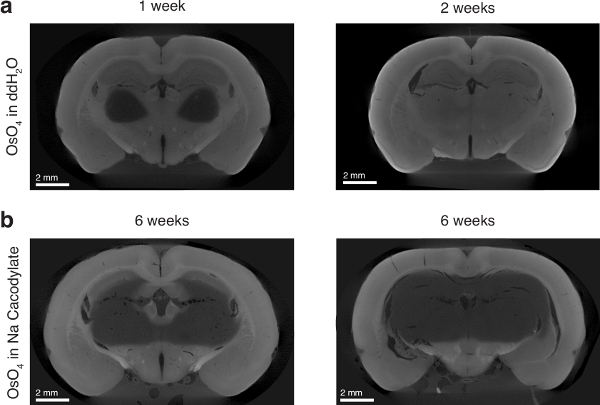
Figura 6 : Efeito de tetróxido de ósmio solvente na penetração do ósmio. (um) painel esquerdo: cérebro de rato incubadas em tetróxido de ósmio em ddH2O durante 1 semana. Painel direito: cérebro de rato incubadas em tetróxido de ósmio em ddH2O durante 2 semanas. (b) cérebro de rato dois incubados em tetróxido de ósmio no buffer de cacodylate de sódio por 6 semanas. Figura usada com permissão do autores13. Clique aqui para ver uma versão maior desta figura.
Discussão
A seguir, são passos críticos para o protocolo: em primeiro lugar, o uso de uma combinação de PFA e GA para perfundir o animal e posteriormente fixar o cérebro foi fundamental para alcançar penetração consistente ósmio total do tecido. Embora não podemos testar isso explicitamente, uma explicação plausível é que a fixação de PFA é reversível15, Considerando que a fixação de GA não é reversível16,17. Porque uma incubação de duas semanas em tetróxido de ósmio é necessária para a completa infiltração do tecido, é possível que o PFA no interior do cérebro difunde-se para fora e o tecido fica prejudicado durante a coloração. O ósmio, portanto, não podemos preservar as estruturas interiores.
O uso do ósmio aquoso, em oposição a ósmio dissolvido em um buffer (i.e., de sódio cacodylate), era absolutamente necessário para assegurar uma penetração no tecido completo pelo ósmio. Mesmo após uma incubação de 6 semanas, ósmio dissolvido em sódio cacodylate não se infiltrar o tecido completamente e apareceu ao encontro de uma barreira de difusão (Figura 6). Ósmio é extremamente reativo de lipídios e pensei em ligar nas membranas celulares18,19,20. Se o tecido não é suficientemente permeabilizado, como pode ser o caso com um buffer suave como cacodylate de sódio, é possível que as membranas celulares podem saturar com ósmio e estericamente impedir mais ósmio de difusão no tecido. Nós a hipótese, no entanto, que a água como um solvente para o ósmio atua como um detergente leve e permeabilizes o tecido suficiente para permitir a difusão profunda no tecido.
Se experimentadores estão preparando um cérebro mais pequeno, como a de um rato, provavelmente pode ser reduzido o tempo de incubação no ósmio. Da mesma forma, o tempo de incubação precisa ser aumentado em amostras maiores. Isso pode ser testado para determinar o tempo mínimo para a coloração consistente em um cérebro que é diferente do tamanho de um rato. Se experimentadores encontram problemas com infiltração de ósmio cheio, os prováveis problemas não estão usando PFA e GA durante a perfusão e pós-fixação, não utilizando água como solvente para ósmio (como discutido acima) e a agitação insuficiente durante o ósmio incubação. Encontramos, por exemplo, que quando incubando em tubos Erlenmeyer de 50 mL, colocar os tubos do lado deles (ao contrário de verticalmente sobre um suporte), enchendo-os com mancha e colocando-os em um agitador orbital a 50 rpm para a incubação de toda período assegurada adequada infiltração.
Este método é limitado de várias maneiras. Em primeiro lugar, a preparação não preserva ultraestrutura muito bem, então não deve ser usado para a microscopia eletrônica. Este método não pode ser combinado com qualquer mais histologia ou imunofluorescência. A resolução do volume digital é determinada pelo tamanho da amostra (amostras menores podem ser verificadas em resoluções mais altas) e pela geometria do scanner, se baseia-se na ampliação geométrica; no entanto, subseções da amostra podem ser verificadas em resoluções mais altas, se desejado.
Foi apresentado um novo método que combina o tratamento de tecido de microscopia eletrônica-estilo com micro-CT imaging para quantificação de lesões e localização de eletrodos no cérebro de animais pequeno. Este método é sem dúvida menos trabalhoso, requer menos experiência e produz resultados quantificáveis mais facilmente do que o atual padrão de ouro para o corte e a coloração de um cérebro. Os cientistas têm descrito anteriormente, um protocolo para a penetração do ósmio mesmo em cérebro de rato que serve para preservar a ultraestrutura para microscopia eletrônica21,22. Este protocolo, no entanto, é bastante complexo. Neste estudo, os autores objetivou desenvolver um método mais simples para micro-CT imagens ao invés de microscopia eletrônica. Há outros estudos aplicando micro-CT para cérebros de imagem para diversos fins. Uma investigação anterior em coelhos e ratos usado micro-CT para localizar tumores e outras anormalidades23. Esta investigação feita uso de agentes de contraste MRI proprietários, mas os pesquisadores prever a utilidade potencial de micro-CT é em estudos de lesão. Outro estudo em ratos destinadas a encontrar diferenças morfológicas brutas para um teste de drogas envolveram a coloração de cérebro de rato com iodo no crânio, mas os autores enfrentaram o encolhimento de tecido irregular e optaram por incorporar o tecido em um hidrogel24. Outros estudos em ratos têm visava encontrar malformações cavernosas cerebrais, uma desordem dos capilares anormalmente grandes e irregulares e fizeram uso de tetróxido de ósmio e iodo aquoso como manchas; no entanto, estas foram realizadas em amostras muito menores (hindbrains rato isolada) do que o descrito aqui25,26,27. Métodos alternativos para a geração de volumes 3D do cérebro são µMRI28 e de microscopia de alta resolução episcopic31. A resolução de µMRI é mais pobres (~ 25 µm voxels para semelhante amostras28), e a técnica é mais caro de23,30. Microscopia de alta resolução episcopic também enfrenta desafios: que é uma técnica destrutiva, e precisaria de um aparelho de cara-de-bloco, permitindo que o cérebro de toda a corte para ser produzido. O trabalho aqui apresentado também estende anteriores esforços para localizar os eléctrodos no cérebro com raios-x32,33,34 capturando ambos o eléctrodo e tecido circundante. Além disso, a técnica permite localizar único eletrodos, matrizes tetrode, lesões eletrolíticos, faixas de eletrodo e sondas de silicone.
Uma valiosa orientação futura seria a criação de um atlas de "cérebro médio" para o qual estudos de lesão poderiam ser co registrados para padronizar a lesão localização e quantificação de tamanho. Esse método também pode ser expandido para outros modelo e organismos não-modelo, como exemplificado pela sua aplicação imediata para o cérebro de zebra finch (Figura 2).
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores agradecer Greg Lin e Arthur McClelland seus conhecimentos com o micro-CT máquina, David Richmond Hunter Elliott na imagem e núcleo de análise de dados (IDAC) na Harvard Medical School para seu conselhos de processamento de imagem e William Liberti em Boston Universidade para graciosamente, fornecendo um cérebro zebra finch. Este trabalho foi realizado em parte no centro para sistemas de nanoescala (CNS), um membro do nacional nanotecnologia coordenada infra-estrutura de rede (NNCI), que é apoiado pela Fundação Nacional de ciência sob prêmio NSF n º 1541959. CNS é uma parte da Universidade de Harvard. Este trabalho foi apoiado pelo Richard e Susan Smith Family Foundation e IARPA (contrato #D16PC00002). S.B.E.W. foi apoiado por bolsas do programa de ciência de fronteira humana (HFSP; LT000514/2014) e a Organização Europeia de Biologia Molecular (EMBO; ALTF1561-2013). G.G. foi apoiado pela National Science Foundation (NSF) pós-graduação pesquisa Fellowship programa (GRFP).
Materiais
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences (EMS) | 15710 | 2% (w/v/) in 1X PBS |
| Glutaraldehyde (GA) | EMS | 16220 | 2.5% (w/v) GA in 1x PBS |
| OsO4 | EMS | 19190 | Work in fume hood |
| Ethanol | Decon Labs | Koptec | 140, 190, 200 proof |
| Acetone | EMS | 10015 | Glass-distilled |
| Durcupan ACM resin | Sigma-Aldrich | 44610 | A, B, C and D components, resin for embedding |
| Disposable molds | Ted Pella | 27114 | Suggested |
| milliQ water (ultrapure water) | Millipore Sigma | QGARD00R1 (or related purifier) | Suggested |
| Parafilm (paraffin film) | Millipore Sigma | P7793 | Suggested paraffin film |
| Micro-CT scanner | Nikon Metrology Ltd., Tring, UK | X-Tek HMS ST 225 | Used by authors |
| Software for visualizing and analyzing micro-CT scans: | |||
| Volume Graphics | VG Studio Max | Used by authors | |
| FEI / Thermo Scientific | Avizo | Used by authors | |
| FEI / Thermo Scientific | Amira | Similar to Avizo | |
| Mark Sutton & Russell Garwood | Spiers | Free, http://spiers-software.org/ | |
| Pixmeo Sarl | Osirix Lite | Free, https://www.osirix-viewer.com/ | |
| Open Source | FIJI | Free, https://fiji.sc/ | |
| Adobe | Photoshop | Good for analyzing one slice at a time |
Referências
- Scoville, W., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neuropsychiatry and Clinical Neuroscience. 12, 103-113 (2000).
- Damasio, H., Grabowski, T., Frank, R., Galaburda, A. M., Damasio, A. R. The return of Phineas Gage: clues about the brain from the skull of a famous patient. Science. 264 (5162), 1102-1105 (1994).
- Kawai, R., et al. Motor cortex is required for learning but not for executing a motor skill. Neuron. 86, 800-812 (2015).
- Otchy, T., et al. Acute off-target effects of neural circuit manipulations. Nature. 528, 358-363 (2015).
- Wright, N., Vann, S., Aggleton, J., Nelson, A. A critical role for the anterior thalamus in directing attention to task-relevant stimuli. Journal of Neuroscience. 35, 5480-5488 (2015).
- Kapgal, V., Prem, N., Hegde, P., Laxmi, T., Kutty, B. Long term exposure to combination paradigm of environmental enrichment, physical exercise and diet reverses the spatial memory deficits and restores hippocampal neurogenesis in ventral subicular lesioned rats. Neurobiology of Learning and Memory. 130, 61-70 (2016).
- Hosseini, N., Alaei, H., Reisi, P., Radahmadi, M. The effects of NBM- lesion on synaptic plasticity in rats. Brain Research. 1655, 122-127 (2017).
- Palagina, G., Meyer, J., Smirnakis, S. Complex visual motion representation in mouse area V1. Journal of Neuroscience. 37, 164-183 (2017).
- Ranjbar, H., Radahmadi, M., Reisi, P., Alaei, H. Effects of electrical lesion of basolateral amygdala nucleus on rat anxiety-like behavior under acute, sub-chronic, and chronic stresses. Clinical and Experimental Pharmacology and Physiology. , (2017).
- Wood, R., et al. The honeycomb maze provides a novel test to study hippocampal-dependent spatial navigation. Nature. , (2018).
- Vermaercke, B., et al. Functional specialization in rat occipital and temporal visual cortex. Journal of Neurophysiology. 112, 1963-1983 (2014).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551, 232-236 (2017).
- Masís, J., et al. micro-CT-based method for quantitative brain lesion characterization and electrode localization. Scientific Reports. 8, 5184 (2018).
- Gage, G., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. 65, 3564 (2012).
- Helander, K. Kinetic studies of formaldehyde binding in tissue. Biotechnic & Histochemistry. , (1994).
- Paljärvi, L., Garcia, J., Kalimo, H. The efficiency of aldehyde fixation for electron microscopy: stabilization of rat brain tissue to withstand osmotic stress. Histochemical Journal. , (1979).
- Okuda, K., Urabe, I., Yamada, Y., Okada, H. Reaction of glutaraldehyde with amino and thiol compounds. Journal of Fermentation and Bioengineering. 71, (1991).
- Bahr, G. Osmium tetroxide and ruthenium tetroxide and their reactions with biologically important substances: electron stains III. Experimental Cell Research. , (1954).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry & Cytochemistry. 9, 560-563 (1961).
- Riemersma, J. Osmium tetroxide fixation of lipids for electron microscopy a possible reaction mechanism. Biochimica et Biophysica Acta. 152, (1968).
- Mikula, S., Binding, J., Denk, W. Staining and embedding the whole mouse brain for electron microscopy. Nature Methods. 9, 1198-1201 (2012).
- Mikula, S., Denk, W. High-resolution whole-brain staining for electron microscopic circuit reconstruction. Nature Methods. 12, 541-546 (2015).
- Crespigny, A., et al. 3D micro-CT imaging of the postmortem brain. Journal of Neuroscience Methods. 171, 207-213 (2008).
- Anderson, R., Maga, A. A novel procedure for rapid imaging of adult mouse brains with MicroCT using Iodine-Based contrast. PLoS One. 10, 0142974 (2015).
- Zhou, Z., et al. Cerebral cavernous malformations arise from endothelial gain of MEKK3-KLF2/4 signalling. Nature. 532, 122-126 (2016).
- Choi, J., et al. Micro-CT imaging reveals mekk3 heterozygosity prevents cerebral cavernous malformations in Ccm2-Deficient mice. PloS One. 11, 0160833 (2016).
- Choi, J., Yang, X., Foley, M., Wang, X., Zheng, X. Induction and Micro-CT imaging of cerebral cavernous malformations in mouse model. Journal of Visualized Experiments. , (2017).
- Benveniste, H., Kim, K., Zhang, L., Johnson, G. Magnetic resonance microscopy of the C57BL mouse brain. Neuroimage. 11, 601-611 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211, 213-221 (2006).
- Schneider, J. E., et al. high-throughput magnetic paragraph sign resonance imaging of mouse embryonic paragraph sign anatomy using a fast gradient-echo sequence. MAGMA. 16, 43-51 (2003).
- Sharpe, J. Optical projection tomography. Annual Review of Biomedical Engineering. 6, 209-228 (2004).
- Cox, D. D., Papanastassiou, A., Oreper, D., Andken, B., James, D. High-Resolution Three-Dimensional microelectrode brain mapping using stereo microfocal x-ray imaging. Journal of Neurophysiology. 100, 2966-2976 (2008).
- Borg, J. S., et al. Localization of metal electrodes in the intact rat brain using registration of 3D microcomputed tomography images to a magnetic resonance histology atlas. eNeuro. 2, (2015).
- Fu, T. -. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13, 875-882 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados