Method Article
マイクロ ct 画像に基づく法病変を特徴と、小動物の脳に電極を配置
要約
この資料では、マイクロ CT イメージング、どの病変を示すことができる、電極を脳全体のコンテキストで高精度に位置する小動物の脳を準備する簡単な方法について説明します。
要約
病変と電極の位置確認は伝統的を介して病理染色脳スライスの手動の推定を必要とする時間のかかる手順を行われています。ここでは、シンプルで簡単な病変を定量化し、少ない骨の折れるより詳細な結果は、脳に電極を検索法について述べる.頭脳全体は四酸化オスミウム染色、樹脂に埋め込まれている、マイクロ CT スキャナーで画像化します。スキャンの解像度・仮想セクション厚さサンプル サイズに依存して脳の 3 D デジタル ボリュームの結果 (ラット、キンカチョウの voxel あたり 12-15 および 5-6 μ m 脳、それぞれ)。表面・深部病変が特徴付けることができる単管四極管, ・ テトロード配列, 電解病変とシリコン プローブのローカライズすることができます。独占的なソフトウェアでは、実験者面とボリュームのセグメントからサンプル ボリュームを手動でまたは自動的に調べることができます。このメソッドでは、脳全体のボリュームを生成するため内および研究間での比較を標準化するため、現在の方法でよりもはるかに高い程度に病変と電極を定量化することができます。
概要
神経科学者は、機能と脳の位置関係を理解するために長い時間のための病変に頼ってきました。たとえば、我々 の理解は、学習と記憶に不可欠なものとして海馬と衝動の制御のためのキーであると前頭前野の人間1,2の偶然の病変の両方の製品であった。ただし、動物モデルの使用は、セレンディピティ、越えて行くことによって病変の力を利用する神経科学者を許可しているし、無数の脳領域の機能を介して構造-機能相関の体系的な研究を通じて解明されてきた病変3,4。
正しく関数を構造体に割り当て、ただし、病変の研究は必要正確な定量化プロシージャは、不足している領域です。病変を定量化するための現在のゴールド スタンダードは、セクション、マウント、および光顕によるイメージ脳することです。イメージのスライス、アトラスに最も近いセクションに一致し、科目間で病変のおおよその座標が間接的に報告される、多くの場合カメラ lucida 画像や例組織スライス3,4 を使用して ,5,6,7,8,9,10。
現在病変定量化手順の不正確さを超えてこれらのテクニックがかかり、故障しやすいです。脳剛性、刃の鋭さ、および温度の小さな変化は、しくじった、ワープ、または引き裂かれたセクションにつながることができます。セクションで均等にない染色もできるし、正しく取り付け中の泡のためイメージを作成します。重要なは、断面、時に脳の病変の位置の三次元のコンテキストが失われ、挑戦的な脳の病変の正確な 3 D 再構成を行います。
病変のもう一つの一般的なアプリケーションは、シングルと脳内の複数の電極レコーディングの場所を確認してきました。最後の記録セッションの終わりには、研究者は、電極先端部に小型の電解病変を誘発する、従来病変実験11で組織学的脳を処理します。この手法は, 組織学的検索に挑戦されている電解の病変は通常それらを行うための電極よりも大きいが、通常十分に小さいという別の問題と上記で説明した同じ欠点により苦しみます。・ テトロード配列の場合のように複数の電極を挿入する場合、電解病変による検証はさらに困難です。電解病変に代わるは12, 組織学的にことを確認後に電極上の染料の使用が、従来の組織に付属する同じ欠点に苦しんでいるこの手法。
ここでは、我々 が詳細に説明染色電子顕微鏡検査 (EM) や x 線技術に基づいて最近説明方法13 ct マイクロ-) 病変を定量化し、現在より小さな動物の脳に電極を検索メソッド。マイクロ CT は x 線がシンチレータを収集しないサンプルによって偏向 x 線 360 ° 回転したサンプル ショットは、イメージング手法です。結果は、任意の方向の可視化および正確に定量化できるサンプルの高解像度デジタル 3 D 再構成です。多くの学術機関があるマイクロ CT スキャナーも市販されています。
プロトコル
すべてのケアと動物の実験操作の見直しにも承認されてハーバード大学施設動物ケアおよび使用委員会。ここで説明した灌流は、ラットの特定、手順はより小さいまたは同様に大きさで分類された頭脳を持つ任意の動物に適用されます。
1. 血流
- リン酸緩衝生理食塩水 (PBS) × 1 を準備します。ラットの (年齢: 0.5-1.5 歳、重量: 250-600 g)、800-1,000 mL で十分なはず。動物と定着剤を希釈する追加 400 mL を灌流して 400 mL を使用します。
- 2% (w/v) パラホルムアルデヒド (PFA) および 1x PBS で 2.5% (w/v) グルタールアルデヒド (GA) から成る固定液を準備します。ラット、400 mL で十分です。灌流後の脳のポスト固定の 50 mL の円錐管に 50 mL を保存します。
- 15 分 (0.8 L/分 O2 1.0 バー 21 ° c) で 4-5% イソフルラン ガスでラットを麻酔します。
- ペントバルビ タール ナトリウムの致死量を腹腔内注入 (180 mg/kg)。
- つま先ピンチ反射試験を行うことにより動物の反射損失をテストします。動物は、その反射的な反応を失っているまで灌流を開始するを待ちます。
- 前述 intracardial 血流と脳抽出プロトコル14次のソリューションに従います: 400 ml の 1x PBS 125 mmhg 血液を取り除くために動物を灌流します。すべての血は削除されており 1x PBS に置き換え、PFA と 125 mm Hg に 1x PBS で溶解 2.5% GA 400 mL の 2% の溶液を灌を開始します。
メモ: 手順は、ラットではない動物で行われているが場合、灌流プロシージャの唯一の重要なコンポーネントは 1 × PBS と 2% の使用 PFA、1 × PBS で 2.5% ジョージア。ソリューション ボリュームと灌流圧は、種に応じて調整する可能性があります。
2. ポスト固定
- 抽出した脳が、2 %pfa、PBS 溶液 (以前動物を灌流するために使用同じ溶液) x 1 2.5% ジョージア。ソリューション ボリュームが少なくとも脳のボリューム x 10 であることを確認します。ラット、溶液 50 mL と 50 mL の円錐管で脳を配置します。2-3 日間、4 ° C で軽く揺れポスト固定のサンプルを格納します。
注: サンプルは 50 mL のコニカル チューブには、軌道のシェーカーに水平方向に配置する最良の結果確保されます。 - サンプル後、修正されています長い間十分な後洗って純水や脱イオン水 (式行先方向2O)、二重蒸留水 (ddH2O) のサンプル (材料の表を参照) を 4 回次の期間: 1、1、1、および 15 分。
注: このプロトコルの ddH2O、式行先方向2O、または純水べき交換です。便宜上、ddH2O は精製水を今後参照するために使用されます。
3. 染色
注意: このステップでは、手袋を使用している間、フードの下ですべてのソリューションの準備を実施します。
- 少なくとも 10 x の染色液の脳の容積を準備します。ラット脳の ddH2O で 4% OsO4原液 25 mL と ddH2o. の 25 mL を組み合わせることによりの 2% (w/v) 四酸化オスミウム (OsO4) 50 mL を準備する.
注意: 四酸化オスミウムは揮発性一時的な失明および呼吸器系の問題を引き起こす可能性がありますしないと適切に処理します。セカンダリ コンテナー内の適切な化学物質の危険コンテナーの四酸化オスミウムにお問い合わせくださいすべての資料を破棄します。 - 新しい 50 mL の円錐管で脳を置き、OsO4ソリューションを追加します。脳は、OsO4組織の脂質と反応として茶色を回すが開始されます。
- 管を閉じるし、はパラフィン徹底的に印鑑 (材料の表を参照) を映画には潜伏中に漏洩しないことを確認します。
注: オスミウムは揮発性と正しくチューブをシールすることは非常に重要なので、チューブのプラスチックで穏やかに反応します。チューブは、追加の保護用アルミ箔で包まれるかもしれない。 - 4 ° c で 2 週間 50 回転軌道シェーカーで軽く揺れ封管を格納します。最高の混合をように水平方向にチューブを置きます。揺れながらサンプルを完全に水没のソリューションを確認します。
注: オスミウムを継続的に循環する許可されていない場合、それが完全に浸透できませんサンプルでは、シェーカーの水平方向の配置は非常に重要ですので。
4. 埋め込み
- サンプルは、2 週間の OsO4で培養されてが後で洗って室温 (RT) で ddH2O 5 回次の期間: 1、1、1、15、およびサンプルのすべての非連結 OsO4を削除する 60 分。
注: 最後の 60 分交換を含む複数の交換を拡散する循環システムですべてのオスミウムを許可する必要があります。 - 4 ° C で ddH2O 30 分のサンプルを洗う
注: オスミウムをサンプルから拡散する続行可能性がありますが、その量は前の手順から大幅に削減する必要があります。 - 最終的に樹脂を浸透させるエタノールとサンプルを脱水します。10-20 mL (30 分間各で 4 ° C) 以下のエタノールの希釈液の脱水に置き換える ddH2O: エタノール 20% (v/v) と 80% (v/v) ddH2O;50% (v/v) エタノール、50% (v/v) ddH2O;70% (v/v) エタノールと 30% (v/v) ddH2O;90% (v/v) エタノールおよび 10% (v/v) ddH2O;100% エタノール。
- とおりアセトン/樹脂希釈液を準備します。
- 製造元の指示に従って (材料の表を参照) を埋め込むため樹脂の 100 mL を準備します。
- 33% (v/v) 樹脂-67% をアセトン溶液にするには、50 mL の円錐管に樹脂の 15 mL を注ぐし、100% ガラス蒸留アセトン 30 mL を加えます。
- 50% (v/v) 樹脂 50% アセトンをするためには、50 mL の円錐管に樹脂 22.5 mL を注ぎ、100% ガラス蒸留アセトンの 22.5 mL を追加します。
- 67% (v/v) 樹脂-33% アセトン溶液を作る、50 mL の円錐管に樹脂の 30 mL を注ぎ、100% ガラス蒸留アセトンの 15 ミリリットルを追加します。
- 100% 樹脂の下の最初の解決策として残りの 32.5 mL の樹脂を使用します。
- を介して次のアセトン ・ アセトン/樹脂希釈 10 〜 20 mL サンプルを移動することによって樹脂浸透過程を開始: 4 ° C で 30 分間 100% アセトン4 ° C で 30 分間 100% アセトン・室内温度 (RT) で 30 分間 100% アセトン。
注: 残りの浸透プロセスで行われる RT。 - 常温では、3 h の 33% (v/v) 樹脂 67% アセトン、RT、RT で 3 h の 67% (v/v) ガレージ 33% アセトンと室温 12 h 100% 樹脂で 3 h の 50% (v/v) 樹脂 50% アセトンでサンプルを浸す
- 樹脂ボトルの指示に従っての 50 mL の新鮮なバッチを作る。サンプルが治癒されるコンテナーに転送 (e.g。、使い捨て金型材料の表に記載されている)。新鮮な 100% 樹脂でサンプルを室温 4 時間蒸らします
メモ: は、前日に樹脂が途中で硬化を開始新鮮な樹脂を使用しない場合、サンプルを操作するは難しいでしょう。 - ドガ、45 ° C で 15 分間真空オーブン サンプル
メモ: この手順、サンプル内で気泡を取り除くのに役立ちますが、必須ではない、データの品質は影響しません。 - 最後に、60 ° C で 48 時間オーブンでサンプルを治す
5. マイクロ CT
- サンプルが硬化されている一度使い捨て金型をはがし、マイクロ CT 機械でそれをスキャンします。
注: 使用機械によっては設定が異なるがあります。材料の表に記載されている著者によって使用されるスキャナーの推奨設定は、130 kV、0.1 mm の銅フィルターとモリブデン ソース、1 秒露出と投影あたり 4 フレームの平均で 135 μ A。ただし、多くの要因が特定のセッション中に最適な設定に影響を与える、実験者で個別にスキャナーする必要があります調整します。 - スキャンが完了すると、スキャナー ソフトウェアをコンピューター上の実験者のスキャナー/ソフトウェアの組み合わせの推奨パラメーターとサンプルを再構成します。
- 最後に、視覚化し、実験者の好みのソフトウェアを使用して再建されたデジタル ボリュームを分析する (例は材料の表を参照)。
結果
従来、脳の断面や病変を定量化し、電極を検索するために染色が、このメソッドは、エラーが発生しやすい、労働集約的で、通常、結果の推定を必要とします。マイクロ CT イメージングの頭脳全体を準備することによってサンプルの損傷の確率が大幅に減少、興味の機能は、脳全体のコンテキストで分析されるよう、メソッドは多数試料の並列処理にかなりそれ自身を貸すサンプル準備をスピードアップします。
メソッドは 4 つの主要なステップを含む: (1) 四酸化オスミウムと灌流脳の染色、(2) 樹脂の脳を埋め込み、(3) マイクロ CT スキャナーで脳をイメージング、(4) 解析結果デジタル ボリューム (図 1)。この記事では、手順 4 (解析) は、プロジェクトの特定のニーズによってかなり異なりますにのみ手順 1-3 を説明します。
一方で伝統的な断面 1 断面方向事前選択する必要があります、このメソッドから作成されたデジタル ボリュームが 3 つの次元で操作し、事実上任意の方向でスライス (図 2 a・ 2 b)。ユーザーはまた神経線維と個々 の糸球体が表示されます (図 2c) をラットの脳の嗅球など、必要な場合、高い解像度でサンプルのサブセクションをスキャン可能性があります。メソッドは、小動物の脳に広く適用も。これを確認するには、キンカチョウ脳は、ラットの脳に使用され、成功したデジタル ボリューム (図 2e) の結果は、同じプロトコルを使用して準備されました。走査電子顕微鏡 (SEM) マイクロ CT の調製した試料の組織されたマイクロ CT の解像度 (図 2d) を超える解像度の大きさの順序まで破損していないことを確認しました。ただし、この手法を電子顕微鏡検査 (EM) に適さない作るかなりの超微形態傷害があった。
技法を使用して表面の病変 (図 3) を検索して (図 4) 脳の奥深くの病変。技術はまた、単一管四極管上皮内、電解病変、十分な径の電極トラックの検索により、・ テトロード配列、原とシリコン プローブ上皮内(図 5)。
失敗した準備が正しくないバッファーを使用している場合も発生可能性があります組織の不完全な鉱化作用を構成する (図 6)。ただし、表面の機能が必要な場合にのみなど、表面だけ染色サンプルがあります実験者のための十分です。
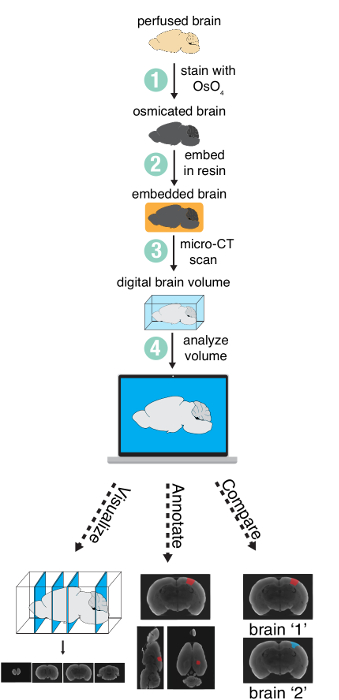
図 1: メソッドの概要。準備し、マイクロ CT イメージングを用いた全脳を解析に必要な手順の概要です。図13の作者から許可を得て使用します。この図の拡大版を表示するのにはここをクリックしてください。
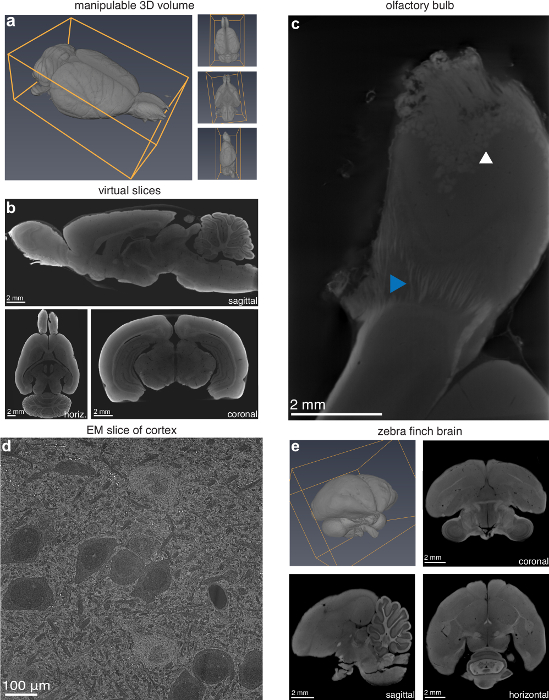
図 2: マイクロ CT イメージングによる病変評価の機能。(、) Manipulatable 3 D ボリュームと (b) 仮想スライス (13.9 μ m 画素) ロング ・ ラットのマイクロ CT スキャンから任意の方向に。(c) 嗅球糸球体 (白い矢印) および個々 の神経線維 (青い矢印) を明らかにより高い解像度 (4.9 μ m 画素) でスキャンします。マイクロ CT イメージング用ラット脳の視覚野の走査型電子顕微鏡 (SEM) (d) イメージ (10 nm/ピクセル)。キンカチョウ (キンカチョウにおける) (e) 脳のマイクロ CT イメージング; のために準備3 D ボリュームと冠状断、水平方向での 2D スライス (5.6 μ m 画素) と矢状断像。図13の作者から許可を得て使用します。この図の拡大版を表示するのにはここをクリックしてください。

図 3: マイクロ CT を用いた視覚皮質病変評価キノリン酸と視覚野における破壊ラット脳の (、) の 3次元可視化。左側のパネルでは、脳 (脳病変の視覚的なアクセスを許可するように若干透明) のコンテキストで性病変の容積を示しています。右側のパネルは、孤立性病変の容積を示しています。(b) 冠状断、水平方向、および矢状面 (12.8 μ m 画素) における病巣の 2D スライス。トップ 3 パネルらかい無節のセクションを示し底面 3 オーバーレイ病変注釈セクション。この瘤は手動ですべての 2 スライス コロナ向きで注釈が付けられました。その後に補間により作成されたボリューム。図13の作者から許可を得て使用します。この図の拡大版を表示するのにはここをクリックしてください。
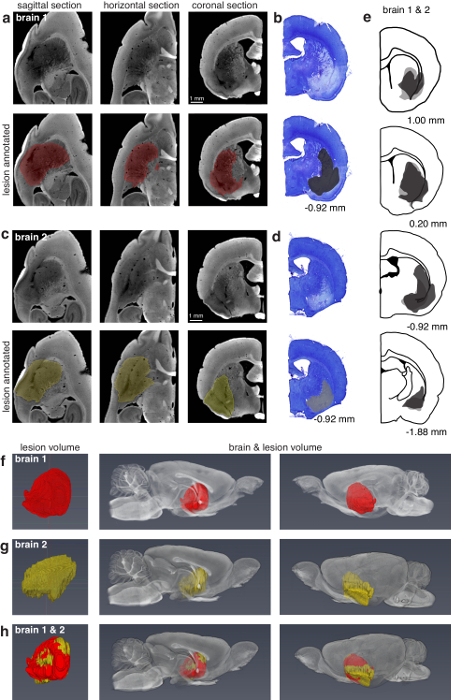
図 4:マイクロ CT と組織を用いた背側線条体病変評価の比較。マイクロ CT (13.5 μ m 画素) の処理半分「脳 1」の左の (、) 矢状水平、そしてコロナ ビュー。トップ 3 パネルらかい無節のセクションを示し底面 3 注釈付きの病変のセクションは同じに。病変が手動で矢状面におけるすべての 2 つのセクションに分割し、その後に補間されます。(b)「脳 1」の半分は光学顕微鏡観察の組織学的処理権利の最も近い一致する冠状断面。パネル (c, d) は (a、b) に似ていますが、「脳 2」に対応。脳 2 病変はすべて 8 セクション コロナの平面では分割手動で。(e) 1 (ダークグレー) 2 (ライトグレー) の脳の右半分の組織治療の病変評価。パネルの下にある (b、d、e) 内の数字は、前位置に対応します。マイクロ ct 処理 1 の脳の半分左側の病変評価 (f)最初のパネルは、孤立した病変を示しています。2 番目と 3 番目のパネルは、2 つの視点から脳のコンテキストで病変を示します。(g) (f) と同じですが、2 の脳に対応します。(h) 病変のオーバーレイの (f, g) デジタル脳容積と病変評価の比較の機能を示します。(F) の病変は病変 (g) に登録され、両方が 2 の脳の左半分のコンテキストで表示されます。図13の作者から許可を得て使用します。この図の拡大版を表示するのにはここをクリックしてください。
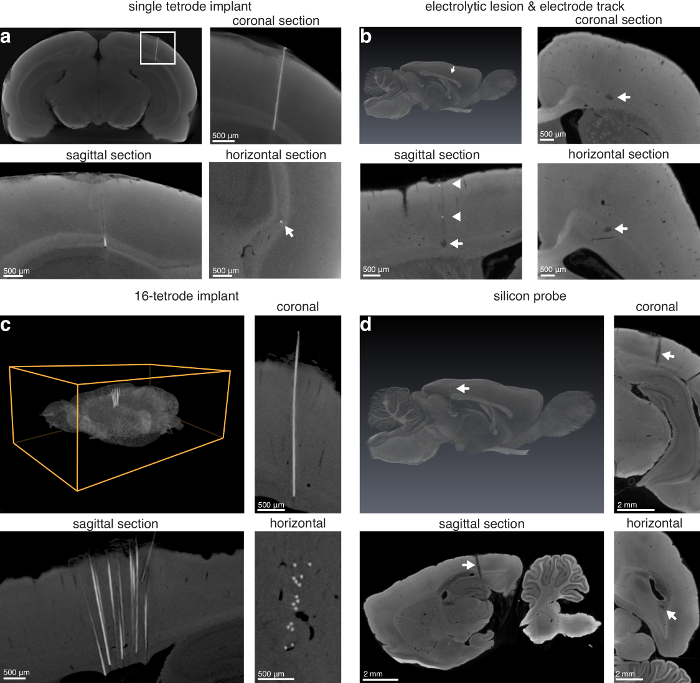
図 5:マイクロ CT イメージングによる電極局在。(、) シングル ・ テトロード左の in situ (14.0 μ m 画素)。左上のパネル: ニクロム ・ テトロード; ラットの脳梁に視覚野を旅の場所を示す仮想のコロナ セクションの最大強度投影右上: (a) (白い四角形) の左上のパネルに示すように画像のクローズ アップ。左下: 矢状;右下: 注入電極の水平方向のビュー (白い矢印は、熱の位置を示します)。ラット脳 (13.9 μ m 画素) の前歯の電解 (b) 病変と電極のトラックします。トップ左: 電解病変と脳の 3 D レンダリング (紫色の病変を示す白い矢印) を分割。右上: コロナ。左下: 矢状;右下: 75 μ m 径のタングステン電極と電解病変 (白い矢印) を示す水平方向のセクションが生成されます。さらに、いくつかの金属の後退後に、電極により作製した、矢状ビュー (白い矢印) のトラックに沿って表示されます。(c) 16 ・ テトロード インプラントがラットの脳の前方の皮質の場に残って。トップ左: 左注入; 16 ・ テトロード配列と脳全体の 3 D レンダリング右上: コロナ。左下: 矢状;右下: 水平方向のセクション 16 ・ テトロード インプラント (8.9 μ m 画素) を示します。(d) シリコン プローブ (10 mm シャンク、32 サイト) を残したその場で後部皮質、海馬と皮質下構造 (13.9 μ m 画素) を通過します。トップ左: セグメント化されたシリコン プローブ (白い矢印を示す緑色プローブ); と脳全体の 3 D レンダリング右上: コロナ。左下: 矢状;右下: 脳プローブのシリコンの水平方向のビュー。さらに、シリコン プローブのサイト参照がコロナおよび矢状のセクション (白い矢印の先端) で表示されます。図13の作者から許可を得て使用します。この図の拡大版を表示するのにはここをクリックしてください。
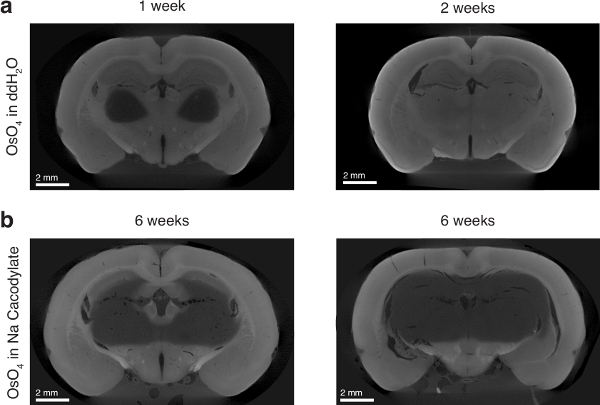
図 6: 浸透オスミウム四酸化オスミウム溶媒の効果。(、) 左: 1 週間 ddH2O に四酸化オスミウムで培養したラットの脳。右側のパネル: 2 週間 ddH2O に四酸化オスミウムで培養したラットの脳。(b) 2 つのラット脳ナトリウム cacodylate バッファーの四酸化オスミウム 6 週間培養。図13の作者から許可を得て使用します。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
プロトコルへの重要なステップを次に示します: まず、動物を灌流し、その後脳を修正後に PFA と GA の組み合わせの使用された組織の一貫性のある完全オスミウム浸透を達成するために重要です。我々 は明示的にこれをテストしていない、もっともらしい説明が PFA 固定がという可逆15、GA 固定ではなく可逆16,17。四酸化オスミウムで 2 週間培養組織の完全浸透に必要なため、脳の内部に PFA が外部に拡散し、染色中の組織が劣化です。オスミウムは、これにより内部の構造を保持できません。
バッファーに溶解した水溶液オスミウム, オスミウムとは対照的の使用(すなわち、ナトリウム cacodylate)、オスミウムによる完全組織浸透を確保するため絶対に必要だった。6 週間培養後もナトリウム cacodylate に溶解したオスミウムは、完全に、組織に潜入したないと拡散障壁 (図 6) が発生するように見えた。オスミウムは非常に脂質に反応し、細胞膜18,19,20のそれらをバインドすると思った。組織はない十分にグリセリン、としてナトリウムの cacodylate のような穏やかなバッファーの場合があります、それは細胞膜がオスミウムと飽和しよりオスミウムの組織に拡散を防ぐ立体。しかし、我々 仮説をオスミウムの溶剤として水光の洗剤として使用して組織に深い拡散を許可するのに十分な組織を permeabilizes です。
実験者は、マウスなどの小さい脳を準備しているオスミウムのインキュベーション時間が減らせます。同様に、インキュベーション時間はより大きいサンプルで増加する必要があります。これは、異なるサイズのラットの脳で一貫性のある染色の最小時間を確認するテストできます。PFA とオスミウム (前述)、・ オスミウムの中に十分な攪拌用溶媒として水を使用していない血流と後の固定中に GA の両方問題を可能性がありますを使用していない場合は実験者によるオスミウム浸潤で問題が発生、インキュベーション。分かった、例えば、50 mL の円錐管に培養 (ホルダーに垂直に反対して) として彼らの側でチューブを敷設、汚れ、それらを充填、全体の孵化期間保証適切な 50 回転軌道シェーカーでそれらを置くこと浸透。
このメソッドは、いくつかの方法で制限されます。まず、準備は保持されません微細構造非常によくので、電子顕微鏡は使用しないでください。このメソッドは、さらに組織または蛍光抗体法と組み合わせることはできません。デジタル ボリュームの解像度は、サンプルのサイズによって決まります (小さいサンプルは高解像度でスキャンすることができます)、それは幾何学的な倍率に依存している場合は、スキャナーのジオメトリただし、必要な場合は、サンプルのサブセクションを高解像度でスキャンできます。
定量化病変に対するマイクロ CT イメージングと小動物の脳に電極をローカライズと電子顕微鏡的組織治療を組み合わせる新しい手法が提示されています。このメソッドは間違いなく少ない骨の折れる、以下の専門知識を必要とし、区分および脳の汚損のための現在のゴールド スタンダードより容易に定量化可能な結果が得られます。以前は、科学者たちは、電子顕微鏡21,22の微細構造を維持するために意味されるマウスの脳もオスミウム浸透のためのプロトコルを説明しています。しかし、このプロトコルはかなり複雑です。本研究で著者らは電子顕微鏡観察ではなく、マイクロ CT イメージングのはるかに簡単な方法を開発する目的としました。他の研究は、様々 な目的のための脳のイメージングへのマイクロ CT の適用されています。ウサギ ・ マウスの前の調査は、腫瘍とその他の異常23を見つけようマイクロ CT を使用しました。この調査研究者独自の MRI 造影剤の使用した病変研究におけるマイクロ CT の潜在的な有用性を予測します。別のマウスでの研究は、頭蓋骨の中のヨウ素のマウス脳の染色薬剤スクリーンの総の形態学的差異が関与して、著者が不均一な組織収縮に直面し、ハイドロゲル24にティッシュを埋め込むことを選んだを見出すことを目指した。他のマウスでの研究脳海綿静脈奇形、異常に大きくて不規則な毛細血管の障害を見つけるししたを目指した四酸化オスミウムと汚れ; として水溶液中のヨウ素の使用ただし、これらは25,26,27をここで説明したよりもはるかに小さいサンプル (戸建マウス hindbrains) で行われました。3 D 脳のボリュームを生成するための代替方法は、µMRI28と高分解能垂直落射顕微鏡31です。µMRI の解像度は貧しい (〜 25 μ m 画素と同様のサンプル28)、および技術はより高価な23,30。高分解能垂直落射顕微鏡も挑戦に直面する: それは破壊的な技術と全脳切断できるようにブロック顔装置生産する必要があります。ここで紹介する作業も両方の電極をキャプチャし、周囲の組織によって x 線32,33,34脳内電極を見つけることの前の努力を拡張します。さらに、単一電極、熱配列、電解病変、電極トラックおよびシリコン プローブを特定するテクニックができます。
貴重な将来の方向性と病変研究する病変の位置とサイズの定量を標準化する共同登録することができる「平均脳」アトラスの作成です。このメソッドは、他のモデルと非モデル生物、キンカチョウ脳 (図 2) への即時の応用によって代表されるように拡張できます。
開示事項
著者が明らかに何もありません。
謝辞
作者ありがとうグレッグ ・ リンとアーサー ・ マクレランドの専門知識のマイクロ CT 機、デビッド リッチモンドと、イメージでハンター エリオットとデータ解析コア (加) 画像処理のアドバイスのためのハーバード衛生学校、ボストンでウィリアム Liberti 付き優雅キンカチョウ脳を提供する大学。この作業を行った一部センターでナノスケール システム (CNS)、メンバーの国家ナノテクノロジー調整インフラストラクチャ ネットワーク (NNCI)、全米科学財団 NSF 賞第 1541959 の下でサポートされているため。中枢神経系は、ハーバード大学の一部です。この作品は、リチャードとスーザン ・ スミス ・ ファミリー基金と IARPA (契約 #D16PC00002) によって支えられました。S.B.E.W. は人間のフロンティア科学プログラム (HFSP; から奨学金によって支えられました。LT000514/2014)、欧州分子生物学機構 (エンボ;ALTF1561-2013)。G. g. で、国立科学財団 (NSF) 大学院研究奨学金プログラム (GRFP) に対応しました。
資料
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences (EMS) | 15710 | 2% (w/v/) in 1X PBS |
| Glutaraldehyde (GA) | EMS | 16220 | 2.5% (w/v) GA in 1x PBS |
| OsO4 | EMS | 19190 | Work in fume hood |
| Ethanol | Decon Labs | Koptec | 140, 190, 200 proof |
| Acetone | EMS | 10015 | Glass-distilled |
| Durcupan ACM resin | Sigma-Aldrich | 44610 | A, B, C and D components, resin for embedding |
| Disposable molds | Ted Pella | 27114 | Suggested |
| milliQ water (ultrapure water) | Millipore Sigma | QGARD00R1 (or related purifier) | Suggested |
| Parafilm (paraffin film) | Millipore Sigma | P7793 | Suggested paraffin film |
| Micro-CT scanner | Nikon Metrology Ltd., Tring, UK | X-Tek HMS ST 225 | Used by authors |
| Software for visualizing and analyzing micro-CT scans: | |||
| Volume Graphics | VG Studio Max | Used by authors | |
| FEI / Thermo Scientific | Avizo | Used by authors | |
| FEI / Thermo Scientific | Amira | Similar to Avizo | |
| Mark Sutton & Russell Garwood | Spiers | Free, http://spiers-software.org/ | |
| Pixmeo Sarl | Osirix Lite | Free, https://www.osirix-viewer.com/ | |
| Open Source | FIJI | Free, https://fiji.sc/ | |
| Adobe | Photoshop | Good for analyzing one slice at a time |
参考文献
- Scoville, W., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neuropsychiatry and Clinical Neuroscience. 12, 103-113 (2000).
- Damasio, H., Grabowski, T., Frank, R., Galaburda, A. M., Damasio, A. R. The return of Phineas Gage: clues about the brain from the skull of a famous patient. Science. 264 (5162), 1102-1105 (1994).
- Kawai, R., et al. Motor cortex is required for learning but not for executing a motor skill. Neuron. 86, 800-812 (2015).
- Otchy, T., et al. Acute off-target effects of neural circuit manipulations. Nature. 528, 358-363 (2015).
- Wright, N., Vann, S., Aggleton, J., Nelson, A. A critical role for the anterior thalamus in directing attention to task-relevant stimuli. Journal of Neuroscience. 35, 5480-5488 (2015).
- Kapgal, V., Prem, N., Hegde, P., Laxmi, T., Kutty, B. Long term exposure to combination paradigm of environmental enrichment, physical exercise and diet reverses the spatial memory deficits and restores hippocampal neurogenesis in ventral subicular lesioned rats. Neurobiology of Learning and Memory. 130, 61-70 (2016).
- Hosseini, N., Alaei, H., Reisi, P., Radahmadi, M. The effects of NBM- lesion on synaptic plasticity in rats. Brain Research. 1655, 122-127 (2017).
- Palagina, G., Meyer, J., Smirnakis, S. Complex visual motion representation in mouse area V1. Journal of Neuroscience. 37, 164-183 (2017).
- Ranjbar, H., Radahmadi, M., Reisi, P., Alaei, H. Effects of electrical lesion of basolateral amygdala nucleus on rat anxiety-like behavior under acute, sub-chronic, and chronic stresses. Clinical and Experimental Pharmacology and Physiology. , (2017).
- Wood, R., et al. The honeycomb maze provides a novel test to study hippocampal-dependent spatial navigation. Nature. , (2018).
- Vermaercke, B., et al. Functional specialization in rat occipital and temporal visual cortex. Journal of Neurophysiology. 112, 1963-1983 (2014).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551, 232-236 (2017).
- Masís, J., et al. micro-CT-based method for quantitative brain lesion characterization and electrode localization. Scientific Reports. 8, 5184 (2018).
- Gage, G., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. 65, 3564 (2012).
- Helander, K. Kinetic studies of formaldehyde binding in tissue. Biotechnic & Histochemistry. , (1994).
- Paljärvi, L., Garcia, J., Kalimo, H. The efficiency of aldehyde fixation for electron microscopy: stabilization of rat brain tissue to withstand osmotic stress. Histochemical Journal. , (1979).
- Okuda, K., Urabe, I., Yamada, Y., Okada, H. Reaction of glutaraldehyde with amino and thiol compounds. Journal of Fermentation and Bioengineering. 71, (1991).
- Bahr, G. Osmium tetroxide and ruthenium tetroxide and their reactions with biologically important substances: electron stains III. Experimental Cell Research. , (1954).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry & Cytochemistry. 9, 560-563 (1961).
- Riemersma, J. Osmium tetroxide fixation of lipids for electron microscopy a possible reaction mechanism. Biochimica et Biophysica Acta. 152, (1968).
- Mikula, S., Binding, J., Denk, W. Staining and embedding the whole mouse brain for electron microscopy. Nature Methods. 9, 1198-1201 (2012).
- Mikula, S., Denk, W. High-resolution whole-brain staining for electron microscopic circuit reconstruction. Nature Methods. 12, 541-546 (2015).
- Crespigny, A., et al. 3D micro-CT imaging of the postmortem brain. Journal of Neuroscience Methods. 171, 207-213 (2008).
- Anderson, R., Maga, A. A novel procedure for rapid imaging of adult mouse brains with MicroCT using Iodine-Based contrast. PLoS One. 10, 0142974 (2015).
- Zhou, Z., et al. Cerebral cavernous malformations arise from endothelial gain of MEKK3-KLF2/4 signalling. Nature. 532, 122-126 (2016).
- Choi, J., et al. Micro-CT imaging reveals mekk3 heterozygosity prevents cerebral cavernous malformations in Ccm2-Deficient mice. PloS One. 11, 0160833 (2016).
- Choi, J., Yang, X., Foley, M., Wang, X., Zheng, X. Induction and Micro-CT imaging of cerebral cavernous malformations in mouse model. Journal of Visualized Experiments. , (2017).
- Benveniste, H., Kim, K., Zhang, L., Johnson, G. Magnetic resonance microscopy of the C57BL mouse brain. Neuroimage. 11, 601-611 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211, 213-221 (2006).
- Schneider, J. E., et al. high-throughput magnetic paragraph sign resonance imaging of mouse embryonic paragraph sign anatomy using a fast gradient-echo sequence. MAGMA. 16, 43-51 (2003).
- Sharpe, J. Optical projection tomography. Annual Review of Biomedical Engineering. 6, 209-228 (2004).
- Cox, D. D., Papanastassiou, A., Oreper, D., Andken, B., James, D. High-Resolution Three-Dimensional microelectrode brain mapping using stereo microfocal x-ray imaging. Journal of Neurophysiology. 100, 2966-2976 (2008).
- Borg, J. S., et al. Localization of metal electrodes in the intact rat brain using registration of 3D microcomputed tomography images to a magnetic resonance histology atlas. eNeuro. 2, (2015).
- Fu, T. -. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13, 875-882 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved