Method Article
Ein Mikro-CT-basierte Verfahren zur Charakterisierung von Läsionen und Lokalisierung von Elektroden in kleinen tierischen Gehirnen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine einfache Methode zur Vorbereitung von kleinen tierischen Gehirne für Mikro-CT-Bildgebung, in welche Läsionen quantifiziert werden können und Elektroden mit hoher Präzision im Kontext des gesamten Gehirns gelegen.
Zusammenfassung
Verifizierung der Läsion und Elektrode Lage erfolgt traditionell über histologische Untersuchung von gefärbten Gehirnscheiben ein zeitaufwändiges Verfahren, die manuelle Schätzung erfordert. Hier beschreiben wir eine einfache, unkomplizierte Methode zur Quantifizierung der Läsionen und Auffinden von Elektroden in das Gehirn, das ist weniger mühsam und liefert genauere Ergebnisse. Ganze Köpfe sind mit Osmium ausgefällt befleckt, in Harz eingebettet und abgebildet mit einem Mikro-CT-Scanner. Die Scans führen in 3D digital Bänden der Gehirne mit Auflösungen und virtuellen Bereich stärken abhängig von Größe der Stichprobe (12 – 15 und 5 – 6 µm pro Voxel für Ratte und Zebrafinken Gehirne, beziehungsweise). Oberflächlichen und tiefe Läsionen können charakterisiert werden und einzelne Tetroden, Tuberkuloseinfektion Arrays, elektrolytische Läsionen und Silizium-Sonden können auch lokalisiert werden. Freie und proprietäre Software kann Experimentatoren, das Probenvolumen von Flugzeug und Segment die Lautstärke manuell oder automatisch zu prüfen. Da diese Methode ganze Hirnvolumen generiert, können Läsionen und Elektroden in viel höherem Maße als in gängigen Methoden quantifiziert werden die helfen Vergleiche innerhalb und zwischen den Studien zu standardisieren.
Einleitung
Neurowissenschaftler haben auf Läsionen für eine lange Zeit verlassen, um die Beziehung zwischen Funktion und Position im Gehirn zu verstehen. Zum Beispiel wurden unser Verständnis des Hippocampus als unerlässlich für lernen und Gedächtnis und des präfrontalen Kortex als Schlüssel zur Impulskontrolle beide Produkte von glücklichen Zufälle Läsionen im Menschen1,2. Die Verwendung von Tiermodellen, jedoch konnten Neurowissenschaftler um die Macht der Läsionen durch hinauszugehen, Serendipity, und hat die Funktion der unzähligen Hirnareale durch systematische Untersuchungen der Struktur-Funktions-Beziehungen durch aufgeklärt Läsionen3,4.
Um richtig Funktion einer Struktur zuzuordnen, jedoch erfordern Läsion Studien präzise Quantifizierung Verfahren, die eine Fläche, die gefehlt hat. Der aktuelle Goldstandard zur Quantifizierung der Läsionen ist Abschnitt, Berg und Bild Gehirne mit einem Lichtmikroskop. Die abgebildeten Scheiben sind dann in den nächsten Abschnitten auf einer Atlas abgestimmt, und die ungefähren Koordinaten der Läsionen über Themen werden indirekt gemeldet, oft durch den Einsatz von Kamera Lucida Bilder oder Beispiel histologischen Scheiben3,4 ,5,6,7,8,9,10.
Über die Ungenauigkeit der derzeitigen Läsion Quantifizierung Verfahren sind diese Verfahren zeitaufwändig und fehleranfällig. Kleine Veränderungen im Gehirn Steifigkeit, Klinge Schärfe und Temperatur kann zu verpfuschten, verzogene oder zerrissene Abschnitte führen. Abschnitte können auch ungleichmäßig beflecken und unsachgemäß wegen Luftblasen in das Eindeckmittel abgebildet werden. Wichtig ist, ist beim Schneiden, dreidimensionalen Rahmen der Ort der Läsion im Gehirn verloren, präzise 3D-Rekonstruktion der Läsion im Gehirn schwierig machen.
Eine weitere häufige Anwendung für Läsionen wurde zur Bestimmung der Position von Einzel- und mehrere Aufnahmen der Elektrode im Gehirn. Am Ende der letzten Aufnahmesession Forscher induzieren kleine elektrolytische Läsionen an der Elektrodenspitze und verarbeitet das Gehirn histologisch wie in einem konventionellen Läsion Experiment11getan. Diese Technik leidet die gleichen Nachteile, die oben beschrieben, mit zusätzlichen Problemen ist, dass die elektrolytischen Läsionen meist größer als die Elektroden verwendet sind, um sie zu machen, aber sind in der Regel klein genug, die sie herausfordern, um histologisch zu finden. Wenn mehrere Elektroden, wie im Fall von einer Tuberkuloseinfektion Array eingesetzt werden ist eine Verifizierung durch elektrolytische Läsionen noch schwieriger. Eine Alternative zur elektrolytischen Läsionen ist die Verwendung eines Farbstoffes auf der Elektrode später histologisch12überprüfen, aber diese Technik leidet die gleichen Nachteile, die mit konventionellen Histologie kommen.
Hier beschreiben wir eingehende einer kürzlich beschriebenen Methode13 basierend auf Färbetechniken in Elektronenmikroskopie (EM) und Röntgen-Computertomographie (Mikro-CT), die quantifiziert Läsionen und sucht Elektroden in kleinen tierischen Gehirnen besser als Strom Methoden. Mikro-CT ist ein bildgebendes Verfahren, in dem Röntgenstrahlen an einer Probe geschossen werden, die 360 ° gedreht wird, während ein Szintillator die Röntgenstrahlen nicht abgelenkt durch die Probe sammelt. Das Ergebnis ist eine hochauflösende digitale 3D-Rekonstruktion der Probe, die visualisiert in beliebiger Orientierung und präzise quantifiziert werden kann. Viele Hochschulen haben Mikro-CT-Scannern, die auch im Handel erhältlich sind.
Protokoll
Alle Pflege und experimentelle Manipulation von Tieren wurden überprüft und durch die Harvard institutionelle Animal Care and Use Committee genehmigt. Die hier beschriebenen Perfusion ist spezifisch für Ratten, aber das Verfahren ist anwendbar auf alle Tiere mit kleineren oder ähnlich große Gehirne.
(1) perfusion
- Bereiten Sie 1 x Phosphat-gepufferte Kochsalzlösung (PBS). Für eine Ratte (Alter: 0,5 – 1,5 Jahre alt, Gewicht: 250-600 g), 800-1.000 mL sollte ausreichend sein. Verwenden Sie 400 mL, um das Tier und eine zusätzliche 400 mL verdünnen das Fixiermittel durchspülen.
- Bereiten Sie das Fixiermittel, bestehend aus 2 % (w/V) Paraformaldehyd (PFA) und 2,5 % (w/V) Glutaraldehyd (GA) mit 1 X PBS-Puffer. Für eine Ratte ist 400 mL ausreichend. Sparen Sie 50 mL in einen 50 mL konische Rohr für Post-Fixierung des Gehirns nach Perfusion.
- Die Ratte mit 4 – 5 % Isofluran Gas (bei 0,8 L/min O2 bei 1,0 Bar bei 21 ° C) 15 Minuten lang zu betäuben.
- Eine tödliche Dosis von Natrium-Pentobarbital intraperitoneale Injektion (180 mg/kg).
- Test für reflex Verlust in das Tier durch die Durchführung einer Zehe-Prise reflex Prüfung. Warten Sie, um die Durchblutung zu beginnen, bis das Tier seinen Reflexe Antwort verloren hat.
- Folgen Sie den zuvor beschriebenen Intracardial Perfusion und Gehirn Extraktion Protokoll Nr.14 mit den folgenden Lösungen: Durchspülen des Tieres mit 400 mL 1 X PBS bei 125 mm Hg, das Blut zu entfernen. Sobald alle Blut wurde entfernt und ersetzt mit 1 X PBS, beginnen Sie Vorrichtung mit 400 mL einer Lösung von 2 % PFA und 2,5 % GA aufgelöst in 1 X PBS bei 125 mm Hg.
Hinweis: Wenn das Verfahren in ein Tier, die keine Ratte ist durchgeführt wird, sind die einzig wichtigen Komponenten des Verfahrens Perfusion der Verwendung von 1 x PBS und 2 % PFA, 2,5 % GA mit 1 X PBS-Puffer. Die Lösung-Bände und Perfusionsdruck können je nach Tierart angepasst werden.
(2) Post-Fixierung
- Legen Sie die extrahierte Gehirn in 2 % PFA, 2,5 % GA 1 x PBS-Lösung (gleiche Lösung verwendet, um das Tier vorher durchspülen). Sicherstellen Sie, dass das Volumen der Lösung mindestens 10 x das Volumen des Gehirns ist. Legen Sie für Ratten das Gehirn in ein 50 mL konische Röhrchen mit 50 mL der Lösung. Speichern Sie die Probe in Post-Fixierung für 2 – 3 Tage, schütteln leicht bei 4 ° c
Hinweis: Wenn die Probe in einem 50 mL konische Röhrchen ist, indem Sie sie horizontal auf einem Orbitalschüttler die besten Ergebnisse gewährleistet. - Nachdem die Probe für lange genug nach dem feststeht, waschen Sie die Probe in bidestilliertem Wasser (DdH2O), deionisiertes Wasser (DiH2O) oder Reinstwasser (siehe Tabelle der Materialien) viermal für die folgenden Laufzeiten: 1, 1, 1 und 15 Minuten.
Hinweis: Für dieses Protokoll sollte DdH2O, DiH2O oder Reinstwasser austauschbar sein. Der Einfachheit halber wird DdH2O fortan verweisen auf gereinigtes Wasser verwendet werden.
3. Färbung
Achtung: In diesem Schritt führen Sie alle Lösung Vorbereitungen unter einer Haube während der Verwendung von Handschuhen.
- Bereiten Sie mindestens 10 x das Hirnvolumen der Färbelösung vor. Ratte Gehirn Vorbereitung 50 mL 2 % (w/V) Osmium ausgefällt (OsO4) DdH2O durch die Kombination von 25 mL Stammlösung 4 % OsO4 und 25 mL DdH2O.
Achtung: Osmium ausgefällt flüchtig und vorübergehende Blindheit und Atemprobleme verursachen kann wenn nicht angemessen behandelt. Entsorgen Sie alle Materialien, die die Osmium ausgefällt in einem entsprechenden Chemisches Risiko-Behälter in einem sekundären Container kontaktieren. - Das Gehirn in einem neuen 50 mL konische Röhrchen geben Sie und die OsO4 Lösung. Das Gehirn sollte beginnen zu bräunen als OsO4 mit Lipiden im Gewebe reagiert.
- Das Röhrchen verschließen und versiegeln Sie es gründlich mit Paraffin film (siehe Tabelle der Materialien), um sicherzustellen, dass es nicht während der Inkubation leckt.
Hinweis: Die Osmium ist flüchtig und reagiert leicht mit dem Kunststoff des Schlauchs, so dass das Rohr richtig Abdichtung sehr wichtig ist. Das Rohr kann mit Alu-Folie für zusätzlichen Schutz umwickelt werden. - Speichern der versiegelten Tube bei 4 ° C auf einem Orbitalschüttler bei 50 u/min für 2 Wochen leicht schütteln. Legen Sie das Rohr horizontal, um die beste Mischung zu gewährleisten. Sicherstellen Sie, dass die Probe unter Schütteln vollständig in die Lösung eingetaucht ist.
Hinweis: Wenn die Osmium ständig zirkulieren nicht zulässig ist, kann es nicht vollständig die Probe eindringen so horizontale Platzierung auf den Shaker sehr wichtig.
4. einbetten
- Nachdem die Probe OsO4 für 2 Wochen inkubiert, waschen Sie ihn mit DdH2O 5 Mal bei Raumtemperatur (RT) für die folgenden Laufzeiten: 1, 1, 1, 15 und 60 min., alle ungebundenen OsO-4 in der Probe zu entfernen.
Hinweis: Mehrere Börsen, einschließlich des letzten 60 Minuten Austauschs sind erforderlich, damit die Osmium in das zirkulierende System, heraus zu verbreiten. - Waschen Sie die Probe mit DdH2O für 30 min bei 4 ° C.
Hinweis: Osmium kann weiterhin aus der Probe zu verbreiten, aber die Menge sollte aus dem vorherigen Schritt stark reduziert werden. - Entwässern Sie die Probe mit Ethanol um schließlich mit Harz zu infiltrieren. Um zu entwässern, ersetzen die DdH2O mit 10 – 20 mL der folgenden Ethanol-Verdünnungen (für jeweils 30 min. bei 4 ° C): 20 % (V/V) Ethanol und 80 % (V/V) DdH2O; 50 % (V/V) Ethanol und 50 % (V/V) DdH2O; 70 % (V/V) Ethanol und 30 % (V/V) DdH2O; 90 % (V/V) Ethanol und 10 % (V/V) DdH2O; 100 % Ethanol.
- Aceton/Harz-Verdünnungen wie folgt vorbereiten.
- Bereiten Sie 100 mL des Harzes für das Einbetten (siehe Tabelle der Materialien), gemäß den Anweisungen des Herstellers.
- Um 33 % (V/V) Harz - 67 % Aceton-Lösung machen, Gießen Sie 15 mL Harz in ein 50 mL konische Röhrchen und 30 mL 100 % Glas destilliert Aceton.
- Um 50 % (V/V) Harz - 50 % Aceton machen, Gießen Sie 22,5 mL Harz in ein 50 mL konische Röhrchen und 22,5 mL 100 % Glas destilliert Aceton.
- Um 67 % (V/V) Harz - 33 % Aceton-Lösung machen, Gießen Sie 30 mL Harz in ein 50 mL konische Röhrchen und 15 mL 100 % Glas destilliert Aceton.
- Verwenden Sie die restliche 32,5 mL Harz, als die erste Lösung 100 % Harz unten.
- Beginnen die Harz Infiltration durch Verschieben der Probe durch 10-20 mL der folgenden Aceton und Aceton/Harz Verdünnungen: 100 % Aceton für 30 min bei 4 ° C; 100 % Aceton für 30 min bei 4 ° C; und 100 % Aceton für 30 min bei Raumtemperatur (RT).
Hinweis: Der Rest der Infiltrationsprozess wird bei RT stattfinden - Eintauchen der Probe in 33 % (V/V) Harz 67 % Aceton für 3 h bei RT, dann 50 % (V/V) Harz - 50 % Aceton für 3 h bei RT, 67 % (V/V) Harz 33 % Aceton für 3 h bei RT und 100 % Harz für 12 h bei RT
- Machen Sie eine frische 50 mL Charge gemäß den Anweisungen auf der Flasche. Übertragen Sie die Probe auf den Container, in dem es geheilt werden (zB., die verfügbaren Formen beschrieben in Tabelle der Materialien). Infusion die Probe mit frischen 100 % Harz für 4 Stunden bei RT
Hinweis: Wenn frisches Harz nicht verwendet wird, das Harz am Vortag startet vorzeitig aushärten lassen, und die Probe werden schwer zu manipulieren. - Degas die Probe in einem Vakuumofen für 15 min bei 45 ° C.
Hinweis: Dieser Schritt hilft eingeschlossene Luftblasen innerhalb der Probe zu entfernen, aber es ist unwesentlich und hat keine Auswirkungen auf die Qualität der Daten. - Zu guter Letzt heilen Sie die Probe in einem Ofen für 48 h bei 60 ° C.
5. Micro-CT
- Sobald die Probe geheilt hat, abziehen der Einweg-Form und Scannen Sie es mit der Mikro-CT-Maschine.
Hinweis: Abhängig von der Maschine verwendet, werden die Einstellungen unterschiedlich sein. Für den Scanner verwendet von den Autoren, die in der Tabelle der Materialienaufgeführt, die empfohlenen Einstellungen sind 130 kV, 135 µA mit 0,1 mm Kupfer Filter und einer Molybdän-Quelle, eine 1-Sekunden-Belichtung und einen Durchschnitt von 4 Frames pro Projektion. Jedoch sollten Experimentatoren den Scanner einzeln, kalibrieren, wie optimale Einstellungen während einer bestimmten Sitzung durch viele Faktoren beeinflusst werden. - Sobald der Scan abgeschlossen ist, die Probe mit den empfohlenen Parametern für den Experimentator Scanner/Software-Kombination auf einem Computer mit der Scannersoftware zu rekonstruieren.
- Zu guter Letzt visualisieren und analysieren die rekonstruierte digitale Lautstärke mit der Experimentator Software der Wahl (siehe Tabelle der Materialien für Beispiele).
Ergebnisse
Traditionell, Gehirne sind geschnitten und gefärbt um Läsionen zu quantifizieren und Elektroden zu finden, aber diese Methode ist fehleranfällig, arbeitsintensiv, und erfordert in der Regel eine Einschätzung der Ergebnisse. Durch die ganze Gehirne für die Mikro-CT-Bildgebung Vorbereitung, die Wahrscheinlichkeit einer Beschädigung der Proben ist stark reduziert, Sehenswürdigkeiten im Kontext des gesamten Gehirns analysiert werden können und die Methode eignet sich für parallele Verarbeitung vieler Proben erheblich Beschleunigung der Probenvorbereitung.
Die Methode besteht aus vier wichtige Schritten: (1) Färbung ein perfundierten Gehirn mit Osmium ausgefällt, (2) Einbetten des Gehirns im Harz (3) Bildgebung des Gehirns mit einem Mikro-CT-Scanner und (4) Analyse der entstehenden digitalen Volumen (Abbildung 1). In diesem Artikel werden nur die Schritte 1 – 3 beschrieben, wie Schritt 4 (Analyse) je nach spezifischen Anforderungen des Projekts unterschiedlich sein wird.
Während im traditionellen Schnitt, in dem ein strukturierendes Orientierung vorher gewählt werden muss, kann die resultierende digitale Lautstärke von dieser Methode in drei Dimensionen manipuliert und praktisch in beliebiger Orientierung geschnitten (Abbildung 2a-2 b). Der Benutzer kann auch ein Teilgebiet der Probe mit einer höheren Auflösung falls gewünscht Nervenfasern und einzelne Glomeruli sichtbar (Abbildung 2c sind), wie z. B. den Riechkolben von einem Rattengehirn scannen. Die Methode ist auch im großen und ganzen gilt für kleine Tiere Gehirne. Um dies zu überprüfen, wurde eine Zebrafinken Gehirn zubereitet dasselbe Protokoll verwendet, um die Ratte Köpfe und führte zu einem erfolgreichen digitalen Volumen (Abb. 2e). Rasterelektronenmikroskopie (SEM) einer Probe vorbereitet für Mikro-CT bestätigt, dass das Gewebe bis zu einer Größenordnung in Entschließung über die Mikro-CT-Auflösung (Abbildung 2d) nicht beschädigt wurde. Allerdings sollte angemerkt werden, dass erhebliche Ultrastrukturforschung Schaden, so dass diese Technik ungeeignet für Elektronenmikroskopie (EM).
Die Technik kann verwendet werden, Oberflächen Läsionen (Abbildung 3) zu finden und Läsionen, die tief in das Gehirn (Abbildung 4). Die Technik ermöglicht auch das Auffinden der einzelnen Tetroden in Situ, elektrolytische Läsionen, Elektrode Tracks von ausreichenden Durchmesser, Tuberkuloseinfektion Arrays in Situ und Silizium-Sonden in Situ (Abbildung 5).
Erfolglose Vorbereitungen umfasst unvollständige Mineralisierung des Gewebes, die auch auftreten, wenn falsche Puffer verwendet werden (Abbildung 6). Jedoch wenn nur Oberflächen-Features erforderlich sind, kann zum Beispiel dann nur Oberfläche Färbung der Probe für den Experimentator ausreichen.
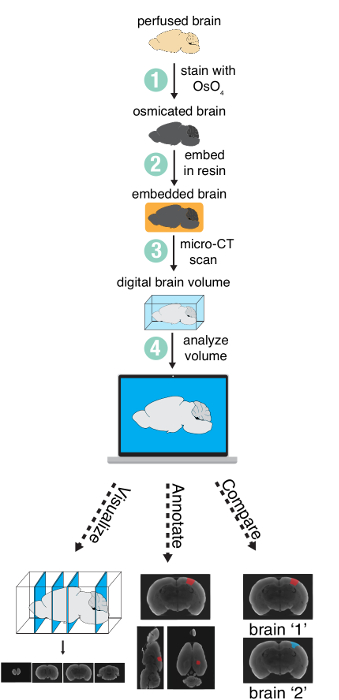
Abbildung 1 : Methode Übersicht. Übersicht über die erforderlichen Schritte zum Erstellen und analysieren ein ganze Gehirn mittels Mikro-CT-Bildgebung. Abbildung mit freundlicher Genehmigung von der Autoren-13verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
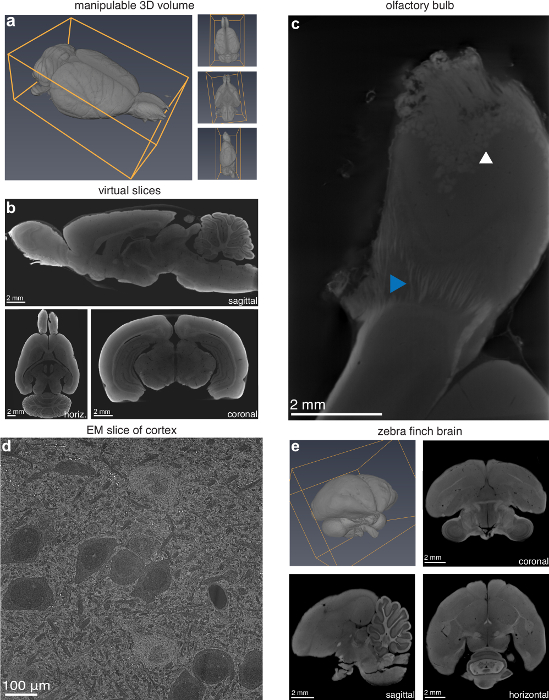
Abbildung 2 : Möglichkeiten der Läsion Charakterisierung durch Mikro-CT-Bildgebung. (ein) Manipulatable 3D Volumen und (b) virtuelle Scheiben (13,9 µm Voxel) in beliebigen Ausrichtungen aus einem Mikro-CT-Scan einer Long-Evans-Ratte. (c) Riechkolben mit höherer Auflösung (4,9 µm Voxel) enthüllt Glomeruli (weiße Pfeilspitze) und einzelne Nervenfasern (blaue Pfeilspitze) gescannt. (d) Rasterelektronenmikroskop (REM) Bild (10 nm/Pixel) des visuellen Kortex des Gehirns Ratte vorbereitet für die Mikro-CT-Bildgebung. (e) Zebrafinken (Taeniopygia Guttata) Gehirn vorbereitet für Mikro-CT-Bildgebung; 3D-Volumen und 2D Scheiben (5,6 µm Voxel) in den koronalen, horizontalen und sagittalen Flugzeuge. Abbildung mit freundlicher Genehmigung von der Autoren-13verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Sehrinde Läsion Charakterisierung mittels Mikro-CT (ein) 3D Visualisierung von einem Rattengehirn lesioned im visuellen Kortex mit Quinolinsäure Säure. Die linke Tafel zeigt Läsion Volumen im Zusammenhang mit dem Gehirn (leicht transparent visuellen Zugriff auf die Läsion gemacht). Im Rechte Bereich zeigt isolierte Läsion Volumen. (b) 2D Scheiben Läsion im koronalen, horizontalen und sagittalen Flugzeuge (12,8 µm Voxel). Die Top 3 Tafeln zeigen die unsegmented Abschnitte, und die unteren 3 Tafeln zeigen Querschnitte mit überlagerten Läsion Annotation. Diese Läsion wurde manuell kommentiert in der koronalen Ausrichtung jedes 2 Scheiben. Die Band entstand dann durch Interpolation. Abbildung mit freundlicher Genehmigung von der Autoren-13verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
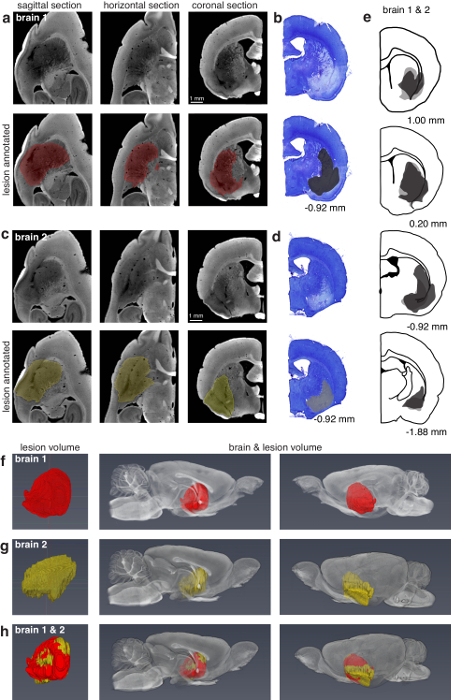
Abbildung 4: Vergleich von dorsal-Lateral Striatum Läsion Charakterisierung mittels Mikro-CT und Histologie. (ein) Sagittal, horizontalen und koronale Ansichten der linken Hälfte "Brain 1" für Mikro-CT-Bildgebung (13,5 µm Voxel) verarbeitet. Die Top 3 Tafeln zeigen unsegmented Abschnitte und die unteren 3 Platten kommentierte Läsion auf die gleichen Abschnitte. Die Läsion wurde manuell jeden 2 Abschnitte in der Sagittalebene segmentiert und anschließend interpoliert. (b) am nächsten passenden koronalen Teil der rechten Hälfte des "Gehirns 1" histologisch für Lichtmikroskopie verarbeitet. Platten (c, d) sind vergleichbar mit (a, b), sondern "Gehirn 2" entsprechen. Die Gehirn 2 Läsion wurde manuell in der koronalen Ebene alle 8 Teile segmentiert. (e) Läsion Charakterisierung der Histologie behandelt rechten Hälften des Gehirns 1 (dunkelgrau) und 2 (hellgrau). Die Zahlen in (b, d, e) unterhalb der Platten entsprechen Positionen relativ Bregma. (f) Läsion Charakterisierung der linken Hälfte des Gehirns 1 für Mikro-CT verarbeitet. Die erste Tafel zeigt die isolierte Läsion. Die zweiten und dritten Tafeln zeigen die Läsion im Kontext des Gehirns aus zwei Blickwinkeln. (g) (f) identisch, aber entsprechende Gehirn 2. (h) eine Überlagerung der Läsionen in (f, g) illustrieren die Fähigkeit zum Vergleich der Läsion Charakterisierung mit digitalen Gehirn Bände. Die Läsion (f) wurde um die Läsion in (g) registriert, und beide sind im Zusammenhang mit der linken Hälfte des Gehirns 2 gezeigt. Abbildung mit freundlicher Genehmigung von der Autoren-13verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
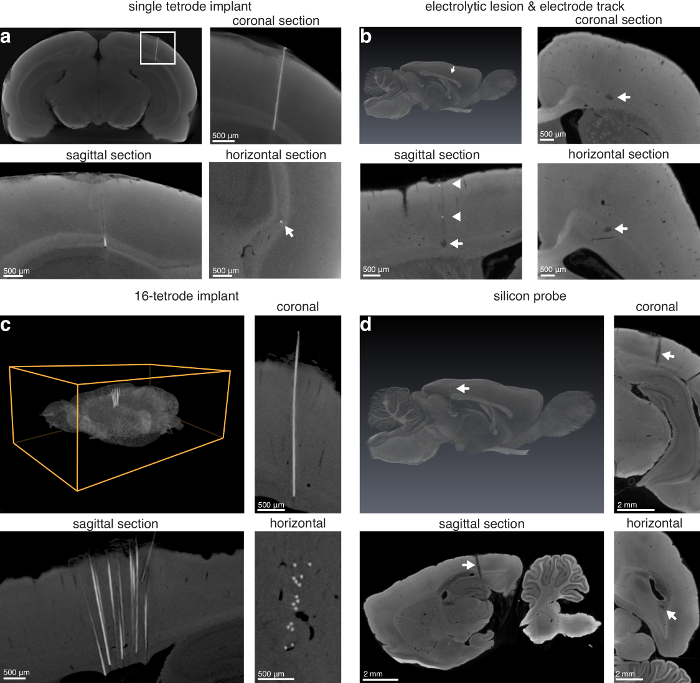
Abbildung 5 : Elektrode Lokalisierung durch Mikro-CT-Bildgebung. (ein) Single Tuberkuloseinfektion Links in Situ (14,0 µm Voxel). Oberen linken Bereich: Max-Intensität Projektion des virtuellen koronalen Abschnitte zeigt den Standort von einem Nichrom Tuberkuloseinfektion Reisen durch den visuellen Cortex in den Corpus Callosum einer Ratte; oben rechts: Nahaufnahme eines Bildes in der linken Oberseite des (a) (weißes Rechteck) gezeigt. Unten links: sagittale; unten rechts: horizontale Ansichten der implantierten Elektrode (weißer Pfeil gibt die Position von der Tuberkuloseinfektion). (b) elektrolytische Läsion und Elektrode im Frontzahnbereich ein Rattengehirn (13,9 µm Voxel) zu verfolgen. Oben links: 3D-Rendering des Gehirns mit der elektrolytischen Läsion segmentiert, (weißer Pfeil, lila Läsion); oben rechts: koronalen. Unten links: sagittale; unten rechts: horizontale Abschnitte anzeigt elektrolytische Läsion (weisse Pfeile) mit einer Wolframelektrode 75 µm Durchmesser hergestellt. Darüber hinaus sieht man einige Metall abgeschieden von der Elektrode auf Widerruf entlang der Strecke in der sagittalen Ansicht (weiße Pfeilspitzen). (c) 16-Tuberkuloseinfektion Implantat links in Situ in der anterioren Cortex des Gehirns eine Ratte. Oben links: 3D-Rendering des gesamten Gehirns mit einem 16-Tuberkuloseinfektion Array links implantiert; oben rechts: koronalen. Unten links: sagittale; unten rechts: horizontale Abschnitte, eine 16-Tuberkuloseinfektion Implantat (8,9 µm Voxel) angibt. (d) Silizium-Sonde (10 mm Schaft, 32 Seiten) links in Situ durch die hinteren Kortex, Hippocampus und subkortikalen Strukturen (13,9 µm Voxel) zu reisen. Oben links: 3D-Rendering des gesamten Gehirns mit einer segmentierten Silizium-Sonde (weißer Pfeil zeigt grüne Sonde); oben rechts: koronalen. Unten links: sagittale; unten rechts: horizontale Ansichten von einem Silizium-Sonde im Gehirn. Darüber hinaus ist die Referenz-Website auf die Silizium-Sonde in den Abschnitten koronalen und sagittalen (Spitze des weißen Pfeile) sichtbar. Abbildung mit freundlicher Genehmigung von der Autoren-13verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
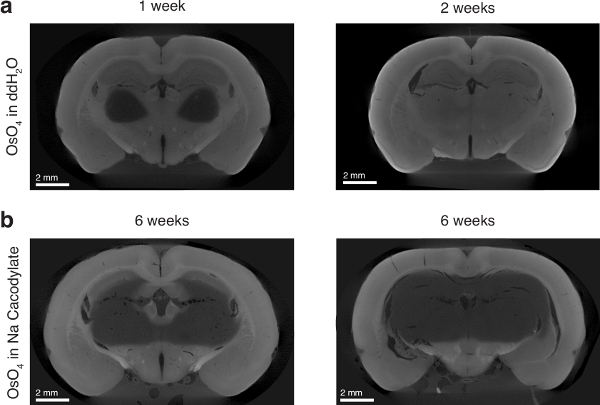
Abbildung 6 : Wirkung von Osmium ausgefällt Lösungsmittel auf Osmium eindringen. (ein) linken: Rattengehirn für 1 Woche in Osmium ausgefällt in DdH2O inkubiert. Rechten Seite: Rattengehirn in Osmium ausgefällt DdH2O für 2 Wochen inkubiert. (b) zwei Ratten Gehirne in Osmium ausgefällt in Natrium Cacodylate Puffer für 6 Wochen inkubiert. Abbildung mit freundlicher Genehmigung von der Autoren-13verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Folgende sind wichtige Schritte für das Protokoll: Erstens die Verwendung einer Kombination aus PFA und GA Durchspülen des Tieres und anschließend nach dem Beheben des Gehirns war ausschlaggebend für die konsequente voll Osmium Durchdringung des Gewebes zu erreichen. Obwohl wir dies nicht explizit testen, ist eine plausible Erklärung, dass PFA Fixierung reversible15, GA-Fixierung ist nicht reversibel16,17. Da eine zweiwöchige Inkubation in Osmium ausgefällt für vollständige Infiltration des Gewebes erforderlich ist, ist es möglich, dass die PFA im Inneren des Gehirns heraus diffundiert und das Gewebe, während die Färbung abbaut. Die Osmium kann nicht damit die inneren Strukturen bewahren.
Die Verwendung von wässrigen Osmium, im Gegensatz zu Osmium aufgelöst in einem Puffer (d.h., Natrium-Cacodylate), war absolut notwendig, volle Gewebe eindringen durch die Osmium zu gewährleisten. Auch nach einer 6-wöchigen Inkubation Osmium in Natrium Cacodylate aufgelöst nicht das Gewebe vollständig zu infiltrieren und schien eine Diffusionsbarriere (Abbildung 6) auftreten. Osmium ist extrem reaktiv, Lipide und dachte in Zellmembranen18,19,20binden. Wenn das Gewebe nicht ausreichend permeabilized ist, wie der Fall mit einem sanften Puffer wie Natrium Cacodylate sein könnte, ist es möglich, dass die Zellmembranen mit Osmium sättigen und sterisch verhindern, dass weitere Osmium in das Gewebe diffundieren kann. Wir vermuten jedoch, das Wasser als Lösungsmittel für die Osmium fungiert als einem leichten Reinigungsmittel und permeabilizes das Gewebe ausreichend um Tiefe Diffusion in das Gewebe zu ermöglichen.
Wenn Experimentatoren, ein kleineres Gehirn, wie einer Maus vorbereiten, kann wahrscheinlich die Inkubationszeit im Osmium reduziert werden. Ebenso muss die Inkubationszeit in größeren Proben erhöht werden. Dies kann getestet werden, um die minimale Zeit für einheitliche Färbung in ein Gehirn, das in der Größe unterscheidet sich von einer Ratte ist zu bestimmen. Wenn Experimentatoren mit vollen Osmium Infiltration Probleme, verwenden die wahrscheinlichsten Probleme nicht PFA und GA während der Perfusion und Post-Fixierung, nicht mit Wasser als Lösungsmittel für Osmium (wie oben erläutert) und unzureichende Agitation während osmium Inkubation. Wir gefunden, zum Beispiel, wenn Inkubation in 50 mL konische Rohre, Verlegung der Röhren auf ihrer Seite (wie vertikal auf einem Halter gegen), füllt sie mit Fleck und legte sie auf einem Orbitalschüttler bei 50 u/min, für die gesamte Inkubation Zeit richtige gewährleistet Infiltration.
Diese Methode ist in mehrfacher Hinsicht begrenzt. Zuerst bewahrt die Vorbereitung nicht Ultrastruktur sehr gut es für Elektronenmikroskopie sollte nicht verwendet werden. Diese Methode kann nicht mit weiteren Histologie oder Immunfluoreszenz kombiniert werden. Die Auflösung der digitalen Volumen richtet sich nach der Größe der Stichprobe (kleinere Proben können bei höheren Auflösungen gescannt werden) und durch die Geometrie des Scanners, wenn es stützt sich auf geometrische Vergrößerung; Unterabschnitte der Probe können jedoch bei höheren Auflösungen gescannt werden, falls gewünscht.
Eine neue Methode, die Kombination von Elektronenmikroskopie-Stil Gewebe Behandlung mit Mikro-CT-Bildgebung für die Quantifizierung Läsionen und Lokalisierung von Elektroden in kleinen tierischen Gehirnen wurde vorgestellt. Diese Methode ist wohl weniger aufwändig, erfordert weniger Fachwissen und quantifizierbaren Ergebnissen leichter als der aktuelle Gold-Standard für Schnitt und Färbung eine Gehirn. Bisher haben Wissenschaftler ein Protokoll für sogar Osmium Eindringen in Mäusegehirnen beschrieben, die Ultrastruktur für Elektronenmikroskopie21,22bewahren soll. Dieses Protokoll ist jedoch sehr komplex. In dieser Studie sollte die Autoren eine viel einfachere Methode für Mikro-CT-Bildgebung anstatt Elektronenmikroskopie zu entwickeln. Es wurden andere Studien Anwendung von Mikro-CT Imaging Gehirne für verschiedene Zwecke. Eine frühere Untersuchung bei Kaninchen und Mäusen verwendet Mikro-CT, um Tumoren und andere Anomalien23zu finden. Diese Untersuchung gemacht Verwendung von proprietären MRT-Kontrastmittel, aber die Forscher sahen voraus, Mikro-CT potenziellen Nutzen in Studien der Läsion. Eine weitere Studie an Mäusen Ziel zu finden, grob morphologischen Unterschiede für einen Drogentest beteiligt die Färbung von Mäusegehirnen mit Jod in den Schädel, aber die Autoren konfrontiert ungleichmäßige Gewebe schrumpfen und sich dafür entschieden, das Gewebe in einem Hydrogel24einbetten. Andere Studien an Mäusen haben darauf abgezielt, zerebrale höhlenartige Fehlbildungen, eine Störung der ungewöhnlich große und unregelmäßige Kapillaren zu finden und haben Gebrauch von Osmium ausgefällt und wässrigen Jod als Flecken; jedoch wurden diese in viel kleineren Proben (freistehende Maus Hindbrains) als25,26,27hier beschrieben durchgeführt. Alternative Methoden zur Erzeugung von 3D Gehirn Bände sind µMRI28 und hochauflösende Episcopic Mikroskopie31. Die Auflösung des µMRI ist schlechter (~ 25 µm Voxel für ähnliche Proben28), und die Technik ist teurer23,30. Hochauflösende Episcopic Mikroskopie auch Herausforderungen: Es ist eine destruktive Technik, sodass eine Block-Gesicht-Apparat ermöglicht, ganze Gehirn schneiden würde produziert werden müssen. Die hier vorgestellte Arbeit erstreckt sich auch auf frühere Bemühungen, Elektroden in das Gehirn mit Röntgenstrahlen32,33,34 zu finden, durch die Erfassung sowohl der Elektrode und umliegendes Gewebe. Darüber hinaus ermöglicht die Technik zur Ortung von einzelnen Elektroden Tuberkuloseinfektion Arrays, elektrolytische Läsionen, Elektrode Spuren und Silizium-Sonden.
Eine wertvolle zukünftige Richtung wäre die Einrichtung eines "Durchschnittliches Gehirn" Atlas auf die Läsion Studien Co registriert werden könnte, um Läsion Lage und Größe Quantifizierung zu standardisieren. Diese Methode kann auch für andere Modell und nicht-Modellorganismen, wie durch seine unmittelbare Anwendung auf das Gehirn Zebrafinken (Abbildung 2) erweitert werden.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Greg Lin und Arthur McClelland für ihr Fachwissen mit der Mikro-CT-Maschine, David Richmond und Hunter Elliott auf das Bild und Daten-Analyse-Kern (sein) an der Harvard Medical School für ihre Bildverarbeitungs-Beratung und William Liberti bei Boston Universität für die Bereitstellung von gnädig einer Zebrafinken-Gehirns. Diese Arbeit wurde teilweise in der Mitte für Nanoscale Systems (ZNS), ein Mitglied von der nationalen Nanotechnologie abgestimmte Infrastruktur Netzwerk (NNCI), durchgeführt, die von der National Science Foundation unter NSF Award Nr. 1541959 unterstützt wird. CNS ist ein Teil von der Harvard University. Diese Arbeit wurde von Richard und Susan Smith Family Foundation und IARPA (Vertrag #D16PC00002) unterstützt. S.B.E.W. wurde unterstützt durch Stipendien aus dem Human Frontier Science Program (HFSP; LT000514/2014) und der European Molecular Biology Organization (EMBO; ALTF1561-2013). G.g. wurde von der National Science Foundation (NSF) Graduate Research Fellowship Programm (GRFP) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences (EMS) | 15710 | 2% (w/v/) in 1X PBS |
| Glutaraldehyde (GA) | EMS | 16220 | 2.5% (w/v) GA in 1x PBS |
| OsO4 | EMS | 19190 | Work in fume hood |
| Ethanol | Decon Labs | Koptec | 140, 190, 200 proof |
| Acetone | EMS | 10015 | Glass-distilled |
| Durcupan ACM resin | Sigma-Aldrich | 44610 | A, B, C and D components, resin for embedding |
| Disposable molds | Ted Pella | 27114 | Suggested |
| milliQ water (ultrapure water) | Millipore Sigma | QGARD00R1 (or related purifier) | Suggested |
| Parafilm (paraffin film) | Millipore Sigma | P7793 | Suggested paraffin film |
| Micro-CT scanner | Nikon Metrology Ltd., Tring, UK | X-Tek HMS ST 225 | Used by authors |
| Software for visualizing and analyzing micro-CT scans: | |||
| Volume Graphics | VG Studio Max | Used by authors | |
| FEI / Thermo Scientific | Avizo | Used by authors | |
| FEI / Thermo Scientific | Amira | Similar to Avizo | |
| Mark Sutton & Russell Garwood | Spiers | Free, http://spiers-software.org/ | |
| Pixmeo Sarl | Osirix Lite | Free, https://www.osirix-viewer.com/ | |
| Open Source | FIJI | Free, https://fiji.sc/ | |
| Adobe | Photoshop | Good for analyzing one slice at a time |
Referenzen
- Scoville, W., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neuropsychiatry and Clinical Neuroscience. 12, 103-113 (2000).
- Damasio, H., Grabowski, T., Frank, R., Galaburda, A. M., Damasio, A. R. The return of Phineas Gage: clues about the brain from the skull of a famous patient. Science. 264 (5162), 1102-1105 (1994).
- Kawai, R., et al. Motor cortex is required for learning but not for executing a motor skill. Neuron. 86, 800-812 (2015).
- Otchy, T., et al. Acute off-target effects of neural circuit manipulations. Nature. 528, 358-363 (2015).
- Wright, N., Vann, S., Aggleton, J., Nelson, A. A critical role for the anterior thalamus in directing attention to task-relevant stimuli. Journal of Neuroscience. 35, 5480-5488 (2015).
- Kapgal, V., Prem, N., Hegde, P., Laxmi, T., Kutty, B. Long term exposure to combination paradigm of environmental enrichment, physical exercise and diet reverses the spatial memory deficits and restores hippocampal neurogenesis in ventral subicular lesioned rats. Neurobiology of Learning and Memory. 130, 61-70 (2016).
- Hosseini, N., Alaei, H., Reisi, P., Radahmadi, M. The effects of NBM- lesion on synaptic plasticity in rats. Brain Research. 1655, 122-127 (2017).
- Palagina, G., Meyer, J., Smirnakis, S. Complex visual motion representation in mouse area V1. Journal of Neuroscience. 37, 164-183 (2017).
- Ranjbar, H., Radahmadi, M., Reisi, P., Alaei, H. Effects of electrical lesion of basolateral amygdala nucleus on rat anxiety-like behavior under acute, sub-chronic, and chronic stresses. Clinical and Experimental Pharmacology and Physiology. , (2017).
- Wood, R., et al. The honeycomb maze provides a novel test to study hippocampal-dependent spatial navigation. Nature. , (2018).
- Vermaercke, B., et al. Functional specialization in rat occipital and temporal visual cortex. Journal of Neurophysiology. 112, 1963-1983 (2014).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551, 232-236 (2017).
- Masís, J., et al. micro-CT-based method for quantitative brain lesion characterization and electrode localization. Scientific Reports. 8, 5184 (2018).
- Gage, G., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. 65, 3564 (2012).
- Helander, K. Kinetic studies of formaldehyde binding in tissue. Biotechnic & Histochemistry. , (1994).
- Paljärvi, L., Garcia, J., Kalimo, H. The efficiency of aldehyde fixation for electron microscopy: stabilization of rat brain tissue to withstand osmotic stress. Histochemical Journal. , (1979).
- Okuda, K., Urabe, I., Yamada, Y., Okada, H. Reaction of glutaraldehyde with amino and thiol compounds. Journal of Fermentation and Bioengineering. 71, (1991).
- Bahr, G. Osmium tetroxide and ruthenium tetroxide and their reactions with biologically important substances: electron stains III. Experimental Cell Research. , (1954).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry & Cytochemistry. 9, 560-563 (1961).
- Riemersma, J. Osmium tetroxide fixation of lipids for electron microscopy a possible reaction mechanism. Biochimica et Biophysica Acta. 152, (1968).
- Mikula, S., Binding, J., Denk, W. Staining and embedding the whole mouse brain for electron microscopy. Nature Methods. 9, 1198-1201 (2012).
- Mikula, S., Denk, W. High-resolution whole-brain staining for electron microscopic circuit reconstruction. Nature Methods. 12, 541-546 (2015).
- Crespigny, A., et al. 3D micro-CT imaging of the postmortem brain. Journal of Neuroscience Methods. 171, 207-213 (2008).
- Anderson, R., Maga, A. A novel procedure for rapid imaging of adult mouse brains with MicroCT using Iodine-Based contrast. PLoS One. 10, 0142974 (2015).
- Zhou, Z., et al. Cerebral cavernous malformations arise from endothelial gain of MEKK3-KLF2/4 signalling. Nature. 532, 122-126 (2016).
- Choi, J., et al. Micro-CT imaging reveals mekk3 heterozygosity prevents cerebral cavernous malformations in Ccm2-Deficient mice. PloS One. 11, 0160833 (2016).
- Choi, J., Yang, X., Foley, M., Wang, X., Zheng, X. Induction and Micro-CT imaging of cerebral cavernous malformations in mouse model. Journal of Visualized Experiments. , (2017).
- Benveniste, H., Kim, K., Zhang, L., Johnson, G. Magnetic resonance microscopy of the C57BL mouse brain. Neuroimage. 11, 601-611 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211, 213-221 (2006).
- Schneider, J. E., et al. high-throughput magnetic paragraph sign resonance imaging of mouse embryonic paragraph sign anatomy using a fast gradient-echo sequence. MAGMA. 16, 43-51 (2003).
- Sharpe, J. Optical projection tomography. Annual Review of Biomedical Engineering. 6, 209-228 (2004).
- Cox, D. D., Papanastassiou, A., Oreper, D., Andken, B., James, D. High-Resolution Three-Dimensional microelectrode brain mapping using stereo microfocal x-ray imaging. Journal of Neurophysiology. 100, 2966-2976 (2008).
- Borg, J. S., et al. Localization of metal electrodes in the intact rat brain using registration of 3D microcomputed tomography images to a magnetic resonance histology atlas. eNeuro. 2, (2015).
- Fu, T. -. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13, 875-882 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.