Method Article
أسلوب المستندة إلى الأشعة المقطعية الصغرى لتميز الآفات وتحديد مواقع الأقطاب في أدمغة الحيوانات الصغيرة
In This Article
Summary
توضح هذه المقالة طريقة واضحة لإعداد أدمغة الحيوانات الصغيرة لتصوير الأشعة المقطعية الصغرى، في الآفات التي يمكن قياسها كمياً واقطاب الموقع بدقة عالية في سياق الدماغ كله.
Abstract
التحقق من مكان الآفة والقطب تتم تقليديا عبر نسيجية فحص شرائح المخ الملون، إجراء تستغرق وقتاً طويلاً ويتطلب تقدير دليل. وهنا يصف لنا أسلوب بسيط ومباشر للتحديد الكمي للآفات وتحديد مواقع أقطاب كهربائية في الدماغ الذي هو أقل مشقة، وتعطي نتائج أكثر تفصيلاً. العقول كلها ملطخة بأكسيد الاوزميوم، جزءا لا يتجزأ من الراتنج، وتصويرها مع الماسح ضوئي CT الصغرى. المسح الضوئي ينتج وحدات التخزين الرقمي 3D للعقول مع القرارات وسمك الفرع الافتراضي يعتمد على حجم العينة (12-15 و 5-6 ميكرون كل فوكسل للفئران وحمار وحشي فينش العقول، على التوالي). الآفات السطحية والعميقة يمكن أن توصف، وواحدة تيتروديس, تيترودي صفائف, آفات كهربائياً، ويمكن أيضا أن تكون مترجمة المسابير السليكون. البرمجيات الحرة والملكية يسمح المجربون لدراسة حجم العينة من أي طائرة والجزء المتعلق بالحجم يدوياً أو تلقائياً. نظراً لأن هذا الأسلوب إنشاء حجم الدماغ كله، الآفات واقطاب يمكن قياسها كمياً لدرجة أعلى بكثير مما في الأساليب الحالية، مما سيساعد على توحيد المقارنات داخل وعبر الدراسات.
Introduction
علماء الأعصاب قد اعتمدت على الآفات لفترة طويلة من أجل فهم العلاقة بين الوظيفة والمكان في الدماغ. على سبيل المثال، قد فهمنا الحصين بأنه لا غنى عنه للتعلم والذاكرة وقشرة prefrontal كمفتاح للتحكم دفعة منتجات كلا من آفات الصدفة في البشر1،2. قد يسمح باستخدام نماذج حيوانية، ولكن علماء الأعصاب لتسخير القوة الآفات التي يتجاوز مجرد الصدفة، وقد تم توضيح الوظيفة من عدد لا يحصى من مناطق الدماغ من خلال دراسات منهجية للدالة هيكل العلاقات من خلال 3،الآفات4.
لتعيين الدالة بشكل صحيح إلى بنية، ومع ذلك، تتطلب دراسات الآفة إجراءات القياس الكمي الدقيق، وهي منطقة التي كانت تفتقر إلى. معيار الذهب الحالي للتحديد الكمي للآفات إلى الباب، وجبل، والعقول الصورة مع مجهر ضوء. ثم تتم مطابقة الشرائح المصورة لأقرب الفروع المتعلقة بأطلس، واحداثيات تقريبية للآفات عبر مواضيع غير مباشر يقال، غالباً من خلال استخدام الصور lucida الكاميرا أو المثال شرائح نسيجية3،4 ،،من56،،من78،9،10.
أبعد من عدم الدقة في الإجراءات الحالية لتقدير حجم الآفة، هذه التقنيات مضيعة للوقت وعرضه للفشل. يمكن أن تؤدي التغييرات الصغيرة في تصلب الدماغ والحدة بليد، ودرجة الحرارة إلى مقاطع فاشلة أو مشوه أو ممزقة. مقاطع يمكن أيضا وصمة عار غير متكافئ وتصويرها غير سليمة بسبب فقاعات في الأجلين المتوسط وتصاعد. الأهم من ذلك، تقطيع، إطار ثلاثي الأبعاد للموقع للآفة في الدماغ عند المفقودة، مما يجعل إعادة الإعمار 3D دقيقة من الآفة في تحدي الدماغ.
وقد آخر التطبيقات الشائعة للآفات لتحديد موقع واحد ومتعددة التسجيلات الكهربائي في الدماغ. في نهاية الدورة التسجيل النهائي، الباحثون حمل آفات الالكتروليتى صغيرة على طرف القطب وعملية المخ الأشيع كما فعلت في تجربة آفة تقليدية11. هذا الأسلوب يعاني من نفس العيوب المذكورة أعلاه، مع مشاكل إضافية هي أن تكون عادة أكبر من أقطاب كهربائية تستخدم لجعلها الآفات الالكتروليتى ولكن عادة ما تكون صغيرة بما يكفي بأنها تمثل تحديا لإيجاد الأشيع. عندما يتم إدراج متعددة الأقطاب، على غرار مجموعة تيترودي، التحقق من خلال الآفات الالكتروليتى حتى أكثر صعوبة. بديل لآفات الالكتروليتى هو استخدام صبغة على مسرى بعد التحقق من الأشيع12، ولكن هذا الأسلوب يعاني من نفس العيوب التي تأتي مع الأنسجة التقليدية.
هنا، يمكننا وصف متعمق أسلوب وصف مؤخرا13 استناداً إلى تلطيخ تقنيات الميكروسكوب الإلكتروني (م) والأشعة السينية المقطعي (الصغرى-CT) التي يوضحها الآفات ويحدد موقع الأقطاب في أدمغة الحيوانات الصغيرة أفضل من الحالية أساليب. CT الجزئي هو أسلوب تصوير فيها إطلاق النار الأشعة السينية في نموذج الذي يتم استدارة 360 درجة بينما يقوم سسينتيلاتور تجميع الأشعة السينية لا نحيد بالعينة. والنتيجة هي إعادة إعمار 3D رقمية ذات الدقة عالية للعينة التي يمكن أن تصور في أي اتجاه وتحديداً كمياً. وقد العديد من المؤسسات الأكاديمية الصغرى-CT الماسحات الضوئية، وهي أيضا متاحة تجارياً.
Protocol
استعراض كل الرعاية والتلاعب التجريبية للحيوانات ووافقت عليه لجنة الاستخدام وجامعة هارفارد، الرعاية المؤسسية على الحيوان. نضح الموصوفة هنا محددة للفئران، ولكن هذا الإجراء لا ينطبق على أي الحيوانات مع أدمغة أصغر أو الحجم وبالمثل.
1. نضح
- إعداد 1 × مخزنة الفوسفات المالحة (PBS). للفئران (العمر: 0.5 – 1.5 سنة، الوزن: غ 250 – 600)، 800 – 1,000 مل ينبغي أن يكون كافياً. استخدم 400 مل نتخلل الحيوان و 400 مل إضافية تمييع مثبت.
- إعداد مثبت تتكون من 2% (w/v) بارافورمالدهيد (PFA) و 2.5% (w/v) جلوتارالديهيدي (GA) في برنامج تلفزيوني 1 x. للفئران، 400 مل كافية. حفظ 50 مل في أنبوب 50 مل مخروطية للتثبيت بعد الدماغ بعد نضح.
- تخدير الفئران مع الغاز إيسوفلوراني 4 – 5% (في 0.8 لتر في الدقيقة س2 في شريط 1.0 في 21 درجة مئوية) لمدة 15 دقيقة.
- حقن جرعة قاتلة من بينتوباربيتال الصوديوم إينترابيريتونيلي (180 مغ/كغ).
- اختبار فقدان المنعكس في الحيوان بإجراء امتحان تو-رشة منعكس. الانتظار للبدء نضح حتى الحيوان فقد ردها منعكس.
- اتبع إينتراكارديال هو موضح سابقا نضح والدماغ استخراج البروتوكول14 مع الحلول التالية: نتخلل الحيوان مع 400 مل من برنامج تلفزيوني 1 x في 125 ملم زئبق لإزالة الدم. مرة واحدة كل الدم قد تم إزالته واستبداله ببرنامج تلفزيوني x 1، تبدأ بيرفوسينج مع 400 مل الحل % 2 منهاج عمل بيجين والجأ 2.5% حله في برنامج تلفزيوني x 1 في 125 ملم زئبق.
ملاحظة: إذا كان الإجراء الذي يجري في حيوان الذي هو ليس من الفئران، العناصر الهامة فقط في الإجراء نضح هي استخدام 1 × 2% وبرنامج تلفزيوني منهاج عمل بيجين، GA 2.5% في برنامج تلفزيوني 1 x. يمكن تعديل حجم الحل وضغط التروية وفقا للأنواع.
2-بعد انتهاء التثبيت
- ضع الدماغ المستخرجة في 2% منهاج عمل بيجين، GA 2.5% في 1 × برنامج تلفزيوني الحل (نفس المستخدمة في نتخلل الحيوان سابقا). التأكد من أن حجم الحل على الأقل 10 × حجم الدماغ. للفئران، وضع الدماغ في أنبوب 50 مل مخروطية مع 50 مل من محلول. تخزين العينة في التثبيت بعد 2-3 أيام، تهز طفيفة عند 4 درجة مئوية.
ملاحظة: إذا كانت العينة في أنبوب 50 مل مخروطية، وضعه أفقياً على شاكر مداري سوف ضمان أفضل النتائج. - بعد العينة قد تم بعد ثابتة لفترة طويلة كافية، تغسل العينة في الماء المقطر مزدوجة (ddH2س) أو الماء المتأين دي (diH2س) الماء عالي النقاوة (انظر الجدول للمواد) أربع مرات للفترات التالية: 1، 1، 1، و 15 دقيقة.
ملاحظة: لهذا البروتوكول، ddH2س أو س diH2الماء عالي النقاوة ينبغي أن تكون قابلة للتبادل. للبساطة، ستستخدم ddH2س للإشارة إلى تنقية المياه من الآن فصاعدا.
3-تلوين
تنبيه: لهذه الخطوة، إجراء جميع الأعمال التحضيرية الحل تحت غطاء محرك السيارة أثناء استخدام القفازات.
- إعداد على الأقل 10 × حجم الدماغ تلطيخ الحل. لأدمغة الفئران، إعداد 50 مل من 2% (w/v) أكسيد الاوزميوم (أوسو4) في ddH2س بضم 25 مل من 4% الأسهم أوسو4 الحل و 25 مل ddH2o.
تنبيه: أكسيد الاوزميوم قابلة للاشتعال وقد تسبب العمى المؤقت ومشاكل في الجهاز التنفسي إذا لم تعالج على نحو ملائم. تجاهل جميع المواد التي اتصل أكسيد الاوزميوم في حاوية مناسبة عن إخطار المواد كيميائية داخل حاوية ثانوية. - وضع الدماغ في أنبوب 50 مل مخروطية الشكل جديد وإضافة الحل4 أوسو. ينبغي أن تبدأ الدماغ لتحويل البنى أوسو4 يتفاعل مع الدهون في الأنسجة.
- إغلاق الأنبوب وختم ذلك تماما مع البارافين الفيلم (انظر الجدول للمواد) التأكد من أنها لا تسرب أثناء الحضانة.
ملاحظة: الاوزميوم متقلبة وسترد أقل ما يقال ببلاستيك الأنبوب، حتى إغلاق الأنبوب بشكل صحيح مهم جداً. قد يكون التفاف الأنبوب مع رقائق الألومنيوم للحماية الإضافية. - تخزين الأنبوبة المختومة في 4 درجات مئوية، تهز طفيفة في شاكر مداري 50 لفة في الدقيقة لمدة أسبوعين. ضع أنبوب أفقياً لضمان خلط أفضل. التأكد من أن العينة هي مغمورة تماما في الحل بينما تهز.
ملاحظة: إذا كان غير مسموح الاوزميوم أن تعمم بشكل مستمر، فإنه قد لا تماما اختراق العينة، ذلك الموضع الأفقي على شاكر مهم جداً.
4-التضمين
- بعد قد تم المحتضنة العينة في أوسو4 لمدة أسبوعين، يغسل مع ddH2س 5 مرات في درجة حرارة الغرفة (RT) للفترات التالية: 1، 1، 1 و 15 و 60 دقيقة لإزالة جميع أوسو غير منضم4 في العينة.
ملاحظة: التبادلات متعددة، بما في ذلك تبادل آخر 60 دقيقة، ضرورية للسماح لجميع أوزميوم في الدورة الدموية منتشر ب. - تغسل العينة مع ddH2س لمدة 30 دقيقة في 4 درجات مئوية.
ملاحظة: قد يستمر أوزميوم منتشر من العينة، ولكن كمية ينبغي أن يخفض إلى حد كبير من الخطوة السابقة. - يذوي العينة مع الإيثانول التسلل في نهاية المطاف أنه مع الراتنج. ليذوي، استبدل ddH2س 10 – 20 مل تخفيف الإيثانول التالية (مدة 30 دقيقة كل في 4 درجات مئوية): الإيثانول 20% (v/v) و 80% (v/v) ddH2س؛ الإيثانول 50% (v/v) و 50% (v/v) ddH2س؛ إيثانول 70% (v/v) و 30% (v/v) ddH2س؛ الإيثانول 90% (v/v) و 10% (v/v) ddH2س؛ الإيثانول 100%.
- إعداد تخفيف الأسيتون/الراتنج كما يلي.
- تحضير 100 مل الراتنج لتضمين (انظر الجدول للمواد) وفقا لإرشادات الشركة المصنعة.
- جعل 33% (v/v) راتنج-67% الحل الأسيتون، صب 15 مل راتنج في أنبوب 50 مل مخروطية وإضافة 30 مل الأسيتون المقطر الزجاج 100%.
- جعل الأسيتون راتنج-50% 50% (v/v)، صب 22.5 مل راتنج في أنبوب 50 مل مخروطية وإضافة 22.5 مل الأسيتون المقطر الزجاج 100%.
- جعل 67% (v/v) راتنج-33% الحل الأسيتون، صب 30 مل راتنج في أنبوب 50 مل مخروطية وإضافة 15 مل الأسيتون المقطر الزجاج 100%.
- استخدم مل 32.5 المتبقية من راتنج كحل أول 100 ٪ راتنج أدناه.
- تبدأ عملية تسلل الراتنج بتحريك العينة من خلال 10-20 مل تخفيف الأسيتون، والاسيتون/الراتنج التالية: الأسيتون 100% لمدة 30 دقيقة عند 4 درجة مئوية؛ الأسيتون 100% لمدة 30 دقيقة عند 4 درجة مئوية؛ والاسيتون 100% لمدة 30 دقيقة في درجة حرارة الغرفة (RT).
ملاحظة: بقية عملية تسلل ستجري في الرايت - تزج العينة في 33% (v/v) الأسيتون 67% راتنج ح 3 في الرايت، ثم الأسيتون راتنج-50% 50% (v/v) ح 3 في الرايت، الأسيتون 33 ٪ راتنج 67% (v/v) ح 3 في الرايت، وراتنج 100% ح 12 في الرايت
- تقديم دفعة جديدة 50 مل من الراتنج اتباع التعليمات الموجودة على الزجاجة. نقل العينة إلى الحاوية التي سيتم علاجها (مثلاً.، قوالب المتاح المبين في الجدول للمواد). صب العينة مع الطازجة 100 ٪ راتنج لمدة 4 ساعات في الرايت
ملاحظة: إذا لم يتم استخدام الراتنج الطازجة، الراتنج به في اليوم السابق سوف تبدأ في تتصلب قبل الأوان، وسوف يكون من الصعب للتلاعب العينة. - ديغا العينة في فرن فراغ لمدة 15 دقيقة عند 45 درجة مئوية.
ملاحظة: هذه الخطوة سوف تساعد على إزالة أي فقاعات الهواء المحبوس داخل العينة، بل هو غير ضروري ولن يؤثر على نوعية البيانات. - وأخيراً، علاج العينة في فرن ح 48 عند 60 درجة مئوية.
5-الصغير-الأشعة المقطعية
- بمجرد قد تم علاجه العينة، تقشر العفن المتاح ومسحها ضوئياً مع الجهاز الصغير-CT.
ملاحظة: اعتماداً على الإله المستخدمة، سوف تكون الإعدادات مختلفة. للماسح المستخدمة من قبل المؤلفين المدرجة في الجدول للمواد، هي الإعدادات المستحسنة 130 كيلو فولت، µA 135 مع عامل تصفية نحاس 0.1 مم ومصدر موليبدينوم، تعرض لفترة ثانية واحدة، وفي متوسط 4 الإطارات في الإسقاط. ومع ذلك، المجربون ينبغي معايرة الماسح الضوئي كل على حدة، كما سوف تؤثر عوامل كثيرة على الإعدادات المثلى خلال جلسة خاصة. - وبمجرد الانتهاء من المسح الضوئي، إعادة إعمار العينة مع المعلمات الموصى به لتركيبة المجرب الماسح الضوئي وبرامج على جهاز كمبيوتر مع برنامج الماسح الضوئي.
- وأخيراً، تصور وتحليل وحدة التخزين الرقمي أعيد بناؤها باستخدام البرمجيات المجرب الاختيار (انظر الجدول للمواد للحصول على أمثلة).
النتائج
تقليديا، مقطوع العقول والملون من أجل التحديد الكمي للآفات وتحديد موقع كهربائي، ولكن هذا الأسلوب عرضه للخطأ، وكثيفة العمالة، وعادة ما يتطلب تقدير النتائج. قبل إعداد العقول كلها للتصوير بالأشعة المقطعية الصغرى، احتمال إلحاق الضرر بالعينات هو تقلص إلى حد كبير وقد حلل الميزات للاهتمام في سياق كامل الدماغ والأسلوب الذي يفسح المجال للمعالجة المتوازية لكثير من العينات، إلى حد كبير الإسراع بإعداد عينة.
الأسلوب يتضمن أربع خطوات رئيسية: (1) تلطيخ المخ perfused مع أكسيد الاوزميوم، (2) تضمين الدماغ في الراتنج، (3) تصوير الدماغ مع الماسح ضوئي CT الصغرى، و (4) تحليل وحدة التخزين الرقمي الناتج عن ذلك (الشكل 1). في هذه المقالة، يرد فقط الخطوات 1-3، كما الخطوة 4 (التحليل) سوف تختلف اختلافاً كبيرا تبعاً للاحتياجات المحددة للمشروع.
بينما في تقطيع التقليدية التي يجب اختيار اتجاه تقطيع مسبقاً، يمكن التلاعب في ثلاثة أبعاد التخزين الرقمي الناتج من هذا الأسلوب وشرائح تقريبا في أي اتجاه (الشكل 2 ألف-2). وقد تفحص المستخدم أيضا فقرة فرعية من العينة بدقة أعلى إذا كان المطلوب، مثل لمبة شمي الدماغ الفئران، حيث تكون الألياف العصبية و glomeruli الفردية مرئية (الشكل 2ج). الأسلوب الذي ينطبق أيضا على نطاق واسع لأدمغة الحيوانات الصغيرة. للتحقق من هذا، أعد المخ زيبرا فينش باستخدام نفس البروتوكول المستخدمة لأدمغة الفئران، وأدت إلى وحدة تخزين رقمي ناجح (الشكل 2ه). وأكد المسح الضوئي المجهر الإلكتروني (SEM) من عينة على استعداد للأشعة المقطعية الصغرى أن الأنسجة تضررت لا تصل إلى حجم في القرار وراء القرار الجزئي CT (الشكل 2د). ومع ذلك، تجدر الإشارة إلى أن هناك ضررا كبيرا ultrastructural، مما يجعل هذا الأسلوب غير مناسب الميكروسكوب الإلكتروني (م).
يمكن استخدام هذه التقنية للعثور على الآفات السطحية (الشكل 3) وآفات عميقة داخل المخ (الشكل 4). التقنية ويسمح أيضا بتحديد تيتروديس واحد في الموقع، آفات الالكتروليتى، المسارات قطب كهربائي للقطر كافية، تيترودي صفائف في الموقع، والسليكون تحقيقات في الموقع (الشكل 5).
وستضم التحضيرات غير الناجحة ناقصة التمعدن النسيج، الذي قد يحدث أيضا في حالة استخدام المخازن المؤقتة غير صحيحة (الشكل 6). ومع ذلك، إلا إذا كان السمات السطحية ضرورية، على سبيل المثال، ثم تلطيخ السطح فقط من العينة قد تكون كافية المجرب.
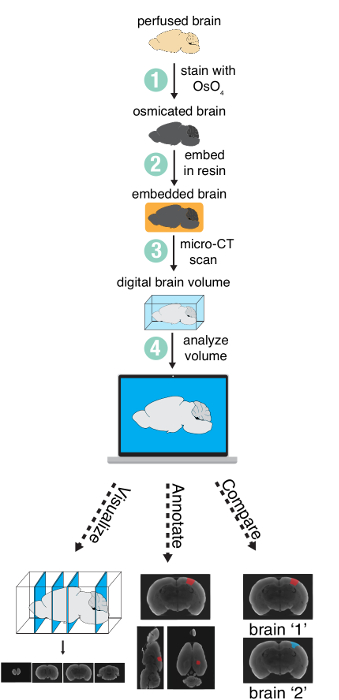
الشكل 1 : نظرة عامة على الأسلوب. نظرة عامة على الخطوات اللازمة لإعداد وتحليل دماغ كله باستخدام التصوير بالأشعة المقطعية الصغرى. الشكل تستخدم بإذن من المؤلفين13. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
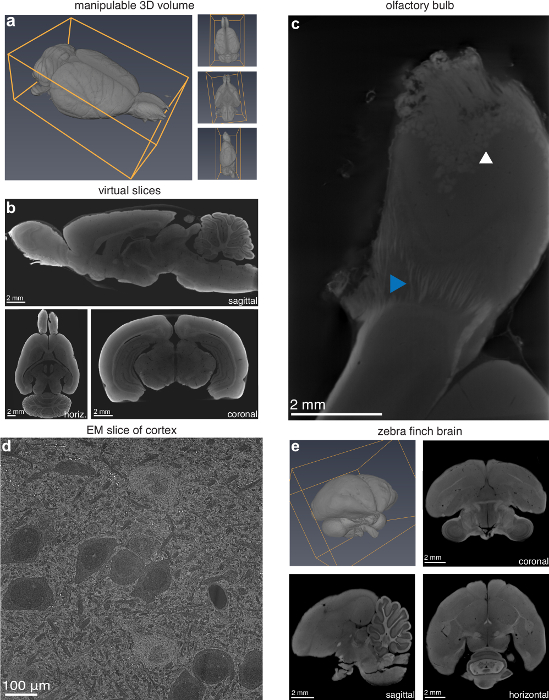
الشكل 2 : قدرات لتوصيف الآفة عن طريق التصوير بالأشعة المقطعية الصغرى. () مانيبولاتابل 3D حجم و (ب) الظاهري شرائح (13.9 مكم فوكسيلس) في التوجهات التعسفية من مايكرو-مقطعية للفئران إيفانز منذ فترة طويلة. (ج) شمي لمبة الممسوحة ضوئياً بدقة أعلى (4.9 مكم فوكسيلس) يكشف عن جلوميرولي (السهم الأبيض) والألياف العصبية الفردية (السهم الأزرق). (د) المسح الضوئي المجهر الإلكتروني (SEM) صورة (10 نيوتن متر/بكسل) البصرية قشرة الدماغ الفئران المعدة للتصوير بالأشعة المقطعية الصغرى. (ﻫ) حمار وحشي فينش (الرقشاء Taeniopygia) الدماغ أعدت للصغير-الأشعة المقطعية التصوير؛ حجم ثلاثي الأبعاد وشرائح 2D (5.6 ميكرون فوكسيلس) في كرونال، الأفقية، وطائرات السهمي. الشكل تستخدم بإذن من المؤلفين13. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3 : توصيف الآفة القشرة البصرية باستخدام مايكرو-قيراط () التصور ثلاثي الأبعاد للدماغ الفئران ليسيونيد في القشرة البصرية مع حمض كوينولينيك. اللوحة اليسرى يظهر حجم الآفة في سياق المخ (الدماغ شفافية قليلاً للسماح بالوصول البصرية للآفة). اللوحة اليسرى يظهر حجم الآفة معزولة. (ب) شرائح 2D الآفة في كورونال وأفقي، وطائرات السهمي (12.8 مكم فوكسيلس). لوحات 3 الأعلى تظهر المقاطع غير مصنف، والألواح السفلي 3 تظهر المقاطع مع الشرح الآفة متراكبة. كانت هذه الآفة يدوياً المشروح في اتجاه الاكليلية كل الشرائح 2. تم إنشاء وحدة التخزين ثم عن طريق الاستيفاء. الشكل تستخدم بإذن من المؤلفين13. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
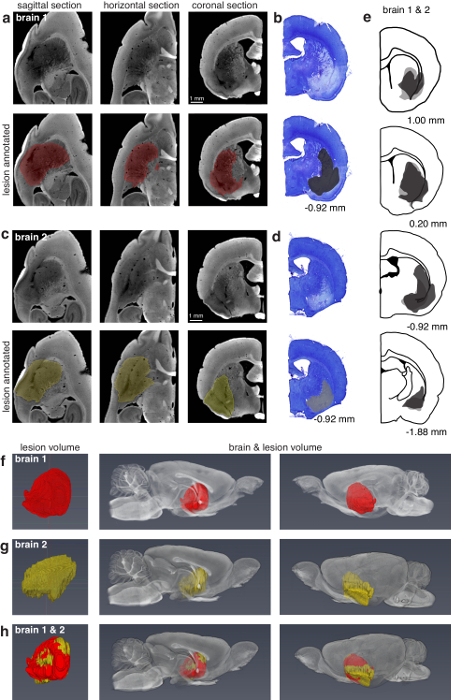
الشكل 4: مقارنة لتوصيف الآفة الجانبية دورسو المخطط باستخدام الأشعة المقطعية الصغرى وعلم الأنسجة. () السهمي، آراء الأفقية، والاكليليه من الجانب الأيمن من "المخ 1" نصف المجهزة للصغير-الأشعة المقطعية التصوير (13.5 مكم فوكسيلس). لوحات 3 الأعلى تظهر المقاطع غير مصنف، والألواح السفلي 3 تظهر الآفة المشروح في نفس المقاطع. كانت الآفة يدوياً مجزأة في الطائرة السهمي كل الأقسام 2 ومحرف في وقت لاحق. (ب) الأقرب مطابقة الاكليلية الفرع الحق في نصف "الدماغ 1" معالجة الأشيع للفحص المجهري الخفيفة. تشبه اللوحات (ج، د) إلى (أ، ب) ولكن تناظر "الدماغ 2". كانت مجزأة في الطائرة الاكليلية الآفة الدماغ 2 يدوياً كل 8 أقسام. (ﻫ) وصف الآفة المعالجة بعلم الأنسجة الصحيح نصفي العقول 1 (رمادي داكن) و 2 (رمادي فاتح). الأرقام في (ب، د، ه) تحت اللوحات تتوافق مع المواقف بالنسبة إلى بريجما. (و) وصف الآفة من اليسار نصف الدماغ 1 المجهزة للصغير-قيراط الفريق الأول يظهر الآفة معزولة. وتظهر اللوحات الثانية والثالثة الآفة في سياق الدماغ من وجهتي. (ز) نفس (و) لكن المقابلة للدماغ 2. (ح) تراكب للآفات في (و، ز) التي توضح القدرة على المقارنة بين توصيف الآفة مع وحدات التخزين الرقمي الدماغ. وسجلت الآفة في (و) للآفة في (ز)، وكلاهما يرد في سياق النصف الأيسر من الدماغ 2. الشكل تستخدم بإذن من المؤلفين13. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
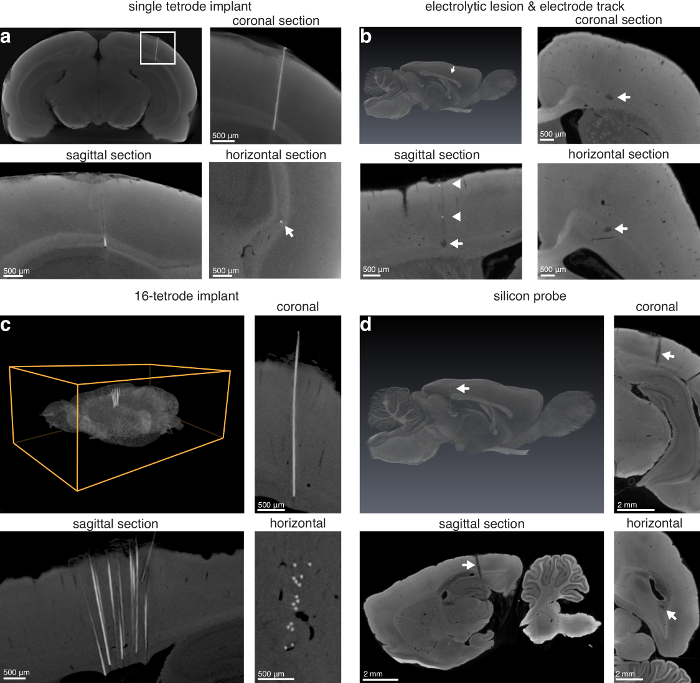
الشكل 5 : القطب التعريب من خلال التصوير بالأشعة المقطعية الصغرى. () واحدة تيترودي الأيمن في الموقع (14.0 مكم فوكسيلس). اللوحة اليسرى العلوية: ماكس-كثافة الإسقاط الأقسام الاكليلية الظاهري تبين موقع تيترودي نيتشرومي السفر عبر القشرة البصرية إلى كلثوم الإحضار من الفئران؛ أعلى اليمين: عن قرب صورة تظهر في أعلى اللوحة اليسرى من (أ) (مستطيل أبيض). أسفل اليسار: السهمي؛ أسفل اليمين: وجهات النظر الأفقي القطب مزروع (السهم الأبيض يشير إلى موقع تيترودي). (ب) الكهرلية الآفة والقطب المسار في المنطقة الأمامية من الدماغ الفئران (13.9 مكم فوكسيلس). أعلى اليسار: عرض ثلاثي الأبعاد للدماغ مع الآفة الالكتروليتى مجزأة بها (سهم أبيض يشير إلى آفة الأرجواني)؛ أعلى اليمين: كرونال. أسفل اليسار: السهمي؛ أسفل اليمين: أنتجت المقاطع الأفقية التي تشير إلى آفة الالكتروليتى (الأسهم البيضاء) مع مكم 75 قطر تنغستن قطب. وبالإضافة إلى ذلك، بعض المعادن التي أودعتها الكهربائي عند سحب مرئياً على طول المسار في رأي السهمي (رؤوس بيضاء). (ج) 16-تيترودي زرع تركت في الموقع في اللحاء الأمامي للمخ الفئران. أعلى اليسار: التقديم ثلاثي الأبعاد للدماغ كله مع مجموعة 16-تيترودي اليسار مزروع؛ أعلى اليمين: كرونال. أسفل اليسار: السهمي؛ أسفل اليمين: مقاطع أفقية مما يدل زرع 16-تيترودي (8.9 مكم فوكسيلس). مسبار (د) السليكون (عرقوب 10 ملم، ومواقع 32) تركت في الموقع السفر عن طريق اللحاء الخلفي، والحصين، وهياكل سوبكورتيكال (13.9 مكم فوكسيلس). أعلى اليسار: عرض ثلاثي الأبعاد للمخ كامل مع تحقيق سليكون مجزأة (السهم الأبيض مسبار الخضراء التي تشير إلى)؛ أعلى اليمين: كرونال. أسفل اليسار: السهمي؛ أسفل اليمين: سبر الآراء الأفقي السيليكون في الدماغ. بالإضافة إلى ذلك، الموقع المرجعي في التحقيق السليكون مرئياً في المقاطع الاكليلية والسهمي (نصيحة أسهم البيضاء). الشكل تستخدم بإذن من المؤلفين13. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
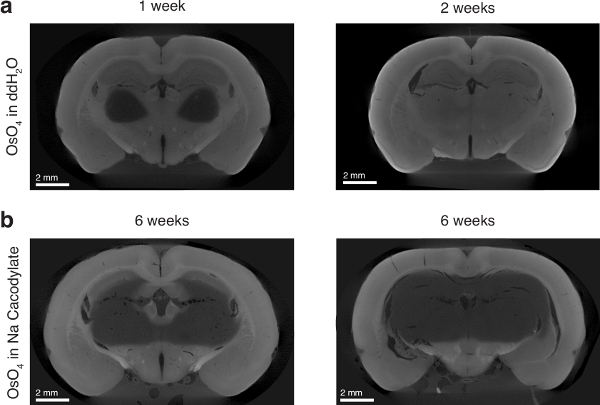
الرقم 6 : تأثير المذيبات أكسيد الاوزميوم على اختراق أوزميوم- () ترك الفريق: الفئران الدماغ المحتضنة في أكسيد الاوزميوم في ddH2س لمدة أسبوع واحد. اللوحة اليسرى: الفئران الدماغ المحتضنة في أكسيد الاوزميوم في ddH2س لمدة أسبوعين. المحتضنة أدمغة الفئران اثنين (ب) في أكسيد الاوزميوم في المخزن المؤقت كاكوديلاتي الصوديوم لمدة 6 أسابيع. الشكل تستخدم بإذن من المؤلفين13. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
وفيما يلي الخطوات الأساسية للبروتوكول: أولاً، استخدام مزيج من منهاج عمل بيجين والجأ نتخلل الحيوان وفي وقت لاحق بعد إصلاح الدماغ أمر بالغ الأهمية لتحقيق اختراق أوزميوم كاملة متسقة من الأنسجة. على الرغم من أننا لا اختبار هذا صراحة، تفسيراً معقولاً هو أن تثبيت PFA15من عكسها، حين ألجأ التثبيت ليس عكسها16،17. لأنه مطلوب حضانة أسبوعين في أكسيد الاوزميوم لتسلل كامل النسيج، فمن الممكن أن منهاج عمل بيجين في المناطق الداخلية للدماغ ينشر خارجاً والأنسجة ويتحلل خلال تلطيخ. أوزميوم وبالتالي لا يمكن الحفاظ على الهياكل الداخلية.
استخدام أوزميوم مائي، بدلاً من أوزميوم حله في المخزن مؤقت (أي، كاكوديلاتي الصوديوم)، كانت ضرورية لضمان اختراق الأنسجة كاملة قبل الاوزميوم. حتى بعد حضانة أسبوع 6، أوزميوم المذابة في كاكوديلاتي الصوديوم لا اختراق الأنسجة تماما، ويبدو أن تواجه حاجزاً نشرها (الشكل 6). أوزميوم هو رد الفعل جداً للدهون والفكر لربط تلك الموجودة في أغشية الخلايا18،،من1920. إذا لم يتم بيرميبيليزيد الأنسجة بما فيه الكفاية، كما قد يكون الحال بالنسبة لمنطقة عازلة رقيقة مثل كاكوديلاتي الصوديوم، فمن الممكن أن أغشية الخلية قد تشبع مع أوزميوم ومنع ستيريكالي أوزميوم المزيد من نزع فتيل الأنسجة. ومع ذلك، نحن افترض أن الماء كمذيب الاوزميوم ويعمل كمطهر خفيفة وبيرميبيليزيس الأنسجة بما فيه الكفاية للسماح بنشر العميق الأنسجة.
إذا المجربون تجهز دماغ أصغر، مثل الماوس، يمكن المحتمل أن تخفيض فترة الحضانة في أوزميوم. وبالمثل، يحتاج فترة حضانة المرض إلى زيادة في عينات أكبر. ويمكن اختبار هذا لتحديد الحد الأدنى من الوقت لتلطيخ متسقة في دماغ التي تختلف في الحجم مقارنة بالفئران. إذا المجربون تواجه مشاكل مع تسلل أوزميوم الكامل، المشاكل المحتمل لا تستخدم كل من منهاج عمل بيجين والجأ أثناء التروية وبعد انتهاء التثبيت، لا تستخدم الماء المذيب أوزميوم (كما ورد أعلاه)، والانفعالات غير كافية خلال أوزميوم الحضانة. وجدنا، على سبيل المثال، أنه عندما تفرخ في أنابيب مخروطية 50 مل، مد الأنابيب إلى جانبهم (في مقابل رأسياً على حامل) وملئها بوصمة عار، ووضعها على شاكر مداري 50 لفة في الدقيقة لفترة حضانة أسرة السليم عمليات التسلل.
ويقتصر هذا الأسلوب في عدة طرق. أولاً، الإعداد لا يحافظ على أولتراستروكتوري جيد جداً، حيث أنه لا ينبغي أن تستخدم للمجهر الإلكتروني. لا يمكن دمج هذا الأسلوب مع أي المزيد من الأنسجة أو الفلورة. حل وحدة التخزين الرقمي يتحدد حجم العينة (عينات أصغر يمكن مسحها ضوئياً بدقة أعلى) والهندسة من الماسح الضوئي، إذا أنها تعتمد على التكبير هندسية؛ ومع ذلك، يمكن تفحص أجزاء فرعية من العينة بدقة أعلى، إذا رغبت في ذلك.
وقد قدمت أسلوب جديد يجمع بين المجهر الإلكتروني على غرار الأنسجة المعاملة مع تصوير مايكرو-الأشعة المقطعية لتحديد الآفات وإضفاء الطابع المحلي على أقطاب في أدمغة الحيوانات الصغيرة. هذا الأسلوب يمكن القول أقل مشقة، ويتطلب أقل خبرة، وغلة النتائج القابلة للقياس بسهولة أكثر من معيار الذهب الحالي لتمزيقها وتلطيخ في المخ. سابقا، وقد وصف العلماء بروتوكول لاختراق أوزميوم حتى في العقول الماوس التي تهدف إلى الحفاظ على أولتراستروكتوري الميكروسكوب الإلكتروني21،22. بيد أن هذا البروتوكول، معقدة جداً. في هذه الدراسة، الكتاب يهدف إلى تطوير طريقة أبسط بكثير للتصوير بالأشعة المقطعية الصغرى بدلاً من المجهر الإلكتروني. وهناك دراسات أخرى تطبيق الصغرى-CT للتصوير العقول لأغراض مختلفة. تحقيق سابق في الفئران والأرانب المستخدمة الصغرى-CT للعثور على أورام و تشوهات أخرى23. هذا التحقيق استخدام الملكية عوامل التباين التصوير بالرنين المغناطيسي، ولكن الباحثين التنبؤ الصغرى-CT الفائدة المحتملة في دراسات الآفة. دراسة أخرى في الفئران الرامية إلى إيجاد الاختلافات المورفولوجية الإجمالي لشاشة المخدرات تشارك تلطيخ العقول الماوس مع اليود في الجمجمة، ولكن المؤلفين تواجه انكماش الأنسجة متفاوتاً واختارت لتضمين الأنسجة في المائية24. دراسات أخرى في الفئران وتهدف إلى البحث عن التشوهات الدماغية مجوف، اضطراب في الشعيرات الدموية الكبيرة انخفاضا غير عادي وغير النظامية، وجعلت استخدام أكسيد الازميوم واليود مائي كالبقع؛ ومع ذلك، هذه أجريت في عينات أصغر بكثير (فصل الماوس هيندبرينس) مما وصف هنا25،،من2627. هي أساليب بديلة لتوليد كميات الدماغ 3D µMRI28 و الفحص المجهري ابيسكوبيك عالي الدقة31. حل µMRI الأكثر فقراً (~ 25 ميكرومتر فوكسيلس ل عينات مماثلة28)، وهذا الأسلوب هو أغلى23،30. مجهرية ابيسكوبيك عالية الدقة كما يواجه تحديات: أن أسلوب مدمرة، وسيحتاج جهاز كتلة من وجه السماح تقطيع الدماغ الجامع إنتاجها. ويمتد العمل المقدمة هنا أيضا الجهود السابقة لتحديد موقع أقطاب كهربائية في الدماغ بالأشعة السينية32،،من3334 بالتقاط كل مسرى والأنسجة المحيطة. علاوة على ذلك، يسمح هذا الأسلوب لتحديد موقع واحد أقطاب، صفائف تيترودي والآفات الالكتروليتى، المسارات القطب والمسابير السليكون.
أن اتجاه مستقبل قيمة إنشاء أطلس "متوسط الدماغ" تسجيل التي الآفة دراسات يمكن أن يشترك بتوحيد مكان الآفة وتقدير حجم. كما يمكن توسيع هذا الأسلوب إلى أخرى النموذج والكائنات الحية غير النموذجية، كما يتضح من تطبيقه فورا على الدماغ حمار وحشي فينش (الشكل 2).
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
يشكر المؤلفون لين جريج وآرثر ماكليلاند لخبرتهم مع آلة الأشعة المقطعية الصغرى وديفيد ريتشموند واليوت هنتر في الصورة وتحليل البيانات الأساسية (إيداك) في مدرسة هارفارد الطبية لهذه المشورة ومعالجة الصور، ووليام ليبرتي في بوسطن الجامعة تكرم توفير المخ زيبرا فينش. هذا العمل قد أنجز جزئيا في المركز لأنظمة النانو (CNS)، عضوا للوطنية تكنولوجيا النانو منسقة البنية التحتية الشبكة (ننسى)، الذي تدعمه "المؤسسة الوطنية للعلوم" NSF جائزة 1541959 رقم. الجهاز العصبي المركزي جزء من جامعة هارفارد. كان يؤيد هذا العمل ريتشارد و "سوزان سميث مؤسسة الأسرة" وإياربا (عقد #D16PC00002). وأيده S.B.E.W. زمالات دراسية من "برنامج العلوم البشرية الحدودية" (هفسب؛ LT000514/2014) والمنظمة الأوروبية في مجال البيولوجيا الجزيئية (التطريز؛ ALTF1561-2013). وأيد غ. غ. بمؤسسة العلوم الوطنية (NSF) الدراسات العليا البحوث زمالة برنامج (جرفب).
Materials
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences (EMS) | 15710 | 2% (w/v/) in 1X PBS |
| Glutaraldehyde (GA) | EMS | 16220 | 2.5% (w/v) GA in 1x PBS |
| OsO4 | EMS | 19190 | Work in fume hood |
| Ethanol | Decon Labs | Koptec | 140, 190, 200 proof |
| Acetone | EMS | 10015 | Glass-distilled |
| Durcupan ACM resin | Sigma-Aldrich | 44610 | A, B, C and D components, resin for embedding |
| Disposable molds | Ted Pella | 27114 | Suggested |
| milliQ water (ultrapure water) | Millipore Sigma | QGARD00R1 (or related purifier) | Suggested |
| Parafilm (paraffin film) | Millipore Sigma | P7793 | Suggested paraffin film |
| Micro-CT scanner | Nikon Metrology Ltd., Tring, UK | X-Tek HMS ST 225 | Used by authors |
| Software for visualizing and analyzing micro-CT scans: | |||
| Volume Graphics | VG Studio Max | Used by authors | |
| FEI / Thermo Scientific | Avizo | Used by authors | |
| FEI / Thermo Scientific | Amira | Similar to Avizo | |
| Mark Sutton & Russell Garwood | Spiers | Free, http://spiers-software.org/ | |
| Pixmeo Sarl | Osirix Lite | Free, https://www.osirix-viewer.com/ | |
| Open Source | FIJI | Free, https://fiji.sc/ | |
| Adobe | Photoshop | Good for analyzing one slice at a time |
References
- Scoville, W., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neuropsychiatry and Clinical Neuroscience. 12, 103-113 (2000).
- Damasio, H., Grabowski, T., Frank, R., Galaburda, A. M., Damasio, A. R. The return of Phineas Gage: clues about the brain from the skull of a famous patient. Science. 264 (5162), 1102-1105 (1994).
- Kawai, R., et al. Motor cortex is required for learning but not for executing a motor skill. Neuron. 86, 800-812 (2015).
- Otchy, T., et al. Acute off-target effects of neural circuit manipulations. Nature. 528, 358-363 (2015).
- Wright, N., Vann, S., Aggleton, J., Nelson, A. A critical role for the anterior thalamus in directing attention to task-relevant stimuli. Journal of Neuroscience. 35, 5480-5488 (2015).
- Kapgal, V., Prem, N., Hegde, P., Laxmi, T., Kutty, B. Long term exposure to combination paradigm of environmental enrichment, physical exercise and diet reverses the spatial memory deficits and restores hippocampal neurogenesis in ventral subicular lesioned rats. Neurobiology of Learning and Memory. 130, 61-70 (2016).
- Hosseini, N., Alaei, H., Reisi, P., Radahmadi, M. The effects of NBM- lesion on synaptic plasticity in rats. Brain Research. 1655, 122-127 (2017).
- Palagina, G., Meyer, J., Smirnakis, S. Complex visual motion representation in mouse area V1. Journal of Neuroscience. 37, 164-183 (2017).
- Ranjbar, H., Radahmadi, M., Reisi, P., Alaei, H. Effects of electrical lesion of basolateral amygdala nucleus on rat anxiety-like behavior under acute, sub-chronic, and chronic stresses. Clinical and Experimental Pharmacology and Physiology. , (2017).
- Wood, R., et al. The honeycomb maze provides a novel test to study hippocampal-dependent spatial navigation. Nature. , (2018).
- Vermaercke, B., et al. Functional specialization in rat occipital and temporal visual cortex. Journal of Neurophysiology. 112, 1963-1983 (2014).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551, 232-236 (2017).
- Masís, J., et al. micro-CT-based method for quantitative brain lesion characterization and electrode localization. Scientific Reports. 8, 5184 (2018).
- Gage, G., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. 65, 3564 (2012).
- Helander, K. Kinetic studies of formaldehyde binding in tissue. Biotechnic & Histochemistry. , (1994).
- Paljärvi, L., Garcia, J., Kalimo, H. The efficiency of aldehyde fixation for electron microscopy: stabilization of rat brain tissue to withstand osmotic stress. Histochemical Journal. , (1979).
- Okuda, K., Urabe, I., Yamada, Y., Okada, H. Reaction of glutaraldehyde with amino and thiol compounds. Journal of Fermentation and Bioengineering. 71, (1991).
- Bahr, G. Osmium tetroxide and ruthenium tetroxide and their reactions with biologically important substances: electron stains III. Experimental Cell Research. , (1954).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry & Cytochemistry. 9, 560-563 (1961).
- Riemersma, J. Osmium tetroxide fixation of lipids for electron microscopy a possible reaction mechanism. Biochimica et Biophysica Acta. 152, (1968).
- Mikula, S., Binding, J., Denk, W. Staining and embedding the whole mouse brain for electron microscopy. Nature Methods. 9, 1198-1201 (2012).
- Mikula, S., Denk, W. High-resolution whole-brain staining for electron microscopic circuit reconstruction. Nature Methods. 12, 541-546 (2015).
- Crespigny, A., et al. 3D micro-CT imaging of the postmortem brain. Journal of Neuroscience Methods. 171, 207-213 (2008).
- Anderson, R., Maga, A. A novel procedure for rapid imaging of adult mouse brains with MicroCT using Iodine-Based contrast. PLoS One. 10, 0142974 (2015).
- Zhou, Z., et al. Cerebral cavernous malformations arise from endothelial gain of MEKK3-KLF2/4 signalling. Nature. 532, 122-126 (2016).
- Choi, J., et al. Micro-CT imaging reveals mekk3 heterozygosity prevents cerebral cavernous malformations in Ccm2-Deficient mice. PloS One. 11, 0160833 (2016).
- Choi, J., Yang, X., Foley, M., Wang, X., Zheng, X. Induction and Micro-CT imaging of cerebral cavernous malformations in mouse model. Journal of Visualized Experiments. , (2017).
- Benveniste, H., Kim, K., Zhang, L., Johnson, G. Magnetic resonance microscopy of the C57BL mouse brain. Neuroimage. 11, 601-611 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211, 213-221 (2006).
- Schneider, J. E., et al. high-throughput magnetic paragraph sign resonance imaging of mouse embryonic paragraph sign anatomy using a fast gradient-echo sequence. MAGMA. 16, 43-51 (2003).
- Sharpe, J. Optical projection tomography. Annual Review of Biomedical Engineering. 6, 209-228 (2004).
- Cox, D. D., Papanastassiou, A., Oreper, D., Andken, B., James, D. High-Resolution Three-Dimensional microelectrode brain mapping using stereo microfocal x-ray imaging. Journal of Neurophysiology. 100, 2966-2976 (2008).
- Borg, J. S., et al. Localization of metal electrodes in the intact rat brain using registration of 3D microcomputed tomography images to a magnetic resonance histology atlas. eNeuro. 2, (2015).
- Fu, T. -. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13, 875-882 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved