Method Article
Un método basado en el Micro-CT para caracterizar las lesiones y la localización de electrodos en cerebros de animales pequeños
En este artículo
Resumen
Este artículo describe un método sencillo para preparar pequeños cerebros animales micro-CT en la proyección de imagen, en que las lesiones se pueden cuantificar y electrodos con alta precisión en el contexto de todo el cerebro.
Resumen
Verificación de localización de lesión y electrodo tradicionalmente se realizan a través de la examinación histológica de rebanadas de cerebro manchada, un procedimiento desperdiciador de tiempo que requiere la estimación manual. Aquí, describimos un método simple y directo para cuantificar las lesiones y localización de los electrodos en el cerebro que es menos laborioso y produce resultados más detallados. Cerebro entero es teñida con tetróxido de osmio, incrustado en resina y fotografiada con un explorador micro-CT. Las exploraciones como resultado volúmenes digitales 3D de los cerebros con resoluciones y espesores de la sección virtual depende del tamaño de muestra (12 – 15 y 5 – 6 μm por voxel para rata y Pinzón de la cebra de cerebros, respectivamente). Lesiones superficiales y profundas pueden ser caracterizadas y solo tetrodos, arreglos de discos de tetrodo, lesiones electrolíticas, y sondas de silicio también pueden ser localizadas. Software libre y propietario permite experimentadores examinar el volumen de la muestra desde cualquier plano y el volumen del segmento manualmente o automáticamente. Debido a que este método genera volumen de todo el cerebro, lesiones y electrodos pueden cuantificarse en un grado mucho más alto que en los métodos actuales, que le ayudará a estandarizar las comparaciones dentro y a través de estudios.
Introducción
Neurocientíficos han dependido de las lesiones durante mucho tiempo para entender la relación entre la función y ubicación en el cerebro. Por ejemplo, nuestra comprensión del hipocampo como indispensable para el aprendizaje y la memoria y de la corteza prefrontal como clave para el control de los impulsos era ambos productos de serendipidad lesiones en los seres humanos1,2. El uso de modelos animales, sin embargo, ha permitido neurocientíficos aprovechar el poder de las lesiones por ir más allá de serendipity, y la función de numerosas áreas del cerebro ha sido dilucidada a través de estudios sistemáticos de las relaciones estructura y función a través de las lesiones de3,4.
Para asignar correctamente la función a una estructura, sin embargo, estudios de lesión requieren procedimientos de cuantificación precisa, que es un área que ha sido. El estándar de oro actual para la cuantificación de las lesiones es a sección, montaje y cerebros de imagen con un microscopio de luz. Las rebanadas de la imagen luego se corresponden a las secciones más cercanas en un atlas, y las coordenadas aproximadas de las lesiones a través de temas se comunican indirectamente, a menudo mediante el uso de imágenes de cámara lúcida o ejemplo cortes histológicos3,4 ,5,6,7,8,9,10.
Más allá de la imprecisión de los procedimientos de cuantificación de lesión actual, estas técnicas son lentos y propensos al fracaso. Pequeños cambios en la rigidez cerebral, filo de cuchilla y temperatura puede conducir a secciones botched, deformadas o rotas. Secciones pueden también manchar irregularmente y mal ser reflejadas debido a las burbujas en el medio de montaje. Lo importante, al seccionamiento, el contexto tridimensional de la localización de la lesión en el cerebro se pierde, que precisa reconstrucción 3D de la lesión en el cerebro un reto.
Otra aplicación común para las lesiones ha sido determinar la ubicación de simple y múltiples grabaciones de electrodo en el cerebro. Al final de la sesión de grabación final, los investigadores inducen pequeñas lesiones electrolíticas en la punta del electrodo y procesan el cerebro histológico como hecho en un experimento convencional lesión del11. Esta técnica adolece de los mismo inconvenientes descritos anteriormente, con problemas adicionales ya que las lesiones electrolíticas son generalmente más grandes que los electrodos utilizados para hacerlos pero son generalmente bastante pequeñas que son difíciles de encontrar histológico. Cuando se insertan electrodos múltiples, como en el caso de una matriz de tetrodo, la verificación a través de lesiones electrolíticas es incluso más difícil. Una alternativa a las lesiones electrolíticas es el uso de un colorante en el electrodo para más tarde comprobar histológicamente12, pero esta técnica adolece de los mismos inconvenientes que vienen con la histología convencional.
Aquí, describimos a fondo un método recientemente descrito13 basado en técnicas de microscopía electrónica (EM) y rayos x de tinción la tomografía computada (micro-CT que cuantifica las lesiones y localiza más corriente de electrodos en cerebros de animales pequeños) métodos. Micro-CT es una técnica de imagen en la que se disparan rayos x en una muestra que gira 360° mientras un scintillator recoge los rayos x no se desvió por la muestra. El resultado es una reconstrucción 3D digital alta resolución de la muestra que puede ser visualizada en cualquier orientación y cuantificar precisamente. Muchas instituciones académicas tienen micro-CT escáneres, que están disponibles comercialmente.
Protocolo
Todo el cuidado y manipulación experimental de animales fueron revisadas y aprobadas por la Comisión de uso y cuidado Animal institucional de Harvard. La perfusión que se describe aquí es específica para las ratas, pero el procedimiento es aplicable a los animales con cerebros más pequeños o similar tamaños.
1. perfusión
- Preparar 1 x solución salina tamponada con fosfato (PBS). Para una rata (edad: 0,5 – 1,5 años de edad, peso: 250 – 600 g), 800-1.000 mL debe ser suficiente. Usar 400 mL para perfusión el animal y un adicional 400 mL para diluir el fijador.
- Preparar el fijador consistente en 2% (w/v) paraformaldehido (PFA) y 2,5% (p/v) de glutaraldehído (GA) en PBS 1 x. Para una rata, 400 mL es suficiente. Ahorre 50 mL en un tubo cónico de 50 mL para la posterior fijación del cerebro después de la perfusión.
- Anestesiar la rata con 4 – 5% isoflurano gas (0,8 L/min O2 a 1,0 bar a 21 ° C) durante 15 minutos.
- Inyectar una dosis letal de pentobarbital sódico por vía intraperitoneal (180 mg/kg).
- Prueba para la pérdida de refleja en el animal mediante la realización de un examen reflejo del pellizco del dedo del pie. Esperar para comenzar la perfusión hasta que el animal ha perdido su respuesta refleja.
- Siga la descrita intracardial perfusión y cerebro extracción protocolo14 con las siguientes soluciones: inundar el animal con 400 mL de PBS 1 x a 125 mm Hg para quitar la sangre. Una vez que toda la sangre ha sido eliminada y reemplazado con 1 x PBS, comenzar inunda con 400 mL de una solución de 2% PDA y GA 2.5% disuelto en 1 x PBS a 125 mm Hg.
Nota: Si el procedimiento se lleva a cabo en un animal que no es una rata, los componentes sólo importantes el procedimiento de perfusión son el uso de 1 x PBS y 2% PFA, GA de 2.5% en PBS 1 x. Los volúmenes de solución y la presión de perfusión pueden ajustarse según las especies.
2. posteriores a la fijación
- Colocar el cerebro extraído en 2% PFA, GA de 2.5% de 1 x PBS (solución mismo solía inundar el animal previamente). Asegúrese de que el volumen de la solución es al menos 10 veces el volumen del cerebro. Para las ratas, colocar el cerebro en un tubo cónico de 50 mL con 50 mL de solución. Almacenar la muestra en la fijación de 2 – 3 días, agitando ligeramente a 4 ° C.
Nota: Si la muestra está en un tubo cónico de 50 mL, colocar horizontalmente en un agitador orbital asegurará los mejores resultados. - Después de la muestra ha sido post fijó por mucho tiempo suficiente, lavar la muestra en agua ultrapura, agua doble destilada (ddH2O) y agua desionizada (diH2O) (véase Tabla de materiales) cuatro veces durante los siguientes períodos: 1, 1, 1 y 15 minutos.
Nota: Para este protocolo, ddH2O diH2O y agua ultrapura debe ser intercambiable. Por simplicidad, ddH2O se utilizará para referirse a agua purificada en adelante.
3. tinción
PRECAUCIÓN: Para este paso, realizar todas las preparaciones solución bajo una campana durante el uso de guantes.
- Preparar al menos 10 veces el volumen del cerebro de la coloración de la solución. De cerebro de rata, preparar 50 mL 2% (w/v) de tetróxido de osmio (OsO4) en Dec2O mediante la combinación de 25 mL de solución 4% OsO4 y 25 mL de ddH2O.
PRECAUCIÓN: tetróxido de osmio es volátil y puede provocar ceguera temporal y problemas respiratorios si no se maneja adecuadamente. Deseche todos los materiales que en contacto con el tetraóxido de osmio en un contenedor apropiado de peligro químico dentro de un contenedor secundario. - Colocar el cerebro en un nuevo tubo cónico de 50 mL y añadir la solución de4 OsO. El cerebro debe empezar a dar vuelta a marrón como OsO4 reacciona con los lípidos en el tejido.
- Cierre el tubo y sellar bien con parafina (véase Tabla de materiales) de la película para asegurarse de que no gotea durante la incubación.
Nota: El osmio es inestable y reacciona suavemente con el plástico del tubo, así sellando el tubo correctamente es muy importante. El tubo se puede envolver con papel de aluminio para mayor protección. - Guarde el tubo sellado a 4 ° C, agitándolo ligeramente en un agitador orbital a 50 rpm durante 2 semanas. Coloque el tubo horizontalmente para garantizar la mejor mezcla. Asegúrese de que la muestra esté completamente sumergida en la solución agitando.
Nota: Si el osmio no se permite que circule constantemente, que puede no completamente penetrar la muestra, para que la colocación horizontal de la coctelera es muy importante.
4. incrustación
- Después de que la muestra ha sido incubada en OsO4 durante 2 semanas, lávelo con ddH2O 5 veces a temperatura ambiente (RT) para las siguientes duraciones: 1, 1, 1, 15 y 60 min para eliminar el de OsO,4 en la muestra.
Nota: Los intercambios múltiples, incluyendo el último intercambio de 60 min, son necesarios para permitir que el osmio en el sistema circulatorio difundir hacia fuera. - Lavar la muestra con ddH2O 30 min a 4 ° C.
Nota: Osmio puede continuar difundir fuera de la muestra, pero su cantidad debe ser mucho reducido del paso anterior. - Deshidratar la muestra con etanol para infiltrarse en tiempo con la resina. Para deshidratar, reemplazar el ddH2O con 10 – 20 mL de las siguientes diluciones de etanol (para 30 min de cada uno a 4 ° C): 20% (v/v) de etanol y 80% (v/v) ddH2O; 50% (v/v) de etanol y 50% (v/v) ddH2O; etanol al 70% (v/v) y 30% (v/v) ddH2O; 90% (v/v) de etanol y 10% (v/v) ddH2O; etanol al 100%.
- Preparar las diluciones de resina acetona como se indica a continuación.
- Preparar 100 mL de resina para inclusión (véase Tabla de materiales) según las instrucciones del fabricante.
- Para hacer la resina 33% (v/v) - 67% solución de acetona, vierte 15 mL de resina en un tubo cónico de 50 mL y añadir 30 mL de acetona destilada vidrio 100%.
- El 50% (v/v) de la resina - 50% acetona, vierta 22,5 mL de resina en un tubo cónico de 50 mL y añadir 22,5 mL de acetona destilada vidrio 100%.
- El 67% (v/v) de la resina - 33% solución de acetona, Vierta 30 mL de resina en un tubo cónico de 50 mL y añadir 15 mL de acetona destilada vidrio 100%.
- Utilice los restantes 32,5 mL de resina como la primera solución de resina 100% abajo.
- Comenzar el proceso de infiltración de resina moviendo la muestra a través de 10-20 mL de las diluciones siguientes de acetona y la acetona/resina: acetona al 100% durante 30 min a 4 ° C; 100% acetona durante 30 min a 4 ° C; y 100% acetona durante 30 min a temperatura ambiente (RT).
Nota: El resto del proceso de infiltración llevará a cabo a TA. - Sumergir la muestra en 33% (v/v) resina 67% acetona durante 3 horas a temperatura ambiente, luego acetona de resina - 50% 50% (v/v) durante 3 horas a temperatura ambiente, 67% (v/v) resina 33% acetona durante 3 horas a temperatura ambiente y 100% de resina de 12 h a TA.
- Hacer una hornada fresca 50 mL de resina siguiendo las instrucciones en la botella. Transferir la muestra al recipiente en que se curará (por ej., los moldes desechables se describe en la Tabla de materiales). Infusionar la muestra con resina 100% fresca durante 4 horas a TA.
Nota: Si no se utiliza la resina fresca, hecha el día anterior que empezará a endurecerse prematuramente, y la muestra será difícil de manipular. - Desgasificar la muestra en una estufa de vacío por 15 min a 45 ° C.
Nota: Este paso le ayudará a eliminar las posibles burbujas de aire atrapado dentro de la muestra, pero es no esencial y no afectará la calidad de los datos. - Por último, curar la muestra en un horno durante 48 h a 60 ° C.
5. micro-CT
- Una vez la muestra ha sido curada, desprenda el molde desechable y escanear con la máquina micro-CT.
Nota: Dependiendo de la máquina utilizada, la configuración será diferente. Para el escáner utilizado por los autores mencionados en la Tabla de materiales, la configuración recomendada es 130 kV, MA 135 con un filtro de cobre de 0,1 mm y una fuente de molibdeno, una exposición de 1 segundo y un promedio de 4 fotogramas por proyección. Sin embargo, experimentadores deben calibrar el analizador individualmente, como muchos factores afectarán la configuración óptima durante una sesión en particular. - Una vez terminado el escaneo, reconstruir la muestra con los parámetros recomendados para la combinación de software de escáner del experimentador en un ordenador con el software del escáner.
- Por último, visualizar y analizar el volumen digital reconstruido usando software del experimentador de la opción (véase Tabla de materiales por ejemplo).
Resultados
Tradicionalmente, cerebros son seccionados y manchados con el fin de cuantificar las lesiones y ubicar los electrodos, pero este método es propenso, mano de obra intensiva y por lo general requiere la estimación de los resultados. Preparando el cerebro entero para micro-CT en la proyección de imagen, se reduce la probabilidad de dañar las muestras características de interés se pueden analizar en el contexto de todo el cerebro y el método se presta a procesamiento en paralelo de muchas muestras, considerablemente acelerar la preparación de la muestra.
El método consiste en cuatro pasos principales: (1) la coloración de un cerebro inundado con tetróxido de osmio, (2) incorporar el cerebro en resina (3) la proyección de imagen del cerebro con un escáner de micro-CT y (4) analizar el volumen digital resultante (figura 1). En este artículo, se describen sólo los pasos 1 – 3, ya paso 4 (el análisis) variará considerablemente dependiendo de las necesidades específicas del proyecto.
Mientras que en tradicional sección en la que una orientación de seccionamiento debe ser elegida previamente, el volumen digital resultante de este método se puede manipular en tres dimensiones y prácticamente cortado en cualquier orientación (Figura 2a-2b). El usuario también puede escanear una subdivisión de la muestra a una resolución mayor si lo desea, como el bulbo olfativo de un cerebro de rata, donde las fibras nerviosas y glomérulos individuales son visibles (figura 2c). El método también es ampliamente aplicable a pequeños cerebros animales. Para comprobar esto, un cerebro del pinzón de la cebra fue preparado usando el mismo protocolo utilizado para el cerebro de rata y dio lugar a un exitoso volumen digital (figura 2e). Microscopía electrónica de barrido (SEM) de una muestra preparada para micro-CT confirmó que el tejido no fue dañado hasta un orden de magnitud en la resolución más allá de la resolución de la micro-CT (figura 2d). Sin embargo, cabe señalar que hubo considerables daños ultraestructurales, haciendo esta técnica inadecuada para la microscopia electrónica (EM).
La técnica puede utilizarse para localizar lesiones superficiales (figura 3) y las lesiones profundas dentro del cerebro (figura 4). La técnica también permite la localización de tetrodos solo en situ, lesiones electrolíticas, pistas de electrodo de diámetro suficiente, tetrodo matrices in situ y silicio sondas en situ (figura 5).
Preparaciones incluirá incompleta mineralización de los tejidos, que también pueden ocurrir si se utilizan buffers incorrecta (figura 6). Sin embargo, si sólo características superficiales son necesarios, por ejemplo, entonces sólo superficie de tinción de la muestra puede ser suficiente para el experimentador.
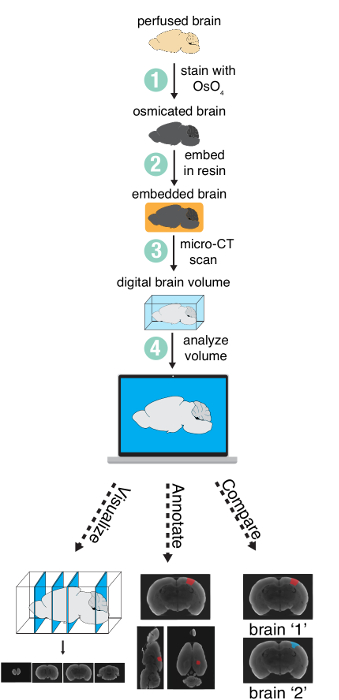
Figura 1 : Resumen método. Resumen de los pasos necesarios para preparar y analizar una total mediante micro-CT en la proyección de imagen del cerebro. Figura con el permiso de los autores13. Haga clic aquí para ver una versión más grande de esta figura.
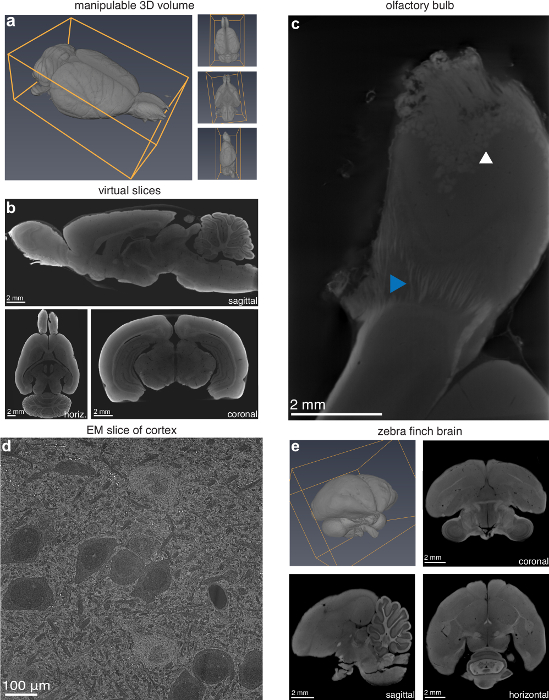
Figura 2 : Capacidad de caracterización de la lesión a través de la proyección de imagen micro-CT. (un) Manipulatable 3D volumen y (b) virtuales rebanadas (13,9 μm voxels) en orientaciones arbitrarias de una micro-TC de una rata Long-Evans. (c) bulbo olfatorio escaneada a una resolución más alta (4,9 μm voxels) revelando glomérulos (punta de flecha blanca) y las fibras individuales del nervio (flecha azul). (d) microscopio electrónico de barrido (SEM) imagen (10 nm/pixel) de la corteza visual del cerebro de rata para micro-CT en la proyección de imagen. (e) Pinzón cebra (Taeniopygia guttata) cerebro preparado para micro-CT en la proyección de imagen; Volumen 3D y 2D rebanadas (5,6 μm voxels) en los planos sagital, coronal y horizontal. Figura con el permiso de los autores13. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Caracterización de la lesión de corteza visual mediante micro-CT. (a) visualización en 3D de un cerebro de rata lesionado en la corteza visual con ácido quinolínico. El panel de la izquierda muestra el volumen de lesión en el contexto del cerebro (cerebro ligeramente transparentes para permitir el acceso visual a la lesión). El panel de la derecha muestra lesión aislada de volumen. (b) rebanadas 2D de lesión en los planos sagital (12,8 μm voxels), coronal y horizontal. El top 3 paneles muestran las secciones no segmentadas, y los paneles de fondo 3 Mostrar secciones con anotación de overlaid de la lesión. Esta lesión fue manualmente anotado en la orientación coronal cada 2 rebanadas. El volumen fue creado luego por interpolación. Figura con el permiso de los autores13. Haga clic aquí para ver una versión más grande de esta figura.
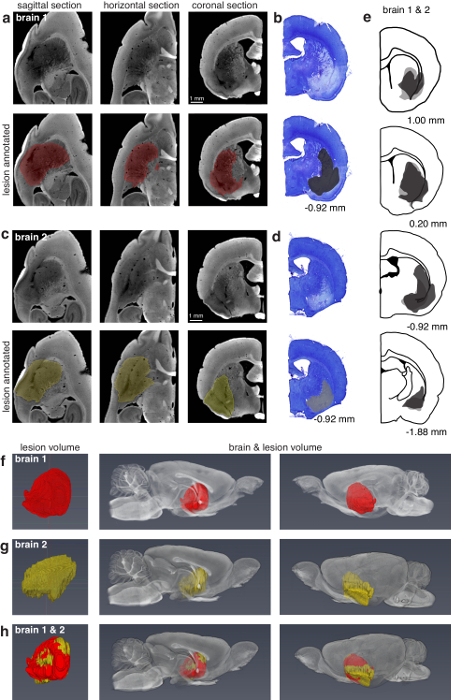
Figura 4: comparación de la caracterización de lesión dorso-lateral estriado mediante micro-CT y la histología. (a) sagital, horizontales y coronales vistas de la izquierda de la mitad de "cerebro 1" procesada para micro-CT imaging (13,5 μm voxels). El top 3 paneles muestran secciones no segmentadas, y los paneles de fondo 3 Mostrar la lesión anotada en las mismas secciones. La lesión era manualmente segmentados en el plano sagital cada 2 secciones y posteriormente interpolados. (b) coronal coincidente más cercano de la derecha la mitad de "cerebro 1" procesada histológico por microscopía de luz. Paneles (c, d) son similares a (a, b) sino que corresponden a "cerebro 2". La lesión de cerebro 2 fue manualmente dividido en segmentos en el plano coronal cada 8 secciones. (e) caracterización de la lesión de Tratado de histología derecha mitades de cerebros 1 (gris oscuro) y 2 (gris claro). Los números en (b, d, e) por debajo de los paneles se corresponden con posiciones en relación a bregma. (f) caracterización de la lesión de la izquierda de la mitad de cerebro 1 procesada para micro-CT. El primer panel muestra la lesión aislada. Los paneles segundo y terceros muestran la lesión dentro del cerebro de dos puntos de vista. (g) igual a (f) pero correspondiente al cerebro 2. (h) una superposición de las lesiones en (f, g) que ilustran la capacidad para la comparación de la caracterización de la lesión con volúmenes de cerebro digital. La lesión en (f) se registró a la lesión (g), y ambos se muestran en el contexto de la mitad izquierda del cerebro 2. Figura con el permiso de los autores13. Haga clic aquí para ver una versión más grande de esta figura.
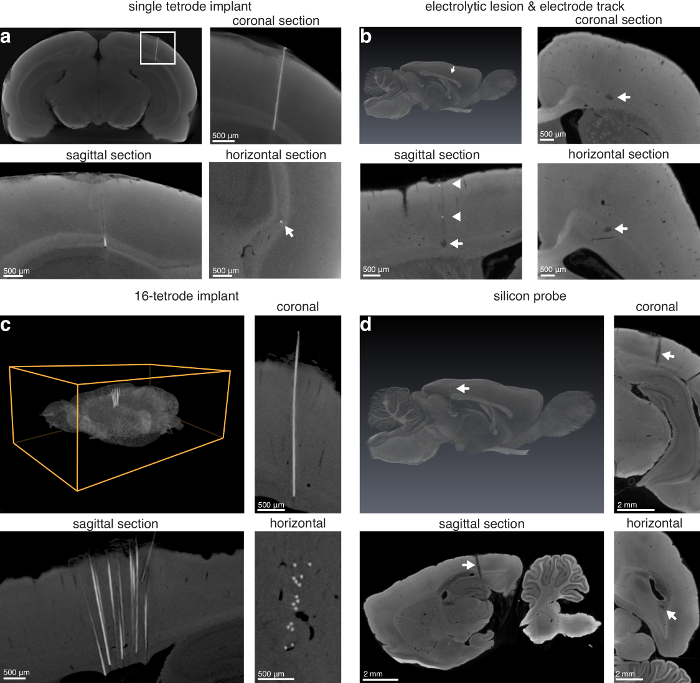
Figura 5 : Localización de electrodos a través de la proyección de imagen micro-CT. (una) sola tetrodo izquierda en situ (14,0 μm voxels). Panel superior izquierdo: proyección de máxima intensidad de virtuales secciones coronales mostrando la ubicación de un tetrodo de nicrom viaja a través de la corteza visual en el cuerpo calloso de una rata; arriba a la derecha: primer plano de una imagen que se muestra en el panel superior izquierdo de (a) (rectángulo blanco). Parte inferior izquierda: sagital; abajo a la derecha: vista horizontal del electrodo implantado (flecha blanca indica la ubicación de la tetrodo). electrodo de lesión (b) electrolítica vía en la región anterior de un cerebro de rata (13,9 μm voxels). Superior izquierda: representación 3D de un cerebro con la lesión electrolítica segmentado (flecha blanca que indica la lesión púrpura); arriba a la derecha: coronal. Parte inferior izquierda: sagital; abajo a la derecha: secciones horizontales indicando lesión electrolítica (flechas blancas) producción con un electrodo de tungsteno de 75 μm de diámetro. Además, algunos metal depositado por el electrodo sobre la retracción es visible a lo largo de la pista en la vista sagital (flecha blanca). (c) implante 16-tetrodo dejado en situ en la corteza anterior de un cerebro de rata. Superior izquierda: representación 3D de un cerebro entero con una matriz de 16-tetrodo izquierda implantado; arriba a la derecha: coronal. Parte inferior izquierda: sagital; abajo a la derecha: secciones horizontales indicando un implante 16-tetrodo (8,9 μm voxels). sonda (d) silicio (caña de 10 mm, 32 páginas) a la izquierda en situ viajando a través de la corteza posterior, hipocampo y estructuras subcorticales (13.9 μm voxels). Superior izquierda: representación 3D de un cerebro entero con una sonda de silicona segmentadas (flecha blanca que indica verde punta de prueba); arriba a la derecha: coronal. Parte inferior izquierda: sagital; abajo a la derecha: vista horizontal de un silicio de sonda en el cerebro. Además, el sitio de referencia en la sonda de silicona es visible en las secciones coronales y sagitales (punta de flechas blancas). Figura con el permiso de los autores13. Haga clic aquí para ver una versión más grande de esta figura.
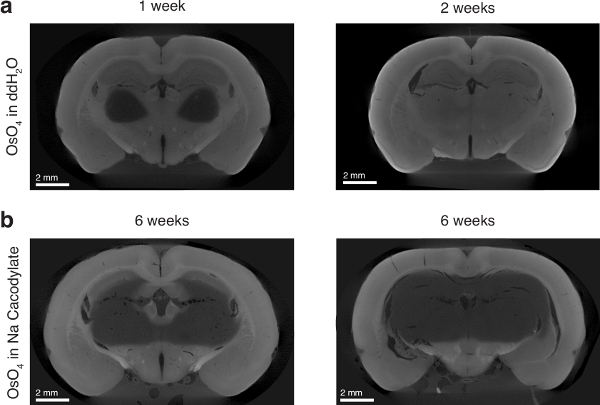
Figura 6 : Efecto del disolvente de tetróxido de osmio en la penetración de osmio. (a) panel de la izquierda: cerebro de la rata incubados en tetróxido de osmio en ddH2O 1 semana. Panel de la derecha: cerebro de la rata incubados en tetróxido de osmio en ddH2O 2 semanas. (b) cerebros de rata dos incuban en tetróxido de osmio en buffer de cacodilato de sodio por 6 semanas. Figura con el permiso de los autores13. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los siguientes son pasos críticos en el protocolo: en primer lugar, el uso de una combinación de PFA y GA a inundar el animal y posteriormente fijar después el cerebro fue fundamental para lograr la penetración constante de osmio completo del tejido. Aunque nos no probar esto explícitamente, una explicación plausible es que la fijación del PFA es reversible15, mientras que GA fijación no es reversible16,17. Porque una incubación de dos semanas en tetróxido de osmio es necesaria para plena infiltración del tejido, es posible que la PFA del interior del cerebro se difunde hacia fuera y los tejidos se degradan durante la tinción. El osmio así no puede preservar las estructuras interiores.
El uso de osmio acuoso, en lugar de osmio disuelto en un buffer (es decir, cacodilato de sodio), era absolutamente necesaria para asegurar la penetración completa del tejido por el osmio. Incluso después de una incubación de 6 semanas, osmio disuelto en cacodilato de sodio no infiltran el tejido completamente y parece encontrar una barrera de difusión (figura 6). El osmio es extremadamente reactivo para lípidos y piensa para las membranas de la célula18,19,20atar a. Si el tejido no es suficientemente permeabilized, como podría ser el caso con un tampón suave como el cacodilato de sodio, es posible que las membranas celulares pueden saturar con osmio y sterically impedir osmio más difusión en el tejido. Presumimos, sin embargo, que el agua como un solvente para el osmio actúa como un detergente ligero y permeabilizes el tejido lo suficiente como para permitir una difusión profunda en el tejido.
Si los experimentadores están preparando un cerebro más pequeño, como el de un ratón, probablemente puede reducir el tiempo de incubación en el osmio. Del mismo modo, el tiempo de incubación debe incrementarse en muestras más grandes. Esto puede analizarse para determinar el tiempo mínimo para la tinción consistente en un cerebro que es diferente en tamaño que el de una rata. Si los experimentadores de problemas con la infiltración de osmio completo, los problemas probablemente no utiliza PFA y GA durante la perfusión y posteriores a la fijación, no utilizar agua como solvente para osmio (según lo discutido arriba) y la agitación insuficiente durante el osmio incubación. Encontramos, por ejemplo, que cuando se incuban en tubos cónicos de 50 mL, colocar los tubos en su lado (en comparación con verticalmente en un soporte), llenándolos con mancha y colocándolos en un agitador orbital a 50 rpm para la incubación toda período aseguró adecuada infiltración.
Este método es limitado de varias maneras. En primer lugar, la preparación no conserva la ultraestructura muy bien, así que no debería utilizarse para microscopía electrónica. Este método no se puede combinar con cualquier otro histología o inmunofluorescencia. La resolución del volumen digital está determinada por el tamaño de la muestra (muestras más pequeñas se pueden escanear a resoluciones más altas) y por la geometría del scanner, si confía en aumento geométrico; sin embargo, subdivisiones de la muestra pueden analizarse en resoluciones más altas, si se desea.
Se ha presentado un nuevo método de combinar estilo de microscopia electrónica del tejido tratamiento con micro-CT en la proyección de imagen para la cuantificación de las lesiones y la localización de electrodos en cerebros de animales pequeños. Este método es sin duda menos laborioso, requiere menos conocimientos y produce resultados cuantificables más fácilmente que el patrón oro para el seccionamiento y la coloración de un cerebro. Los científicos han descrito previamente, un protocolo para la penetración de osmio incluso en cerebros de ratón que está destinado a preservar la ultraestructura microscopia electrónica21,22. Este protocolo, sin embargo, es bastante complejo. En este estudio, los autores pretenden desarrollar un método mucho más simple para micro-CT en la proyección de imagen en lugar de microscopia electrónica. Ha habido otros estudios aplicación micro-CT a cerebro la proyección de imagen para diversos fines. Una investigación anterior en conejos y ratones utiliza micro-CT para encontrar tumores y otras anormalidades23. Esta investigación hace uso de agentes de contraste de MRI propietarios, pero los investigadores predecir la utilidad potencial de micro-CT en los estudios de lesión. Otro estudio en ratones encaminadas a encontrar diferencias morfológicas brutas para una pantalla de droga habían involucrado tinción de cerebro de ratón con yodo en el cráneo, pero los autores ante la contracción de tejido desigual y optaron por incorporar el tejido en un hidrogel24. Otros estudios en ratones han dirigido a encontrar las malformaciones cavernosas cerebrales, un desorden de los capilares anormalmente grandes e irregulares y han hecho uso de tetróxido de osmio y yodo acuoso como manchas; sin embargo, estos fueron realizados en muestras mucho más pequeñas (hindbrains ratón independiente) que se describen aquí25,26,27. Métodos alternativos para la generación de volúmenes 3D de cerebro son µMRI28 y microscopía de alta resolución episcópica31. La resolución de µMRI es más pobre (~ 25 voxels del μm para muestras similares28), y la técnica es más caro23,30. Microscopia de alta resolución episcópica también enfrenta desafíos: que es una técnica destructiva, y un aparato de bloque cara permitiendo seccionar todo el cerebro tendría que ser producido. El trabajo aquí presentado extiende también a los esfuerzos anteriores para ubicar los electrodos en el cerebro con rayos x32,33,34 por captar tanto el electrodo y el tejido circundante. Además, la técnica permite localizar solo electrodos, matrices de tetrodo, lesiones electrolíticas, pistas de electrodos y sondas de silicio.
Una valiosa orientación futura sería la creación de un atlas de "medio cerebro" para que estudios de lesión podrían estar Co inscrito para estandarizar la ubicación de la lesión y la cuantificación del tamaño. Este método se puede también ampliar a otros modelo y organismos no-modelo, como por su aplicación inmediata en el cerebro del pinzón de la cebra (figura 2).
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen Greg Lin y Arthur McClelland su experiencia con la máquina micro-CT, David Richmond y Hunter Elliott en la imagen y base de análisis de datos (IDAC) en Harvard Medical School para su Consejo de procesamiento de imágenes y William Liberti en Boston Universidad para proporcionar amablemente un cerebro del pinzón de la cebra. Este trabajo fue realizado en parte en el centro de sistemas de nanoescala (CNS), un miembro de la nacional nanotecnología coordinada infraestructura red (NNCI), que es apoyado por la National Science Foundation bajo premio NSF no. 1541959. CNS es una parte de la Universidad de Harvard. Este trabajo fue apoyado por el Richard y Susan Smith Family Foundation y IARPA (contrato #D16PC00002). S.B.E.W. fue apoyado por becas del programa de ciencia frontera humana (HFSP; LT000514/2014) y la Organización Europea de Biología Molecular (EMBO; ALTF1561-2013). G.G. fue apoyado por la National Science Foundation (NSF) postgrado investigación beca programa (GRFP).
Materiales
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences (EMS) | 15710 | 2% (w/v/) in 1X PBS |
| Glutaraldehyde (GA) | EMS | 16220 | 2.5% (w/v) GA in 1x PBS |
| OsO4 | EMS | 19190 | Work in fume hood |
| Ethanol | Decon Labs | Koptec | 140, 190, 200 proof |
| Acetone | EMS | 10015 | Glass-distilled |
| Durcupan ACM resin | Sigma-Aldrich | 44610 | A, B, C and D components, resin for embedding |
| Disposable molds | Ted Pella | 27114 | Suggested |
| milliQ water (ultrapure water) | Millipore Sigma | QGARD00R1 (or related purifier) | Suggested |
| Parafilm (paraffin film) | Millipore Sigma | P7793 | Suggested paraffin film |
| Micro-CT scanner | Nikon Metrology Ltd., Tring, UK | X-Tek HMS ST 225 | Used by authors |
| Software for visualizing and analyzing micro-CT scans: | |||
| Volume Graphics | VG Studio Max | Used by authors | |
| FEI / Thermo Scientific | Avizo | Used by authors | |
| FEI / Thermo Scientific | Amira | Similar to Avizo | |
| Mark Sutton & Russell Garwood | Spiers | Free, http://spiers-software.org/ | |
| Pixmeo Sarl | Osirix Lite | Free, https://www.osirix-viewer.com/ | |
| Open Source | FIJI | Free, https://fiji.sc/ | |
| Adobe | Photoshop | Good for analyzing one slice at a time |
Referencias
- Scoville, W., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neuropsychiatry and Clinical Neuroscience. 12, 103-113 (2000).
- Damasio, H., Grabowski, T., Frank, R., Galaburda, A. M., Damasio, A. R. The return of Phineas Gage: clues about the brain from the skull of a famous patient. Science. 264 (5162), 1102-1105 (1994).
- Kawai, R., et al. Motor cortex is required for learning but not for executing a motor skill. Neuron. 86, 800-812 (2015).
- Otchy, T., et al. Acute off-target effects of neural circuit manipulations. Nature. 528, 358-363 (2015).
- Wright, N., Vann, S., Aggleton, J., Nelson, A. A critical role for the anterior thalamus in directing attention to task-relevant stimuli. Journal of Neuroscience. 35, 5480-5488 (2015).
- Kapgal, V., Prem, N., Hegde, P., Laxmi, T., Kutty, B. Long term exposure to combination paradigm of environmental enrichment, physical exercise and diet reverses the spatial memory deficits and restores hippocampal neurogenesis in ventral subicular lesioned rats. Neurobiology of Learning and Memory. 130, 61-70 (2016).
- Hosseini, N., Alaei, H., Reisi, P., Radahmadi, M. The effects of NBM- lesion on synaptic plasticity in rats. Brain Research. 1655, 122-127 (2017).
- Palagina, G., Meyer, J., Smirnakis, S. Complex visual motion representation in mouse area V1. Journal of Neuroscience. 37, 164-183 (2017).
- Ranjbar, H., Radahmadi, M., Reisi, P., Alaei, H. Effects of electrical lesion of basolateral amygdala nucleus on rat anxiety-like behavior under acute, sub-chronic, and chronic stresses. Clinical and Experimental Pharmacology and Physiology. , (2017).
- Wood, R., et al. The honeycomb maze provides a novel test to study hippocampal-dependent spatial navigation. Nature. , (2018).
- Vermaercke, B., et al. Functional specialization in rat occipital and temporal visual cortex. Journal of Neurophysiology. 112, 1963-1983 (2014).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551, 232-236 (2017).
- Masís, J., et al. micro-CT-based method for quantitative brain lesion characterization and electrode localization. Scientific Reports. 8, 5184(2018).
- Gage, G., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. 65, 3564(2012).
- Helander, K. Kinetic studies of formaldehyde binding in tissue. Biotechnic & Histochemistry. , (1994).
- Paljärvi, L., Garcia, J., Kalimo, H. The efficiency of aldehyde fixation for electron microscopy: stabilization of rat brain tissue to withstand osmotic stress. Histochemical Journal. , (1979).
- Okuda, K., Urabe, I., Yamada, Y., Okada, H. Reaction of glutaraldehyde with amino and thiol compounds. Journal of Fermentation and Bioengineering. 71, (1991).
- Bahr, G. Osmium tetroxide and ruthenium tetroxide and their reactions with biologically important substances: electron stains III. Experimental Cell Research. , (1954).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry & Cytochemistry. 9, 560-563 (1961).
- Riemersma, J. Osmium tetroxide fixation of lipids for electron microscopy a possible reaction mechanism. Biochimica et Biophysica Acta. 152, (1968).
- Mikula, S., Binding, J., Denk, W. Staining and embedding the whole mouse brain for electron microscopy. Nature Methods. 9, 1198-1201 (2012).
- Mikula, S., Denk, W. High-resolution whole-brain staining for electron microscopic circuit reconstruction. Nature Methods. 12, 541-546 (2015).
- Crespigny, A., et al. 3D micro-CT imaging of the postmortem brain. Journal of Neuroscience Methods. 171, 207-213 (2008).
- Anderson, R., Maga, A. A novel procedure for rapid imaging of adult mouse brains with MicroCT using Iodine-Based contrast. PLoS One. 10, 0142974(2015).
- Zhou, Z., et al. Cerebral cavernous malformations arise from endothelial gain of MEKK3-KLF2/4 signalling. Nature. 532, 122-126 (2016).
- Choi, J., et al. Micro-CT imaging reveals mekk3 heterozygosity prevents cerebral cavernous malformations in Ccm2-Deficient mice. PloS One. 11, 0160833(2016).
- Choi, J., Yang, X., Foley, M., Wang, X., Zheng, X. Induction and Micro-CT imaging of cerebral cavernous malformations in mouse model. Journal of Visualized Experiments. , (2017).
- Benveniste, H., Kim, K., Zhang, L., Johnson, G. Magnetic resonance microscopy of the C57BL mouse brain. Neuroimage. 11, 601-611 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211, 213-221 (2006).
- Schneider, J. E., et al. high-throughput magnetic paragraph sign resonance imaging of mouse embryonic paragraph sign anatomy using a fast gradient-echo sequence. MAGMA. 16, 43-51 (2003).
- Sharpe, J. Optical projection tomography. Annual Review of Biomedical Engineering. 6, 209-228 (2004).
- Cox, D. D., Papanastassiou, A., Oreper, D., Andken, B., James, D. High-Resolution Three-Dimensional microelectrode brain mapping using stereo microfocal x-ray imaging. Journal of Neurophysiology. 100, 2966-2976 (2008).
- Borg, J. S., et al. Localization of metal electrodes in the intact rat brain using registration of 3D microcomputed tomography images to a magnetic resonance histology atlas. eNeuro. 2, (2015).
- Fu, T. -M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13, 875-882 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados