Method Article
Passivo novo métodos de compensação para a produção rápida de transparência óptica no tecido inteiro do CNS
Neste Artigo
Resumo
Aqui, apresentamos duas novas metodologias, psPACT e mPACT, para alcançar a máxima transparência óptica e posterior análise microscópica da vascularização do tecido no roedor intacta toda CNS.
Resumo
Desde o desenvolvimento de clareza, uma bioelectrochemical técnica de compensação que permite mapeamento tridimensional fenótipo dentro de tecidos transparentes, uma multiplicidade de metodologias de romance clareira incluindo cúbico (imagens do cérebro desobstruído, desobstruído cocktails e análise computacional), SWITCH (todo o sistema de controle de tempo de interação) e cinética de produtos químicos, mapa (análise ampliada da proteoma) e Pacto (técnica de clareza passiva), foram criadas para expandir ainda mais o conjunto de ferramentas existente para a análise microscópica de tecidos biológicos. O presente estudo tem por objetivo aperfeiçoar e otimizar o procedimento original do pacto para uma matriz de tecidos de roedores intactas, incluindo a todo sistema de nervoso central (SNC), rins, baço e embriões do rato inteiro. Denominado psPACT (processo-separe pacto) e mPACT (Pacto modificado), essas novas técnicas fornecem meios altamente eficazes de circuitos de célula de mapeamento e visualização de estruturas subcelulares em tecidos normais e patológicos intactas. No protocolo a seguir, apresentamos um esboço detalhado, passo a passo sobre como conseguir autorização de tecido máxima com o mínimo de violação de sua integridade estrutural através de psPACT e mPACT.
Introdução
Dos objectivos fundamentais do inquérito científico e clínico envolve alcançar uma compreensão completa da estrutura do órgão e função; no entanto, a natureza extremamente complexa de mamíferos órgãos muitas vezes serve como uma barreira para atingir plenamente este objectivo1. CLAREZA (lipídios clara-trocadas acrilamida-hibridizado rígida de imagem compatível com tecidos-hidrogel)2,3,4, que envolve a construção de um híbrido baseado em acrilamida hidrogel de tecidos intactos, alcança acesso óptico de uma variedade de órgãos, incluindo o cérebro, fígado e baço, preservando sua integridade estrutural5. CLAREZA, portanto, permitiu não só a visualização, mas também a oportunidade de dissecar finamente complexas redes celulares e morfologias de tecido sem a necessidade de seccionamento.
Para alcançar o apuramento de tecido, clareza emprega métodos eletroforético para remover o conteúdo lipídico da amostra à mão. Enquanto a clareza tem sido notada por produzir híbridos de tecido-hidrogel fisicamente estável, estudos têm demonstrado que seu uso de métodos de compensação (ETC) de tecido eletroforética produz resultados variáveis em termos de qualidade de tecido, incluindo alourar, epítopo danos, e proteína perda5,6. Para solucionar esses problemas, protocolos modificados como Pacto (passivo clareza técnica), que substitui o tratamento ETC com uma técnica passiva, detergente iônico-baseado delipidation, têm sido desenvolvidos7,8,9. Apesar de atingir uma maior consistência nos resultados, no entanto, o pacto exige mais tempo para obter máxima abertura. Além disso, nenhuma destas técnicas ainda foram aplicadas a todo o formulário do CNS, ou em modelos maiores de roedores como ratos e cobaias.
O presente estudo pretende abordar estas limitações, propondo metodologias romance, psPACT (processo-separe pacto) e mPACT (Pacto modificado), para facilitar o rápido desembaraço do CNS inteiro e órgãos internos em tanto o rato e o rato modelos10. Especificamente, psPACT processos de tecidos em acrilamida 4% e 0,25% VA-044 em duas etapas distintas durante a formação de hidrogel; mPACT essencialmente envolve as mesmas etapas, mas complementa a solução baseada em SDS clareira com 0,5% de α-thioglycerol como um reagente chave. Ambas as técnicas aproveitar o endógeno sistêmico e uidos circulatório para reduzir significativamente o tempo necessário para produzir afastamento óptico. Como prova de princípio, vamos mostrar o uso da microscopia confocal para analisar padrões de vasos sanguíneos nos tecidos limpos10.
Protocolo
Todos os procedimentos foram aprovados pelo Comitê de ética de pesquisa apropriada na faculdade de medicina da Universidade de Yonsei. Todos os animais são sacrificados em conformidade com as diretrizes do Comitê de cuidados com animais de laboratório na faculdade de medicina da Universidade de Yonsei.
1. preparação dos reagentes
Cuidado: Paraformaldehyde (PFA), acrilamida e sódio Dodecil sulfato de sódio (SDS) são irritantes tóxicos e, portanto, deve ser manipulado em uma coifa com equipamento de protecção adequado (EPI; jaleco, luvas, óculos de proteção).
- solução de acrilamida (A.A) de 4% (A4P0): Adicionar 20 mL de solução de acrilamida 40% a 180 mL de 0.1 M tampão fosfato salino (PBS).
- Solução de 0,25% VA-044: Adicionar 0,5 g de 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] dicloridrato (VA-044) em pó para 200 mL de 0.1 M tampão fosfato salino (PBS). Enquanto o pó de VA-044 pode ser armazenado à temperatura ambiente, devem ser armazenado a 4 ° C, após solubilização em PBS. Para melhores resultados, prepare somente a quantidade de solução necessária para o experimento.
- Solução de cocktail Pacto: Adicione 10 g de acrilamida a 225 mL de solução a 4% paraformaldeído (PFA) e ajustar o volume de 200 mL com 4% PFA. Antes da utilização, adicione 100 mg de pó de VA-044 a 40 mL de mistura em um tubo cónico de 50 mL.
- Pacto de limpar o buffer de solução: Adicione 40 g de sulfato dodecyl de sódio (SDS) a 350 mL de PBS 0,1 M e ajustar o volume para 500 mL com PBS 0,1 M. Para mPACT limpar solução, adicione 0,5% α-thioglycerol ao Pacto de limpar o buffer de solução.
- Os ratos utilizados neste estudo foram ratos masculinos da BALB 2 semanas de idade; os ratos utilizados neste estudo foram 2 semanas de idade SD-ratos machos.
2. anestesia e cirurgia de perfusão
Cuidado: PFA e acrilamida são irritantes tóxicos e, portanto, devem ser manipulados em uma coifa com EPI adequado.
- Anestesia o animal em um quarto livre de patógeno com 30 mg/kg de zoletil utilizando uma seringa de 1 mL com uma agulha de calibre 26. Monitorar o animal por 5-10 min.
- Uma vez que o animal tenha atingido um plano cirúrgico da anestesia, use o método do dedo do pé-pitada de resposta para determinar a profundidade da anestesia. Confirme a apatia.
Nota: As seguintes etapas envolvendo cirurgia de rato e rato sigam um protocolo similar usado em um anterior de estudo11. - Faça uma incisão de 5-6 cm abaixo da caixa torácica, através do tegumento e a parede abdominal.
- Use tesoura curva, contundente para fazer uma incisão no diafragma, palpar a área torácica para localizar o local da incisão de antemão.
- Estenda a incisão através de todo o comprimento da caixa torácica para expor a cavidade pleural.
- Cuidadosamente, deslocar os pulmões. Fazer um corte através da caixa torácica até a clavícula. Usando uma tesoura de íris, faça uma pequena incisão à extremidade posterior do ventrículo esquerdo. Inserir uma agulha de calibre 18 ou verde-oliva-ponta romba perfusão da aorta ascendente, passando por corte ventrículo.
- Segura a agulha e impedir o escapamento, fixando o coração com uma pinça hemostática. Como alternativa, use uma pinça hemostática modificada para fixar a aorta ao redor da ponta da agulha.
- Fazer uma grande incisão no átrio direito, tendo o cuidado de garantir o mínimo de danos para a aorta descendente. O rato está agora pronto para perfusão.
3. toda perfusão e dissecção de rato
Cuidado: PFA e acrilamida são irritantes tóxicos e, portanto, devem ser manipulados em uma coifa com EPI adequado.
Nota: As seguintes etapas de perfusão inteiro são uma similar a um protocolo usado em estudo anterior por Woo et al. (2016) 10 , 11.
- Anexe o átrio direito do coração para uma agulha de calibre 18, tendo o cuidado de não introduzir quaisquer bolhas de ar.
- Utilizando uma seringa de 50 mL, rapidamente e uniformemente bomba 50 mL de solução de PBS 0,1 M fria contendo heparina (10 unidades/mL).
- Conecte a agulha de calibre 18 ao tubo da bomba peristáltica.
- Lavar com 200 mL de solução de PBS 0,1 M fria contendo heparina (10 unidades/mL) a uma velocidade de circulação de 10 mL/min.
- Fixe com 250 mL de solução fria de PFA 4% a uma velocidade de circulação de 10 mL/min. O rato deve ser duro nesta fase.
- Coletar e armazenar a solução restante da PFA para a eliminação.
- Pacto, para perfundir os tecidos com uma solução de pacto refrigerado cocktail de 4% PFA do acrilamido 4% e 0,25% VA-044 pó com uma agulha de calibre 18 e em seguida, retire a cabeça e a coluna vertebral. Expor o crânio, fazendo uma incisão na linha média do pescoço ao nariz. Esta etapa de perfusão adicional é desnecessária para os métodos psPACT e mPACT; após a fixação, imediatamente isolar a cabeça e a coluna vertebral e expor o crânio.
- Expor a base do crânio, removendo qualquer residual pescoço e músculos da coluna vertebral.
- Use ruginas e tesoura para descascar o crânio. Remova o cérebro ea medula espinhal.
- Armazenar o tecido em 4% PFA a 4 ° C; os tecidos podem ser armazenados por até 1 semana.
4. hidrogel monômero infusão e polimerização do rato e do rato SNC
Cuidado: Acrilamida, SDS, α-thioglycerol e PFA são irritantes e, portanto, devem ser manipulado em uma coifa e com xixi apropriado.
-
Pacto (técnica de compensação de passivo)
- Isolar e cultura todo SNC (cérebro e medula espinhal) do fixo e ratos para um tubo de 50 mL contendo uma solução de pacto refrigerada cocktail de 4% PFA, acrilamida de 4% e 0,25% VA-044 pó e loja a 4 ° C por 24 h. Certifique-se de que o tecido é completamente imerso no s olution.
- Incorporar a amostra de gás nitrogênio para 10 min, usando um tecido do gel sistema de hibridização, conectado a um tanque de nitrogênio: Configure o sistema para 37 ° C. Transferência de tecidos para um tubo de 50 mL contendo fresco frio (4 ° C) pacto solução cocktail e conectar-se com a tampa do tubo e, em seguida, ligue o aspirador.
- Para polimerizar o hidrogel, coloque o tubo contendo a amostra em uma incubadora de agitação (150 rpm, 37 ° C) por 3 h, ou até polimerização é completa.
- Usando papel mata-borrão (ver Tabela de materiais), remover o restante hidrogel polimerizado, os tecidos circundantes.
- Transferi o tecido para um tubo de 50 mL contendo solução de limpeza (8% SDS em PBS 0,1 M, pH 8.0).
- Coloca a amostra numa incubadora tremendo conjunto para 37 ° C e 150 rpm, até que o tecido tenha sido apagado. Em média, demora cerca de 20 dias para o mouse CNS para alcançar a total clareza.
-
psPACT (processo separado técnica de compensação passiva)
- Isole o CNS inteiro (cérebro e medula espinhal) com osso cortador e tesoura de PFA-fixo e ratos sobre uma bancada limpa.
- Tecidos de transferir para um tubo de 50 mL contendo 4% PFA e loja a 4 ° C por 24 h. para garantir que o tecido é completamente imerso no fixador.
- Lave o tecido fixo por 1h em PBS 0,1 M e depois transferir a solução de A4P0 (4% do acrilamido em PBS 0,1 M). Loja a 37 ° C por 24 h.
- Lave o tecido por 5 min em PBS 0,1 M.
- Mergulhe o tecido em 0,25% em PBS 0,1 M de VA-044. Armazenar a 37 ° C por 6-24 h e depois transferir a solução fresca de VA-044/PBS de 0,25%.
- Incorporar a amostra em gás nitrogênio por 10 min, usando um tecido do gel hibridização sistema (ver Tabela de materiais) conectado a um tanque de nitrogênio: transferência de tecidos para um tubo de 50 mL contendo fresco frio (4 ° C) solução de VA-044/PBS de 0,25% e se conectar com a tampa do tubo. Ligue o aspirador.
- Transferi o tecido para limpar a solução (8% SDS em PBS 0,1 M, pH 8.0).
- Incube a amostra numa incubadora tremendo conjunto para 37 ° C e 150 rpm, até que o tecido tenha sido apagado. Em média, demora cerca de 17 dias para mouse CNS para alcançar a total clareza.
-
mPACT (técnica de compensação passiva modificada)
- Isole o CNS inteiro (cérebro e medula espinhal) com osso cortador e tesoura de PFA-fixo e ratos sobre uma bancada limpa.
- Siga os passos 4.2.2 - 4.2.8 do protocolo psPACT.
- Transferi o tecido para a solução de compensação. Observe que, ao contrário dos protocolos de pacto e psPACT, mPACT requer uma solução de limpeza consiste em 0,5% α-thioglycerol, além de 8% SDS em PBS 0,1 M, pH 8.0. Α-thioglycerol é um agente un-torra que ajuda a limpar o tecido mais rapidamente e eficazmente. Certifique-se de que o tecido está totalmente imerso na solução.
- Coloca a amostra numa incubadora tremendo conjunto para 37 ° C e 150 rpm, até que o tecido tenha sido apagado. Em média, demora cerca de 2 semanas para mouse CNS para alcançar a total clareza.
5. índice de refração de correspondência e imunocoloração de CNS apurada
Nota: jantes n(solução de correspondência do índice de refração baseada em Nycodenz) consiste em 0,8 g/mL Nycodenz pó dissolvido em 30 mL de tampão base (0,01% de azida sódica e Tween-20 em PBS 0,1 M, pH 8.0). É recomendável que a solução é colocada em um 37 ° C, agitando a incubadora para permitir a adequada solvatação do pó.
- Incubar os tecidos em 0,1% Triton X-100 em PBS 0,1 M para 2 h, em seguida, bloquear com 2% albumina de soro bovino (BSA) em PBS 0,1 M para 6 h.
- Lave as seções três vezes em PBST (0.1% Tween-20 em PBS 0,1 M) para 2 h. mancha seções com anticorpos primários (no caso, um anticorpo de PECAM-CD31 anticoelho, que as manchas dos vasos sanguíneos) por 2 dias.
- Mancha de seções com anticorpos secundários (no caso, um cabra anti-coelho IgG Cy3 conjugado fluorescente) em BSA 2% por 2 dias.
- Lavagem rotulada tecidos três vezes em PBST por 2 h e a loja em 15 mL njantes para 2-10 dias.
- Antes de imagem, mova rotulado de tecidos para uma pequena quantidade de jantes nem pratos de cultura de tecido - ou 60-35mm. Fixe com silicone ao redor da borda inferior do prato.
- Adicione 1,5-2 mL de fresco njantes.
6. processamento de imagem
- Adquirir imagens de tecidos limpos com telha digitalização usando uma ampliação de 10x de microscopewith varredura a laser confocal (ver Tabela de materiais). Para de tecido Cy3-etiquetadas, usar comprimentos de onda de 550-600 nm.
Resultados
Geração de um modelo transparente do SNC inteiro usando técnicas de compensação passiva otimizado
Óptica autorização do camundongo e rato de tecidos CNS foi rapidamente alcançada utilizando várias técnicas de compensação passiva (Figura 1). Um esquema do tecido ao longo do tempo de compensação é mostrado na Figura 2A. Ao contrário do método original de pacto, psPACT (Pacto de processo-separe) envolve tratar amostras com solução de iniciador de VA-044 de 0,25% e 4% de acrilamida (A4P0) em duas etapas distintas, a fim de formar o híbrido de hidrogel. mPACT (Pacto modificado) melhora ainda mais psPACT, completando o SDS de 8%, limpando a solução com 0,5% de α-thioglycerol. Amostras processadas através do Pacto, psPACT e mPACT no dia 14 são comparadas e apresentadas na Figura 2B.
Em um estudo anterior, informamos que enquanto o protocolo original do Pacto alcançado óptico desembaraço em 23 dias, psPACT e mPACT limpou todo mouse CNS em apenas 20 e 14 dias, respectivamente,10. No presente estudo, quando tratamos de amostras de cérebro do rato através do protocolo mPACT, achamos que eles alcançaram a transparência óptica após 14 dias (Figura 2B). Rato toda CNS amostras processadas através de psPACT e mPACT também mostrou que mPACT conseguido autorização máxima com a maior eficiência, como tecidos foram apurados nos dias 20 e 30, respectivamente (Figura 3A, B). Cérebro de rato adulto sozinho, ao contrário do CNS inteiro, foram limpos com mPACT em um mero 5 dias (Figura 4A). Padrões de vaso sanguíneo do cérebro do rato apuradas foram analisados através de imunofluorescência após psPACT e processamento mPACT para demonstrar a utilidade destes procedimentos de compensação para a análise anatômica e funcional do cérebro (Figura 4B, dados mPACT mostrado em Woo et al. 2016)10.
Usando estes otimizado passivo tecido protocolos de compensação, fomos capazes de visualizar modelos intactos, transparentes do SNC todo, embora os tempos de compensação diferem entre os três protocolos. Passivo otimizado métodos de compensação alcançado clareza de órgão de um comprimento mais curto de tempo. Tomados em conjunto, estes resultados sugerem que o método de compensação mPACT pode gerar claro CNS mais estável e rápido do que o anterior passiva métodos de compensação. Assim, mPACT possui grande potencial para uso análises no futuro estruturais e anatômicas dos órgãos de mamíferos e fornece uma vantagem significativa sobre os métodos existentes em termos de eficácia e segurança.
Geração de órgãos internos opticamente apurados e embriões usando mPACT
Além de tecidos CNS, o rato adulto baço e rins foram limpos com mPACT nos dias 19 e 23, respectivamente (Figura 5AB). Embriões do rato em E10.5 e E13.5 também foram liberados após 3 dias de processamento via protocolo mPACT. Figura 5 -E mostra a visualização de padrões de vasos sanguíneos em todo embrião, bem como da microvasculatura da região da cauda do embrião do rato, rato cauda equina e o baço de rato. Estes resultados sugerem que mPACT pode ser usado para gerar modelos transparentes de uma grande variedade de tecidos e órgãos para a análise anatômica 3D.
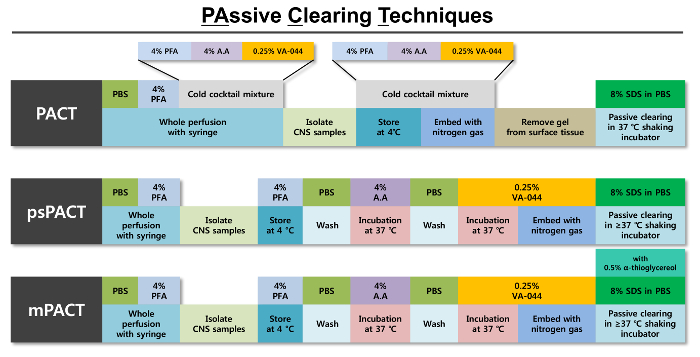
Figura 1: representação esquemática das técnicas de compensação passiva otimizado (Pacto). Um resumo das etapas individuais envolvidas em cada um dos três protocolos pacto é fornecido juntamente com os reagentes necessários para cada etapa. O protocolo original do pacto é a polimerização de tecido da formação de hidrogel com uma mistura fria de 4% PFA, solução de acrilamida (A.A) de 4% e 0,25% solução de iniciador de VA-044. Depois o tecido é polimerizado usando gás nitrogênio, que é passivamente cancelou com SDS de 8%, solução de compensação. O psPACT (Pacto de processo-separe) usa processos de tratamento separado de solução A.A de 4% e solução de iniciador de VA-044 de 0,25% para a formação de hidrogel do tecido; Estas condições diferem do protocolo original do pacto. O mPACT (Pacto modificado) adicional adiciona 0,5% α-thioglycerol 8% SDS limpando a solução do protocolo psPACT. Para todos os três protocolos, os tecidos intactos são incubados a > = 37 ° C numa incubadora de agitação até iss afastamento máximo alcançada. Clique aqui para ver uma versão maior desta figura.
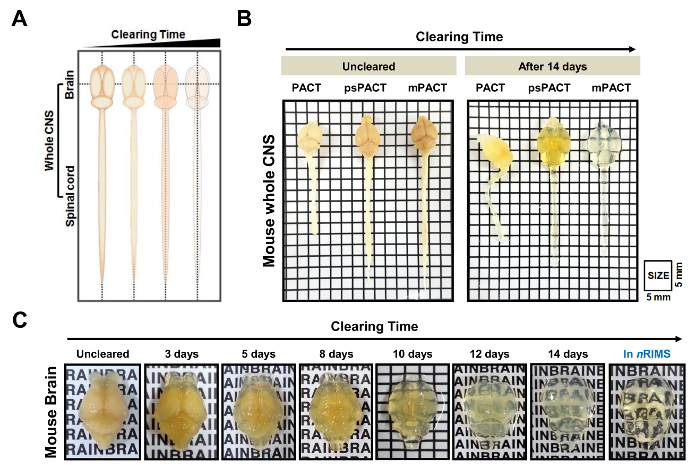
Figura 2: transparência óptica do rato todo sistema nervoso central (CNS) por compensação passiva de tecido. (A) esquematização de todo tecido de CNS, através de métodos baseados em pacto de compensação ao longo do tempo. (B) comparação entre os três protocolos de compensação passiva (pacto original, psPACT, mPACT) rato toda CNS em 14 dias após o processamento. (C) liberação de ótica do cérebro do rato submetido a mPACT processamento durante 14 dias. Esta figura foi modificada de Woo et al . 201610. As letras em C 2 são 3 milímetros de altura. Clique aqui para ver uma versão maior desta figura.
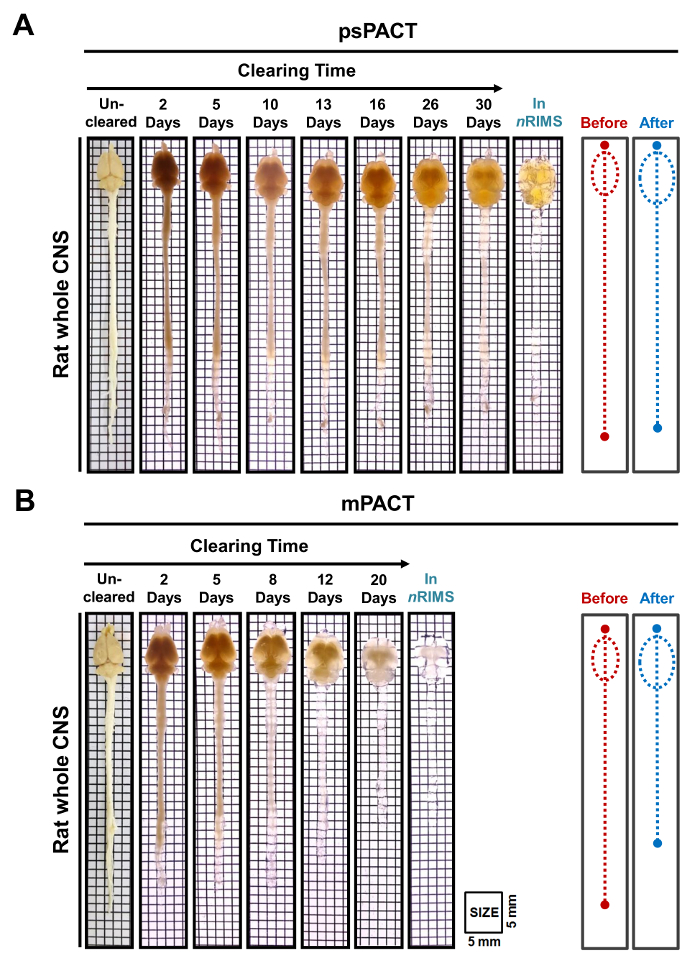
Figura 3: transparência óptica de rato toda CNS tecidos post-psPACT e mPACT. (A) todo tecido de CNS rato adulto alcançado apuramento óptico máximo com psPACT após 30 dias. (B) tecido de CNS todo rato adulto alcançado apuramento óptico máximo com mPACT após 20 dias. O antes e depois de diagramas indicam o tamanho do SNC todo antes e após o tratamento, medida pelo olho. Clique aqui para ver uma versão maior desta figura.

Figura 4: mPACT visualização processamento e microvasculatura do cérebro do rato adulto seccionado. (A) comparação de cérebro de rato adulto grosso de 4mm seções depois mPACT processamento em 3 e 5 dias. (B) projeção 3D de padrões dos vasos sanguíneos no cérebro de ratos adultos visualizado com anticorpo anti-CD31 após o processamento de psPACT. Barras de escala, 1.500 µm e 100 µm. Esta figura foi modificada de Woo et al . 201610. Clique aqui para ver uma versão maior desta figura.
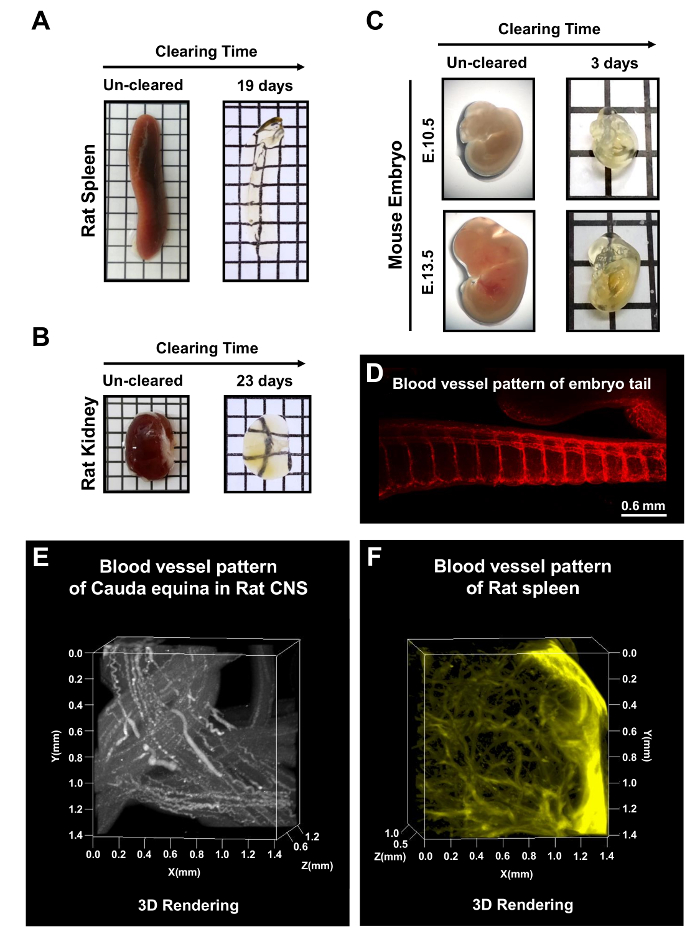
Figura 5: mPACT processamento de órgãos de roedores e embriões do rato inteiro. mPACT alcançado transparência óptica no baço de rato adulto (A) e (B) rim nos dias 19 e 23, respectivamente. (C) mPACT produzido embriões do rato transparentes de E10.5 e E13.5 depois de 3 dias. (D) visualização da microvasculatura com anti-CD31 na região da cauda do embrião do rato após limpeza com mPACT. (E) projeção 3D da vasculatura no rato cauda equina e baço de rato (F) com anti-CD31, após o processamento via mPACT. Esta figura foi modificada de Woo et al . 201610. Clique aqui para ver uma versão maior desta figura.
Discussão
Enquanto os métodos de extração passiva, não-eletroforética empregado no Pacto melhorou significativamente a consistência alcançada com tecido anterior limpando métodos tais como clareza,2,3,4,7 , 8, a técnica ainda tem várias deficiências, o mais urgente do que é o período de tempo necessário para atingir o tecido máxima clareza12. No estudo atual, apresentamos protocolos modificados do pacto que reduzem significativamente o tempo necessário para o tecido, limpar, ainda preservando o tecido integridade e estrutura6,10. Além disso, pela primeira vez, podemos demonstrar a aplicação do tecido, limpando os protocolos em tecidos CNS e em um modelo de roedor de ordem superior, o rato10.
Especificamente, psPACT envolve o processamento de amostra em acrilamida 4% e 0,25% VA-044 em duas etapas distintas durante a formação de hidrogel, enquanto mPACT mais baseia-se psPACT e suplementos o SDS 8% solução com 0,5% de α-thioglycerol10de compensação. Separando a acrilamida e a etapa subsequente de VA-044 evita a necessidade de remover restante monômeros de hidrogel não polimerizadas que cercam o tecido, o que pode comprometer a integridade do tecido final depois de alcançar a transparência com o pacto; Além disso, isto reduz significativamente o tempo necessário para produzir o máximo afastamento óptico. A adição de α-thioglycerol no método mPACT mais acelera a clareira processar13, como α-thioglycerol é um agente un-torra que ajuda a limpar as regiões do tecido que são menos acessíveis usando apenas os reagentes no método pacto original 7 , 8 , 9.
Uma comparação do Pacto, psPACT e mPACT em tecido de roedor demonstrou que enquanto psPACT melhora a transparência óptica em relação o protocolo original do Pacto, mPACT mais eficiente permite a compensação e a subsequente de imagem de alta resolução de ambos todo órgãos de mamíferos e fatias secionadas, como demonstrado na Figura 2, Figura 3, Figura 4. A dispensa de α-thioglycerol-base lipídica dos órgãos transformados na chave mPACT método provado para as diferenças na estabilidade do tecido, transparência e eficiência em comparação com outros métodos de limpeza de dois. Isto permitiu a rápida análise 3D de órgãos transformados, especificamente no que diz respeito a morfologia da vasculatura de sangue, através da imunofluorescência e microscopia confocal (Figura 5E).
Enquanto a adição de α-thioglycerol para a solução de compensação baseada em SDS é fundamental para acelerar a transparência óptica, também ligeiramente aumenta a fragilidade do tecido e torna mais suscetíveis a danos de pós-processamento. A clara superioridade do mPACT com relação à sua eficiência supera essa limitação; no entanto, atualmente trabalho para garantir que a compensação máxima pode ser alcançada com mínima para nenhuma despesa da integridade do tecido.
Assim, nossos resultados estabelecem mPACT como uma poderosa ferramenta de investigação para fornecer uma análise 3D das características funcionais e anatômicas dos órgãos de mamíferos, incluindo mas não limitado a redes neuronais, vasculatura de sangue e tecido arquitetura de matriz. Movendo-se para a frente, acreditamos que mPACT pode ser especialmente útil na investigação de ordem superior mecanismos biológicos que contribuem para a fisiopatologia da doença, tais como lesão tecidual, malformações do desenvolvimento, câncer e neurodegenerativas doença14,15,16,17. Combinado com um estudo dos mais fino mecanismos celulares envolvidos na doença, mPACT tem potencial para fornecer uma escala multi mais completa, compreensão da doença díspar como vários mecanismos interagem para originar o fenótipo observado.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo projeto cérebro Coreia 21 PLUS para ciências médicas, Universidade de Yonsei. Além disso, este trabalho foi financiado por um subsídio da Fundação de pesquisa nacional da Coreia (NRF-2017R1D1A1B03030315).
Materiais
| Name | Company | Catalog Number | Comments |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix, Inc. | 75819 | Clearing solution |
| Nycodenz | Axia-Shield | 1002424 | nRIMS solution |
| 40% Acrylamide Solution | Bio Rad Laboratories, Inc. | 161-0140 | Polymerization (A4P0) |
| 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] Dihydrochloride | Wako Pure Chemical Industries, Ltd. | 017-19362 | Polymerization (VA-044) |
| 1-Thioglycerol | Sigma-Aldrich | M1753-100ML | Clearing solution (mPACT) |
| Tween-20 | Georgiachem | 9005-64-5 | nRIMS solution |
| Triton X-100 | Sigma-Aldrich | T8787-50ML | Immuno Staining |
| Bovine serum albumin (BSA) | Bovogen | BSA100 | Immuno Staining |
| Heparin | Merck Millipore | 375095 | Perfusion (PBS) |
| Sodium azide | Sigma-Aldrich | S2002-25G | nRIMS solution |
| PECAM-CD31 antibody | Santa Cruz Biotechnology Inc. | sc-28188 | Immuno Staining |
| Goat anti-rabbit-IgG Cy3 fluorescent conjugate | Jackson ImmunoResearch Inc. | 111-165-003 | Immuno Staining |
| 4% Paraformaldehyde | Tech & Innovation | BPP-9004 | Perfusion, Polymerization |
| 20X Phosphate Buffered Saline (pH 7.4) | Tech & Innovation | BPB-9121 | Perfusion, Buffer |
| 10 mL stripette | Coatar | 4488 | Solution transfer |
| 50 mL tube | Falcon | 352070 | Clearing tube |
| 35 mm Cell culture dish | SPL | 20035 | Imaging |
| Confocal dish | SPL | 211350 | Imaging |
| 1 mL syringe | Korea vaccine Co., Ltd | 26G 1/2 | Anesthetize |
| 50 mL syringe | Korea vaccine Co., Ltd | 21G1 1/4 | Perfusion |
| Acrylamide | Sigma-Aldrich | A3553 | Polymerization (A4P0) |
| Whatman 3MM paper | Sigma-Aldrich | Z270849 | Blotting paper for gel removal |
| Confocal microscope | Zeiss | LSM780 | Imaging |
| ZEN lite Software | Zeiss | ZEN 2012 | Imaging |
| Peristaltic pump | Longerpump | BT100-1F | Perfusion |
| EasyGel | Lifecanvas Technologies | EasyGel | Tissue gel hybridization system |
Referências
- Zhu, X., Xia, Y., Wang, X., Si, K., Gong, W. Optical brain imaging: A powerful tool for neuroscience. Neurosci Bull. 33 (1), 95-102 (2017).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9 (7), 1682-1697 (2014).
- Feng, Y., et al. CLARITY reveals dynamics of ovarian follicular architecture and vasculature in three-dimensions. Sci Rep. 7, 44810(2017).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Dev Biol. 14, 48(2014).
- Jensen, K. H. R., Berg, R. W. Advances and perspectives in tissue clearing using CLARITY. J Chem Neuroanat. 86, 19-34 (2017).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nat Protoc. 10 (11), 1860-1896 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331(2016).
- Woo, J., Lee, M., Seo, J. M., Park, H. S., Cho, Y. E. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Exp Mol Med. 48 (12), 274(2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Roberts, D. G., Johnsonbaugh, H. B., Spence, R. D., MacKenzie-Graham, A. Optical clearing of the mouse central nervous system using passive CLARITY. J Vis Exp. (112), (2016).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: A simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16 (8), 1154-1161 (2013).
- Choi, B. R., et al. Increased expression of the receptor for advanced glycation end products in neurons and astrocytes in a triple transgenic mouse model of Alzheimer's disease. Exp Mol Med. 46, 75(2014).
- Chang, D. J., et al. Contralaterally transplanted human embryonic stem cell-derived neural precursor cells (ENStem-A) migrate and improve brain functions in stroke-damaged rats. Exp Mol Med. 45, 53(2013).
- Kim, T. K., et al. Analysis of differential plaque depositions in the brains of Tg2576 and Tg-APPswe/PS1dE9 transgenic mouse models of Alzheimer disease. Exp Mol Med. 44 (8), 492-502 (2012).
- Kinameri, E., et al. Prdm proto-oncogene transcription factor family expression and interaction with the Notch-Hes pathway in mouse neurogenesis. PLoS One. 3 (12), e3859(2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados