Method Article
Nuevo pasivo claro los métodos para la producción rápida de transparencia óptica en todo el tejido del SNC
En este artículo
Resumen
Aquí, presentamos dos metodologías novedosas, psPACT y mPACT, para lograr la máxima transparencia óptica y posterior análisis microscópico de vascularización del tejido en el roedor intacto todo CNS.
Resumen
Desde el desarrollo de la claridad, un bioelectroquímicos limpieza técnica permite mapeo tridimensional fenotipo dentro de tejidos transparentes, una multitud de metodologías de novela claro incluyendo cúbicos (proyección de imagen de cerebro claro y sin obstrucciones cócteles y análisis computacional), interruptor (todo el sistema de control de tiempo de interacción) y la cinética de los productos químicos, mapa (ampliada análisis del proteoma), Pacto (técnica de claridad pasivo), se han establecido para ampliar las herramientas existentes para el análisis microscópico de tejidos biológicos. El presente estudio pretende mejorar y optimizar el procedimiento de Pacto original para una gran variedad de tejidos de roedores intactos, incluyendo el todo sistema nervioso central (CNS), riñones, bazo y embriones de ratón todo. Denominado psPACT (Pacto de proceso separado) y mPACT (Pacto modificado), estas nuevas técnicas proporcionan medios altamente eficaces de asignación de circuitos de células y visualizar estructuras subcelulares en los tejidos normales y patológicos intactos. En el siguiente protocolo, proporciona un contorno detallado, paso a paso cómo lograr separación máxima del tejido con mínima invasión de su integridad estructural a través de psPACT y mPACT.
Introducción
Un objetivo fundamental de la investigación científica y clínica consiste en lograr una comprensión completa de la estructura de órgano y función; sin embargo, la naturaleza extremadamente compleja de órganos mamíferos a menudo sirve como una barrera para alcanzar plenamente este objetivo1. CLARIDAD (intercambian lípidos claro cruzado por hibridación acrilamida rígido compatible con la proyección de imagen Tisssue-hidrogel)2,3,4, que implica la construcción de un híbrido basados en acrilamida hidrogel de tejidos intactos, logra separación óptica de una variedad de órganos, incluyendo el cerebro, el hígado y el bazo, mientras que preserva su integridad estructural5. CLARIDAD así ha permitido no sólo la visualización, sino también la oportunidad de disecar finamente complejas redes celulares y morfologías de tejido sin necesidad de seccionar.
Para lograr la separación de tejido, claridad emplea métodos electroforéticos para eliminar el contenido de lípidos de la muestra de mano. Mientras que la claridad se ha observado para producir híbridos de tejido-hidrogel físicamente estable, los estudios han demostrado que el uso de métodos de electroforesis tejido claro (ETC) produce resultados variables en cuanto a la calidad del tejido, incluyendo dorado, daño del epítopo, y pérdida de proteína de5,6. Para tratar estos temas, protocolos modificados como Pacto (pasivo claridad técnica), que sustituye el tratamiento etc. con una técnica pasiva, detergente iónico delipidation basado, han sido desarrollados7,8,9. A pesar de lograr una mayor consistencia en los resultados, sin embargo, pacto requiere más tiempo para obtener la máxima separación. Además, ninguna de estas técnicas todavía se aplicaron a la forma entera de la CNS, o en modelos más grandes roedores como las ratas y conejillos de Indias.
El presente estudio pretende abordar estas limitaciones proponiendo metodologías novela, psPACT (Pacto de proceso separado) y mPACT (Pacto modificado), para facilitar la rápida liquidación de CNS todo los órganos internos en modelos de ratón y rata10. Específicamente, psPACT procesos de tejidos en acrilamida 4% y 0.25% VA-044 en dos pasos separados durante la formación del hidrogel; mPACT esencialmente implica los mismos pasos, pero complementa la solución claro basado en SDS 0,5% α-thioglycerol como un reactivo clave. Ambas técnicas aprovechan la endógena sistémica y cerebroespinal circulatorio para reducir significativamente el tiempo necesario para producir la separación óptica. Como una prueba de principio, nos demuestran el uso de la microscopia confocal para analizar patrones de vasos sanguíneos en los tejidos despejado10.
Protocolo
Todos los procedimientos han sido aprobados por el Comité de ética de la investigación adecuada en el Colegio de medicina de la Universidad de Yonsei. Todos los animales experimentales son sacrificados con arreglo a las directrices del Comité de cuidado de los animales de laboratorio en la Universidad de medicina de la Universidad de Yonsei.
1. preparación de reactivos
PRECAUCIÓN: Paraformaldehido (PFA), acrilamida y sodio dodecil sulfato (SDS) son tóxicos irritantes y por lo tanto debe manejarse en una campana de humos con equipo de protección personal (PPE, bata, guantes, gafas protectoras).
- solución de acrilamida (A.A) 4% (A4P0): Añadir 20 mL de solución de acrilamida del 40% a 180 mL de 0.1 M tampón fosfato salino (PBS).
- Solución al 0.25% VA-044: agregar 0.5 g de 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] diclorhidrato (VA-044) polvo en 200 mL de 0.1 M tampón fosfato salino (PBS). Mientras que el polvo VA-044 puede almacenarse a temperatura ambiente, deben almacenarse a 4 ° C sobre la solubilización en PBS. Para mejores resultados, prepare sólo la cantidad de solución necesaria para el experimento.
- Solución cóctel Pacto: Añadir 10 g de acrilamida a 225 mL de solución al 4% paraformaldehido (PFA) y ajustar el volumen a 200 mL con 4% PFA. Antes de usar Añadir 100 mg de polvo de VA-044 a 40 mL de la mezcla en un tubo cónico de 50 mL.
- Pacto de compensación buffer solución: Añadir 40 g de sulfato de sodio dodecyl (SDS) a 350 mL de PBS de 0,1 M y ajuste el volumen a 500 mL con PBS de 0,1 M. Para mPACT claro solución, Añadir 0,5% α-thioglycerol al Pacto de compensación buffer de solución.
- Los ratones utilizados en este estudio fueron ratones machos de BALB de 2 semanas de edad; las ratas utilizadas en este estudio fueron 2 semanas de edad SD-ratas macho.
2. anestesia y la cirugía de la perfusión
PRECAUCIÓN: PFA acrilamida son tóxicos irritantes y por lo tanto debe manejarse en una campana de humos con PPE apropiado.
- Anestesiar al animal en un ambiente libre de patógenos con 30 mg/kg zoletil utilizando una jeringa de 1 mL con una aguja de calibre 26. Vigilar al animal para 5-10 min.
- Una vez que el animal ha alcanzado un plano quirúrgico de anestesia, utilice el método de respuesta del pellizco del dedo del pie para determinar la profundidad de la anestesia. Confirman falta de respuesta.
Nota: Los siguientes pasos involucrando cirugía de ratón y rata siguen un protocolo similar usado en un anterior estudio11. - Haga una incisión de 5-6 cm por debajo de la caja torácica, a través del tegumento y de la pared abdominal.
- Utilice tijeras curvadas, romos para hacer una incisión en el diafragma, palpando la zona torácica para localizar el sitio de la incisión previamente.
- Extender la incisión a través de toda la longitud de la caja torácica para exponer la cavidad pleural.
- Desplazar con cuidado los pulmones. Hacer un corte a través de la caja torácica a la altura de la clavícula. Usando las tijeras de iris, haga una pequeña incisión en la parte posterior del ventrículo izquierdo. Inserte una aguja calibre 18 u oliva-punta de la perfusión en la aorta ascendente, pasando por el ventrículo corte.
- Asegure la aguja y evitar fugas por el corazón con una pinza de sujeción. Alternativamente, utilizar una pinza modificada para apretar la aorta alrededor de la punta de la aguja.
- Hacer una gran incisión en la aurícula derecha, teniendo cuidado de asegurar un mínimo daño a la aorta descendente. La rata está ahora lista para perfusión.
3. toda perfusión y disección de la rata
PRECAUCIÓN: PFA acrilamida son tóxicos irritantes y por lo tanto debe manejarse en una campana de humos con PPE apropiado.
Nota: Los siguientes pasos de perfusión todo son un similar a un protocolo que se utiliza en un estudio previo por Woo et al. (2016) 10 , 11.
- Fije la aurícula derecha del corazón a una aguja de calibre 18, teniendo cuidado de no introducir burbujas de aire.
- Rápida y uniformemente bomba utilizando una jeringa de 50 mL, de 50 mL de solución de PBS de 0,1 M fría que contiene heparina (10 unidades/mL).
- Conecte la aguja de calibre 18 para el tubo de la bomba peristáltica.
- Lave con 200 mL de solución de PBS de 0,1 M fría que contiene heparina (10 unidades/mL) a una velocidad de circulación de 10 mL/min.
- Fijar con 250 mL de solución fría de PFA 4% a una velocidad de circulación de 10 mL/min. La rata debe ser rígida en este momento.
- Recoger y almacenar la solución restante de PFA para su eliminación.
- Pacto, perfusión de los tejidos con una solución cóctel frío de Pacto de 4% PFA 4% acrilamida y 0.25% VA-044 polvo con una aguja de calibre 18 y retire la cabeza y columna vertebral. Exponer el cráneo haciendo una incisión de línea media del cuello a la nariz. Este paso adicional de la perfusión es necesaria para los métodos psPACT y mPACT; después de la fijación, inmediatamente aislar la cabeza y la columna vertebral y exponer el cráneo.
- Exponer la base del cráneo mediante la eliminación de cualquier cuello residual y muscular de la columna vertebral.
- Utilizar gubias y tijeras para pelar lejos del cráneo. Quitar el cerebro y la médula espinal.
- Guarde el tejido en 4% PFA a 4 ° C; los tejidos pueden conservarse hasta 1 semana.
4. hidrogel monómero infusión y polimerización del SNC de rata y ratón
PRECAUCIÓN: Acrilamida, SDS, α-thioglycerol y PFA son irritantes y por lo tanto deben manejarse en una campana de humos y con PEE apropiado.
-
Pacto (compensación técnica pasiva)
- Aislar y cultura todo SNC (cerebro y médula espinal) de las ratas y ratones fijadas a un tubo de 50 mL que contiene una solución cóctel fría de Pacto de 4% PFA, 4% de acrilamida y 0.25% VA-044 polvo y almacenar a 4 ° C por 24 h. Asegúrese de que el tejido está completamente inmerso en la s olution.
- Embeber la muestra en gas nitrógeno para 10 minutos utilizando un gel sistema de hibridación conectado a un tanque de nitrógeno: sistema a 37 ° C. Transferencia de tejidos en un tubo de 50 mL que contenga dulce frío (4 ° C) Pacto solución cóctel y conectar con la tapa del tubo, girar en el vacío.
- Para polimerizar el hidrogel, coloque el tubo que contiene la muestra en un incubador de agitación (150 rpm, 37 ° C) durante 3 horas o hasta que la polimerización sea completa.
- Usando papel secante (véase Tabla de materiales), quitar el restante hidrogel polimerizado alrededor de los tejidos.
- Transferir el tejido a un tubo de 50 mL conteniendo solución clearing (8% de SDS en PBS de 0,1 M, pH 8.0).
- Coloque la muestra en un incubador de agitación poner a 37 ° C y 150 rpm hasta que el tejido se ha borrado. En promedio, tarda unos 20 días para el ratón del CNS para lograr claridad completa.
-
psPACT (proceso separado técnica pasiva claro)
- Aislar todo SNC (cerebro y médula espinal) con hueso cortador y tijeras de PFA-fijo de ratones y ratas en una mesa de trabajo limpia.
- Transferencia de tejidos para un tubo de 50 mL que contiene 4% PFA y almacenar a 4 ° C por 24 h. aseguran que el tejido está totalmente inmerso en el fijador.
- Lavar el tejido fijo para 1 h en PBS de 0,1 M y luego se transfieren a la solución de A4P0 (4% acrilamida en PBS de 0,1 M). Tienda a 37 ° C durante 24 h.
- Lavar el tejido durante 5 minutos en PBS de 0,1 M.
- Sumergir el tejido en 0.25% VA-044 en PBS de 0,1 M. Mantenga a 37 ° C durante 6-24 h y luego se transfieren a la solución de PBS-044/VA de 0.25% fresca.
- Embeber la muestra en gas nitrógeno para 10 minutos utilizando un gel hibridación sistema (véase Tabla de materiales) conectado a un tanque de nitrógeno: transferencia de tejidos en un tubo de 50 mL que contenga dulce frío (4 ° C) solución de PBS-044/VA de 0.25% y conectar con la tapa del tubo. Encienda la aspiradora.
- Transferir el tejido a limpiar solución (8% de SDS en PBS de 0,1 M, pH 8.0).
- Incubar la muestra en un incubador de agitación poner a 37 ° C y 150 rpm hasta que el tejido se ha borrado. En promedio, tarda aproximadamente 17 días para mouse CNS para lograr claridad completa.
-
mPACT (técnica de compensación pasiva modificado)
- Aislar todo SNC (cerebro y médula espinal) con hueso cortador y tijeras de PFA-fijo de ratones y ratas en una mesa de trabajo limpia.
- Siga los pasos 4.2.2 - 4.2.8 del protocolo psPACT.
- Transferir el tejido a limpiar solución. Observe que a diferencia de los protocolos de Pacto y psPACT, mPACT requiere una solución claro de 0.5% α-thioglycerol además de SDS de 8% en PBS de 0,1 M, pH 8.0. Α-thioglycerol es un agente sin dorador que ayuda a eliminar tejido más rápidamente y con eficacia. Asegúrese de que el tejido se sumerge totalmente en la solución.
- Coloque la muestra en un incubador de agitación poner a 37 ° C y 150 rpm hasta que el tejido se ha borrado. En promedio, tarda aproximadamente 2 semanas para mouse CNS para lograr claridad completa.
5. Índice de refracción que empareja y el Immunostaining del CNS despejado
Nota: nllantas (Nycodenz solución basada en Índice de refracción que empareja) consiste en 0,8 g/mL Nycodenz polvo disuelto en 30 mL de tampón base (0,01% de azida sódica y Tween-20 en PBS de 0,1 M, pH 8.0). Se recomienda que la solución esté en a 37 ° C agitando incubadora para permitir la adecuada solvatación del polvo.
- Incubar los tejidos en 0,1% Tritón X-100 en PBS de 0,1 M durante 2 h, luego bloquear con 2% albúmina sérica bovina (BSA) en PBS de 0,1 M durante 6 h.
- Lávese las secciones tres veces en SAFT (0,1% Tween-20 en PBS de 0,1 M) de 2 h. Mancha secciones con anticuerpos primarios (en este caso, un anticuerpo de anti-conejo PECAM-CD31, que tiñe los vasos sanguíneos) para 2 días.
- Mancha de secciones con anticuerpos secundarios (en este caso, un cabra anti-conejo IgG Cy3 fluorescente conjugado) en 2% de BSA durante 2 días.
- Lavado había etiquetado tejidos tres veces en SAFT durante 2 h y tienda en 15 mL llantas n2-10 días.
- Antes de la proyección de imagen, hacia tejidos etiquetados una pequeña cantidad de nllantas en platos de cultivo de tejidos de 35 o 60 milímetros. Fijar con silicona alrededor del borde inferior del plato.
- Añadir 1.5-2 mL de fresco nllantas.
6. tratamiento de la imagen
- Adquisición de imágenes de tejidos despejados con azulejo análisis mediante un aumento de 10 x-sistema de escaneo láser confocal microscopewith (véase Tabla de materiales). De tejido marcado con Cy3, utilizar longitudes de onda de 550-600 nm.
Resultados
Generación de un modelo transparente del CNS todo claro pasivo optimizado técnicas
Espacio óptico de los tejidos CNS todo ratón y rata se logró rápidamente utilizando diversas técnicas de compensación pasiva (figura 1). Un esquema de tejido claro con el tiempo se muestra en la figura 2A. A diferencia del método original del Pacto, psPACT (Pacto de proceso separado) consiste en tratar las muestras con 4% acrilamida (A4P0) y solución al 0.25% VA-044 iniciador en dos pasos distintos para formar el híbrido de hidrogel. mPACT (Pacto modificado) mejora aún más psPACT complementando la SDS 8% solución con 0,5% α-thioglycerol del claro. Muestras procesadas mediante pacto, psPACT y mPACT en el día 14 se comparan y se presenta en la figura 2B.
En un estudio anterior, informó que mientras que el protocolo original del Pacto había alcanzado espacio óptico en 23 días, psPACT y mPACT despejó el ratón entero del CNS en sólo 20 y 14 días, respectivamente10. En el presente estudio, cuando tratamos a muestras de cerebro de ratón mediante el protocolo mPACT, nos encontramos con que logra transparencia óptica después de 14 días (figura 2B). Muestras de CNS todas rata procesadas a través de psPACT y mPACT también demostrada eso mPACT logra separación máxima con la mayor eficiencia, como los tejidos eran despejaron en 30 y 20 días, respectivamente (Figura 3A, B). Cerebro de rata adulta solamente, en comparación con el SNC todo, fueron despejado con mPACT en sólo 5 días (Figura 4A). Patrones vasculares de cerebro de rata despejado se analizaron por inmunofluorescencia después de psPACT y mPACT proceso para demostrar la utilidad de estos procedimientos de claro para el análisis anatómico y funcional del cerebro (Figura 4B, mPACT datos se muestra en Woo et al 2016)10.
Con estas había optimizado tejido pasivo claro protocolos, hemos sido capaces de visualizar modelos intactos, transparentes del SNC todo, aunque los tiempos claro diferían entre los tres protocolos. Pasivo optimizado claro métodos logra claridad órgano en un periodo corto de tiempo. Tomados en conjunto, estos resultados sugieren que el mPACT claro método puede generar más estable y rápido que el anterior pasivo claro métodos claro CNS. Así, mPACT tiene gran potencial para el uso de análisis en el futuro estructurales y anatómicos de los órganos mamíferos y proporciona una ventaja significativa sobre los métodos existentes en términos de eficacia y seguridad.
Generación de órganos internos ópticamente limpia y embriones utilizando mPACT
Además todo tejidos CNS, bazo de rata adulta y riñón fueron despejados con mPACT en 19 y 23 días, respectivamente (figura 5AB). Embriones de ratón en E10.5 y E13.5 eran también despejaron después de 3 días de tratamiento mediante el protocolo mPACT. Figura 5 -E muestra la visualización de los patrones de vasos sanguíneos en el embrión entero, así como de la microvasculatura de la región de la cola del embrión de ratón, rata cauda equina y el bazo de rata. Estos resultados sugieren que eso mPACT puede utilizarse para generar modelos transparentes de una gran variedad de tejidos y órganos para el análisis anatómico 3D.
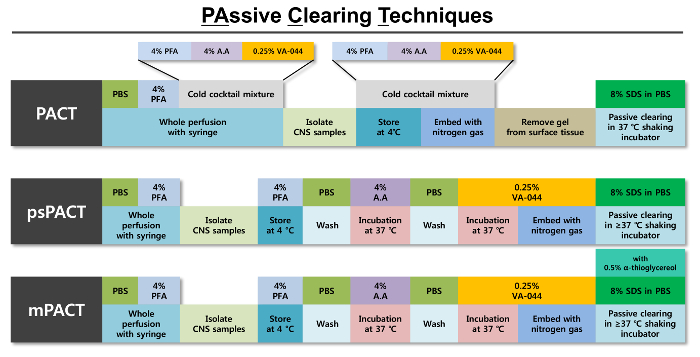
Figura 1: representación esquemática de las técnicas de compensación pasiva optimizada (Pacto). Se proporciona un resumen de los pasos individuales en cada uno de los tres protocolos del Pacto junto con los reactivos necesarios para cada paso. El protocolo original de Pacto es polimerización tejido de formación del hidrogel con una mezcla fría de 4% PFA, solución de acrilamida (A.A) 4% y 0.25% VA-044 iniciador solución. Después de que tejido es polimerizado usando nitrógeno gas, pasivamente se borra con el SDS 8% solución de limpieza. PsPACT (Pacto de proceso separado) utiliza procesos de tratamiento separados de la solución A.A 4% y 0.25% VA-044 iniciador para la formación de hidrogel del tejido; estas condiciones difieren de las del protocolo original de Pacto. MPACT (Pacto modificado) adicional agrega 0.5% α-thioglycerol a la SDS 8% solución del protocolo psPACT del claro. Para todos los tres protocolos, los tejidos intactos se incuban en > = 37 ° C en un incubador de agitación hasta iss separación máxima alcanzada. Haga clic aquí para ver una versión más grande de esta figura.
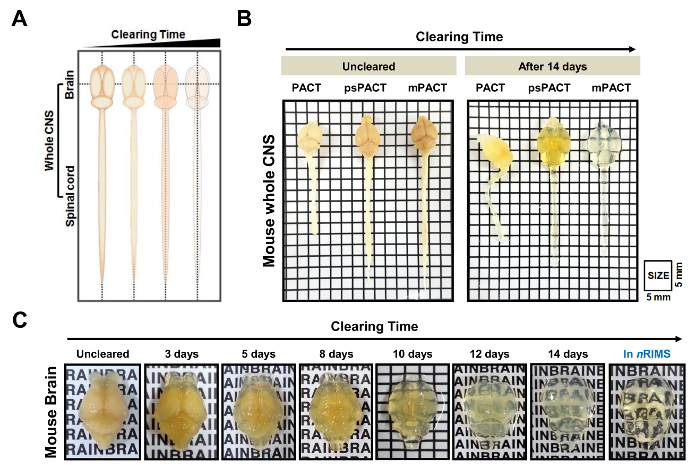
Figura 2: transparencia óptica del ratón todo sistema nervioso central (SNC) despejando tejido pasivo. (A) esquematización de todo tejido de CNS claro a través de métodos basados en el pacto con el tiempo. (B) comparación de los tres protocolos de compensación pasiva (Pacto original, psPACT, mPACT) en SNC todo ratón a los 14 días después de su transformación. (C) separación óptica del cerebro del ratón sometido a mPACT tratamiento durante 14 días. Esta figura ha sido modificada desde Woo et al. 201610. Las letras de 2C son 3 mm de alto. Haga clic aquí para ver una versión más grande de esta figura.
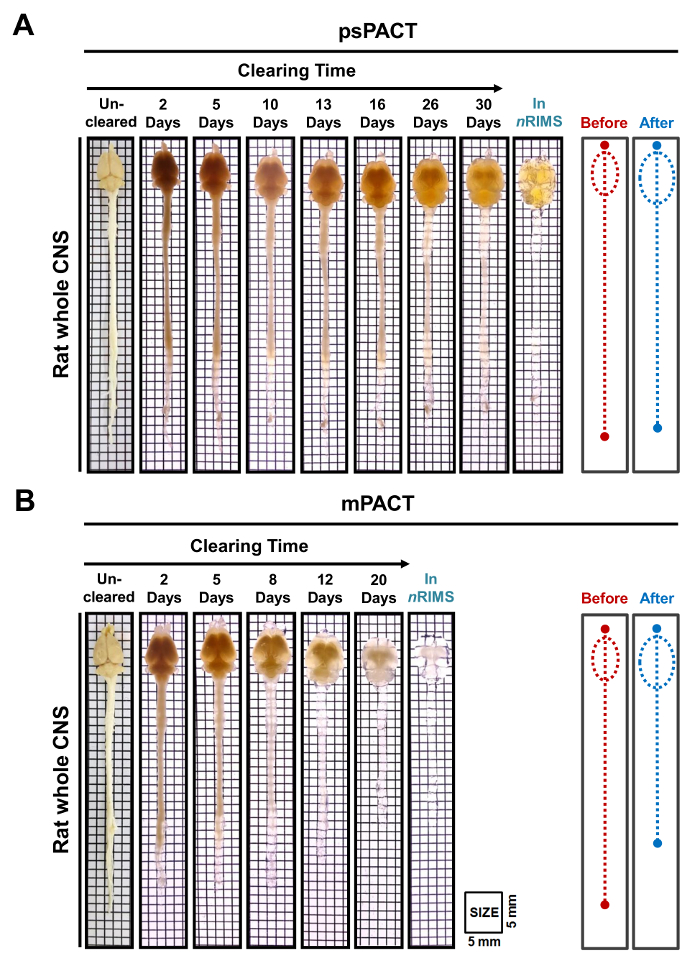
Figura 3: transparencia óptica de rata todo CNS tejidos post-psPACT y mPACT. (A) tejido de CNS toda rata adulta logra máxima separación óptica con psPACT después de 30 días. (B) tejido de CNS toda rata adulta logra máxima separación óptica con mPACT después de 20 días. El antes y después de diagramas indican el tamaño del SNC todo antes y después del tratamiento, medida por el ojo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: mPACT procesamiento y microvascularización visualización del cerebro de rata adulta seccionado. (A) comparación del cerebro de rata adulta espesor 4 mm secciones después de mPACT procesamiento en 3 y 5 días. (B) la proyección en 3D de los patrones de vasos sanguíneos en el cerebro de rata adulta visualizado con anticuerpo anti-CD31 después de un tratamiento psPACT. Barras de escala, 1.500 μm y 100 μm. Esta figura ha sido modificada desde Woo et al. 201610. Haga clic aquí para ver una versión más grande de esta figura.
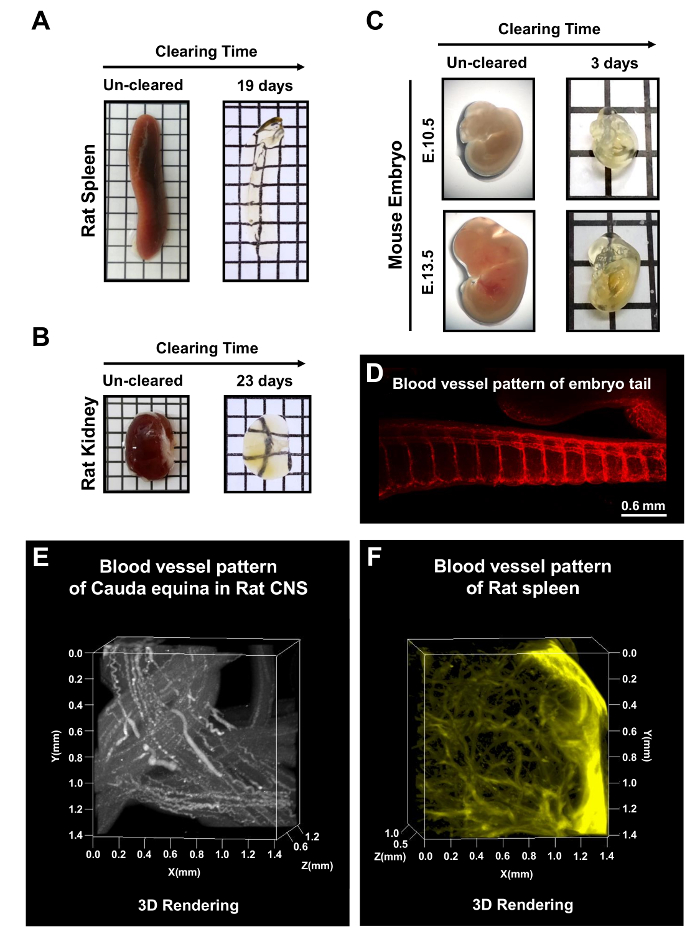
Figura 5: procesamiento de mPACT de roedores órganos y embriones de ratón todo. mPACT logra transparencia óptica en bazo de rata adulta (A) y (B) riñón en 19 y 23 días, respectivamente. (C) mPACT había producido embriones de ratón E10.5 y E13.5 transparentes después de 3 días. (D) visualización de microvascularización con anti-CD31 en la región de la cola del embrión del ratón después de la tala con mPACT. Proyección 3D (E) de la vasculatura en la rata cauda equina y bazo de rata (F) con anti-CD31, después de procesar vía mPACT. Esta figura ha sido modificada desde Woo et al. 201610. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Mientras que los métodos de extracción pasiva, no electroforéticas emplean en pacto mejoró significativamente la consistencia alcanzada con tejido anterior claro métodos tales como la claridad2,3,4,7 , 8, la técnica aún tiene varios defectos, el más acuciante de que es la longitud de tiempo requerido para lograr el máximo tejido claridad12. En el estudio actual, se presentan modificado los protocolos de pacto que reducen significativamente el tiempo necesario para el tejido, claro conservando aún tejido integridad y estructura6,10. Además, por primera vez, demostramos la aplicación de protocolos en tejidos CNS todo y en un modelo roedor de orden superior, la rata10del claro del tejido.
Específicamente, psPACT implica el procesamiento de las muestras en 4% de acrilamida y 0.25% VA-044 en dos pasos separados durante la formación del hidrogel, mientras mPACT más psPACT y se construye con suplementos SDS 8% claro solución con 0,5% de α-thioglycerol10. Separando la acrilamida y el posterior paso de VA-044 evita la necesidad de eliminación restante hidrogel sin polimerizar monómeros que rodean el tejido, que puede comprometer la integridad de tejido final después de lograr transparencia con pacto; Además, esto reduce significativamente el tiempo necesario para producir la máxima separación óptica. La adición de α-thioglycerol en el método de mPACT más acelera el claro proceso de13, como α-thioglycerol es un agente sin dorador que ayuda a eliminar regiones del tejido que son menos accesibles usando únicamente los reactivos en el método original de Pacto 7 , 8 , 9.
Una comparación del Pacto, psPACT y mPACT en tejido roedor demostró que mientras que psPACT mejora la transparencia óptica en relación con el protocolo original del Pacto, mPACT más eficiente permite la compensación y posterior proyección de imagen de alta resolución de ambos todo órganos mamíferos y rebanadas seccionadas, como se demuestra en la figura 2, figura 3, figura 4. El lavado de lípidos basada en α-thioglycerol de órganos procesados en la clave del método demostrado mPACT a las diferencias en la estabilidad de la transparencia, la eficiencia y el tejido en comparación con los otros métodos de compensación de dos. Esto permitió el rápido análisis 3D de órganos procesados, específicamente con respecto a la morfología de la vasculatura arterial, mediante inmunofluorescencia y microscopía confocal (figura 5E).
Mientras que la adición de α-thioglycerol a la solución de SDS basado claro es fundamental para acelerar la transparencia óptica, también ligeramente aumenta la fragilidad del tejido y la hace más susceptible al daño post-processing. La clara superioridad de mPACT en cuanto a su eficiencia compensa esta limitación; sin embargo, actualmente se trabaja para asegurar que se puede conseguir claro máximo con mínima a ningún cargo de la integridad del tejido.
Así, nuestros resultados establecen mPACT como una poderosa herramienta de investigación para proporcionar un análisis de las características funcionales y anatómicas de los órganos mamíferos, incluyendo pero no limitado a las redes neuronales, vasculatura de sangre y tejido matriz arquitectura 3D. Avanzar, creemos mPACT podría ser especialmente útil en la investigación de orden superior de mecanismos biológicos que contribuyen a la fisiopatología de la enfermedad, lesión tisular, malformaciones del desarrollo, cáncer y neurodegenerativas enfermedad14,15,16,17. Combinado con un estudio de los más finos mecanismos celulares involucrados en la enfermedad, mPACT tiene el potencial para proporcionar una multi-escala más completa comprensión de cómo varias enfermedades diferentes mecanismos interactúan para dar lugar al fenotipo observado.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el proyecto cerebro Corea 21 PLUS para ciencias médicas, Universidad de Yonsei. Además, este trabajo fue apoyado por una beca de la Fundación Nacional de investigación de Corea (NRF-2017R1D1A1B03030315).
Materiales
| Name | Company | Catalog Number | Comments |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix, Inc. | 75819 | Clearing solution |
| Nycodenz | Axia-Shield | 1002424 | nRIMS solution |
| 40% Acrylamide Solution | Bio Rad Laboratories, Inc. | 161-0140 | Polymerization (A4P0) |
| 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] Dihydrochloride | Wako Pure Chemical Industries, Ltd. | 017-19362 | Polymerization (VA-044) |
| 1-Thioglycerol | Sigma-Aldrich | M1753-100ML | Clearing solution (mPACT) |
| Tween-20 | Georgiachem | 9005-64-5 | nRIMS solution |
| Triton X-100 | Sigma-Aldrich | T8787-50ML | Immuno Staining |
| Bovine serum albumin (BSA) | Bovogen | BSA100 | Immuno Staining |
| Heparin | Merck Millipore | 375095 | Perfusion (PBS) |
| Sodium azide | Sigma-Aldrich | S2002-25G | nRIMS solution |
| PECAM-CD31 antibody | Santa Cruz Biotechnology Inc. | sc-28188 | Immuno Staining |
| Goat anti-rabbit-IgG Cy3 fluorescent conjugate | Jackson ImmunoResearch Inc. | 111-165-003 | Immuno Staining |
| 4% Paraformaldehyde | Tech & Innovation | BPP-9004 | Perfusion, Polymerization |
| 20X Phosphate Buffered Saline (pH 7.4) | Tech & Innovation | BPB-9121 | Perfusion, Buffer |
| 10 mL stripette | Coatar | 4488 | Solution transfer |
| 50 mL tube | Falcon | 352070 | Clearing tube |
| 35 mm Cell culture dish | SPL | 20035 | Imaging |
| Confocal dish | SPL | 211350 | Imaging |
| 1 mL syringe | Korea vaccine Co., Ltd | 26G 1/2 | Anesthetize |
| 50 mL syringe | Korea vaccine Co., Ltd | 21G1 1/4 | Perfusion |
| Acrylamide | Sigma-Aldrich | A3553 | Polymerization (A4P0) |
| Whatman 3MM paper | Sigma-Aldrich | Z270849 | Blotting paper for gel removal |
| Confocal microscope | Zeiss | LSM780 | Imaging |
| ZEN lite Software | Zeiss | ZEN 2012 | Imaging |
| Peristaltic pump | Longerpump | BT100-1F | Perfusion |
| EasyGel | Lifecanvas Technologies | EasyGel | Tissue gel hybridization system |
Referencias
- Zhu, X., Xia, Y., Wang, X., Si, K., Gong, W. Optical brain imaging: A powerful tool for neuroscience. Neurosci Bull. 33 (1), 95-102 (2017).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9 (7), 1682-1697 (2014).
- Feng, Y., et al. CLARITY reveals dynamics of ovarian follicular architecture and vasculature in three-dimensions. Sci Rep. 7, 44810(2017).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Dev Biol. 14, 48(2014).
- Jensen, K. H. R., Berg, R. W. Advances and perspectives in tissue clearing using CLARITY. J Chem Neuroanat. 86, 19-34 (2017).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nat Protoc. 10 (11), 1860-1896 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331(2016).
- Woo, J., Lee, M., Seo, J. M., Park, H. S., Cho, Y. E. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Exp Mol Med. 48 (12), 274(2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Roberts, D. G., Johnsonbaugh, H. B., Spence, R. D., MacKenzie-Graham, A. Optical clearing of the mouse central nervous system using passive CLARITY. J Vis Exp. (112), (2016).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: A simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16 (8), 1154-1161 (2013).
- Choi, B. R., et al. Increased expression of the receptor for advanced glycation end products in neurons and astrocytes in a triple transgenic mouse model of Alzheimer's disease. Exp Mol Med. 46, 75(2014).
- Chang, D. J., et al. Contralaterally transplanted human embryonic stem cell-derived neural precursor cells (ENStem-A) migrate and improve brain functions in stroke-damaged rats. Exp Mol Med. 45, 53(2013).
- Kim, T. K., et al. Analysis of differential plaque depositions in the brains of Tg2576 and Tg-APPswe/PS1dE9 transgenic mouse models of Alzheimer disease. Exp Mol Med. 44 (8), 492-502 (2012).
- Kinameri, E., et al. Prdm proto-oncogene transcription factor family expression and interaction with the Notch-Hes pathway in mouse neurogenesis. PLoS One. 3 (12), e3859(2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados