Method Article
Roman passif méthodes de compensation pour la Production rapide de transparence optique dans tout le tissu CNS
Dans cet article
Résumé
Nous présentons ici deux nouvelles méthodes, psPACT et mPACT, pour réaliser la transparence optique maximale et l’analyse microscopique ultérieure de la vascularisation des tissus chez le rongeur intact entier CNS.
Résumé
Depuis la mise au point de clarté, une bioelectrochemical technique de compensation qui permet pour la cartographie en trois dimensions de phénotype au sein des tissus transparents, une multitude de méthodes de compensation roman notamment cubique (l’imagerie cérébrale claire et dégagée cocktails et analyse computationnelle), SWITCH (contrôle systémique du temps de l’interaction) et la cinétique des produits chimiques, carte (grossie analyse du protéome) et Pacte (technique de clarté passive), ont été établis afin d’accroître la boîte à outils existant pour l’analyse microscopique des tissus biologiques. La présente étude vise à améliorer et optimiser la procédure initiale de Pacte pour une gamme de tissus de rongeurs intacts, y compris l’ensemble du système nerveux central (CNS), les reins, rate et des embryons de souris tout. Appelé psPACT (Pacte de processus-Remscheid) et mPACT (mis à jour le Pacte), ces nouvelles techniques fournissent des moyens très efficaces de cartographie des circuits de cellules et la visualisation des structures subcellulaires dans les tissus normaux et pathologiques intacts. Dans le protocole suivant, nous fournissons un aperçu détaillé, étape par étape sur comment réaliser le dégagement maximal tissu avec atteinte minimale à leur intégrité structurale via psPACT et mPACT.
Introduction
Des objectifs fondamentaux de l’enquête scientifique et clinique consiste à atteindre une compréhension complète de la structure de l’organe et la fonction ; Toutefois, la nature extrêmement complexe d’organes chez les mammifères sert souvent de barrière pour atteindre pleinement cet objectif1. CLARTÉ (lipides claire-échangé hybridé Acrylamide rigide compatible avec l’imagerie violets-hYdrogel)2,3,4, qui prévoit la construction d’un hybride d’hydrogel axée sur l’acrylamide de tissus intacts, réalise espace optique de divers organes, y compris le cerveau, le foie et la rate, tout en préservant leur intégrité structurale5. CLARTÉ a ainsi permis de non seulement visualisation, mais aussi l’occasion de disséquer finement les réseaux cellulaires complexes et morphologies de tissus sans la nécessité pour le sectionnement.
Afin de réaliser le dégagement de tissu, clarté emploie des méthodes électrophorétiques pour éliminer la teneur en lipides de l’échantillon à portée de main. Alors que la clarté a été notée pour produire des hybrides de tissu-hydrogel physiquement stable, des études ont montré que son utilisation des méthodes de compensation (etc.) tissu électrophorétique donne des résultats variables en termes de qualité de tissus, y compris le brunissement, épitope dommage, et protéine perte5,6. Pour résoudre ces problèmes, les protocoles modifiés tels que le Pacte (Technique PAssive de clarté), qui remplace le traitement ETC avec une technique de délipidation fonction passive, ionique-détergent, ont été développés7,8,9. Malgré la réalisation d’une plus grande cohérence dans les résultats, cependant, Pacte exige plus de temps pour obtenir l’autorisation maximale. En outre, aucune de ces techniques ont encore été appliqué à la forme de CNS entier, ou dans des modèles plus grands rongeurs comme les rats et les cobayes.
La présente étude vise à pallier ces lacunes en proposant de nouvelles méthodes, psPACT (Pacte de processus-Remscheid) et mPACT (mis à jour le Pacte), pour faciliter le dégagement rapide de la CNS entier et des organes internes à la souris et le rat modèles10. Plus précisément, psPACT traite les tissus à 4 % d’acrylamide et 0,25 % VA-044 en deux étapes distinctes au cours de la formation de l’hydrogel ; mPACT essentiellement basée sur les mêmes étapes, mais complète la solution de compensation basée sur SDS avec 0,5 % α-thioglycérol comme un réactif de clés. Les deux techniques d’exploiter les systèmes circulatoires systémiques et céphalo-rachidien endogènes pour réduire considérablement le temps nécessaire pour produire la clairance optique. Comme une preuve de principe, nous montrent l’utilisation de la microscopie confocale à analyser les tendances des vaisseaux sanguins dans les tissus dégagé10.
Protocole
Toutes les méthodes qui ont été approuvés par le Comité d’éthique de recherche appropriées à la faculté de médecine de l’Université de Yonsei. Tous les animaux sont sacrifiés selon les orientations de la Comité de protection des animaux de laboratoire à la faculté de médecine de l’Université de Yonsei.
1. préparation des réactifs
ATTENTION : Paraformaldéhyde (PFA), acrylamide et sodium dodecyl sulfate (SDS) sont irritants toxiques et doivent donc être manipulés sous une hotte avec les équipements de protection individuelle appropriés (PPE, blouse, gants, lunettes de protection).
- solution à 4 % d’acrylamide (A.A) (A4P0) : ajouter 20 mL de solution de 40 % d’acrylamide à 180 mL de 0,1 M de tampon phosphate salin (PBS).
- 0,25 % VA-044 solution : ajouter 0,5 g de 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] dihydrochloride (VA-044) poudre à 200 mL de 0,1 M de tampon phosphate salin (PBS). Tandis que la poudre VA-044 peut être conservée à température ambiante, il doit être stocké à 4 ° C après solubilisation dans du PBS. Pour de meilleurs résultats, préparer uniquement la quantité de solution requise pour l’expérience.
- Solution cocktail Pacte : ajouter 10 g de l’acrylamide à 225 mL de solution de paraformaldéhyde (PFA) de 4 % et régler le volume à 200 mL avec 4 % PFA. Avant utilisation, ajouter 100 mg de poudre de VA-044 à 40 mL du mélange dans un tube conique de 50 mL.
- Pacte de solution tampon de compensation : ajouter 40 g de dodécylsulfate de sodium (SDS) à 350 mL de PBS de 0,1 M et régler le volume de 500 mL avec du PBS de 0,1 M. Pour mPACT clearing solution, ajouter 0,5 % α-thioglycérol au Pacte de solution tampon de compensation.
- Les souris utilisées dans cette étude étaient des souris mâles BALB 2 semaines ; les rats utilisés dans cette étude étaient SD-rats mâles âgés de 2 semaines.
2. anesthésie et la chirurgie de Perfusion
ATTENTION : PFA et acrylamide sont irritants toxiques et donc doivent être manipulés sous une hotte avec épi approprié.
- Anesthésier l’animal dans une pièce exempts de micro-organismes pathogènes avec 30 mg/kg de zoletil à l’aide d’une seringue de 1 mL avec une aiguille de calibre 26. Surveiller l’animal pendant 5-10 min.
- Une fois que l’animal ait atteint un plan chirurgical de l’anesthésie, utilisez la méthode de réponse orteil-pincée pour déterminer la profondeur de l’anesthésie. Confirmer l’absence de réaction.
Remarque : Les étapes suivantes impliquant la souris et le rat chirurgie suivent un protocole similaire utilisé dans une précédente étude11. - Faire une incision de 5 à 6 cm sous la cage thoracique, à travers le tégument et la paroi abdominale.
- Utiliser des ciseaux courbés, émoussé à pratiquer une incision dans la membrane, palpant la région thoracique pour localiser le site d’incision au préalable.
- Prolonger l’incision sur toute la longueur de la cage thoracique pour exposer la cavité pleurale.
- Soigneusement supplanter les poumons. Faire une coupe à travers la cage thoracique jusqu'à la clavicule. À l’aide de ciseaux iris, faire une petite incision à l’extrémité postérieure du ventricule gauche. Insérer une aiguille de calibre 18-pointe arrondie ou d’olive perfusion dans l’aorte ascendante, passant par le ventricule coupé.
- Fixer l’aiguille et éviter les fuites en pinçant le coeur avec une pince hémostatique. Alternativement, utiliser une pince hémostatique modifiée afin de serrer l’aorte autour de la pointe de l’aiguille.
- Faire une grande incision dans l’oreillette droite, en veillant à assurer un minimum de dommages à l’aorte. Le rat est maintenant prêt pour perfusion.
3. toute Perfusion et la Dissection du Rat
ATTENTION : PFA et acrylamide sont irritants toxiques et donc doivent être manipulés sous une hotte avec épi approprié.
Remarque : Les étapes suivantes de toute perfusion sont un semblable à un protocole utilisé dans une étude antérieure par Woo et al. (2016) 10 , 11.
- Fixer l’oreillette droite du coeur à une aiguille de calibre 18, en prenant soin de n’introduit ne pas de bulles d’air.
- Rapidement et uniformément à l’aide d’une seringue de 50 mL, pompe de 50 mL de solution de PBS 0,1 M froide contenant de l’héparine (10 unités/mL).
- Connectez l’aiguille de calibre 18 au tube de la pompe péristaltique.
- Lavez avec 200 mL de solution de PBS 0,1 M froide contenant de l’héparine (10 unités/mL) à une vitesse de circulation de 10 mL/min.
- Difficulté avec 250 mL de solution PFA froide 4 % à une vitesse de circulation de 10 mL/min. Le rat doit être raide à ce stade.
- Collecter et stocker la solution restante de la PFA à l’élimination.
- Du Pacte, pour perfuse les tissus avec une solution de cocktail de Pacte réfrigérée 4 % PFA, 4 % d’acrylamide, et 0,25 % VA-044 poudre avec une aiguille de calibre 18 et retirez la tête et la colonne vertébrale. Exposer le crâne en faisant une incision médiane du cou au nez. Cette étape de perfusion supplémentaire n’est pas nécessaire pour les méthodes psPACT et mPACT ; après fixation, immédiatement isoler la tête et la colonne vertébrale et exposer le crâne.
- Exposer la base du crâne en enlevant toute cou résiduel et les muscles de la colonne vertébrale.
- Utiliser des pinces-gouges et ciseaux à se pour décoller du crâne. Retirer le cerveau et la moelle épinière.
- Stocker les tissus chez 4 % PFA à 4 ° C ; les tissus peuvent être stockés pendant 1 semaine.
4. Hydrogel monomère Infusion et la polymérisation du SNC Rat et souris
ATTENTION : Acrylamide, SDS, α-thioglycérol et PFA sont irritants et donc doivent être manipulés sous une hotte et avec PEE approprié.
-
Pacte (Passive Technique de compensation)
- Isoler et de la culture de la CNS entier (cerveau et moelle épinière) de rats et de souris fixes dans un tube de 50 mL contenant une solution de cocktail de Pacte réfrigérée de 4 % PFA, 4 % d’acrylamide et 0,25 % de poudre de VA-044 et conserver à 4 ° C pendant 24 h. veiller à ce que le tissu est complètement immergé dans le s olution.
- Incorporer l’échantillon en azote gazeux pour 10 min à l’aide d’un tissu gel système d’hybridation raccordé à un réservoir d’azote : définir le système à 37 ° C. Transfert de tissus dans un tube de 50 mL contenant frais froid (4 ° C) Pacte solution cocktail et se connecter avec le capuchon du tube, puis allumez l’aspirateur.
- Pour polymériser l’hydrogel, placer le tube contenant l’échantillon dans un incubateur à agitation (150 tr/mn, 37 ° C) pendant 3 h, ou jusqu'à ce que la polymérisation est terminée.
- À l’aide de papier buvard (voir la Table des matières), retirez l’hydrogel polymérisée reste les tissus environnants.
- Transférer le tissu dans un tube de 50 mL contenant une solution de compensation (8 % SDS dans du PBS de 0,1 M, pH 8,0).
- Placer l’échantillon dans un incubateur à agitation mis à 37 ° C et 150 tr/min, jusqu'à ce que le tissu a été effacé. En moyenne, il faut environ 20 jours pour la souris CNS pour atteindre la pleine clarté.
-
psPACT (Technique de compensation Passive distincts de processus)
- Isoler le CNS entier (cerveau et moelle épinière) avec coupe-OS et ciseaux de PFA-correction des souris et des rats sur un banc propre.
- Transfert de tissus dans un tube de 50 mL contenant 4 % PFA et conserver à 4 ° C pendant 24 h. s’assurer que le tissu est complètement immergé dans le fixateur.
- Laver le tissu fixe pendant 1 h dans du PBS de 0,1 M et puis les transférer vers la solution A4P0 (4 % d’acrylamide dans du PBS de 0,1 M). Magasin à 37 ° C pendant 24 h.
- Laver le tissu pendant 5 min dans du PBS de 0,1 M.
- Plongez le tissu dans 0,25 % VA-044 dans du PBS de 0,1 M. Stocker à 37 ° C pendant 6 à 24 heures et puis les transférer vers la nouvelle solution VA-044/PBS de 0,25 %.
- Incorporer l’échantillon en azote gazeux pour 10 min à l’aide d’un tissu gel hybridation système (voir la Table des matières) raccordé à un réservoir d’azote : transférer des tissus dans un tube de 50 mL contenant frais froid (4 ° C) solution de 0,25 % de VA-044/PBS et se connecter avec le capuchon du tube. Allumez l’aspirateur.
- Transférer le tissu à clearing solution (8 % SDS dans du PBS de 0,1 M, pH 8,0).
- Incuber l’échantillon dans un incubateur à agitation mis à 37 ° C et 150 tr/min, jusqu'à ce que le tissu a été effacé. En moyenne, il faut environ 17 jours pour souris CNS pour atteindre la pleine clarté.
-
mPACT (mis à jour le passif Clearing Technique)
- Isoler le CNS entier (cerveau et moelle épinière) avec coupe-OS et ciseaux de PFA-correction des souris et des rats sur un banc propre.
- Suivez les étapes 4.2.2 - 4.2.8 du protocole psPACT.
- Transférer le tissu à la solution de compensation. Notez que, contrairement à des protocoles de Pacte et psPACT, mPACT nécessite une solution de compensation composée de 0,5 % α-thioglycérol en plus de 8 % SDS dans du PBS de 0,1 M, pH 8,0. Α-thioglycérol est un agent non-brunissage qui aide à effacer les tissus plus rapidement et efficacement. S’assurer que le tissu est complètement immergé dans la solution.
- Placer l’échantillon dans un incubateur à agitation mis à 37 ° C et 150 tr/min, jusqu'à ce que le tissu a été effacé. En moyenne, il faut environ 2 semaines pour souris CNS pour atteindre la pleine clarté.
5. indice de réfraction correspondant et Immunostaining des CNS défrichée
Remarque : njantes (axée sur les Nycodenz de la Solution indice de réfraction correspondant) se compose de 0,8 g/mL Nycodenz poudre dissous dans 30 mL de tampon base (0,01 % d’azide de sodium et Tween-20 dans du PBS de 0,1 M, pH 8,0). Il est recommandé que la solution est placée dans un 37 ° C, secouant incubateur permettant de solvatation correcte de la poudre.
- Incuber les tissus dans 0,1 % Triton X-100 dans du PBS de 0,1 M pendant 2 h, puis se bloquent avec 2 % sérum d’albumine bovine (BSA) dans du PBS de 0,1 M pendant 6 h.
- Laver les sections trois fois dans le PBST (0,1 % Tween-20 dans du PBS de 0,1 M) pendant 2 h. tache sections avec des anticorps primaires (dans ce cas, un anticorps anti-lapin PECAM-CD31, dont les vaisseaux sanguins des taches) durant 2 jours.
- Tacher les sections avec des anticorps secondaires (dans ce cas, un chèvre anti-lapin IgG Cy3 fluorescent conjugué) à 2 % de BSA durant 2 jours.
- Laver les étiquettes tissus trois fois dans du PBST pendant 2 h et magasin dans 15 mL njantes pendant 2 à 10 jours.
- Pour imagerie, changer tissus marqués d’une petite quantité de jantes nsur la vaisselle de vitroplants de 35 – ou 60 mm. Fixer avec du silicone autour du bord inférieur du plat.
- Ajouter 1,5 à 2 mL de frais njantes.
6. traitement de l’image
- Acquisition d’images de tissus défrichées avec tuile de numérisation à l’aide d’un grossissement de 10 x microscopewith confocale à balayage laser (voir Table des matières). Pour du tissu Cy3 marquée, utilisez longueurs d’onde de 550-600 nm.
Résultats
Génération d’un modèle transparent de la CNS tout en utilisant des techniques de compensation passive optimisée
Optique apurement des souris et le rat des tissus de CNS entiers a été réalisée rapidement en utilisant diverses techniques de compensation passive (Figure 1). Un schéma du tissu de compensation au fil du temps est illustré dans la Figure 2 a. Contrairement à la méthode originale de Pacte, psPACT (Pacte de processus-Remscheid) sert au traitement des échantillons avec 4 % d’acrylamide (A4P0) et de 0,25 % VA-044 initiateur solution en deux étapes distinctes afin de former l’hydrogel hybride. mPACT (mis à jour le Pacte) améliore encore psPACT en complétant le SDS 8 % clearing solution avec 0,5 % α-thioglycérol. Échantillons traités via PACT, psPACT et mPACT à J14 sont comparés et présentés dans la Figure 2 b.
Dans une étude précédente, nous avons rapporté que tandis que le protocole original du Pacte atteint optique dégagement en 23 jours, psPACT et mPACT effacé l’ensemble souris CNS dans seulement 20 et 14 jours, respectivement10. Dans la présente étude, lorsque nous avons traité des échantillons de cerveau de souris via le protocole mPACT, nous avons constaté qu’ils obtenu transparence optique après 14 jours (Figure 2 b). Échantillons de CNS entier de rat traitées via psPACT et mPACT ont également montré que mPACT atteint dégagement maximal avec la plus grande efficacité, car les tissus ont été déminés en 30 et 20 jours, respectivement (Figure 3 a, B). Cerveau de rat adulte seul, par opposition à la CNS ensemble, ont été dégagées avec le mPACT dans un simple 5 jours (Figure 4 a). Modèles de vaisseau sanguin de cerveau de rat déboisées ont été analysés par immunofluorescence après psPACT et traitement mPACT démontrer l’utilité de ces procédures de compensation pour l’analyse anatomique et fonctionnelle du cerveau (Figure 4 bdonnées mPACT montré dans Woo et al 2016)10.
L’utilisation de ces optimisé passif tissu protocoles de compensation, nous étions en mesure de visualiser les modèles intacts et transparents du CNS entier, bien que les temps de compensation différaient entre les trois protocoles. Passif optimisé, méthodes de compensation atteint clarté orgue dans un court laps de temps. Pris ensemble, ces résultats suggèrent que le mPACT méthode de compensation peut générer des CNS clairement plus stable et plus rapide que la précédente passive méthodes de compensation. Ainsi, mPACT un grand potentiel pour l’utilisation des analyses à l’avenir structurels et anatomiques des organes chez les mammifères et apporte des avantages importants par rapport aux méthodes existantes en termes d’efficacité et d’innocuité.
Génération de viscères optiquement défrichées et embryons utilisant mPACT
En plus de tissus entiers de CNS, le rat adulte rate et les reins ont été dégagées avec le mPACT dans 19 et 23 jours, respectivement (Figure 5 aB). Des embryons de souris à E10.5 et E13.5 ont aussi été éclaircies après 3 jours de traitement via le protocole mPACT. Figure 5 -E illustre la visualisation de modèles de vaisseaux sanguins dans l’embryon entier, ainsi que la microcirculation de la région de la queue de l’embryon de souris, rat cauda équine et la rate de rat. Ces résultats suggèrent que mPACT peut être utilisé pour produire des modèles d’une grande variété de tissus et d’organes pour des analyses anatomiques 3D transparents.
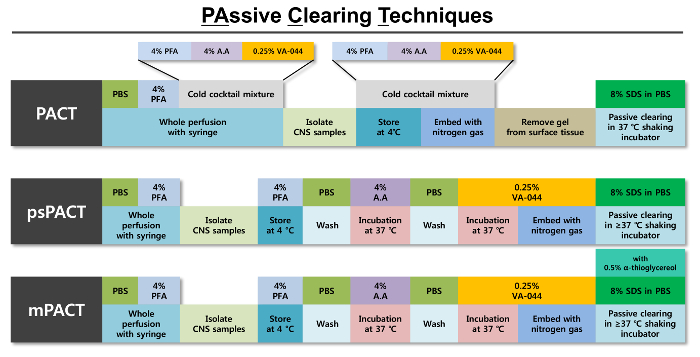
Figure 1 : représentation schématique des techniques de compensation passive optimisée (PACT). Un aperçu des différentes étapes impliquées dans chacun des trois protocoles Pacte est fourni à côté les réactifs nécessaires à chaque étape. Le protocole original du Pacte est la polymérisation de tissu de formation hydrogel avec un mélange de froid de 4 % PFA, Acrylamide (A.A) solution à 4 % et 0,25 % solution de VA-044 initiateur. Après que le tissu est polymérisé à l’aide d’azote gazeux, il est effacé passivement avec SDS 8 % solution de compensation. Le psPACT (Pacte de processus-Remscheid) utilise des procédés de traitement séparé de solution A.A 4 % et 0,25 % VA-044 initiateur pour la formation d’hydrogel du tissu ; ces conditions diffèrent de celles du protocole original de Pacte. Le mPACT (mis à jour le Pacte) supplémentaire ajoute 0,5 % α-thioglycérol à la SDD 8 % clearing solution du protocole psPACT. Pour les trois protocoles, les tissus intacts sont incubés à > = 37 ° C dans un incubateur à agitation jusqu'à iss dégagement maximal atteint. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
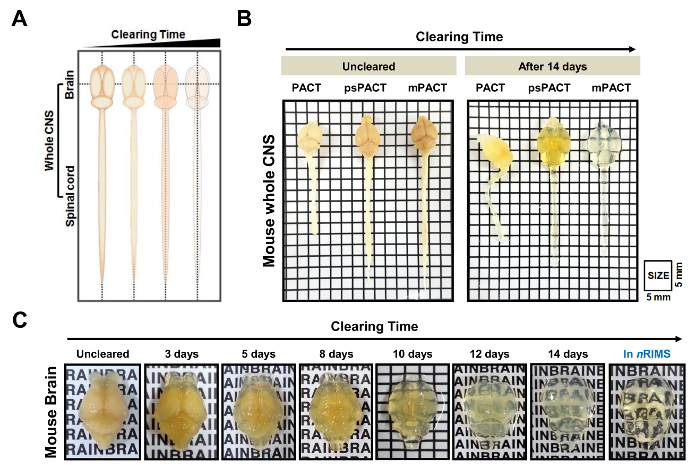
Figure 2 : transparence optique de souris ensemble système nerveux central (SNC) par compensation passive tissu. (A) schématisation du tissu de CNS toute compensation par l’intermédiaire de méthodes axées sur le pacte avec le temps. (B) la comparaison des trois protocoles compensation passive (Pacte de l’original, psPACT, mPACT) dans souris entière SNC à 14 jours après le traitement. (C) autorisation d’optique du cerveau de souris soumises à mPACT sur 14 jours de traitement. Ce chiffre a été modifié par Woo et coll. 201610. Les lettres de 2C sont de 3 mm de hauteur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
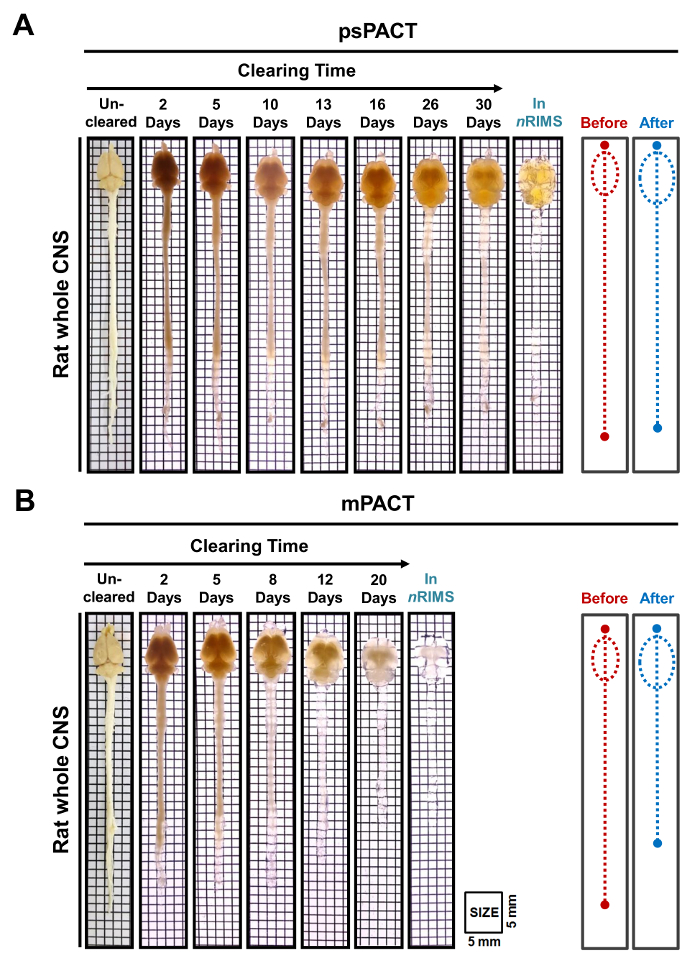
Figure 3 : transparence optique de rat ensemble CNS tissus post-psPACT et mPACT. (A) tissus de CNS entiers de rat adulte atteint une clairance optique maximale avec psPACT après 30 jours. (B) tout tissu de CNS rat adulte atteint une clairance optique maximale avec mPACT après 20 jours. L’avant et après les diagrammes indiquent la taille de la CNS ensemble avant et après traitement, telle que mesurée par le œil. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : mPACT visualisation traitement et capillaires du cerveau du rat adulte sectionnés. (A) Comparaison de cerveau de rat adulte épaisseur 4 mm Articles suit mPACT à 3 et 5 jours de traitement. (B) la projection 3D des modèles de vaisseaux sanguins dans le cerveau de rat adulte visualisés avec anticorps anti-CD31 après traitement de psPACT. Barreaux de l’échelle, 1 500 µm et 100 µm. Ce chiffre a été modifié par Woo et coll. 201610. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
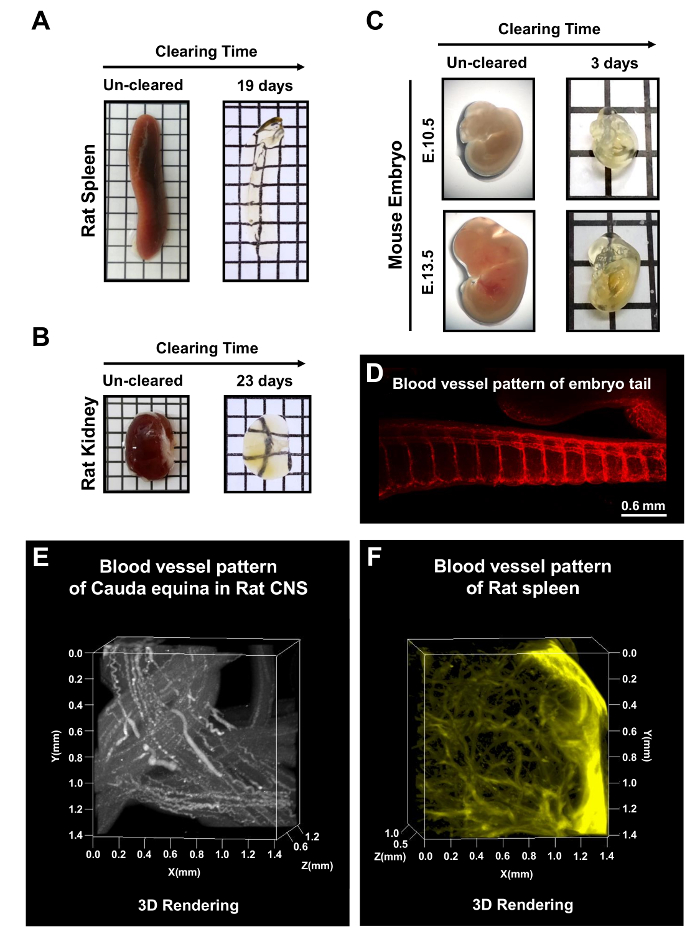
Figure 5 : traitement mPACT des organes rongeurs et des embryons de souris tout. mPACT atteint transparence optique dans la rat adulte (A) rate et les reins (B) en 19 et 23 jours, respectivement. MPACT (C) produite des embryons de souris E10.5 et de E13.5 transparents après 3 jours. (D) la visualisation après compensation avec mPACT de microcirculation avec anti-CD31 dans la région de la queue de l’embryon de souris. (E) la projection 3D du système vasculaire rat cauda équine et la rate de rat (F) avec anti-CD31, après transformation par l’intermédiaire de mPACT. Ce chiffre a été modifié par Woo et coll. 201610. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Alors que les méthodes d’extraction passive, non-électrophorétique employées dans Pacte amélioré de manière significative la consistance obtenue avec tissu précédent compensation des méthodes telles que clarté2,3,4,7 , 8, la technique porte encore plusieurs lacunes, les plus pressants dont sont la longueur du temps nécessaire pour atteindre les tissus maximale clarté12. Dans la présente étude, nous présentons des protocoles mis à jour le Pacte qui réduisent considérablement le temps requis pour le tissu de compensation tout en préservant les tissus l’intégrité et la structure de6,10. En outre, pour la première fois, nous démontrons l’application des protocoles en tissus entiers de CNS et dans un modèle d’ordre supérieur rongeur, le rat10de compensation des tissus.
Plus précisément, psPACT implique traitement des échantillons à 4 % d’acrylamide et 0,25 % VA-044 en deux étapes distinctes au cours de la formation de l’hydrogel, tandis que mPACT davantage s’appuie sur psPACT et complète le SDS 8 % clearing solution avec 0,5 % α-thioglycérol10. Séparant l’acrylamide et pas de VA-044 successif évite la nécessité d’enlever le restant des monomères non polymérisés hydrogel qui entourent le tissu, ce qui peut compromettre l’intégrité des tissus final après la réalisation de transparence avec le Pacte ; en outre, cela réduit considérablement le temps nécessaire pour produire une clairance optique maximale. L’ajout de le α-thioglycérol dans la méthode mPACT outre accélère la clairière au processus13, tel que α-thioglycérol est un agent non-brunissage qui aide à effacer les régions des tissus qui sont moins accessibles en utilisant uniquement les réactifs dans la méthode originale de Pacte 7 , 8 , 9.
Une comparaison du Pacte, psPACT et mPACT sur tissus de rongeurs ont démontré que tandis que psPACT améliore la transparence optique par rapport à l’original du Protocole Pacte, mPACT permet plus efficacement pour la compensation et l’imagerie haute résolution subséquente de deux ensemble organes de mammifères et tranches sectionnés, comme l’a démontré à la Figure 2, Figure 3, Figure 4. L’effondrement du pont de base α-thioglycérol lipides des organes transformés dans la clé de méthode s’est avérée mPACT des différences dans la transparence et l’efficacité des tissus stabilité en comparaison avec les autres méthodes de deux compensation. Ceci permettait à l’analyse 3D rapide des organes transformés, notamment en ce qui concerne la morphologie de vascularisation sanguine, par immunofluorescence et microscopie confocale (Figure 5E).
Alors que l’ajout de le α-thioglycérol à la solution de compensation basée sur SDS est essentiel pour accélérer la transparence optique, elle aussi légèrement augmente la fragilité tissulaire et rend plus sensibles aux dégâts de post-traitement. La supériorité claire de mPACT en ce qui concerne son efficacité l’emporte sur cette limitation ; Néanmoins, travail se fait actuellement pour s’assurer que la compensation maximale peut être réalisée avec peu ou pas de frais de l’intégrité des tissus.
Ainsi, nos résultats établissent mPACT comme un puissant outil d’investigation pour fournir une analyse 3D des caractéristiques anatomiques et fonctionnelles des organes chez les mammifères, y compris mais non limité aux réseaux neurones, vaisseaux sanguins et tissulaires matrice architecture. Aller de l’avant, nous croyons mPACT pourrait être particulièrement utile à l’enquête sur l’ordre supérieur des mécanismes biologiques qui contribuent à la physiopathologie de la maladie, tels que les lésions tissulaires, des malformations du développement, le cancer et neurodégénératives maladie14,15,16,17. Combiné avec une étude des plus fine des mécanismes cellulaires impliqués dans la maladie, mPACT a le potentiel pour fournir une plus complète, multi-échelle comprendre des maladies disparates comment divers mécanismes interagissent pour donner naissance au phénotype observé.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le projet cerveau Corée 21 avec pour la Science médicale, Université de Yonsei. En outre, ce travail a été soutenu par une subvention de la Fondation nationale de recherche de Corée (FRO-2017R1D1A1B03030315).
matériels
| Name | Company | Catalog Number | Comments |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix, Inc. | 75819 | Clearing solution |
| Nycodenz | Axia-Shield | 1002424 | nRIMS solution |
| 40% Acrylamide Solution | Bio Rad Laboratories, Inc. | 161-0140 | Polymerization (A4P0) |
| 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] Dihydrochloride | Wako Pure Chemical Industries, Ltd. | 017-19362 | Polymerization (VA-044) |
| 1-Thioglycerol | Sigma-Aldrich | M1753-100ML | Clearing solution (mPACT) |
| Tween-20 | Georgiachem | 9005-64-5 | nRIMS solution |
| Triton X-100 | Sigma-Aldrich | T8787-50ML | Immuno Staining |
| Bovine serum albumin (BSA) | Bovogen | BSA100 | Immuno Staining |
| Heparin | Merck Millipore | 375095 | Perfusion (PBS) |
| Sodium azide | Sigma-Aldrich | S2002-25G | nRIMS solution |
| PECAM-CD31 antibody | Santa Cruz Biotechnology Inc. | sc-28188 | Immuno Staining |
| Goat anti-rabbit-IgG Cy3 fluorescent conjugate | Jackson ImmunoResearch Inc. | 111-165-003 | Immuno Staining |
| 4% Paraformaldehyde | Tech & Innovation | BPP-9004 | Perfusion, Polymerization |
| 20X Phosphate Buffered Saline (pH 7.4) | Tech & Innovation | BPB-9121 | Perfusion, Buffer |
| 10 mL stripette | Coatar | 4488 | Solution transfer |
| 50 mL tube | Falcon | 352070 | Clearing tube |
| 35 mm Cell culture dish | SPL | 20035 | Imaging |
| Confocal dish | SPL | 211350 | Imaging |
| 1 mL syringe | Korea vaccine Co., Ltd | 26G 1/2 | Anesthetize |
| 50 mL syringe | Korea vaccine Co., Ltd | 21G1 1/4 | Perfusion |
| Acrylamide | Sigma-Aldrich | A3553 | Polymerization (A4P0) |
| Whatman 3MM paper | Sigma-Aldrich | Z270849 | Blotting paper for gel removal |
| Confocal microscope | Zeiss | LSM780 | Imaging |
| ZEN lite Software | Zeiss | ZEN 2012 | Imaging |
| Peristaltic pump | Longerpump | BT100-1F | Perfusion |
| EasyGel | Lifecanvas Technologies | EasyGel | Tissue gel hybridization system |
Références
- Zhu, X., Xia, Y., Wang, X., Si, K., Gong, W. Optical brain imaging: A powerful tool for neuroscience. Neurosci Bull. 33 (1), 95-102 (2017).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9 (7), 1682-1697 (2014).
- Feng, Y., et al. CLARITY reveals dynamics of ovarian follicular architecture and vasculature in three-dimensions. Sci Rep. 7, 44810(2017).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Dev Biol. 14, 48(2014).
- Jensen, K. H. R., Berg, R. W. Advances and perspectives in tissue clearing using CLARITY. J Chem Neuroanat. 86, 19-34 (2017).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nat Protoc. 10 (11), 1860-1896 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331(2016).
- Woo, J., Lee, M., Seo, J. M., Park, H. S., Cho, Y. E. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Exp Mol Med. 48 (12), 274(2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Roberts, D. G., Johnsonbaugh, H. B., Spence, R. D., MacKenzie-Graham, A. Optical clearing of the mouse central nervous system using passive CLARITY. J Vis Exp. (112), (2016).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: A simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16 (8), 1154-1161 (2013).
- Choi, B. R., et al. Increased expression of the receptor for advanced glycation end products in neurons and astrocytes in a triple transgenic mouse model of Alzheimer's disease. Exp Mol Med. 46, 75(2014).
- Chang, D. J., et al. Contralaterally transplanted human embryonic stem cell-derived neural precursor cells (ENStem-A) migrate and improve brain functions in stroke-damaged rats. Exp Mol Med. 45, 53(2013).
- Kim, T. K., et al. Analysis of differential plaque depositions in the brains of Tg2576 and Tg-APPswe/PS1dE9 transgenic mouse models of Alzheimer disease. Exp Mol Med. 44 (8), 492-502 (2012).
- Kinameri, E., et al. Prdm proto-oncogene transcription factor family expression and interaction with the Notch-Hes pathway in mouse neurogenesis. PLoS One. 3 (12), e3859(2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon