Method Article
소설 수동 전체 CNS 조직에 광학 투명도의 급속 한 생산을 위한 방법 삭제
요약
여기, 선물이 두 소설 방법론, psPACT 및 최대 광학 투명성과 조직 맥 관 구조에 그대로 설치류의 후속 현미경 분석을 달성 하기 위한 mPACT 전체 CNS.
초록
선명도의 개발 이후 기술 삭제 bioelectrochemical 수 있는 3 차원 표현 형 매핑 투명 한 조직 내의 다양 한 큐빅 (명확 하 고 가리지 뇌 이미징 등 새로운 개간 방법론에 대 한 칵테일 및 전산 분석), 스위치 (상호 작용 시간의 시스템 제어) 및 화학 제품의 활동, 지도 (확대는 프로테옴의 분석), 및 협정 (수동 선명도 기술)에 대 한 기존의 툴킷 확대 설립 되었습니다 생물학 직물의 현미경 분석입니다. 현재 향상 하 고 전체 중앙 신경 시스템 (CNS), 신장, 비장, 그리고 전체 마우스 배아를 포함 하 여 그대로 설치류 조직의 배열에 대 한 원래 협정 절차를 최적화 하는 것을 목표로 공부 합니다. PsPACT (프로세스 별도 협정) 및 mPACT (수정 된 협정) 되 나, 이러한 소설 기법 셀 회로 고 그대로 정상 및 병 적인 조직에서 subcellular 구조 시각화의 높은 효능 수단을 제공 합니다. 다음 프로토콜에서 우리는 psPACT 및 mPACT 통해 그들의 구조적 무결성의 최소한의 침공으로 최대한 조직 허가 달성 하는 방법에 세부, 단계별 개요를 제공 합니다.
서문
과학 및 임상 조회의 근본적인 목적은 관련 기관의 구조와 기능;의 완벽 한 이해를 달성 그러나, 포유류 장기의 상당히 복잡 한 자연 완전히이 목표1을 달성 하는 방 벽으로 수시로 제공 합니다. 명확성 (명확한 지질 교환 아크릴 때 교배 엄밀한 이미징 호환 Tisssue-하이드로 겔)2,3,4, 건물 그대로 조직에서 히드로 아크릴 기반 하이브리드 포함, 달성 다양 한 기관, 뇌, 간, 그리고 비장를 포함 하 여5그들의 구조적 무결성 유지 하면서 광학 정리. 선명도 시각화 뿐만 아니라 복잡 한 셀룰러 네트워크 및 단면 필요 없이 조직 형태학을 정밀 하 게 해 부를 기회에 따라서 사용할 수 있습니다.
조직 허가 달성 하기 위해 선명도 샘플의 지질 콘텐츠 제거 하 전기 이동 방법을 사용 합니다. 물리적으로 안정적인 조직-히드로 하이브리드 생산에 대 한 선명도 지적 하는 동안 연구 전기 이동 조직 개간 (등) 방법의 사용 조직 품질, 브라우닝, epitope 손상을 포함 한 변수 결과 산출 하 고 단백질 손실5,6. 이러한 문제를 해결 하려면 수동, 이온-세제 기반된 delipidation 기술 등 치료를 대체 하는 협정 (수동 선명도 기술) 등 수정된 프로토콜 개발된7,,89되었습니다. 그러나 결과에 더 일관성을 달성에 불구 하 고, 협정 최대한 정리를 얻기 위해 더 많은 시간이 필요 합니다. 또한, 이러한 기술의 아무도 아직 적용 되었을 전체 CNS 양식 또는 쥐 및 기니 피그와 같은 큰 설치류 모델.
현재 연구는 psPACT (프로세스 별도 협정) 및 mPACT (수정 된 협정), 전체 CNS와 마우스와 쥐 모델10에 내부 장기의 빠른 통관을 촉진을 위한 새로운 방법론을 제안 하 여 이러한 한계를 해결 하고자 합니다. 특히, psPACT 처리 조직 4% 아크릴에 0.25% 하이드로 겔 형성; 하는 동안 두 개의 별도 단계에서 버지니아-044 mPACT는 기본적으로 동일한 단계를 수행 하지만 키 시 약으로 서 0.5% α-thioglycerol와 개간 SDS 기반 솔루션을 보완. 두 기술을 마구 크게 광학 클리어런스를 생산 하는 데 필요한 시간을 줄이기 위해 내 생 적인 조직 및 cerebrospinal 순환 시스템. 원리의 증거로, 허가 조직10혈관 패턴 분석에 confocal 현미경 검사 법의 사용을 설명 합니다.
프로토콜
모든 절차는 연 세 대학 의과대학에서 적절 한 연구 윤리 위원회에 의해 승인 되었습니다. 연 세 대학 대학의과 대학에 실험실 동물 관리 위원회의 지침에 따라 모든 실험 동물을 희생 한다.
1입니다. 시 약의 준비
주의: Paraformaldehyde (PFA), 아크릴 및 나트륨 라우릴 황산 염 (SDS) 독성 irritants 이며 따라서 적절 한 개인 보호 장비 (PPE; 실험실 외 투, 장갑, 보호 안경)와 증기 두건에서 처리 되어야 합니다.
- 4% 아크릴 (금주 모임) 솔루션 (A4P0): 0.1 M 인산 염 버퍼 식 염 수 (PBS)의 180 ml 40% 아크릴 솔루션의 20 mL를 추가.
- 0.25% 버지니아-044 솔루션: 2,2´-Azobis[2-(2-imidazolin-2-yl)propane의 0.5 g 추가] dihydrochloride (VA-044) 파우더 200 mL의 0.1 M 인산 염 버퍼 식 염 수 (PBS)를. 버지니아-044 분말은 실내 온도에 저장 될 수, 그러나 PBS에 가용 화 시 4 ° C에 저장 되어야 합니다. 최상의 결과 얻으려면 솔루션 실험에 필요한 만큼만 준비 합니다.
- 협정 칵테일 솔루션: 4 %paraformaldehyde (PFA) 솔루션의 225 mL에 아크릴의 10 g를 추가 하 고 4%와 200 mL에 양을 맞추십시오 PFA. 사용 전에 40 ml 50 mL 원뿔 튜브에 혼합물의 버지니아-044 분말의 100 mg을 추가 합니다.
- 협정 솔루션 버퍼 지우기: 0.1 M PBS의 350 mL에 나트륨 라우릴 황산 염 (SDS)의 40 g을 추가 하 고 0.1 M PBS 가진 500 mL에 양을 맞추십시오. MPACT 삭제 솔루션, 솔루션 버퍼를 삭제 하는 협정에 0.5% α-thioglycerol를 추가 합니다.
- 이 연구에 사용 된 마우스 했다 2 주 된 BALB 남성 쥐; 이 연구에 사용 된 쥐 2 주 오래 된 남성 SD-쥐 했다.
2. 마 취와 관류 수술
주의: PFA와 아크릴 독성 irritants 이며 따라서 적절 한 보호구와 증기 두건에서 처리 되어야 합니다.
- 26-게이지 바늘 1 mL 주사기를 사용 하 여 zoletil의 30 mg/kg으로 병원 체 무료 객실에 동물 anesthetize 5 동물 모니터링-10 분.
- 동물 마 취의 수술 평면에 도달 했습니다, 일단 마 취의 깊이 결정 하는 발가락 핀치 응답 메서드를 사용 합니다. 응답을 확인 합니다.
주: 마우스와 쥐 수술을 포함 하는 다음 단계 이전 연구11에 사용 되는 유사한 프로토콜을 따릅니다. - 5-6 cm 절 개 외피와 복 벽을 통해 흉 곽 아래를 확인 합니다.
- 곡선, 무딘가 위를 사용 하 여 미리 절 개의 사이트를 찾으려고 흉부 지역 palpating 횡 경 막에 절 개를 만들기 위해.
- 절 개 흉 흉 막 캐비티를 폭로 전체 길이 걸쳐 확장.
- 조심 스럽게 폐 치환. 쇄 골까지 흉 곽을 통해 상처를 확인 합니다. 아이리스가 위를 사용 하 여, 좌 심 실의 후부 끝에 작은 절 개를 확인 합니다. 오름차순 대동맥, 컷된 심 통과에 무뚝뚝한 또는 올리브 밀고 관류 18 게이지 바늘을 삽입 합니다.
- 바늘을 장악 하 고는 hemostat로 마음을 클램핑 하 여 누설을 방지. 또는, 수정된 hemostat 사용 하 여 바늘 팁 주위 대동맥을 클램프.
- 오른쪽 아 트리 움, 하강 대동맥에 최소한의 피해를 보장 하기 위해 돌에 큰 절 개를 확인 합니다. 쥐 관류에 대 한 준비가 지금 이다.
3. 전체 관류와 쥐의 해 부
주의: PFA와 아크릴 독성 irritants 이며 따라서 적절 한 보호구와 증기 두건에서 처리 되어야 합니다.
참고: 다음 전체 관류 단계는 비슷합니다 우 외에 의해 이전 연구에서 사용 되는 프로토콜. (2016) 10 , 11.
- 심장의 오른쪽 아 트리 움 어떤 기포를 소개 하지를 돌보는 18 게이지 주사 바늘에 연결 합니다.
- 50 mL 주사기를 사용 하 여, 신속 하 고 균일 하 게 감기 0.1 M PBS 솔루션 포함 하는 헤 파 린 (10 단위/mL)의 50 mL 펌프.
- 연동 펌프 튜브에 18-게이지 바늘을 연결 합니다.
- 10 mL/min의 순환 속도에 헤 파 린 (10 단위/mL)에 포함 된 감기 0.1 M PBS 솔루션의 200 mL와 함께 씻으십시오.
- 10 mL/min의 순환 속도에 찬 4 %PFA 솔루션의 250 mL와 함께 수정. 쥐가이 단계에서 뻣 뻣 한 되어야 합니다.
- 수집 하 고 처리를 위한 나머지 PFA 솔루션을 저장 합니다.
- 협정, 4 %PFA, 4% 아크릴, 및 0.25% 버지니아-044 분말의 냉장 협정 칵테일 솔루션 조직 18 게이지 바늘, perfuse 및 머리와 척추를 제거. 코에는 목에서 정중 선 절 개 하 여 두개골을 노출 합니다. 이 추가 관류 단계 psPACT와 mPACT 방법;에 대 한 필요 하지 않습니다. 고정, 후 즉시 머리와 척추를 분리 하 고 두개골을 노출.
- 어떤 잔여 목과 척추 근육을 제거 하 여 두개골의 기지를 노출 합니다.
- 벗 겨 두개골을 rongeurs와가 위를 사용 합니다. 뇌와 척수를 제거 합니다.
- 4%에서 조직 저장 PFA 4 ° c; 조직 최대 1 주일까지 저장할 수 있습니다.
4. 하이드로 겔 단위체 주입 및 쥐 및 마우스 CNS의 중 합
주의: 아크릴, SDS, α-thioglycerol 및 PFA irritants 있으며 따라서 처리 연기 후드와 적절 한 오 줌.
-
협정 (패시브 기술 삭제)
- 분리 하 고 전체 CNS (뇌와 척수) 고정된 쥐 및 쥐에서 냉장된 협정 칵테일 4 %PFA, 4% 아크릴, 및 0.25% 버지니아-044 분말 및 24 h. 확인 조직 s에 완전히 몰입은 4 ° C에서 스토어의 솔루션을 포함 하는 50 mL 튜브에 문화 olution입니다.
- 10 분 휴지를 사용 하 여 젤 질소 탱크에 연결 된 하이브리드 시스템에 대 한 질소 가스에 샘플을 포함: 37 ° c 시스템 설정 신선한 냉 (4 ° C) 협정을 포함 하는 50 mL 튜브에 조직 전송 칵테일 솔루션 관 모자, 연결한 다음 진공에 설정.
- 유해는 하이드로 겔, 3 h, 또는 중 합 완료 될 때까지 떨고 인큐베이터 (150 rpm, 37 ° C)에서 샘플을 포함 하는 튜브를 배치 합니다.
- 압 지를 사용 하 여 (참조 테이블의 자료), 제거 나머지 polymerized 히드로 조직을 둘러싼.
- 50 mL 튜브 청소 솔루션 (0.1 m M PBS, pH 8.0에서에서 8 %SDS)를 포함 하는 조직 전송.
- 조직 삭제 되었습니다 때까지 37 ℃, 150 rpm으로 설정 떨고 인큐베이터에서 샘플을 놓습니다. 평균적으로, 그것은 전체 선명도 달성 마우스 CNS 약 20 일 걸립니다.
-
psPACT (별도 수동 삭제 기술 처리)
- 뼈 절단기와 PFA-고정 마우스와 깨끗 한 벤치에 쥐가 위 전체 CNS (뇌와 척수)를 격리 합니다.
- 조직 전송 50 mL 튜브 4% 포함 된 PFA, 및 24 h. 4 ° C에서 저장소 확인 조직은 정착 액에 완전히 잠기 다.
- 0.1 m M PBS에서 1 시간에 대 한 고정된 조직을 세척 하 고 A4P0 솔루션 (0.1 m M PBS에 4% 아크릴)을 전송. 24 h에 대 한 37 ° C에서 저장소.
- 0.1 m M PBS에 씻어 5 분에 대 한 조직.
- 0.25%에서 조직 담가 0.1 M PBS에 버지니아-044. 6-24 h, 37 ° C에서 저장 하 고 신선한 0.25% 버지니아-044/PBS 솔루션을 전송.
- 10 분 휴지를 사용 하 여 젤 교 잡에 대 한 질소 가스에 샘플을 포함 질소 탱크에 연결 ( 테이블의 자료를 참조) 시스템: 조직 신선한 감기 (4 ° C)를 포함 하는 50 mL 튜브에 전송 0.25% 버지니아-044/PBS 솔루션, 튜브 캡과 연결. 진공을 켭니다.
- 전송 하는 조직 솔루션 (0.1 m M PBS, pH 8.0에서에서 8 %SDS) 삭제.
- 조직 삭제 되었습니다 때까지 37 ℃, 150 rpm으로 설정 떨고 인큐베이터에서 샘플을 품 어. 평균적으로, 그것은 마우스 전체 선명도 달성 하는 CNS에 대 한 약 17 일 걸립니다.
-
mPACT (수정된 수동 삭제 하는 기법)
- 뼈 절단기와 PFA-고정 마우스와 깨끗 한 벤치에 쥐가 위 전체 CNS (뇌와 척수)를 격리 합니다.
- 단계-4.2.2 4.2.8 psPACT 프로토콜의 수행 합니다.
- 전송 하는 조직 솔루션을 지우기. 협정 및 psPACT 프로토콜 달리 mPACT 0.5% α-thioglycerol 0.1 M PBS, pH 8.0에서에서 8 %SDS 이외에 구성 된 개간 솔루션이 필요한 note. Α-thioglycerol는 더 신속 하 고 효과적으로 조직을 취소 하는 데 도움이 유엔 브라우닝 에이전트. 조직의 솔루션에 완전히 포장 되어 있는지 확인 합니다.
- 조직 삭제 되었습니다 때까지 37 ℃, 150 rpm으로 설정 떨고 인큐베이터에서 샘플을 놓습니다. 평균적으로, 그것은 마우스 전체 선명도 달성 하는 CNS에 대 한 약 2 주 걸립니다.
5. 굴절률 매칭과 허가 CNS의 Immunostaining
참고: n바퀴 (Nycodenz 기반 굴절률 매칭 솔루션) 0.8 g/mL Nycodenz 분말 30 mL 기본 버퍼 (0.01% 나트륨 아 지 드와 0.1 m M PBS, pH 8.0에서에서 트윈-20)에 녹아 있는 이루어져 있다. 솔루션 파우더의 적절 한 solvation 수 있도록 인큐베이터 떨고 37 ° C에 배치 하는 것이 좋습니다.
- 0.1%에서 조직 품 어 2 h, 0.1 m M PBS에 Triton X-100 다음 2% 소 혈 청 알 부 민 (BSA) 0.1 m M h 6에 대 한 PBS에와 차단.
- PBST에 세 번 섹션을 세척 (0.1 %0.1 M PBS에 트윈-20) 2 헤에 대 한 일에 대 한 섹션 주요 항 체 (이 경우, 혈관 얼룩는 반대로 토끼 PECAM CD31 항 체)에 얼룩.
- 2 일에 대 한 2 차 항 체 (이 경우는 염소-토끼 IgG Cy3 형광 공액)에 2 %BSA 섹션을 얼룩.
- 워시 분류 2 h, PBST에 세 번 조직 및 저장소 15 ml에서 n바퀴 2-10 일.
- 이미징, 전에 35 또는 60 m m 조직 문화 접시에 레이블이 조직 n바퀴의 작은 금액을 이동 합니다. 접시의 아래쪽 가장자리 주위 실리콘 수정.
- 신선한 n바퀴의 1.5-2 mL를 추가 합니다.
6. 이미지 처리
- 타일 confocal 레이저 스캐닝 microscopewith 10 배 확대를 사용 하 여 검색 이미지 삭제 조직의 취득 ( 재료의 표참조). 조직 Cy3 표시의 사용 하 여 550-600 nm의 파장.
결과
최적화 된 수동 청소 기술을 사용 하 여 전체 CNS의 투명 한 모델의 생성
마우스와 쥐 전체 CNS 조직의 광 정리 빠른 속도로 다양 한 수동 개간 기법 (그림 1)를 사용 하 여 달성 되었다. 조직 시간이 지남에 비운의 회로도 그림 2A에 표시 됩니다. 원래 협정 메서드와 달리 psPACT (프로세스 별도 협정) 히드로 하이브리드를 형성 하기 위하여 4% 아크릴 아 미드 (A4P0)와 0.25% 버지니아-044 초기자 솔루션 샘플을 두 개의 별도 단계에서 치료 포함 됩니다. mPACT (수정 된 협정) psPACT 8 %SDS 지우기 0.5% α-thioglycerol 솔루션을 보완 하 여 더욱 향상 시켰습니다. 협정, psPACT, 그리고 하루 14 mPACT 통해 처리 샘플 비교 되며 그림 2B에 제시.
이전 연구에서 우리가 보고 그 동안 원래 협정 프로토콜 달성 23 일, psPACT에에서 광 정리 및 mPACT 전체 마우스 CNS 단지 20 및 14 일, 각각10. 현재 연구에서 우리가 mPACT 프로토콜을 통해 마우스 뇌 샘플 처리 우리 발견 그들은 (그림 2B)는 14 일 후 광학 투명도 달성. 쥐 전체 CNS 샘플은 psPACT를 통해 처리 되 고 mPACT 또한 보여주었다 그 mPACT 최고의 효율으로 허가 최대한 달성으로 조직 각각 30, 20 일에 허가 했다 (그림 3A, B). 성인 쥐 두뇌 전체 CNS 반대로 혼자 mPACT로 (그림 4A) 단순한 5 일에 허가 했다. 삭제 된 쥐 두뇌의 혈관 패턴 psPACT 및 (그림 4B, mPACT 데이터 뇌의 해 부와 기능 분석에 대 한 이러한 개간 절차의 유틸리티를 보여 주기 위해 mPACT 처리 후 면역 형광 검사를 통해 분석 되었다 에 우 외. 2016 표시)10.
이들을 사용 하 여 최적화 수동 조직 프로토콜을 삭제, 우리 전체 CNS의 손상, 투명 모델을 시각화 수 있지만 세 가지 프로토콜 중 개간 시간 달랐다. 최적화 된 수동 삭제 방법 짧은 기간에 장기 선명도 달성. 함께 찍은, 이러한 결과 지우기 방법 mPACT 분명 CNS 더 안정적이 고 이전 보다 빠르게 수동 삭제 방법을 생성할 수 있습니다 것이 좋습니다. 따라서, mPACT 포유류 장기의 미래에 구조 및 해 부 분석 사용 하기 위해 큰 잠재력을 보유 하 고 효능과 안전성 면에서 기존 방법에 비해 상당한 이점을 제공 한다.
광학 허가 내부 기관과 mPACT를 사용 하 여 배아의 생성
전체 CNS 조직 뿐만 아니라 성인 쥐 비장 및 신장 맑게 되었다 mPACT로 19과 23 일에 각각 (그림 5AB). E10.5 및 E13.5에서 마우스 배아 했다 또한 mPACT 프로토콜을 통해 처리의 3 일 후 삭제 됩니다. 그림 5C -E 마우스 배아, 쥐 cauda 말 및 쥐 비장 꼬리 지역의 microvasculature로 전체 태아 혈관 패턴의 시각화를 표시합니다. 이러한 결과 mPACT 다양 한 조직 및 3D 해 부 분석에 대 한 장기의 투명 한 모델 생성에 사용할 수 있습니다 것이 좋습니다.
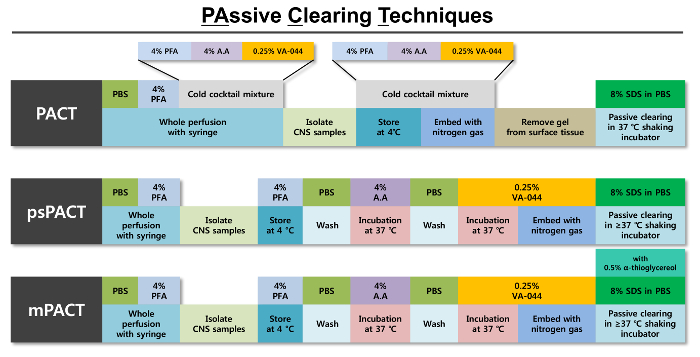
그림 1: 최적화 된 수동 개간 기법 (협정)의 도식 대표. 3 협정 프로토콜의 각 개별 단계에 대 한 개요는 각 단계에 필요한 시 약 함께 제공 됩니다. 원래 협정 프로토콜은 4 %PFA, 4% 아크릴 (금주 모임) 솔루션 및 0.25% 버지니아-044 초기자 솔루션의 차가운 혼합물으로 히드로에서 중 합 조직입니다. 후 조직 질소 가스를 사용 하 여 생산은, 솔루션을 삭제 하는 8 %SDS 수 동적으로 지워집니다. 조직;의 하이드로 겔 형성을 위한 4% 금주 모임 솔루션 및 0.25% 버지니아-044 초기자 솔루션의 별도 처리 프로세스를 사용 하는 psPACT (프로세스 별도 협정) 이러한 조건은 원래 협정 프로토콜의 다. MPACT (수정 된 협정) 추가 8% SDS psPACT 프로토콜의 솔루션을 지우기에 0.5% α-thioglycerol를 추가 합니다. 모든 세 가지 프로토콜에 대 한 그대로 조직에서 incubated은 > 최대한 클리어런스 iss 달성까지 떨고 인큐베이터에서 37 ° C =. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
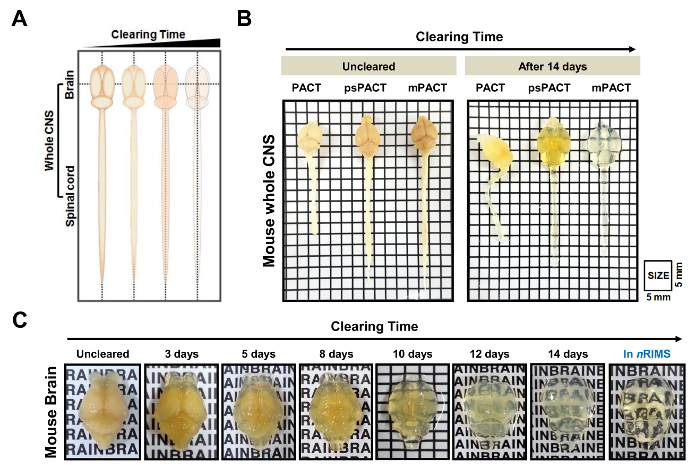
그림 2: 마우스 전체 중앙 신경 시스템 (CNS) 수동 조직 개간 하 여의 광학 투명도. (A) Schematization 전체 CNS 조직의 시간이 지남에 협정 기반 방법을 통해 삭제. 3 수동 개간 프로토콜 (원래 협정, psPACT, mPACT) 마우스 처리 후 14 일에 모든 CNS의 (B) 비교. MPACT 14 일 이상 처리 대상이 마우스 뇌의 (C) 광학 정리. 이 그림은 우 외. 201610에서 수정 되었습니다. 2 c에서 문자가 키가 3 m m입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
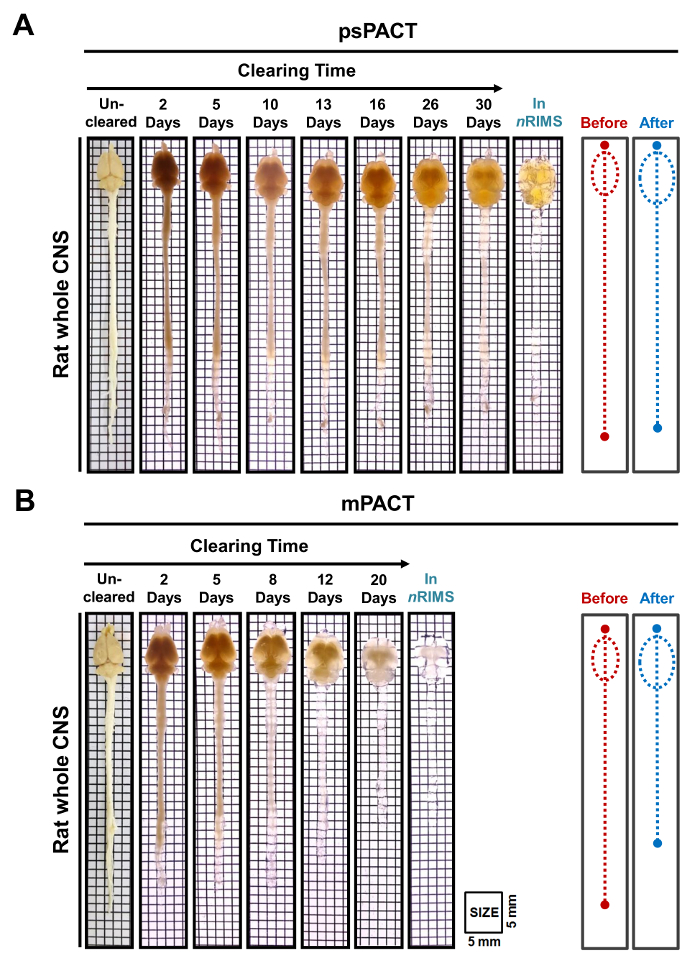
그림 3: 쥐 전체 CNS 조직 게시물-psPACT 및 mPACT 광학 투명도. (A) 성인 쥐 전체 CNS 조직 달성 30 일 후 psPACT와 최대한 광 정리. (B) 성인 쥐 전체 CNS 조직 달성 20 일 후 mPACT로 최대한 광 정리. 다이어그램의 크기를 나타낼 전체 CNS 치료 전후 눈으로 측정 된 전후. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: mPACT 처리 및 microvasculature 시각화 sectioned 성인 쥐 두뇌의. (A) mPACT 3 ~ 5 일에 처리 후 4 m m 두꺼운 성인 쥐 두뇌의 비교 섹션. (B) psPACT 처리 후 안티 CD31 항 체로 시각화 성인 쥐 두뇌에 있는 혈관 패턴 3D 투영 스케일 바, 1500 µ m, 100 µ m. 이 그림은 우 외. 201610에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
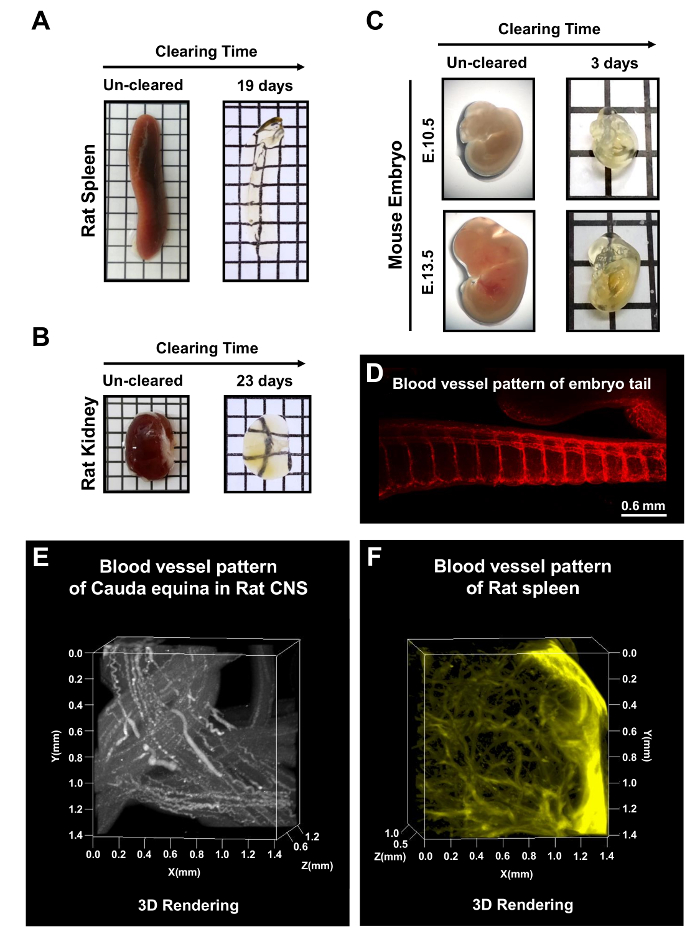
그림 5: 설치류 기관과 전체 마우스 배아 mPACT 처리. mPACT 달성 성인 쥐 (A) 비장 및 (B) 신장에 광학 투명도 19 ~ 23 일, 각각. (C) mPACT는 3 일 후 투명 한 E10.5 및 E13.5 마우스 배아를 생산. MPACT로 개간 후 마우스 배아의 꼬리 영역에서 안티 CD31와 microvasculature의 (D) 시각화. (E) mPACT 통해 처리 후 쥐 cauda 말에 안티-CD31와 (F) 쥐 비장 맥 관 구조의 3D 투영 이 그림은 우 외. 201610에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
수동, 전기 이동 비 추출 방법에 고용 하는 동안 협정 크게 이전 조직 삭제 선명도2,3,,47 같은 방법으로 달성 일관성 향상 , 8, 기술은 여전히 가장 눌러 최대한 조직 선명도12를 달성 하는 데 필요한 시간의 길이 여러 가지 단점을 맺는 다. 현재 연구에서 선물이 조직 조직 무결성 및 구조6,10유지 하면서 지우기에 필요한 시간을 크게 줄일 수정된 협정 프로토콜. 또한, 처음으로 우리 조직의 전체 CNS 조직 및 더 높은 순서 설치류 모델 쥐10프로토콜 삭제 응용 프로그램을 보여 줍니다.
특히, psPACT 4% 아크릴에 0.25% 샘플 처리를 포함 한다 버지니아-044 하이드로 겔 형성 하는 동안 두 개의 별도 단계에서 mPACT 추가 psPACT 시 빌드 동안 0.5% α-thioglycerol10솔루션 삭제 8 %SDS 보충. Unpolymerized 히드로 단위체 협정;와 투명도 달성 한 후 최종 조직의 무결성을 손상 시킬 수 있는 조직을 둘러싸고 있는 나머지를 제거 하기 위한 필요 방지 아크릴 및 후속 버지니아-044 단계 분리 또한, 최대 광학 클리어런스를 생산 하는 데 필요한 시간이 크게 줄어듭니다. Α-thioglycerol mPACT 메서드에서 추가의 추가 가속 청소13, α-thioglycerol는 원래 협정 방법에만 약을 사용 하 여 액세스 되는 조직 영역을 취소 하는 데 도움이 유엔 브라우닝 에이전트 처리 7 , 8 , 9.
그 동안 psPACT 원래 협정 프로토콜을 기준으로 광 투명성 향상, mPACT 가장 효율적으로 허용 한다 개간 그리고 두 전부의 후속 고해상도 이미징에 대 한 협정, psPACT 및 설치류 조직에 mPACT의 비교 시연 포유류 장기 고 그림 2, 그림 3, 그림 4에서 시연으로 sectioned 조각. MPACT 입증 방법 키 다른 두 개간 방법에 비해 투명성, 효율성, 그리고 조직 안정성에 차이를에서 처리 된 장기의 α-thioglycerol-기반 지질 희미하게. 이 특히 면역 형광 검사 confocal 현미경 검사 법 (그림 5DE)을 통해 혈 맥 관 구조 형태에 관하여 처리 기관의 급속 한 3D 분석에 대 한 허용.
Α-thioglycerol 개간 SDS 기반 솔루션의 추가 가속 광학 투명도 대 한 중요 한 동안, 그것은 또한 약간 조직 취약성을 증가 하 고 후 처리 손상에 더 취약 하 게. 그것의 효율성에 관하여 mPACT의 명확한 우월 능가이 제한; 그럼에도 불구 하 고, 작업은 현재 행해지고 최대한 개간으로 달성 될 수 있도록 보장 하기 위해 조직의 무결성의 비용을 최소화.
따라서, 우리의 결과 포유류 장기, 신경 네트워크, 혈 맥 관 구조, 조직 매트릭스 아키텍처 하 되이 국한 되지 않음 등의 기능과 해 부 특징의 3 차원 분석을 제공 하기 위한 강력한 수사 도구로 mPACT를 설정 합니다. MPACT 질병, 조직 손상, 발달 기형, 암, 신경 등의 이상에 기여 하는 더 높은 순서 생물 학적 메커니즘의 조사에 특히 유용할 수 있다고 앞으로 이동, 질병14,15,,1617. 질병에 관련 된 미세한 세포 메커니즘의 연구와 함께, mPACT는 얼마나 다양 한 이질적인 질병의 메커니즘을 관찰된 표현 형을 상호 작용 이해, 다중 스케일을 제공 하.
공개
저자는 공개 없다.
감사의 말
이 작품은 두뇌 한국 21 플러스 프로젝트 의료 과학, 연세대에 지원 됩니다. 또한,이 작품은 국립 연구 재단의 한국 (NRF-2017R1D1A1B03030315)에서 교부 금에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix, Inc. | 75819 | Clearing solution |
| Nycodenz | Axia-Shield | 1002424 | nRIMS solution |
| 40% Acrylamide Solution | Bio Rad Laboratories, Inc. | 161-0140 | Polymerization (A4P0) |
| 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] Dihydrochloride | Wako Pure Chemical Industries, Ltd. | 017-19362 | Polymerization (VA-044) |
| 1-Thioglycerol | Sigma-Aldrich | M1753-100ML | Clearing solution (mPACT) |
| Tween-20 | Georgiachem | 9005-64-5 | nRIMS solution |
| Triton X-100 | Sigma-Aldrich | T8787-50ML | Immuno Staining |
| Bovine serum albumin (BSA) | Bovogen | BSA100 | Immuno Staining |
| Heparin | Merck Millipore | 375095 | Perfusion (PBS) |
| Sodium azide | Sigma-Aldrich | S2002-25G | nRIMS solution |
| PECAM-CD31 antibody | Santa Cruz Biotechnology Inc. | sc-28188 | Immuno Staining |
| Goat anti-rabbit-IgG Cy3 fluorescent conjugate | Jackson ImmunoResearch Inc. | 111-165-003 | Immuno Staining |
| 4% Paraformaldehyde | Tech & Innovation | BPP-9004 | Perfusion, Polymerization |
| 20X Phosphate Buffered Saline (pH 7.4) | Tech & Innovation | BPB-9121 | Perfusion, Buffer |
| 10 mL stripette | Coatar | 4488 | Solution transfer |
| 50 mL tube | Falcon | 352070 | Clearing tube |
| 35 mm Cell culture dish | SPL | 20035 | Imaging |
| Confocal dish | SPL | 211350 | Imaging |
| 1 mL syringe | Korea vaccine Co., Ltd | 26G 1/2 | Anesthetize |
| 50 mL syringe | Korea vaccine Co., Ltd | 21G1 1/4 | Perfusion |
| Acrylamide | Sigma-Aldrich | A3553 | Polymerization (A4P0) |
| Whatman 3MM paper | Sigma-Aldrich | Z270849 | Blotting paper for gel removal |
| Confocal microscope | Zeiss | LSM780 | Imaging |
| ZEN lite Software | Zeiss | ZEN 2012 | Imaging |
| Peristaltic pump | Longerpump | BT100-1F | Perfusion |
| EasyGel | Lifecanvas Technologies | EasyGel | Tissue gel hybridization system |
참고문헌
- Zhu, X., Xia, Y., Wang, X., Si, K., Gong, W. Optical brain imaging: A powerful tool for neuroscience. Neurosci Bull. 33 (1), 95-102 (2017).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9 (7), 1682-1697 (2014).
- Feng, Y., et al. CLARITY reveals dynamics of ovarian follicular architecture and vasculature in three-dimensions. Sci Rep. 7, 44810(2017).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Dev Biol. 14, 48(2014).
- Jensen, K. H. R., Berg, R. W. Advances and perspectives in tissue clearing using CLARITY. J Chem Neuroanat. 86, 19-34 (2017).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nat Protoc. 10 (11), 1860-1896 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331(2016).
- Woo, J., Lee, M., Seo, J. M., Park, H. S., Cho, Y. E. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Exp Mol Med. 48 (12), 274(2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Roberts, D. G., Johnsonbaugh, H. B., Spence, R. D., MacKenzie-Graham, A. Optical clearing of the mouse central nervous system using passive CLARITY. J Vis Exp. (112), (2016).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: A simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16 (8), 1154-1161 (2013).
- Choi, B. R., et al. Increased expression of the receptor for advanced glycation end products in neurons and astrocytes in a triple transgenic mouse model of Alzheimer's disease. Exp Mol Med. 46, 75(2014).
- Chang, D. J., et al. Contralaterally transplanted human embryonic stem cell-derived neural precursor cells (ENStem-A) migrate and improve brain functions in stroke-damaged rats. Exp Mol Med. 45, 53(2013).
- Kim, T. K., et al. Analysis of differential plaque depositions in the brains of Tg2576 and Tg-APPswe/PS1dE9 transgenic mouse models of Alzheimer disease. Exp Mol Med. 44 (8), 492-502 (2012).
- Kinameri, E., et al. Prdm proto-oncogene transcription factor family expression and interaction with the Notch-Hes pathway in mouse neurogenesis. PLoS One. 3 (12), e3859(2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유