Method Article
Romanzo passivo metodi di compensazione per la produzione rapida di trasparenza ottica nell'intero tessuto dello SNC
In questo articolo
Riepilogo
Qui, presentiamo due nuove metodologie, psPACT e MPATTO, per raggiungere la massima trasparenza ottica e la successiva analisi microscopica del sistema vascolare del tessuto nel roditore intatto tutta CNS.
Abstract
Poiché lo sviluppo di chiarezza, un bioelectrochemical tecniche di taglio che consente per la mappatura tridimensionale fenotipo all'interno dei tessuti trasparenti, una moltitudine di schiarimento romanzo metodologie tra cui CUBIC (imaging cerebrale chiaro, senza ostacoli cocktail e analisi computazionale), SWITCH (tutto il sistema di controllo del tempo di interazione) e cinetica di sostanze chimiche, mappa (ingrandita analisi del proteoma) e patto (tecnica passiva chiarezza), sono stati istituiti per espandere ulteriormente il toolkit esistente per l'analisi microscopica dei tessuti biologici. Il presente studio mira a migliorare e ottimizzare la procedura di patto originale per una matrice di tessuti roditore intatti, compreso l'intero sistema nervoso centrale (CNS), reni, milza ed embrioni del mouse intero. Denominato psPACT (Patto di processo-separi) e mPACT (Patto modificata), queste nuove tecniche forniscono altamente efficace mezzo di mappatura circuito di cella e la visualizzazione di strutture subcellulari nei tessuti normali e patologici intatti. Nel seguente protocollo, forniamo un contorno dettagliate su come raggiungere la distanza massima del tessuto con l'invasione minima della loro integrità strutturale tramite psPACT e mPACT.
Introduzione
Un obiettivo fondamentale di indagine scientifica e clinica coinvolge il raggiungimento di una completa comprensione della struttura dell'organo e funzione; Tuttavia, la natura estremamente complessa di organi mammiferi spesso funge da barriera per realizzare pienamente questo obiettivo1. CHIAREZZA (chiaro del lipido-scambiati acrilamide-ibridato rigida Imaging-compatibile tessutale-idrogel)2,3,4, che prevede la costruzione di un ibrido di idrogel a base di acrilammide dai tessuti intatti, raggiunge gioco ottico di una varietà di organi, compreso il cervello, il fegato e la milza, preservando la loro integrità strutturale5. CHIAREZZA così ha permesso non solo la visualizzazione, ma anche la possibilità di sezionare finemente complesse reti cellulari e morfologie di tessuto senza l'esigenza di sezionamento.
Al fine di ottenere la liquidazione del tessuto, chiarezza impiega i metodi elettroforetici per rimuovere il contenuto lipidico del campione a portata di mano. Mentre la chiarezza è stato notato per la produzione di ibridi fisicamente stabile del tessuto-idrogel, studi hanno dimostrato che l'uso di metodi di schiarimento (ecc) di tessuto elettroforetica produce risultati variabili in termini di qualità dei tessuti, tra cui browning, epitopo danni, e proteina perdita5,6. Per risolvere questi problemi, protocolli modificati come patto (passivo chiarezza tecnica), che sostituisce il trattamento ecc con una tecnica passiva, ionico-detergente delipidizzazione base, sono stati sviluppati7,8,9. Malgrado il raggiungimento di una maggiore coerenza nei risultati, tuttavia, il patto richiede più tempo per ottenere la massima altezza. Inoltre, nessuna di queste tecniche sono ancora stata applicata per l'intero modulo di CNS, o nei modelli più grandi roditori quali ratti e cavie.
Il presente studio cerca di affrontare queste limitazioni, proponendo nuove metodologie, psPACT (Patto di processo-separi) e mPACT (Patto modificata), per facilitare il gioco veloce del SNC intero e organi interni nel topo e ratto modelli10. In particolare, psPACT processi tessuti in 4% di acrilammide e 0,25% VA-044 in due passaggi separati durante la formazione di idrogel; MPATTO essenzialmente coinvolge la stessa procedura, ma integra la soluzione basata su SDS schiarimento con 0,5% α-thioglycerol come reagente chiave. Entrambe le tecniche sfruttano sistemi circolatorio sistemici e cerebrospinali endogeni per ridurre significativamente il tempo necessario per produrre gioco ottico. Come prova di principio, dimostriamo l'uso della microscopia confocale per analizzare modelli di vaso sanguigno nei tessuti sgomberati10.
Protocollo
Tutte le procedure sono state approvate dal comitato etico di ricerca appropriato presso Yonsei University College of Medicine. Tutti gli animali sperimentali sono sacrificati in conformità con le linee guida del Comitato di cura degli animali di laboratorio presso Yonsei University College of Medicine.
1. preparazione dei reagenti
Attenzione: Paraformaldeide (PFA), acrilammide e sodio dodecil solfato (SDS) sono irritanti tossici e quindi deve essere maneggiato in una cappa con appropriati dispositivi di protezione individuale (PPE; camice da laboratorio, guanti, occhiali protettivi).
- soluzione di acrilammide (Agosta) 4% (A4P0): aggiungere 20 mL della soluzione di 40% di acrilammide a 180 mL di 0.1 M tampone fosfato salino (PBS).
- 0,25% VA-044 soluzione: aggiungere 0,5 g di 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] dicloridrato (VA-044) polvere a 200 mL di 0.1 M tampone fosfato salino (PBS). Mentre la polvere VA-044 può essere conservata a temperatura ambiente, esso deve essere conservato a 4 ° C su solubilizzazione in PBS. Per risultati ottimali, è necessario preparare solo la quantità di soluzione necessaria per l'esperimento.
- Soluzione cocktail patto: aggiungere 10 g di acrilammide a 225 mL di soluzione al 4% paraformaldeide (PFA) e regolare il volume a 200 mL con 4% PFA. Prima dell'uso, aggiungere 100 mg di polvere di VA-044 a 40 mL della miscela in una provetta conica da 50 mL.
- PATTO di cancellazione soluzione buffer: aggiungere 40 g di sodio dodecil solfato (SDS) a 350 mL di PBS 0.1 M e regolare il volume a 500 mL con 0.1 M PBS. Per mPACT deselezionando la soluzione, aggiungere 0,5% α-thioglycerol il patto cancellazione soluzione buffer.
- I topi utilizzati in questo studio erano topi maschii di BALB 2-settimana-vecchio; i ratti utilizzati in questo studio erano SD-ratti maschii di 2 settimane di età.
2. anestesia e chirurgia di perfusione
Attenzione: PFA e acrilammide sono irritanti tossici e così deve essere gestite in una cappa aspirante con PPE appropriato.
- Anestetizzare l'animale in una stanza senza agente patogeno con 30 mg/kg di zoletil utilizzando una siringa da 1 mL con ago 26-gauge. Monitorare l'animale per 5-10 min.
- Una volta che l'animale ha raggiunto un aereo chirurgico di anestesia, è possibile utilizzare il metodo di risposta di punta-pizzico per determinare la profondità dell'anestesia. Confermare l'apatia.
Nota: La seguente procedura che coinvolge la chirurgia di topo e di ratto seguire un simile protocollo usato in un precedente studio11. - Fare un'incisione di 5-6 cm sotto la gabbia toracica, attraverso il tegumento e la parete addominale.
- Usare le forbici curve, smussate per fare un'incisione nel diaframma, palpare la zona toracica per individuare il sito di incisione in anticipo.
- Estendere l'incisione su tutta la lunghezza della gabbia toracica per esporre la cavità pleurica.
- Spostare con cautela i polmoni. Fare un taglio attraverso la gabbia toracica fino alla clavicola. Utilizzando le forbici iris, praticare una piccola incisione all'estremità posteriore del ventricolo sinistro. Inserire un ago calibro 18 con punta blunt o d'oliva aspersione nell'aorta ascendente, passando attraverso il ventricolo di taglio.
- Fissare l'ago ed evitare dispersioni di bloccaggio il cuore con una pinza emostatica. In alternativa, utilizzare una pinza emostatica modificata per bloccare l'aorta intorno alla punta dell'ago.
- Fare una grande incisione nell'atrio di destra, avendo cura di assicurare il minimo danno all'aorta discendente. Il ratto è ora pronto per aspersione.
3. intera aspersione e dissezione del ratto
Attenzione: PFA e acrilammide sono irritanti tossici e così deve essere gestite in una cappa aspirante con PPE appropriato.
Nota: I seguenti passaggi di aspersione intero sono un simile a un protocollo utilizzato in uno studio precedente di Woo et al. (2016) 10 , 11.
- Collegare l'atrio destro del cuore a un ago calibro 18, avendo cura di non introdurre eventuali bolle d'aria.
- Usando una siringa da 50 mL, rapidamente e in modo uniforme pompa 50 mL di soluzione di PBS 0.1 M fredda contenente eparina (10 unità/mL).
- Collegare l'ago calibro 18 al tubo della pompa peristaltica.
- Lavare con 200 mL di soluzione di PBS 0.1 M fredda contenente eparina (10 unità/mL) ad una velocità di circolazione di 10 mL/min.
- Difficoltà con 250 mL di soluzione fredda di PFA 4% ad una velocità di circolazione di 10 mL/min. In questa fase, il topo deve essere rigido.
- Raccogliamo e memorizziamo la soluzione rimanente PFA per lo smaltimento.
- Per patto, irrorare i tessuti con una soluzione di cocktail patto refrigerato di 4% PFA, 4% di acrilammide e 0,25% VA-044 polvere con un ago calibro 18 e quindi rimuovere la testa e la spina dorsale. Esporre il cranio con un'incisione del midline dal collo al naso. Questo passaggio aggiuntivo aspersione è inutile per i metodi psPACT e mPACT; Dopo la fissazione, immediatamente isolare la testa e la colonna vertebrale e il cranio di esporre.
- Esporre la base del cranio, eliminando qualsiasi residuo collo e muscoli della colonna vertebrale.
- Utilizzare Pinze ossivore e forbici per staccarsi il cranio. Rimuovere il cervello e il midollo spinale.
- Conservare il tessuto in 4% PFA a 4 ° C; tessuti possono essere memorizzati fino a 1 settimana.
4. idrogel monomero infusione e polimerizzazione del Mouse e del ratto SNC
Attenzione: Acrilamide, SDS, α-thioglycerol e PFA sono irritanti e così deve essere gestito in una cappa aspirante e con la pipì appropriato.
-
PATTO (passivo tecniche di taglio)
- Isolare e cultura SNC intero (cervello e midollo spinale) da fissi topi e ratti a un tubo da 50 mL contenente una soluzione di cocktail patto refrigerata di 4% PFA, 4% di acrilammide e 0,25% VA-044 polvere e conservare a 4 ° C per 24 h. Assicurarsi che il tessuto è completamente immerso nella s oluzione.
- Incorporare il campione in gas di azoto per 10 min utilizzando un tessuto gel sistema di ibridazione collegato ad un serbatoio di azoto: impostare il sistema a 37 ° C. Transfer tessuti a un tubo da 50 mL contenente freddo fresco (4 ° C) patto soluzione cocktail e connetterti con cappuccio del tubo, quindi applicare il vuoto.
- Per polimerizzare l'idrogel, posto nella provetta contenente il campione in un incubatore d'agitazione (150 giri/min, 37 ° C) per 3 ore, o fino a quando la polimerizzazione è completa.
- Utilizzando la carta assorbente (Vedi Tabella materiali), Rimuovi il restante idrogelo polimerizzato i tessuti circostanti.
- Trasferire il tessuto a un tubo da 50 mL contenente soluzione di schiarimento (8% SDS in 0.1 M PBS, pH 8.0).
- Il campione viene posto in un'incubatrice agitazione impostata a 37 ° C e 150 giri/min fino a quando il tessuto è stato cancellato. In media, ci vogliono circa 20 giorni per il mouse CNS per raggiungere piena chiarezza.
-
psPACT (tecnica di compensazione passiva separata di processo)
- Isolare l'intero CNS (cervello e midollo spinale) con osso cutter e forbici da PFA-fisso di topi e ratti su un banco pulito.
- Tessuti di trasferimento di un tubo da 50 mL contenente 4% PFA e conservare a 4 ° C per 24 h. garantire che il tessuto è completamente immerso nel fissativo.
- Lavare il tessuto fisso per 1 h in 0.1 M PBS e poi il trasferimento a A4P0 soluzione (4% di acrilammide in 0.1 M PBS). Negozio a 37 ° C per 24 h.
- Lavare il tessuto per 5 min in 0.1 M PBS.
- Immergere il tessuto in 0,25% VA-044 in 0.1 M PBS. Conservare a 37 ° C per 6-24 ore e poi il trasferimento al soluzione fresca di VA-044/PBS 0,25%.
- Incorporare il campione in gas di azoto per 10 min utilizzando un tessuto di ibridazione del gel sistema (Vedi Tabella materiali) collegato ad un serbatoio di azoto: Transfer tessuti a un tubo da 50 mL contenente freddo fresco (4 ° C) 0,25% soluzione VA-044/PBS e connetterti con tappo della provetta. Applicare il vuoto.
- Trasferire il tessuto a compensazione soluzione (8% SDS in 0.1 M PBS, pH 8.0).
- Incubare il campione in un incubatore agitazione impostato a 37 ° C e 150 giri/min fino a quando il tessuto è stato cancellato. In media, ci vogliono circa 17 giorni per mouse SNC a raggiungere piena chiarezza.
-
MPATTO (tecnica di compensazione passiva modificata)
- Isolare l'intero CNS (cervello e midollo spinale) con osso cutter e forbici da PFA-fisso di topi e ratti su un banco pulito.
- Seguire i passaggi 4.2.2 - 4.2.8 del protocollo psPACT.
- Trasferire la soluzione di compensazione il tessuto. Si noti che, diversamente dai protocolli di patto e psPACT, mPACT richiede una soluzione di schiarimento composto da 0,5% α-thioglycerol oltre 8% SDS in 0.1 M PBS, pH 8.0. Α-thioglycerol è un agente delle Nazioni Unite-doratura più rapido ed efficace nell'eliminazione del tessuto. Assicurarsi che il tessuto è completamente immerso nella soluzione.
- Il campione viene posto in un'incubatrice agitazione impostata a 37 ° C e 150 giri/min fino a quando il tessuto è stato cancellato. In media, ci vogliono circa 2 settimane per mouse SNC a raggiungere piena chiarezza.
5. indice di rifrazione di corrispondenza e Immunostaining del CNS deselezionata
Nota: cerchi n(soluzione basata su Nycodenz indice di rifrazione di corrispondenza) è composto di 0,8 g/mL Nycodenz polvere sciolta in 30 mL di tampone di base (0,01% sodio azide e Tween-20 in PBS di 0,1 M, pH 8.0). È consigliabile che la soluzione sia collocata in un 37 ° C in agitazione incubatore per consentire adeguata solvatazione della polvere.
- Incubare tessuti nello 0,1% Triton X-100 in 0.1 M PBS per 2 h, quindi bloccare con 2% di albumina di siero bovino (BSA) in 0.1 M PBS per 6 h.
- Lavare sezioni tre volte in PBST (0.1% Tween-20 in 0.1 M PBS) per 2 h. macchia sezioni con gli anticorpi primari (in questo caso, un anticorpo anti-coniglio PECAM-CD31, che le macchie di vasi sanguigni) per 2 giorni.
- Macchia di sezioni con anticorpi secondari (in questo caso, un capra anti-coniglio Cy3 IgG coniugato fluorescente) nel 2% BSA per 2 giorni.
- Lavare con etichetta tessuti tre volte in PBST per 2 h e negozio in 15 mL ncerchi per 2-10 giorni.
- Prima di formazione immagine, spostare con etichettate tessuti una piccola quantità di ncerchi su piastre di coltura del tessuto di 35 o 60 mm. Difficoltà con il silicone intorno al bordo inferiore del piatto.
- Aggiungere 1,5-2 mL di fresco ncerchi.
6. image processing
- Acquisire immagini dei tessuti sgomberati con mattonelle scansione utilizzando un ingrandimento di 10x microscopewith scansione laser confocale (Vedi Tabella materiali). Del tessuto Cy3-etichetta, utilizzare lunghezze d'onda di 550-600 nm.
Risultati
Generazione di un modello trasparente dello SNC intero utilizzando tecniche di compensazione passiva ottimizzata
Ottica clearance di topo e ratto tessuti dello SNC interi rapidamente è stata ottenuta utilizzando varie tecniche di compensazione passiva (Figura 1). Un disegno schematico del tessuto di compensazione nel corso del tempo è mostrato nella Figura 2A. A differenza del metodo originale di patto, psPACT (Patto di processo-separato) coinvolge il trattamento di campioni con 4% di acrilammide (A4P0) e 0,25% VA-044 iniziatore soluzione in due passaggi separati per formare l'ibrido di idrogel. MPATTO (Patto modificata) migliora ulteriormente su psPACT completando l'8% SDS soluzione con 0,5% α-thioglycerol di compensazione. I campioni trattati tramite patto, psPACT e mPACT al giorno 14 sono rispetto e presentati in Figura 2B.
In uno studio precedente, abbiamo riferito che mentre il protocollo originale del patto realizzato ottico distanza in 23 giorni, psPACT e mPACT ha eliminato tutto il mouse CNS in appena 20 e 14 giorni, rispettivamente10. Nello studio presente, quando abbiamo trattato i campioni di cervello del mouse tramite il protocollo MPATTO, abbiamo trovato che hanno raggiunto la trasparenza ottica dopo 14 giorni (Figura 2B). Ratto intero CNS campioni elaborati tramite psPACT e mPACT inoltre ha mostrato che quel mPACT realizzato massima distanza con la massima efficienza, come tessuti sono stati liquidati in 30 e 20 giorni, rispettivamente (Figura 3A, B). Cervelli di ratto adulto da solo, al contrario di intero sistema nervoso centrale, sono stati liquidati con mPACT in appena 5 giorni (Figura 4A). Modelli di vaso sanguigno del cervello di ratto sgomberati sono stati analizzati tramite immunofluorescenza dopo psPACT e l'elaborazione di mPACT per dimostrare l'utilità di queste procedure di compensazione per l'analisi anatomica e funzionale del cervello (Figura 4B, mPACT dati mostrato in Woo et al 2016)10.
Usando questi ottimizzato passiva del tessuto protocolli di compensazione, siamo stati in grado di visualizzare modelli intatti, trasparenti dello SNC intero, anche se i tempi di schiarimento differivano tra tre protocolli. Ottimizzato passivo metodi di compensazione raggiunto chiarezza dell'organo in un più breve periodo di tempo. Presi insieme, questi risultati suggeriscono che il metodo di compensazione mPACT può generare chiara CNS più stabile e più rapidamente rispetto al precedente passivo metodi di compensazione. Così, mPACT tiene il grande potenziale per l'uso in futuro strutturali e anatomiche analisi degli organi dei mammiferi e fornisce un vantaggio significativo rispetto ai metodi esistenti in termini di efficacia e la sicurezza.
Generazione degli organi interni otticamente deselezionati ed embrioni usando mPACT
Oltre tutto tessuti dello SNC, ratto adulto milza e rene sono stati liquidati con mPACT nei giorni 19 e 23, rispettivamente (Figura 5AB). Embrioni di topo e 10.5 e E13.5 inoltre sono stati liquidati dopo 3 giorni di elaborazione tramite il protocollo mPACT. Figura 5 -E Mostra la visualizzazione di modelli di vasi sanguigni in embrione intero, come pure del microcircolo della regione coda di embrione di topo, ratto cauda equina e la milza di ratto. Questi risultati indicano che mPACT può essere utilizzato per generare modelli trasparenti di una vasta gamma di tessuti e organi per analisi anatomica 3D.
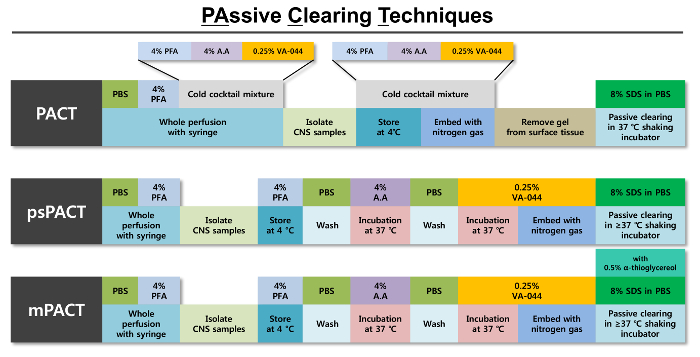
Figura 1: rappresentazione schematica delle tecniche di compensazione passiva ottimizzata (patto). Un contorno dei singoli passaggi necessari in ciascuno dei tre protocolli Patto viene fornito insieme ai reagenti necessari per ogni passaggio. Il protocollo originale del patto è polimerizzazione di tessuto dalla formazione di idrogel con una miscela fredda di 4% PFA, soluzione di acrilammide (Agosta) 4% e 0,25% VA-044 iniziatore soluzione. Dopo tessuto viene polimerizzato con azoto gas, passivamente viene cancellato con 8% SDS soluzione di compensazione. Il psPACT (Patto di processo-separi) utilizza processi di trattamento separato di Agosta soluzione al 4% e 0,25% VA-044 iniziatore soluzione per la formazione di idrogel del tessuto; queste condizioni diverse da quelle del protocollo patto originale. MPATTO (Patto modificata) ulteriore aggiunge 0,5% α-thioglycerol 8% SDS compensazione soluzione del protocollo psPACT. Per tutti e tre i protocolli, i tessuti intatti vengono incubati a > = 37 ° C in un incubatore d'agitazione fino alla massima distanza iss raggiunto. Clicca qui per visualizzare una versione più grande di questa figura.
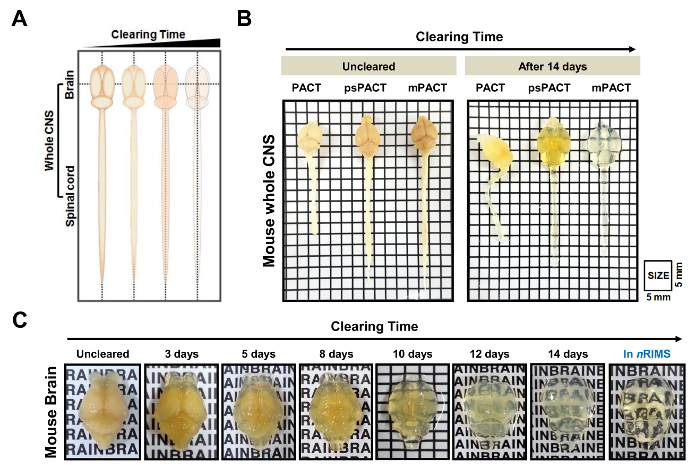
Figura 2: trasparenza ottica del mouse centrale intero (CNS) sistema nervoso di compensazione passiva del tessuto. (A) schematizzazione dell'intero tessuto dello SNC di compensazione tramite metodi basati su patto nel corso del tempo. (B) confronto dei tre protocolli compensazione passiva (patto originale, psPACT, mPACT) nel topo SNC intero a 14 giorni dopo l'elaborazione. (C) ottica clearance del cervello del topo sottoposto a elaborazione mPACT oltre i 14 giorni. Questa figura è stata modificata da Woo et al 201610. Le lettere in 2C sono 3 mm di altezza. Clicca qui per visualizzare una versione più grande di questa figura.
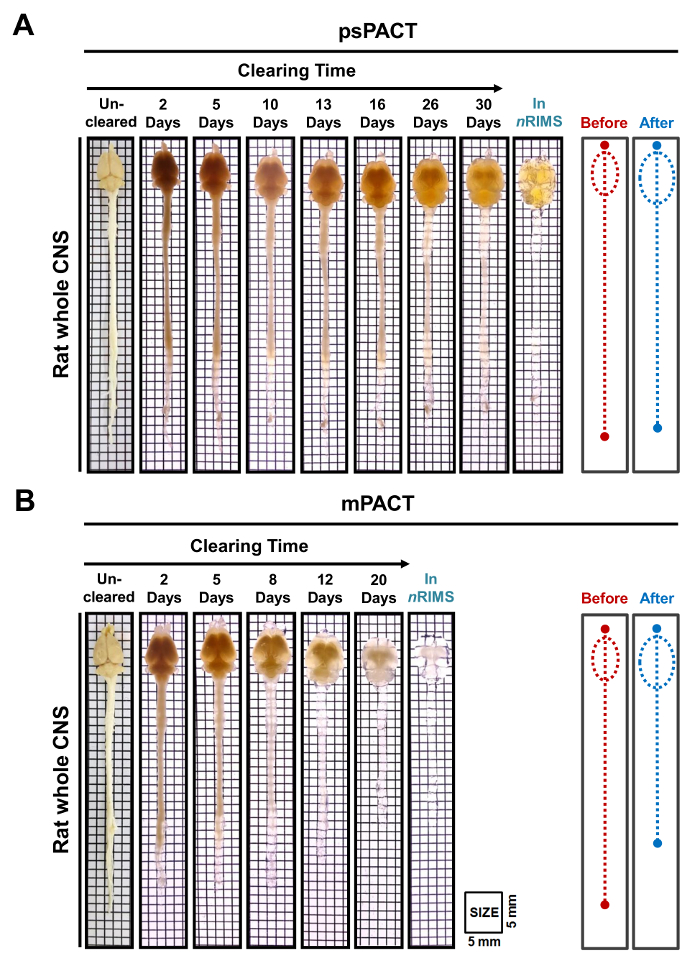
Figura 3: trasparenza ottica di ratto intero CNS tessuti post-psPACT e mPACT. (A) tessuto di ratto adulto intero dello SNC raggiunto massima distanza ottica con psPACT dopo 30 giorni. (B) tessuto di ratto adulto intero dello SNC raggiunto massima distanza ottica con mPACT dopo 20 giorni. La prima e dopo diagrammi indicano le dimensioni dell'intero sistema nervoso centrale prima e dopo il trattamento, come misurato dall'occhio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: visualizzazione di elaborazione e microcircolo mPACT del cervello del ratto adulto sezionato. (A) confronto del cervello del ratto adulto spessa 4 mm sezioni dopo mPACT elaborazione a 3 e 5 giorni. (B) proiezione 3D di modelli di vasi sanguigni nel cervello del ratto adulto visualizzato con anticorpo anti-CD31 dopo l'elaborazione psPACT. Barre della scala, 1.500 µm e 100 µm. Questa figura è stata modificata da Woo et al 201610. Clicca qui per visualizzare una versione più grande di questa figura.
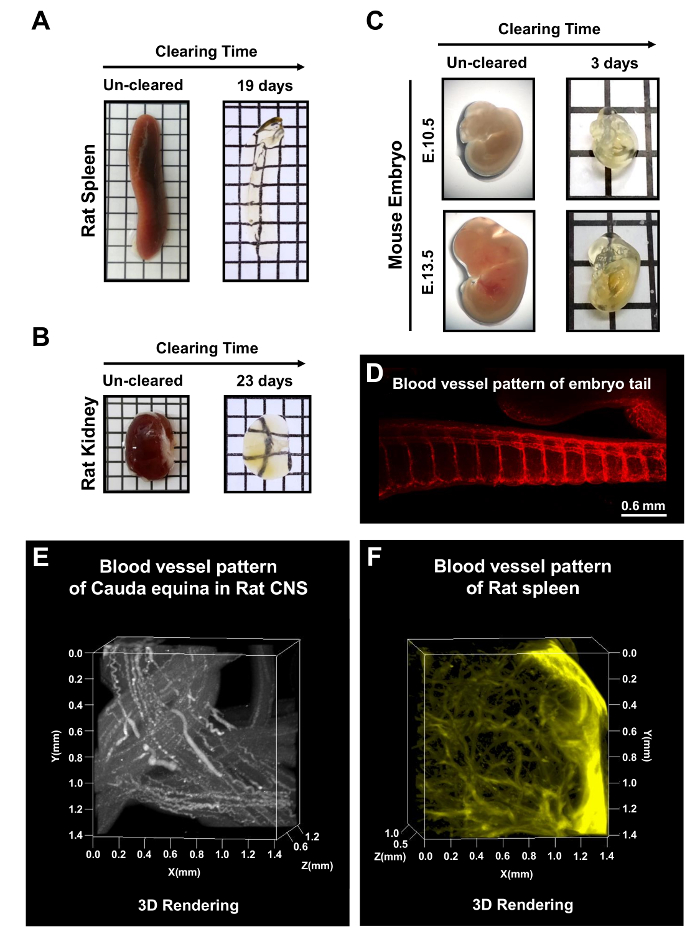
Figura 5: mPACT elaborazione degli organi del roditore ed embrioni del mouse tutto. MPATTO raggiunto trasparenza ottica nel ratto adulto (A) milza e rene (B) nei giorni 19 e 23, rispettivamente. (C) mPACT prodotto embrioni del mouse trasparenti e 10.5 ed E13.5 dopo 3 giorni. (D) visualizzazione del microcircolo con anti-CD31 nella regione della coda dell'embrione del mouse dopo schiarimento con mPACT. (E) proiezione 3D del sistema vascolare nel ratto cauda equina e milza di ratto (F) con anti-CD31, dopo l'elaborazione tramite mPACT. Questa figura è stata modificata da Woo et al 201610. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Mentre i metodi di estrazione passivo, elettroforesi-impiegato nel patto ha migliorato significativamente la consistenza realizzata con tessuto precedente schiarimento metodi ad esempio chiarezza2,3,4,7 , 8, la tecnica porta ancora varie carenze, la più urgente delle quali è la lunghezza del tempo necessario per raggiungere il tessuto massima chiarezza12. Nello studio corrente, presentiamo modificate protocolli di patto che riducono sensibilmente il tempo necessario per il tessuto di compensazione pur mantenendo tessuto integrità e struttura6,10. Inoltre, per la prima volta, dimostriamo l'applicazione del tessuto protocolli nei tessuti dello SNC interi e in un modello del roditore di ordine superiore, il ratto10di compensazione.
In particolare, psPACT l'elaborazione è campione in 4% di acrilammide e 0,25% VA-044 in due passaggi separati durante la formazione di idrogel, mentre mPACT ulteriormente si basa su psPACT e supplementi 8% SDS compensazione soluzione con 0,5% α-thioglycerol10. Che separa l'acrilammide e successive VA-044 passaggio evita la necessità per la rimozione di restanti monomeri non polimerizzate idrogel che circondano il tessuto, che può compromettere l'integrità del tessuto finale dopo il raggiungimento della trasparenza con patto; Inoltre, questo riduce notevolmente il tempo necessario per produrre la massima distanza ottica. L'aggiunta di α-thioglycerol nel metodo mPACT ulteriormente accelera lo schiarimento elaborare13, come α-thioglycerol è un agente delle Nazioni Unite-doratura che aiuta a cancellare le regioni del tessuto che sono meno accessibili utilizzando solo i reagenti nel metodo patto originale 7 , 8 , 9.
Un confronto del patto, psPACT e mPACT sul tessuto roditore hanno dimostrato che mentre psPACT migliora la trasparenza ottica rispetto il protocollo originale del patto, mPACT permette in modo più efficiente per la compensazione e la formazione immagine ad alta risoluzione successiva di entrambi insieme organi dei mammiferi e fette sezionate, come dimostrato nella Figura 2, Figura 3, Figura 4. L'interruzione di α-thioglycerol-base lipidica degli organi trasformati nella chiave del metodo si è rivelato mPACT alle differenze di trasparenza, efficienza e tessuto stabilità rispetto ad altri metodi di due schiarimento. Questo ha permesso per la rapida analisi 3D degli organi trattati, in particolare rispetto alla morfologia del sistema vascolare sangue, tramite immunofluorescenza e microscopia confocale (Figura 5E).
Mentre l'aggiunta di α-thioglycerol per la soluzione basata su SDS schiarimento è fondamentale per accelerare la trasparenza ottica, anche leggermente aumenta la fragilità del tessuto e lo rende più suscettibile ai danni post-elaborazione. La netta superiorità di mPACT per quanto riguarda la sua efficienza supera questa limitazione; Tuttavia, lavoro attualmente è stato fatto per garantire che la compensazione massima ottenibile con minima o nessuna spesa di integrità del tessuto.
Così, i nostri risultati stabiliscono mPACT come un potente strumento di indagine per fornire un'analisi 3D delle caratteristiche anatomiche e funzionali degli organi dei mammiferi, compreso ma non limitato a reti neuronali, sistema vascolare sanguigno e architettura di matrice del tessuto. Andando avanti, crediamo mPACT potrebbe essere particolarmente utile nell'indagine dei meccanismi biologici di ordine superiore che contribuiscono alla patofisiologia della malattia, quali la lesione del tessuto, malformazioni inerenti allo sviluppo, tumorali e neurodegenerative malattia14,15,16,17. Combinato con uno studio dei più sottili meccanismi cellulari coinvolti nella malattia, mPACT ha il potenziale per fornire una più completa, multi-scala comprensione della malattia più disparata come i vari meccanismi di interagiscono per dare luogo al fenotipo osservato.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal progetto cervello Corea 21 PLUS per la scienza medica, Università di Yonsei. Inoltre, questo lavoro è stato supportato da una sovvenzione della Fondazione ricerca nazionale di Corea (NRF-2017R1D1A1B03030315).
Materiali
| Name | Company | Catalog Number | Comments |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix, Inc. | 75819 | Clearing solution |
| Nycodenz | Axia-Shield | 1002424 | nRIMS solution |
| 40% Acrylamide Solution | Bio Rad Laboratories, Inc. | 161-0140 | Polymerization (A4P0) |
| 2,2´-Azobis[2-(2-imidazolin-2-yl)propane] Dihydrochloride | Wako Pure Chemical Industries, Ltd. | 017-19362 | Polymerization (VA-044) |
| 1-Thioglycerol | Sigma-Aldrich | M1753-100ML | Clearing solution (mPACT) |
| Tween-20 | Georgiachem | 9005-64-5 | nRIMS solution |
| Triton X-100 | Sigma-Aldrich | T8787-50ML | Immuno Staining |
| Bovine serum albumin (BSA) | Bovogen | BSA100 | Immuno Staining |
| Heparin | Merck Millipore | 375095 | Perfusion (PBS) |
| Sodium azide | Sigma-Aldrich | S2002-25G | nRIMS solution |
| PECAM-CD31 antibody | Santa Cruz Biotechnology Inc. | sc-28188 | Immuno Staining |
| Goat anti-rabbit-IgG Cy3 fluorescent conjugate | Jackson ImmunoResearch Inc. | 111-165-003 | Immuno Staining |
| 4% Paraformaldehyde | Tech & Innovation | BPP-9004 | Perfusion, Polymerization |
| 20X Phosphate Buffered Saline (pH 7.4) | Tech & Innovation | BPB-9121 | Perfusion, Buffer |
| 10 mL stripette | Coatar | 4488 | Solution transfer |
| 50 mL tube | Falcon | 352070 | Clearing tube |
| 35 mm Cell culture dish | SPL | 20035 | Imaging |
| Confocal dish | SPL | 211350 | Imaging |
| 1 mL syringe | Korea vaccine Co., Ltd | 26G 1/2 | Anesthetize |
| 50 mL syringe | Korea vaccine Co., Ltd | 21G1 1/4 | Perfusion |
| Acrylamide | Sigma-Aldrich | A3553 | Polymerization (A4P0) |
| Whatman 3MM paper | Sigma-Aldrich | Z270849 | Blotting paper for gel removal |
| Confocal microscope | Zeiss | LSM780 | Imaging |
| ZEN lite Software | Zeiss | ZEN 2012 | Imaging |
| Peristaltic pump | Longerpump | BT100-1F | Perfusion |
| EasyGel | Lifecanvas Technologies | EasyGel | Tissue gel hybridization system |
Riferimenti
- Zhu, X., Xia, Y., Wang, X., Si, K., Gong, W. Optical brain imaging: A powerful tool for neuroscience. Neurosci Bull. 33 (1), 95-102 (2017).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9 (7), 1682-1697 (2014).
- Feng, Y., et al. CLARITY reveals dynamics of ovarian follicular architecture and vasculature in three-dimensions. Sci Rep. 7, 44810(2017).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Dev Biol. 14, 48(2014).
- Jensen, K. H. R., Berg, R. W. Advances and perspectives in tissue clearing using CLARITY. J Chem Neuroanat. 86, 19-34 (2017).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nat Protoc. 10 (11), 1860-1896 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331(2016).
- Woo, J., Lee, M., Seo, J. M., Park, H. S., Cho, Y. E. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Exp Mol Med. 48 (12), 274(2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Roberts, D. G., Johnsonbaugh, H. B., Spence, R. D., MacKenzie-Graham, A. Optical clearing of the mouse central nervous system using passive CLARITY. J Vis Exp. (112), (2016).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: A simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16 (8), 1154-1161 (2013).
- Choi, B. R., et al. Increased expression of the receptor for advanced glycation end products in neurons and astrocytes in a triple transgenic mouse model of Alzheimer's disease. Exp Mol Med. 46, 75(2014).
- Chang, D. J., et al. Contralaterally transplanted human embryonic stem cell-derived neural precursor cells (ENStem-A) migrate and improve brain functions in stroke-damaged rats. Exp Mol Med. 45, 53(2013).
- Kim, T. K., et al. Analysis of differential plaque depositions in the brains of Tg2576 and Tg-APPswe/PS1dE9 transgenic mouse models of Alzheimer disease. Exp Mol Med. 44 (8), 492-502 (2012).
- Kinameri, E., et al. Prdm proto-oncogene transcription factor family expression and interaction with the Notch-Hes pathway in mouse neurogenesis. PLoS One. 3 (12), e3859(2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon