Method Article
Quantificando a densidade de ramificação em glândulas mamárias de ratos montadas inteiras usando o método de análise Sholl
Neste Artigo
Resumo
O desenvolvimento da glândula mamária no roedor tipicamente foi avaliado usando avaliações descritivas ou medindo atributos físicos básicos. A densidade de ramificação é um indicador de desenvolvimento mamário que é difícil de quantificar objetivamente. Este protocolo descreve um método confiável para a avaliação quantitativa das características de ramificação da glândula mamária.
Resumo
Um número crescente de estudos está utilizando a glândula mamária do roedor como um ponto final para avaliar a toxicidade do desenvolvimento de uma exposição química. Os efeitos dessas exposições no desenvolvimento da glândula mamária são tipicamente avaliados usando medidas dimensionais básicas ou marcando características morfológicas. No entanto, a ampla gama de métodos para interpretar mudanças de desenvolvimento pode levar a traduções inconsistentes em todos os laboratórios. É necessário um método comum de avaliação para que as interpretações apropriadas possam ser formadas a partir de dados comparados em todos os estudos. O presente estudo descreve a aplicação do método de análise Sholl para quantificar as características de ramificação da glândula mamária. O método Sholl foi originalmente desenvolvido para uso na quantificação de padrões dendríticos neuronais. Usando o ImageJ, um pacote de software de análise de imagens de código aberto e um plugin desenvolvido para esta análise, a densidade de ramificação da glândula mamária e a complexidade de amA glândula amariária de uma fêmea feminina peripúbera foi determinada. Os métodos aqui descritos permitirão o uso da análise Sholl como uma ferramenta eficaz para quantificar uma característica importante do desenvolvimento da glândula mamária.
Introdução
A ramificação das glândulas mamárias é uma característica comumente avaliada como um indicador do desenvolvimento das glândulas, mas é difícil quantificar objetivamente. Em 1953, Sholl 1 descreveu um método para medir a arborização dendrítica neuronal nos cortis visual e motor do gato, e um complemento para esta técnica foi desenvolvido por Ferriera et al . 2 . Uma vez que tanto os neurônios como as glândulas mamárias exibem uma estrutura semelhantes a uma árvore similar, o complemento foi empregado para quantificar as densidades de ramificação epitelial mamária em imagens 2D da glândula mamária do rato peripúbero. O estágio peripúbero foi escolhido para análise porque o desmame é um estágio de vida que é freqüentemente avaliado em laboratórios acadêmicos e estudos de orientação de teste. A análise Sholl é um plugin distribuído com FIJI, que é o pacote de processamento de imagens de código aberto ImageJ, com plugins adicionais incluídos. O plugin cria uma série de anéis concêntricos que envolvem um predefCentro interno (tipicamente o soma de um neurônio ou a origem do ducto primário de uma glândula mamária) e estendendo-se para a parte mais distal do objeto (o raio de encerramento). Em seguida, conta o número de interseções (N) que ocorrem em cada um dos anéis. O plugin também retorna um coeficiente de regressão de Sholl ( k ), que é uma medida da taxa de decaimento da ramificação epitelial.
Usando ImageJ, é criada uma imagem esqueletizada de um conjunto completo de glândula mamária e mede-se a área epitelial mamária (MEA). A imagem é analisada usando o plugin de análise Sholl, e os valores para N e k , entre outros valores não utilizados aqui, são retornados. A densidade de ramificação epitelial mamária é determinada pelo cálculo de N / MEA. A extensão em que a ramificação continua nas regiões externas do epitélio glandular é a complexidade de ramificação e é um indicador de crescimento epitelial distal uniforme. Como k é uma medida da diminuição distal em EpithElial ramificação, é uma medida efetiva da complexidade de ramificação e um indicador confiável do desenvolvimento mamário.
Este protocolo descreve um método assistido por computador para criar imagens esqueletizadas de montagens inteiras de glândulas mamárias e avaliar quantitativamente características de ramificação mamária em ratos machos e fêmeas peripúberas. Este método é relativamente rápido e não requer o uso de equipamentos de microscopia especializados. O desenvolvimento e a validação deste método estão descritos em Stanko et al. (2015) 3 . Este relatório também descreve a preparação da glândula mamária de rato inteiro = montagens. Procedimentos semelhantes de mamaria total foram descritos em Assis et al. (2010) 4 e Plante et al. (2011) 5 .
Protocolo
Todos os animais utilizados e procedimentos para este estudo foram aprovados pelo NIEHS Laboratory Animal Care and Use Committee e conduzido em uma Associação para Avaliação e Credenciamento de Laboratório Animal Care-acreditada facilidade.
1. Glândulas mamárias de consumo excessivo
- Pre-rotular todos os slides usando um método à prova de xileno (o lápis funciona melhor). Cubra-os com solução de montagem no final para preservar o rótulo.
- Eutanizar o animal por meio de um método institucional de cuidados com animais e uso aprovado pelo comitê.
- Após a eutanásia, coloque o animal nas costas sobre uma placa de dissecação ( Figura 1 ). Estique e defina todos os quatro membros, com os membros traseiros formando um V invertido (segurando pinos ou agulhas de calibre pequeno funcionam bem).
- Pulverize o abdômen liberalmente com 70% de etanol para manter o cabelo fora da amostra mamária.
- Usando fórceps, puxe a pele abdominal na linha média e faça uma pequena incisão comTesoura de dissecação, tendo cuidado para não perfurar o peritoneu.
- A partir da incisão, corte a pele até a região do pescoço e depois distalmente para o membro da frente. Reduzir para a região inguinal e depois distalmente para a primeira articulação do membro traseiro do mesmo lado; Esta incisão normalmente separa as glândulas mamárias 5 e 6. Evite cortar o peritoneu.
- Retire a pele com a almofada de gordura mamária anexada usando fórceps, separando-a suavemente do peritoneu usando a extremidade contundente das tesouras de dissecação. Separa-se dorsalmente na medida do possível para expor totalmente a 4 e 5 de glândulas mamárias inguinais no lado inferior da pele; Coloque a pele na placa de dissecação ( Figura 2 ).
- Suavemente agarrar o tecido mamário da glândula 5 ° com a face arredondada de uma pinça curvos e lentamente aparar a glândula para longe da pele, tendo o cuidado para não cortar a glândula ou a pele.
- Continue a cortar,movendo-se dorsalmente até as glândulas 4 e 5 th th foram completamente levantada a partir da pele. Certifique-se de que a região do mamilo é removida com o resto da glândula, pois isso serve como ponto de partida para a análise Sholl. Corte o tecido mamário longe do corpo onde está preso na glândula 4.
- Uma vez que a glândula é removida do animal, espalhe-a uniformemente em um slide de microscopia de 25 mm x 75 mm x 1 mm carregado eletrostáticamente, com o lado adjacente à pele voltada para baixo.
NOTA: Para glândulas de animais mais velhos ou em lactação, pode ser necessário um slide de 51 x 75 x 1 mm. - Ao usar luvas, aperte suavemente as bolhas de ar. Cubra a glândula com uma película de parafina de plástico e outro slide de microscópio e comprima a glândula para aderir ao slide.
NOTA: Um tubo cônico de 50 mL cheio com água serve como um peso adequado. A quantidade de tempo necessário para aderir ao slide depende da espessura da glândula. Fino, postnaDia (PND) 4 glândulas devem ser comprimidas por um mínimo de 30 min, enquanto as glândulas mais grossas podem exigir até 2 a 5 h.
2. Prepare mamíferos inteiros
- Prepare a solução de alumínio de carmim com pelo menos 24 h de antecedência, pois requer fervura e refrigeração.
- Dissolve-se 1 g de sulfato de alumínio carmim e 2,5 g de sulfato de alumínio e potássio (AIK (SO4) 2 · 12H 2 O) em 500 mL de água destilada e ferver durante 20 minutos em um frasco de 1-L. Traga o volume final para 500 mL usando água destilada.
- Filtre a solução através de papel de filtro sob vácuo e refrigerar para armazenamento.
NOTA: A solução de alumínio de carmim pode ser reutilizada, mas deve ser descartada quando a cor começa a desaparecer.
- Antes da fixação, remova o filme de parafina da glândula, tomando cuidado para não puxar a glândula do slide. Coloque o (s) slide (s) em um frasco de coloração de vidro e imergem no fixador (100% de etanOl, clorofórmio e ácido acético glacial numa proporção 6: 3: 1) durante 12 a 48 h, dependendo da espessura das glândulas.
- Despeje o fixador e remova as glândulas em etanol a 70% durante 15 min. Gradualmente rehidrate as glândulas despejando 1/3 da solução de etanol e substituindo-a com água destilada. Mergulhe por 5 min. Repita esse processo três vezes.
- Após o enxágüe final, despeje toda a solução de etanol / água e substitua-a por 100% de água destilada. Mergulhe as glândulas por 5 min.
- Despeje a água destilada e mergulhe as glândulas na solução de alumínio de carmim. Mancha as glândulas durante 12-24 h, dependendo da espessura.
NOTA: As glândulas não podem ser manchadas demais, mas o tempo de coloração para vários lotes deve ser o mesmo, de modo que a intensidade de coloração seja a mesma. - Despeje a solução de alquimato de carmim e lave as glândulas em 100% de água destilada durante 30 s. Gradualmente, desidrate as glândulas embebendo-as em etanol a 70% durante 15 min, etanol a 95% durante 15 min, umaE 100% de etanol durante 20 min.
- Limpe as glândulas de gordura embebendo-as em xileno durante 12 a 72 h, dependendo da espessura.
NOTA: As glândulas devem ser translúcidas (claras). Se as áreas opacas (esbranquiçadas) permanecerem, continue a embeber em xileno até ficar translúcido. Se as gânglios que estão em lactação ou de outra forma muito grossas estão sendo manchadas e limpas, o xileno pode precisar ser substituído uma vez para limpar completamente as glândulas. - Monte as lâminas com um meio de montagem baseado em xileno, pipetando meio suficiente para apenas cobrir a glândula. Adicione um lamínula, garantindo que não se formem bolhas de ar.
- Deixe as lâminas secar. À medida que o meio de montagem seca, ele vai se contrair sob a lamela, e pode ser necessário adicionar um meio de montagem adicional. Uma vez que não é necessário um meio adicional, deixe as lâminas secarem completamente; Isso pode demorar 2-3 semanas.
- Uma vez que as lâminas estão completamente secas, qualquer meio de montagem residual pode ser removido com um cotonete de algodão e uma pequena quantidade de xileno. Tenha cuidado para não usarXileno demais, pois isso pode dissolver o meio de montagem e soltar o lamínula. Se isso acontecer e as bolhas de ar coletam sob o lamínula, a lamínula deve ser removida em xileno e o processo de montagem deve ser repetido.
3. Prepare imagens de montagem total para análise
- Capture imagens de montagens inteiras ( Figura 3 ) utilizando um macroscópio ou microscópio de dissecação e uma câmera digital com o software apropriado.
NOTA: Embora seja possível selecionar qualquer ampliação que capture todo o epitélio glandular, é imperativo capturar todas as imagens de montagem total que serão comparadas entre si com a mesma ampliação. - Baixe o software ImageJ (ou o software FIJI) 6 .
- Abra a imagem mamária total em ImageJ clicando em "Arquivo" → "Abrir". Selecione a ferramenta Freehand e trate em torno do epitélio glandular. Selecione "Editar" & #8594; "Limpar Fora".
- Remova os nódulos linfáticos rastreando o nó e usando a ferramenta Freehand e "Edit" → "Cut".
- Separe os canais de cores selecionando "Imagem" → "Cor" → "Canais divididos". Selecione o canal com o melhor contraste, tipicamente o canal azul.
NOTA: Uma imagem RGB consiste em uma pilha dos componentes vermelho, verde e azul dessa imagem. Esta ação separa esses componentes em três imagens de grayscale de 8 bits. - Submeta o plano de fundo selecionando "Processar" → "Subtrair fundo". Escolha os parâmetros desejados e clique em "Visualizar" para visualizar as mudanças.
NOTA: "Subtrair fundo" remove fundos lisos e contínuos. Além disso, "Processo" → "Filtros" → "Unsharp Mask" pode ser usado para criar contraste. - Escolha um dos th E seguintes métodos para remover automaticamente o ruído: despeckle ou remover outliers.
NOTA: ImageJ oferece um terceiro método para a remoção automática de ruído: remove NaNs. No entanto, o comando remove NaNs não é aplicável, pois usa imagens de 32 bits e o método atual usa imagens de 8 bits.- Remova o ruído usando o comando despeckle selecionando "Processar" → "Ruído" → "Despejar".
NOTA: Isto é equivalente a adicionar um filtro mediano, que substitui cada pixel com o valor médio em sua vizinhança 3 × 3. - Remova o ruído usando o comando remove outliers selecionando "Processar" → "Ruído" → "Remover outliers".
NOTA: Este processo substitui um pixel com a mediana dos pixels nos arredores imediatos se se desviar da mediana em mais de um determinado valor (o limite).
- Remova o ruído usando o comando despeckle selecionando "Processar" → "Ruído" → "Despejar".
- Remova qualquer ruído restante manualmente (Lass = "xfig"> Figura 4).
- Abra uma cópia da imagem original e use isso como um guia para o que é e o que não é ruído. Clique no botão de seta de vermelho duplo na extremidade direita da barra de ferramentas. Selecione as Ferramentas de desenho; Os botões da Ferramenta de desenho aparecerão agora na barra de ferramentas.
- Clique na ferramenta Eraser. Ajuste o diâmetro da borracha clicando com o botão direito do mouse no botão da ferramenta Eraser. Mantenha o botão esquerdo do mouse para apagar o ruído.
NOTA: Apenas uma sessão de apagamento pode ser desfeita. Uma vez que o botão esquerdo do mouse é liberado e clicado novamente, o apagamento anterior não pode ser desfeito.
- Ajuste o limite selecionando "Imagem" → "Ajustar" → "Limiar". Mova os controles deslizantes para ajustar o limite mínimo (controle deslizante superior) e máximo (slider inferior) até que uma representação adequada da glândula seja alcançada.
NOTA: Configurando o valor de limiar segmentos imagens de escala de cinza em recursos de interesse e fundo.- Clique em Aplicar. Se necessário, remova o ruído adicional neste ponto, seguindo as etapas 3.6.1 e 3.6.2.
- Reconstrua as porções do epitélio glandular que foram removidas por limiar e remoção de ruído ( Figura 5 ).
- Realize a reconstrução da imagem com cuidado e de forma mínima para manter a integridade da imagem original. Consulte a imagem original para obter uma referência sobre o que é e o que não é epitélio.
- Clique na ferramenta Spray Can (na barra de ferramentas com as Ferramentas de desenho). Ajuste o diâmetro e a taxa de pulverização clicando com o botão direito do mouse no botão da ferramenta Spray Can. Complete cuidadosamente as seções faltantes da glândula clicando ou pressionando o botão esquerdo do mouse.
- Crie uma imagem esqueletizada da glândula para realizar a Análise Sholl. Certifique-se de que a imagem limite seja binária selecionando "Processar" → "Binário" → "Fazer B Inary. "
- Se a imagem estiver branca em um fundo preto, selecione "Processar" → "Binário" → "Opções" e desmarque "Fundo preto". Esqueletisize a imagem selecionando "Processar" → "Binário" → "Esqueletizar".
NOTA: Isso remove repetidamente pixels das bordas da imagem binária até que seja reduzido a uma forma de um único pixel. - Dilate a imagem uma vez, selecionando "Processar" → "Binário" → "Dilatar".
NOTA: Isso preenche as lacunas criadas pelo limite e esqueletização, adicionando pixels às bordas da imagem binária.
- Se a imagem estiver branca em um fundo preto, selecione "Processar" → "Binário" → "Opções" e desmarque "Fundo preto". Esqueletisize a imagem selecionando "Processar" → "Binário" → "Esqueletizar".
- Salve a imagem selecionando "Arquivo" → "Salvar como". Selecione um tipo de imagem (tipicamente jpeg), insira o nome do arquivo e clique em "OK".
- Verifique a precisão da imagem esqueletizada sobrepondo a imagem esqueletizada para a imagem original (Ass = "xfig"> Figura 6).
- Crie uma sobreposição abrindo a imagem original e a imagem esqueletizada. Selecione "Imagem" → "Sobreposição" → "Adicionar imagem". Na caixa de diálogo "Adicionar imagem", selecione a imagem do esqueleto no menu suspenso "Imagem para Adicionar" e defina a opacidade em 30%.
- Salve a imagem da imagem do esqueleto sobreposta ao original selecionando "Arquivo" → "Salvar como". Selecione um tipo de imagem, digite o nome do arquivo e clique em "OK".
4. Realizar a Análise Sholl
- Abra uma imagem de esqueleto e faça a imagem binária selecionando "Processar" → "Binário" → "Fazer binário".
- Antes de ajustar a escala de ampliação, mede o número de pixels / mm usando um micômetro para a ampliação na qual as imagens foram capturadas.
- Defina a ampliação medida sCale selecionando "Analisar" → "Definir escala". Digite o número de pixels / mm. Defina a "Distância conhecida" e a "Relação de aspecto de pixel", tanto para 1. Digite "mm" para a "Unidade de Comprimento" e marque "Global" (mantém a mesma escala para cada imagem).
- Determine o raio de término (raio de encerramento) para a análise de Sholl, desenhando uma linha desde o início do ducto primário (centro de análise) até o ponto mais distal do epitélio glandular ( Figura 7 ).
- Use a ferramenta de desenho de linha na barra de ferramentas para desenhar uma linha entre os pontos de interesse. Pressione a tecla "M" para tomar uma medida e observe que uma janela de resultados será aberta.
NOTA: O valor na coluna "Comprimento" é o comprimento da linha em mm. Esse valor será automaticamente inserido como o Rádio final ao definir os parâmetros Sholl. O plugin Sholl usará o ponto de partidaDa linha como o centro dos anéis centrais.
- Use a ferramenta de desenho de linha na barra de ferramentas para desenhar uma linha entre os pontos de interesse. Pressione a tecla "M" para tomar uma medida e observe que uma janela de resultados será aberta.
- Execução da Análise Sholl.
- Execute a análise selecionando "Plugins" "Advanced Sholl Analysis;" Uma janela de parâmetros aparecerá.
- Defina o raio de partida em "I. Definição de conchas" para 0,00 mm; O comprimento da linha medida no passo 4.2 será automaticamente inserido como "Rádio de término".
- Defina o "Tamanho da etapa do raio" para 0,1 mm.
NOTA: O tamanho do passo do raio determina o número de anéis (efetivamente o número de iterações); Um tamanho de passo menor aumentará o número de anéis, enquanto um tamanho de passo maior diminuirá o número de anéis. O raio não pode ser definido muito pequeno, embora um raio excessivamente pequeno resulte em um número desnecessariamente grande de anéis. No entanto, ele pode ser configurado muito grande, o que criará menos anéis e subseqüentemente subestimará o número real de interseções. Consulte Stanko et al.(2015) para obter mais informações sobre como determinar o tamanho da etapa. - Defina o "# Amostras" para 1 e a "Integração" para "Média" em "II. Múltiplas Amostras por Raio".
- Defina o "Limite de raio de encerramento" para 1 e verifique "inferir do raio de partida" para o "# Ramificações primárias" em "III. Descritores e ajuste de curvas".
NOTA: "Ajustar perfil e calcular descritores" e "Mostrar detalhes de montagem" podem ser verificados conforme desejado. - Marque "Linear" e selecione "Melhor grau de ajuste" em "Perfis sem normalização"; Verifique "Mais informativo". Selecione "Área para Perfis Normalizados" em "IV. Métodos Sholl".
- Marque "Criar máscara de interseções" em "V. Opções de saída" para criar um mapa de calor das interseções (opcional).
- Clique em "Cf. Segmentação" para gerar uma janela de visualização da imagem com anéis para confirmar a áreaDe análise.
- Clique em "OK" para executar a análise.
5. Medindo o MEA
- Meça o MEA rastreando a menor distância em torno da árvore epitelial ( Figura 8 ).
- No ImageJ com a imagem do esqueleto da glândula aberta, clique na ferramenta Polígono. Clique em um ponto no perímetro da árvore epitelial para começar o polígono, mova-se ao redor do perímetro da glândula e clique para adicionar um segmento de linha.
- Quando toda a área epitelial foi contornada, clique duas vezes para fechar o polígono. Pressione a tecla "M" para abrir uma janela de resultados; O valor na coluna "Área" é o MEA.
- Nos casos em que o epitélio glandular se estendeu para além do nódulo linfático, subtrair a área dos linfonodos (LNA) do MEA ao calcular a densidade de ramificação.
- Medir o LNA rastreando o nódulo linfático no mesmo mannComo a árvore epitelial e pressionando "M."
NOTA: O LNA deve ser subtraído do MEA nestes casos porque o nódulo linfático impede a análise de contar as interseções dentro do LNA. Quando o epitélio não atingiu o nódulo linfático, o LNA é zero.
- Medir o LNA rastreando o nódulo linfático no mesmo mannComo a árvore epitelial e pressionando "M."
6. Relatórios de dados
- Relata os valores para o raio envolvente, MEA, N, k e densidade de ramificação.
NOTA: O raio de inclusão é determinado no passo 4.2 e o MEA é determinado no passo 5.1.- Execute a análise para gerar uma janela de resultados Sholl.
NOTA: O N relatado é o valor para o fluxo de soma. O k relatado é o valor do coeficiente de regressão de Sholl (semi-log). A análise de Sholl retornará um valor para k em qualquer região medida do epitélio glandular. Para obter um valor preciso para k sobre o epitélio completo, as extremidades ductais devem estar presentes. - Modificar thAnálise e Sholl para a glândula mamária usando o valor de saída para N para calcular a densidade de ramificação (o ponto final fundamental desse método). Calcule a densidade de ramificação usando a fórmula N / (MEA-LNA) e relate o valor como N / mm 2 .
- Execute a análise para gerar uma janela de resultados Sholl.
Resultados
Os valores para o raio fechado medido, MEA, N, k e densidade de ramificação calculada para a glândula mamária analisada neste protocolo são relatados na Tabela 1 . A análise Sholl gera parcelas lineares e semi-logs do número de interseções em cada raio ( Figura 9 ) e, se selecionado, um mapa de calor das interseções ( Figura 10 ). As glândulas menos desenvolvidas exibem menos intersecções dentro do mesmo MEA e, portanto, têm uma menor densidade de ramificação. Uma glândula bem desenvolvida continuará a se ramificar uniformemente ao longo de todo o epitélio glandular, particularmente nas regiões distantes. A extensão em que a ramificação continua nessas regiões pode ser descrita como complexidade de ramificação e as diminuições de complexidade são transmitidas como uma taxa de decaimento (ou coeficiente de regressão de Sholl, k ). A taxa de decaimento reflete a mudança no sutiã epitelial distalE é medido como a inclinação da linha do número de interseções traçadas contra o raio de encerramento ( ou seja, o crescimento longitudinal do epitélio). Assim, o coeficiente de regressão de Sholl é calculado tomando a inclinação da linha do lote de log (N / S) versus a distância radial (r), onde log (N / S) = - k r + m, sendo N O número de interseções para cada anel de raio r e área S (πr 2 ) e m sendo a intercepção. Como a inclinação - k descreve a decadência das interseções, um valor de - k = 0 indicaria desintegração zero e ramificação uniforme do centro de análise até a borda do epitélio. Nas glândulas escassamente desenvolvidas, a deterioração das ramificações é aumentada; Há menos interseções na região distal da árvore epitelial; E a inclinação, k , é aumentada. Portanto, os valores de k que se aproximam de 0 são indicativos de maior ramificação distal ( ou seja, complexidade de ramificação) e um poço- glândula mamária desenvolvida.
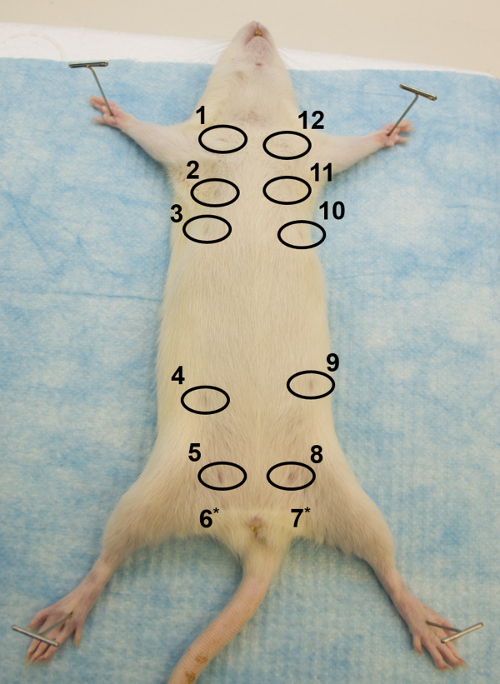
Figura 1: Vista Ventral. Imagem da porção ventral de um rato Sprague Dawley fêmea adulto, ilustrando como proteger o rato na superfície de dissecação e a localização das 12 glândulas mamárias, com os mamilos circundados. * Os mamilos das glândulas 6 e 7 não são visíveis. Clique aqui para ver uma versão maior dessa figura.

Figura 2: Glândula mamária de rato feminino. Ilustração das glândulas mamárias expostas 4 (MG4) e 5 (MG5), com a pele fixada na superfície de dissecção acima de MG4 e logo abaixo da MG5. As glândulas devem ser removidas do sk No início com MG5 e continuando e dorsalmente até MG5 e 4 serem completamente removidos. O mamilo está na área distal da glândula 4, e deve-se ter cuidado para colecionar esta área. O nódulo linfático é indicado para referência. Clique aqui para ver uma versão maior dessa figura.

Figura 3: Mammary Gland Whole-mount. Uma imagem total de uma glândula mamária coletada de um dia pós-natal 25 do sexo feminino Sprague Dawley. Barra de escala = 1 mm. Clique aqui para ver uma versão maior dessa figura.
.jpg "/>
Figura 4: remoção de ruído. O canal de cor azul de uma imagem mamária completa, com o segundo plano subtraído. ( A ) demonstra exemplos com ruído. As setas indicam o ruído criado pelos vasos sangüíneos, e a região mais sombreada que envolve as extremidades ductais é um exemplo de ruído criado subtraindo o fundo. ( B ) ilustra a imagem após o ruído ter sido removido. Clique aqui para ver uma versão maior dessa figura.

Figura 5: Reconstrução de Imagem. Reconstrução das porções apagadas da imagem limiar. ( A ) As setas vermelhas indicam regiões onde partes da imagem foram perdidas devido ao limiar. Reconhecimento da imagemA rucção deve ser realizada nessas regiões. ( B ) Imagem mamária depois de reconstruir as regiões excluídas. A reconstrução da imagem deve ser conduzida com cuidado e de forma mínima para manter a integridade da imagem original. Clique aqui para ver uma versão maior dessa figura.

Figura 6: Sobreposição de uma imagem esqueletizada. Imagem de sobreposição que mostra uma imagem esqueletizada sobreposta à imagem original de montagem total. Esta imagem demonstra que a glândula esqueletizada reflete a ramificação da glândula real com um alto grau de precisão. Clique aqui para ver uma versão maior dessa figura.
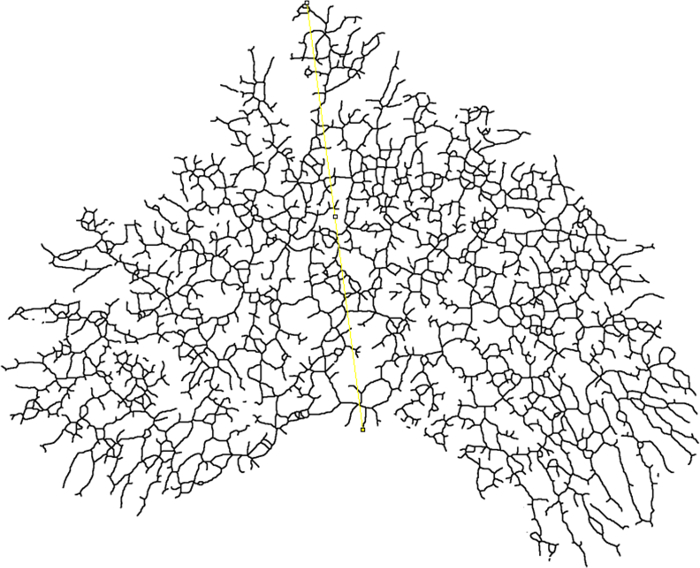
Figura 7: Encerramento do raio. Imagem esqueletizada de uma montagem mamária total onde o raio de fechamento é medido (amarelo). A linha deve começar na base da árvore epitelial (centro de análise) e se estender até o ponto mais distal do epitélio. Clique aqui para ver uma versão maior dessa figura.

Figura 8: Área Epitelial Mamária. Imagem esqueletizada mostrando um polígono rastreado em torno da árvore epitelial para determinar o MEA. Clique aqui para ver um ver maiorDa figura.

Figura 9: Sholl Plot Output. Produção Sholl de gráficos lineares ( A ) e semi-log ( B ) do número de interseções em cada incremento radial. O ponto vermelho no painel (A) é a abscissa do centróide (centro geométrico). No painel (B), a linha azul é a regressão linear sobre a gama completa de dados, enquanto que a linha vermelha representa a regressão linear sobre o 10 th -90 percentil. Clique aqui para ver uma versão maior dessa figura.
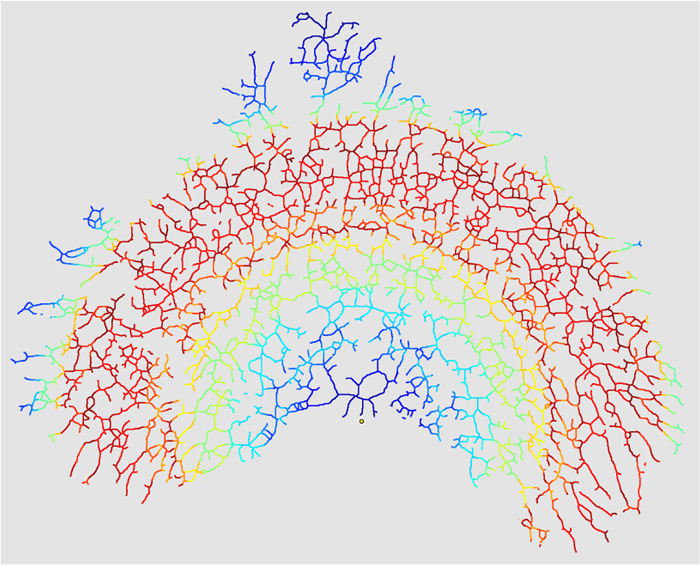
Figura 10: Máscara de Intersecções. Quando o "Criar InterSeção de máscaras de seções "(etapa 4.3.7), a análise produzirá um mapa de calor do número de interseções em todo o raio envolvente da imagem. Esse mapa de calor reflete a densidade das interseções de ramificação em todo o epitélio (vermelho = quente = Alta densidade, azul = frio = baixa densidade). Todo o epitélio seria da mesma cor num mapa de calor de uma imagem onde k = 0. Clique aqui para ver uma versão maior dessa figura.
Tabela 1: Parâmetros de Análise Sholl. Os valores são os dados relatados para a análise Sholl. O Raio de Encerramento (etapa 4.2) e MEA (etapa 5.1) são valores medidos, N e k são resultados de análise Sholl e são retornados na janela de resultados da análise Sholl (etapa 6.1.) E a Densidade de Ramificação é calculada usando a fórmula N / ( MEA-LNA) (passo 6.1.2).
| Encerrando o raio (mm) | MEA (mm2) | N | K | Densidade de ramificação (N / mm2) |
| 7.4 | 71.7 | 2381 | 0,73 | 33.2 |
Discussão
Do nascimento até a puberdade, o crescimento da glândula mamária é alométrico. Após a puberdade, a glândula mamária se desenvolve através de extensas derivações ductais e alongamento, que continuam até o epitélio mamário ocupar toda a almofada de gordura. As características de ramificação são um aspecto importante do desenvolvimento da glândula mamária e a capacidade de quantificar objetivamente essas características pode ser altamente útil para avaliar o desenvolvimento mamário normal e para identificar o desenvolvimento anormal após exposições iniciais à vida nos tóxicos mamários.
As características morfológicas de pontuação, a quantificação de medidas dimensionais básicas e a contagem de estruturas mamárias são métodos típicos para avaliar o desenvolvimento de glândulas mamárias. No entanto, esses métodos não são especialmente sensíveis devido à variação considerável no tamanho e forma das glândulas mamárias de roedores e a interpretação do desenvolvimento pode ser difícil para um avaliador inexperiente. Além disso, o potencial deExiste sesgo em estudos que não estão cegos adequadamente. O método de análise de Sholl fornece um protocolo eficiente para quantificar com precisão a densidade de ramificação epitelial mamária e complexidade de ramificação, características morfológicas discretas do desenvolvimento de glândulas mamárias, que podem ser facilmente comparadas entre estudos e laboratórios.
Existem etapas críticas em várias seções deste protocolo. O primeiro e o mais importante refere-se à condição da glândula mamária todo o suporte. A precisão deste método depende de uma glândula mamária que seja coletada inteiramente intacta, montada sem defeitos, devidamente fixada e manchada e não demonstra oxidação da glândula ou descoloração significativa do meio de montagem. Se a glândula estiver rasgada ou dobrada, não é possível obter uma medida precisa da densidade de ramificação. Se as extremidades ductais não estiverem presentes, o valor para k não será representativo de toda a glândula. O limiar será difícil nas glândulasQue não foram totalmente corrigidos por falta de contraste de coloração no epitélio ductal. E, finalmente, se a oxidação ou a descoloração estiver presente, essas imperfeições podem impedir a análise de medir as interseções na área afetada.
Quando montadas completas adequadas foram preparadas, a próxima etapa crítica é capturar as imagens com a mesma ampliação. É prática comum capturar imagens digitais com a máxima resolução possível. No entanto, para a análise Sholl, é mais importante que todas as imagens sejam capturadas na mesma ampliação. Conforme descrito em Stanko et al. (2015) 3 , descobriu-se uma ressalva em que imagens de glândulas menores capturadas em alta ampliação apresentavam maiores densidades de ramificação do que as imagens de glândulas maiores capturadas em uma menor ampliação, embora aparentemente pareciam estar menos desenvolvidas. Nós hipotetizamos que a maior ampliação resultou em maiores detalhes, que foram transferidos paraEle esqueletizou a imagem e resultou em um N maior, que representou a densidade de ramificação das glândulas menores. Esta questão é aliviada ao capturar todas as imagens com a mesma ampliação.
Embora a base de uma análise precisa esteja dentro do conjunto completo, o maior potencial para mudanças influenciadas pelo usuário nos dados de interseção estão nas etapas de remoção de ruído. Todas as imagens contêm ruído, até certo ponto, devido a intensidade de coloração, entidades fisiológicas não relevantes ( por exemplo, vasos sanguíneos) e artefatos de limiar. Cada imagem deve ser abordada de forma independente devido a variações na quantidade de ruído entre as imagens. Deve ter cuidado para não remover muito ou muito ruído, pois isso pode distorcer o número de interseções e, conseqüentemente, a densidade de ramificação. No entanto, a medida em que o ruído afeta a interpretação não foi examinada. O usuário deve decidir o quão meticuloso estar com a remoção de ruído e também deve exercer consisTenacidade para manter a integridade das imagens. É altamente recomendável que o usuário seja cegado para o tratamento ao realizar a remoção de ruído, pois isso minimizará o potencial de polarização. A remoção de ruído é descrita detalhadamente no ImageJ User's Guide 7 . Neste procedimento, o ruído é removido principalmente da imagem subtraída de fundo. Além disso, o próprio processo de limiar pode remover segmentos da glândula. Porções da glândula onde apenas alguns pixels foram removidos serão reconstruídos automaticamente quando a imagem esqueletizada estiver dilatada. No entanto, lacunas expansivas podem requerer reconstrução manual. O usuário deve decidir se e em que medida para reconstruir esses segmentos, mantendo novamente a integridade das imagens originais.
Embora isso não seja crítico, é importante manter as atualizações de software, pois o software ImageJ é atualizado com freqüência. Os métodos descritos aqui são baseados na versão 1.48v. FIJI e o Sholl aO complemento de nalisia também é atualizado regularmente, e o protocolo descrito aqui é baseado na v3.4.1. As alterações feitas nas versões posteriores do ImageJ e do plugin da Análise Sholl podem afetar esses métodos. O ImageJ verifica automaticamente as atualizações, mas as atualizações para o FIJI devem ser realizadas regularmente e as mudanças entre as versões atuais e as utilizadas aqui devem ser abordadas conforme necessário. Todos os parâmetros são definidos nas subposições na página da Web da Análise Sholl 6 . As configurações de parâmetros dentro deste procedimento são baseadas em imagens capturadas de montes inteiros de glândulas mamárias criadas em nosso laboratório e não são absolutas. A preparação de montagem total varia de laboratório para laboratório, e esses parâmetros podem ser ajustados de acordo para otimizar imagens e saída.
O conjunto completo da glândula mamária utilizado neste estudo foi de um rato fêmea Sprague Dawley no PND 25, e o método foi aplicado de forma adequada e sem limitações. Em ratos, a densidade epitelial mamária incReúne-se com a idade até um ponto em que impede que o tamanho da imagem seja suficientemente alto para gerar uma imagem esqueletizada precisa da glândula. Portanto, atualmente, não recomendamos usar este método em glândulas de ratos anteriores ao PND40. Embora a cepa do rato tenha sido indicada aqui, é irrelevante, já que os autores não estão conscientes de nenhum traço mamário específico da cepa que evite o uso desse método. Além disso, enquanto o método descrito dentro foi conduzido utilizando um rato fêmea, também poderia ser aplicado às glândulas mamárias de ratos machos. Este aplicativo também foi efetivamente usado com montagens inteiras de ratos (Deirdre Tucker, comunicação pessoal) e deve ser adequado para ratos de qualquer idade, uma vez que as glândulas mamárias em camundongos não crescem tão densas como as de ratos. No entanto, existem duas limitações com o uso desta aplicação em camundongos: 1) pode haver poucas interseções de ramificação em camundongos mais jovens para detectar diferenças significativas e 2) este método não podeT ser aplicado a ratos machos, pois não exibem epitélio mamário. Independentemente disso, este método automatizado é mais rápido, imparcial e muito menos intensivo em mão-de-obra do que contar indiretamente as interseções de ramificação.
É possível que os pesquisadores desejem utilizar a glândula mamária para outras técnicas experimentais, como excisão de estruturas anormais ou para imuno-histoquímica (IHC). Embora Tucker et al. (2016) descreveram um método para preparar uma seção corada com hematoxilina-eosina a partir de uma montagem total de glândula mamária de rato 8 , normalmente consideramos a criação de um conjunto completo para ser um processo terminal e não conhecemos métodos para usar um todo- Montou a glândula mamária para ensaios sensíveis adicionais, como os ensaios IHC ou TUNEL. Onde os ensaios sensíveis que utilizam tecido da glândula mamária são necessários em conjunto com montagens inteiras, recomenda-se a utilização das glândulas mamárias contralaterais.
A glândula mamária continua tO seja o ponto focal em um número cada vez maior de estudos, porém as diferenças entre laboratórios existem em preparação de montagem completa 9 , 10 , 11 , 12 e avaliações de desenvolvimento 13 , 14 , 15 . A modificação da análise de Sholl descrita aqui fornece um método padronizado para a quantificação objetiva da densidade de ramificação, uma característica importante do desenvolvimento da glândula mamária, na glândula mamária do roedor. Este método pode ser aplicado a montagens inteiras mamárias de roedores machos ou fêmeas e, embora atualmente recomendado para uso apenas em glândulas pós-natal a peripúberas precoces de ratos, pode ser aplicado a glândulas mamárias de camundongos de todas as idades. O aplicativo é particularmente adequado para glândulas mamárias coletadas de roedores peripúberos, pois este período é recomendadoPonto final para a preparação de montagem total mamária em estudos de orientação de teste. A otimização deste método para uso nas glândulas mamárias mais densas de ratos adultos está sendo considerada.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores gostariam de reconhecer o Dr. Michael Easterling (Social and Scientific Systems, Inc., Durham, Carolina do Norte) por sua assistência na validação deste método e Dr. Tiago Ferreira (Universidade McGill, Montreal, Quebec, Canadá) por sua contínua Assistência com o aplicativo Sholl.
Materiais
| Name | Company | Catalog Number | Comments |
| Dissecting board | NA | NA | A piece of styrofoam roughly 10"x12" is suitable. |
| Dissecting T-Pins | Daigger | EF7419A | |
| Spray bottle with ethanol | NA | NA | 70% ethanol is suitable. |
| Curved dissecting scissors | Fine Science Tools | 14569-09 | |
| Straight dissecing scissors | Fine Science Tools | 14568-09 | |
| Curved forceps | Fine Science Tools | 11003-12 | |
| Superfrost Plus 24 x 75 x 1 mm microscope slides | ThermoFisher Scientific | 4951PLUS-001 | Thermo Scientific Superfrost Plus & Colorfrost Plus slides hold tissue sections on permanently without the need for expensive coatings in IHC and Anatomical Pathology applications. This treatment reduces tissue loss during staining as well as hours of slide preparation. Slides electro-statically attract frozen tissue sections and cytology preparations and feature a chemistry similar to silane, although optimized to improve application performance. https://www.thermofisher.com/order/catalog/product/4951PLUS4. |
| Fisherfinest Premium Cover Glass 24 x 60 x 1 mm | Fisher scientific | 12-548-5P | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher scientific | 13-374-12 | |
| Chloroform | Sigma-Aldrich | C2432 | |
| Glacial acetic acid | Sigma-Aldrich | A9967 | |
| Ethanol absolute, ≥99.8% (GC) | Sigma-Aldrich | 24102 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Carmine alum | Sigma-Aldrich | C1022 | |
| Aluminum potassium sulfate | Sigma-Aldrich | A6435 | |
| Permount mounting media | Fisher Scientific | SP15 | |
| Macroscope | Leica | Z16 APO | This is the image capturing hardware and software used in this laboratory. As there are many different options, the methods and applications may vary between laboratories. |
| Digital camera | Leica | DFC295 | |
| Camera software | Leica | Leica Application Suite v3.1 | |
| ImageJ software | Open source | http://imagej.net/Welcome | |
| Sholl analysis | Open source | http://imagej.net/Sholl_Analysis |
Referências
- Sholl, D. A. Dendritic organization of the neurons in the visual and motor cortices of the cat. J Anat. 87 (4), 387-406 (1953).
- Ferreira, T. A., Iacono, L. L., Gross, C. T. Serotonin receptor 1A modulates actin dynamics and restricts dendritic growth in hippocampal neurons. Eur J Neurosci. 32 (1), 18-26 (2010).
- Stanko, J. P., Easterling, M. R., Fenton, S. E. Application of Sholl analysis to quantify changes in growth and development in rat mammary gland whole mounts. Reprod Toxicol. 54, 129-135 (2015).
- Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in Mammary Gland Morphology and Breast Cancer Risk in Rats. J. Vis. Exp. (44), e2260 (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of Mammary Gland Development and Function in Mouse Models. J. Vis. Exp. (53), e2828 (2011).
- ImageJ User Guide. IJ 1.46r. ImageJ Available from: https://imagej.nih.gov/ij/docs/guide/146.html (2012)
- Tucker, D. K., Foley, J. F., Hayes-Bouknight, S. A., Fenton, S. E. Preparation of High-quality Hematoxylin and Eosin-stained Sections from Rodent Mammary Gland Whole Mounts for Histopathologic Review. Toxicol Pathol. 44 (7), 1059-1064 (2016).
- Fenton, S. E., Hamm, J. T., Birnbaum, L. S., Youngblood, G. L. Persistent abnormalities in the rat mammary gland following gestational and lactational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Toxicol Sci. 67 (1), 63-74 (2002).
- Murray, T. J., Maffini, M. V., Ucci, A. A., Sonnenschein, C., Soto, A. M. Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure. Reprod Toxicol. 23 (3), 383-390 (2007).
- Moral, R., Santucci-Pereira, J., Wang, R., Russo, I. H., Lamartiniere, C. A., Russo, J. In utero exposure to butyl benzyl phthalate induces modifications in the morphology and the gene expression profile of the mammary gland: an experimental study in rats. Environ Health. 10 (1), 5 (2011).
- Johnson, M. D., Mueller, S. C. Three dimensional multiphoton imaging of fresh and whole mount developing mouse mammary glands. BMC Cancer. 13, 373 (2013).
- Enoch, R. R., Stanko, J. P., Greiner, S. N., Youngblood, G. L., Rayner, J. L., Fenton, S. E. Mammary gland development as a sensitive end point after acute prenatal exposure to an atrazine metabolite mixture in female Long-Evans rats. Environ Health Persp. 115 (4), 541-547 (2007).
- Hovey, R. C., Coder, P. S., Wolf, J. C., Sielken, R. L., Tisdel, M. O., Breckenridge, C. B. Quantitative assessment of mammary gland development in female Long Evans rats following in utero exposure to atrazine. Toxicol Sci. 119 (2), 380-390 (2011).
- Mandrup, K. R., Hass, U., Christiansen, S., Boberg, J. Perinatal ethinyl oestradiol alters mammary gland development in male and female Wistar rats. Inter J of Androl. 35 (3), 385-396 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados