Method Article
Quantification de la densité de branchement dans les boîtes entières de glandes mammaires de rat utilisant la méthode d'analyse Sholl
Dans cet article
Résumé
Le développement des glandes mammaires chez le rongeur a généralement été évalué à l'aide d'évaluations descriptives ou en mesurant les attributs physiques de base. La densité de branchement est un indicateur du développement mammaire difficile à quantifier objectivement. Ce protocole décrit une méthode fiable pour l'évaluation quantitative des caractéristiques de ramification des glande mammaire.
Résumé
Un nombre croissant d'études utilisent la glande mammaire de rongeur comme point final pour évaluer la toxicité pour le développement d'une exposition chimique. Les effets de ces expositions sur le développement des glandes mammaires sont généralement évalués en utilisant des mesures dimensionnelles de base ou en décrivant des caractéristiques morphologiques. Cependant, le large éventail de méthodes pour interpréter les changements de développement pourrait conduire à des traductions incompatibles entre les laboratoires. Une méthode d'évaluation commune est nécessaire pour que les interprétations appropriées puissent être formées à partir de données comparées entre les études. La présente étude décrit l'application de la méthode d'analyse Sholl pour quantifier les caractéristiques de ramification des glandes mammaires. La méthode Sholl a été développée à l'origine pour être utilisée dans la quantification des modèles dendritiques neuronaux. En utilisant ImageJ, un progiciel d'analyse d'image open source et un plugin développés pour cette analyse, la densité de ramification de la glande mammaire et la complexité de l'amLa glande ammaire d'un rat femelle peripubertaire a été déterminée. Les méthodes décrites ici permettront l'utilisation de l'analyse Sholl comme outil efficace pour quantifier une caractéristique importante du développement de la glande mammaire.
Introduction
La branchement de la glande mammaire est une caractéristique qui est généralement évaluée comme un indicateur du développement des glandes, mais il est difficile de quantifier objectivement. En 1953, Sholl 1 décrit une méthode pour mesurer l'arborisation dendritique neuronale dans les cortices visuels et moteurs du chat, et un plugin pour cette technique a été développé par Ferriera et al 2 . Parce que les neurones et les glandes mammaires présentent une structure semblable à celle d'un arbre similaire, le plugin a été utilisé pour quantifier les densités de ramifications épithéliales mammaires dans les images 2D de la glande mammaire du rat peripubertal. Le stade peripubertal a été choisi pour analyse car le sevrage est une étape de la vie qui est souvent évaluée dans les laboratoires universitaires et les études de référence. L'analyse Sholl est un plugin distribué avec FIJI, qui est le pack de traitement d'image open source ImageJ, avec des plugins supplémentaires inclus. Le plugin crée une série d'anneaux concentriques encerclant un Predef(Généralement le soma d'un neurone ou l'origine du conduit primaire d'une glande mammaire) et s'étend jusqu'à la partie la plus distale de l'objet (le rayon d'enceinte). Il compte alors le nombre d'intersections (N) qui se produisent sur chacun des anneaux. Le plugin renvoie également un coefficient de régression Sholl ( k ), qui est une mesure du taux de désintégration de la ramification épithéliale.
À l'aide d'ImageJ, une image squelettisée d'un ensemble de glandes mammaires est créée et la zone épithéliale mammaire (MEA) est mesurée. L'image est analysée à l'aide du plugin d'analyse Sholl, et les valeurs pour N et k , entre autres valeurs non utilisées ici, sont renvoyées. La densité de ramification épithéliale mammaire est déterminée en calculant N / MEA. La mesure dans laquelle la ramification se poursuit dans les régions extérieures de l'épithélium glandulaire est la complexité de la ramification et est un indicateur d'une croissance épithéliale distale uniforme. Comme k est une mesure de la diminution distale de l'épithElial Branching, c'est une mesure efficace de la complexité de la ramification et un indicateur fiable du développement mammaire.
Ce protocole décrit une méthode assistée par ordinateur pour créer des images squelettisées de montures entières de glandes mammaires et évaluer quantitativement les caractéristiques de ramification mammaire chez des rats mâles et femelles peripubertaux. Cette méthode est relativement rapide et ne requiert pas l'utilisation d'équipements microscopiques spécialisés. Le développement et la validation de cette méthode sont décrits dans Stanko et al. (2015) 3 . Ce rapport décrit également la préparation de la glande mammaire de rat entière = des supports. Des procédures de montage total mammaire semblables ont été décrites dans Assis et al. (2010) 4 et Plante et al. (2011) 5 .
Protocole
Tous les animaux utilisés et les procédures pour cette étude ont été approuvés par le NIEHS Laboratory Animal Care and Use Committee et ont été menés dans une association pour l'évaluation et l'accréditation d'un laboratoire accrédité par les animaux de laboratoire.
1. Glandes mammaires d'accise
- Pré-étiqueter toutes les glissières à l'aide d'une méthode anti-xylène (le crayon fonctionne le mieux). Couvrez-les avec une solution de montage à la fin pour préserver l'étiquette.
- Éuthaniser l'animal par une méthode approuvée par le Comité des soins et l'utilisation de l'établissement.
- Après l'euthanasie, placez l'animal sur le dos sur un panneau de dissection ( figure 1 ). Étirez et épinglez tous les quatre membres, les branches arrière formant un V inversé (les goupilles de maintien ou les aiguilles à petite jauge fonctionnent bien).
- Pulvérisez libéralement l'abdomen avec de l'éthanol à 70% pour éviter les cheveux de l'échantillon mammaire.
- À l'aide d'une pince, tirez la peau abdominale à la ligne médiane et faites une petite incision avecDissecant des ciseaux, en prenant soin de ne pas crever le péritoine.
- À partir de l'incision, couper la peau jusqu'à la région du cou, puis distalement vers le membre avant. Réduire vers la région inguinale et ensuite distalement vers la première articulation de l'arrière du même côté; Cette incision sépare habituellement les glandes mammaires 5 et 6. Évitez de couper le péritoine.
- Retirer la peau avec le tampon gras mammaire attaché à l'aide d'une pince, en la séparant doucement du péritoine à l'aide de l'extrémité émoussée des ciseaux à dissection. Séparer autant que possible dorsalement afin d' exposer complètement la 4 ème et 5 ème glandes mammaires inguinales sur la face inférieure de la peau; Épinglez la peau au panneau de dissection ( figure 2 ).
- Saisissez doucement le tissu mammaire de la 5ème glande avec le côté arrondit de la pince courbe et retirez lentement la glande de la peau en prenant soin de ne pas entamer la glande ou la peau.
- Continuez à couper,déplacer le dos jusqu'à ce que les glandes 4 ème et 5 ème ont été complètement enlevé de la peau. Assurez-vous que la région du mamelon est enlevée avec le reste de la glande, car cela sert de point de départ pour l'analyse Sholl. Couper le tissu mammaire loin du corps où il est attaché à la glande 4.
- Une fois que la glande est enlevée de l'animal, étaler uniformément sur une lame de microscopie 25 mm x 75 mm x 1 mm chargée électrostatiquement, avec le côté adjacent à la peau vers le bas.
REMARQUE: Pour les glandes provenant d'animaux plus âgés ou en lactation, une diapositive de 51 x 75 x 1 mm peut être requise. - Tout en portant des gants, essuyez délicatement toutes les bulles d'air. Couvrez la glande avec un film de paraffine en plastique et une autre glissière de microscope et comprimez la glande pour l'adhérer à la glissière.
REMARQUE: Un tube conique de 50 ml rempli d'eau sert de poids approprié. La quantité de temps nécessaire pour adhérer à la diapositive dépend de l'épaisseur de la glande. Mince, postnaJour (PND) 4 glandes devraient être comprimées pendant au moins 30 minutes, tandis que les glandes adulte plus épais peuvent nécessiter jusqu'à 2-5 h.
2. Préparer les montants complets mammaires
- Préparez la solution d'alun de carmin au moins 24 h à l'avance, car elle nécessite une ébullition et une réfrigération.
- Dissoudre 1 g d'alun de carmin et 2,5 g de sulfate de potassium et d'aluminium (AlK (SO 4 ) 2 · 12H 2 O) dans 500 ml d'eau distillée et faire bouillir pendant 20 minutes dans un ballon de 1 L. Apportez le volume final à 500 mL en utilisant de l'eau distillée.
- Filtrer la solution à travers du papier filtre sous vide et réfrigérer pour le stockage.
REMARQUE: La solution d'alun de carmin peut être réutilisée mais doit être rejetée lorsque la couleur commence à s'effacer.
- Avant la fixation, éplucher le film de paraffine de la glande, en prenant soin de ne pas tirer la glande de la glissière. Placez la (les) glissière (s) dans un pot vitré à lames et immergez le fixateur (100% éthaneOl, chloroforme et acide acétique glacial dans un rapport 6: 3: 1) pendant 12 à 48 h, selon l'épaisseur des glandes.
- Verser le fixateur et tremper les glandes dans 70% d'éthanol pendant 15 min. Réhydrater graduellement les glandes en versant 1/3 de la solution d'éthanol et en la remplaçant par de l'eau distillée. Tremper pendant 5 min. Répétez ce processus trois fois.
- Après le rinçage final, versez toute la solution d'éthanol / eau et remplacez-la par de l'eau 100% distillée. Trempez les glandes pendant 5 min.
- Verser l'eau distillée et immerger les glandes dans la solution d'alun de carmin. Tenez les glandes pendant 12-24 h, selon l'épaisseur.
REMARQUE: les glandes ne peuvent pas être sur-tachées, mais le temps de coloration pour plusieurs lots doit être le même, de sorte que l'intensité de coloration est la même. - Verser la solution d'alun de carmin et rincer les glandes dans de l'eau 100% distillée pendant 30 s. Déshydrater graduellement les glandes en les trempant dans de l'éthanol à 70% pendant 15 minutes, 95% d'éthanol pendant 15 min,Et 100% d'éthanol pendant 20 min.
- Effacez les glandes de graisse en les trempant dans du xylène pendant 12 à 72 h, selon l'épaisseur.
REMARQUE: Les glandes doivent être translucides (clair). Si des zones opaques (blanchâtres) restent, continuez à tremper dans du xylène jusqu'à ce qu'elles soient translucides. Si des glandes allaitant ou autrement très épaisses sont colorées et nettoyées, le xylène peut devoir être remplacé une fois pour dégager complètement les glandes. - Monter les diapositives avec un support de fixation à base de xylène en pipetant assez de milieu pour couvrir simplement la glande. Ajoutez une lamelle, assurant qu'aucune bulle d'air ne se forme.
- Laissez les glissières sécher. À mesure que le milieu de montage se dessèche, il se contractera sous la lamelle, et il peut être nécessaire d'ajouter un support de montage supplémentaire. Une fois qu'aucun moyen supplémentaire n'est nécessaire, laissez les glissières sécher complètement; Cela peut prendre 2-3 semaines.
- Une fois que les glissières sont complètement sèches, tout support de montage résiduel peut être retiré avec un coton-tige et une petite quantité de xylène. Veillez à ne pas utiliserTrop de xylène, car cela peut dissoudre le support de montage et desserrer le lamelle. Si cela se produit et que les bulles d'air se rassemblent sous la lamelle, la lamelle doit être retirée dans du xylène et le processus de montage doit être répété.
3. Préparez des images intégrales pour analyse
- Capturez des images de supports entiers ( Figure 3 ) à l'aide d'un microscope ou d'un microscope à dissection et d'un appareil photo numérique avec le logiciel approprié.
REMARQUE: Si l'on peut choisir un grossissement qui capture l'épithélium glandulaire entier, il est impératif de capturer toutes les images intégrales qui seront comparées l'une à l'autre au même grossissement. - Télécharger le logiciel ImageJ (ou le logiciel FIJI) 6 .
- Ouvrez l'image mammaire complète dans ImageJ en cliquant sur "Fichier" → "Ouvrir". Sélectionnez l'outil Freehand et tracez autour de l'épithélium glandulaire. Sélectionnez "Modifier" et "#"8594; "Effacer dehors".
- Retirez les ganglions lymphatiques en traçant autour du noeud et en utilisant l'outil Freehand et "Edit" → "Cut".
- Séparez les canaux de couleur en sélectionnant "Image" → "Couleur" → "Split Channels". Sélectionnez le canal avec le meilleur contraste, généralement le canal bleu.
REMARQUE: une image RVB consiste en une pile de composants rouges, verts et bleus de cette image. Cette action sépare ces composants en trois images en niveaux de gris de 8 bits. - Soustrayez l'arrière-plan en sélectionnant "Processer" → "Soustraire le fond". Choisissez les paramètres souhaités, puis cliquez sur "Aperçu" pour prévisualiser les modifications.
REMARQUE: "Soustraire le fond" élimine les arrière-plans lisses et continus. De plus, "Process" → "Filters" → "Unsharp Mask" peut être utilisé pour créer un contraste. - Choisissez l'un des th E suivre les méthodes pour éliminer automatiquement le bruit: dépeche ou retirez les valeurs aberrantes.
REMARQUE: ImageJ offre une troisième méthode pour l'élimination automatique du bruit: supprimer les NaN. Cependant, la commande remove NaNs n'est pas applicable car elle utilise des images 32 bits et la méthode actuelle utilise des images 8 bits.- Supprimez le bruit à l'aide de la commande despeckle en sélectionnant "Traiter" → "Bruit" → "Découper".
REMARQUE: cela équivaut à l'ajout d'un filtre médian, qui remplace chaque pixel par la valeur médiane dans son quartier 3 × 3. - Supprimez le bruit à l'aide de la commande remove outliers en sélectionnant "Process" → "Noise" → "Remove Outliers".
REMARQUE: Ce processus remplace un pixel par la médiane des pixels dans l'environnement immédiat s'il dévie de la médiane par plus d'une certaine valeur (le seuil).
- Supprimez le bruit à l'aide de la commande despeckle en sélectionnant "Traiter" → "Bruit" → "Découper".
- Supprimez manuellement le bruit restant (Lass = "xfig"> Figure 4).
- Ouvrez une copie de l'image originale et utilisez ceci comme un guide pour ce qui est et ce qui n'est pas du bruit. Cliquez sur le bouton à double flèche rouge à l'extrême droite de la barre d'outils. Sélectionnez les outils de dessin; Les boutons de l'outil de dessin apparaîtront désormais dans la barre d'outils.
- Cliquez sur l'outil Eraser. Réglez le diamètre de la gomme en cliquant avec le bouton droit sur le bouton de l'outil Eraser. Tenez le bouton gauche de la souris pour effacer le bruit.
REMARQUE: Une seule session d'effacement peut être annulée. Une fois que le bouton gauche de la souris est relâché et fait un nouveau clic, l'effacement précédent ne peut pas être annulé.
- Réglez le seuil en sélectionnant "Image" → "Ajuster" → "Seuil". Déplacez les curseurs pour ajuster les seuils minimum (coulisseau supérieur) et maximum (slider inférieur) jusqu'à ce qu'une représentation adéquate de la glande soit atteinte.
REMARQUE: Régler les images de niveaux de gris des segments de valeurs de seuil dans des caractéristiques d'intérêt et d'arrière-plan.- Cliquez sur Appliquer. Si nécessaire, retirez le bruit supplémentaire à ce stade en suivant les étapes 3.6.1 et 3.6.2.
- Reconstruire les portions de l'épithélium glandulaire qui ont été enlevées par le seuillage et l'élimination du bruit ( Figure 5 ).
- Effectuez une reconstruction de l'image soigneusement et sur une base minimale afin de maintenir l'intégrité de l'image originale. Reportez-vous à l'image originale pour une référence sur ce qui est et ce qui n'est pas l'épithélium.
- Cliquez sur l'outil Spray Can (dans la barre d'outils avec les outils de dessin). Réglez le diamètre et le débit de la pulvérisation en cliquant avec le bouton droit sur le bouton de l'outil Spray Can. Remplissez soigneusement les sections manquantes de la glande en cliquant ou en appuyant sur le bouton gauche de la souris.
- Créez une image squelettisée de la glande pour effectuer l'analyse Sholl. Assurez-vous que l'image de seuil est binaire en sélectionnant "Process" → "Binary" → "Make B Inary. "
- Si l'image est blanche sur fond noir, sélectionnez "Processer" → "Binaire" → "Options" et décochez "Fond noir". Skeletonize l'image en sélectionnant "Process" → "Binary" → "Skeletonize".
REMARQUE: ceci supprime de façon répétée les pixels des bords de l'image binaire jusqu'à ce qu'il soit réduit à une seule forme de pixel. - Dilatez l'image une fois en sélectionnant "Process" → "Binary" → "Dilate".
REMARQUE: cela comble les lacunes créées par le seuillage et la squelette en ajoutant des pixels aux bords de l'image binaire.
- Si l'image est blanche sur fond noir, sélectionnez "Processer" → "Binaire" → "Options" et décochez "Fond noir". Skeletonize l'image en sélectionnant "Process" → "Binary" → "Skeletonize".
- Enregistrez l'image en sélectionnant "Fichier" → "Enregistrer sous". Sélectionnez un type d'image (généralement jpeg), entrez le nom du fichier et cliquez sur "OK".
- Vérifiez la précision de l'image squelettisée en recouvrant l'image squelettisée sur l'image originale (Ass = "xfig"> Figure 6).
- Créez une superposition en ouvrant à la fois l'image originale et l'image squelettisée. Sélectionnez "Image" → "Overlay" → "Ajouter une image". Dans la boîte de dialogue "Ajouter une image", sélectionnez l'image squelette dans le menu déroulant "Image à ajouter" et définissez l'opacité à 30%.
- Enregistrez l'image de l'image squelette sur l'original en sélectionnant "Fichier" → "Enregistrer sous". Sélectionnez un type d'image, entrez le nom du fichier et cliquez sur "OK".
4. Effectuer l'analyse Sholl
- Ouvrez une image squelette et faites l'image binaire en sélectionnant "Process" → "Binary" → "Make Binary".
- Avant de régler l'échelle de grossissement, mesurez le nombre de pixels / mm à l'aide d'un micromètre pour le grossissement auquel les images ont été capturées.
- Définir le grossissement mesuré sCale en sélectionnant "Analyser" → "Définir l'échelle". Entrez le nombre de pixels / mm. Réglez la "Distance connue" et le "Rapport d'aspect du pixel", à la fois pour 1. Entrez "mm" pour l'unité de longueur et cochez "Global" (maintient la même échelle pour chaque image).
- Déterminer le rayon de fin (rayon d'enceinte) pour l'analyse de Sholl en traçant une ligne entre le début du conduit primaire (centre d'analyse) et le point le plus distal de l'épithélium glandulaire ( Figure 7 ).
- Utilisez l'outil de dessin de ligne dans la barre d'outils pour tracer une ligne entre les points d'intérêt. Appuyez sur la touche "M" pour prendre une mesure et notez qu'une fenêtre de résultats s'ouvrira.
REMARQUE: la valeur de la colonne "Longueur" est la longueur de la ligne en mm. Cette valeur sera automatiquement saisie en tant que rayon de fin lors de la définition des paramètres Sholl. Le plugin Sholl utilisera le point de départDe la ligne comme centre des anneaux centraux.
- Utilisez l'outil de dessin de ligne dans la barre d'outils pour tracer une ligne entre les points d'intérêt. Appuyez sur la touche "M" pour prendre une mesure et notez qu'une fenêtre de résultats s'ouvrira.
- Exécution de l'analyse Sholl.
- Exécutez l'analyse en sélectionnant "Plugins" "Advanced Sholl Analysis;" Une fenêtre de paramètres apparaîtra.
- Réglez le rayon de départ dans "I. Définition des coquilles" à 0,00 mm; La longueur de la ligne mesurée à l'étape 4.2 sera automatiquement entrée en tant que "fin de rayon".
- Réglez la "Taille du gradient de rayon" à 0,1 mm.
REMARQUE: la taille du rayon détermine le nombre d'anneaux (effectivement le nombre d'itérations); Une taille plus petite augmente le nombre d'anneaux, tandis qu'une taille plus grande diminue le nombre d'anneaux. Le rayon ne peut pas être trop petit, bien qu'un rayon excessivement faible entraîne un nombre inutilement important d'anneaux. Cependant, il peut être trop grand, ce qui créera moins d'anneaux et sous-estime le nombre réel d'intersections. Se référer à Stanko et al.(2015) pour plus d'informations sur la détermination de la taille des étapes. - Réglez "# Samples" sur 1 et "Intégration" sur "Moyenne" dans "II. Échantillons multiples par rayon".
- Réglez le "Verrouillage du rayon d'enclenchement" sur 1 et vérifiez "déduire du rayon de départ" pour "# branches primaires" dans "III. Descripteurs et ajustement des courbes".
REMARQUE: "Ajuster les profils de profil et de calcul" et "Afficher les détails de montage" peuvent être vérifiés comme vous le souhaitez. - Cochez "Linéaire" et sélectionnez "Meilleur degré" dans "Profils sans normalisation"; Cochez "Plus informatif". Sélectionnez "Zone pour les profils normalisés" dans "IV. Méthodes Sholl".
- Cochez "Créer des masques d'intersection" dans "V. Options de sortie" pour créer une carte de chaleur des intersections (facultatif).
- Cliquez sur "Cf. Segmentation" pour générer une fenêtre de prévisualisation de l'image avec des anneaux pour confirmer la zoneD'analyse.
- Cliquez sur "OK" pour exécuter l'analyse.
5. Mesurer le MEA
- Mesurez le MEA en traçant la distance la plus courte autour de l'arbre épithélial ( Figure 8 ).
- Dans ImageJ avec l'image squelette de la glande ouverte, cliquez sur l'outil Polygone. Cliquez sur un point sur le périmètre de l'arbre épithélial pour commencer le polygone, déplacez-vous autour du périmètre de la glande et cliquez pour ajouter un segment de ligne.
- Lorsque toute la zone épithéliale a été contournée, double-cliquez pour fermer le polygone. Appuyez sur la touche "M" pour ouvrir une fenêtre de résultats; La valeur dans la colonne "Zone" est le MEA.
- Dans les cas où l'épithélium glandulaire s'est étendu au-delà du ganglion lymphatique, soustrait la zone des ganglions lymphatiques (LNA) du MEA lors du calcul de la densité de ramification.
- Mesurer le LNA en traçant le ganglion lymphatique dans le même mannEr comme l'arbre épithélial et en appuyant sur "M."
NOTE: Le LNA doit être soustrait du MEA dans ces cas car le ganglion lymphatique empêche l'analyse de compter les intersections dans le LNA. Lorsque l'épithélium n'a pas atteint le ganglion lymphatique, le LNA est nul.
- Mesurer le LNA en traçant le ganglion lymphatique dans le même mannEr comme l'arbre épithélial et en appuyant sur "M."
6. Données de rapport
- Indiquer les valeurs pour le rayon d'enceinte, MEA, N, k et la densité de ramification.
REMARQUE: Le rayon d'enceinte est déterminé à l'étape 4.2 et le MEA est déterminé à l'étape 5.1.- Exécutez l'analyse pour générer une fenêtre de résultats Sholl.
REMARQUE: Le rapport N est la valeur pour l'intersection de la somme. Le k signalé est la valeur du coefficient de régression Sholl (semi-journal). L'analyse de Sholl renverra une valeur pour k sur toute région mesurée de l'épithélium glandulaire. Pour obtenir une valeur précise pour k sur l'épithélium complet, les extrémités ducales doivent être présentes. - ModifierE Analyse Sholl pour la glande mammaire en utilisant la valeur de sortie pour N pour calculer la densité de ramification (point final final de cette méthode). Calculez la densité de ramification en utilisant la formule N / (MEA-LNA) et signalez la valeur en N / mm 2 .
- Exécutez l'analyse pour générer une fenêtre de résultats Sholl.
Résultats
Les valeurs pour le rayon entourant mesuré, MEA, N, k et la densité de ramification calculée pour la glande mammaire analysée dans ce protocole sont rapportées dans le tableau 1 . L'analyse Sholl génère des parcelles linéaires et semi-logiques du nombre d'intersections à chaque rayon ( Figure 9 ) et, si sélectionné, une carte de chaleur des intersections ( Figure 10 ). Les glandes moins développées présentent moins d'intersections dans le même MEA et ont donc une densité de ramification plus faible. Une glande bien développée continuera à se ramifier uniformément dans l'ensemble de l'épithélium glandulaire, en particulier dans les régions distales. La mesure dans laquelle la ramification se poursuit dans ces régions peut être décrite comme une complexité de ramification et les diminutions de complexité sont transmises en tant que taux de désintégration (ou coefficient de régression de Sholl, k ). Le taux de désintégration reflète la variation du soutien épithélial distalEt est mesurée comme la pente de la ligne du nombre d'intersections représentées par rapport au rayon d'enceinte ( c.-à-d., La croissance longitudinale de l'épithélium). Ainsi, le coefficient de régression de Sholl est calculé en prenant la pente de la ligne de la parcelle de log (N / S) par rapport à la distance radiale (r), où log (N / S) = - k r + m, N étant Le nombre d'intersections pour chaque anneau de rayon r et la zone S (πr 2 ), et m étant l'interception. Parce que la pente - k décrit la décroissance des intersections, une valeur de - k = 0 indiquerait une désintégration nulle et une ramification uniforme du centre d'analyse au bord de l'épithélium. Dans les glandes peu développées, la dégradation des ramifications augmente; Il y a moins d'intersections dans la région distale de l'arbre épithélial; Et la pente, k , augmente. Par conséquent, les valeurs de k approchant 0 sont indicatives d'une plus grande dérivation distale ( c.-à-d. Complexité de ramification) et d'un puits- glande mammaire développée.
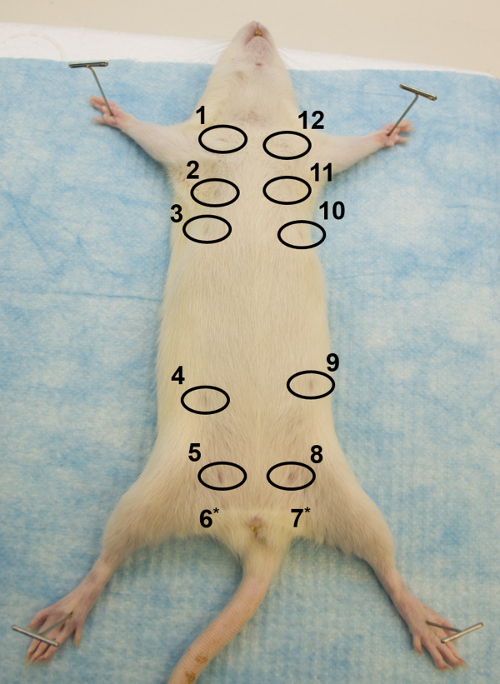
Figure 1: Vue ventrale. Image de la partie ventrale d'un rat Sprague Dawley femelle adulte, illustrant comment sécuriser le rat sur la surface de dissection et l'emplacement des 12 glandes mammaires, avec les tétons encerclés. * Les tétons des glandes 6 et 7 ne sont pas visibles. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2: Glandes mammaires de rat femelles. Illustration des glandes mammaires exposées 4 (MG4) et 5 (MG5), avec la peau fixée à la surface de dissection au-dessus de MG4 et juste en dessous de MG5. Les glandes devraient être retirées du sk En commençant par MG5 et en continuant et dorsal jusqu'à ce que MG5 et 4 soient complètement supprimés. Le mamelon se trouve dans la zone distale de la glande 4, et il faut faire preuve de prudence pour collecter cette zone. Le ganglion lymphatique est indiqué pour référence. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: Gland mammaire entièrement monté. Une image complète d'une glande mammaire recueillie à partir d'un jour postnatal 25 femelles Sprague Dawley rat. Barre d'échelle = 1 mm. Cliquez ici pour voir une version plus grande de ce chiffre.
.jpg "/>
Figure 4: Suppression du bruit. Le canal de couleur bleue d'une image mammaire complète, avec l'arrière-plan soustrait. ( A ) montre des exemples de bruit. Les flèches indiquent le bruit créé par les vaisseaux sanguins, et la région plus fortement ombrée entourant les extrémités ducales est un exemple de bruit créé en soustrayant l'arrière-plan. ( B ) illustre l'image après que le bruit a été supprimé. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5: Reconstruction d'image. Reconstruction des parties effacées de l'image de seuil. ( A ) Les flèches rouges indiquent des régions où des parties de l'image ont été perdues en raison du seuillage. Reconstruction de l'imageUne ruction devrait être effectuée dans ces régions. ( B ) Image mammaire après reconstitution des régions supprimées. La reconstruction de l'image doit être menée avec soin et sur une base minimale afin de maintenir l'intégrité de l'image originale Cliquez ici pour voir une version plus grande de cette image.

Figure 6: superposition d'une image squelettisée. Image superposée montrant une image squelettique superposée à l'image originale intégrale. Cette image démontre que la glande squelettisée reflète la ramification de la glande réelle avec un haut degré de précision. Cliquez ici pour voir une version plus grande de ce chiffre.
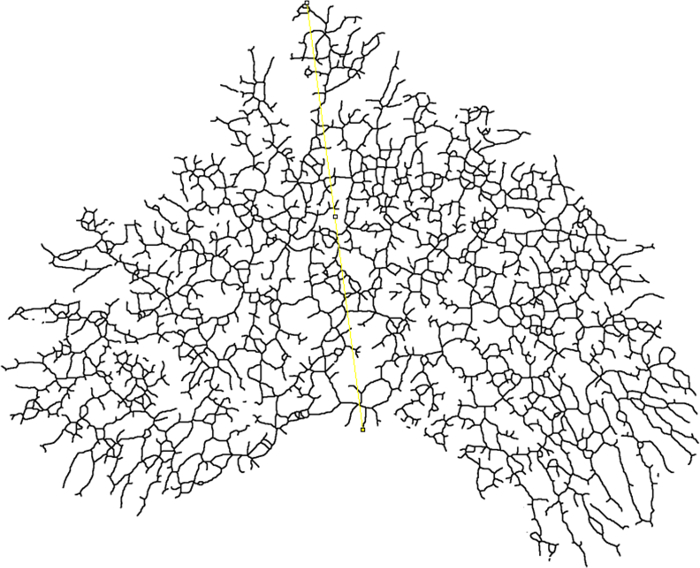
Figure 7: Enclosing Radius. Image squelettisée d'un montage total mammaire montrant où le rayon d'enceinte est mesuré (jaune). La ligne devrait commencer à la base de l'arbre épithélial (centre d'analyse) et s'étend jusqu'au point le plus distal de l'épithélium. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 8: Zone épithéliale mammaire. Image squeletonisée montrant un polygone tracé autour de l'arbre épithélial pour déterminer l'AME. Cliquez ici pour voir un plus grand verDe cette figure.

Figure 9: Sortie de parcelle Sholl. Sortie Sholl des tracés linéaires ( A ) et semi-log ( B ) du nombre d'intersections à chaque incrément radial. Le point rouge dans le panneau (A) est l'abscisse du centroïde (centre géométrique). Dans le panneau (B), la ligne bleue est la régression linéaire sur la gamme complète de données, tandis que la ligne rouge représente la régression linéaire sur la 10 ème -90 ème percentile. Cliquez ici pour voir une version plus grande de ce chiffre.
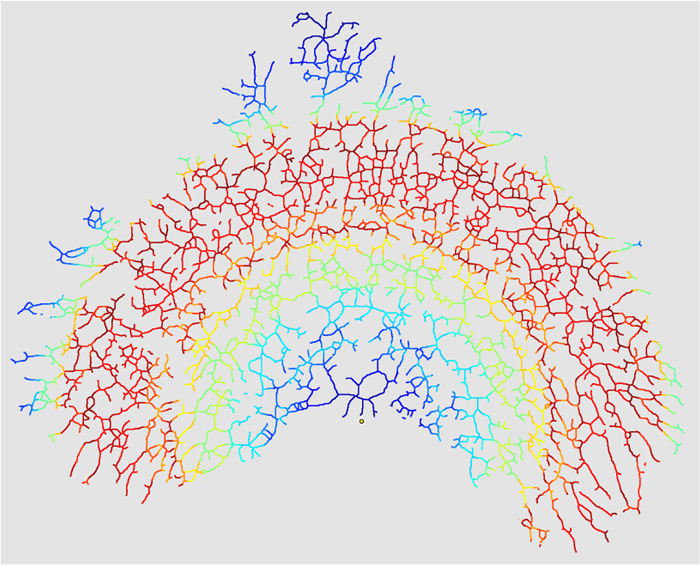
Figure 10: Masque des intersections. Lorsque le "Create InterL'option «Masque de sections» est sélectionnée (étape 4.3.7), l'analyse produira une carte de chaleur du nombre d'intersections dans le rayon de l'image. Cette carte de chaleur reflète la densité des intersections de ramification dans l'épithélium (rouge = chaud = Haute densité: bleu = froid = faible densité). L'épithélium entier serait de la même couleur dans une carte de chaleur d'une image où k = 0. Cliquez ici pour voir une version plus grande de cette figure.
Tableau 1: Paramètres d'analyse Sholl. Les valeurs sont les données déclarées pour l'analyse Sholl. Le rayon d'enclenchement (étape 4.2) et MEA (étape 5.1) sont des valeurs mesurées, N et k sont des résultats d'analyse Sholl et sont renvoyés dans la fenêtre des résultats d'analyse Sholl (étape 6.1.) Et la densité de branchement est calculée selon la formule N / ( MEA-LNA) (étape 6.1.2).
| Enclosing Radius (mm) | MEA (mm2) | N | K | Densité de branchement (N / mm2) |
| 7.4 | 71,7 | 2381 | 0,73 | 33.2 |
Discussion
De la naissance à la puberté, la croissance de la glande mammaire est allométrique. Après la puberté, la glande mammaire se développe grâce à une ramification et un allongement ductal étendus, qui se poursuivent jusqu'à ce que l'épithélium mammaire occupe l'intégralité de la graisse. Les caractéristiques de branchement sont un aspect important du développement de la glande mammaire et la capacité de quantifier objectivement ces caractéristiques peut être très utile pour évaluer le développement mammaire normal et pour identifier un développement anormal suite à une exposition précoce à la vie chez les toxicomanes mammaires.
Les caractéristiques morphologiques marquantes, la quantification des mesures dimensionnelles de base et le comptage des structures mammaires sont des méthodes typiques pour évaluer le développement des glandes mammaires. Cependant, ces méthodes ne sont pas particulièrement sensibles en raison de la variation considérable de la taille et de la forme des glandes mammaires des rongeurs et l'interprétation du développement peut être difficile pour un évaluateur inexpérimenté. En outre, le potentiel deLe biais existe dans des études qui ne sont pas aveuglées correctement. La méthode d'analyse Sholl fournit un protocole efficace pour quantifier avec précision la densité de branche épithéliale mammaire et la complexité de la ramification, les caractéristiques morphologiques discrètes du développement des glandes mammaires, qui peuvent être facilement comparées entre les études et les laboratoires.
Il existe des étapes critiques dans plusieurs sections de ce protocole. Le premier et le plus important concerne l'état de la monture mammaire intégrale. La précision de cette méthode repose sur une glande mammaire qui est entièrement intégrée, montée sans défauts, correctement fixée et colorée, et ne démontre aucune oxydation de la glande ou une décoloration significative du support de montage. Si la glande est déchirée ou pliée, une mesure précise de la densité de ramification ne peut pas être obtenue. Si les extrémités ducales ne sont pas présentes, la valeur pour k ne sera pas représentative de la glande entière. Le seuil sera difficile dans les glandesQui n'ont pas été entièrement corrigés en raison d'un manque de contraste de coloration dans l'épithélium ductal. Et enfin, si l'oxydation ou la décoloration est présente, ces imperfections pourraient empêcher l'analyse de mesurer les intersections dans la zone affectée.
Lorsque des montures entières appropriées ont été préparées, la prochaine étape critique consiste à capturer les images au même grossissement. Il est courant de capturer des images numériques à la plus haute résolution possible. Cependant, pour l'analyse Sholl, il est plus important que toutes les images soient capturées au même grossissement. Comme décrit dans Stanko et al. (2015) 3 , une mise en garde a été découverte où les images de glandes plus petites capturées à un grossissement élevé présentaient des densités de ramification plus importantes que les images de glandes plus grandes capturées à un grossissement inférieur, même si elles apparaissaient visuellement moins développées. Nous avons émis l'hypothèse que le grossissement plus élevé a abouti à plus de détails, qui a été reporté enIl a squelette l'image et a abouti à un N supérieur, qui surreprésentait la densité de ramification des glandes plus petites. Ce problème est atténué en capturant toutes les images au même grossissement.
Bien que la base d'une analyse précise se situe dans l'ensemble, le plus grand potentiel pour les changements influencés par l'utilisateur dans les données d'intersection se situent dans les étapes de l'élimination du bruit. Toutes les images contiennent du bruit, dans une certaine mesure, en raison de l'intensité de coloration, des entités physiologiques non pertinentes ( par exemple, des vaisseaux sanguins) et des artefacts de seuillage. Chaque image doit être traitée indépendamment en raison des variations de la quantité de bruit entre les images. Il faut prendre soin de ne pas enlever trop peu ou trop de bruit, car cela peut fausser le nombre d'intersections et, par conséquent, la densité de ramification. Cependant, la mesure dans laquelle le bruit affecte l'interprétation n'a pas été examinée. L'utilisateur devrait décider combien il est méticuleux d'éliminer le bruit et devrait également faire preuve de consisPour maintenir l'intégrité des images. Il est fortement recommandé que l'utilisateur soit aveuglé au traitement lors de l'élimination du bruit, car cela réduira le potentiel de polarisation. L'élimination du bruit est décrite en détail dans le Guide de l'utilisateur ImageJ 7 . Dans cette procédure, le bruit est supprimé principalement de l'image soustraite en arrière-plan. En outre, le processus de seuillage lui-même peut supprimer des segments de la glande. Les portions de la glande où seuls quelques pixels ont été supprimés seront reconstruites automatiquement lorsque l'image squelettisée est dilatée. Cependant, des lacunes expansives peuvent nécessiter une reconstruction manuelle. L'utilisateur devrait décider si et dans quelle mesure pour reconstruire ces segments, en maintenant l'intégrité des images originales.
Bien que cela ne soit pas critique, il est important de maintenir les mises à jour logicielles, car le logiciel ImageJ est mis à jour fréquemment. Les méthodes décrites ici sont basées sur la version 1.48v. FIJI et le Sholl aNalysis plugin sont également mis à jour régulièrement, et le protocole décrit ici est basé sur v3.4.1. Les modifications apportées dans les versions ultérieures de ImageJ et du plugin Analyse Sholl peuvent affecter ces méthodes. ImageJ vérifie automatiquement les mises à jour, mais les mises à jour pour FIJI doivent être effectuées régulièrement, et les modifications entre les versions actuelles et celles utilisées ici doivent être traitées au besoin. Tous les paramètres sont définis dans les sous-titres sur la page Web de l'Analyse Sholl 6 . Les paramètres dans cette procédure sont basés sur des images capturées à partir de montures entières de glande mammaire créées dans notre laboratoire et ne sont pas absolues. La préparation intégrale varie d'un laboratoire à l'autre, et ces paramètres peuvent être ajustés en conséquence afin d'optimiser les images et les résultats.
L'ensemble complet de la glande mammaire utilisé dans cette étude provient d'une femelle Sprague Dawley rat au PND 25 et la méthode a été appliquée de manière appropriée et sans limites. Chez le rat, la densité épithéliale mammaire incPasse avec l'âge jusqu'à un point où il empêche le seuillage de l'image avec une résolution suffisamment élevée pour générer une image squelettisée précise de la glande. Par conséquent, nous ne recommandons actuellement pas d'utiliser cette méthode sur les glandes provenant de rats antérieurs à PND40. Bien que la souche du rat a été indiquée ici, elle n'est pas pertinente, car les auteurs ne connaissent pas actuellement de traces mammaires spécifiques à la souche qui empêcheraient l'utilisation de cette méthode. En outre, alors que la méthode décrite ci-dessus a été réalisée en utilisant un rat femelle, elle pourrait également être appliquée aux glandes mammaires de rats mâles. Cette application a également été utilisée efficacement avec des monts complets de souris (Deirdre Tucker, communication personnelle) et devrait convenir à des souris de n'importe quel âge, car les glandes mammaires chez la souris ne poussent pas aussi denses que chez les rats. Cependant, il existe deux limitations dans l'utilisation de cette application chez la souris: 1) il peut y avoir trop peu d'intersections dans des souris plus jeunes pour détecter des différences importantes et 2) cette méthode ne peut pasT être appliqué à des souris mâles, car ils ne présentent pas d'épithélium mammaire. Quoi qu'il en soit, cette méthode automatisée est plus rapide, impartiale et beaucoup moins exigeante en main-d'œuvre que de comptabiliser les intersections de branchement manuellement.
Il est possible que les chercheurs souhaitent utiliser la glande mammaire pour d'autres techniques expérimentales, telles que l'excision de structures anormales ou l'immunohistochimie (IHC). Bien que Tucker et al. (2016) ont décrit un procédé de préparation d' une section hématoxyline-éosine teinté d'un tout montage, 8 on considère généralement la glande mammaire de la souris créant tout-monter un être un processus terminal et ne savent pas de méthodes d'utilisation d' un whole- Monté mammaire pour les tests sensibles supplémentaires, tels que les tests IHC ou TUNEL. Lorsque des tests sensibles utilisant un tissu de glandes mammaires sont nécessaires en conjonction avec des ensembles entiers, il est recommandé d'utiliser les glandes mammaires contralatérales.
La glande mammaire continue tO soit le point focal dans un nombre croissant d'études, mais les différences entre les laboratoires existent dans la préparation intégrale 9 , 10 , 11 , 12 et les évaluations du développement 13 , 14 , 15 . La modification de l'analyse Sholl décrite ici fournit une méthode standardisée pour la quantification objective de la densité de ramification, une caractéristique importante du développement de la glande mammaire, dans la glande mammaire des rongeurs. Cette méthode peut être appliquée à des ensembles mammaires complets de rongeurs mâles ou femelles et, bien qu'il soit actuellement recommandé pour être utilisé uniquement dans les glandes pré-postnatales à peripuberales chez les rats, il peut être appliqué aux glandes mammaires de souris de tous âges. L'application est particulièrement appropriée pour les glandes mammaires recueillies chez les rongeurs peripubertiques car cette période est recommandéePoint final pour la préparation du support total mammaire dans les études de référence de test. L'optimisation de cette méthode pour l'utilisation dans les glandes mammaires plus denses des rats adultes est en cours d'étude.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs souhaitent remercier le Dr Michael Easterling (Social and Scientific Systems, Inc., Durham, NC) pour son aide à la validation de cette méthode et le Dr Tiago Ferreira (Université McGill, Montréal, Québec, Canada) pour son continu Aide à l'application Sholl.
matériels
| Name | Company | Catalog Number | Comments |
| Dissecting board | NA | NA | A piece of styrofoam roughly 10"x12" is suitable. |
| Dissecting T-Pins | Daigger | EF7419A | |
| Spray bottle with ethanol | NA | NA | 70% ethanol is suitable. |
| Curved dissecting scissors | Fine Science Tools | 14569-09 | |
| Straight dissecing scissors | Fine Science Tools | 14568-09 | |
| Curved forceps | Fine Science Tools | 11003-12 | |
| Superfrost Plus 24 x 75 x 1 mm microscope slides | ThermoFisher Scientific | 4951PLUS-001 | Thermo Scientific Superfrost Plus & Colorfrost Plus slides hold tissue sections on permanently without the need for expensive coatings in IHC and Anatomical Pathology applications. This treatment reduces tissue loss during staining as well as hours of slide preparation. Slides electro-statically attract frozen tissue sections and cytology preparations and feature a chemistry similar to silane, although optimized to improve application performance. https://www.thermofisher.com/order/catalog/product/4951PLUS4. |
| Fisherfinest Premium Cover Glass 24 x 60 x 1 mm | Fisher scientific | 12-548-5P | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher scientific | 13-374-12 | |
| Chloroform | Sigma-Aldrich | C2432 | |
| Glacial acetic acid | Sigma-Aldrich | A9967 | |
| Ethanol absolute, ≥99.8% (GC) | Sigma-Aldrich | 24102 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Carmine alum | Sigma-Aldrich | C1022 | |
| Aluminum potassium sulfate | Sigma-Aldrich | A6435 | |
| Permount mounting media | Fisher Scientific | SP15 | |
| Macroscope | Leica | Z16 APO | This is the image capturing hardware and software used in this laboratory. As there are many different options, the methods and applications may vary between laboratories. |
| Digital camera | Leica | DFC295 | |
| Camera software | Leica | Leica Application Suite v3.1 | |
| ImageJ software | Open source | http://imagej.net/Welcome | |
| Sholl analysis | Open source | http://imagej.net/Sholl_Analysis |
Références
- Sholl, D. A. Dendritic organization of the neurons in the visual and motor cortices of the cat. J Anat. 87 (4), 387-406 (1953).
- Ferreira, T. A., Iacono, L. L., Gross, C. T. Serotonin receptor 1A modulates actin dynamics and restricts dendritic growth in hippocampal neurons. Eur J Neurosci. 32 (1), 18-26 (2010).
- Stanko, J. P., Easterling, M. R., Fenton, S. E. Application of Sholl analysis to quantify changes in growth and development in rat mammary gland whole mounts. Reprod Toxicol. 54, 129-135 (2015).
- Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in Mammary Gland Morphology and Breast Cancer Risk in Rats. J. Vis. Exp. (44), e2260(2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of Mammary Gland Development and Function in Mouse Models. J. Vis. Exp. (53), e2828(2011).
- Ferreira, T. Sholl Analysis. ImageJ. , Available from: http://imagej.net/Sholl_Analysis (2012).
- Ferreira, T., Rasband, W. ImageJ User Guide. IJ 1.46r. ImageJ. , Available from: https://imagej.nih.gov/ij/docs/guide/146.html (2012).
- Tucker, D. K., Foley, J. F., Hayes-Bouknight, S. A., Fenton, S. E. Preparation of High-quality Hematoxylin and Eosin-stained Sections from Rodent Mammary Gland Whole Mounts for Histopathologic Review. Toxicol Pathol. 44 (7), 1059-1064 (2016).
- Fenton, S. E., Hamm, J. T., Birnbaum, L. S., Youngblood, G. L. Persistent abnormalities in the rat mammary gland following gestational and lactational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Toxicol Sci. 67 (1), 63-74 (2002).
- Murray, T. J., Maffini, M. V., Ucci, A. A., Sonnenschein, C., Soto, A. M. Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure. Reprod Toxicol. 23 (3), 383-390 (2007).
- Moral, R., Santucci-Pereira, J., Wang, R., Russo, I. H., Lamartiniere, C. A., Russo, J. In utero exposure to butyl benzyl phthalate induces modifications in the morphology and the gene expression profile of the mammary gland: an experimental study in rats. Environ Health. 10 (1), 5(2011).
- Johnson, M. D., Mueller, S. C. Three dimensional multiphoton imaging of fresh and whole mount developing mouse mammary glands. BMC Cancer. 13, 373(2013).
- Enoch, R. R., Stanko, J. P., Greiner, S. N., Youngblood, G. L., Rayner, J. L., Fenton, S. E. Mammary gland development as a sensitive end point after acute prenatal exposure to an atrazine metabolite mixture in female Long-Evans rats. Environ Health Persp. 115 (4), 541-547 (2007).
- Hovey, R. C., Coder, P. S., Wolf, J. C., Sielken, R. L., Tisdel, M. O., Breckenridge, C. B. Quantitative assessment of mammary gland development in female Long Evans rats following in utero exposure to atrazine. Toxicol Sci. 119 (2), 380-390 (2011).
- Mandrup, K. R., Hass, U., Christiansen, S., Boberg, J. Perinatal ethinyl oestradiol alters mammary gland development in male and female Wistar rats. Inter J of Androl. 35 (3), 385-396 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon