Method Article
Quantificazione della densità di raggruppamento nelle ghiandole del mammella di ratto intere con il metodo di analisi di Sholl
In questo articolo
Riepilogo
Lo sviluppo della ghiandola mammaria nel roditore è stato tipicamente valutato utilizzando valutazioni descrittive o misurando gli attributi fisici di base. La densità di derivazione è un indicatore dello sviluppo mammario che è difficile da quantificare in modo oggettivo. Questo protocollo descrive un metodo affidabile per la valutazione quantitativa delle caratteristiche di ramificazione delle ghiandole mammarie.
Abstract
Un numero crescente di studi stanno utilizzando la ghiandola mammaria di roditore come un endpoint per valutare la tossicità dello sviluppo di un'esposizione chimica. Gli effetti che queste esposizioni hanno sullo sviluppo delle ghiandole mammarie sono tipicamente valutate utilizzando misure di dimensione basale o rilevando caratteristiche morfologiche. Tuttavia, l'ampia gamma di metodi per interpretare i cambiamenti nello sviluppo può portare a traduzioni incoerenti tra i laboratori. È necessario un metodo comune di valutazione in modo che possano essere formate delle correttive interpretazioni dai dati che vengono confrontati negli studi. Il presente studio descrive l'applicazione del metodo di analisi di Sholl per quantificare le caratteristiche di ramificazione delle ghiandole mammarie. Il metodo Sholl è stato originariamente sviluppato per l'uso nella quantificazione dei modelli neuronali dendritici. Utilizzando ImageJ, un pacchetto software di analisi di immagini open source e un plugin sviluppato per questa analisi, la densità di ramificazione della ghiandola mammaria e la complessità diLa ghiandola ammia da un ratto femminile peripubertale è stata determinata. I metodi qui descritti consentiranno l'utilizzo dell'analisi di Sholl come uno strumento efficace per quantificare una caratteristica importante dello sviluppo della ghiandola mammaria.
Introduzione
La ramificazione delle ghiandole mammarie è una caratteristica che comunemente viene valutata come indicatore dello sviluppo delle ghiandole, ma è difficile quantificare oggettivamente. Nel 1953, Sholl 1 descritto un metodo per misurare neuronale arborization dendritiche nella corteccia motorie e visive del gatto, e un plugin per questa tecnica è stata sviluppata da Ferriera et al 2. Poiché entrambi i neuroni e le ghiandole mammarie presentano una struttura simile ad albero, il plugin è stato impiegato per quantificare la densità di ramificazione epiteliale mammaria in immagini 2D della ghiandola mammaria del ratto peripubertale. Lo stadio peripubertale è stato scelto per l'analisi perché lo svezzamento è una fase di vita spesso valutata nei laboratori accademici e negli studi di orientamento test. L'analisi di Sholl è un plugin distribuito con FIJI, il pacchetto ImageJ di elaborazione delle immagini open source, con plugin aggiuntivi inclusi. Il plugin crea una serie di anelli concentrici che circondano un predef(In genere il soma di un neurone o l'origine del condotto primario di una ghiandola mammaria) e che si estende fino alla parte più distale dell'oggetto (il raggio di chiusura). Quindi conta il numero di intersezioni (N) che si verificano su ciascuno degli anelli. Il plugin restituisce anche un coefficiente di regressione Sholl ( k ), che è una misura della velocità di decadimento della ramificazione epiteliale.
Usando ImageJ, viene creata un'immagine scheletrata di una ghiandola mammaria completa e viene misurata l'area epiteliale mammaria (MEA). L'immagine viene analizzata usando il plugin di analisi di Sholl e vengono restituiti i valori per N e k , tra gli altri valori non utilizzati qui. La densità di ramificazione dell'epitelio mammario è determinata calcolando N / MEA. La misura in cui la ramificazione continua nelle regioni esterne dell'epitelio ghiandolare è la complessità di ramificazione e rappresenta un indicatore di crescita uniforme epiteliale distale. Come k è una misura della diminuzione distale dell'epitRamificazione elitaria, è una misura efficace della complessità di ramificazione e un indicatore affidabile dello sviluppo mammario.
Questo protocollo descrive un metodo informatico assistito per la creazione di immagini scheletriche di ghiandole mammarie e di valutare quantitativamente le caratteristiche di ramificazione del mammario nei ratti maschi e femmine peripubertali. Questo metodo è relativamente rapido e non richiede l'uso di apparecchiature microscopiche specializzate. Lo sviluppo e la convalida di questo metodo sono descritti in Stanko et al. (2015) 3 . Questo rapporto descrive anche la preparazione di ghiandole mammarie di ratto whole = montanti. Sono state descritte procedure similari di mammary intere montagne in Assis et al. (2010) 4 e Plante et al. (2011) 5 .
Protocollo
Tutti gli usi animali e le procedure per questo studio sono state approvate dal comitato di cura e uso degli animali di laboratorio NIEHS e condotte in un'Associazione per la valutazione e l'accreditamento della struttura accreditata per la cura degli animali da laboratorio.
1. Ghiandole mammarie di accisa
- Pre-etichettare tutte le diapositive utilizzando un metodo a prova di xilene (la matita funziona meglio). Coprire con una soluzione di montaggio alla fine per conservare l'etichetta.
- Eutanizzare l'animale da un metodo approvato dal Comitato istituzionale per la cura degli animali.
- Dopo l'eutanasia, posizionare l'animale sulla schiena su una tavola di dissezione ( Figura 1 ). Stretch e pin down tutti e quattro le membra, con gli arti posteriori che formano un V invertito (pin di aggancio o piccoli aghi funzionano bene).
- Spruzzare l'addome liberamente con il 70% di etanolo per mantenere i capelli fuori dal campione mammario.
- Usando le pinze, sollevare la pelle addominale alla linea mediana e fare una piccola incisione conForbici di dissezione, facendo attenzione a non perforare il peritoneo.
- A partire dall'incisione, tagliare la pelle fino alla regione del collo e quindi distalmente all'arto anteriore. Tagliare verso la regione inguinale e quindi distalmente al primo giunto dell'arto posteriore sullo stesso lato; Questa incisione solitamente separa le ghiandole mammarie 5 e 6. Evitare di tagliare il peritoneo.
- Tirare indietro la pelle con l'apposito tampone grasso mammario usando le pinze, separandola delicatamente dal peritoneo usando la fine punta delle forbici di dissezione. Separare il più possibile dorsale per esporre pienamente le ghiandole mammarie del 4 ° e 5 ° inguinale sulla parte inferiore della pelle; Applicare la pelle alla scheda di dissezione ( Figura 2 ).
- Afferrare delicatamente il tessuto mammario della 5a ghiandola con il lato arrotondato delle pinze curve e tagliare lentamente la ghiandola dalla pelle, facendo attenzione a non assalire la ghiandola o la pelle.
- Continuare a tagliare,spostando dorsalmente fino ghiandole 4 ° e 5 ° sono stati completamente sollevato dalla pelle. Assicurarsi che la regione del capezzolo sia rimossa con il resto della ghiandola, in quanto questo è il punto di partenza dell'analisi di Sholl. Tagliare il tessuto mammario lontano dal corpo dove è attaccato alla ghiandola 4.
- Una volta che la ghiandola viene rimossa dall'animale, spargli uniformemente su uno scivolo a microscopia da 25 mm x 75 mm x 1 mm, elettrostaticamente, con il lato adiacente alla pelle rivolta verso il basso.
NOTA: Per le ghiandole di animali anziani o allattanti, può essere necessaria una scivolata da 51 x 75 x 1 mm. - Durante l'uso di guanti, estrarre delicatamente le bolle d'aria. Coprire la ghiandola con una pellicola di paraffina di plastica e un'altra diapositiva del microscopio e comprimere la ghiandola per aderire alla diapositiva.
NOTA: Un tubo conico da 50 ml riempito con acqua serve come un peso adeguato. La quantità di tempo necessaria per aderire alla diapositiva dipende dallo spessore della ghiandola. Sottile, postale(PND) 4 ghiandole devono essere compresse per un minimo di 30 minuti, mentre le ghiandole adulti più spesse possono richiedere fino a 2-5 h.
2. Preparare i montanti interi a mammiferi
- Preparare la soluzione di alluminio di carminio almeno 24 ore in anticipo, in quanto richiede bollitura e refrigerazione.
- Sciogliere 1 g di allume di carminio e 2,5 g di solfato di potassio di alluminio (AlK (SO 4 ) 2 · 12H 2 O) in 500 ml di acqua distillata e far bollire per 20 minuti in un pallone da 1 lt. Portare il volume finale a 500 mL utilizzando acqua distillata.
- Filtrare la soluzione con carta filtrante sotto vuoto e refrigerare per la conservazione.
NOTA: La soluzione di alluminio del Carmine può essere riutilizzata ma deve essere scartata quando il colore inizia a svanire.
- Prima di fissare, sfilare la pellicola paraffina fuori dalla ghiandola, facendo attenzione a non tirare la ghiandola dalla diapositiva. Posizionare il vetrino in un contenitore di verniciatura a vetro e immergere nel fissativo (100% ethanOl, cloroformio e acido acetico glaciale in rapporto 6: 3: 1) per 12-48 h, a seconda dello spessore delle ghiandole.
- Versare il fissativo e immergere le ghiandole in etanolo del 70% per 15 minuti. Riabbassare gradualmente le ghiandole versando 1/3 della soluzione di etanolo e sostituendola con acqua distillata. Immergere per 5 min. Ripetere questo processo tre volte.
- Dopo il risciacquo finale versare tutta la soluzione di etanolo / acqua e sostituirla con acqua al 100% distillata. Immergere le glandule per 5 minuti.
- Versare l'acqua distillata e immergere le ghiandole nella soluzione di alluminio di carminio. Infilare le ghiandole per 12-24 ore, a seconda dello spessore.
NOTA: Le ghiandole non possono essere sovraccaricate, ma il tempo di colorazione per i lotti multipli dovrebbe essere lo stesso, in modo che l'intensità di colorazione sia la stessa. - Versare la soluzione di alluminio di carminio e sciacquare le ghiandole in acqua distillata al 100% per 30 s. Deglutire gradualmente le ghiandole imbevando di etanolo al 70% per 15 minuti, il 95% di etanolo per 15 minuti,Nd 100% etanolo per 20 minuti.
- Sgrassare le ghiandole di grasso addolcendole in xilene per 12-72 h, a seconda dello spessore.
NOTA: Le ghiandole devono essere traslucide (chiare). Se rimangono aree opache (biancastre), continuare a immergere in xilene fino a traslucido. Se le ghiandole in allattamento o altrimenti molto spesso vengono macchiate e schiarite, il xilene potrebbe essere necessario sostituire una volta per eliminare completamente le ghiandole. - Montare le diapositive con un mezzo di montaggio a base di xilene pipettando un mezzo sufficiente per coprire la ghiandola. Aggiungere una copertura, assicurandosi che non si formino bolle d'aria.
- Lasciare asciugare le diapositive. Quando il supporto di asciugatura si conclude sotto la copertura e potrebbe essere necessario aggiungere un supporto di montaggio supplementare. Una volta che non è necessario un supporto aggiuntivo, lasciare che le diapositive si asciugano completamente; Questo può richiedere 2-3 settimane.
- Una volta che le diapositive sono completamente asciutte, qualsiasi supporto di montaggio residuo può essere rimosso con un tampone di cotone e una piccola quantità di xilene. Fare attenzione a non utilizzareTroppo xilene, poiché questo può sciogliere il supporto di montaggio e allentare la copertura. Se questo accade e le bolle d'aria raccolgono sotto la copertura, la copertura deve essere rimossa in xilene e il processo di montaggio deve essere ripetuto.
3. Preparare immagini intere per l'analisi
- Cattura immagini di interi montanti ( Figura 3 ) utilizzando un microscopio macroscopico o dissezione e una fotocamera digitale con il software appropriato.
NOTA: Mentre è possibile selezionare qualsiasi ingrandimento che cattura l'intero epitelio ghiandolare, è imperativo catturare tutte le immagini montate intere che verranno confrontate l'uno con l'altro allo stesso ingrandimento. - Scaricare il software ImageJ (o il software FIJI) 6 .
- Apri l'immagine di montatura mammaria in ImageJ facendo clic su "File" → "Apri". Seleziona lo strumento Freehand e traccia l'epitelio ghiandolare. Seleziona "Modifica" & #8594; "Cancella all'esterno".
- Rimuovi i linfonodi tracciando attorno al nodo e usando lo strumento Freehand e "Modifica" → "Taglia".
- Separare i canali di colore selezionando "Immagine" → "Colore" → "Split Channels". Selezionare il canale con il migliore contrasto, tipicamente il canale blu.
NOTA: un'immagine RGB consiste di una pila di componenti rossi, verdi e blu dell'immagine. Questa azione separa questi componenti in tre immagini in scala di grigi a 8 bit. - Sottrai lo sfondo selezionando "Processo" → "Sottrarre sfondo". Scegli i parametri desiderati e fai clic su "Anteprima" per visualizzare in anteprima le modifiche.
NOTA: "Sottrazione dello sfondo" rimuove gli sfondi lisci e continui. Inoltre, è possibile utilizzare "Process" → "Filtri" → "Maschera non danneggiata" per creare il contrasto. - Scegli una delle tue E seguenti metodi per eliminare automaticamente il rumore: despeckle o rimuovere outliers.
NOTA: ImageJ offre un terzo metodo per la rimozione automatica del rumore: rimuovere NaNs. Tuttavia, il comando rimuovi NaNs non è applicabile in quanto utilizza immagini a 32 bit e il metodo corrente utilizza immagini a 8 bit.- Rimuovere il rumore usando il comando despeckle selezionando "Processo" → "Rumore" → "Despeckle".
NOTA: Ciò equivale ad aggiungere un filtro mediano, che sostituisce ogni pixel con il valore mediano nel suo quartiere 3 × 3. - Rimuovere il rumore usando il comando rimuovi outliers selezionando "Processo" → "Rumore" → "Rimuovi Outliers".
NOTA: Questo processo sostituisce un pixel con il mediano dei pixel nell'ambiente immediato se si discosta dal mediano di più di un determinato valore (la soglia).
- Rimuovere il rumore usando il comando despeckle selezionando "Processo" → "Rumore" → "Despeckle".
- Rimuovere manualmente qualsiasi rumore residuo (Lass = "xfig"> Figura 4).
- Apri una copia dell'immagine originale e usa questa guida come guida per ciò che è e cosa non è rumore. Fai clic sul pulsante a doppia freccia rossa nell'estrema destra della barra degli strumenti. Selezionare gli Strumenti di disegno; I pulsanti dell'attrezzo di disegno vengono visualizzati nella barra degli strumenti.
- Fare clic sullo strumento Eraser. Regolare il diametro della gomma facendo clic con il pulsante destro del mouse sul pulsante strumento Eraser. Tenere premuto il pulsante sinistro del mouse per cancellare il rumore.
NOTA: è possibile annullare solo una sessione di cancellazione. Una volta rilasciata e cliccata nuovamente il pulsante sinistro del mouse, la cancellazione precedente non può essere annullata.
- Regolare la soglia selezionando "Immagine" → "Regola" → "Soglia". Spostare i cursori per regolare i valori di soglia minima (cursore superiore) e massimo (inferiore del cursore) fino a ottenere una rappresentazione adeguata della ghiandola.
NOTA: l'impostazione del valore di soglia segna le immagini in scala di grigi in funzioni di interesse e di sfondo.- Fare clic su Applica. Se necessario, rimuovere il rumore aggiuntivo a questo punto seguendo i passaggi 3.6.1 e 3.6.2.
- Ricostruire le porzioni dell'epitelio ghiandolare che sono state rimosse dalla soglia e dalla rimozione del rumore ( Figura 5 ).
- Eseguire la ricostruzione dell'immagine con cura e su base minima per mantenere l'integrità dell'immagine originale. Fare riferimento all'immagine originale per un riferimento a ciò che è e cosa non è epitelio.
- Fare clic sullo strumento Spray Can (sulla barra degli strumenti con gli Strumenti di disegno). Regolare il diametro e la velocità dello spruzzo facendo clic con il pulsante destro del mouse sul pulsante utensile a spruzzo. Compilare con cura i tratti mancanti della ghiandola facendo clic o tenendo premuto il pulsante sinistro del mouse.
- Creare un'immagine scheletrata della ghiandola per condurre l'analisi di Sholl. Assicurarsi che l'immagine soglia sia binaria selezionando "Processo" → "Binario" → "Crea B fabbrica di alcune componenti."
- Se l'immagine è bianca su sfondo nero, seleziona "Processo" → "Binario" → "Opzioni" e deseleziona "Sfondo nero". Skeletonizzare l'immagine selezionando "Processo" → "Binario" → "Skeletonize".
NOTA: Rimuove ripetutamente i pixel dai bordi dell'immagine binaria finché non viene ridotta a una forma a pixel singolo. - Dilare l'immagine una volta selezionando "Processo" → "Binario" → "Dilata".
NOTA: questo riempie le lacune create dalla soglia e dagli scheletrizione aggiungendo i pixel ai bordi dell'immagine binaria.
- Se l'immagine è bianca su sfondo nero, seleziona "Processo" → "Binario" → "Opzioni" e deseleziona "Sfondo nero". Skeletonizzare l'immagine selezionando "Processo" → "Binario" → "Skeletonize".
- Salvare l'immagine selezionando "File" → "Salva con nome". Selezionare un tipo di immagine (in genere jpeg), immettere il nome del file e fare clic su "OK".
- Controllare l'esattezza dell'immagine scheletrata sovrapponendo l'immagine scheletrata sull'immagine originale (Ass = "xfig"> Figura 6).
- Creare un overlay aprendo sia l'immagine originale che l'immagine scheletrata. Seleziona "Immagine" → "Sovrapposizione" → "Aggiungi immagine". Nella finestra di dialogo "Aggiungi immagine", selezionare l'immagine scheletrica dal menu a discesa "Image to Add" e impostare l'opacità al 30%.
- Salvare l'immagine dell'immagine dello scheletro sovrapposto all'originale selezionando "File" → "Salva con nome". Selezionare un tipo di immagine, immettere il nome del file e fare clic su "OK".
4. Condurre l'analisi di Sholl
- Apri un'immagine a scheletro e fai l'immagine binaria selezionando "Processo" → "Binario" → "Crea binario".
- Prima di impostare la scala di ingrandimento, misurare il numero di pixel / mm utilizzando un micrometro per l'ingrandimento alle quali sono state catturate le immagini.
- Impostare l'ingrandimento misurato sCale selezionando "Analizza" → "Imposta scala". Inserisci il numero di pixel / mm. Impostare "Distanza nota" e "Rapporto di aspetto pixel", entrambi a 1. Immettere "mm" per "Unità di lunghezza" e controllare "Globale" (mantiene la stessa scala per ogni immagine).
- Determinare il raggio finale (raggio di chiusura) per l'analisi di Sholl tracciando una linea dall'inizio del condotto primario (centro di analisi) al punto più distale dell'epitelio ghiandolare ( Figura 7 ).
- Utilizzare lo strumento di disegno linea sulla barra degli strumenti per tracciare una linea tra i punti di interesse. Premere il tasto "M" per eseguire una misurazione e notare che verrà aperta una finestra dei risultati.
NOTA: Il valore nella colonna "Lunghezza" è la lunghezza della linea in mm. Questo valore verrà automaticamente inserito come Raggio finale durante l'impostazione dei parametri di Sholl. Il plugin Sholl utilizzerà il punto di partenzaDella linea come centro degli anelli centrici.
- Utilizzare lo strumento di disegno linea sulla barra degli strumenti per tracciare una linea tra i punti di interesse. Premere il tasto "M" per eseguire una misurazione e notare che verrà aperta una finestra dei risultati.
- Eseguire l'analisi di Sholl.
- Esegui l'analisi selezionando "Plugins" "Advanced Sholl Analysis;" Apparirà una finestra di parametro.
- Impostare il raggio di avvio in "I. Definizione delle coperture" a 0,00 mm; La lunghezza della linea misurata nel punto 4.2 verrà automaticamente immessa come "Raggio finale".
- Impostare la "misura del passo del raggio" a 0,1 mm.
NOTA: il formato del passo del raggio determina il numero di anelli (effettivamente il numero di iterazioni); Una dimensione minore di passo aumenterà il numero di squilli, mentre una dimensione maggiore del passo diminuirà il numero di squilli. Il raggio non può essere impostato troppo piccolo, anche se un raggio eccessivamente piccolo determina un numero inutilmente di anelli. Tuttavia, può essere impostato troppo grande, che crea meno anelli e successivamente sottovaluti il vero numero di intersezioni. Fare riferimento a Stanko et al.(2015) per ulteriori informazioni sulla determinazione della dimensione del passo. - Impostare "# campioni" a 1 e "Integrazione" a "Medio" in "II campioni multipli per raggio".
- Impostare il campo "raggruppamento di raggio" a 1 e controllare "inferire dal raggio di inizio" per "# rami primarie" in "Descrittori III e montaggio curva".
NOTA: può essere controllato come desiderato "Adatta profilo e calcolo dei descrittori" e "Mostra dettagli di montaggio". - Controllare "Lineare" e selezionare "Miglior grado di adattamento" in "Profili senza normalizzazione"; Controlla "più informativo". Selezionare "Area per i profili normalizzati" in "Metodi IV. Sholl".
- Controllare "Crea maschera intersezioni" in "V. Opzioni di uscita" per creare una mappa termica delle intersezioni (opzionale).
- Fai clic su "Cfr. Segmentazione" per generare una finestra di anteprima dell'immagine con gli anelli per confermare l'areaDi analisi.
- Fai clic su "OK" per eseguire l'analisi.
5. Misurazione del MEA
- Misurare l'MEA tracciando la distanza più breve intorno all'albero epiteliale ( Figura 8 ).
- In ImageJ con l'immagine scheletrica della ghiandola aperta, fare clic sullo strumento Poligono. Fare clic su un punto sul perimetro dell'albero epiteliale per iniziare il poligono, spostarsi intorno al perimetro della ghiandola e fare clic per aggiungere un segmento di riga.
- Quando l'intera zona epiteliale è stata elusa, fare doppio clic per chiudere il poligono. Premere il tasto "M" per aprire una finestra di risultati; Il valore nella colonna "Area" è il MEA.
- Nei casi in cui l'epitelio ghiandolare si estende oltre il linfonodo, sottrarre l'area linfonodale (LNA) dalla MEA quando si calcola la densità di ramificazione.
- Misurare l'LNA tracciando il linfonodo nello stesso mannEr come l'albero epiteliale e premendo "M."
NOTA: L'LNA deve essere sottratto dalla MEA in questi casi perché il linfonodo impedisce l'analisi di contare le intersezioni all'interno dell'LNA. Quando l'epitelio non ha raggiunto il linfonodo, l'LNA è zero.
- Misurare l'LNA tracciando il linfonodo nello stesso mannEr come l'albero epiteliale e premendo "M."
6. Dati di segnalazione
- Valori del rapporto per il raggio di chiusura, MEA, N, k , e la densità di ramificazione.
NOTA: Il raggio di chiusura è determinato nel passaggio 4.2 e il MEA è determinato nel punto 5.1.- Esegui l'analisi per generare una finestra dei risultati di Sholl.
NOTA: Il N riportato è il valore per gli inters di somma. Il rapporto k è il valore del coefficiente di regressione di Sholl (semi-log). L'analisi di Sholl restituirà un valore per k su qualsiasi regione misurata dell'epitelio ghiandolare. Per ottenere un valore preciso per k sull'intero epitelio, le estremità ductali devono essere presenti. - Modifica thE Sholl per la ghiandola mammaria usando il valore di uscita per N per calcolare la densità di ramificazione (l'endpoint fondamentale di questo metodo). Calcolare la densità di ramificazione utilizzando la formula N / (MEA-LNA) e riportare il valore come N / mm 2 .
- Esegui l'analisi per generare una finestra dei risultati di Sholl.
Risultati
I valori per il raggio racchiuso misurato, MEA, N, k e la densità di ramificazione calcolata per la ghiandola mammaria analizzati in questo protocollo sono riportati nella tabella 1 . L'analisi di Sholl genera diagrammi lineari e semi-log del numero di intersezioni ad ogni raggio ( Figura 9 ) e, se selezionato, una mappa termica delle intersezioni ( Figura 10 ). Le ghiandole meno sviluppate presentano meno intersezioni all'interno della stessa MEA e quindi hanno una densità di ramificazione inferiore. Una ghiandola ben sviluppata continuerà a raggrupparsi uniformemente in tutto l'epitelio ghiandolare, in particolare nelle regioni distali. La misura in cui si prosegue la ramificazione in queste regioni può essere descritta come la complessità di ramificazione e le diminuzioni della complessità vengono trasmesse come un tasso di decadimento (o coefficiente di regressione di Sholl, k ). Il tasso di decadenza riflette la modifica del reggiseno epiteliale distaleNching e viene misurata come pendenza della linea del numero di intersezioni tracciate contro il raggio di chiusura ( cioè la crescita longitudinale dell'epitelio). Quindi, il coefficiente di regressione di Sholl viene calcolato assumendo la pendenza della linea del diagramma di log (N / S) rispetto alla distanza radiale (r), dove log (N / S) = - k r + m, con N essendo Il numero di intersezioni per ciascun anello di raggio r e area S (πr 2 ), e m è l'intercetta. Poiché la pendenza - k descrive il decadimento delle intersezioni, un valore di - k = 0 indicherebbe un decadimento zero e una ramificazione uniforme dal centro dell'analisi al bordo dell'epitelio. Nelle ghiandole poco sviluppate, la decadimento di ramificazione è aumentata; Ci sono meno intersezioni nella regione distale dell'albero epiteliale; E la pendenza, k , è aumentata. Pertanto, i valori di k che si avvicina a 0 sono indicativi di una maggiore distillazione distale ( cioè, complessità di ramificazione) e di un pozzo- la ghiandola mammaria sviluppata.
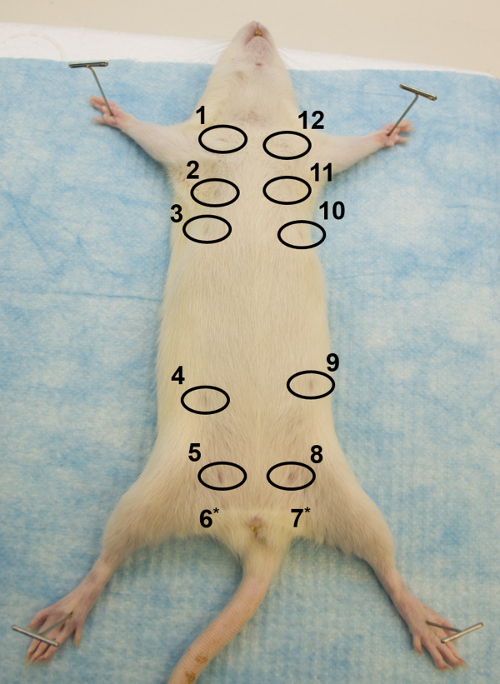
Figura 1: Vista ventrale. Immagine della porzione ventrale di un femmina adulte Sprague Dawley ratto, che illustra come garantire il ratto sulla superficie di dissezione e la posizione delle 12 ghiandole mammarie, con i capezzoli circondati. * I capezzoli delle ghiandole 6 e 7 non sono visibili. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: ghiandola mammaria del ratto femminile. Illustrazione delle ghiandole mammarie esposte 4 (MG4) e 5 (MG5), con la pelle appuntata alla superficie di dissezione sopra MG4 e appena sotto MG5. Le ghiandole devono essere rimosse dallo sk Inizio con MG5 e continuare fino e dorsale finché MG5 e 4 sono completamente rimossi. Il capezzolo si trova nella zona distale della ghiandola 4, e si dovrebbe esercitare la cura per raccogliere questa zona. Il linfonodo è indicato per riferimento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: ghiandola mammaria interamente montata. Un'immagine a monte di una ghiandola mammaria raccolta da un giorno postnatale di 25 femmine Sprague Dawley ratto. Barra di scala = 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.
.jpg "/>
Figura 4: Rimozione del rumore. Il canale a colori azzurro di un'immagine di montaggio mammario, con il fondo sottratto. ( A ) mostra esempi con rumore. Le frecce indicano il rumore creato dai vasi sanguigni e la regione più ombreggiata che circonda le estremità duttali è un esempio di rumore creato sottraendo lo sfondo. ( B ) illustra l'immagine dopo che il rumore è stato rimosso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Ricostruzione dell'immagine. Ricostruzione delle parti cancellate dell'immagine soglia. ( A ) Le frecce rosse indicano le regioni in cui le porzioni dell'immagine sono state perse a causa della soglia. L'immagine si ricostruisceDovrebbe essere eseguito in queste regioni. ( B ) Immagine mammaria dopo la ricostruzione delle regioni cancellate. La ricostruzione dell'immagine dovrebbe essere eseguita con attenzione e su base minima per mantenere l'integrità dell'immagine originale Cliccare qui per visualizzare una versione più grande di questa figura.

Figura 6: Sovrapposizione di un'immagine scheletrata. Immagine di sovrapposizione che mostra un'immagine scheletrata sovrapposta all'immagine originale completa. Questa immagine dimostra che la ghiandola scheletrica riflette la ramificazione della ghiandola reale con un alto grado di precisione. Clicca qui per visualizzare una versione più grande di questa figura.
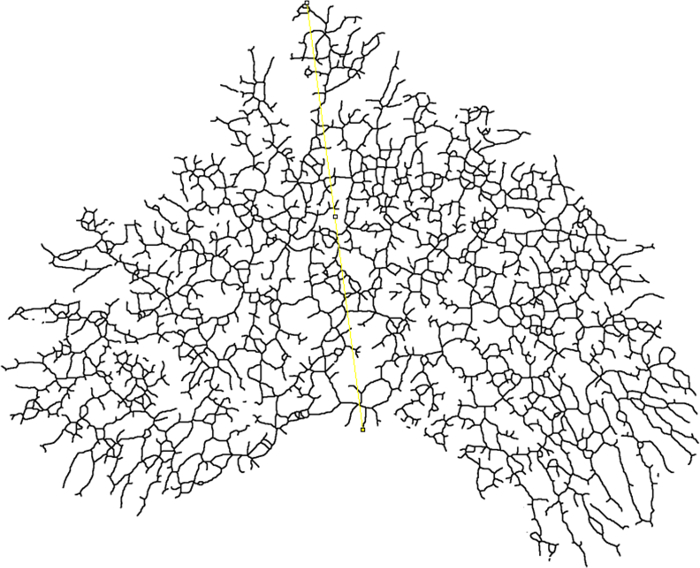
Figura 7: Raggio di chiusura. Immagine scheletrata di un mammifero che mostra dove il raggio di misura è misurato (giallo). La linea dovrebbe iniziare alla base dell'albero epiteliale (centro di analisi) e si estende fino al punto più distale dell'epitelio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Area Epiteliale Mammaria. Immagine scheletrata che mostra un poligono tracciato intorno all'albero epiteliale per determinare la MEA. Clicca qui per visualizzare una versione più grandeSione di questa figura.

Figura 9: Uscita di tracciato di Sholl. Uscita Sholl di linee lineari ( A ) e semi-log ( B ) del numero di intersezioni ad ogni incremento radiale. Il punto rosso nel pannello (A) è l'ascesa del centroide (centro geometrico). Nel pannello (B), la linea blu è la regressione lineare sull'intera gamma di dati, mentre la linea rossa è la regressione lineare entro il 10 ° -90 ° percentile. Clicca qui per visualizzare una versione più grande di questa figura.
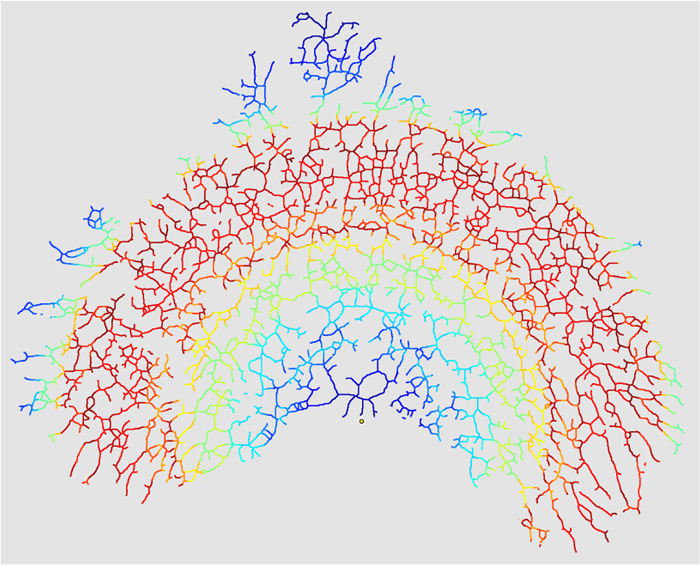
Figura 10: Maschera intersezioni. Quando il "Crea InterSe si seleziona l'opzione Maschera "Maschera" (passo 4.3.7), l'analisi emetterà una mappa termica del numero di intersezioni nel raggio di chiusura dell'immagine. Questa mappa termica riflette la densità delle intersezioni ramificanti in tutto l'epitelio (rosso = caldo = Alta densità, blu = freddo = bassa densità) L'intero epitelio sarebbe lo stesso colore in una mappa di calore di un'immagine dove k = 0. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Parametri di analisi di Sholl. I valori sono i dati riportati per l'analisi di Sholl. Il raggio di chiusura (punto 4.2) e MEA (passo 5.1) sono valori misurati, N e k sono risultati di analisi di Sholl e vengono restituiti nella finestra dei risultati dell'analisi di Sholl (fase 6.1) e la densità di branching viene calcolata utilizzando la formula N / ( MEA-LNA) (passo 6.1.2).
| Raggio di chiusura (mm) | MEA (mm2) | N | K | Densità di derivazione (N / mm2) |
| 7.4 | 71,7 | 2381 | 0.73 | 33.2 |
Discussione
Dalla nascita fino alla pubertà, la crescita delle ghiandole mammarie è allometrico. Dopo la pubertà, la ghiandola mammaria si sviluppa attraverso un'estesa ramificazione e allungamento dei dotti, che continuano fino a quando l'epitelio mammario occupa l'intero grasso di grasso. Le caratteristiche di ramificazione sono un aspetto importante dello sviluppo della ghiandola mammaria e la capacità di quantificare oggettivamente queste caratteristiche può essere estremamente utile per valutare lo sviluppo normale del mammario e per identificare lo sviluppo anomalo dopo le esposizioni di vita precoce alle tossiche mammarie.
La valutazione delle caratteristiche morfologiche, la quantificazione delle misure dimensionali di base e il conteggio delle strutture mammarie sono metodi tipici per la valutazione dello sviluppo delle ghiandole mammarie. Tuttavia, questi metodi non sono particolarmente sensibili a causa della considerevole variazione della dimensione e della forma delle ghiandole mammarie roditori e l'interpretazione dello sviluppo può essere difficile per un valutatore inesperto. Inoltre, il potenziale perLa bias esiste in studi che non sono accecati correttamente. Il metodo di analisi di Sholl fornisce un efficace protocollo per quantificare con precisione la densità di ramificazione epiteliale mammaria e la complessità di ramificazione, le caratteristiche morfologiche discrete delle ghiandole mammarie, che possono essere facilmente confrontate in studi e laboratori.
Ci sono passi critici in diverse sezioni di questo protocollo. Il primo e il più importante riguarda la condizione dell'intero supporto della ghiandola mammaria. L'esattezza di questo metodo si basa su una ghiandola mammaria che viene raccolta interamente intatta, montata senza difetti, correttamente fissata e macchiata e non dimostra alcuna ossidazione della ghiandola o scolorimento significativo del supporto di montaggio. Se la ghiandola è strappata o piegata, non è possibile ottenere una misura precisa della densità di ramificazione. Se le estremità duttali non sono presenti, il valore per k non sarà rappresentativo dell'intera ghiandola. La soglia sarà difficile nelle ghiandoleChe non sono stati completamente fissati a causa della mancanza di contrasto di colorazione nell'epitelio ductale. E infine, se è presente l'ossidazione o la scolorita, queste macchie potrebbero impedire l'analisi di misurare le intersezioni nell'area interessata.
Quando sono stati preparati appositi supporti interi, il passo critico successivo sta catturando le immagini allo stesso ingrandimento. È pratica comune acquisire immagini digitali con la massima risoluzione possibile. Tuttavia, per l'analisi di Sholl, è più importante che tutte le immagini siano catturate allo stesso ingrandimento. Come descritto in Stanko et al. (2015) 3 , è stato scoperto un avvertimento dove le immagini delle ghiandole più piccole catturate ad alta ingrandimento mostravano maggiori densità di ramificazione rispetto alle immagini delle ghiandole più grandi catturate ad un ingrandimento inferiore, anche se apparivano meno sviluppate. Abbiamo ipotizzato che l'ingrandimento più elevato ha portato a maggiori dettagli, che ha portato in tHa scheletrato l'immagine e ha prodotto una maggiore N, che ha rappresentato troppo la densità di ramificazione delle ghiandole più piccole. Questo problema è alleviato catturando tutte le immagini allo stesso ingrandimento.
Mentre la base di un'analisi accurata si trova nell'intero montaggio, il maggior potenziale per le modifiche influenzate dagli utenti nei dati di intersezione si trova nelle fasi per la rimozione del rumore. Tutte le immagini contengono rumore, in una certa misura, a causa dell'intensità di colorazione, delle entità fisiologiche non pertinenti ( ad es. Vasi sanguigni) e degli artefatti di soglia. Ogni immagine deve essere indirizzata indipendentemente dalle variazioni della quantità di rumore tra le immagini. Occorre prestare attenzione a non rimuovere troppo o troppo rumore, in quanto ciò può rendere incline il numero di intersezioni e, di conseguenza, la densità di ramificazione. Tuttavia, la misura in cui il rumore influenza l'interpretazione non è stata esaminata. L'utente dovrebbe decidere come meticoloso essere con la rimozione del rumore e dovrebbe anche esercitare consisPer mantenere l'integrità delle immagini. È altamente raccomandato che l'utente venga accecato al trattamento quando conduce la rimozione del rumore, in quanto ciò minimizzerà il potenziale di polarizzazione. La rimozione del rumore è descritta in dettaglio della Guida dell'utente 7 di ImageJ. In questa procedura, il rumore viene rimosso principalmente dall'immagine sottrattata di sfondo. Inoltre, il processo di determinazione della soglia può rimuovere i segmenti della ghiandola. Porzioni della ghiandola in cui sono stati rimossi solo pochi pixel saranno ricostruiti automaticamente quando l'immagine scheletrata viene dilatata. Tuttavia, le lacune espansive possono richiedere la ricostruzione manuale. L'utente dovrebbe decidere se e in quale misura ricostruire questi segmenti, mantenendo nuovamente l'integrità delle immagini originali.
Anche se questo non è critico, è importante mantenere aggiornamenti software, in quanto il software ImageJ viene aggiornato frequentemente. I metodi descritti qui si basano sulla versione 1.48v. FIJI e lo Sholl aInoltre, il plugin di nalisi viene aggiornato regolarmente e il protocollo qui descritto si basa su v3.4.1. Le modifiche apportate nelle versioni successive di ImageJ e del plugin di analisi di Sholl possono influenzare questi metodi. ImageJ controlla automaticamente gli aggiornamenti, ma gli aggiornamenti per FIJI devono essere eseguiti regolarmente e le modifiche tra le versioni attuali e quelle utilizzate dovrebbero essere indirizzate se necessario. Tutti i parametri sono definiti nelle sottovoci sulla pagina web di analisi di Sholl 6 . Le impostazioni dei parametri all'interno di questa procedura sono basate su immagini catturate da ghiandole mammarie create nel nostro laboratorio e non sono assolute. La preparazione integrale varia da laboratorio a laboratorio e questi parametri possono essere regolati di conseguenza per ottimizzare le immagini e l'output.
L'intero supporto della ghiandola mammaria utilizzato in questo studio era da un femmina di Sprague Dawley a PND 25 e il metodo è stato applicato in modo appropriato e senza limitazioni. Nei ratti, la densità epiteliale mammaria incRiprende con l'età a un punto in cui impedisce la soglia dell'immagine con risoluzione abbastanza elevata per generare un'immagine scheletrata esatta della ghiandola. Pertanto, attualmente non si consiglia di utilizzare questo metodo sulle ghiandole di ratti più vecchi di PND40. Anche se qui è stato indicato il ceppo di ratto, è irrilevante, poiché gli autori non sono attualmente a conoscenza di tratti mammari specifici del ceppo che impediscono l'uso di questo metodo. Inoltre, mentre il metodo descritto all'interno è stato condotto utilizzando un ratto femminile, potrebbe anche essere applicato alle ghiandole mammarie dei ratti maschi. Questa applicazione è stata anche utilizzata in modo efficace con i supporti interi di topi (Deirdre Tucker, comunicazione personale) e dovrebbero essere adatti a topi di qualsiasi età, poiché le ghiandole mammarie nei topi non crescono così dense come quelle dei ratti. Tuttavia, esistono due limitazioni nell'utilizzo di questa applicazione nei topi: 1) ci possono essere troppo poche intersezioni di ramificazione in topi giovani per rilevare differenze significative e 2) questo metodo cannoSi applicano ai topi maschi, in quanto non presentano epitelio mammario. Indipendentemente da ciò, questo metodo automatizzato è più veloce, imparziale e molto meno intenso del lavoro rispetto al conteggio delle intersezioni di ramificazione manualmente.
È possibile che i ricercatori desiderino utilizzare la ghiandola mammaria per altre tecniche sperimentali, come ad esempio escrezioni di strutture anormali o per immunohistochemistry (IHC). Anche se Tucker et al. (2016) hanno descritto un metodo per la preparazione di una sezione trattata con ematoxilina-eosina da una ghiandola mammaria di topo, 8 che consideriamo tipicamente la creazione di un intero montante per essere un processo terminale e non sappiamo di metodi per utilizzare un intero- Montata per ulteriori test sensibili, come i test IHC o TUNEL. Se sono necessari saggi sensibili che utilizzano tessuti ghiandolari mammari in combinazione con i montanti interi, è consigliabile utilizzare le ghiandole mammarie contralaterali.
La ghiandola mammaria continua tO essere il punto focale in un numero crescente di studi, ma le differenze esistenti nei laboratori esistono in entrambi i preparati a monte 9 , 10 , 11 , 12 e valutazioni dello sviluppo 13 , 14 e 15 . La modifica dell'analisi di Sholl qui descritta fornisce un metodo standardizzato per la quantificazione oggettiva della densità di ramificazione, caratteristica importante dello sviluppo della ghiandola mammaria nella ghiandola mammaria dei roditori. Questo metodo può essere applicato a montanti interni di mammiferi di roditori maschi o femmine, e sebbene attualmente è raccomandato per l'uso in ghiandole peripubertali precoce postnatali da ratti, può essere applicato alle ghiandole mammarie da topi di tutte le età. L'applicazione è particolarmente adatta per le ghiandole mammarie raccolte da roditori peripubertali in quanto questo periodo è consigliatoEndpoint per la preparazione del montante integrale mammario negli studi di orientamento test. L'ottimizzazione di questo metodo per l'uso nelle ghiandole mammarie più densose di ratti adulti è attualmente in fase di studio.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori vorrebbero riconoscere il dottor Michael Easterling (Social and Scientific Systems, Inc., Durham, NC) per la sua assistenza con la convalida di questo metodo e il dottor Tiago Ferreira (McGill University, Montreal, Quebec, Canada) per la sua continua Assistenza con l'applicazione Sholl.
Materiali
| Name | Company | Catalog Number | Comments |
| Dissecting board | NA | NA | A piece of styrofoam roughly 10"x12" is suitable. |
| Dissecting T-Pins | Daigger | EF7419A | |
| Spray bottle with ethanol | NA | NA | 70% ethanol is suitable. |
| Curved dissecting scissors | Fine Science Tools | 14569-09 | |
| Straight dissecing scissors | Fine Science Tools | 14568-09 | |
| Curved forceps | Fine Science Tools | 11003-12 | |
| Superfrost Plus 24 x 75 x 1 mm microscope slides | ThermoFisher Scientific | 4951PLUS-001 | Thermo Scientific Superfrost Plus & Colorfrost Plus slides hold tissue sections on permanently without the need for expensive coatings in IHC and Anatomical Pathology applications. This treatment reduces tissue loss during staining as well as hours of slide preparation. Slides electro-statically attract frozen tissue sections and cytology preparations and feature a chemistry similar to silane, although optimized to improve application performance. https://www.thermofisher.com/order/catalog/product/4951PLUS4. |
| Fisherfinest Premium Cover Glass 24 x 60 x 1 mm | Fisher scientific | 12-548-5P | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher scientific | 13-374-12 | |
| Chloroform | Sigma-Aldrich | C2432 | |
| Glacial acetic acid | Sigma-Aldrich | A9967 | |
| Ethanol absolute, ≥99.8% (GC) | Sigma-Aldrich | 24102 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Carmine alum | Sigma-Aldrich | C1022 | |
| Aluminum potassium sulfate | Sigma-Aldrich | A6435 | |
| Permount mounting media | Fisher Scientific | SP15 | |
| Macroscope | Leica | Z16 APO | This is the image capturing hardware and software used in this laboratory. As there are many different options, the methods and applications may vary between laboratories. |
| Digital camera | Leica | DFC295 | |
| Camera software | Leica | Leica Application Suite v3.1 | |
| ImageJ software | Open source | http://imagej.net/Welcome | |
| Sholl analysis | Open source | http://imagej.net/Sholl_Analysis |
Riferimenti
- Sholl, D. A. Dendritic organization of the neurons in the visual and motor cortices of the cat. J Anat. 87 (4), 387-406 (1953).
- Ferreira, T. A., Iacono, L. L., Gross, C. T. Serotonin receptor 1A modulates actin dynamics and restricts dendritic growth in hippocampal neurons. Eur J Neurosci. 32 (1), 18-26 (2010).
- Stanko, J. P., Easterling, M. R., Fenton, S. E. Application of Sholl analysis to quantify changes in growth and development in rat mammary gland whole mounts. Reprod Toxicol. 54, 129-135 (2015).
- Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in Mammary Gland Morphology and Breast Cancer Risk in Rats. J. Vis. Exp. (44), e2260 (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of Mammary Gland Development and Function in Mouse Models. J. Vis. Exp. (53), e2828 (2011).
- ImageJ User Guide. IJ 1.46r. ImageJ Available from: https://imagej.nih.gov/ij/docs/guide/146.html (2012)
- Tucker, D. K., Foley, J. F., Hayes-Bouknight, S. A., Fenton, S. E. Preparation of High-quality Hematoxylin and Eosin-stained Sections from Rodent Mammary Gland Whole Mounts for Histopathologic Review. Toxicol Pathol. 44 (7), 1059-1064 (2016).
- Fenton, S. E., Hamm, J. T., Birnbaum, L. S., Youngblood, G. L. Persistent abnormalities in the rat mammary gland following gestational and lactational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Toxicol Sci. 67 (1), 63-74 (2002).
- Murray, T. J., Maffini, M. V., Ucci, A. A., Sonnenschein, C., Soto, A. M. Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure. Reprod Toxicol. 23 (3), 383-390 (2007).
- Moral, R., Santucci-Pereira, J., Wang, R., Russo, I. H., Lamartiniere, C. A., Russo, J. In utero exposure to butyl benzyl phthalate induces modifications in the morphology and the gene expression profile of the mammary gland: an experimental study in rats. Environ Health. 10 (1), 5 (2011).
- Johnson, M. D., Mueller, S. C. Three dimensional multiphoton imaging of fresh and whole mount developing mouse mammary glands. BMC Cancer. 13, 373 (2013).
- Enoch, R. R., Stanko, J. P., Greiner, S. N., Youngblood, G. L., Rayner, J. L., Fenton, S. E. Mammary gland development as a sensitive end point after acute prenatal exposure to an atrazine metabolite mixture in female Long-Evans rats. Environ Health Persp. 115 (4), 541-547 (2007).
- Hovey, R. C., Coder, P. S., Wolf, J. C., Sielken, R. L., Tisdel, M. O., Breckenridge, C. B. Quantitative assessment of mammary gland development in female Long Evans rats following in utero exposure to atrazine. Toxicol Sci. 119 (2), 380-390 (2011).
- Mandrup, K. R., Hass, U., Christiansen, S., Boberg, J. Perinatal ethinyl oestradiol alters mammary gland development in male and female Wistar rats. Inter J of Androl. 35 (3), 385-396 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon