Method Article
כימות צפיפות הענף בבלוטת החלב עכברוש- mounts כולו באמצעות שיטת ניתוח Sholl
In This Article
Summary
התפתחות בלוטת החלב במכרסם הוערכה בדרך כלל באמצעות הערכות תיאוריות או על ידי מדידת תכונות פיזיות בסיסיות. צפיפות הענף היא אינדיקטור להתפתחות החלב שקשה לכמת באופן אובייקטיבי. פרוטוקול זה מתאר שיטה אמינה להערכת כמותית של מאפייני הבלוטות החלב.
Abstract
מספר גדל והולך של מחקרים מנצלים את בלוטת החלב המכרעת כנקודת קצה להערכת הרעילות ההתפתחותית של חשיפה כימית. ההשפעות האלה חשיפות יש על התפתחות בלוטת החלב מוערכים בדרך כלל באמצעות מדידות ממדי בסיסי או על ידי ניקוד מאפיינים מורפולוגיים. עם זאת, טווח רחב של שיטות לפרש שינויים התפתחותיים עלול להוביל לתרגומים לא עקביים על פני מעבדות. יש צורך בשיטת הערכה מקובלת, כדי שיוכלו להיווצר פרשנויות מתאימות ממידע שנאסף על פני מחקרים. המחקר הנוכחי מתאר את היישום של שיטת ניתוח Sholl כדי לכמת מאפיינים הסתעפות בלוטת החלב. שיטת Sholl פותחה במקור לשימוש בכימות דפוסי דנדריטים נוירונים. באמצעות ImageJ, קוד פתוח תמונה ניתוח חבילת תוכנה, וכן תוסף שפותח עבור ניתוח זה, בלוטת החלב צפיפות צפיפות המורכבות של AMבלוטת החלב מתוך חולדה נקבה peripubertal נקבעו. השיטות המתוארות כאן יאפשרו את השימוש בניתוח Sholl ככלי יעיל לכימות מאפיין חשוב של התפתחות בלוטת החלב.
Introduction
בלוטת החלב הסתעפות היא מאפיין זה הוא בדרך כלל מוערך כמו אינדיקטור של התפתחות בלוטות, אבל קשה לכמת אובייקטיבי. בשנת 1953, Sholl 1 תיאר שיטה למדידת arborization דנדריטים נוירונים בקורטקס החזותי והמנועי של החתול, ותוסף עבור טכניקה זו פותחה על ידי Ferriera et al 2 . בגלל שני נוירונים בלוטות החלב התערוכה מבנה דומה עץ דמוי, תוסף הועסק לכמת צפיפות הסתעפות האפיתל השד בתמונות 2D של בלוטת החלב peripubertal חולדה. השלב peripubertal נבחר לניתוח בגלל הגמילה היא שלב החיים, כי הוא מוערך לעתים קרובות במעבדות אקדמיות ומבחני מבחן המבחן. ניתוח Sholl הוא תוסף מופץ עם FIJI, המהווה את קוד פתוח עיבוד תמונה ImageJJ, עם תוספים נוספים כלולים. התוסף יוצר סדרה של טבעות קונצנטריות המקיפות פרדף(בדרך כלל סומה של נוירון או המקור של צינור הראשי של בלוטת החלב) והרחבת החוצה לחלק דיסטלי ביותר של האובייקט (רדיוס מצרף). לאחר מכן הוא סופר את מספר הצמתים (N) המתרחשים בכל אחת מהטבעות. תוסף גם מחזירה מקדם רגרסיה Sholl ( k ), המהווה מדידה של קצב ריקבון הסתעפות אפיתל.
באמצעות ImageJ, תמונה skeletized של בלוטת החלב כולו הר נוצר ואזור אפיתל החלב (MEA) נמדדת. התמונה מנותחת באמצעות תוסף ניתוח Sholl, וערכים עבור N ו- k , בין ערכים אחרים שאינם מנוצלים כאן, מוחזרים. צפיפות הסתעפות אפיתל החלב נקבעת על ידי חישוב N / MEA. המידה שבה הסתעפות נמשכת באזורים החיצוניים של האפיתל הבלוטתי הוא המורכבות הסתעפות והוא אינדיקטור לצמיחה אפיתלית אחידה דיסטלי. כמו k הוא מדד של ירידה דיסטלית epithאלירי הסתעפות, הוא מדד יעיל של המורכבות הסתעפות אינדיקטור אמין של התפתחות החלב.
פרוטוקול זה מתאר שיטה בסיוע מחשב ליצירת תמונות skeletized של בלוטות החלב כולו mounts ו הערכה כמותית המאפיינים הסתעפות החלב ב עכברים peripubertal זכר ונקבה. שיטה זו מהירה יחסית ואינה דורשת שימוש בציוד מיקרוסקופי מיוחד. פיתוח ואישור של שיטה זו מתוארים Stanko et al. (2015) 3 . דוח זה מתאר גם הכנה של בלוטת החלב כולו = mounts. הליכים דומים של כל ההר-חזה תוארו ב- Assis et al. (2010) 4 ו Plante et al. (2011) 5 .
Protocol
כל שימוש בבעלי חיים ונהלים עבור מחקר זה אושרו על ידי המעבדה NIEHS טיפול בבעלי חיים ושימוש הוועדה וערך באגודה להערכה ו ההסמכה של מעבדה טיפול בבעלי חיים מעבדה.
1. בלוטות בלוטת החלב
- תווית מראש כל שקופיות באמצעות שיטה הוכחה קסילן (עיפרון עובד הכי טוב). מכסים אותם עם פתרון הרכבה בסוף כדי לשמור על התווית.
- להרדים את החיה על ידי טיפול בבעלי חיים מוסדיים ושימוש ועדת הוועדה אישרה.
- לאחר המתת חסד, במקום החיה על גבה על לוח לנתח ( איור 1 ). למתוח ולדק את כל ארבעת הגפיים, עם הגפיים האחוריות ויוצרים V הפוך (מחזיק סיכות או מחטים מד קטן לעבוד היטב).
- ריססו את הבטן בנדיבות עם אתנול 70% כדי לשמור על השיער מתוך המדגם החלב.
- בעזרת מלקחיים, למשוך את העור הבטן על קו האמצע ולעשות חתך קטן עםלנתח מספריים, נזהר לא לנקב את הצפק.
- החל חתך, לחתוך את העור עד לאזור הצוואר ולאחר מכן distally אל איבר הקדמי. חותכים לאזור המפשעה ולאחר מכן דיסטלי אל המפרק הראשון של האיבר האחורי באותו צד; חתך זה בדרך כלל מפריד בלוטות החלב 5 ו - 6. הימנע חיתוך peritoneum.
- משוך לאחור את העור עם כרית שומן החלב המצורפת באמצעות מלקחיים, להפריד אותו בעדינות מן הצפק באמצעות סוף קהה של מספריים לנתח. פרד ככל dorsally ככל האפשר כדי לחשוף את ה 4 במלואו 5 th בלוטות חלב מפשעתי על החלק התחתון של העור; סיכה את העור ללוח לנתח ( איור 2 ).
- בעדינות לתפוס את רקמת השד של בלוטת 5 th עם הצד המעוגל של מלקחיים מעוקלים לאט לקצץ את הבלוטה מהעור, נזהרת שלא ניק הבלוטה או העור.
- המשך לקצץ,נעים dorsally עד בלוטות 4 וה 5 th הוסרו לחלוטין מהעור. ודא כי אזור הפטמה מוסר עם שאר הבלוטה, כמו זה משמש נקודת המוצא של ניתוח Sholl. חותכים את רקמת החלב מן הגוף שבו הוא מחובר ב בלוטת 4.
- לאחר בלוטת מוסר מן החיה, להפיץ אותו באופן שווה על מטען אלקטרוסטטית, 25 מ"מ x 75 מ"מ x 1 מיקרוסקופית מ"מ, עם הצד שהיה צמוד העור פונה כלפי מטה.
הערה: עבור בלוטות מחיות זקנות או מניקות, ייתכן שיהיה צורך בשקופית 51 x 75 x 1 מ"מ. - בעוד לובש כפפות, בעדינות לסחוט את כל בועות אוויר. לכסות את הבלוטה עם סרט פרפין פלסטיק ועוד שקופיות מיקרוסקופ לדחוס את הבלוטה לדבוק אותו לשקופית.
הערה: צינור חרוטי 50 מ"ל מלא מים משמש משקל מתאים. כמות הזמן הדרוש כדי לדבוק בשקופית תלוי בעובי של הבלוטה. רזה, postnaיום טל (PND) 4 בלוטות צריך להיות דחוס במשך מינימום של 30 דקות, בעוד בלוטות בוגרים עבות יותר עשויים לדרוש ככל 2-5 שעות.
2. הכן החלב כולו Mounts
- הכן את הפתרון alum carmine לפחות 24 שעות מראש, כפי שהוא דורש רותחים וקירור.
- ממיסים 1 גרם של alum carmine ו -2.5 גרם של אלומיניום אשלגן גופרתי (AlK (SO 4 ) 2 · 12H 2 O) ב 500 מ"ל של מים מזוקקים להרתיח במשך 20 דקות בבקבוק 1-L. תביא את נפח הסופי 500 מ"ל באמצעות מים מזוקקים.
- סנן את הפתרון באמצעות נייר סינון תחת ואקום קירור לאחסון.
הערה: פתרון כרמיום אלום ניתן לשימוש חוזר אבל צריך להיות מושלך כאשר הצבע מתחיל להתפוגג.
- לפני קיבעון, לקלף את הסרט פרפין מן הבלוטה, נזהר לא למשוך את הבלוטה את השקופית. מניחים את השקופית (ים) בתוך צנצנת זכוכית צלחת מכתים לטבול מקבע (אתאן 100%Ol, כלורופורם, חומצה אצטית קרחית ביחס 6: 3: 1) במשך 12-48 שעות, בהתאם לעובי של הבלוטות.
- יוצקים את מקבע להשרות את הבלוטות באתנול 70% במשך 15 דקות. לאט לאט לייבש את הבלוטות על ידי שפכו 1/3 של פתרון אתנול והחלפתו עם מים מזוקקים. משרים במשך 5 דקות. חזור על התהליך שלוש פעמים.
- לאחר שטיפה הסופי, לשפוך את כל הפתרון אתנול / מים ולהחליף אותו עם מים מזוקקים 100%. משרים את הבלוטות במשך 5 דקות.
- יוצקים את המים מזוקקים לטבול את הבלוטות פתרון alum carmine. כתם הבלוטות במשך 12-24 שעות, בהתאם לעובי.
הערה: הבלוטות לא יכול להיות מוכתם יתר על המידה, אבל זמן מכתים עבור אצוות מרובים צריך להיות זהה, כך עוצמת מכתים הוא זהה. - יוצקים את הפתרון אלום carmine ולשטוף את הבלוטות במים מזוקקים 100% במשך 30 שניות. בהדרגה לייבש את הבלוטות על ידי השריית אותם באתנול 70% במשך 15 דקות, אתנול 95% במשך 15 דקות,Nd 100% אתנול 20 דקות.
- נקה את בלוטות השומן על ידי השריית אותם קסילן עבור 12-72 שעות, בהתאם לעובי.
הערה: הבלוטות צריכות להיות שקופות (צלולות). אם כל אטום (אזורים לבנבן) להישאר, להמשיך לשריית ב xylene עד שקוף. אם lactating או אחרת עבה מאוד בלוטות מוכתמות וניקוי, xylin ייתכן שיהיה צורך להחליף פעם אחת כדי לנקות את הבלוטות. - הר שקופיות עם המדידה הרכבה מבוסס קסילן ידי pipetting מספיק בינוני רק לכסות את הבלוטה. הוסף coverslip, להבטיח כי אין בועות אוויר הטופס.
- אפשר את השקופיות להתייבש. כמו מתייבש בינוני מתייבש, זה יהיה חוזה תחת coverslip, וזה עשוי להיות נחוץ כדי להוסיף בינוני הרכבה נוספים. פעם אחת לא נדרש מדיום נוסף, לאפשר את השקופיות להתייבש לחלוטין; זה עשוי להימשך 2-3 שבועות.
- לאחר השקופיות יבשים לחלוטין, כל המדיום גובר שיורית ניתן להסיר עם צמר גפן כותנה כמות קטנה של קסילן. היזהר לא להשתמשיותר מדי קסילן, כמו זה יכול לפזר את המדיום גובר ולשחרר את coverslip. אם זה קורה בועות אוויר לאסוף מתחת coverslip, coverslip יש להסיר קסילן ואת תהליך הרכבה יש לחזור.
3. הכן תמונות הר שלם לניתוח
- לכידת תמונות של mounts כולו ( איור 3 ) באמצעות מיקרוסקופ או מיקרוסקופ לנתח מצלמה דיגיטלית עם התוכנה המתאימה.
הערה: בעוד כל הגדלה כי לוכדת את האפיתל השטני כולו ניתן לבחור, זה הכרחי כדי ללכוד את כל הר תמונות כי יהיה להשוות זה לזה בהגדלה זהה. - הורד ImageJ תוכנה (או תוכנה FIJI) 6 .
- פתח את התמונה במלואה הר החלב ב- ImageJ על ידי לחיצה על "קובץ" → "פתח". בחר את הכלי Freehand ו להתחקות סביב אפיתל בלוטתית. בחר "ערוך" & #8594; "נקה בחוץ".
- הסר את בלוטות הלימפה על ידי מעקב אחר הצומת ושימוש בכלי Freehand ו "ערוך" → "גזור".
- הפרד את ערוצי הצבע על ידי בחירת "תמונה" → "צבע" → "ערוצי פיצול". בחר בערוץ עם הניגוד הטוב ביותר, בדרך כלל הערוץ הכחול.
הערה: תמונת RGB מורכבת מערימה של הרכיבים האדומים, הירוקים והכחולים של תמונה זו. פעולה זו מפרידה בין רכיבים אלה לשלוש תמונות בגווני אפור של 8 סיביות. - הפחת את הרקע על-ידי בחירה באפשרות "תהליך" ← "הפחתת רקע". בחר את הפרמטרים הרצויים ולאחר מכן לחץ על "תצוגה מקדימה" כדי להציג את השינויים.
הערה: "Subtract Background" מסיר רקע חלק, רציף. בנוסף, "תהליך" → "מסננים" → "Unsharp Mask" ניתן להשתמש כדי ליצור ניגודיות. - בחר אחד שיטות הבאות להסרה אוטומטית של רעש: ניקוב או הסרת חריגים.
הערה: ImageJ מציעה שיטה שלישית להסרת רעשים אוטומטית: הסרת NaN. עם זאת, הפקודה NaNs הסר אינה ישימה מאחר שהיא משתמשת בתמונות של 32 סיביות, והשיטה הנוכחית משתמשת בתמונות של 8 סיביות.- הסר רעש באמצעות הפקודה despeckle על ידי בחירת "תהליך" → "רעש" → "Despeckle".
הערה: זה שווה ערך הוספת מסנן חציון, אשר מחליף כל פיקסל עם הערך החציוני בשכונה 3 × 3 שלה. - הסר רעש באמצעות הפקודה outliers להסיר על ידי בחירת "תהליך" → "רעש" → "הסר Outliers."
הערה: תהליך זה מחליף פיקסל בחציון של הפיקסלים בסביבה הקרובה, אם הוא חורג מהחציון ביותר מערך מסוים (הסף).
- הסר רעש באמצעות הפקודה despeckle על ידי בחירת "תהליך" → "רעש" → "Despeckle".
- הסר את הרעש הנותר באופן ידני (Lass = "xfig"> איור 4).
- לפתוח עותק של התמונה המקורית ולהשתמש זה בתור מדריך למה הוא ומה לא רעש. לחץ על לחצן החץ הכפול-אדום בקצה השמאלי העליון של סרגל הכלים. בחר בכלי ציור; הלחצנים Tool Drawing יופיעו כעת בסרגל הכלים.
- לחץ על הכלי מחק. כוונן את קוטר המחק על-ידי לחיצה ימנית על לחצן הכלי מחק. החזק את לחצן העכבר השמאלי כדי למחוק רעש.
הערה: ניתן לבטל רק הפעלה אחת של מחיקה. לאחר לחצן העכבר השמאלי משוחרר ולחץ שוב, המחיקה הקודמת לא ניתן לבטל.
- התאם את הסף על ידי בחירת "תמונה" → "התאם" → "סף". הזז את המחוונים כדי לכוונן את ערכי הסף המינימלי (המחוון העליון) ואת הערך המרבי (מחוון נמוך יותר) עד שיושג תיאור הולם של הבלוטה.
הערה: הגדרת מקטעי ערך הסף גווני אפור לתמונות של עניין ורקע.- לחץ על החל. במקרה הצורך, הסר רעש נוסף בנקודה זו על ידי ביצוע השלבים הבאים: 3.6.1 ו - 3.6.2.
- לשחזר את החלקים של האפיתל הבלוטית שהוסרו על ידי הסרת סף והרעש ( איור 5 ).
- ביצוע שחזור תמונה בזהירות על בסיס מינימלי כדי לשמור על שלמות התמונה המקורית. עיין בתמונה המקורית עבור הפניה לגבי מה הוא ומה לא אפיתל.
- לחץ על הכלי Spray Can (בסרגל הכלים עם כלי הציור). התאם את קוטר הרסס ואת קצב על ידי לחיצה ימנית על כפתור ריסוס הכלי. מלא בקטעי הבלוטה החסרים על ידי לחיצה או לחיצה ממושכת על לחצן העכבר השמאלי.
- יצירת תמונה skeletized של הבלוטה לביצוע ניתוח Sholl. ודא כי התמונה thresholded הוא בינארי על ידי בחירת "תהליך" → "בינארי" → "בצע B Inary ".
- אם התמונה היא לבן על רקע שחור, בחר "תהליך" → "בינארי" → "אפשרויות" ובטל את "רקע שחור". Skeletonize את התמונה על ידי בחירת "תהליך" → "בינארי" → "Skeletonize".
הערה: פעולה זו מסירה שוב ושוב פיקסלים מקצוות התמונה הבינארית עד להקטנתה לצורה ברוחב פיקסל יחיד. - לשכפל את התמונה פעם אחת על ידי בחירת "תהליך" → "בינארי" → "דילאט".
הערה: פעולה זו ממלאת פערים שנוצרו על ידי סף ו skeletonizing על ידי הוספת פיקסלים לקצוות של התמונה הבינארית.
- אם התמונה היא לבן על רקע שחור, בחר "תהליך" → "בינארי" → "אפשרויות" ובטל את "רקע שחור". Skeletonize את התמונה על ידי בחירת "תהליך" → "בינארי" → "Skeletonize".
- שמור את התמונה על ידי בחירת "קובץ" → "שמירה בשם". בחר סוג תמונה (בדרך כלל jpeg), הזן את שם הקובץ ולחץ על "אישור".
- בדוק את הדיוק של התמונה skeletized על ידי שכבת התמונה skeletized על התמונה המקורית (התחת = "xfig"> איור 6).
- יצירת שכבת על ידי פתיחת הן את התמונה המקורית ואת התמונה skeletized. בחר "תמונה" → "שכבה" → "הוספת תמונה". בתיבת הדו-שיח 'הוסף תמונה', בחר את תמונת השלד מהתפריט הנפתח 'תמונה להוספה' והגדר את האטימות ב -30%.
- שמור את התמונה של תמונת השלד על גבי המקור על ידי בחירת "קובץ" → "שמירה בשם". בחר סוג תמונה, הזן את שם הקובץ ולחץ על "אישור".
4. לבצע את ניתוח Sholl
- פתח תמונה שלד ולהפוך את התמונה בינארי על ידי בחירת "תהליך" → "בינארי" → "לעשות בינארי".
- לפני הגדרת סולם ההגדלה, מדוד את מספר הפיקסלים / מ"מ באמצעות מיקרומטר עבור ההגדלה שבה נלכדו התמונות.
- הגדר את ההגדלה שנמדדהCale על ידי בחירה באפשרות "Analyse" → "Set Scale". הזן את מספר הפיקסלים / מ"מ. הגדר את "מרחק ידוע" ואת "יחס הממדים פיקסל," הן 1. הזן "מ"מ" עבור "יחידת אורך" ולבדוק "גלובל" (שומר על אותו קנה מידה עבור כל תמונה).
- קביעת רדיוס הסיום (רדיוס מצרף) עבור ניתוח Sholl על ידי ציור קו מתחילת צינור הראשי (מרכז ניתוח) לנקודה הדיסטלית ביותר של האפיתל הבלוטות ( איור 7 ).
- השתמש בכלי ציור קו בסרגל הכלים כדי לצייר קו בין נקודות עניין. לחץ על מקש "M" כדי לבצע מדידה וציין שחלון תוצאות ייפתח.
הערה: הערך בעמודה "אורך" הוא אורך השורה ב- mm. ערך זה יוזן באופן אוטומטי כרדיוס הסיום בעת הגדרת הפרמטרים Sholl. תוסף Sholl ישתמש בנקודת ההתחלהשל הקו כמרכז של הטבעות centric.
- השתמש בכלי ציור קו בסרגל הכלים כדי לצייר קו בין נקודות עניין. לחץ על מקש "M" כדי לבצע מדידה וציין שחלון תוצאות ייפתח.
- הפעלת ניתוח Sholl.
- הפעל את הניתוח על ידי בחירת "Plugins" "ניתוח Sholl מתקדם;" יופיע חלון פרמטר.
- הגדר את רדיוס ההתחלה ב "I. הגדרת פגזים" עד 0.00 מ"מ; אורך הקו הנמדד בשלב 4.2 יוכנס באופן אוטומטי ל"רדיוס הסוף ".
- הגדר את "רדיוס צעד צעד" 0.1 מ"מ.
הערה: גודל הרדיוס קובע את מספר הצלצולים (למעשה מספר האיטרציות); גודל צעד קטן יותר יגדיל את מספר הצלצולים, בעוד שגודל צעד גדול יותר יקטין את מספר הטבעות. הרדיוס לא יכול להיות קטן מדי, אם כי רדיוס קטן מדי יגרום למספר גדול שלא לצורך של טבעות. עם זאת, ניתן להגדיר גדול מדי, אשר תיצור טבעות פחות ולאחר מכן לזלזל במספר האמיתי של צמתים. עיין סטאנקו et al.(2015) לקבלת מידע נוסף על קביעת גודל צעד. - הגדר את "# דוגמאות" ל 1 ואת "אינטגרציה" ל "ממוצע" ב "דוגמאות מרובות לכל רדיוס."
- הגדר את "חתוך רדיוס לחתוך" ל 1 לבדוק "להסיק החל רדיוס החל" עבור "# סניפים ראשיים" ב "ג תיאורים ו עקומת הולם."
הערה: ניתן לסמן את האפשרות "התאמת פרופיל ומחשב" ו "הצג פרטים מתאימים" לפי הצורך. - בדוק "ליניארי" ובחר "התאמת הטוב ביותר" ב "פרופילים ללא נורמליזציה;" לבדוק "אינפורמטיבי ביותר." בחר "שטח עבור פרופילים מנורמל" ב "שיטות Sholl IV."
- בדוק "צור צמתים מסכה" ב "V. אפשרויות פלט" כדי ליצור מפת חום של צמתים (אופציונלי).
- לחץ על "Cf. Segmentation" כדי ליצור חלון תצוגה מקדימה של התמונה עם טבעות כדי לאשר את האזורניתוח.
- לחץ על "אישור" כדי להפעיל את הניתוח.
5. מדידת MEA
- למדוד את MEA על ידי מעקב אחר המרחק הקצר ביותר סביב העץ אפיתל ( איור 8 ).
- ב- ImageJ עם תמונת השלד של הבלוטה הפתוחה, לחץ על הכלי מצולע. לחץ על נקודה על היקף של אפיתל העץ להתחיל את המצולע, לנוע סביב המערכת של הבלוטה, ולחץ כדי להוסיף קטע שורה.
- כאשר אזור אפיתל כולו כבר לעקוף, לחץ פעמיים כדי לסגור את המצולע. לחץ על "M" כדי לפתוח חלון תוצאות; הערך בעמודה "אזור" הוא MEA.
- במקרים בהם האפיתל הבלוטלי הורחב מעבר לצומת הלימפה, הפחת את אזור הצומת הלימפה (LNA) מן MEA בעת חישוב צפיפות הסתעפות.
- למדוד את LNA על ידי מעקב אחר הצומת הלימפה באותו mannאה כמו עץ אפיתל הקשה על "מ"
הערה: LNA חייב להיות מופחת מן MEA במקרים אלה, כי הצומת הלימפה מונע את ניתוח מספור צמתים בתוך LNA. כאשר האפיתל לא הגיע לנקודת הלימפה, ה- LNA הוא אפס.
- למדוד את LNA על ידי מעקב אחר הצומת הלימפה באותו mannאה כמו עץ אפיתל הקשה על "מ"
6. נתוני דיווח
- דווח על ערכי הרדיוס המקיף, MEA, N, k וצפיפות הסתעפות.
הערה: הרדיוס המצורף נקבע בשלב 4.2 וה- MEA נקבע בשלב 5.1.- הפעל את הניתוח כדי ליצור חלון תוצאות Sholl.
הערה: N דיווח הוא הערך עבור סכום inters. K מדווח הוא הערך עבור מקדם רגרסיה Sholl (חצי יומן). ניתוח Sholl יחזיר ערך עבור k על כל אזור נמדד של האפיתל הבלוטות. כדי להשיג ערך מדויק עבור k על אפיתל מלא, הקצוות ductal חייב להיות נוכח. - שנה את הE ניתוח Sholl עבור בלוטת החלב באמצעות ערך הפלט עבור N לחשב את צפיפות הסתעפות (נקודת הקצה הבסיסית של שיטה זו). חישוב צפיפות הסתעפות באמצעות נוסחה N / (MEA-LNA) ולדווח על הערך כמו N / mm 2 .
- הפעל את הניתוח כדי ליצור חלון תוצאות Sholl.
תוצאות
הערכים עבור רדיוס סגורה נמדד, MEA, N, k , וצפיפות הסתעפות מחושב עבור בלוטת החלב ניתח בפרוטוקול זה מדווחים בטבלה 1 . ניתוח Sholl מייצר מגרשים ליניארי ו חצי יומן של מספר צמתים בכל רדיוס ( איור 9 ), ואם נבחר, מפת חום של צמתים ( איור 10 ). בלוטות פחות מפותחות התערוכה פחות צמתים בתוך MEA זהה ולכן יש צפיפות הסתעפות נמוכה יותר. בלוטה מפותח ימשיך סניף אחידה לאורך כל האפיתל הבלוטות, במיוחד באזורים דיסטלי. המידה בה ניתן להסתעף באזורים אלו יכולה להיות מתוארת כמורכבות של הסתעפות וירידה במורכבות מועברת כשיעור ריקבון (או מקדם רגרסיה של Sholl, k ). שיעור ריקבון משקף את השינוי בחזייה אפיתל דיסטליNching ונמדדת כמו המדרון של הקו של מספר הצמתים זממו נגד רדיוס מצרף ( כלומר, צמיחה האורך של האפיתל). לפיכך, מקדם רגרסיה Sholl מחושב על ידי לקיחת השיפוע של הקו של העלילה של יומן (N / S) לעומת המרחק רדיאלי (r), שבו יומן (N / S) = - k r + m, עם N מספר הצמתים עבור כל טבעת של רדיוס r ושטח S (πr 2 ), ו m להיות ליירט. בגלל המדרון - k מתאר את ריקבון של צמתים, ערך של - k = 0 יציין אפס עששת הסתעפות אחידה ממרכז הניתוח עד קצה האפיתל. ב בלוטות שפותח בדלילות, ריקבון הסתעפות הוא גדל; יש פחות צמתים באזור הדיסטלי של עץ האפיתל; ואת המדרון, k , הוא גדל. לכן, ערכי k מתקרב 0 מצביעים על הסתעפות דיסטלית גדולה יותר ( כלומר, מורכבות הסתעפות) ובארבלוטת החלב.
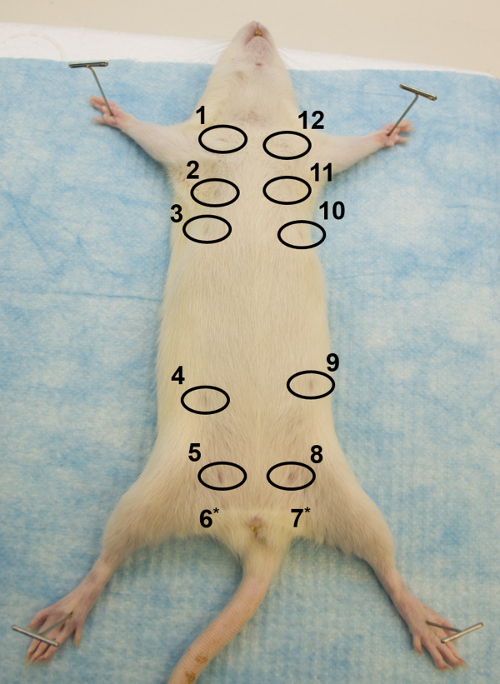
איור 1: מבט הגחון. תמונה של החלק הגחון של נקבה מבוגר עכבר Sprague Dawley, ממחיש כיצד לאבטח את החולדה על פני השטח לנתח את המיקום של 12 בלוטות החלב, עם הפטמות הקיפו. * הפטמות של בלוטות 6 ו -7 אינם גלויים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 2: נקבה חולדה בלוטת החלב. איור של בלוטות החלב 4 (MG4) ו 5 (MG5), עם העור הצמיד אל משטח לנתח מעל MG4 ו ממש מתחת MG5. הבלוטות יש להסיר מן sk בתחילת MG5 ולהמשיך עד dorsally עד MG5 ו 4 מוסרים לחלוטין. הפטמה נמצאת באזור הדיסטלי של הבלוטה 4, ויש לטפל בה כדי לאסוף את האזור. הצומת הלימפה מסומן עבור הפניה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 3: בלוטת החלב מלא הר. תמונה של הר שלם של בלוטת החלב נאספה יום לאחר הלידה 25 עכברוש Sprague Dawley. סולם בר = 1 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Ag "/>
איור 4: הסרת רעש. הערוץ הצבעוני הכחול של תמונה של חזה שלם, עם הרקע שחסר. ( א ) מדגים דוגמאות עם רעש. החצים מצביעים על הרעש שנוצר על ידי כלי הדם, והאזור המוצל יותר המקיף את הקצוות הדוקטליים הוא דוגמה לרעש שנוצר על ידי הפחתת הרקע. ( B ) ממחישה את התמונה לאחר הסרת הרעש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 5: שחזור תמונה. שחזור החלקים הנמחקו של התמונה הסופית. ( א ) החצים האדומים מציינים אזורים שבהם חלקים של התמונה אבדו עקב סף. שחזור תמונה Ruction צריך להתבצע באזורים אלה. ( ב ) תמונה החלב לאחר שחזור האזורים שנמחקו. שחזור תמונה צריך להתבצע בזהירות על בסיס מינימלי כדי לשמור על שלמות התמונה המקורית אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 6: שכבת תמונה של שלד. שכבת תמונה המציגה תמונה ממוזערת על התמונה המקורית של הר שלם. תמונה זו ממחישה כי בלוטת השלד משקף את הסתעפות של בלוטת בפועל עם מידה גבוהה של דיוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
S = "jove_content" עבור: keep-together.within-page = "1"> 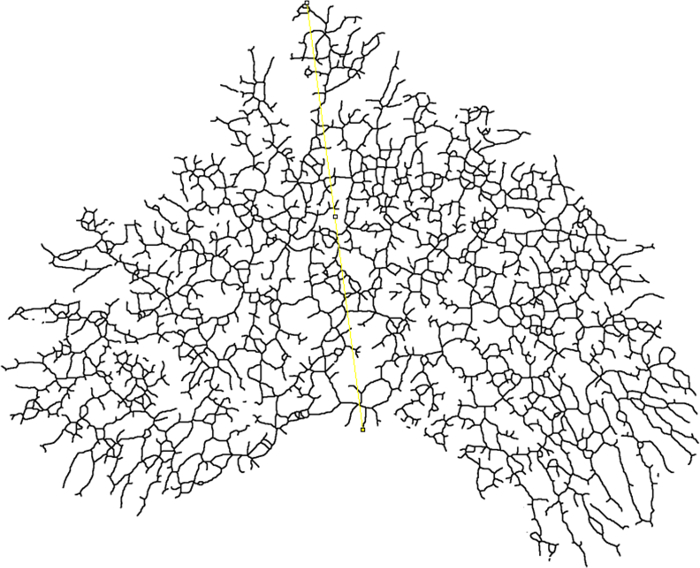
איור 7: סגירת רדיוס. תמונה Skeletized של החזה כולו הר מראה היכן רדיוס מצרף נמדדת (צהוב). הקו צריך להתחיל בבסיס של עץ אפיתל (מרכז ניתוח) ולהאריך לנקודה הדיסטלית ביותר של האפיתל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 8: אזור אפיתל החלב. תמונה Skeletonized מראה מצולע התחקה סביב עץ אפיתל כדי לקבוע את MEA. לחץ כאן לצפייה בסרט גדול יותרSion של דמות זו.

איור 9: יציאת פלט. פלט Sholl של ליניארי ( A ) ו חצי יומן ( ב ) מגרשים של מספר צמתים בכל תוספת רדיאלי. הנקודה האדומה בפנל (A) היא אבסיסה של centroid (מרכז גיאומטרי). בלוח (B), הקו הכחול הוא רגרסיה ליניארית על פני מגוון רחב של נתונים, תוך הקו האדום הוא רגרסיה ליניארית מעל לאחוזון ה 10 th -90. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
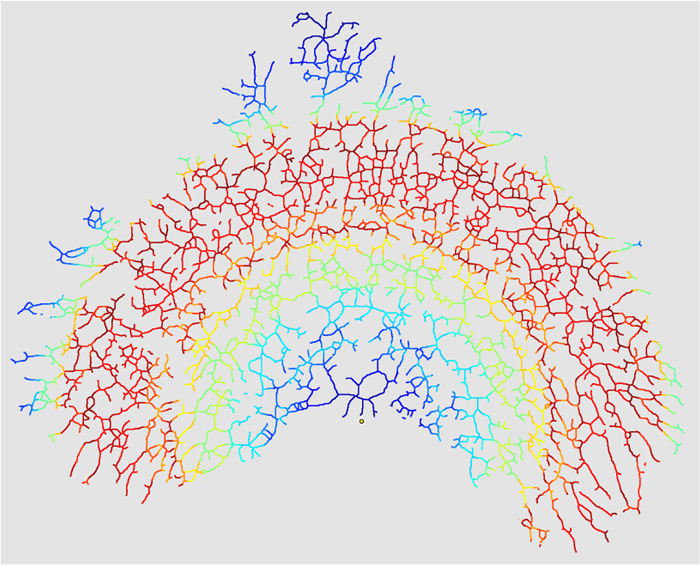
איור 10: מסכת צמתים. כאשר "יצירת אינטרסלקציה "(שלב 4.3.7), הניתוח יפיק מפה חומה של מספר הצמתים על פני הרדיוס המקיף של התמונה.מפה זו משקפת את הצפיפות של צמתים מסתעפים לאורך האפיתל (אדום = חם = צפיפות גבוהה, כחול = קר = צפיפות נמוכה) האפיתל כולו יהיה באותו צבע במפה החום של תמונה שבה k = 0. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
טבלה 1: פרמטרים של ניתוח Sholl. הערכים הם הנתונים המדווחים עבור ניתוח Sholl. הריתוך המקיף (שלב 4.2) ו MEA (שלב 5.1) הם ערכים נמדדים, N ו- K הם תוצאות ניתוח Sholl ומוחזרים בחלון תוצאות ניתוח Sholl (שלב 6.1), ואת צפיפות הענף מחושב באמצעות הנוסחה N / MEA-LNA) (שלב 6.1.2).
| סגירת רדיוס (מ"מ) | MEA (mm2) | N | K | צפיפות הענף (N / mm2) |
| 7.4 | 71.7 | 2381 | 0.73 | 33.2 |
Discussion
מלידה עד גיל ההתבגרות, הצמיחה בלוטת החלב היא allometric. לאחר גיל ההתבגרות, בלוטת החלב מתפתחת דרך הסתעפות הדוקטריים התארכות, אשר ממשיכים עד אפיתל החלב תופסת את כרית שומן כולו. מאפייני הסניף הם היבט חשוב של התפתחות בלוטת החלב, והיכולת לאמוד באופן אובייקטיבי מאפיינים אלה יכולה להיות שימושית מאוד להערכת התפתחות החלב הנורמלית ולזיהוי התפתחות חריגה בעקבות חשיפות מוקדמות לחיים של רעילות החלב.
ניקוד מאפיינים מורפולוגיים, כימות מדידות מימדיות בסיסיות וספירת מבנים החלב הם שיטות אופייניות להערכת התפתחות בלוטת החלב. עם זאת, שיטות אלה אינן רגישות במיוחד בשל השונות הניכרת בגודל ובצורה של בלוטות החלב מכרסם ופרשנות התפתחותית עשוי להיות קשה עבור מעריך חסרי ניסיון. יתר על כן, פוטנציאלהטיה קיימת במחקרים שאינם מסונוורים כראוי. שיטת ניתוח Sholl מספק פרוטוקול יעיל עבור כימות מדויק צפיפות הסתעפות האפיתל השד המורכבות הסתעפות, מאפיינים מורפולוגיים נפרדים של התפתחות בלוטת החלב, אשר בקלות ניתן להשוות בין מחקרים ומעבדות.
ישנם צעדים קריטיים בתוך מספר קטעים של פרוטוקול זה. הראשון והחשוב ביותר מתייחס למצב של בלוטת החלב שלמה הר. הדיוק של שיטה זו מסתמך על בלוטת החלב שנאספה לחלוטין שלם, מותקן ללא פגמים, קבוע ומוכתם כהלכה, ומראה שום חמצון של בלוטת או שינוי צבע משמעותי של המדיום הרכבה. אם הבלוטה קרועה או מקופלת, לא ניתן לקבל מדד מדויק של צפיפות הסתעפות. אם הקצוות הדוקטליים אינם נוכחים, הערך עבור k לא יהיה נציג של הבלוטה כולה. סף יהיה קשה בבלוטותכי לא תוקנו באופן מלא בשל חוסר ניגוד מכתים באפיתל ductal. ולבסוף, אם החמצון או דהוי קיים, פגמים אלה יכולים למנוע את ניתוח מדידת צמתים באזור המושפע.
כאשר מתאים כולו mounts הוכנו, השלב הקריטי הבא הוא לכידת תמונות בהגדלה זהה. מקובל ללכוד תמונות דיגיטליות ברזולוציה הגבוהה ביותר האפשרית. עם זאת, עבור ניתוח Sholl, חשוב יותר כי כל התמונות להיות שנתפסו באותו הגדלה. כפי שתואר ב Stanko et al. (2015) 3 , התגלה caveat שבו תמונות של בלוטות קטנות יותר שנתפסו בהגדלה גבוהה הציגו צפיפויות הסתעפות גדול יותר תמונות של בלוטות גדולות שנלכדו בהגדלה נמוכה יותר, למרות שהם חזותיים נראה פחות מפותחים. שיערנו שההגדלה הגבוהה יותר גרמה לפרטיות רבה יותר, שהובילה אל tהוא סגר את התמונה וגרם ל N גבוה יותר, אשר מייצג יתר על המידה את צפיפות הסתעפות של בלוטות קטנות יותר. בעיה זו הוא alleviated על ידי לכידת כל התמונות באותו הגדלה.
בעוד הבסיס של ניתוח מדויק טמון בתוך הר שלם, הפוטנציאל הגדול ביותר עבור המשתמש מושפע שינויים בנתוני הצומת נמצא בתוך השלבים להסרת הרעש. כל התמונות מכילות רעש, במידה מסוימת, בשל עוצמת מכתים, לא רלוונטיים פיזיולוגיים ישויות ( למשל, כלי דם), וכן חפצים של סף. כל תמונה צריכה להיות מטופלת באופן עצמאי עקב שינויים בכמות הרעש בין התמונות. יש להקפיד לא להסיר מעט מדי רעש או יותר מדי, כמו זה יכול להטות את מספר צמתים, וכתוצאה מכך, צפיפות הסתעפות. עם זאת, לא נבדקה מידת ההשפעה של הרעש על הפרשנות. המשתמש צריך להחליט כמה קפדנית להיות עם הסרת רעש צריך גם לממש consisTency לשמור על שלמות התמונות. מומלץ מאוד שהמשתמש יהיה עיוור לטיפול בעת ביצוע הסרת הרעש, שכן זה יהיה למזער את הפוטנציאל הטיה. הסרת רעש מתוארת בפירוט במדריך למשתמש ImageJ 7 . בהליך זה, הרעש מוסר בעיקר מהתמונה שחוסרה ברקע. בנוסף, תהליך הסף עצמו עשוי להסיר קטעים של הבלוטה. חלקים של הבלוטה שבה רק כמה פיקסלים הוסרו ישוחזר באופן אוטומטי כאשר התמונה skeletized הוא מורחב. עם זאת, פערים רחבים עשויים לדרוש שחזור ידני. המשתמש צריך להחליט אם ובאיזו מידה לשחזר את הקטעים האלה, שוב לשמור על שלמות התמונות המקוריות.
למרות שזה לא קריטי, חשוב לשמור על עדכוני תוכנה, כמו תוכנת ImageJ מתעדכן לעתים קרובות. השיטות המתוארות כאן מבוססות על גרסה 1.48v. פיג 'י והשאול אתוסף nalysis מתעדכנים גם באופן קבוע, והפרוטוקול המתואר כאן מבוסס על v3.4.1. שינויים שבוצעו בגרסאות מאוחרות יותר של ImageJ ו- Plug Sholl עשויים להשפיע על שיטות אלו. ImageJ בודק באופן אוטומטי עדכונים, אך עדכונים עבור FIJI צריכים להיעשות באופן סדיר, ושינויים בין הגרסאות הנוכחיות לבין אלה המשמשים כאן יש לטפל בהתאם לצורך. כל הפרמטרים מוגדרים בכותרות משנה באתר האינטרנט Shol Analysis 6 . הגדרות פרמטר בתוך הליך זה מבוססים על תמונות שנתפסו מן בלוטת החלב כולו mounts שנוצרו במעבדה שלנו אינם מוחלטים. הכנת הר שלם משתנה ממעבדה למעבדה, ופרמטרים אלה עשויים להיות מותאמים בהתאם למטב תמונות ופלט.
כל בלוטת החלב ששימשה במחקר זה הייתה מעכברה של Sprague Dawley ב- PND 25, והשיטה יושמה בצורה נאותה וללא מגבלות. ב חולדות, צפיפות אפיתל החלב incמשחזר עם הגיל לנקודה שבה הוא מונע סף את התמונה עם רזולוציה גבוהה מספיק כדי ליצור תמונה מדויקת skeletized של הבלוטה. לכן, כרגע אנחנו לא ממליצים להשתמש בשיטה זו על בלוטות חולדות מבוגר יותר PND40. למרות שהלחץ של חולדה כבר צוין כאן, זה לא רלוונטי, כמו המחברים אינם מודעים כרגע של כל תכונה ספציפית החלב ספציפי שימנע את השימוש בשיטה זו. יתר על כן, בעוד השיטה המתוארת בתוך נעשתה באמצעות חולדה נקבה, זה יכול להיות מיושם גם על בלוטות החלב של חולדות זכר. יישום זה יש גם בשימוש יעיל עם כל mounts של עכברים (Deirdre טאקר, תקשורת אישית) צריך להיות מתאים עכברים בכל גיל, כמו בלוטות החלב בעכברים לא גדלים צפופים כמו אלה חולדות. עם זאת, ישנן שתי מגבלות עם שימוש ביישום זה בעכברים: 1) ייתכן שיש מעט מדי צמתים מסתעפים בעכברים צעירים יותר כדי לזהות הבדלים משמעותיים 2) שיטה זו cannoלא להיות מוחל על עכברים זכריים, כפי שהם אינם מוצגים אפיתל החלב. עם זאת, שיטה אוטומטית זו מהירה יותר, בלתי מוטה, והרבה פחות עבודה אינטנסיבית מאשר ספירת צמתים מסתעפים באופן ידני.
ייתכן כי החוקרים עשויים לרצות לנצל את בלוטת החלב עבור טכניקות ניסיוניות אחרות, כגון הוצאת מבנים חריגים או אימונוהיסטוכימיה (IHC). למרות טאקר et al. (2016) תיארו שיטה להכנת קטע hematoxylin- eosin מוכתמת של בלוטת החלב כולו הר, 8 אנחנו בדרך כלל שוקלים ליצור הר שלם כדי להיות תהליך מסוף לא יודע על שיטות לשימוש שלם, בלוטת החלב רכוב מבחנים רגישים נוספים, כגון מבחני IHC או TUNEL. כאשר מבחני רגישות באמצעות רקמת בלוטת החלב נדרשים בשילוב עם mounts כולו, מומלץ להשתמש בלוטות החלב הנגדית.
בלוטת החלב ממשיכהO להיות מוקד במספר גדל והולך של מחקרים, אך ההבדלים בין מעבדות קיימים הן הכנת הר שלם 9 , 10 , 11 , 12 והערכות התפתחותיות 13 , 14 , 15 . השינוי של ניתוח Sholl המתואר כאן מספק שיטה מתוקננת לכימות אובייקטיבי של צפיפות הסתעפות, מאפיין חשוב של התפתחות בלוטת החלב, בבלוטת החלב המכרסמים. שיטה זו יכולה להיות מיושמת על כל mounts החלב של מכרסמים זכר או נקבה, ועל אף שמומלץ כיום לשימוש רק בשלב מוקדם לאחר הלידה כדי בלוטות peripubertal מחולדות, זה יכול להיות מיושם על בלוטות החלב של עכברים מכל הגילאים. היישום מתאים במיוחד בלוטות החלב שנאספו מכרסמים peripubertal כמו תקופה זו מומלץנקודת קצה עבור הכנת הר שלם בחלב במבחני המבחן. אופטימיזציה של שיטה זו לשימוש בבלוטות החלב צפופה של עכברושים בוגרים כרגע נחשב.
Disclosures
למחברים אין מה לגלות.
Acknowledgements
המחברים מבקשים להודות לד"ר מיכאל אסטרלינג (Social and Scientific Systems, Inc., Durham, NC) על עזרתו עם אימות השיטה הזאת וד"ר טיאגו פריירה (אוניברסיטת מקגיל, מונטריאול, קוויבק, קנדה) סיוע עם יישום Sholl.
Materials
| Name | Company | Catalog Number | Comments |
| Dissecting board | NA | NA | A piece of styrofoam roughly 10"x12" is suitable. |
| Dissecting T-Pins | Daigger | EF7419A | |
| Spray bottle with ethanol | NA | NA | 70% ethanol is suitable. |
| Curved dissecting scissors | Fine Science Tools | 14569-09 | |
| Straight dissecing scissors | Fine Science Tools | 14568-09 | |
| Curved forceps | Fine Science Tools | 11003-12 | |
| Superfrost Plus 24 x 75 x 1 mm microscope slides | ThermoFisher Scientific | 4951PLUS-001 | Thermo Scientific Superfrost Plus & Colorfrost Plus slides hold tissue sections on permanently without the need for expensive coatings in IHC and Anatomical Pathology applications. This treatment reduces tissue loss during staining as well as hours of slide preparation. Slides electro-statically attract frozen tissue sections and cytology preparations and feature a chemistry similar to silane, although optimized to improve application performance. https://www.thermofisher.com/order/catalog/product/4951PLUS4. |
| Fisherfinest Premium Cover Glass 24 x 60 x 1 mm | Fisher scientific | 12-548-5P | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher scientific | 13-374-12 | |
| Chloroform | Sigma-Aldrich | C2432 | |
| Glacial acetic acid | Sigma-Aldrich | A9967 | |
| Ethanol absolute, ≥99.8% (GC) | Sigma-Aldrich | 24102 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Carmine alum | Sigma-Aldrich | C1022 | |
| Aluminum potassium sulfate | Sigma-Aldrich | A6435 | |
| Permount mounting media | Fisher Scientific | SP15 | |
| Macroscope | Leica | Z16 APO | This is the image capturing hardware and software used in this laboratory. As there are many different options, the methods and applications may vary between laboratories. |
| Digital camera | Leica | DFC295 | |
| Camera software | Leica | Leica Application Suite v3.1 | |
| ImageJ software | Open source | http://imagej.net/Welcome | |
| Sholl analysis | Open source | http://imagej.net/Sholl_Analysis |
References
- Sholl, D. A. Dendritic organization of the neurons in the visual and motor cortices of the cat. J Anat. 87 (4), 387-406 (1953).
- Ferreira, T. A., Iacono, L. L., Gross, C. T. Serotonin receptor 1A modulates actin dynamics and restricts dendritic growth in hippocampal neurons. Eur J Neurosci. 32 (1), 18-26 (2010).
- Stanko, J. P., Easterling, M. R., Fenton, S. E. Application of Sholl analysis to quantify changes in growth and development in rat mammary gland whole mounts. Reprod Toxicol. 54, 129-135 (2015).
- Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in Mammary Gland Morphology and Breast Cancer Risk in Rats. J. Vis. Exp. (44), e2260 (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of Mammary Gland Development and Function in Mouse Models. J. Vis. Exp. (53), e2828 (2011).
- ImageJ User Guide. IJ 1.46r. ImageJ Available from: https://imagej.nih.gov/ij/docs/guide/146.html (2012)
- Tucker, D. K., Foley, J. F., Hayes-Bouknight, S. A., Fenton, S. E. Preparation of High-quality Hematoxylin and Eosin-stained Sections from Rodent Mammary Gland Whole Mounts for Histopathologic Review. Toxicol Pathol. 44 (7), 1059-1064 (2016).
- Fenton, S. E., Hamm, J. T., Birnbaum, L. S., Youngblood, G. L. Persistent abnormalities in the rat mammary gland following gestational and lactational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Toxicol Sci. 67 (1), 63-74 (2002).
- Murray, T. J., Maffini, M. V., Ucci, A. A., Sonnenschein, C., Soto, A. M. Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure. Reprod Toxicol. 23 (3), 383-390 (2007).
- Moral, R., Santucci-Pereira, J., Wang, R., Russo, I. H., Lamartiniere, C. A., Russo, J. In utero exposure to butyl benzyl phthalate induces modifications in the morphology and the gene expression profile of the mammary gland: an experimental study in rats. Environ Health. 10 (1), 5 (2011).
- Johnson, M. D., Mueller, S. C. Three dimensional multiphoton imaging of fresh and whole mount developing mouse mammary glands. BMC Cancer. 13, 373 (2013).
- Enoch, R. R., Stanko, J. P., Greiner, S. N., Youngblood, G. L., Rayner, J. L., Fenton, S. E. Mammary gland development as a sensitive end point after acute prenatal exposure to an atrazine metabolite mixture in female Long-Evans rats. Environ Health Persp. 115 (4), 541-547 (2007).
- Hovey, R. C., Coder, P. S., Wolf, J. C., Sielken, R. L., Tisdel, M. O., Breckenridge, C. B. Quantitative assessment of mammary gland development in female Long Evans rats following in utero exposure to atrazine. Toxicol Sci. 119 (2), 380-390 (2011).
- Mandrup, K. R., Hass, U., Christiansen, S., Boberg, J. Perinatal ethinyl oestradiol alters mammary gland development in male and female Wistar rats. Inter J of Androl. 35 (3), 385-396 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved