Method Article
Cuantificación de la densidad de ramificación en las monturas enteras de la glándula mamaria de rata usando el método de análisis Sholl
En este artículo
Resumen
El desarrollo de la glándula mamaria en el roedor se ha evaluado típicamente mediante evaluaciones descriptivas o mediante la medición de atributos físicos básicos. La densidad de ramificación es un indicador del desarrollo mamario que es difícil de cuantificar objetivamente. Este protocolo describe un método fiable para la evaluación cuantitativa de las características de ramificación de las glándulas mamarias.
Resumen
Un número creciente de estudios están utilizando la glándula mamaria de roedor como punto final para evaluar la toxicidad de desarrollo de una exposición química. Los efectos que estas exposiciones tienen en el desarrollo de la glándula mamaria se evalúan típicamente usando mediciones dimensionales básicas o marcando características morfológicas. Sin embargo, la amplia gama de métodos para interpretar los cambios en el desarrollo podría llevar a traducciones inconsistentes entre los laboratorios. Se necesita un método común de evaluación para que las interpretaciones adecuadas puedan formarse a partir de los datos que se comparan entre los estudios. El presente estudio describe la aplicación del método de análisis Sholl para cuantificar las características de ramificación de las glándulas mamarias. El método de Sholl se desarrolló originalmente para su uso en la cuantificación de patrones dendríticos neuronales. Mediante el uso de ImageJ, un paquete de software de análisis de imágenes de código abierto, y un complemento desarrollado para este análisis, la densidad de ramificación de la glándula mamaria y la complejidad de la amSe determinó la glándula mamaria de una rata hembra peripubertal. Los métodos descritos aquí permitirán el uso del análisis de Sholl como una herramienta eficaz para cuantificar una característica importante del desarrollo de la glándula mamaria.
Introducción
La ramificación de las glándulas mamarias es una característica que comúnmente se evalúa como un indicador del desarrollo de las glándulas, pero es difícil de cuantificar objetivamente. En 1953, Sholl 1 describe un método para medir arborización dendrítica neuronal en las cortezas visuales y motoras del gato, y un plugin para esta técnica fue desarrollada por Ferriera et al 2. Debido a que las neuronas y las glándulas mamarias exhiben una estructura parecida a un árbol similar, el plugin se empleó para cuantificar las densidades de ramificación epitelial mamaria en imágenes 2D de la glándula mamaria peripubertal de rata. La etapa peripuberal fue elegida para el análisis porque el destete es una etapa de la vida que se evalúa a menudo en los laboratorios académicos y los estudios de la guía de la prueba. El análisis de Sholl es un plugin distribuido con FIJI, que es el paquete de procesamiento de imágenes de código abierto ImageJ, con complementos adicionales incluidos. El complemento crea una serie de anillos concéntricos que rodean un prefijo(Típicamente el soma de una neurona o el origen del conducto primario de una glándula mamaria) y extendiéndose hacia fuera hasta la porción más distal del objeto (el radio envolvente). A continuación, cuenta el número de intersecciones (N) que se producen en cada uno de los anillos. El complemento también devuelve un coeficiente de regresión de Sholl ( k ), que es una medida de la tasa de decaimiento de la ramificación epitelial.
Utilizando ImageJ, se crea una imagen esqueletizada de una glándula mamaria de montaje completo y se mide el área epitelial mamaria (MEA). La imagen se analiza utilizando el plugin de análisis de Sholl, y se devuelven valores para N yk , entre otros valores no utilizados aquí. La densidad de ramificación epitelial mamaria se determina mediante el cálculo de N / MEA. La extensión a la cual la ramificación continúa en las regiones externas del epitelio glandular es la complejidad de la ramificación y es un indicador del crecimiento epitelial distal uniforme. Como k es una medida de la disminución distal en epítetoEs una medida eficaz de la complejidad ramificada y un indicador fiable del desarrollo mamario.
Este protocolo describe un método asistido por ordenador para crear imágenes esqueletizadas de glándulas mamarias globales y evaluar cuantitativamente las características de ramificación mamaria en ratas peripuberales macho y hembra. Este método es relativamente rápido y no requiere el uso de equipos de microscopía especializados. El desarrollo y la validación de este método se describen en Stanko et al. (2015) 3 . Este informe también describe la preparación de glándulas mamarias de rata enteras = monturas. Se han descrito procedimientos mamarios de montaje completo similares en de Assis et al. (2010) 4 y Plante et al. (2011) 5 .
Protocolo
Todos los usos y procedimientos de los animales para este estudio fueron aprobados por el Comité de Uso y Cuidado de Animales del Laboratorio del NIEHS y llevados a cabo en una instalación acreditada por la Asociación de Evaluación y Acreditación de Laboratorios de Cuidado de Animales.
1. Glándulas mamarias de los impuestos especiales
- Pre-etiquete todas las diapositivas con un método a prueba de xileno (el lápiz funciona mejor). Cubrirlos con una solución de montaje al final para preservar la etiqueta.
- Eutanasiar el animal mediante un método aprobado por el Comité Institucional de Cuidado y Uso de Animales.
- Después de la eutanasia, coloque el animal en su espalda en una tabla de disección ( Figura 1 ). Estirar y fijar las cuatro extremidades, con las extremidades posteriores formando una V invertida (agujas de mantenimiento o agujas de calibre pequeño funcionan bien).
- Rocíe abundantemente el abdomen con etanol al 70% para mantener el pelo fuera de la muestra mamaria.
- Usando fórceps, levante la piel abdominal en la línea media y haga una pequeña incisión conDiseccionando las tijeras, teniendo cuidado de no perforar el peritoneo.
- Comenzando en la incisión, corte la piel hasta la región del cuello y luego distalmente al miembro delantero. Reducir a la región inguinal y luego distalmente a la primera articulación de la extremidad trasera en el mismo lado; Esta incisión normalmente separa las glándulas mamarias 5 y 6. Evite cortar el peritoneo.
- Retirar la piel con la almohadilla de grasa mamaria adjunta usando una pinza, separándola suavemente del peritoneo usando el extremo romo de las tijeras de disección. Separe lo más profundamente posible para exponer completamente las glándulas mamarias inguinal 4ª y 5ª en la parte inferior de la piel; Fije la piel al tablero de disección ( Figura 2 ).
- Agarrar suavemente el tejido mamario de la 5ª glándula con el lado redondeado de pinzas curvas y lentamente recortar la glándula de la piel, teniendo cuidado de no nick la glándula o la piel.
- Continúe recortando,Moviéndose dorsalmente hasta que las glándulas 4 ª y 5 ª hayan sido completamente levantadas de la piel. Asegúrese de que la región del pezón se retira con el resto de la glándula, ya que esto sirve como punto de partida para el análisis Sholl. Cortar el tejido mamario lejos del cuerpo donde se adhiere a la glándula 4.
- Una vez que la glándula se retira del animal, esparcir uniformemente sobre una diapositiva de microscopía de 25 mm x 75 mm x 1 mm cargada electrostáticamente, con el lado que estaba adyacente a la piel hacia abajo.
NOTA: Para las glándulas de animales más viejos o lactantes, una diapositiva de 51 x 75 x 1 mm puede ser necesaria. - Mientras usa guantes, apriete suavemente las burbujas de aire. Cubrir la glándula con una película de parafina de plástico y otro portaobjetos de microscopio y comprimir la glándula para adherirla a la diapositiva.
NOTA: Un tubo cónico de 50 ml lleno de agua sirve como un peso adecuado. La cantidad de tiempo necesario para adherirse a la corredera depende del espesor de la glándula. Thin, postna(PND) 4 glándulas deben comprimirse durante un mínimo de 30 min, mientras que las glándulas adultas más gruesas pueden requerir hasta 2-5 h.
2. Preparar los Montes Mamarios
- Prepare la solución de alumbre de carmín al menos 24 horas antes, ya que requiere hervir y refrigerar.
- Disolver 1 g de alúmina de carmín y 2,5 g de sulfato de aluminio y potasio (AlK (SO 4 ) 2 · 12H 2 O) en 500 ml de agua destilada y dejar hervir durante 20 minutos en un matraz de 1 L. Llevar el volumen final a 500 ml usando agua destilada.
- Filtrar la solución a través de papel de filtro en un vacío y refrigerar para el almacenamiento.
NOTA: La solución de alumbre de carmín puede reutilizarse pero debe descartarse cuando el color empiece a desvanecerse.
- Antes de la fijación, pelar la película de parafina de la glándula, teniendo cuidado de no tirar de la glándula de la diapositiva. Coloque la (s) lámina (s) en una jarra de cristal y sumerja en un fijador (100% ethanOl, cloroformo y ácido acético glacial en una relación 6: 3: 1) durante 12-48 h, dependiendo del grosor de las glándulas.
- Se vierte el fijador y se empapa las glándulas en etanol al 70% durante 15 min. Gradualmente rehidratar las glándulas mediante el vertido de 1/3 de la solución de etanol y reemplazarlo con agua destilada. Remoje durante 5 min. Repita este proceso tres veces.
- Después del enjuague final, vierta toda la solución etanol / agua y reemplácela con agua destilada al 100%. Remoje las glándulas durante 5 min.
- Vierta el agua destilada y sumerja las glándulas en la solución de alumbre de carmín. Mancha las glándulas durante 12-24 h, dependiendo del grosor.
NOTA: Las glándulas no pueden ser demasiado teñidas, pero el tiempo de tinción para múltiples lotes debe ser el mismo, de modo que la intensidad de tinción sea la misma. - Vierta la solución de alumbre de carmín y enjuague las glándulas en agua destilada al 100% durante 30 s. Gradualmente deshidratar las glándulas empapándolas en etanol al 70% durante 15 min, etanol al 95% durante 15 min, unaNd etanol al 100% durante 20 min.
- Borrar las glándulas de grasa remojándolas en xileno durante 12-72 h, dependiendo del grosor.
NOTA: Las glándulas deben ser translúcidas (claras). Si quedan áreas opacas (blanquecinas), continúe remojándolas en xileno hasta que queden translúcidas. Si las glándulas lactantes o muy gruesas están siendo manchadas y eliminadas, el xileno puede necesitar ser reemplazado una vez para liberar completamente las glándulas. - Montar las diapositivas con un medio de montaje a base de xileno pipeteando suficiente medio para cubrir la glándula. Añadir un cubreobjetos, asegurando que no se forman burbujas de aire.
- Deje que los portaobjetos se sequen. A medida que el medio de montaje se seca, se contrae bajo la cubreobjetos y puede ser necesario añadir medio de montaje adicional. Una vez que no se requiere ningún medio adicional, permita que las diapositivas se sequen completamente; Esto puede tomar 2-3 semanas.
- Una vez que los portaobjetos están completamente secos, cualquier medio de montaje residual se puede retirar con un hisopo de algodón y una pequeña cantidad de xileno. Tenga cuidado de no usarDemasiado xileno, ya que esto puede disolver el medio de montaje y aflojar el cubreobjetos. Si esto ocurre y las burbujas de aire se acumulan debajo de la cubreobjetos, la cubreobjetos se debe quitar en xileno y el proceso de montaje debe repetirse.
3. Preparar imágenes de montaje completo para el análisis
- Capture imágenes de montajes enteros ( Figura 3 ) usando un macroscopio o microscopio de disección y una cámara digital con el software apropiado.
NOTA: Si bien se puede seleccionar cualquier ampliación que capte todo el epitelio glandular, es imprescindible capturar todas las imágenes de montaje completo que se compararán entre sí con la misma ampliación. - Descargue el software ImageJ (o el software FIJI) 6 .
- Abra la imagen mamaria de montaje completo en ImageJ haciendo clic en "Archivo" → "Abrir". Seleccione la herramienta Mano a Mano y trace alrededor del epitelio glandular. Seleccione "Editar" & #8594; -El exterior claro.
- Quite los ganglios linfáticos trazando alrededor del nodo y usando la herramienta Mano a Mano y "Editar" → "Cortar".
- Separe los canales de color seleccionando "Imagen" → "Color" → "Canales divididos". Seleccione el canal con el mejor contraste, típicamente el canal azul.
NOTA: Una imagen RGB consiste en una pila de los componentes rojo, verde y azul de esa imagen. Esta acción separa estos componentes en tres imágenes de 8 bits en escala de grises. - Restar el fondo seleccionando "Proceso" → "Restar fondo". Seleccione los parámetros deseados y haga clic en "Vista previa" para ver los cambios.
NOTA: "Restar fondo" elimina fondos continuos y suaves. Además, "Proceso" → "Filtros" → "Unsharp Mask" se puede utilizar para crear contraste. - Elige uno de los E los siguientes métodos para eliminar automáticamente el ruido: despeckle o remove outliers.
NOTA: ImageJ ofrece un tercer método para la eliminación automática de ruido: quite NaNs. Sin embargo, el comando Eliminar NaNs no es aplicable ya que utiliza imágenes de 32 bits y el método actual utiliza imágenes de 8 bits.- Elimine el ruido utilizando el comando despeckle seleccionando "Procesar" → "Ruido" → "Eliminar".
NOTA: Esto es equivalente a agregar un filtro mediano, que reemplaza cada píxel con el valor mediano en su vecindario 3 × 3. - Elimine el ruido utilizando el comando de eliminación de valores aleatorios seleccionando "Proceso" → "Ruido" → "Eliminar valores atípicos".
NOTA: Este proceso reemplaza un píxel con la mediana de los píxeles en el entorno inmediato si se desvía de la mediana por más de un cierto valor (el umbral).
- Elimine el ruido utilizando el comando despeckle seleccionando "Procesar" → "Ruido" → "Eliminar".
- Elimine manualmente el ruido restante (Lass = "xfig"> Figura 4).
- Abra una copia de la imagen original y utilícela como guía para lo que es y lo que no es ruido. Haga clic en el botón de doble flecha roja situado en el extremo derecho de la barra de herramientas. Seleccione las herramientas de dibujo; Los botones de la herramienta de dibujo aparecerán ahora en la barra de herramientas.
- Haga clic en la herramienta Borrador. Ajuste el diámetro del borrador haciendo clic con el botón derecho en el botón de la herramienta Borrador. Mantenga pulsado el botón izquierdo del ratón para borrar el ruido.
NOTA: Sólo se puede deshacer una sesión de borrado. Una vez que el botón izquierdo del ratón se suelta y vuelve a hacer clic, la borradura anterior no se puede deshacer.
- Ajuste el umbral seleccionando "Imagen" → "Ajustar" → "Umbral". Mueva los controles deslizantes para ajustar los valores umbral mínimo (control deslizante superior) y máximo (control deslizante inferior) hasta obtener una representación adecuada de la glándula.
NOTA: Establecer el valor de umbral segmenta las imágenes en escala de grises en características de interés y de fondo.- Haga clic en Aplicar. Si es necesario, elimine el ruido adicional en este punto siguiendo los pasos 3.6.1 y 3.6.2.
- Reconstruir las porciones del epitelio glandular que se eliminaron por el umbral y la eliminación de ruido ( Figura 5 ].
- Realizar la reconstrucción de la imagen cuidadosamente y sobre una base mínima para mantener la integridad de la imagen original. Consulte la imagen original para obtener una referencia a lo que es y lo que no es epitelio.
- Haga clic en la herramienta Spray Can (en la barra de herramientas con las herramientas de dibujo). Ajuste el diámetro y la velocidad de pulverización haciendo clic con el botón derecho en el botón de la herramienta Spray Can. Rellene cuidadosamente las secciones que faltan de la glándula haciendo clic o manteniendo presionado el botón izquierdo del ratón.
- Crear una imagen esqueletizada de la glándula para llevar a cabo el Análisis de Sholl. Asegúrese de que la imagen umbral sea binaria seleccionando "Proceso" → "Binario" → "Hacer B Inary ".
- Si la imagen es blanca sobre un fondo negro, seleccione "Procesar" → "Binario" → "Opciones" y desmarque "Fondo Negro". Esqueleice la imagen seleccionando "Proceso" → "Binario" → "Esqueleto".
NOTA: Esto quita repetidamente los píxeles de los bordes de la imagen binaria hasta que se reduce a una forma de un solo píxel de ancho. - Dilate la imagen una vez seleccionando "Proceso" → "Binario" → "Dilate".
NOTA: Esto rellena las brechas creadas por el umbral y el esqueleto añadiendo píxeles a los bordes de la imagen binaria.
- Si la imagen es blanca sobre un fondo negro, seleccione "Procesar" → "Binario" → "Opciones" y desmarque "Fondo Negro". Esqueleice la imagen seleccionando "Proceso" → "Binario" → "Esqueleto".
- Guarde la imagen seleccionando "Archivo" → "Guardar como". Seleccione un tipo de imagen (normalmente jpeg), escriba el nombre del archivo y haga clic en "Aceptar".
- Compruebe la exactitud de la imagen esqueletizada superponiendo la imagen esqueletizada en la imagen original (Ass = "xfig"> Figura 6).
- Cree una superposición abriendo tanto la imagen original como la imagen esqueletizada. Seleccione "Imagen" → "Superposición" → "Añadir imagen". En el cuadro de diálogo "Agregar imagen", seleccione la imagen de esqueleto del menú desplegable "Imagen a Agregar" y establezca la opacidad al 30%.
- Guarde la imagen de la imagen de esqueleto superpuesta en el original seleccionando "Archivo" → "Guardar como". Seleccione un tipo de imagen, escriba el nombre del archivo y haga clic en "Aceptar".
4. Realizar el Análisis de Sholl
- Abra una imagen de esqueleto y realice el binario de imagen seleccionando "Proceso" → "Binario" → "Hacer binario".
- Antes de ajustar la escala de aumento, mida el número de píxeles / mm usando un micrómetro para la magnificación en la que se capturaron las imágenes.
- Ajustar la magnificación medida sSeleccionando "Analizar" → "Establecer escala". Introduzca el número de píxeles / mm. Ajuste la "Distancia conocida" y la "Relación de aspecto de píxel", tanto para 1. Introduzca "mm" para la "Unidad de longitud" y marque "Global" (mantiene la misma escala para cada imagen).
- Determine el radio final (radio que lo rodea) para el análisis de Sholl, trazando una línea desde el inicio del conducto primario (centro de análisis) hasta el punto más distal del epitelio glandular ( Figura 7 ).
- Utilice la herramienta de dibujo lineal en la barra de herramientas para dibujar una línea entre los puntos de interés. Presione la tecla "M" para tomar una medida y observe que se abrirá una ventana de resultados.
NOTA: El valor en la columna "Longitud" es la longitud de la línea en mm. Este valor se introducirá automáticamente como el radio final cuando se establecen los parámetros Sholl. El complemento Sholl utilizará el punto de partidaDe la línea como el centro de los anillos céntricos.
- Utilice la herramienta de dibujo lineal en la barra de herramientas para dibujar una línea entre los puntos de interés. Presione la tecla "M" para tomar una medida y observe que se abrirá una ventana de resultados.
- Ejecución del análisis Sholl.
- Ejecute el análisis seleccionando "Plugins" "Advanced Sholl Analysis"; Aparecerá una ventana de parámetros.
- Establecer el radio de inicio en "I. Definición de los depósitos" a 0,00 mm; La longitud de la línea medida en el paso 4.2 se introducirá automáticamente como el "radio final".
- Ajuste el "Tamaño de paso del radio" a 0.1 mm.
NOTA: El tamaño del paso del radio determina el número de anillos (efectivamente el número de iteraciones); Un paso más pequeño aumentará el número de anillos, mientras que un paso más grande disminuirá el número de anillos. El radio no se puede establecer demasiado pequeño, aunque un radio excesivamente pequeño resultará en un número innecesariamente grande de anillos. Sin embargo, se puede configurar demasiado grande, lo que creará menos anillos y, posteriormente, subestimar el número verdadero de intersecciones. Véase Stanko et al.(2015) para obtener información adicional sobre la determinación del tamaño del paso. - Establezca "# Muestras" en 1 y la "Integración" en "Media" en "II Múltiples Muestras por Radio".
- Ajuste el "Cutoff del radio de cierre" en 1 y marque "inferir desde el radio de inicio" para "# Primarios" en "III Descriptores y ajuste de la curva".
NOTA: "Ajustar el perfil y calcular los descriptores" y "Mostrar detalles de ajuste" se pueden comprobar como se desee. - Marque "Lineal" y seleccione "Mejor grado de ajuste" en "Perfiles sin normalización"; Marque "Más informativo". Seleccione "Area for Normalized Profiles" en "IV. Sholl Methods".
- Marque "Crear máscara de intersecciones" en "V. Opciones de salida" para crear un mapa de calor de las intersecciones (opcional).
- Haga clic en "Cf. Segmentación" para generar una ventana de vista previa de la imagen con anillos para confirmar el áreaDel análisis.
- Haga clic en "Aceptar" para ejecutar el análisis.
5. Medición del MEA
- Mida el MEA trazando la distancia más corta alrededor del árbol epitelial ( Figura 8 ).
- En ImageJ con la imagen de esqueleto de la glándula abierta, haga clic en la herramienta Polígono. Haga clic en un punto del perímetro del árbol epitelial para comenzar el polígono, desplazarse por el perímetro de la glándula y hacer clic para añadir un segmento de línea.
- Cuando todo el área epitelial ha sido eludido, haga doble clic para cerrar el polígono. Presione la tecla "M" para abrir una ventana de resultados; El valor en la columna "Área" es el MEA.
- En los casos en que el epitelio glandular se ha extendido más allá del ganglio linfático, restar el área de los ganglios linfáticos (LNA) del MEA al calcular la densidad de ramificación.
- Medir el LNA mediante el seguimiento de los ganglios linfáticos en el mismo mannEr como el árbol epitelial y presionando "M."
NOTA: El LNA debe ser restado del MEA en estos casos porque el ganglio linfático impide que el análisis cuente las intersecciones dentro del LNA. Cuando el epitelio no ha alcanzado el ganglio linfático, el LNA es cero.
- Medir el LNA mediante el seguimiento de los ganglios linfáticos en el mismo mannEr como el árbol epitelial y presionando "M."
6. Datos de los informes
- Informe valores para el radio envolvente, MEA, N, k , y la densidad de ramificación.
NOTA: El radio de inclusión se determina en el paso 4.2 y el MEA se determina en el paso 5.1.- Ejecute el análisis para generar una ventana de resultados Sholl.
NOTA: El N informado es el valor de la suma inters. El k informado es el valor para el coeficiente de regresión de Sholl (semi-log). El análisis de Sholl devolverá un valor para k sobre cualquier región medida del epitelio glandular. Para obtener un valor exacto para k sobre todo el epitelio, los extremos ductales deben estar presentes. - ModificarE Análisis de Sholl para la glándula mamaria usando el valor de salida para N para calcular la densidad de ramificación (el punto final fundamental de este método). Calcular la densidad de ramificación utilizando la fórmula N / (MEA-LNA) y comunicar el valor como N / mm 2.
- Ejecute el análisis para generar una ventana de resultados Sholl.
Resultados
Los valores para el radio cerrado medido, MEA, N, k , y densidad de ramificación calculada para la glándula mamaria analizada en este protocolo se presentan en la Tabla 1 . El análisis de Sholl genera diagramas lineales y semi-log del número de intersecciones en cada radio ( Figura 9 ) y, si se selecciona, un mapa de calor de las intersecciones ( Figura 10 ). Las glándulas menos desarrolladas exhiben menos intersecciones dentro del mismo MEA y por lo tanto tienen una menor densidad de ramificación. Una glándula bien desarrollada continuará ramificándose uniformemente a lo largo de todo el epitelio glandular, particularmente en las regiones distales. El grado en que la ramificación continúa en estas regiones se puede describir como complejidad de ramificación y las disminuciones en complejidad se transmiten como una tasa de decaimiento (o coeficiente de regresión de Sholl, k ). La tasa de decaimiento refleja el cambio en el sujetador epitelial distalY se mide como la pendiente de la línea del número de intersecciones trazado contra el radio que lo rodea ( es decir, el crecimiento longitudinal del epitelio). Por tanto, el coeficiente de regresión de Sholl se calcula tomando la pendiente de la recta del gráfico de log (N / S) en función de la distancia radial (r), donde log (N / S) = - k r + m, siendo N N El número de intersecciones para cada anillo de radio r y área S (πr 2 ), siendo m la intersección. Debido a que la pendiente - k describe la desintegración de las intersecciones, un valor de - k = 0 indicaría un decaimiento cero y una ramificación uniforme desde el centro del análisis hasta el borde del epitelio. En las glándulas escasamente desarrolladas, la desintegración ramificada se incrementa; Hay menos intersecciones en la región distal del árbol epitelial; Y la pendiente, k , se incrementa. Por lo tanto, los valores de k aproximándose a 0 son indicativos de una mayor ramificación distal ( es decir, complejidad de ramificación) y un pozo- glándula mamaria desarrollada.
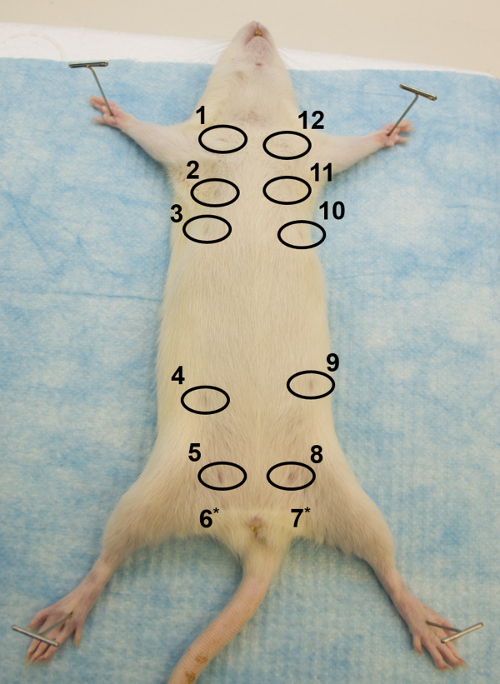
Figura 1: Vista ventral. Imagen de la porción ventral de una rata Sprague Dawley hembra adulta, que ilustra cómo asegurar la rata en la superficie de disección y la ubicación de las 12 glándulas mamarias, con los pezones en círculos. * Los pezones de las glándulas 6 y 7 no son visibles. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Glándula Mamaria de Rata Femenina. Ilustración de las glándulas mamarias expuestas 4 (MG4) y 5 (MG5), con la piel fijada a la superficie de disección por encima de MG4 y justo por debajo de MG5. Las glándulas se deben quitar del sk Al comenzar con MG5 y continuar hacia arriba y dorsalmente hasta que MG5 y 4 se eliminan por completo. El pezón se encuentra en el área distal de la glándula 4, y se debe ejercer cuidado para recoger esta zona. El ganglio linfático está indicado como referencia. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Glándula mamaria Montaje completo. Una imagen de montaje completo de una glándula mamaria recogida de una rata hembra Sprague Dawley de día 25 postnatal. Barra de escala = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
.jpg "/>
Figura 4: Eliminación del ruido. El canal de color azul de una imagen mamaria de montaje completo, con el fondo restado. ( A ) muestra ejemplos con ruido. Las flechas indican el ruido creado por los vasos sanguíneos, y la región más sombreada alrededor de los extremos ductales es un ejemplo de ruido creado por sustracción del fondo. ( B ) ilustra la imagen después de que se ha eliminado el ruido. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Reconstrucción de imágenes. Reconstrucción de las partes borradas de la imagen umbral. ( A ) Las flechas rojas indican regiones donde se perdieron partes de la imagen debido al umbral. Reconocimiento de imagenEn estas regiones. ( B ) Imagen mamaria después de reconstruir las regiones suprimidas. La reconstrucción de la imagen debe realizarse con cuidado y sobre una base mínima para mantener la integridad de la imagen original. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Superposición de una imagen esqueletizada. Imagen superpuesta que muestra una imagen esqueletizada superpuesta a la imagen original de montaje completo. Esta imagen demuestra que la glándula esqueletizada refleja la ramificación de la glándula real con un alto grado de precisión. Haga clic aquí para ver una versión más grande de esta figura.
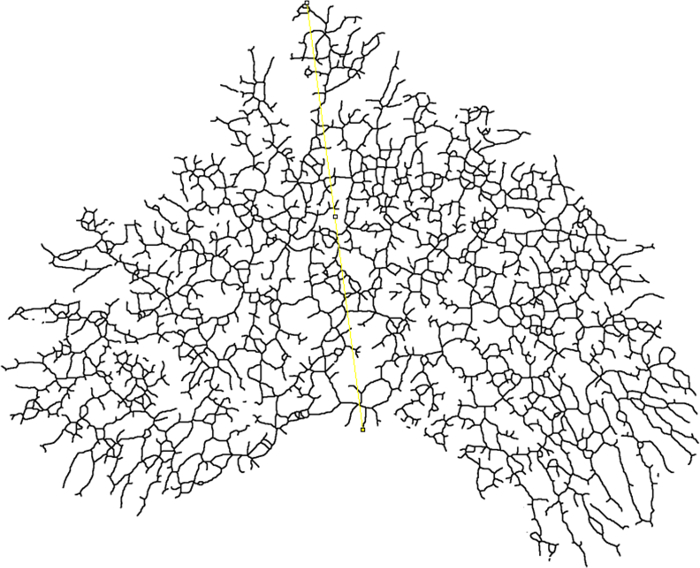
Figura 7: Radio envolvente. Imagen esqueletizada de un montaje mamario entero que muestra donde se mide el radio que lo rodea (amarillo). La línea debe comenzar en la base del árbol epitelial (centro de análisis) y extenderse hasta el punto más distal del epitelio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Área epitelial mamaria. Imagen esqueletizada que muestra un polígono trazado alrededor del árbol epitelial para determinar el MEA. Haga clic aquí para ver una versión más grandeDe esta cifra.

Figura 9: Salida de trazado Sholl. Salida de Sholl de tramas lineales ( A ) y semi-log ( B ) del número de intersecciones en cada incremento radial. El punto rojo en el panel (A) es la abscisa del centroide (centro geométrico). En el panel (B), la línea azul es la regresión lineal en el intervalo completo de datos, mientras que la línea roja es la regresión lineal en el 10 º -90 º percentil. Haga clic aquí para ver una versión más grande de esta figura.
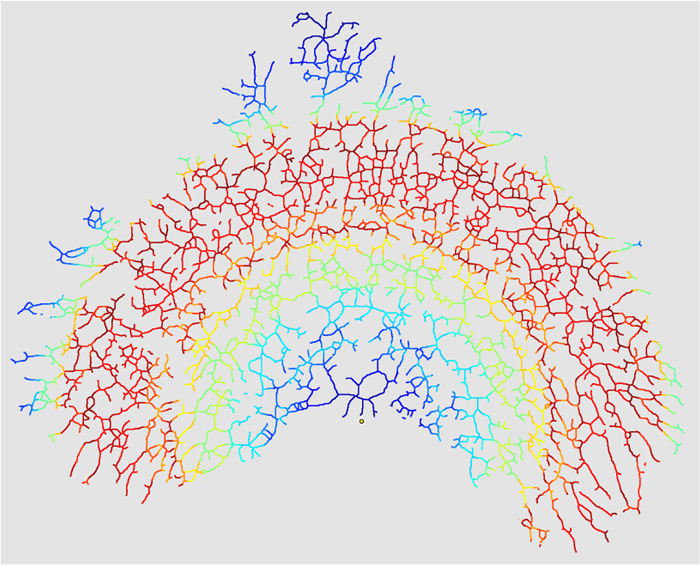
Figura 10: Máscara de intersecciones. Cuando el "Create InterEste mapa de calor refleja la densidad de las intersecciones de ramificación en todo el epitelio (rojo = caliente = Alta densidad, azul = frío = densidad baja) Todo el epitelio sería del mismo color en un mapa de calor de una imagen donde k = 0. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Parámetros de Análisis de Sholl. Los valores son los datos reportados para el análisis Sholl. El radio de cercado (paso 4.2) y el MEA (paso 5.1) son valores medidos, N yk son resultados del análisis de Sholl y se devuelven en la ventana de resultados del análisis de Sholl (paso 6.1), y la densidad de ramificación se calcula usando la fórmula N / MEA-LNA) (paso 6.1.2).
| Radio de cercado (mm) | MEA (mm2) | norte | K | Densidad de ramificación (N / mm2) |
| 7,4 | 71,7 | 2381 | 0,73 | 33,2 |
Discusión
Desde el nacimiento hasta la pubertad, el crecimiento de la glándula mamaria es alométrico. Después de la pubertad, la glándula mamaria se desarrolla a través de ramificaciones ductales extensas y elongación, que continúan hasta que el epitelio mamario ocupa la almohadilla de grasa entera. Las características de ramificación son un aspecto importante del desarrollo de la glándula mamaria y la capacidad de cuantificar objetivamente estas características puede ser muy útil para evaluar el desarrollo mamario normal y para identificar el desarrollo anormal después de la exposición temprana a los tóxicos mamarios.
La determinación de las características morfológicas, la cuantificación de las medidas dimensionales básicas y el recuento de las estructuras mamarias son métodos típicos para evaluar el desarrollo de la glándula mamaria. Sin embargo, estos métodos no son especialmente sensibles debido a la considerable variación en el tamaño y la forma de las glándulas mamarias de roedores y la interpretación del desarrollo puede ser difícil para un evaluador inexperto. Además, el potencialExiste sesgo en estudios que no están cegados adecuadamente. El método de análisis de Sholl proporciona un protocolo eficiente para cuantificar con precisión la densidad de ramificación epitelial mamaria y la complejidad de ramificación, características morfológicas discretas del desarrollo de la glándula mamaria, que pueden compararse fácilmente entre estudios y laboratorios.
Hay pasos críticos dentro de varias secciones de este protocolo. La primera y más importante se refiere a la condición de la glándula mamaria de montaje completo. La exactitud de este método se basa en una glándula mamaria que se recoge totalmente intacto, montado sin defectos, correctamente fijado y teñido, y no demuestra la oxidación de la glándula o decoloración significativa del medio de montaje. Si la glándula está desgarrada o doblada, no se puede obtener una medida exacta de la densidad de ramificación. Si los extremos ductal no están presentes, el valor de k no será representativo de toda la glándula. El umbral será difícil en las glándulasQue no se han fijado completamente debido a una falta de contraste de tinción en el epitelio ductal. Y finalmente, si la oxidación o la decoloración están presentes, estas imperfecciones podrían prevenir el análisis de medir intersecciones en el área afectada.
Cuando se han preparado montajes enteros adecuados, el siguiente paso crítico es capturar las imágenes con la misma ampliación. Es una práctica común capturar imágenes digitales a la máxima resolución posible. Sin embargo, para el análisis Sholl, es más importante que todas las imágenes sean capturadas con la misma ampliación. Como se describe en Stanko et al. (2015) 3 , se descubrió una advertencia en la que las imágenes de las glándulas más pequeñas capturadas con gran aumento exhibían mayores densidades de ramificación que las imágenes de las glándulas más grandes capturadas con un aumento menor, a pesar de que parecían visualmente menos desarrolladas. Se planteó la hipótesis de que la mayor magnificación resultó en mayor detalle, que se trasladó a tÉl esqueletizó la imagen y resultó en un N más alto, que sobre-representó la densidad de ramificación de las glándulas más pequeñas. Este problema se alivia al capturar todas las imágenes con la misma ampliación.
Si bien la base de un análisis preciso se encuentra dentro del montaje completo, el mayor potencial para los cambios influenciados por el usuario en los datos de intersección se encuentra dentro de los pasos para la eliminación del ruido. Todas las imágenes contienen ruido, en cierta medida, debido a la intensidad de tinción, entidades fisiológicas no relevantes ( por ejemplo, vasos sanguíneos) y artefactos de umbral. Cada imagen debe ser abordada independientemente debido a las variaciones en la cantidad de ruido entre imágenes. Se debe tener cuidado de no eliminar demasiado poco o demasiado ruido, ya que esto puede sesgar el número de intersecciones y, en consecuencia, la densidad de ramificación. Sin embargo, no se ha examinado hasta qué punto el ruido afecta a la interpretación. El usuario debe decidir cuan meticuloso ser con la eliminación de ruido y también debe ejercer consisMantener la integridad de las imágenes. Se recomienda encarecidamente que el usuario esté cegado al tratamiento al realizar la eliminación del ruido, ya que esto minimizará el potencial de sesgo. La eliminación del ruido se describe en detalle en la Guía del usuario de ImageJ 7 . En este procedimiento, el ruido se elimina principalmente de la imagen substraída de fondo. Además, el propio proceso de umbradura puede eliminar segmentos de la glándula. Partes de la glándula donde sólo se han quitado algunos píxeles se reconstruirán automáticamente cuando la imagen esqueletizada se dilate. Sin embargo, las brechas expansivas pueden requerir reconstrucción manual. El usuario debe decidir si y en qué medida reconstruir estos segmentos, manteniendo de nuevo la integridad de las imágenes originales.
Aunque esto no es crítico, es importante mantener las actualizaciones de software, ya que el software de ImageJ se actualiza con frecuencia. Los métodos descritos aquí se basan en la versión 1.48v. FIJI y el Sholl aNalysis plugin también se actualizan regularmente, y el protocolo descrito aquí se basa en v3.4.1. Los cambios realizados en las versiones posteriores de ImageJ y del complemento Sholl Analysis pueden afectar a estos métodos. ImageJ comprueba automáticamente si hay actualizaciones, pero las actualizaciones para FIJI deben realizarse regularmente, y los cambios entre las versiones actuales y las utilizadas aquí deben ser abordados según sea necesario. Todos los parámetros se definen en las subpartidas de la página web de Análisis de Sholl 6 . Los ajustes de parámetros dentro de este procedimiento se basan en las imágenes capturadas de glándulas mamarias enteras creadas en nuestro laboratorio y no son absolutas. La preparación de montaje completo varía de laboratorio a laboratorio, y estos parámetros se pueden ajustar en consecuencia para optimizar las imágenes y la salida.
El montaje completo de la glándula mamaria utilizado en este estudio fue de una rata Sprague Dawley hembra en PND 25, y el método se aplicó apropiadamente y sin limitaciones. En ratas, la densidad epitelial mamariaSe eleva con la edad hasta un punto en el que impide el umbral de la imagen con una resolución suficientemente alta para generar una imagen esqueletizada precisa de la glándula. Por lo tanto, actualmente no recomendamos el uso de este método en glándulas de ratas mayores de PND40. Aunque la cepa de rata se ha indicado aquí, es irrelevante, ya que los autores no están actualmente al tanto de cualquier rasgo mamarias cepa específica que impida el uso de este método. Además, aunque el método descrito en el interior se realizó utilizando una rata hembra, también podría aplicarse a las glándulas mamarias de ratas macho. Esta aplicación también se ha utilizado con eficacia con enteros monturas de ratones (Deirdre Tucker, comunicación personal) y debe ser adecuado para los ratones de cualquier edad, como las glándulas mamarias en ratones no crecen tan denso como los de ratas. Sin embargo, existen dos limitaciones con el uso de esta aplicación en ratones: 1) no puede ser demasiado pocas intersecciones de ramificación en ratones más jóvenes para detectar diferencias significativas y Canno 2) este métodoT se aplican a ratones machos, ya que no presentan epitelio mamario. Sin embargo, este método automatizado es más rápido, imparcial y mucho menos intensivo de trabajo que contar las intersecciones de ramificación manualmente.
Es posible que los investigadores deseen utilizar la glándula mamaria para otras técnicas experimentales, tales como extirpar estructuras anormales o para inmunohistoquímica (IHC). Aunque Tucker et al. (2016) han descrito un método para preparar una sección teñida con hematoxilina-eosina a partir de un montaje completo de glándula mamaria de ratón 8 , normalmente consideramos la creación de un montaje completo para ser un proceso terminal y no conocemos los métodos para usar una sección entera- Montado en la glándula mamaria para los ensayos sensibles adicionales, tales como IHC o TUNEL ensayos. Cuando se requieren ensayos sensibles usando tejido de la glándula mamaria en conjunto con monturas enteras, se recomienda usar las glándulas mamarias contralaterales.
La glándula mamaria continúaO ser el punto focal en un número creciente de estudios, pero las diferencias entre los laboratorios existen tanto en la preparación integral 9 , 10 , 11 , 12 como en las evaluaciones de desarrollo 13 , 14 , 15 . La modificación del análisis de Sholl descrito aquí proporciona un método estandarizado para la cuantificación objetiva de la densidad de ramificación, una característica importante del desarrollo de la glándula mamaria, en la glándula mamaria de roedor. Este método puede aplicarse a monturas mamarias enteras de roedores machos o hembras, y aunque actualmente se recomienda para uso sólo en las glándulas pre-postnatales a peripuberales de ratas, puede aplicarse a glándulas mamarias de ratones de todas las edades. La aplicación es particularmente adecuada para las glándulas mamarias recolectadas de roedores peripuberales, ya que este período es una recomendaciónPunto final para la preparación mamaria completa en los estudios de referencia de la prueba. Actualmente se está considerando la optimización de este método para su uso en las glándulas mamarias más densas de ratas adultas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al Dr. Michael Easterling (Sistemas Social y Científico, Inc., Durham, NC) por su ayuda con la validación de este método y el Dr. Tiago Ferreira (McGill University, Montreal, Quebec, Canadá) Asistencia con la aplicación Sholl.
Materiales
| Name | Company | Catalog Number | Comments |
| Dissecting board | NA | NA | A piece of styrofoam roughly 10"x12" is suitable. |
| Dissecting T-Pins | Daigger | EF7419A | |
| Spray bottle with ethanol | NA | NA | 70% ethanol is suitable. |
| Curved dissecting scissors | Fine Science Tools | 14569-09 | |
| Straight dissecing scissors | Fine Science Tools | 14568-09 | |
| Curved forceps | Fine Science Tools | 11003-12 | |
| Superfrost Plus 24 x 75 x 1 mm microscope slides | ThermoFisher Scientific | 4951PLUS-001 | Thermo Scientific Superfrost Plus & Colorfrost Plus slides hold tissue sections on permanently without the need for expensive coatings in IHC and Anatomical Pathology applications. This treatment reduces tissue loss during staining as well as hours of slide preparation. Slides electro-statically attract frozen tissue sections and cytology preparations and feature a chemistry similar to silane, although optimized to improve application performance. https://www.thermofisher.com/order/catalog/product/4951PLUS4. |
| Fisherfinest Premium Cover Glass 24 x 60 x 1 mm | Fisher scientific | 12-548-5P | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher scientific | 13-374-12 | |
| Chloroform | Sigma-Aldrich | C2432 | |
| Glacial acetic acid | Sigma-Aldrich | A9967 | |
| Ethanol absolute, ≥99.8% (GC) | Sigma-Aldrich | 24102 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Carmine alum | Sigma-Aldrich | C1022 | |
| Aluminum potassium sulfate | Sigma-Aldrich | A6435 | |
| Permount mounting media | Fisher Scientific | SP15 | |
| Macroscope | Leica | Z16 APO | This is the image capturing hardware and software used in this laboratory. As there are many different options, the methods and applications may vary between laboratories. |
| Digital camera | Leica | DFC295 | |
| Camera software | Leica | Leica Application Suite v3.1 | |
| ImageJ software | Open source | http://imagej.net/Welcome | |
| Sholl analysis | Open source | http://imagej.net/Sholl_Analysis |
Referencias
- Sholl, D. A. Dendritic organization of the neurons in the visual and motor cortices of the cat. J Anat. 87 (4), 387-406 (1953).
- Ferreira, T. A., Iacono, L. L., Gross, C. T. Serotonin receptor 1A modulates actin dynamics and restricts dendritic growth in hippocampal neurons. Eur J Neurosci. 32 (1), 18-26 (2010).
- Stanko, J. P., Easterling, M. R., Fenton, S. E. Application of Sholl analysis to quantify changes in growth and development in rat mammary gland whole mounts. Reprod Toxicol. 54, 129-135 (2015).
- Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in Mammary Gland Morphology and Breast Cancer Risk in Rats. J. Vis. Exp. (44), e2260 (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of Mammary Gland Development and Function in Mouse Models. J. Vis. Exp. (53), e2828 (2011).
- ImageJ User Guide. IJ 1.46r. ImageJ Available from: https://imagej.nih.gov/ij/docs/guide/146.html (2012)
- Tucker, D. K., Foley, J. F., Hayes-Bouknight, S. A., Fenton, S. E. Preparation of High-quality Hematoxylin and Eosin-stained Sections from Rodent Mammary Gland Whole Mounts for Histopathologic Review. Toxicol Pathol. 44 (7), 1059-1064 (2016).
- Fenton, S. E., Hamm, J. T., Birnbaum, L. S., Youngblood, G. L. Persistent abnormalities in the rat mammary gland following gestational and lactational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Toxicol Sci. 67 (1), 63-74 (2002).
- Murray, T. J., Maffini, M. V., Ucci, A. A., Sonnenschein, C., Soto, A. M. Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure. Reprod Toxicol. 23 (3), 383-390 (2007).
- Moral, R., Santucci-Pereira, J., Wang, R., Russo, I. H., Lamartiniere, C. A., Russo, J. In utero exposure to butyl benzyl phthalate induces modifications in the morphology and the gene expression profile of the mammary gland: an experimental study in rats. Environ Health. 10 (1), 5 (2011).
- Johnson, M. D., Mueller, S. C. Three dimensional multiphoton imaging of fresh and whole mount developing mouse mammary glands. BMC Cancer. 13, 373 (2013).
- Enoch, R. R., Stanko, J. P., Greiner, S. N., Youngblood, G. L., Rayner, J. L., Fenton, S. E. Mammary gland development as a sensitive end point after acute prenatal exposure to an atrazine metabolite mixture in female Long-Evans rats. Environ Health Persp. 115 (4), 541-547 (2007).
- Hovey, R. C., Coder, P. S., Wolf, J. C., Sielken, R. L., Tisdel, M. O., Breckenridge, C. B. Quantitative assessment of mammary gland development in female Long Evans rats following in utero exposure to atrazine. Toxicol Sci. 119 (2), 380-390 (2011).
- Mandrup, K. R., Hass, U., Christiansen, S., Boberg, J. Perinatal ethinyl oestradiol alters mammary gland development in male and female Wistar rats. Inter J of Androl. 35 (3), 385-396 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados