Method Article
A escala do Engineered enxertos vasculares Usando 3D Impresso Guides and the Ring método de empilhamento
Neste Artigo
Resumo
vasos sanguíneos engenharia escaláveis iria melhorar a aplicabilidade clínica. Usando guias impresso-3D facilmente consideráveis, anéis de músculo liso vascular foram criados e empilhados para uma forma tubular, formando um enxerto vascular. Enxertos podem ser dimensionados para atender toda a gama de dimensões das artérias coronárias humanas, simplesmente mudando o tamanho guia impresso-3D.
Resumo
A doença arterial coronariana continua a ser uma das principais causas de morte, que afeta milhões de americanos. Com a falta de enxertos vasculares autólogos disponíveis, os enxertos de engenharia oferecem um grande potencial para o tratamento do paciente. No entanto, os enxertos vasculares de engenharia em geral, não são facilmente escaláveis, exigindo o fabrico de moldes de mercadorias ou tubos de polímero, de modo a personalizar a tamanhos diferentes, constituindo um demorado e dispendioso prática. artérias humanas variam em diâmetro luminal de cerca de 2,0-38 mm e espessura de parede de cerca de 0,5-2,5 mm. Criámos um método, denominado o "Anel método de empilhamento," em que os anéis de tamanhos variáveis de tecido do tipo de célula desejado, aqui demonstrado com células do músculo liso vascular (CML), pode ser criada usando guias de postes centrais para controlar o diâmetro do lúmen e camadas externas de ditar a espessura da parede do vaso. Estes anéis de tecido são então empilhadas para criar uma construção tubular, que imita a forma natural de um vaso sanguíneo. O comprimento do vaso pode be adaptada por empilhamento simplesmente o número de toques necessários para constituir o comprimento necessário. Com a nossa técnica, os tecidos de formas tubular, semelhante a um vaso sanguíneo, pode ser facilmente fabricado numa variedade de dimensões e comprimentos para satisfazer as necessidades do paciente e clínica.
Introdução
No tratamento de doença arterial coronária (CAD), próprios vasos sanguíneos de um paciente são colhidas como material de enxerto para a cirurgia de bypass. No entanto, muitas vezes, pacientes doentes não têm vasos viáveis para doar a si mesmos, e nos casos em que eles fazem, o local doador causa dano adicional considerável e tem um sério risco para a infecção. 1 enxertos vasculares Engineered poderia preencher essa necessidade. A escalabilidade é de extrema importância para as embarcações de engenharia, a fim de satisfazer a vasta gama de requisitos de tamanho vaso do paciente. No entanto, os métodos actuais para os navios de engenharia não são facilmente escaláveis, e tipicamente requer refabrique de moldes complexos ou andaimes de polímero. A maioria engenharia enxertos quer utilizar um andaime tubular polímero que é semeada com fibroblastos, músculo liso vascular, ou células endoteliais; ou enrolamento de uma folha de células em torno de um mandril para criar um tubo de tecido. Dois enxertos vasculares artificiais nos ensaios clínicos são baseadas em um decellularized plataforma de polímero de ECM. 2, 3, 4 enxertos de polímero disponíveis para utilização na reparação vascular já são conhecidos por terem problemas com a permeabilidade, o que poderia surgir como um grande problema com aplicação a longo prazo de um enxerto com uma presença polímero sustentado. Moldes tubulares têm sido usados para fabricar completamente vasos celulares, 5, 6, 7, 8, 9, 10, 11, 12, 13, que os procedimentos que exigem adicional de design e fabricação de ferramentas para moldes personalizados, a fim de produzir navios em uma variedade de tamanhos .
O método aqui descrito envolve um nova técnica para criar vascular manipulado facilmente escaláveisenxertos usando inserções impressas em 3D customizáveis e placas de cultura tradicionais. 14 As células são cultivadas em placas com inserções de um posto central e casca exterior. Os controlos pós de diâmetro de lumen e permite que a monocamada de células para auto-montar em um anel de tecido. A casca exterior controlos espessura do anel, e, assim, a espessura da parede do recipiente final. anéis de tecido concluídas são então empilhados para formar um tubular, enxerto vascular. A vantagem do presente método, o denominado "anel método de empilhamento," é que qualquer tipo de célula aderente pode ser semeadas em placa a configuração e anéis de tecido ou tubos, de qualquer tamanho necessário para a aplicação desejada pode ser gerada por simples modificação inserções guia. Técnicas comparativas em tecido anéis de engenharia Criação de tecidos permanecem difíceis de escala, 15, 16 requerendo remanufatura de moldes para cada tamanho desejado. Além disso, os enxertos vasculares feita utilizando este método pode ser produzird em 2-3 semana, várias semanas mais rápido em comparação com outros vasos de engenharia. 6 Para a clínica, este tempo de discrepância pode fazer uma diferença significativa no tratamento de um paciente deterioração.
Protocolo
1. Cultura de Células Preparação
- Utilizar células musculares lisas da aorta humana adquiridos comercialmente.
- células em meio de crescimento de células de músculo liso compostas de 88,6% Manter a 231 meios de comunicação, 0,1% cada de insulina recombinante humana (rh-insulina), factor de crescimento de fibroblastos humano recombinante (rh-FGF), factor de crescimento epidérmico humano recombinante (rh-FGF), e ácido ascórbico; e 5% de cada soro fetal de bovino (FBS) e L-glutamina; e 1% de antibiótico / antimicótico.
NOTA: Cada factor de crescimento, de FBS e L-glutamina são adquiridas como um kit de meio de crescimento vascular. - Mudança de mídia a cada 48 horas, até que as células são cerca de 90% confluentes e pronto para a semeadura de tecidos.
- células de loja em uma incubadora entre mudanças de suporte para a expansão.
2. Preparação de 3D Impresso Inserções e Silicone personalizado moldado Plates
- Use uma impressora 3D comercial (por exemplo, Replicator Mini) para 3D imprimir as inserções de placas.
- use open software de design de fonte 3D, como Blender para criar os modelos 3D dos exteriores conchas e mensagens impressas.
- Exporte arquivo de driver do modelo através de um formato .stl permitindo a portabilidade para software da impressora 3D.
- Produzem mensagens impressas e camadas externas usando poli filamento (ácido láctico) (PLA) carregados na impressora 3D.
- Na sequência de impressão, execute a 30 minutos de molho em uma solução de etanol a 100% a 70% para esterilizar cada inserção.
- Prepara-se uma agente de cura à base 01:10 mistura de polímeros de poli (dimetilsiloxano) (PDMS) de polímero de silicone e permitir que a mistura para desgaseificar à temperatura ambiente durante 10 min.
- Definir tamanhos de petri prato utilizados como pequena (35 mm), intermediário (60 mm), e grande (100 mm).
- Adicionar 2 ml, 4 ml e 6 ml de silicone não curado para cada pequeno, médio e grande placa, respectivamente, e criar uma camada fina em todo o fundo da placa de Petri.
- Criar postos para a pequena placa por vazamento PDMS em um100 milímetros placa de uma altura de 7 mm e deixar curar numa placa quente a 60 ° C durante cerca de 2-3 horas. Em seguida, use um perfurador de biópsia de 5 mm para perfurar para fora mensagens cilíndricas. Usar uma pequena quantidade de PDMS não curado para fixar cada PDMS cilindro e para o centro de cada pequena placa.
- Para as placas intermédias e grandes, antes de completar a cura do PDMS na parte inferior da placa, colocar as mensagens impressas 3D 10 mm e 20 mm de diâmetro centralmente em cada um pratos intermédios e grandes, respectivamente. Para as grandes placas, adicionalmente, colocar um 3D impresso casca exterior cerca de 66,7 mm de diâmetro eqüidistância do post.
- Permitir que cada prato para curar ao ar livre numa placa quente a 60 ° C durante cerca de 2-3 horas, permitindo que 18 horas para a desgaseificação do polímero. Fix componentes impressos para a placa na região adequada e orientação, como visto na Figura 1.
- Adicionar uma solução de 70% de etanol com 30% de água destilada durante 30 minutos, para o interior de todos PLAtes para a esterilização e, em seguida, cobrir cada placa.
- Aspirar cuidadosamente o etanol a partir de cada placa e deixar secar ao ar.
- Arrume cada prato em uma cabine de segurança biológica (BSC) ao lado de sua tampa, virado para cima. Expor pratos e tampas à luz UV sob o BSC durante 30 minutos para completar a esterilização. técnica estéril é realizada a cada passo após a exposição UV.
3. Preparação de fibrina hidrogel, semeando com células musculares lisas e manutenção de placas
- Misturar uma solução de gel de fibrina contendo meio de crescimento + 0,01% de TGF-β1 nas quantidades de 0,5 mL, 1,1 mL e 1,81 mL de tamanhos pequenos, intermediários e grande placa, respectivamente.
- Adicionar 40 ul, 88,4 uL e 145 uL de trombina, a partir de um stock de 100 U / ml, para os meios de comunicação de cada pequena, intermédia e de grande placa, respectivamente. Agite cuidadosamente cada placa à mão para garantir que a trombina é uniformemente misturado dentro da mídia.
- Em seguida, adicione 1601; L, 354 mL e 580 mL de fibrinogénio, de um estoque de 20 mg / mL, gota a gota circular à mistura de trombina-media a cada pequeno, médio e grande placa, respectivamente. Agite suavemente com a mão para assegurar a mistura e distribuição do hidrogel em uma camada uniforme.
- Permitir hidrogel curar durante 10-15 minutos à temperatura ambiente.
- Tripsinizar as células musculares lisas expandido em placas de cultura de células de 150 mm e de centrífuga de acordo com protocolos padrão. O sedimento resultante deve ser ressuspenso em 3 mL de meio de diferenciação que consiste em 98% - 231 de suporte, 1% de FBS e 1% de antibiótico / antimicótico.
- Misture vigorosamente células titulando cima e para baixo com uma pipeta 2 mL para quebrar quaisquer aglomerados de células. Contar as células com um hemocitómetro e criar uma suspensão de células de 2 x 10 6 células / ml, 1,0 x 10 7 células / ml e 1,4 x 10 7 células / mL para pequenas, intermediários e grandes placas, respectivamente.
- Adicionar 1 mL de cada int suspensão de célulasoa correspondente 50 mL cônica rotulado pequeno, médio e grande porte. Configurar um 50 mL cônico adicional desta forma para cada anel de tecido adicional desejado.
- Adicionar meios de diferenciação para cada cónica para se obter volumes de semeadura finais de 2 mL, 4 mL e 5 mL para cada pequeno, médio e grande vaso, respectivamente. Em seguida, pipeta com cuidado a solução de células gota a gota por cima do hidrogel preparado em cada uma das placas correspondente.
- Colocar as placas na incubadora a 37 ° C e 5% de CO 2.
- media de diferenciação mudam a cada 48-72 horas para cada placa. No caso de a placa maior, alterar meios inicialmente após 24 horas, em seguida, mudá-lo a cada 48-24 horas, para compensar a grande densidade de sementeira de células.
- Após 2-4 dias, como os anéis terá completamente contratado em direção ao poste, adicionar 10 mL, 20 mL e 35 mL de TGF-β1 a cada pequeno, médio e grande anel, respectivamente. Após a exposição a TGF-β; 1 durante pelo menos 24 horas, os anéis estão prontos para ser manuseado.
4. Montagem de Vascular Construir e Manutenção
- Antes do fabrico do construto vascular final, de um recipiente especializado é criada para manter o recipiente preenchido.
- Para o pequeno recipiente, criar uma placa de alto para empilhamento anel cortando uma secção de 2 polegadas fora do topo de um tubo cónico de 50 ml de policarbonato, e, em seguida, cola-PDMS a borda de corte numa placa de 35 mm. Utilizar a tampa cónica como a tampa da placa.
- Para o navio anel de altura intermediária e grande empilhamento de placas, corte um tubo de policarbonato diâmetro de 1,75 polegadas para 2,5 polegadas seções longitudinalmente para servir como as paredes de chapa de altura. Para o fundo da placa de altura, corte uma folha de policarbonato 0,125 polegadas de espessura em pedaços círculo de diâmetro de 2 polegadas. Usando o acrílico cimento solvente, vincular a seção de tubo de policarbonato para a peça de corte circular. Utilizar a tampa de uma placa de Petri 60 milímetros como a tampa para o prato de altura.
- 3D pmensagens de Rint 5, 10 e 20 mm de diâmetro e 50 mm de comprimento.
- Adicionar 10 ml de silicone não curado em cada recipiente. Antes da cura completa do PDMS, coloque centralmente cada post criado no passo 4.1.3 em cada pequeno, médio e grande recipiente.
- Deixa-se curar em um conjunto de placa quente a 60 ° C durante 2-3 horas.
- Esteriliza-se com uma solução de etanol a 70% com 30% de água destilada durante 30 minutos.
- Aspirar cuidadosamente o etanol a partir de cada recipiente e depois deixar secar ao ar na BSC. Em seguida, organizar os recipientes na capa com cada placa colocada ao lado de sua tampa, virado para cima. Expor recipientes à luz UV sob o BSC para um período adicional de 30 minutos para mais de esterilização. Use técnica estéril a cada passo após a exposição UV.
- Utilizando uma pinça muito finas, retire cuidadosamente cada anel hidrogel músculo liso bem enrolado do seu posto e transferir para o seu correspondente recipiente maior com as mensagens de altura.
- Use um par deforceps em cada mão e levantar um dos lados do anel do post, e depois o outro. Tenha o cuidado de proteger e manter o lúmen.
- Executar a transferência com este método de duas mãos, deslizando um primeiro lado, então o outro lado do anel para o poste de altura. Usando movimentos graduais suaves, e trabalhando em circunferência, empurre lentamente o anel para baixo para o cargo de altura. Subsequentemente empilhar anéis de tecido até que tenha sido obtido o desejado comprimento do navio, com cada anel adicionando aproximadamente 1-2 mm de comprimento para a construção concluída.
- Com a pilha de anel posicionado sobre as mensagens impressas em 3D altas, virar a placa para que o post é paralelo com a superfície de trabalho.
- Usando uma micropipeta, adicionar 40, 80 e 160 mL de trombina a uma concentração de 100 U / mL suavemente para a superfície exterior de cada pequena, intermédia e grandes vasos, respectivamente. Enquanto a adição de trombina, rodar lentamente a placa para assegurar uma cobertura uniforme de todas as superfícies da construção.Isto irá ser a base para a cola de fibrina utilizado para fixar a construção de pilha anel nos dias iniciais após a construção.
- Em seguida, adicionar 40, 80 e 160 ul de fibrinogénio a uma concentração de 20 mg / mL a cada pequena, intermédia, e grande construto, respectivamente, utilizando uma micropipeta enquanto se rodam a construção rapidamente. A trombina e fibrinogênio definir rapidamente em um gel firme, uma vez misturado. Devido ao curto tempo de cura, aplicar o fibrinogénio mais rapidamente e mais uniformemente possível.
- Adicionar 20 ml de meio de diferenciação para cada recipiente contendo a construção. vasos local em um 37 ° C incubadora até que seja necessário. Mudança de mídia a cada 3-5 dias.
Resultados
Demonstrada aqui é a fabricação de 3 tamanhos diferentes de engenharia vascular do enxerto (Figura 1), mostrando que o método de empilhamento Ring (RSM) é escalável. Para provar aplicabilidade, os 3 tamanhos diferentes vaso escolhido correlato ao tamanho real vaso humano para a artéria descendente anterior (pequeno; diâmetro luminal = 4 mm) 17, aorta descendente (intermediário; diâmetro luminal = 10 mm) e aorta ascendente (grande; lúmen diâmetro = 20 mm) 18. A espessura da parede é cerca de 500 pM para os anéis pequenos, e cerca de 1,500 mm para ambos os anéis intermédios e grandes. Cada vaso é construído demonstrado pelo empilhamento de anéis 6, o que equivale a um comprimento de cerca de 6 mm para o pequeno recipiente e 9 mm para as embarcações intermédias e grandes. O comprimento é baseada na espessura da parede do anel de cada indivíduo.
A análise histológica reveloucelularidade alta em todos os tamanhos de anéis (Figura 2). Material vermelho demarca gel de fibrina. Em pequenos anéis, uma pequena quantidade de gel de fibrina residual é visto na borda exterior do anel. Nos anéis maiores, um pouco de gel de fibrina foi intercalada com o conteúdo celular. Em corante Tricromo de Masson, indicações de produção de colagénio (marcado por azul) pode ser visto nos anéis intermédios e grandes.
Para determinar o fenótipo de células após a formação do anel, anéis de tecido foram analisados por meio de imunofluorescência para anticorpos para a-actina de músculo liso (SMA) e a tropomiosina (Figura 3). Todos os tamanhos de anel foram positivos para ambos os anticorpos, verificando-se que o fenótipo de músculo liso foi mantida.
Ensaio de tracção foi realizada sobre os diferentes anéis de tamanhos para determinar as suas propriedades mecânicas (Figura 4). O U-stretch, uma mecadispositivo de teste de cal, foi usada para tracção de ensaio pequenos e médios navios e anéis, enquanto um Instron foi utilizado para testar grandes vasos e anéis de tracção. módulo de elasticidade (E), resistência máxima à tração (UTS) e força falha de dados (FS) foram coletados. A tendência consistente foi observada com o aumento da força correlacionando ao aumento do anel e do tamanho do vaso.
Sementeira celular número necessário para criar os anéis de tamanhos variados aumentou linearmente com a área de superfície de semeação (Figura 5). A fim de criar anéis maiores, pelo menos 14 milhões de células foram necessários para criar os anéis de aorta abdominal de tamanho.
pilhas de seis anéis, ou vasos, foram testados quanto à sua capacidade de suportar fluxo. As construções foram carregados para um sistema de perfusão feito sob medida (Figura 6) e submetido a fluxo de até 5 minutos a taxas de fluxo de 100-417 mL / min. As embarcações foramcapaz de suportar fluxo. vazamento menor foi observado nas extremidades dos vasos, nos conectores ao sistema de perfusão.
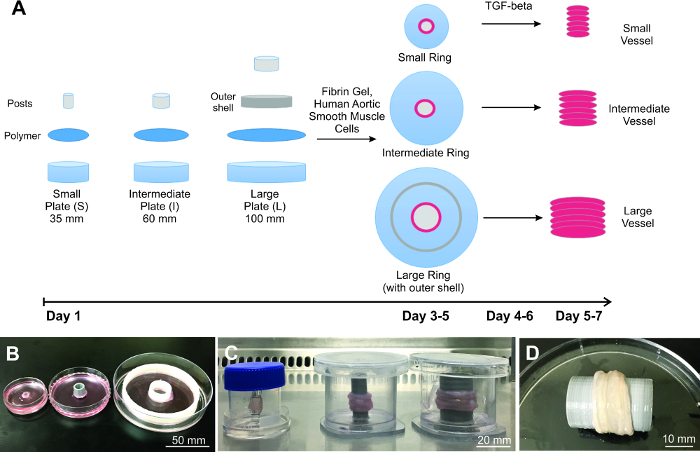
Figura 1: Construção dos vasos engenharia escalados. A) Diagrama do processo de escalar vasos artificiais, começando com a preparação do prato, a sementeira de células e construção de navios. Demonstrou-se três B) anéis de tamanhos diferentes e vasos C). D) grande vaso Representante é completamente biológica e se assemelha ao tecido natural. Por favor clique aqui para ver uma versão maior desta figura.
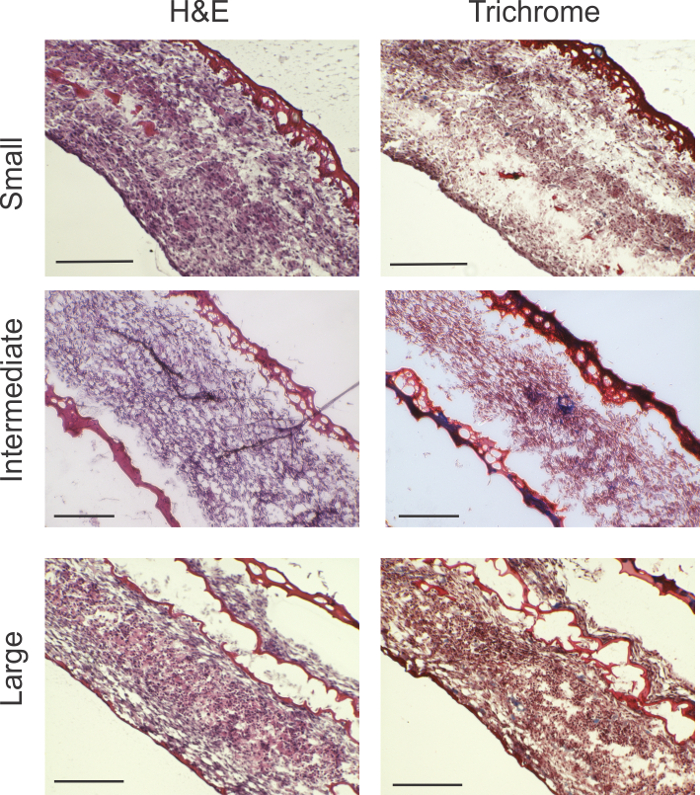
Figura 2: A análise histológica. rong> H & E e manchas Masson mostrar celularidade viável em toda a espessura do anel para todos os tamanhos de anel. Tricrômicos manchas revelar áreas de produção de colágeno indicados por azul (setas azuis). anéis grandes mostraram gel de fibrina intercaladas, provavelmente devido à dobragem da área de superfície relativamente maior da camada de células. Barras de escala: pequenos anéis = 200 um; anéis intermédios = 200 um; e anéis grandes = 0,5 mm. Por favor clique aqui para ver uma versão maior desta figura.
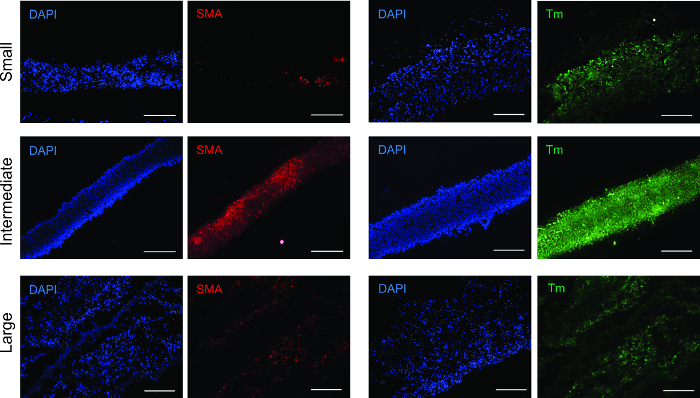
Figura 3: Análise por imunofluorescência para marcadores de músculo liso. Todos os tamanhos de anel foram positivos para proteínas contrácteis do músculo liso actina de músculo liso-α (SMA) e a tropomiosina (TM). Barras de escala = 200 pm.carga / 55322 / 55322fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
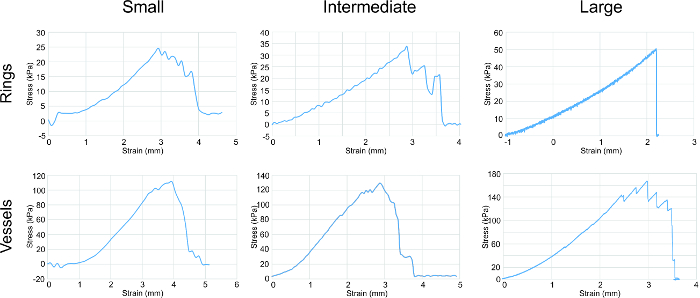
Figura 4: Análise de ensaio de tracção. As curvas de tensão-deformação para todos os tamanhos de vasos e anéis mostrou uma tendência geral de um aumento da força correlacionando com o aumento em tamanho do anel / vaso. Anéis e vasos foram esticados em circunferência. Os parâmetros avaliados foram a partir dos gráficos módulo de elasticidade, resistência à tracção e resistência falha (listados na Tabela 1). Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: celular semeadura correlação número para semeadura de surfárea ace. Com base em células do músculo liso da aorta humana. A área da superfície é definida como a área nas placas de formação de anel entre a coluna central e a parede de placa ou concha exterior. Por favor clique aqui para ver uma versão maior desta figura.
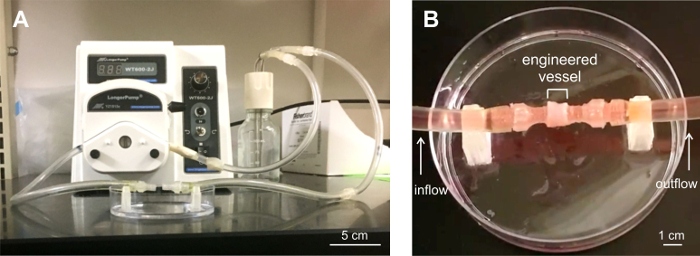
Figura 6: navio seis anéis submetido a análise da perfusão. A) sistema de perfusão construído sob medida para testes de fluxo. B) Engineered navio carregado para o sistema de perfusão. Três vasos foram testados para perfusão fugas durante até 5 minutos, sob condições de fluxo. Os vasos permaneceram estáveis sob fluxo, com menor vazamento nos vasos finais conectores ligados ao sistema de tubagem. por favor clique aqui para visualizaruma versão maior desta figura.

Animated Figura 1: Demonstração do fluxo de perfusão através de um navio de engenharia. Por favor clique aqui para ver este vídeo. (Botão direito do mouse para baixar).
| Pequeno | Intermediário | ampla | |||||
| argolas | Módulo de elasticidade (kPa) | 13,6 ± 2,25 | (N = 6) | 14,5 ± 1,2 | (N = 3) | 17,2 ± 2,2 | (N = 4) |
| Final Resistência à Tração (kaa) | 34,5 ± 10,2 | 39,6 ± 2,98 | 50,9 ± 10,6 | ||||
| Falha Força (kPa) | 34,5 ± 10,2 | 39,6 ± 2,98 | 50,9 ± 10,6 | ||||
| Embarcações | Módulo de elasticidade (kPa) | 49,7 ± 2,80 | (N = 3) | 59,8 ± 3,90 | (N = 2) | 79,8 ± 10,1 | (N = 2) |
| Final Resistência à Tração (kPa) | 115 ± 6,90 | 137 ± 12,0 | 192 ± 86,9 | ||||
| Falha Força (kPa) | 96,2 ± 12,2 | 60,7 ± 12,1 | 173 ± 92,2 | ||||
Tabela 1: Propriedades de tracção dos anéis e vasos escalados.
Discussão
The Ring método de empilhamento apresenta várias vantagens sobre engenharia de tecidos técnicas construto vasculares atuais. O RSM pode ser adaptado para criar vasos humanos de qualquer tamanho, simplesmente personalizar o post e casca exterior dimensões. O nosso método permite o desenvolvimento de vasos de engenharia isentos de polímero constituídas unicamente por células humanas e rapidamente degradar material de suporte encontrado em processo de cicatrização da ferida natural do corpo. enxertos de polímero são conhecidos por causar reestenose na clínica e pode se tornar problemática se continha em enxertos de engenharia. O número de células de semeadura precisa ser modificado para cada um anel de tecido de tamanho diferente. Um gráfico do número de células para a área de superfície de semeação é mostrado na Figura 5 a partir do qual o número de semeadura pode ser aproximado e / ou extrapolados. Deve notar-se que o tipo de célula usado aqui são as células do músculo liso da aorta humana. Para adaptar o RSM para diferentes tipos de células, o tamanho das células e taxa de proliferação têm de ser tidas emconsideração e semeadura ideal densidade determinada. Por exemplo, nós também criaram anéis de fibroblastos humanos utilizando a RSM, e descobriram que, pelo menos, 2 vezes o número de células é necessária em comparação com as SMC. Qualquer comprimento desejado do recipiente pode ser construído através da adição de anéis. pilhas anel foram cultivadas por até 2 meses e manteve-se estável. anéis intermédios e grandes são ambos mantidos ao 1500 um de espessura de parede adequada, embora sejam cada um construído de uma placa de 60 mm e 100 mm, respectivamente, por colocação de um invólucro exterior na placa de 100 mm. Isto demonstra a utilidade do invólucro exterior para controlar e obter a espessura de parede adequada para um determinado recipiente. No passo 3.3.1, TGF-β1 é adicionado porque ele é conhecido por estimular a produção de colagénio e 19 tem o efeito observado de aperto dos anéis. Uma vez que os anéis têm completamente enrolado, uma dose de TGF-β1 é adicionado no último passo, e os anéis estão prontos para utilização um dia mais tarde. TGF-β1 faz aumentar a produção de colagénio nos anéis, como pode ser visto nas imagens Trichrome (Figura 2).
As células nos pequenos anéis são mais redondo e compacto, enquanto que nos 2 tamanhos maiores, as células ao longo das bordas exteriores exibir um certo grau de alinhamento com a borda do tecido e, juntamente com outras células alinhadas. Este último pode indicar uma fase posterior de maturação celular, evoluiu a partir do conteúdo da célula superior nos anéis maiores, e, por conseguinte, um maior grau de sinalização intercelular para encorajar a maturidade. interspersion gel de fibrina em anéis maiores podem indicar que as folhas de células maiores tendem a dobrar um pouco como eles rolam. As imagens histológicas mostram este fenómeno foram tomadas 1 dia após rolo anel completo para cima, portanto, é compreensível que o gel de fibrina, que leva 2 semanas para se degradarem em cultura, ainda estaria presente. A cultura dos anéis por pelo menos 2 semanas deve degradar o gel de fibrina, deixando para trás uma construção totalmente celular.
nt "> alfa-actina de músculo liso (SMA) constitui os filamentos finos que facilitam a contracção e a tropomiosina é uma proteína contráctil. 20, 21 Ambos SMA e tropomiosina estavam presentes em todos os anéis de tamanho, com os mais fortes, o sinal mais uniformemente distribuída no intermediário anéis. Este fenómeno pode ser devido a um grau mais elevado de densidade celular e organização, estimular um aumento no desenvolvimento contráctil operandi.módulo de elasticidade indica a elasticidade dos anéis, ea crescente E desde pequenas a grandes anéis sugere um aumento na produção de colágeno e elastina. resistência à tração é a maior força sofrido pelos anéis sem quebrar. força falha é o ponto de falha do tecido. Para os anéis, UTS é igual a FS. Para os recipientes, UTS é maior do que a FS, o que mostra que a resistência à tracção do navio é atribuído à combinação da contribuição mecânica de todos os anéisno recipiente, e o ponto de falha é devido ao anel mais fraco.
A força de nossos vasos de engenharia estava na faixa kPa, enquanto vasos humanos nativos têm pontos fortes dentro do intervalo MPa. A fim de reforçar nossos vasos em direção a de vasos nativos, estamos investigando técnicas para aumentar a produção de matriz extracelular, ou seja, que de colágeno e elastina. Os factores de crescimento que promovem a produção de colagénio e elastina estão actualmente a ser aplicada aos nossos anéis para investigar se as propriedades de tracção vai aumentar.
Em adição às propriedades mecânicas, medidas funcionais de contracção muscular são relevantes para o desempenho do vaso. estimulação do músculo e contracção por factores tais como a acetilcolina e a epinefrina pode ser usado para testar a força contrátil do músculo. Tais experiências estão sendo considerados para os nossos estudos futuros.
Em geral, os nossos resultados mostram que o Anel método de empilhamento pode ser facilmente dimensionadapara atingir uma gama de tamanhos de tecido vascular modificadas. Escala para os maiores navios humanos, tais como a 40 milímetros lúmen aorta diâmetro, provavelmente exigiria o desenvolvimento de um vasa vasorum, a microcirculação naturalmente presente dentro de grandes vasos de tamanho, que o nosso laboratório está actualmente a desenvolver. Além disso, a camada de células endoteliais (ou seja, da íntima) que tipicamente linhas do lúmen da camada média é importante para o estabelecimento da hemodinâmica adequada num recipiente. Nosso laboratório está actualmente a trabalhar na criação da íntima em nossa pilha de anel SMC usando células endoteliais vasculares humanas. Com estas tecnologias combinadas, vasos de engenharia teriam maior aplicabilidade para a clínica.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer aos nossos colegas do laboratório do companheiro Lam Ammar Chishti e Bijal Patel por sua gentil assistência com um pouco da cultura histologia e celular. O financiamento foi fornecido pelo Estado Wayne University Nanomedicine Fellowship (CBP), start-up fundos e Instituto de Pesquisa Cardiovascular Seed Grant (MTL).
Materiais
| Name | Company | Catalog Number | Comments |
| Human Aortic Smooth Muscle Cells | ATCC | PCS-100-012 | vascular smooth muscle cells |
| Medium 231 | Gibco (Life Technologies | M-231-500 | media specific to vascular smooth muscle cells |
| Human Aortic Smooth Muscle Cell Growth Kit | ATCC | PSC-100-042 | growth factors for maintaining vascular smooth muscle cell viability |
| Replicator Mini 3D printer | MakerBot | N/A | 3D printer |
| Poly(lactic acid) 3D ink (PLA) | MakerBot | N/A | 3D printer filament |
| Poly(dimethlysiloxane) (PDMS) | Ellworth Adhesives | 3097358-1004 | polymer for gluing plate parts |
| Fibrinogen | Hyclone Labratories, Inc. | SH30256.01 | fibrin gel component |
| Thrombin | Sigma Life Sciences | F3879-5G | fibrin gel component |
| Tranforming Growth Factor-Beta 1 | PeproTech | 100-21 | growth factor for stimulating collagen production |
| Hemocytometer | Hausser Scientific Co. | 3200 | for cell counting |
| Polycarbonate tubing | US Plastics | PCTUB1.750X1.625 | material for making tall, ring stacking plates |
| Polycarbonate sheet | Home Depot | 409497 | material for making tall, ring stacking plates |
| Adhesive polymer solvent | SCIGRIP | 10799 | material for making tall, ring stacking plates |
| Instron 5940 | Instron | N/A | tensile testing machine |
| U-Stretch | Cell Scale | N/A | tensile testing machine |
| Smooth Muscle Actin | MA5-11547 | Thermo Fisher | antibody |
| Tropomyosin | MA5-11783 | Thermo Fisher | antibody |
Referências
- Luciani, G. B., et al. Operative risk and outcome of surgery in adults with congenital valve disease. ASAIO J. 54 (5), 458-462 (2008).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: two phase 2 single-arm trials. Lancet. 14 (387), 2026-2034 (2016).
- McAllister, T. N., et al. Effectiveness of haemodialysis access with an autologous tissue-engineered vascular graft: a multicentre cohort study. Lancet. 373 (9673), 1440-1446 (2009).
- Wystrychowski, W., et al. First human use of an allogeneic tissue-engineered vascular graft for hemodialysis access. J Vasc Surg. 60 (5), 1353-1357 (2014).
- Konig, G., et al. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. 30 (8), 1542-1550 (2009).
- Gui, L., et al. Construction of tissue-engineered small-diameter vascular grafts in fibrin scaffolds in 30 days. Tissue Eng Part A. 20 (9-10), 1499-1507 (2014).
- Sundaram, S., Echter, A., Sivarapatna, A., Qiu, C., Niklason, L. Small-diameter vascular graft engineered using human embryonic stem cell-derived mesenchymal cells. Tissue Eng Part A. 20 (3-4), 740-750 (2014).
- Quint, C., Arief, M., Muto, A., Dardik, A., Niklason, L. E. Allogeneic human tissue-engineered blood vessel. J Vasc Surg. 55 (3), 790-798 (2012).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 31 (108), 9214-9219 (2011).
- Dahl, S. L., et al. Readily available tissue-engineered vascular grafts. Sci Transl Med. 2 (68), (2011).
- Syedain, Z. H., Meier, L. A., Lahti, M. T., Johnson, S. L., Tranquillo, R. T. Implantation of completely biological engineered grafts following decellularization into the sheep femoral artery. Tissue Eng Part A. 20 (11-12), 1726-1734 (2014).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Meier, L. A., et al. Blood outgrowth endothelial cells alter remodeling of completely biological engineered grafts implanted into the sheep femoral artery. J Cardiovasc Transl Res. 7 (2), 242-249 (2014).
- Pinnock, C. B., Meier, E. M., Joshi, N. N., Wu, B., Lam, M. T. Customizable engineered blood vessels using 3D printed inserts. Methods. S1046-2023 (15), 30184-30185 (2015).
- Blakely, A. M., Manning, K. L., Tripathi, A., Morgan, J. R. Bio-Pick, Place,and Perfuse: A New Instrument for Three-Dimensional Tissue Engineering. Tissue Eng Part C Methods. 21 (7), 737-746 (2015).
- Gwyther, T. A., et al. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cells Tissues Organs. 194 (1), 13-24 (2011).
- Fearon, W. F., et al. Changes in coronary arterial dimensions early after cardiac transplantation. Transplantation. 27 (6), 700-705 (2007).
- Erbel, R., Eggebrecht, H. Aortic dimensions and the risk of dissection. Heart. 92 (1), 137-142 (2006).
- Ha, D. M., et al. Transforming growth factor-beta 1 produced by vascular smooth muscle cells predicts fibrosis in the gastrocnemius of patients with peripheral artery disease. J Transl Med. 14, 39(2016).
- Skalli, O., et al. Alpha-smooth muscle actin, a differentiation marker of smooth muscle cells, is present in microfilamentous bundles of pericytes. J Histochem Cytochem. 37 (3), 315-321 (1989).
- von der Ecken, J., et al. Structure of the F-actin-tropomyosin complex. Nature. 519 (7541), 114-117 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados