Method Article
El escalado de Engineered injertos vasculares Usando 3D Impreso guías y el método de anillo de apilamiento
En este artículo
Resumen
vasos sanguíneos de ingeniería escalables mejorarían aplicabilidad clínica. El uso de guías fácilmente considerables 3D-impreso, anillos de músculo liso vascular se crearon y se apilan en una forma tubular, formando un injerto vascular. Los injertos pueden ser de un tamaño para cubrir la gama de dimensiones de las arterias coronarias humanas, simplemente cambiando el tamaño de la guía de 3D-impreso.
Resumen
La enfermedad coronaria sigue siendo la principal causa de muerte, que afecta a millones de estadounidenses. Con la falta de injertos vasculares autólogos disponibles, los injertos de ingeniería ofrecen un gran potencial para el tratamiento del paciente. Sin embargo, los injertos vasculares de ingeniería generalmente no son fácilmente escalable, lo que requiere la fabricación de moldes personalizados o tubos de polímero con el fin de personalizar a diferentes tamaños, lo que constituye una práctica que consume tiempo y costoso. arterias humanas varían en diámetro de lumen de aproximadamente 2,0 a 38 mm y espesor de pared de alrededor de 0,5 a 2,5 mm. Hemos creado un método, denominado el "Método de apilado Anillo", en el que los anillos de tamaño variable de tejido del tipo celular deseado, demostraron aquí con las células del músculo liso vascular (SMC), se pueden crear utilizando guías de postes centrales para controlar la luz de diámetro y capas exteriores que dictan espesor de la pared del vaso. Estos anillos de tejido entonces se apilan para crear una construcción tubular, imitando la forma natural de un vaso sanguíneo. La longitud del recipiente puede be adapta simplemente apilar el número de timbres necesarios para constituir la longitud necesaria. Con nuestra técnica, los tejidos de formas tubulares, similar a un vaso sanguíneo, pueden fabricarse fácilmente en una variedad de dimensiones y longitudes para satisfacer las necesidades de la clínica y el paciente.
Introducción
En el tratamiento de la enfermedad arterial coronaria (CAD), los propios vasos sanguíneos de un paciente se cosechan como material de injerto para la cirugía de bypass. Sin embargo, a menudo, los pacientes con enfermedades no tienen vasos viables para donar a sí mismos, y en los casos en que lo hacen, la zona donante causa considerables daños adicionales y tiene un grave riesgo para la infección. 1 injertos vasculares de ingeniería podrían llenar esta necesidad. La escalabilidad es de suma importancia para los buques de ingeniería con el fin de satisfacer la amplia gama de requisitos de tamaño de recipiente de los pacientes. Sin embargo, los métodos actuales para los buques de ingeniería no son fácilmente escalables, y por lo general requieren de nueva fabricación de moldes complejos o estructuras de polímeros. La mayoría diseñados injertos o bien utilizan un andamio tubular de polímero que se siembra con fibroblastos vasculares, músculo liso, o células endoteliales; o rodar una lámina de células alrededor de un mandril para crear un tubo de tejido. Dos injertos vasculares artificiales en los ensayos clínicos se basan en una decellularizeplataforma de polímero ECM d. 2, 3, 4 injertos de polímeros disponibles para su uso en la reparación vascular ya se sabe que tienen problemas con la permeabilidad, lo que podría surgir como un problema importante con la aplicación a largo plazo de un injerto con una presencia sostenida de polímero. Moldes tubulares se han utilizado para fabricar completamente vasos celulares, 5, 6, 7, 8, 9, 10, 11, 12, 13 que los procedimientos requerirían diseño adicional y la fabricación de herramientas para moldes personalizados con el fin de producir los vasos en una variedad de tamaños .
El método descrito en la presente memoria abarca una nueva técnica para la creación vascular ingeniería fácilmente escalableinjertos utilizando insertos impresos en 3D personalizables y placas de cultivo tradicionales. 14 Las células se sembraron en placas con inserciones de un poste central y la carcasa exterior. Los controles a posteriori diámetro de la luz y permite que la monocapa de células que se auto-ensamblan en un anillo de tejido. El exterior de espesor controles de concha del anillo, y por lo tanto el espesor de pared del recipiente final. anillos de tejido terminadas se apilan para formar un tubo, injerto vascular. La ventaja de este método, denominado "Método de apilado Ring," es que cualquier tipo de célula adherente se puede sembrar en la configuración de placas y anillos de tejido o tubos de cualquier tamaño necesario para la aplicación deseada puede ser generada por una simple modificación de los insertos de guía. Técnicas comparativas en el tejido de ingeniería que crea los anillos de tejido siguen siendo difíciles de escala, 15, 16 que requiere refabricación de moldes para cada tamaño deseado. Además, los injertos vasculares hechas usando este método se pueden producird en 2-3 semanas, varias semanas más rápido en comparación con otros buques de ingeniería. 6 Para la clínica, esta discrepancia de tiempo puede hacer una diferencia significativa en el tratamiento de un paciente deterioro.
Protocolo
1. Preparación de cultivo celular
- Utilizar las células del músculo liso aórticas humanas adquiridos comercialmente.
- Mantener las células en medio de crecimiento de células musculares lisas compuestas de 88,6% 231 medios de comunicación, 0,1% cada uno de insulina recombinante humana (rH-insulina), factor de crecimiento de fibroblastos humano recombinante (rH-FGF), factor de crecimiento epidérmico humano recombinante (rH-FGF), y ácido ascórbico; y 5% cada uno de suero bovino fetal (FBS) y L-glutamina; y 1% de antibiótico / antimicótico.
NOTA: Cada factor de crecimiento, FBS y L-glutamina se compran como un kit de crecimiento de los medios vascular. - Cambio de medio cada 48 horas hasta que las células son aproximadamente el 90% de confluencia y listo para la siembra de tejido.
- almacenar células en una incubadora de entre los cambios medios para la expansión.
2. Preparación de 3D Printed Insertos y costumbre de silicona moldeada placas
- Utilice una impresora 3D comercial (por ejemplo, Replicador Mini) para la impresión en 3D los insertos de placas.
- utilice opes fuente de software de diseño 3D como Blender para crear los modelos 3D de las carcasas externas y mensajes impresos.
- Exportar archivo del controlador del modelo a través de un formato STL lo que permite la portabilidad de software de la impresora 3D.
- Producir mensajes impresos y capas exteriores utilizando poli filamento (ácido láctico) (PLA) cargado en la impresora 3D.
- Después de la impresión, lleve a cabo a 30 minutos en remojo en una solución de etanol al 70% -100% para esterilizar cada inserto.
- Preparar un agente de curado 01:10 basar mezcla de polímero de poli (dimetilsiloxano) (PDMS) de polímero de silicona y permitir que la mezcla se desgasifica a temperatura ambiente durante 10 min.
- Definir tamaños Placa de Petri utilizados tan pequeño (35 mm), intermedio (60 mm) y grandes (100 mm).
- Añadir 2 ml, 4 ml y 6 ml de silicona sin curar a cada placa pequeño, medio y grande, respectivamente, y crear una capa fina a través de toda la parte inferior de la placa de Petri.
- Crear puestos para la pequeña placa mediante el vertido de PDMS en una100 mm de placa a una altura de 7 mm y dejarla curar sobre una placa caliente a 60 ° C durante aproximadamente 2-3 horas. A continuación, utilice un punzón de biopsia 5 mm para perforar mensajes cilíndricos. Use una pequeña cantidad de PDMS sin curar para asegurar cada PDMS cilindro y al centro de cada placa pequeña.
- Para las placas intermedias y grandes, antes de completar el curado de los PDMS en la parte inferior de la placa, coloque los mensajes impresos 3D 10 mm y 20 mm de diámetro centralmente en cada uno de placas intermedias y grandes, respectivamente. Para las planchas, además, colocar una capa exterior impresa en 3D sobre 66,7 mm de diámetro equidistancia del poste.
- Deje que cada plato se cure al aire libre sobre una placa caliente a 60 ° C durante aproximadamente 2-3 horas, lo que permite 18 horas para la desgasificación del polímero. Fijar componentes impresos a la placa en la región apropiada y la orientación como se ve en la Figura 1.
- Añadir una solución de 70% de etanol con agua destilada 30% durante 30 minutos en el interior de todas las plates para la esterilización y luego cubrir cada placa.
- aspirar cuidadosamente el etanol a partir de cada placa y dejar secar al aire.
- Colocar en cada plato en una cabina de seguridad biológica (BSC) al lado de su tapa, boca arriba. Exponer las placas y tapas a la luz UV bajo el BSC durante 30 minutos para completar la esterilización. La técnica estéril se realiza con cada paso después de la exposición UV.
3. Preparación de hidrogel de fibrina, la siembra con células musculares lisas y mantenimiento de placas
- Mezcle una solución de gel de fibrina que contiene medio de cultivo + 0,01% TGF-β1 en las cantidades de 0,5 ml, 1,1 ml y 1,81 ml de tamaños pequeños, intermedios y grandes placas, respectivamente.
- Añadir 40 l, 88,4 l y 145 l de trombina, de un stock de 100 U / ml, a los medios de comunicación de cada placa pequeño, medio y grande, respectivamente. Hacer girar suavemente cada placa con la mano para asegurarse de que la trombina se mezcla uniformemente dentro de los medios de comunicación.
- A continuación, añadir 1601; L, 354 ly 580 l de fibrinógeno, a partir de un stock de 20 mg / ml, gota a gota circularmente a la mezcla de trombina medios de comunicación para cada plato pequeño, medio y grande, respectivamente. Hacer girar suavemente con la mano para asegurar la mezcla y distribución del hidrogel en una capa uniforme.
- Permitir hidrogel para curar durante 10-15 minutos a temperatura ambiente.
- Trypsinize células del músculo liso se expandieron en placas de cultivo celular de 150 mm y centrífuga de acuerdo con protocolos estándar. El sedimento resultante se debe resuspendió en 3 ml de medio de diferenciación que consta de 98% - 231 medios de comunicación, 1% de FBS y 1% de antibiótico / antimicótico.
- Mezclar vigorosamente las células mediante la valoración de arriba abajo con una pipeta de 2 ml para romper los agregados celulares. Contar las células con un hemocitómetro y crear una suspensión celular de 2 x 10 6 células / ml, 1,0 x 10 7 células / ml y 1,4 x 10 7 células / ml para las placas pequeñas, medianas y grandes, respectivamente.
- Añadir 1 ml de cada suspensión de células intOA correspondiente 50 ml cónico etiquetado pequeño, medio y grande. Configurar una cónica 50 ml adicionales de esta manera para cada anillo de tejido adicional deseado.
- Añadir medio de diferenciación a cada cónica para obtener volúmenes de siembra final de 2 ml, 4 ml y 5 ml para cada recipiente pequeño, medio y grande, respectivamente. Entonces, pipetear cuidadosamente la solución de células gota a gota en la parte superior del hidrogel preparado en cada placa correspondiente.
- Colocar las placas en la incubadora a 37 ° C y 5% de CO2.
- Cambio de medio de diferenciación cada 48-72 horas para cada plato. En el caso de la placa más grande, cambiar los medios inicialmente después de 24 horas, a continuación, cambiar cada 48-24 horas para compensar la gran densidad de la siembra de células.
- Después de 2-4 días como los anillos se han contraído completamente hacia dentro de la entrada, añadir 10 l, 20 ly 35 l de TGF-β1 a cada anillo pequeño, medio y grande, respectivamente. Después de la exposición a TGF-β; 1 durante al menos 24 horas, los anillos están listos para ser manipulados.
4. Montaje de vasculares construyen y mantenimiento
- Antes de la fabricación de la construcción vascular final, un recipiente especializado se crea para sostener el recipiente completado.
- Para la pequeña embarcación, crear una placa de altura de apilamiento anillo cortando una sección de 2 pulgadas de la parte superior de un tubo cónico de 50 ml de policarbonato, y luego PDMS pegar el borde del corte en una placa de 35 mm. Utilice la tapa cónica como la tapa de la placa.
- Para el anillo de altura recipiente intermedio y grande apilar placas, cortar un tubo de policarbonato de diámetro 1,75 pulgadas en secciones de 2,5 pulgadas a lo largo para servir como las paredes de la placa de altura. Para las partes inferiores de la placa de altura, cortar una lámina de policarbonato de 0,125 pulgadas de espesor en piezas de círculo de diámetro de 2 pulgadas. El uso de cemento solvente acrílico, obligar a la sección de tubo de policarbonato a la pieza de corte circular. Utilice la tapa de una placa de Petri de 60 mm como la tapa de la placa de altura.
- 3D ppuestos de Rint 5, 10 y 20 mm de diámetro y 50 mm de longitud.
- Añadir 10 ml de silicona sin curar a cada recipiente. Antes de la curación completa de los PDMS, colocar centralmente cada puesto creado en el paso 4.1.3 en cada recipiente pequeño, intermedio, y grande.
- Deje curar en un conjunto de placa caliente a 60 ° C durante 2-3 horas.
- Esterilizar con una solución de 70% de etanol con agua destilada 30% durante 30 minutos.
- aspirar cuidadosamente el etanol a partir de cada recipiente y se deja secar al aire en el BSC. A continuación, colocar los contenedores en la campana con cada placa colocada al lado de su tapa, boca arriba. Exponga los envases a la luz UV bajo el BSC durante 30 minutos para su posterior esterilización. Utilice una técnica estéril a cada paso después de la exposición UV.
- Con unas pinzas muy finas, quitar con cuidado cada anillo hidrogel músculo liso firmemente enrollado de su puesto y transferir a su correspondiente contenedor más grande con los postes altos.
- Use un par defórceps en cada mano y levantar un lado del anillo del poste, y luego el otro. Tenga cuidado para proteger y mantener el lumen.
- Realizar la transferencia con este método de dos manos, introduciendo primero un lado y luego al otro lado del anillo en el poste alto. Usando movimientos suaves y graduales, y trabajando circunferencialmente, empujar lentamente el anillo hacia abajo en el poste alto. Posteriormente apilar los anillos de tejido hasta que se haya obtenido la eslora del buque se desea, con cada anillo de la adición de aproximadamente 1-2 mm de longitud a la construcción completado.
- Con la pila de anillo colocado en los postes altos impresas en 3D, gire la placa de modo que el mensaje es en paralelo con la superficie de trabajo.
- Usando una micropipeta, añadir 40, 80 y 160 l de trombina a una concentración de 100 U / ml suavemente a la superficie exterior de cada recipiente pequeño, medio y grande, respectivamente. Mientras que la adición de la trombina, gire lentamente la placa para asegurar una cobertura uniforme de todas las superficies de la construcción.Esta será la base para la cola de fibrina utilizada para asegurar la construcción de pila de anillo en los primeros días después de la construcción.
- A continuación, añadir 40, 80 y 160 l de fibrinógeno a una concentración de 20 mg / ml a cada construcción pequeño, intermedio, y grande, respectivamente, usando una micropipeta mientras gira el constructo rápidamente. La trombina y fibrinógeno establecen rápidamente en un gel firme una vez mezclada. Debido al tiempo de curado corto, aplicar el fibrinógeno como de forma rápida y uniformemente como sea posible.
- Añadir 20 ml de medio de diferenciación a cada recipiente que contiene el constructo. Coloque los vasos en una incubadora a 37 ° hasta que se necesite. Cambio de medio cada 3-5 días.
Resultados
Se ha demostrado aquí es la fabricación de 3 tamaños diferentes de ingeniería vascular del injerto (Figura 1), lo que demuestra que el Método de apilado Anillo (RSM) es escalable. Para demostrar la aplicabilidad, los 3 tamaños de los buques diferentes elegidos correlato a tamaño real vehículo humano de la arteria descendente anterior izquierda (pequeño; diámetro de la luz = 4 mm) 17, la aorta descendente (intermedio; diámetro de la luz = 10 mm) y la aorta ascendente (grande; lumen de diámetro = 20 mm) 18. espesor de la pared es de aproximadamente 500 micras para los pequeños anillos, y aproximadamente 1.500 micras, tanto para los anillos intermedios y grandes. Cada recipiente demostrado se construye apilando 6 anillos, lo que equivale a una longitud de aproximadamente 6 mm para el pequeño recipiente y 9 mm para los vasos intermedios y grandes. La longitud se basa en el espesor de pared de cada anillo individual.
El análisis histológico revelóalta celularidad en todos los tamaños anillos (Figura 2). material rojo demarca gel de fibrina. En pequeños anillos, una pequeña cantidad de gel de fibrina residual se ve en el borde exterior del anillo. En los anillos más grandes, un poco de gel de fibrina se entremezcla con el contenido celular. En tricrómico de Masson, las indicaciones de la producción de colágeno (marcado por azul) se pueden ver en los anillos intermedios y grandes.
Para determinar el fenotipo celular después de la formación del anillo, anillos de tejido se analizaron mediante inmunofluorescencia para anticuerpos frente a alfa-actina de músculo liso (SMA) y la tropomiosina (Figura 3). Todos los tamaños de anillos fueron positivos para ambos anticuerpos, verificando que el fenotipo del músculo liso se mantuvo.
La prueba de tensión se realizó en los diferentes anillos de tamaño para determinar sus propiedades mecánicas (Figura 4). El T-estiramiento, una mecaCal dispositivo de prueba, se utilizó para la prueba de tracción pequeños e intermedios anillos y los vasos, mientras que un Instron se utilizó para grandes anillos y recipientes de ensayo de tracción. El módulo elástico (E), la resistencia última a la tracción (UTS) y la fuerza fallo se recogieron (FS) de datos. Una tendencia constante se observó correlación con el aumento de la resistencia al aumento de anillo y tamaño de los buques.
La siembra de células el número necesario para la creación de los anillos de tamaño variados aumentó de forma lineal al área de la superficie de siembra (Figura 5). Con el fin de crear los anillos más grandes, se necesitan al menos 14 millones de células para crear los anillos de tamaño de la aorta abdominal.
pilas de seis anillos, o vasos, se ensayaron para determinar su capacidad para resistir el flujo. Las construcciones se cargan en un sistema de perfusión hecha a la medida (Figura 6) y se sometieron a fluir durante un máximo de 5 min a velocidades de flujo 100 a 417 ml / min. Los vasos secapaz de soportar flujo. fuga menor se observó en los extremos de los vasos, en los conectores en el sistema de perfusión.
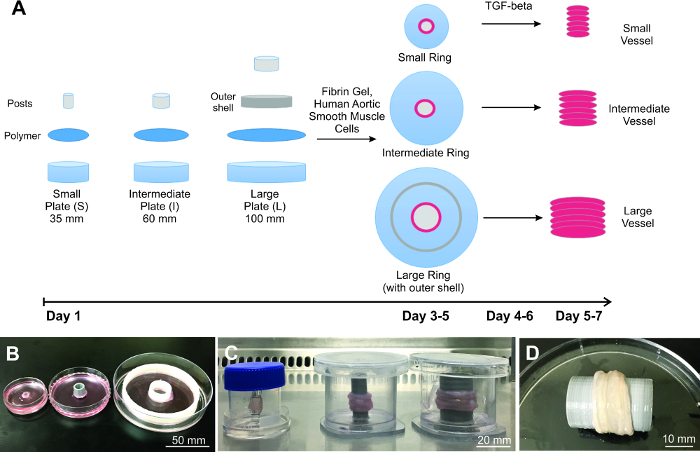
Figura 1: Construcción de los vasos de ingeniería a escala. A) Esquema del proceso de ampliación de los vasos de ingeniería, comenzando con la preparación de la placa, la siembra de células y la construcción de buques. Demostrada son tres anillos B) de diferentes tamaños y los vasos C). D) Representante grandes vasos es totalmente biológico y se asemeja tejido natural. Haga clic aquí para ver una versión más grande de esta figura.
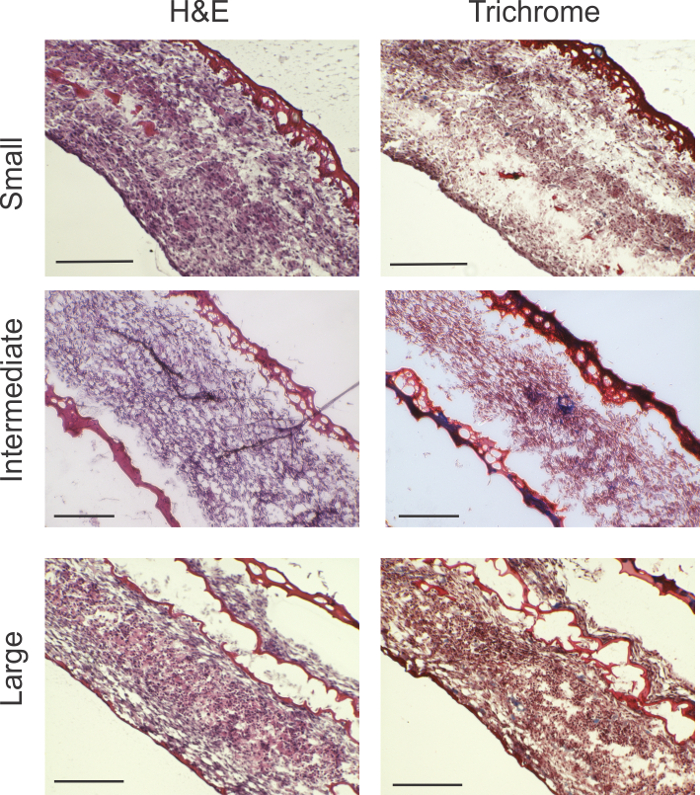
Figura 2: El análisis histológico. rong> H & E y tricrómico de Masson muestran celularidad viables en todo el espesor del anillo para todos los tamaños de anillo. Tricrómico manchas revelan áreas de la producción de colágeno indicadas por las flechas azules (azul). anillos grandes mostraron gel de fibrina entremezcla, probablemente a causa de plegado de la superficie relativamente grande de la lámina de células. Las barras de escala: anillos pequeños = 200 micras; anillos intermedios = 200 micras; y grandes anillos = 0,5 mm. Haga clic aquí para ver una versión más grande de esta figura.
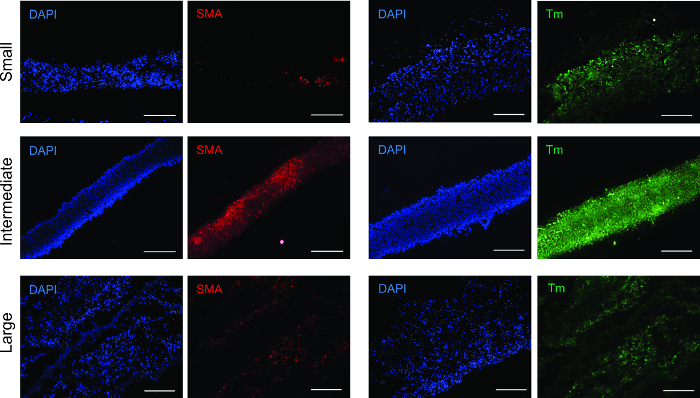
Figura 3: El análisis de inmunofluorescencia para los marcadores de músculo liso. Todos los tamaños de anillos fueron positivos para las proteínas contráctiles del músculo liso α-actina de músculo liso (SMA) y la tropomiosina (Tm). Barras de escala = 200 m.carga / 55322 / 55322fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
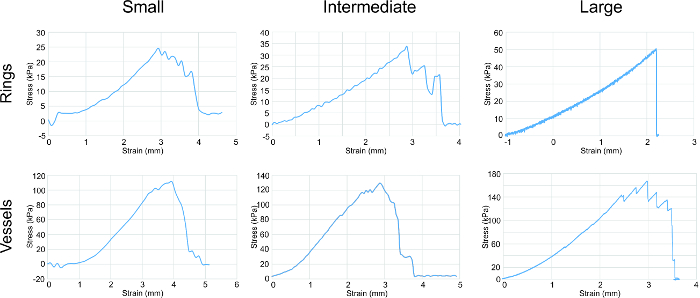
Figura 4: Análisis de ensayo de tracción. curvas tensión-deformación para todos los tamaños de los anillos y los vasos mostraron una tendencia general de un aumento en la fuerza que se correlaciona con aumento de tamaño del anillo / recipiente. Anillos y los vasos se estiraron circunferencialmente. Los parámetros evaluados en los gráficos eran módulo de elasticidad, resistencia a la tracción y resistencia a la ruptura (que se enumeran en la Tabla 1). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: la siembra de células correlación número de la resaca de la siembraárea de la ECA. Sobre la base de células de músculo liso aórticas humanas. El área de superficie se define como el área de las placas de la formación del anillo entre la central y la pared de placa o capa exterior. Haga clic aquí para ver una versión más grande de esta figura.
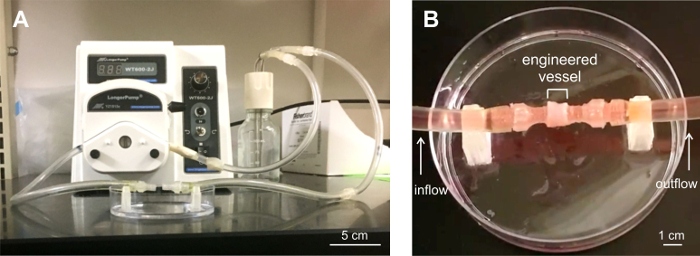
Figura 6: Depósito de seis anillos se sometieron a análisis de perfusión. A) sistema de perfusión hecha a medida para las pruebas de flujo. B) recipiente Diseñado cargado en el sistema de perfusión. Tres buques fueron perfusión sometida a prueba durante un máximo de 5 min en condiciones de flujo. Los vasos se mantuvieron estables bajo flujo, con fugas de menor importancia en los vasos conectores finales conectados a la tubería del sistema. Haga clic aquí para veruna versión más grande de esta figura.

Animada Figura 1: Demostración de flujo de perfusión a través de un recipiente de ingeniería. Por favor, haga clic aquí para ver el vídeo. (Haga clic aquí para descargar.)
| Pequeña | Intermedio | Grande | |||||
| anillos | Módulo elástico (kPa) | 13,6 ± 2,25 | (N = 6) | 14,5 ± 1,2 | (N = 3) | 17,2 ± 2,2 | (N = 4) |
| Resistencia a la tracción (kPensilvania) | 34,5 ± 10,2 | 39.6 ± 2.98 | 50,9 ± 10,6 | ||||
| La falta de fuerza (kPa) | 34,5 ± 10,2 | 39.6 ± 2.98 | 50,9 ± 10,6 | ||||
| vasos | Módulo elástico (kPa) | 49.7 ± 2.80 | (N = 3) | 59,8 ± 3,90 | (N = 2) | 79,8 ± 10,1 | (N = 2) |
| Resistencia a la tracción (kPa) | 115 ± 6,90 | 137 ± 12,0 | 192 ± 86,9 | ||||
| La falta de fuerza (kPa) | 96,2 ± 12,2 | 60,7 ± 12,1 | 173 ± 92,2 | ||||
Tabla 1: Propiedades de tracción de los anillos y los vasos a escala.
Discusión
El Método de apilado Anillo presenta múltiples ventajas sobre las técnicas de construcción de tejido de ingeniería vasculares actuales. La RSM puede ser adaptado para crear vasos humanos de cualquier tamaño simplemente la personalización de las dimensiones de correos y la capa externa. Nuestro método permite el desarrollo de los vasos de ingeniería libre de polímero compuesto solamente de las células humanas y rápida degradación material de soporte que se encuentra en proceso de cicatrización de la herida natural del cuerpo. injertos de polímeros son conocidos por causar la reestenosis en la clínica y podrían llegar a ser problemático si contenida en tejidos cultivados. número siembra de células tiene que ser modificado para cada anillo de tejido de tamaño diferente. Un gráfico del número de células a la superficie de siembra se muestra en la Figura 5 de la que el número de siembra se puede aproximar y / o extrapolados. Cabe señalar que el tipo de células usadas aquí son células de músculo liso aórticas humanas. Para adaptar el RSM a diferentes tipos de células, el tamaño celular y la tasa de proliferación necesitan ser tenido enconsideración y siembra óptima densidad determinada. Por ejemplo, también hemos creado anillos de fibroblastos humanos utilizando el RSM, y hemos encontrado que al menos 2 veces se necesita el número de células en comparación con las SMC. Cualquier longitud deseada del recipiente puede ser construido a través de la adición de anillos. pilas de anillos se han cultivado durante un máximo de 2 meses y se mantuvo estable. anillos intermedios y grandes son a la vez mantienen en el espesor de la pared 1500 micras apropiado a pesar de que están construidos cada uno en una placa de 60 mm y 100 mm, respectivamente, mediante la colocación de una carcasa exterior en la placa de 100 mm. Esto demuestra la utilidad de la carcasa exterior para controlar y obtener el espesor de pared adecuado para un recipiente dado. En el paso 3.3.1, se añade TGF-β1, ya que se sabe que estimula la producción de colágeno 19 y tiene el efecto observado de apriete de los anillos. Una vez que los anillos tienen completamente enrollada, se añade una dosis de TGF-β1 en el paso final, y los anillos están listos para su uso 1 día más tarde. TGF-β1 hace aumentar la producción de colágeno en los anillos, como se ve en las imágenes Trichrome (Figura 2).
Las células en los pequeños anillos son más redonda y compacta, mientras que en los 2 tamaños más grandes, las células a lo largo de los bordes exteriores muestran un grado de alineación con el borde del tejido y junto con otras células alineadas. El último puede indicar una etapa posterior de la madurez celular, evolucionado de mayor contenido celular en los anillos más grandes, y por lo tanto un mayor grado de señalización intercelular para fomentar la madurez. interspersion gel de fibrina en los anillos más grandes puede indicar que láminas de células más grandes tienden a doblar ligeramente a medida que ruedan. Las imágenes histológicas que muestran este fenómeno se tomaron 1 día siguiente rollo anillo completo UP- por lo tanto, es comprensible que el gel de fibrina, que dura 2 semanas a degradarse en cultivo, aún estaría presente. El cultivo de los anillos durante al menos 2 semanas debe degradar el gel de fibrina, dejando atrás una construcción completamente celular.
nt "> alfa-actina de músculo liso (SMA) constituye los filamentos delgados que facilitan la contracción y la tropomiosina es una proteína contráctil. 20, 21 Tanto SMA y tropomiosina estaban presentes en todos los anillos de tamaño, con la señal más fuerte más uniformemente distribuida en el intermedio anillos. Este fenómeno puede ser debido a un mayor grado de la densidad celular y la organización, la estimulación de un aumento en el desarrollo contráctil operandi.módulo de elasticidad indica la elasticidad de los anillos, y la creciente E desde pequeñas a grandes anillos sugiere un aumento de la producción de colágeno y elastina. resistencia a la tracción es la fuerza más alta que padecen los anillos sin romperse. resistencia a la rotura es el punto de la falta de tejido. Para los anillos, UTS es igual a FS. Para los vasos, UTS es mayor que FS, que muestra que la resistencia última de la vasija se atribuye a la combinación de la contribución mecánica de todos los anillosen el recipiente, y el punto de fallo es debido al anillo más débil.
La fuerza de nuestros vasos de ingeniería sentar en el rango kPa, mientras que los vasos humanos nativos tienen fortalezas dentro de la gama MPa. Con el fin de fortalecer nuestros vasos hacia el de los vasos nativos, estamos investigando técnicas para aumentar la producción de matriz extracelular, a saber, la de colágeno y elastina. Los factores de crecimiento que promueven la producción de colágeno y elastina, se están aplicando a nuestros anillos para investigar si las propiedades de tracción se incrementarán.
Además de las propiedades mecánicas, medidas funcionales de la contracción muscular son relevantes para el rendimiento del vaso. La estimulación muscular y la contracción por factores tales como la acetilcolina y la epinefrina se pueden utilizar para probar la fuerza de contracción muscular. Tales experimentos están siendo considerados para nuestros estudios futuros.
En general, nuestros resultados muestran que el Método de apilado anillo se puede escalar fácilmentepara conseguir un intervalo de tamaños de tejido vascular de ingeniería. La ampliación de los mayores buques humanos, como el lumen 40 mm de diámetro de la aorta, probablemente requeriría el desarrollo de un vasa vasorum, la microvasculatura presente de forma natural en los recipientes de gran tamaño, que nuestro laboratorio está desarrollando actualmente. Además, la capa de células endoteliales (es decir, la íntima), que típicamente reviste el lumen de la capa de medios de comunicación es importante para el establecimiento de la hemodinámica adecuada en un recipiente. Nuestro laboratorio está trabajando actualmente en la creación de la íntima en nuestra pila de anillo SMC utilizando células endoteliales vasculares humanas. Con estas tecnologías combinadas, los vasos de ingeniería tendrían mayor aplicabilidad a la clínica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a nuestros colegas de laboratorio compañero de Lam Ammar Chishti y Bijal Patel por su amable ayuda con algo de la cultura y la histología de células. El financiamiento fue proporcionado por la Universidad Estatal de Wayne Nanomedicina Fellowship (CBP), puesta en marcha y Fondos Instituto de Investigación Cardiovascular del Fondo Semilla (MTL).
Materiales
| Name | Company | Catalog Number | Comments |
| Human Aortic Smooth Muscle Cells | ATCC | PCS-100-012 | vascular smooth muscle cells |
| Medium 231 | Gibco (Life Technologies | M-231-500 | media specific to vascular smooth muscle cells |
| Human Aortic Smooth Muscle Cell Growth Kit | ATCC | PSC-100-042 | growth factors for maintaining vascular smooth muscle cell viability |
| Replicator Mini 3D printer | MakerBot | N/A | 3D printer |
| Poly(lactic acid) 3D ink (PLA) | MakerBot | N/A | 3D printer filament |
| Poly(dimethlysiloxane) (PDMS) | Ellworth Adhesives | 3097358-1004 | polymer for gluing plate parts |
| Fibrinogen | Hyclone Labratories, Inc. | SH30256.01 | fibrin gel component |
| Thrombin | Sigma Life Sciences | F3879-5G | fibrin gel component |
| Tranforming Growth Factor-Beta 1 | PeproTech | 100-21 | growth factor for stimulating collagen production |
| Hemocytometer | Hausser Scientific Co. | 3200 | for cell counting |
| Polycarbonate tubing | US Plastics | PCTUB1.750X1.625 | material for making tall, ring stacking plates |
| Polycarbonate sheet | Home Depot | 409497 | material for making tall, ring stacking plates |
| Adhesive polymer solvent | SCIGRIP | 10799 | material for making tall, ring stacking plates |
| Instron 5940 | Instron | N/A | tensile testing machine |
| U-Stretch | Cell Scale | N/A | tensile testing machine |
| Smooth Muscle Actin | MA5-11547 | Thermo Fisher | antibody |
| Tropomyosin | MA5-11783 | Thermo Fisher | antibody |
Referencias
- Luciani, G. B., et al. Operative risk and outcome of surgery in adults with congenital valve disease. ASAIO J. 54 (5), 458-462 (2008).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: two phase 2 single-arm trials. Lancet. 14 (387), 2026-2034 (2016).
- McAllister, T. N., et al. Effectiveness of haemodialysis access with an autologous tissue-engineered vascular graft: a multicentre cohort study. Lancet. 373 (9673), 1440-1446 (2009).
- Wystrychowski, W., et al. First human use of an allogeneic tissue-engineered vascular graft for hemodialysis access. J Vasc Surg. 60 (5), 1353-1357 (2014).
- Konig, G., et al. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. 30 (8), 1542-1550 (2009).
- Gui, L., et al. Construction of tissue-engineered small-diameter vascular grafts in fibrin scaffolds in 30 days. Tissue Eng Part A. 20 (9-10), 1499-1507 (2014).
- Sundaram, S., Echter, A., Sivarapatna, A., Qiu, C., Niklason, L. Small-diameter vascular graft engineered using human embryonic stem cell-derived mesenchymal cells. Tissue Eng Part A. 20 (3-4), 740-750 (2014).
- Quint, C., Arief, M., Muto, A., Dardik, A., Niklason, L. E. Allogeneic human tissue-engineered blood vessel. J Vasc Surg. 55 (3), 790-798 (2012).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 31 (108), 9214-9219 (2011).
- Dahl, S. L., et al. Readily available tissue-engineered vascular grafts. Sci Transl Med. 2 (68), (2011).
- Syedain, Z. H., Meier, L. A., Lahti, M. T., Johnson, S. L., Tranquillo, R. T. Implantation of completely biological engineered grafts following decellularization into the sheep femoral artery. Tissue Eng Part A. 20 (11-12), 1726-1734 (2014).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Meier, L. A., et al. Blood outgrowth endothelial cells alter remodeling of completely biological engineered grafts implanted into the sheep femoral artery. J Cardiovasc Transl Res. 7 (2), 242-249 (2014).
- Pinnock, C. B., Meier, E. M., Joshi, N. N., Wu, B., Lam, M. T. Customizable engineered blood vessels using 3D printed inserts. Methods. S1046-2023 (15), 30184-30185 (2015).
- Blakely, A. M., Manning, K. L., Tripathi, A., Morgan, J. R. Bio-Pick, Place,and Perfuse: A New Instrument for Three-Dimensional Tissue Engineering. Tissue Eng Part C Methods. 21 (7), 737-746 (2015).
- Gwyther, T. A., et al. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cells Tissues Organs. 194 (1), 13-24 (2011).
- Fearon, W. F., et al. Changes in coronary arterial dimensions early after cardiac transplantation. Transplantation. 27 (6), 700-705 (2007).
- Erbel, R., Eggebrecht, H. Aortic dimensions and the risk of dissection. Heart. 92 (1), 137-142 (2006).
- Ha, D. M., et al. Transforming growth factor-beta 1 produced by vascular smooth muscle cells predicts fibrosis in the gastrocnemius of patients with peripheral artery disease. J Transl Med. 14, 39(2016).
- Skalli, O., et al. Alpha-smooth muscle actin, a differentiation marker of smooth muscle cells, is present in microfilamentous bundles of pericytes. J Histochem Cytochem. 37 (3), 315-321 (1989).
- von der Ecken, J., et al. Structure of the F-actin-tropomyosin complex. Nature. 519 (7541), 114-117 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados