Method Article
Mise à l'échelle de l'ingénierie vasculaire Greffes Utilisation 3D Printed Guides et Méthode d'empilage Anneau
Dans cet article
Résumé
les vaisseaux sanguins d'ingénierie évolutive permettrait d'améliorer l'applicabilité clinique. Utilisation des guides 3D imprimés facilement considérables, anneaux de muscle lisse vasculaire ont été créés et empilés en une forme tubulaire, formant un greffon vasculaire. Greffes peuvent être dimensionnés pour répondre à la gamme de dimensions des artères coronaires humaines en changeant simplement la taille de la 3D-imprimé guide.
Résumé
La maladie coronarienne reste une cause majeure de décès, touchant des millions d'Américains. Avec le manque de greffons vasculaires autologues disponibles, les greffes d'ingénierie offrent un grand potentiel pour le traitement des patients. Cependant, les greffes vasculaires d'ingénierie ne sont généralement pas facilement modulable, ce qui nécessite la fabrication de moules sur mesure ou tubes de polymère afin de personnaliser différentes tailles, ce qui constitue une pratique chronophage et coûteuse. artères humaines varient en diamètre de lumière d'environ 2,0 à 38 mm et une épaisseur de paroi d'environ 0,5 à 2,5 mm. Nous avons créé une méthode, appelée "Ring Méthode d'empilage», dans lequel des anneaux de taille variable de tissu du type cellulaire souhaité, montré ici avec des cellules musculaires lisses vasculaires (CML), peut être créé à l'aide des guides de montants centraux pour contrôler le diamètre lumen et coques extérieures de dicter l'épaisseur de la paroi du vaisseau. Ces anneaux de tissu sont ensuite empilées pour créer un produit d'assemblage tubulaire, imitant la forme naturelle d'un vaisseau sanguin. La longueur du navire peut be conçue par l'empilement simplement le nombre de cycles nécessaires pour constituer la longueur nécessaire. Avec notre technique, les tissus de formes tubulaires, semblable à un vaisseau sanguin, peuvent être facilement fabriqués dans une variété de dimensions et longueurs pour répondre aux besoins de la clinique et le patient.
Introduction
Dans le traitement de la maladie coronarienne (CAD), propres vaisseaux sanguins d'un patient sont prélevés en tant que matériau de greffe pour la chirurgie de pontage. Cependant, souvent, les malades ne sont pas des navires viables pour faire un don à eux-mêmes, et dans les cas où ils le font, le site donneur provoque des dommages supplémentaires considérables et a un risque sérieux d'infection. 1 greffes vasculaires Engineered pourraient combler ce besoin. Évolutivité est d'une importance capitale pour les navires d'ingénierie afin de répondre à la vaste gamme de besoins des patients de la taille des navires. Cependant, les méthodes actuelles pour les navires d'ingénierie ne sont pas facilement extensible, et nécessitent généralement refabrication de moules complexes ou échafauds polymères. La plupart des greffons conçus soit utilisent un échafaudage tubulaire en polymère qui est ensemencé avec des fibroblastes musculaires lisses vasculaires ou des cellules endothéliales; ou roulage d'une feuille de cellules autour d'un mandrin pour créer un tube de tissu. Deux greffes vasculaires d'ingénierie dans des essais cliniques sont basés sur une decellularized plateforme polymère ECM. 2, 3, 4 greffes polymères disponibles pour une utilisation dans la réparation vasculaire sont déjà connus pour avoir des problèmes avec la perméabilité, ce qui pourrait se poser comme un problème majeur avec l' application à long terme d'une greffe avec une présence de polymère durable. Moules tubulaires ont été utilisés pour fabriquer complètement vaisseaux cellulaires, 5, 6, 7, 8, 9, 10, 11, 12, 13 quelles procédures auraient besoin de conception supplémentaires et la fabrication d'outils pour moules personnalisés afin de produire des navires dans une variété de tailles .
Le procédé décrit dans ce document comprend une nouvelle technique permettant de créer facilement extensible vasculaire machinégreffes utilisant des inserts personnalisables 3D imprimés et des plaques de culture traditionnelles. 14 Les cellules sont ensemencées dans des plaques avec des inserts d'un poste central et enveloppe extérieure. Les contrôles post diamètre de la lumière et permet à la monocouche cellulaire à l'auto-assembler en un anneau de tissu. L'extérieur des commandes shell épaisseur de l'anneau, et donc l'épaisseur de la paroi du récipient final. anneaux de tissu remplis sont ensuite empilés pour former un tube, la greffe vasculaire. L'avantage de cette méthode, dite "Ring Méthode d'empilage» est que tout type de cellules adhérentes peut être ensemencée dans la configuration de la plaque et les anneaux ou tubes de toute dimension nécessaire à l'application souhaitée des tissus peuvent être générés par simple modification des inserts de guidage. Techniques comparatives en tissus Création d'ingénierie anneaux de tissu restent difficiles à l' échelle, 15, 16 nécessitant refabrication de moules pour chaque taille souhaitée. En outre, des greffes vasculaires faites en utilisant cette méthode peut être produired en 2-3 semaines, plusieurs semaines plus rapide par rapport à d'autres navires d'ingénierie. 6 Pour la clinique, cette fois différence peut faire une différence significative dans le traitement d'un patient se détériore.
Protocole
1. Culture cellulaire Préparation
- Utiliser des cellules musculaires lisses aortiques humaines de muscle achetés dans le commerce.
- Maintenir les cellules dans le muscle lisse des milieux de croissance cellulaire composée de 88,6% 231 médias, 0,1% chacun d'insuline humaine recombinante (rh-insuline), le facteur de croissance fibroblastique humain recombinant (rh-FGF), le facteur de croissance épidermique humain recombinant (rh-FGF), et l'acide ascorbique; et 5% chacun de sérum bovin fœtal (FBS) et de la L-glutamine; et 1% d'antibiotique / antimycotique.
NOTE: Chaque facteur de croissance, de FBS et L-glutamine sont achetés sous forme de kit de croissance des médias vasculaire. - médias Changer toutes les 48 heures jusqu'à ce que les cellules sont environ 90% de confluence et prêt pour l'ensemencement des tissus.
- Stocker les piles dans un incubateur entre les changements des médias pour l'expansion.
2. Préparation de la 3D Printed Inserts et personnalisé en silicone moulé Plaques
- Utilisez une imprimante 3D commerciale (par exemple, Replicator Mini) pour 3D imprimer les inserts de plaque.
- Utilisez open source de logiciel de conception 3D tels que Blender pour créer les modèles 3D des extérieurs coquilles et des postes imprimés.
- Exporter le fichier du pilote du modèle via un format .stl permettant la portabilité au logiciel de l'imprimante 3D.
- Produire des messages imprimés et des coquilles extérieures à l'aide de filaments de poly (acide lactique) (PLA) chargé dans l'imprimante 3D.
- À la suite de l'impression, effectuer un trempage de 30 minutes dans 70% -100% de solution d'éthanol pour stériliser chaque insert.
- Préparer un agent de durcissement 01:10 à la base du mélange polymère de silicone polymère poly (diméthylsiloxane) (PDMS) et permettre au mélange de dégazer à la température ambiante pendant 10 min.
- Définir les tailles de boîtes de Pétri utilisés en tant que petit (35 mm), intermédiaire (60 mm) et de grande taille (100 mm).
- Ajouter 2 ml, 4 ml et 6 ml de silicone non durci à chaque petite plaque intermédiaire et grande, respectivement, et de créer une couche mince à travers tout le fond de la boîte de Pétri.
- Créer des postes pour la petite plaque en versant PDMS dans un100 mm plaque à une hauteur de 7 mm et laisser durcir sur une plaque chauffante à 60 ° C pendant environ 2-3 heures. Ensuite, utilisez une biopsie poinçon de 5 mm pour perforer les messages cylindriques. Utilisez une petite quantité de PDMS non durcies pour fixer chaque PDMS cylindre et au centre de chaque petite assiette.
- Les plaques intermédiaires et grands, avant le durcissement complet du PDMS au fond de la plaque, placer les articles imprimés 3D 10 mm et 20 mm de diamètre au centre dans chacune des plaques intermédiaires et grandes, respectivement. Pour les grandes plaques, placer en outre une 3D imprimée enveloppe extérieure d'environ 66,7 mm de diamètre équidistance du poste.
- Permettre à chaque plat à durcir à l'air libre sur une plaque chauffante à 60 ° C pendant environ 2-3 heures, ce qui permet 18 heures pour le dégazage du polymère. Fixer des composants imprimés sur la plaque dans la région et l' orientation correcte comme on le voit sur la figure 1.
- Ajouter une solution de 70% d'éthanol avec 30% d'eau distillée pendant 30 minutes à l'intérieur de toutes les plates pour la stérilisation puis couvrent chaque plaque.
- Aspirer soigneusement l'éthanol à partir de chaque plaque et laisser sécher à l'air.
- Dresser chaque assiette dans une enceinte de sécurité biologique (BSC) à côté de son couvercle, face vers le haut. Exposer assiettes et couvercles à la lumière UV sous le BSC pendant 30 minutes pour effectuer la stérilisation. La technique stérile est réalisée avec chaque étape après l'exposition aux UV.
3. Préparation de fibrine Hydrogel, Ensemencement avec des cellules musculaires lisses et entretien des plaques
- Mélanger une solution de gel de fibrine contenant du milieu de croissance + 0,01% de TGF-β1 dans des quantités de 0,5 ml, 1,1 ml et 1,81 ml pour les petites et grandes tailles intermédiaires de plaques, respectivement.
- Ajouter 40 ul, 88,4 pi et 145 pi de thrombine, à partir d'un stock de 100 U / ml, pour les médias de chaque petit, intermédiaire et grande plaque, respectivement. Remuer doucement chaque plaque à la main pour veiller à ce que la thrombine soit homogène au sein des médias.
- Ensuite, ajoutez 1601; L, 354 pi et 580 pi fibrinogène, à partir d'un stock de 20 mg / ml, goutte à goutte circulairement au mélange thrombine-médias à chaque petit, intermédiaire et grande plaque, respectivement. Remuer doucement à la main pour assurer le mélange et la distribution de l'hydrogel en une couche régulière.
- Laisser hydrogel durcir pendant 10-15 minutes à la température ambiante.
- Trypsiniser les cellules musculaires lisses élargies en 150 mm des plaques de culture cellulaire et centrifugation selon les protocoles standards. Le culot résultant doit être remis en suspension dans 3 ml de milieu de différenciation consistant en 98% - 231 médias, 1% de FBS et 1% d'antibiotique / antimycotique.
- Mélanger vigoureusement les cellules par titration de haut en bas avec une pipette de 2 mL pour briser les amas cellulaires. Nombre de cellules avec un hémocytomètre et créer une suspension de cellules de 2 x 10 6 cellules / ml, 1,0 x 10 7 cellules / ml et 1,4 x 10 7 cellules / ml pour les petites et les grandes plaques intermédiaires, respectivement.
- Ajouter 1 mL de chaque int suspension cellulaireoa 50 ml conique correspondant marqué petite, intermédiaire et grande. Mettre en place un supplément de 50 ml conique de cette manière pour chaque anneau de tissu supplémentaire souhaité.
- Ajouter un média de différenciation à chaque conique pour obtenir des volumes d'ensemencement final de 2 ml, 4 ml et 5 ml pour chaque petit, intermédiaire et grand vaisseau, respectivement. Ensuite, pipeter soigneusement la solution cellulaire goutte à goutte sur le dessus de l'hydrogel préparé dans chaque plaque correspondante.
- Placer les plaques dans l'incubateur à 37 ° C et 5% de CO 2.
- Changer les médias de différenciation toutes les 48-72 heures pour chaque plaque. Dans le cas de la plus grande plaque, changer de support initialement après 24 heures, puis le changer tous les 48-24 heures pour compenser la grande densité d'ensemencement des cellules.
- Après 2-4 jours que les anneaux ont complètement contractée vers le poste, ajouter 10 pi, 20 pi et 35 pi de TGF-β1 à chaque petit, intermédiaire et grand anneau, respectivement. Après l'exposition au TGF-β; 1 pendant au moins 24 heures, les anneaux sont prêts à être manipulés.
4. Assemblée des Vascular construire et d'entretien
- Avant la fabrication de la construction finale vasculaire, un conteneur spécialisé est créé pour maintenir le récipient rempli.
- Pour le petit navire, créer une plaque haute pour l'anneau d'empilage en coupant une section de 2 pouces sur le dessus d'un polycarbonate ml tube de 50 conique, puis PDMS coller le bord découpé dans une plaque de 35 mm. Utilisez le couvercle conique, comme le couvercle de la plaque.
- Pour le vaisseau de haut anneau intermédiaire et grand empilement de plaques, couper un diamètre tube de polycarbonate de 1,75 pouces dans 2,5 sections pouces de la longueur pour servir les murs de la plaque de hauteur. Pour le fond de la plaque de hauteur, couper une feuille de polycarbonate de 0,125 pouce d'épaisseur en 2 pouces morceaux de cercle de diamètre. Utilisation de ciment acrylique solvant, lier la section de tube de polycarbonate à la pièce de découpe circulaire. Utilisez le couvercle d'une boîte de Pétri de 60 mm que le couvercle pour la plaque de hauteur.
- 3D pmessages de Rint 5, 10 et 20 mm de diamètre et 50 mm de longueur.
- Ajouter 10 ml de silicone non durci à chaque récipient. Avant le durcissement complet du PDMS, placer au centre de chaque poste créé à l'étape 4.1.3 dans chaque petite, intermédiaire et grand récipient.
- Laisser sécher sur un ensemble de plaque chaude à 60 ° C pendant 2-3 heures.
- Stériliser avec une solution d'éthanol à 70% avec 30% d'eau distillée pendant 30 minutes.
- Aspirer soigneusement l'éthanol à partir de chaque récipient, puis laisser sécher à l'air dans le BSC. Ensuite, organiser les conteneurs dans la hotte avec chaque plaque placée à côté de son couvercle, face vers le haut. Exposer des conteneurs à la lumière UV sous le BSC pour 30 minutes supplémentaires pour stérilisation supplémentaire. Utiliser une technique stérile avec chaque étape après l'exposition aux UV.
- En utilisant des pinces très fines, retirez soigneusement chaque anneau d'hydrogel de muscle lisse roulées à partir de son poste et transférer à son grand récipient, correspondant aux grands postes.
- Utilisez une paire deforceps dans chaque main et soulever un côté de l'anneau du poste, puis l'autre. Soyez prudent pour protéger et maintenir la lumière.
- Effectuer le transfert avec ce procédé à deux mains, glissant premier côté, puis de l'autre côté de l'anneau sur le grand poteau. En utilisant, les mouvements progressifs doux, et de travailler de manière circonférentielle, pousser lentement l'anneau vers le bas sur le grand poteau. empiler ensuite les anneaux de tissu jusqu'à ce que la longueur de la cuve souhaitée a été obtenue, chaque anneau ajoutant environ 1-2 mm de longueur pour la construction terminée.
- Avec la pile de l'anneau positionné sur les 3D imprimés messages grands, tourner la plaque de sorte que le poste est parallèle à la surface de travail.
- À l'aide d'une micropipette, ajouter 40, 80 et 160 ul de thrombine à une concentration de 100 U / ml en douceur à la surface extérieure de chaque petit, moyen et gros vaisseaux, respectivement. Tout en ajoutant de la thrombine, tourner lentement la plaque pour assurer une couverture uniforme de toutes les surfaces de la construction.Ce sera la base pour la colle de fibrine utilisé pour sécuriser la construction de la pile de l'anneau dans les premiers jours après la construction.
- Ensuite, ajouter 40, 80 et 160 ul de fibrinogène à une concentration de 20 mg / mL à chaque petite, intermédiaire et grande construction, respectivement, à l'aide d'une micropipette, tout en faisant tourner rapidement le produit d'assemblage. La thrombine et le fibrinogène rapidement mis dans un gel ferme une fois mélangé. En raison du temps de durcissement courts, appliquer le fibrinogène aussi rapidement et uniformément que possible.
- Ajouter 20 ml de milieu de différenciation pour chaque récipient contenant le produit d'assemblage. Placer les vaisseaux dans un incubateur à 37 ° jusqu'à ce que nécessaire. Changer les médias tous les 3-5 jours.
Résultats
Démontrée ici est la fabrication de 3 tailles différentes d' ingénierie vasculaire de greffe (figure 1), ce qui montre que la Méthode d' empilage Ring (RSM) est évolutive. Pour prouver l' applicabilité, les 3 tailles de navires différents choisis corrélat la taille réelle du vaisseau humain pour l'artère descendante antérieure gauche (petite; diamètre de la lumière = 4 mm) 17, aorte descendante (intermédiaire; lumière de diamètre = 10 mm) et l' aorte ascendante (grand; diamètre de la lumière = 20 mm) 18. L'épaisseur de paroi est d'environ 500 um pour les petits anneaux, et environ 1 500 um pour les deux bagues intermédiaires et grands. Chaque récipient est construit démontré par l'empilement 6 anneaux, ce qui équivaut à une longueur d'environ 6 mm pour le petit récipient et 9 mm pour les récipients intermédiaires et grands. Longueur est basée sur l'épaisseur de la paroi de chaque cycle individuel.
L'analyse histologique a révélécellularité élevée dans tous les anneaux de tailles (figure 2). matériau rouge délimite gel de fibrine. En petits anneaux, une petite quantité de gel de fibrine résiduel est vu sur le bord extérieur de l'anneau. Dans les plus grands anneaux, un peu de gel de fibrine a été entrecoupée par le contenu cellulaire. Dans Trichrome de Masson, les indications de la production de collagène (marqué par le bleu) peut être vu dans les anneaux intermédiaires et grands.
Pour déterminer le phénotype cellulaire après la formation des anneaux, des anneaux de tissu ont été analysées à l' aide immunofluorescence pour les anticorps anti-alpha actine musculaire lisse (SMA) et tropomyosine (Figure 3). Toutes les tailles d'anneaux ont été positifs pour les deux anticorps, vérifier que le phénotype du muscle lisse a été maintenue.
L' essai de traction a été effectué sur les différents anneaux de taille pour déterminer leurs propriétés mécaniques (figure 4). Le U-stretch, un mécadispositif de test cal, a été utilisé pour essai de traction petites et intermédiaires des anneaux et des vaisseaux, tandis qu'un Instron a été utilisé pour la traction essai de grands anneaux et les vaisseaux. module d'élasticité (E), la résistance ultime à la traction (UTS) et la force de rupture (FS) des données ont été recueillies. Une tendance constante a été observée avec l'augmentation de la force en corrélation avec l'augmentation anneau et la taille des navires.
Cellule nombre nécessaire pour créer les anneaux de tailles variées ensemencement augmente à peu près linéairement avec la surface d'ensemencement (figure 5). Afin de créer de plus grands anneaux, au moins 14 millions de cellules ont été nécessaires pour créer les anneaux de taille de l'aorte abdominale.
empilements six anneaux, ou des récipients ont été testés pour leur capacité à résister à l'écoulement. Constructions ont été chargés dans un système de perfusion intégré personnalisé (figure 6) et soumis à l' écoulement pour un maximum de 5 minutes à des débits de 100 à 417 ml / min. Les navires étaientcapable de résister à l'écoulement. On a observé des fuites mineures au niveau des extrémités de la cuve, au niveau des connecteurs du système de perfusion.
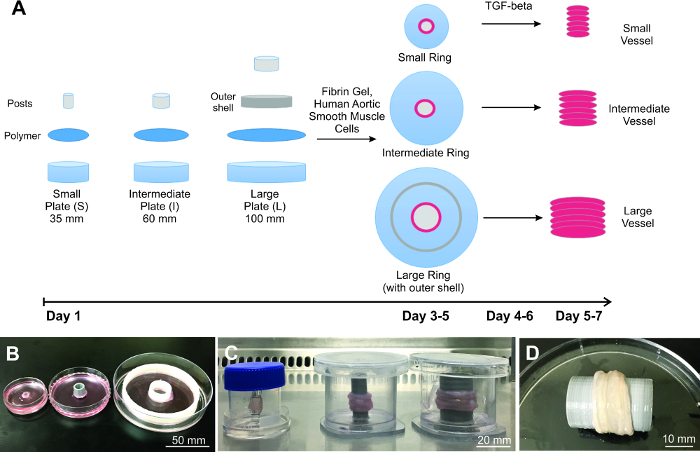
Figure 1: Construction des navires par génie mis à l' échelle. A) Schéma du processus de mise à l' échelle des navires d' ingénierie, en commençant par la préparation de la plaque, l' ensemencement des cellules et la construction des navires. Démontrée sont trois B) anneaux de tailles différentes et C) les navires. D) grand navire représentatif est complètement biologique et ressemble à un tissu naturel. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
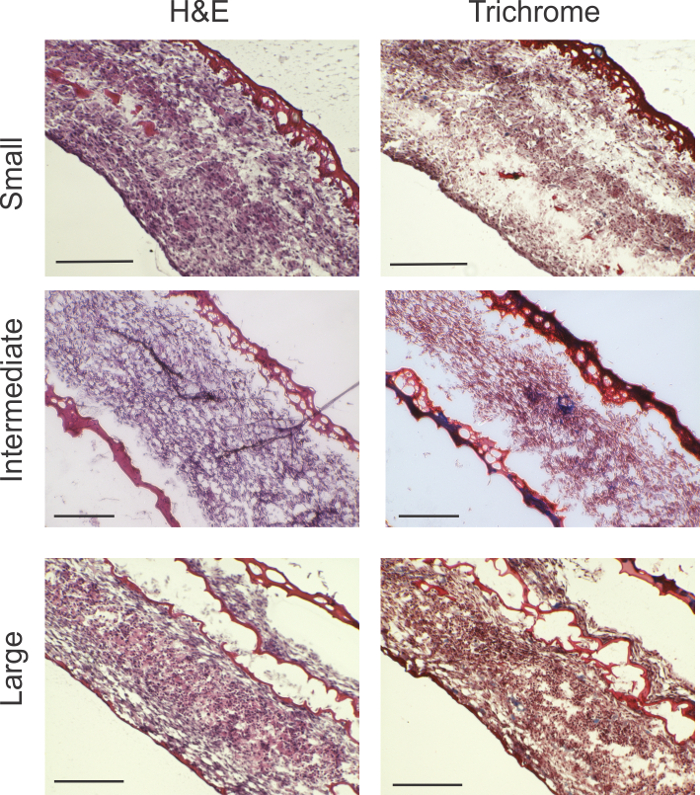
Figure 2: L' analyse histologique. rong> H & E et les taches trichrome de Masson montrent cellularité viable dans toute l'épaisseur de l'anneau pour toutes les tailles de bague. Trichrome taches révèlent des zones de production de collagène indiquées par bleu (flèches bleues). Les grands anneaux ont montré gel de fibrine intercalés, probablement en raison du pliage de la zone de surface relativement plus grande de la feuille de cellules. Barres d'échelle: petits anneaux = 200 um; anneaux intermédiaires = 200 um; et de grands anneaux = 0,5 mm. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
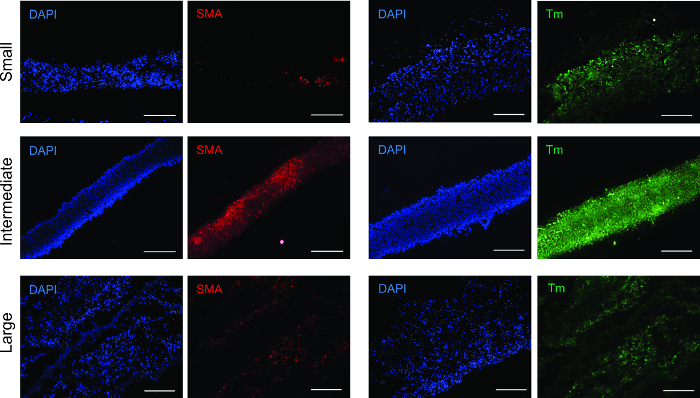
Figure 3: Analyse de marqueurs pour immunofluorescence musculaires lisses. Toutes les tailles de cycle étaient positifs pour les protéines contractiles du muscle lisse de l'actine de muscle lisse α-(SMA) et la tropomyosine (Tm). Les barres d'échelle = 200 um.charge / 55322 / 55322fig3large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
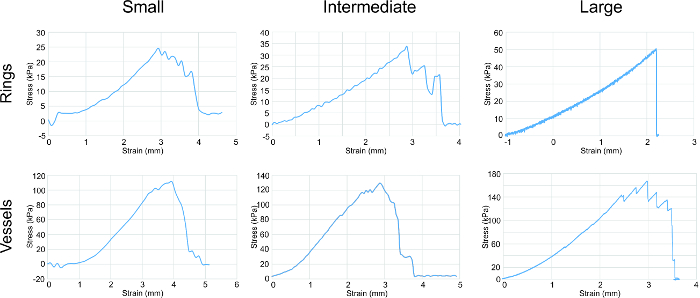
Figure 4: analyse des essais de traction. courbes contrainte-déformation pour toutes les tailles d'anneaux et les navires ont montré une tendance générale d'une augmentation de la force en corrélation avec l'augmentation de la taille / anneau navire. Anneaux et les navires ont été étirés circonférentiellement. Les paramètres évalués à partir des graphiques étaient module d' élasticité, résistance à la traction et de résistance à la rupture (énumérés dans le tableau 1). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5: Cellule ensemencement nombre corrélation pour surfer ensemencementzone ace. Basé sur des cellules humaines de muscle lisse de l'aorte. La surface spécifique est définie comme étant la zone dans les plaques de formation de cycle entre le poste central et la paroi en forme de plaque ou de coque extérieure. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
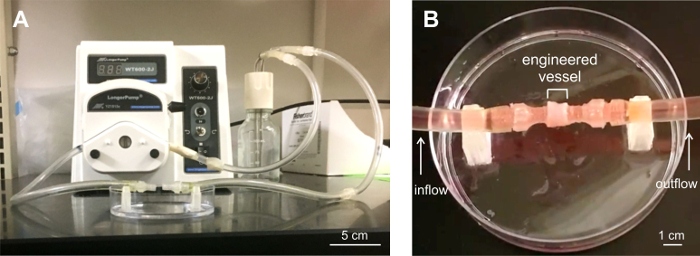
Figure 6: navire Six anneaux soumis à une analyse de perfusion. A) système de perfusion sur mesure construit pour les essais d'écoulement. B) navire d' ingénierie chargé dans le système de perfusion. Trois récipients ont été testés pour la perfusion de fuites pour un maximum de 5 min dans des conditions d'écoulement. Les navires sont restés stables en flux, avec des fuites mineures au niveau des vaisseaux terminaux connecteurs fixés à la tuyauterie du système. Veuillez cliquer ici pour voirune version plus grande de cette figure.

Figure animée 1: Démonstration du débit de perfusion à travers un vaisseau conçu. S'il vous plaît cliquer ici pour voir cette vidéo. (Faites un clic droit pour télécharger.)
| Petit | Intermédiaire | Grand | |||||
| Anneaux | Modulus élastique (kPa) | 13,6 ± 2,25 | (N = 6) | 14,5 ± 1,2 | (N = 3) | 17.2 ± 2.2 | (N = 4) |
| Résistance à la traction (kPennsylvanie) | 34.5 ± 10.2 | 39,6 ± 2,98 | 50,9 ± 10,6 | ||||
| Défaut Force (kPa) | 34.5 ± 10.2 | 39,6 ± 2,98 | 50,9 ± 10,6 | ||||
| Navires | Modulus élastique (kPa) | 49,7 ± 2,80 | (N = 3) | 59,8 ± 3,90 | (N = 2) | 79,8 ± 10,1 | (N = 2) |
| Résistance à la traction (kPa) | 115 ± 6,90 | 137 ± 12,0 | 192 ± 86,9 | ||||
| Défaut Force (kPa) | 96,2 ± 12,2 | 60,7 ± 12,1 | 173 ± 92,2 | ||||
Tableau 1: Les propriétés de traction des anneaux et des navires à l' échelle.
Discussion
La Méthode d'empilage Anneau présente de multiples avantages par rapport aux techniques actuelles vasculaires de l'ingénierie tissulaire construct. Le RSM peut être adapté pour créer des vaisseaux humains de toute taille en personnalisant simplement les dimensions de poste et de coquille extérieure. Notre méthode permet le développement de navires d'ingénierie sans polymères composés uniquement de cellules humaines et de dégradation rapide matériau de support trouvé dans le processus de cicatrisation naturelle du corps. greffes polymères sont connus pour causer la resténose à la clinique et pourrait devenir problématique si contenue dans les greffes d'ingénierie. nombre de cellules d'ensemencement doit être modifié pour chaque anneau de tissu de taille différente. Un graphique du nombre de cellules à la surface d'ensemencement est représenté sur la figure 5 à partir de laquelle le nombre d'ensemencement peut être approchée et / ou extrapolées. Il convient de noter que le type de cellules utilisées ici sont des cellules humaines de muscle lisse de l'aorte. Afin d'adapter le SMR à différents types de cellules, la taille des cellules et le taux de prolifération doivent être pris enla densité de l'examen et l'ensemencement optimale déterminée. Par exemple, nous avons également créé des anneaux de fibroblastes humains en utilisant le RSM, et nous avons constaté qu'au moins 2x le nombre de cellules est nécessaire par rapport à CML. Toute longueur souhaitée du récipient peut être construit par l'ajout d'anneaux. piles à anneaux ont été cultivées pendant jusqu'à 2 mois et est restée stable. anneaux intermédiaires et grands sont à la fois maintenu à 1500 um d'épaisseur de paroi appropriée, même si elles sont chacune construites dans une plaque de 60 mm et 100 mm, respectivement, par le placement d'une enveloppe extérieure de la plaque 100 mm. Cela montre l'utilité de l'enveloppe extérieure pour le contrôle et l'obtention de l'épaisseur de paroi appropriée pour un navire donné. À l' étape 3.3.1, le TGF-β1 est ajouté parce qu'il est connu pour stimuler la production de collagène 19 et a l'effet observé du serrage des anneaux. Une fois que les anneaux ont complètement roulé, une dose de TGF-β1 est ajouté dans l'étape finale, et les anneaux sont prêts à l'utilisation 1 jour plus tard. Le TGF-β1 fait augmenter la production de collagène dans les anneaux, comme on le voit dans les images trichromes (figure 2).
Les cellules dans les petits anneaux sont plus rond et compact, alors que dans les 2 dimensions plus grandes, des cellules le long des bords extérieurs présentent un degré d'alignement avec le bord du tissu et avec d'autres cellules alignées. Ce dernier peut indiquer un stade ultérieur de la maturité de la cellule, a évolué à partir du contenu cellulaire plus élevée dans les anneaux plus grands, et donc un plus grand degré de signalisation intercellulaire pour encourager la maturité. entremêlement de gel de fibrine dans les grandes bagues peut indiquer que les feuilles de cellules plus grandes ont tendance à se replier légèrement comme ils roulent. Les images histologiques montrant ce phénomène ont été prises 1 jour après le rouleau anneau complet amont il est donc compréhensible que le gel de fibrine, qui prend 2 semaines pour se dégrader dans la culture, serait encore présente. Cultiver les anneaux pendant au moins 2 semaines devrait se dégrader le gel de fibrine, laissant derrière elle une construction entièrement cellulaire.
nt "> alpha-actine du muscle lisse (SMA) constitue les filaments minces qui facilitent la contraction et de la tropomyosine est une protéine contractile. 20 21 Les deux SMA et de la tropomyosine étaient présents dans tous les anneaux de grande taille, avec le plus fort, le signal distribué plus uniformément dans le produit intermédiaire anneaux. Ce phénomène peut être dû à un degré plus élevé de la densité et de l'organisation cellulaire, la stimulation d'une augmentation dans le développement contractile de fonctionnement.Le module d'élasticité indique l'élasticité des anneaux, et l'E croissante des petits aux grands anneaux suggère une augmentation de la production de collagène et d'élastine. La résistance ultime à la traction est la plus grande force subie par les anneaux sans se rompre. la force d'échec est le point de défaillance des tissus. Pour les bagues, UTS est égale à FS. Pour les navires, l'UTS est supérieure FS, ce qui montre que la résistance à la rupture du récipient est attribué à la combinaison de la contribution mécanique à partir de toutes les baguesdans le récipient, et le point de défaillance est due à l'anneau le plus faible.
La force de nos navires d'ingénierie réside dans la gamme kPa, alors que les vaisseaux humains indigènes ont des forces dans la gamme MPa. Afin de renforcer nos navires vers celle des navires indigènes, nous étudions des techniques pour augmenter la production de la matrice extracellulaire, à savoir celle du collagène et de l'élastine. Les facteurs de croissance qui favorisent la production de collagène et d'élastine sont actuellement appliquées à nos anneaux pour déterminer si les propriétés de traction augmentera.
En plus des propriétés mécaniques, les mesures fonctionnelles de la contraction du muscle correspondant aux performances du bateau. La stimulation musculaire et la contraction par des facteurs tels que l'acétylcholine et de l'adrénaline peuvent être utilisés pour tester la force contractile du muscle. De telles expériences sont envisagées pour nos études futures.
Dans l'ensemble, nos résultats montrent que la Méthode d'empilage Anneau peut être facilement mise à l'échellepour obtenir une gamme de tailles de tissus vasculaires artificielles. Mise à l'échelle pour les plus grands navires humains, tels que le 40 mm diamètre de la lumière aortique, nécessiterait probablement le développement d'un vasa vasorum, la microvascularisation naturellement présent dans les grands navires de taille, que notre laboratoire développe actuellement. En outre, la couche de cellules endothéliales ( par exemple l'intima) qui typiquement des lignes de la lumière de la couche de support est important pour la mise en place correcte de l' hémodynamique dans un récipient. Notre laboratoire travaille actuellement sur la création de l'intima dans notre pile de cycle SMC en utilisant des cellules endothéliales vasculaires humaines. Avec ces techniques combinées, des navires par génie auraient une plus grande applicabilité à la clinique.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs tiennent à remercier nos collègues Lam laboratoire collègues Ammar Chishti et Bijal Patel pour son aimable collaboration avec certains de la culture de l'histologie et de la cellule. Le financement a été fourni par le Wayne State University nanomédecine Fellowship (CBP), fonds de démarrage et de l'Institut de recherche cardiovasculaire Subvention de démarrage (MTL).
matériels
| Name | Company | Catalog Number | Comments |
| Human Aortic Smooth Muscle Cells | ATCC | PCS-100-012 | vascular smooth muscle cells |
| Medium 231 | Gibco (Life Technologies | M-231-500 | media specific to vascular smooth muscle cells |
| Human Aortic Smooth Muscle Cell Growth Kit | ATCC | PSC-100-042 | growth factors for maintaining vascular smooth muscle cell viability |
| Replicator Mini 3D printer | MakerBot | N/A | 3D printer |
| Poly(lactic acid) 3D ink (PLA) | MakerBot | N/A | 3D printer filament |
| Poly(dimethlysiloxane) (PDMS) | Ellworth Adhesives | 3097358-1004 | polymer for gluing plate parts |
| Fibrinogen | Hyclone Labratories, Inc. | SH30256.01 | fibrin gel component |
| Thrombin | Sigma Life Sciences | F3879-5G | fibrin gel component |
| Tranforming Growth Factor-Beta 1 | PeproTech | 100-21 | growth factor for stimulating collagen production |
| Hemocytometer | Hausser Scientific Co. | 3200 | for cell counting |
| Polycarbonate tubing | US Plastics | PCTUB1.750X1.625 | material for making tall, ring stacking plates |
| Polycarbonate sheet | Home Depot | 409497 | material for making tall, ring stacking plates |
| Adhesive polymer solvent | SCIGRIP | 10799 | material for making tall, ring stacking plates |
| Instron 5940 | Instron | N/A | tensile testing machine |
| U-Stretch | Cell Scale | N/A | tensile testing machine |
| Smooth Muscle Actin | MA5-11547 | Thermo Fisher | antibody |
| Tropomyosin | MA5-11783 | Thermo Fisher | antibody |
Références
- Luciani, G. B., et al. Operative risk and outcome of surgery in adults with congenital valve disease. ASAIO J. 54 (5), 458-462 (2008).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: two phase 2 single-arm trials. Lancet. 14 (387), 2026-2034 (2016).
- McAllister, T. N., et al. Effectiveness of haemodialysis access with an autologous tissue-engineered vascular graft: a multicentre cohort study. Lancet. 373 (9673), 1440-1446 (2009).
- Wystrychowski, W., et al. First human use of an allogeneic tissue-engineered vascular graft for hemodialysis access. J Vasc Surg. 60 (5), 1353-1357 (2014).
- Konig, G., et al. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. 30 (8), 1542-1550 (2009).
- Gui, L., et al. Construction of tissue-engineered small-diameter vascular grafts in fibrin scaffolds in 30 days. Tissue Eng Part A. 20 (9-10), 1499-1507 (2014).
- Sundaram, S., Echter, A., Sivarapatna, A., Qiu, C., Niklason, L. Small-diameter vascular graft engineered using human embryonic stem cell-derived mesenchymal cells. Tissue Eng Part A. 20 (3-4), 740-750 (2014).
- Quint, C., Arief, M., Muto, A., Dardik, A., Niklason, L. E. Allogeneic human tissue-engineered blood vessel. J Vasc Surg. 55 (3), 790-798 (2012).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 31 (108), 9214-9219 (2011).
- Dahl, S. L., et al. Readily available tissue-engineered vascular grafts. Sci Transl Med. 2 (68), (2011).
- Syedain, Z. H., Meier, L. A., Lahti, M. T., Johnson, S. L., Tranquillo, R. T. Implantation of completely biological engineered grafts following decellularization into the sheep femoral artery. Tissue Eng Part A. 20 (11-12), 1726-1734 (2014).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Meier, L. A., et al. Blood outgrowth endothelial cells alter remodeling of completely biological engineered grafts implanted into the sheep femoral artery. J Cardiovasc Transl Res. 7 (2), 242-249 (2014).
- Pinnock, C. B., Meier, E. M., Joshi, N. N., Wu, B., Lam, M. T. Customizable engineered blood vessels using 3D printed inserts. Methods. S1046-2023 (15), 30184-30185 (2015).
- Blakely, A. M., Manning, K. L., Tripathi, A., Morgan, J. R. Bio-Pick, Place,and Perfuse: A New Instrument for Three-Dimensional Tissue Engineering. Tissue Eng Part C Methods. 21 (7), 737-746 (2015).
- Gwyther, T. A., et al. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cells Tissues Organs. 194 (1), 13-24 (2011).
- Fearon, W. F., et al. Changes in coronary arterial dimensions early after cardiac transplantation. Transplantation. 27 (6), 700-705 (2007).
- Erbel, R., Eggebrecht, H. Aortic dimensions and the risk of dissection. Heart. 92 (1), 137-142 (2006).
- Ha, D. M., et al. Transforming growth factor-beta 1 produced by vascular smooth muscle cells predicts fibrosis in the gastrocnemius of patients with peripheral artery disease. J Transl Med. 14, 39(2016).
- Skalli, O., et al. Alpha-smooth muscle actin, a differentiation marker of smooth muscle cells, is present in microfilamentous bundles of pericytes. J Histochem Cytochem. 37 (3), 315-321 (1989).
- von der Ecken, J., et al. Structure of the F-actin-tropomyosin complex. Nature. 519 (7541), 114-117 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon