Method Article
Die Skalierung von Engineered Gefäßprothesen Mit 3D-gedruckte Führer und den Ring Stapelverfahren
In diesem Artikel
Zusammenfassung
Skalierbare engineered Blutgefäße würde klinische Anwendbarkeit zu verbessern. Mit leicht ansehnliche 3D-gedruckte Führer, Ringe der glatten Gefäßmuskulatur wurden in eine röhrenförmige Form erstellt und gestapelt, ein Gefäßtransplantat zu bilden. Die Transplantate können so bemessen sein, um den Bereich der menschlichen Koronararterie Dimensionen gerecht zu werden, indem einfach die 3D-gedruckten Führungsgröße zu verändern.
Zusammenfassung
Koronare Herzkrankheit bleibt eine Haupttodesursache, Millionen von Amerikanern beeinflussen. Mit dem Mangel an autologe Gefäßtransplantate zur Verfügung, bietet entwickeln Transplantate großes Potenzial für die Behandlung des Patienten. Allerdings sind dazu entworfen Gefßtransplantate im Allgemeinen nicht leicht skalierbar, erfordern Herstellung von kundenspezifischen Formen oder Polymerrohren, um verschiedene Größen anzupassen, eine zeitraubende und kostspielige Praxis bilden. Menschliche Arterien erstrecken sie im Lumendurchmesser von etwa 2,0 bis 38 mm und in der Wandstärke von etwa 0,5-2,5 mm. Wir haben ein Verfahren geschaffen, das „Ring-Stacking-Methode“ bezeichnet wird, in der variable Größe Ringe von Geweben der Zelltypen gewünscht wird, hier gezeigt mit vaskulären glatten Muskelzellen (SMCs), kann unter Verwendung von Führungen der Führungsstangen erzeugt wird Lumendurchmesser zu steuern, und Außenschalen Gefäßwanddicke zu diktieren. Diese Geweberinge werden dann mit einem rohrförmigen Konstrukt zu erzeugen gestapelt, um die natürliche Form eines Blutgefäßes nachahmt. Die Fahrzeuglänge kann be durch einfaches Stapeln der Anzahl der Ringe zugeschnitten erforderlich benötigt, um die Länge zu bilden. Mit unserer Technik, Gewebe von röhrenförmigen Formen, ähnlich einem Blutgefäß, kann leicht in einer Vielzahl von Abmessungen und Längen hergestellt werden, um die Bedürfnisse der Klinik und Patienten gerecht zu werden.
Einleitung
Bei der Behandlung der koronaren Herzkrankheit (KHK), eine eigene Blutgefäße des Patienten werden als Implantatmaterial für Bypass-Operation entnommen wurden. Doch oftmals, kranke Patienten haben keine tragfähige Schiffe selbst zu spenden, und in Fällen, in denen sie das tun, bewirkt, dass der Spenderstelle erheblichen zusätzlichen Schaden und hat ein ernsthaftes Risiko für eine Infektion. 1 Engineered Gefäßtransplantaten könnte diesen Bedarf zu füllen. Skalierbarkeit ist von größter Bedeutung für das Engineering Schiffe, um die breite Palette von Patienten Gefäßgröße Anforderungen zu erfüllen. vorliegenden Verfahren für technische Gefäße sind jedoch nicht leicht skalierbar und erfordern in der Regel remanufacture von komplexen Formen oder Polymergerüsten. Die meisten engineered Transplantate entweder ein Polymer Rohrgerüst verwenden, die mit vaskulären Fibroblasten, glatten Muskelzellen oder Endothelzellen ausgesät wird; oder eine Zelle Blechrollen um einen Dorn einer Geweberohr zu schaffen. Zwei engineered Gefäßtransplantate in klinischen Studien basieren auf einer Dezellularisierend Polymer-ECM-Plattform. 2, 3, 4 Polymer - Transplantate zur Verwendung in der Gefäßreparatur verfügbar sind bereits zu haben Probleme mit der Durchgängigkeit bekannt, die als ein wichtiges Thema mit langfristigen Anwendung eines Transplantats mit einer anhaltenden Polymer Präsenz entstehen könnten. Rohrformen verwendet wurden vollständig zelluläre Gefäße herzustellen, 5, 6, 7, 8, 9, 10, 11, 12, 13 , die Verfahren der zusätzlichen Entwurfs- und Werkzeugherstellung für individuelle Formen benötigen , um würde Gefäße in einer Vielzahl von Größen zu produzieren .
Das beschriebene Verfahren umfasst hier eine neue Technik für leicht skalierbar engineered vaskulären SchaffungTransplantate anpassbare 3D-Druckplatten und traditionellen Kulturplatten verwendet wird. 14 Zellen werden in Platten mit Einsätzen aus einem zentralen Pfosten und Außenschale. Die post-Kontrollen Lumendurchmesser und ermöglicht die Zellschicht zur Selbstorganisation zu einem Ring von Gewebe. Die Außenschale steuert Dicke des Rings und somit Wandstärke des fertigen Behälters. Abgeschlossene Gewebe Ringe werden dann mit einem rohrförmigen, Gefäßtransplantat zu bilden, gestapelt. Der Vorteil dieser Methode, bezeichnet als die "Ring Stapelverfahren", ist, dass jede adhärenten Zelltyp in den Plattenaufbau und Gewebe Ringe oder Rohre jeder Größe, die für die gewünschte Anwendung ausgesät werden können, können durch einfaches Modifizieren Führungseinsätzen erzeugt werden. Vergleichstechniken im Tissue Engineering schaffen Ringe des Gewebes bleiben schwierig zu Skala, 15, 16 erfordern remanufacture von Formen für jede gewünschte Größe. Zusätzlich machte Gefäßtransplantate mit dieser Methode produzieren werden könnend in 2-3 Wochen, mehrere Wochen schneller im Vergleich zu anderen engineered Gefäßen. 6 Für die Klinik, diesmal Diskrepanz kann einen wesentlichen Unterschied in der Behandlung eines Patienten verschlechtert machen.
Protokoll
1. Zellkultur Vorbereitung
- Nutzen Sie die menschliche Aorta-Glattmuskelzellen im Handel erworben.
- Pflegen Zellen in Glattmuskelzellwachstumsmedium, bestehend aus 88,6% 231 Medien, jeweils 0,1% von rekombinantem Humaninsulin (rh-Insulin), rekombinanten humanen Fibroblasten-Wachstumsfaktor (rH-FGF), rekombinanten humanen epidermalen Wachstumsfaktor (rH-FGF), und Ascorbinsäure; und jeweils 5% fötales Rinderserum (FBS) und L-Glutamin; und 1% Antibiotikum / Antimykotikum.
HINWEIS: Jeder Wachstumsfaktor, FBS und L-Glutamin als Gefäß Medien Wachstum Kit erworben. - Ändern Medien alle 48 Stunden, bis die Zellen sind etwa 90% konfluent und bereit für die Gewebe Aussaat.
- Shop-Zellen in einem Inkubator in zwischen Medienwechsel für die Expansion.
2. Herstellung von 3D-Druckeinsätze und kundenspezifische Silikon geformten Platten
- Verwenden Sie einen kommerziellen 3D - Drucker (zB Replicator Mini) für 3D - Druck der Platteneinsätze.
- Verwenden Sie op3D-Design-Software en Quelle wie Blender die 3D-Modelle der bedruckten Außenschalen und Beiträge zu erstellen.
- Exportieren Sie die Treiberdatei des Modells über eine .stl Format für die Portabilität für die Software des 3D-Druckers ermöglicht.
- Produzieren gedruckt Pfosten und Außenschalen unter Verwendung von Poly (milchsäure) Filament (PLA) in den Drucker geladen 3D.
- Nach dem Drucken, führen eine 30-minütige in einer 70% -100% Ethanollösung einweichen jeder Einsatz zu sterilisieren.
- Vorbereiten eines Härtungsmittels 01.10 Polymermischung aus Poly (dimethylsiloxan) (PDMS) Siliconpolymer zu stützen und um die Mischung zu entgasen bei Raumtemperatur für 10 min ermöglichen.
- Definieren Petrischale Größen verwendet als kleine (35 mm), Zwischenprodukt (60 mm) und große (100 mm).
- In 2 ml, 4 ml und 6 ml nicht gehärteten Silikon auf jeder kleinen, mittleren und großen Platte, bzw., und erstellen Sie eine dünne Schicht über den gesamten Boden der Petrischale.
- Erstellen Sie Beiträge für die kleine Platte von PDMS in ein Eingießen100 mm Platte auf eine Höhe von 7 mm und ermöglichen für etwa 2-3 Stunden bei 60 ° C auf einer heißen Platte zu härten. Dann mit einem 5 mm Biopsiestanze zylindrischen Pfosten auszuzustanzen. Verwenden, um eine kleine Menge an ungehärtetem PDMS zu sichern jeden PDMS Zylinder und zu der Mitte jeden Plättchens.
- Für die Zwischen- und großen Platten vor an der Unterseite der Platte Härtung der PDMS vervollständigen, Ort, um die 3D-Druckstifte 10 mm und 20 mm im Durchmesser zentrisch in jeder Zwischen und großen Platten, respectively. Für die großen Platten, legen zusätzlich eine 3D-gedruckten Außenschale etwa 66,7 mm im Durchmesser Äquidistanz von der Post.
- Erlauben Jedes Gericht im Freien auf einer heißen Platte zu härten bei 60 ° C für etwa 2-3 Stunden, für 18 Stunden zur Entgasung des Polymers. Fix gedruckten Komponenten auf die Platte in dem richtigen Bereich und die Orientierung , wie in Abbildung 1 zu sehen ist .
- Eine Lösung aus 70% Ethanol mit 30% destilliertem Wasser 30 Minuten lang auf die Innenseite aller plates für die Sterilisation und dann decken jede Platte.
- aspirieren vorsichtig das Ethanol aus jeder Platte und an der Luft trocknen lassen.
- Ordnen Sie jede Platte in einem biologischen Sicherheitsschrank (BSC) neben dem Deckel, dem Gesicht nach oben. Expose Platten und Deckel mit UV-Licht unter dem BSC 30 Minuten Sterilisation zu vervollständigen. Sterile Technik wird bei jedem Schritt nach UV-Bestrahlung durchgeführt.
3. Herstellung von Fibrinhydrogels, mit glatten Muskelzellen und Wartung von Platten Seeding
- Mischen Sie eine Lösung von Fibrin-Gel mit Wachstumsmedium + 0,01% TGF-β1 in den Mengen von 0,5 ml, 1,1 ml und 1,81 ml für kleine, mittlere und große Plattengrößen sind.
- Werden 40 & mgr; l, 88,4 & mgr; l und 145 & mgr; l Thrombin, aus einem Vorrat von 100 U / ml, zu den Medien jedes kleinen, mittleren und großen Platte, respectively. Vorsichtig schwenken jede Platte mit der Hand, dass Thrombin, um sicherzustellen, gleichmäßig in den Medien gemischt wird.
- Als Nächstes fügen 1601 L, 354 & mgr; l und 580 & mgr; l Fibrinogen, aus einem Vorrat von 20 mg / ml, tropfenweise kreisförmig auf die Thrombin-Medien-Gemisch zu jedem kleinen, mittleren und großen Platte auf. Vorsichtig schwenken Mischen von Hand und Verteilung des Hydrogels in einer gleichmäßigen Schicht zu gewährleisten.
- Erlauben Hydrogel für 10-15 Minuten bei Raumtemperatur aushärten.
- Trypsinize glatten Muskelzellen in 150 mm-Zellkulturplatten und zentrifugieren erweitert nach Standardprotokollen. Das resultierende Pellet sollte in 3 ml Differenzierungsmedium resuspendiert werden, bestehend aus 98% - 231 Medien, 1% FBS und 1% Antibiotikum / Antimykotikum.
- Energisch Zellen mischen durch Titration nach oben und unten mit einer 2-ml-Pipette alle Zellklumpen aufzubrechen. Zählen von Zellen mit einem Hämozytometer und schaffen eine Zellsuspension von 2 x 10 6 Zellen / ml, 1,0 x 10 7 Zellen / ml und 1,4 x 10 7 Zellen / ml für kleine, mittlere und große Platten, respectively.
- 1 ml jeder Zellsuspension intoa 50 ml konischen entsprechend markierten kleinen, mittleren und großen. Legen Sie zusätzlich 50 ml konischen auf diese Weise für jeden weiteren Gewebering gewünscht werden.
- In jeder konischen Differenzierung Medien bis zur endgültigen Aussaat Volumen von 2 ml zu erhalten, 4 ml und 5 ml für jeden kleinen, mittleren und großen Gefäße sind. Dann Pipettieren vorsichtig die Zelllösung tropfenweise auf der Oberseite des hergestellten Hydrogels in jeder entsprechenden Platte.
- Ort Platten in den Inkubator bei 37 ° C und 5% CO 2.
- Ändern Differenzierung Medien alle 48-72 Stunden für jede Platte. Bei der größeren Platte, Medien zunächst nach 24 Stunden ändern, dann alle 48 bis 24 Stunden für die große Zelle Aussaatdichte zu kompensieren ändern.
- Nach 2-4 Tagen wie die Ringe vollständig in Richtung der Post unter Vertrag haben wird, mit 10 & mgr; l, 20 & mgr; l und 35 & mgr; l von TGF-β1 zu jedem kleinen, mittleren und großen Ring sind. Nach Exposition gegenüber TGF-β; 1 für mindestens 24 Stunden, Ringe sind bereit behandelt werden.
4. Montage von Vascular Konstruieren und Wartung
- Vor der Herstellung des endgültigen Gefäßkonstrukt ist ein spezialisierter Container erstellt den fertigen Behälter zu halten.
- Für den kleinen Schiff, ein großer Teller für Ringstapel erstellen, indem ein 2-Zoll-Abschnitt von der Spitze eines 50-ml-Polycarbonat konische Röhrchen schneiden und dann PDMS die Schnittkante in eine 35-mm-Platte kleben. Verwenden Sie den konischen Deckel als Plattendeckel.
- Für die Zwischen- und großen Behälter hoch Ringplatten stapeln, schneiden Sie ein 1,75-Zoll Durchmesser Polycarbonatrohr in 2,5-Zoll-Abschnitte in Längsrichtung als die hohen Plattenwände zu dienen. Für die hohen Plattenboden, geschnitten, um eine 0,125 Zoll dicke Polycarbonatfolie in 2-Zoll-Durchmesser-Kreis Stücke. Mit Acryl-Klebe, binden das Polycarbonat Rohrabschnitt an dem kreisförmigen Schnittstück. Verwenden Sie den Deckel aus einer 60 mm Petrischale als Deckel für die hohe Platte.
- 3D-pRINT Beiträge 5, 10 und 20 mm im Durchmesser und 50 mm in der Länge.
- 10 ml ungehärtetem Silikon zu jedem Behälter. Vor der vollständigen Aushärtung des PDMS, legen Sie zentral jeden in Schritt geschaffene 4.1.3 in jedem kleinen, mittleren und großen Behälter.
- Lassen Sie auf einer heißen Platte Set für 2-3 Stunden auf 60 ° C zu heilen.
- Sterilisieren mit einer Lösung von 70% Ethanol mit 30% destilliertem Wasser für 30 Minuten.
- aspirieren vorsichtig das Ethanol aus jedem Behälter und lassen Sie in der BSC an der Luft trocknen. Als nächstes wird mit jeder Platte neben dem Deckel, dem Gesicht nach oben platziert, um die Behälter in der Motorhaube anordnen. Expose Behälter mit UV-Licht unter der BSC für weitere 30 Minuten für die weitere Sterilisation. Verwenden Sie sterile Technik bei jedem Schritt nach der UV-Exposition.
- Mit sehr feinen Pinzette vorsichtig entfernen sich eng gerollte glatten Muskulatur Hydrogel Ring von seinem Posten und Transfer zu seinem entsprechenden größeren Behälter mit den hohen Beiträgen.
- Verwenden Sie ein Paarin jeder Hand Zange und heben Sie eine Seite des Rings von der Post, und dann die andere. Achten Sie darauf, zu schützen und das Lumen aufrechtzuerhalten.
- Führen Sie die Übertragung mit diesem zweihändige Verfahren wird zunächst eine Seite schieben und dann auf der anderen Seite des Rings auf den hohen Beitrag. Durch sanfte, schrittweise Bewegungen, und am Umfang arbeiten, drücken Sie langsam den Ring nach unten auf den hohen Beitrag. Anschließend Ringe stapeln Gewebe, bis die gewünschte Schiffslänge erhalten wurde, wobei jeder Ring Zusatz von ca. 1-2 mm Länge bis zum fertigen Konstrukt.
- Mit dem Ring-Stack auf den hohen 3D-gedruckten Pfosten positioniert ist, drehen Sie die Platte, so dass die Post parallel mit der Arbeitsfläche ist.
- Mit einer Mikropipette, dann werden 40, 80 und 160 & mgr; l Thrombin in einer Konzentration von 100 U / mL sanft auf die Außenfläche jeder kleinen, mittleren und großen Gefäße, respectively. Während die Thrombin Zugabe langsam drehen die Platte Abdeckung aller Oberflächen des Konstrukts, um sicherzustellen, sogar.Dadurch wird die Basis für die Fibrinkleber sein, den Ringstapel Konstrukt in den ersten Tagen nach dem Bau verwendet zu sichern.
- Anschließend fügen in einer Konzentration von 20 mg / mL 40, 80 und 160 & mgr; l Fibrinogen in jedem kleinen, mittleren und großen Konstrukt jeweils mit einer Mikropipette, während das Konstrukt schnell dreht. Das Thrombin und Fibrinogen schnell in ein festes Gel gesetzt einmal gemischt. Aufgrund der Zeit kurzen Aushärtezeit, wenden Sie das Fibrinogen so schnell und gleichmäßig wie möglich.
- 20 ml Differenzierungsmedium zu jedem Behälter, die das Konstrukt halten. Platz Gefäße in einen 37 ° C Inkubator ° bis benötigt. Ändern Medien alle 3-5 Tage.
Ergebnisse
Nachgewiesene hier ist die Herstellung von 3 verschiedenen engineered Gefäßimplantat Größen (Abbildung 1), die zeigen , dass der Ring Stapelverfahren (RSM) skalierbar ist. Um zu beweisen , Anwendbarkeit, die 3 verschiedene Gefäßgrößen Korrelat tatsächlichen menschlichen Gefäßgröße für den linken vorderen absteigenden Arterie gewählt (klein; Lumendurchmesser = 4 mm) 17, absteigend Aorta (Zwischen; Lumendurchmesser = 10 mm) und aufsteigende Aorta (groß; Lumendurchmesser = 20 mm) 18. Die Wanddicke beträgt etwa 500 & mgr; m für die kleinen Ringe und etwa 1500 & mgr; m sowohl für die Zwischen- und große Ringe. Jeder Behälter nachgewiesen wird durch Stapeln 6 Ringen aufgebaut, was einer Länge von etwa 6 mm für die kleinen Behälter und 9 mm für die mittlere und große Schiffe. Länge basiert auf der Wanddicke jedes einzelnen Rings.
Die histologische Analyse zeigte,hohe Zellularität in allen Ringen Größen (Abbildung 2). Red Material abgrenzt Fibrin-Gel. In kleinen Ringen wird eine kleine Menge an restlichem Fibrin-Gel auf der äußeren Kante des Rings gesehen. In den größeren Ringen wurde etwas Fibrin-Gel mit dem zellulären Inhalt setzt. In der Trichromfärbung des Masson, Hinweise auf die Produktion von Kollagen (von blau markiert) in den mittleren und großen Ringen zu sehen.
Um zu bestimmen , wurden Zell - Phänotyp folgenden Ringbildung, Geweberinge mittels Immunofluoreszenz analysiert für Antikörper gegen alpha-Aktin der glatten Muskulatur (SMA) und Tropomyosin (Abbildung 3). Alle Ringgrößen waren positiv für beide Antikörper, Überprüfung, ob der glatten Muskulatur Phänotyp gehalten wurde.
Zugversuch wurde an verschieden große Ringe ausgeführt ihre mechanischen Eigenschaften (4) zu bestimmen. Die U-Stretch, einem mechanical Testgerät wurde verwendet, um Test kleine und Zwischenringen und Gefäße auf Zug, während ein Instron Zugversuch große Ringe und Gefäße verwendet wurde. Der Elastizitätsmodul (E), Reißfestigkeit (UTS) und Bruchfestigkeit (FS) Daten wurden gesammelt. Eine konsequente Trend wurde mit zunehmender Stärke Korrelation zu vergrößernden Ring und Gefäßgröße beobachtet.
Die Zellzahl für die Erstellung der verschiedensten Größe Ringe benötigt Aussaat erhöht annähernd linear mit der Aussaat Oberfläche (Abbildung 5). Um größere Ringe zu schaffen, mindestens 14 Millionen Zellen wurden benötigt, um die Bauchaorta große Ringe zu schaffen.
Sechsringstapeln oder Schiffen, wurden auf ihre Fähigkeit getestet Strömung zu widerstehen. Konstrukten wurden geladen in einen speziell angefertigten Perfusionssystem (Figur 6) und einer für strömen bis zu 5 min bei Strömungsraten von 100 bis 417 ml / min. Die Schiffe warenLage Strömung zu widerstehen. Leichtes Tropfen wurde bei den Anschlüssen an das Perfusionssystem an den Gefäßenden, beobachtet.
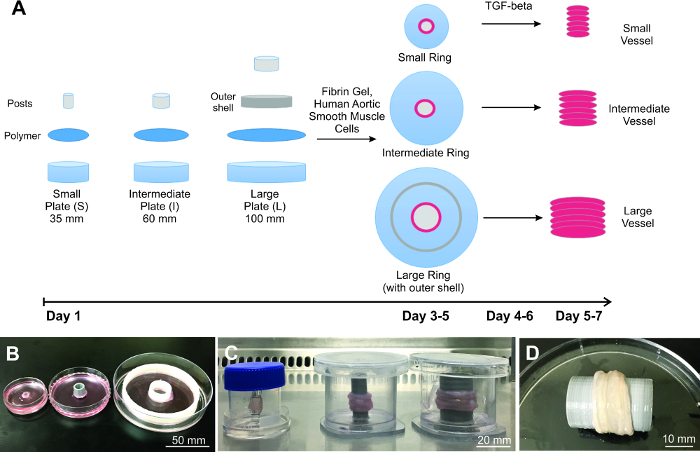
Abbildung 1: Aufbau der skalierten konstruierte Schiffe. A) Schematische Darstellung des Verfahrens von technischen Schiffe Skalierung, beginnend mit Plattenvorbereitung, Zellaussaat und Gefäß Gebäude. Nachgewiesene sind drei unterschiedlich großen B) Ringe und C) Schiffe. D) Vertreter großer Behälter ist vollständig biologisch und ähnelt natürlichem Gewebe. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
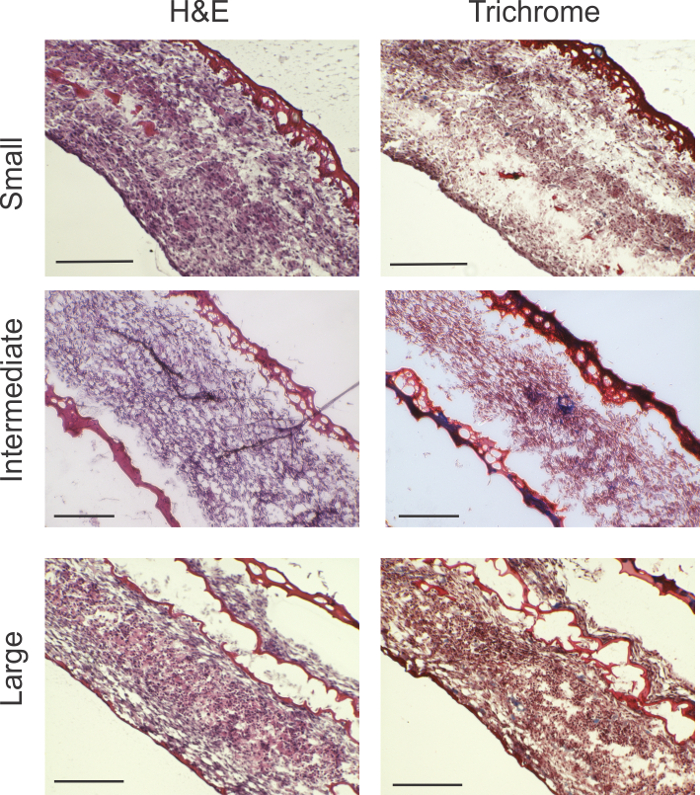
Abbildung 2: Die histologische Analyse. rong> H & E und Trichrom Flecken des Masson zeigen für alle Ringgrößen in der gesamten Ringdicke tragfähige Zellularität. TRICHROM Flecken zeigen Bereiche der Produktion von Kollagen durch blaue (blaue Pfeile) angezeigt. Große Ringe zeigten Fibrin-Gel durchsetzt, wahrscheinlich wegen der Faltung der relativ größeren Oberfläche des Zellrasens. Maßstabsbalken: kleine Ringe = 200 & mgr; m; Zwischenringe = 200 & mgr; m; und große Ringe = 0,5 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
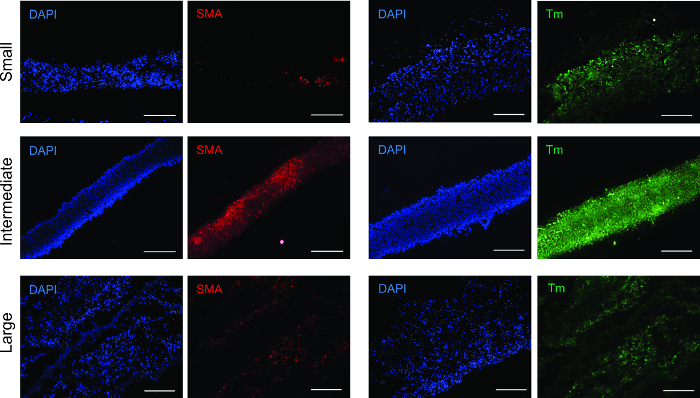
Abbildung 3: Immunfluoreszenz - Analyse für glatte Muskulatur Marker. Alle Ringgrößen waren positiv für glatte Muskulatur kontraktilen Proteine α-Glattmuskelaktin (SMA) und Tropomyosin (Tm). Maßstabsbalken = 200 & mgr; m.Last / 55322 / 55322fig3large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
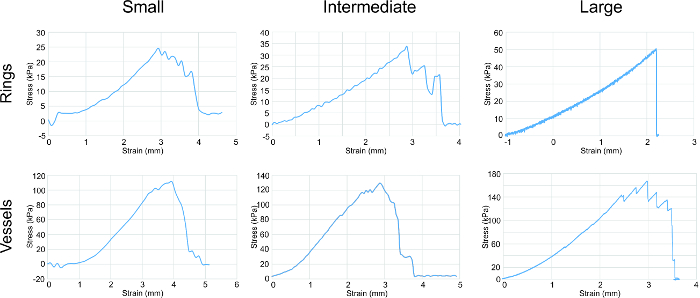
Abbildung 4: Zugversuch Analyse. Spannungs-Dehnungs-Kurven für alle Größen von Ringen und Gefäße zeigten einen allgemeinen Trend einer Erhöhung der Festigkeit mit der Zunahme der Ring / Behältergröße korreliert. Ringe und Gefäße wurden in Umfangsrichtung gestreckt. Die Parameter aus den Graphen beurteilt wurden Elastizitätsmodul, Reißfestigkeit und Bruchfestigkeit (in Tabelle 1). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 5: Zellaussaat Zahl Korrelation zu Impfen surfenace-Bereich. Basierend auf menschliche Aorta-Glattmuskelzellen. Die Oberfläche wird als der Bereich in den Ringbildung Platten zwischen dem Mittelpfosten und der Plattenwand oder Außenschale definiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
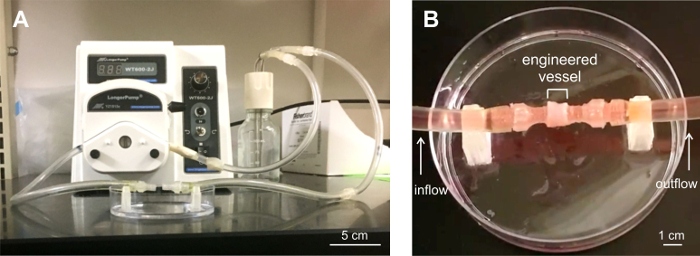
Abbildung 6: Sechs-Ring Gefäß Perfusions - Analyse unterzogen. A) Maßgeschneiderte Perfusionssystem für Flow - Tests. B) Engineered Gefäß in das Perfusionssystem geladen. Drei Gefäße wurden Perfusion auf Lecks bis zu 5 min unter Strömungsbedingungen getestet. Die Gefäße blieben stabil unter Strömung, mit geringfügigen Undichtigkeit an den Gefäßende-Anschlüsse an das System Schläuche angebracht. Bitte klicken Sie hier , umeine größere Version dieser Figur.

Animierte Abbildung 1: Demonstration der Perfusionsströmung durch eines konstruierten Schiff. Bitte klicken Sie hier , um dieses Video anzusehen. (Rechtsklick zum Download bereit .)
| Klein | Mittlere | groß | |||||
| Ringe | Elastizitätsmodul (kPa) | 13,6 ± 2,25 | (N = 6) | 14,5 ± 1,2 | (N = 3) | 17,2 ± 2,2 | (N = 4) |
| Bruchfestigkeit (kPa) | 34,5 ± 10,2 | 39,6 ± 2,98 | 50,9 ± 10,6 | ||||
| Bruchfestigkeit (kPa) | 34,5 ± 10,2 | 39,6 ± 2,98 | 50,9 ± 10,6 | ||||
| Schiffe | Elastizitätsmodul (kPa) | 49,7 ± 2,80 | (N = 3) | 59,8 ± 3,90 | (N = 2) | 79,8 ± 10,1 | (N = 2) |
| Bruchfestigkeit (kPa) | 115 ± 6.90 | 137 ± 12,0 | 192 ± 86,9 | ||||
| Bruchfestigkeit (kPa) | 96,2 ± 12,2 | 60,7 ± 12,1 | 173 ± 92,2 | ||||
Tabelle 1: Zugeigenschaften der skalierten Ringe und Gefäßen.
Diskussion
Der Ring Stapelverfahren stellt mehrere Vorteile gegenüber aktuellen Gefäßgewebe manipulierten Konstrukts Techniken. Die RSM können menschliche Gefäße jeder Größe durch einfaches Anpassen der Post und Außenschale Abmessungen zu schaffen angepasst werden. Unsere Methode ermöglicht die Entwicklung von polymerfreien konstruierte Schiffe, die ausschließlich aus menschlichen Zellen zusammengesetzt und schnell Trägermaterial in der körpereigenen natürlichen Wundheilungsprozess gefunden zu verschlechtern. Polymer-Transplantate sind dafür bekannt, eine Restenose in der Klinik zu verursachen und könnte problematisch werden, wenn in engineered Transplantate enthalten. Zellaussaat Nummer muss für jede unterschiedliche Größe Gewebering modifiziert werden. Eine graphische Darstellung der Zellzahl in den Bereich seeding Oberfläche ist in Abbildung 5 , von dem die Anzahl seeding gezeigt , angenähert und / oder extrapoliert werden. Es sollte beachtet werden, dass der Zelltyp hier sind menschliche Aorta-Glattmuskelzellen verwendet. Um die RSM an verschiedene Zelltypen anpassen, Zellgröße und Proliferationsrate werden müssen, um inRücksichtnahme und optimale Aussaatdichte bestimmt. Zum Beispiel haben wir auch menschliche Fibroblasten Ringe mit dem RSM erzeugt und haben gefunden, daß mindestens die Anzahl der Zellen 2x benötigt wird im Vergleich zu SMCs. Jede gewünschte Länge des Behälters kann durch den Zusatz von Ringen aufgebaut werden. Ring Stapel wurden für bis zu 2 Monate kultiviert und blieb stabil. Zwischen- und großer Ringe sind sowohl auf der geeigneten 1,500 & mgr; m Wandstärke gehalten, obwohl sie in einer 60 mm und 100 mm Platte jeweils aufgebaut sind, jeweils durch Platzierung einer Außenschale in der 100-mm-Platte. Dies zeigt den Nutzen der äußeren Hülle für die Steuerung und die entsprechende Wanddicke für ein bestimmtes Schiff zu erhalten. In Schritt 3.3.1 wird TGF-β1 hinzugefügt , weil es bekannt ist , um die Produktion von Kollagen und 19 hat die beobachtete Wirkung Anziehen der Ringe stimulieren. Nachdem die Ringe vollständig gerollte, eine Dosis von TGF-β1 wird im letzten Schritt hinzugefügt, und die Ringe sind bereit für eine spätere Verwendung 1 Tag. TGF-β1 macht die Produktion von Kollagen in den Ringen zu verbessern, wie es in den Trichrom Bilder (Abbildung 2) zu sehen.
Zellen in den kleinen Ringe sind rund und kompakt, während in den 2 größere Größen Zellen entlang der Außenkanten mit der Gewebekante einen Ausrichtungsgrad anzeigen und zusammen mit anderen ausgerichteten Zellen. Letzteres kann eine spätere Stufe der Zell Reife zeigen, von höheren Zellinhalt in den größeren Ringen entwickelt und somit ein größerer Grad an interzellulärer Signalisierungs Reife zu fördern. Fibringelstruktur Einstreuung in größeren Ringen kann darauf hindeuten, dass größere Zellschichten leicht zu falten neigen, wie sie rollen. Die histologischen Bilder dieses Phänomen zeigen, wurden 1 Tag nach der vollständigen Ringwalze genommen Up- so ist es verständlich, dass das Fibrin-Gel, das nimmt 2 Wochen in Kultur abzubauen, noch vorhanden sein würde. Züchten der Ringe für mindestens 2 Wochen sollte das Fibrin-Gel, Zurücklassung einer vollständig zellulären Konstrukt verschlechtern.
nt "> Alpha-Glattmuskelaktin (SMA) stellt die dünnen Fäden , die Kontraktion und Tropomyosin erleichtern , ist ein Kontraktions Protein. 20, 21 beide SMA und Tropomyosin in allen Größen Ringe vorhanden waren, mit dem stärksten, gleichmäßig verteilte Signal in dem Zwischen Ringe. zu einem höheren Grad der Zelldichte und Organisation, Stimulierung einer Erhöhung der kontraktilen oper Entwicklung zurückzuführen sein Dieses Phänomen kann.Elastizitätsmodul zeigt die Elastizität der Ringe und die zunehmende E von kleinen zu großen Ringen schlägt eine Erhöhung der Produktion von Kollagen und Elastin. Die Zugfestigkeit ist die höchste Festigkeit durch die Ringe ausgehalten, ohne zu brechen. Bruchfestigkeit ist der Punkt, der Gewebeversagen. Für den Ringen gleich UTS FS. Für die Gefäße ist UTS größer als FS, die die Bruchfestigkeit des Schiffes zeigt, dass von allen Ringen der Kombination von mechanischen Beitrag zugeschriebenim Behälter, und die Fehlerstelle ist aufgrund der schwächste Ring.
Die Stärke unserer technisierten Schiffe lagen im Bereich kPa, während nativen menschlichen Gefäße haben Stärken im Bereich MPa. Um unsere Schiffe in Richtung der von nativem Gefäße zu stärken, untersuchen wir Techniken der extrazellulären Matrix-Produktion zu erhöhen, nämlich die von Kollagen und Elastin. Wachstumsfaktoren, die Kollagen und Elastin-Produktion zu fördern sind derzeit auf unsere Ringe angewendet werden, zu untersuchen, ob die Zugeigenschaften zu erhöhen.
Neben den mechanischen Eigenschaften, funktionale Maßnahmen der Muskelkontraktion zu Schiffsleistung relevant. Muskelstimulation und Kontraktion durch Faktoren wie Acetylcholin und Epinephrin kann verwendet werden, Muskelkontraktionskraft zu testen. Solche Experimente werden für unsere zukünftigen Studien berücksichtigt.
Insgesamt zeigen unsere Ergebnisse, dass der Ring Stapelverfahren kann leicht skaliert werdeneine Reihe von technischen Gefäßgewebe Größen zu erreichen. Skalierung zu den größten menschlichen Gefäße, wie die 40 mm Lumendurchmesser Aorta, erfordern würde wahrscheinlich Entwicklung eines Vasa vasorum, die microvasculature natürlich vorhanden in großen große Schiffe, die unser Labor entwickelt derzeit. Darüber hinaus ist die endotheliale Zellschicht (dh der Intima) , die typischerweise Linien das Lumen der Medienschicht zur Schaffung der richtigen Hämodynamik in einem Behälter von Bedeutung ist. Unser Labor arbeitet derzeit bei der Erstellung der Intima in unserem SMC Ringstapel menschlichen vaskulären endothelialen Zellen. Mit diesen kombinierten Technologien würden engineered Schiffe haben eine größere Anwendbarkeit in die Klinik.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten sich unsere Kolleginnen und Lam Labor Kollegen mit einigen der Histologie und Zellkultur Ammar Chishti und Bijal Patel für die freundliche Unterstützung danken. Die Finanzierung wurde von der Wayne State University Nano Fellowship (CBP) zur Verfügung gestellt, Start-up-Fonds und Cardiovascular Research Institute Seed Grant (MTL).
Materialien
| Name | Company | Catalog Number | Comments |
| Human Aortic Smooth Muscle Cells | ATCC | PCS-100-012 | vascular smooth muscle cells |
| Medium 231 | Gibco (Life Technologies | M-231-500 | media specific to vascular smooth muscle cells |
| Human Aortic Smooth Muscle Cell Growth Kit | ATCC | PSC-100-042 | growth factors for maintaining vascular smooth muscle cell viability |
| Replicator Mini 3D printer | MakerBot | N/A | 3D printer |
| Poly(lactic acid) 3D ink (PLA) | MakerBot | N/A | 3D printer filament |
| Poly(dimethlysiloxane) (PDMS) | Ellworth Adhesives | 3097358-1004 | polymer for gluing plate parts |
| Fibrinogen | Hyclone Labratories, Inc. | SH30256.01 | fibrin gel component |
| Thrombin | Sigma Life Sciences | F3879-5G | fibrin gel component |
| Tranforming Growth Factor-Beta 1 | PeproTech | 100-21 | growth factor for stimulating collagen production |
| Hemocytometer | Hausser Scientific Co. | 3200 | for cell counting |
| Polycarbonate tubing | US Plastics | PCTUB1.750X1.625 | material for making tall, ring stacking plates |
| Polycarbonate sheet | Home Depot | 409497 | material for making tall, ring stacking plates |
| Adhesive polymer solvent | SCIGRIP | 10799 | material for making tall, ring stacking plates |
| Instron 5940 | Instron | N/A | tensile testing machine |
| U-Stretch | Cell Scale | N/A | tensile testing machine |
| Smooth Muscle Actin | MA5-11547 | Thermo Fisher | antibody |
| Tropomyosin | MA5-11783 | Thermo Fisher | antibody |
Referenzen
- Luciani, G. B., et al. Operative risk and outcome of surgery in adults with congenital valve disease. ASAIO J. 54 (5), 458-462 (2008).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: two phase 2 single-arm trials. Lancet. 14 (387), 2026-2034 (2016).
- McAllister, T. N., et al. Effectiveness of haemodialysis access with an autologous tissue-engineered vascular graft: a multicentre cohort study. Lancet. 373 (9673), 1440-1446 (2009).
- Wystrychowski, W., et al. First human use of an allogeneic tissue-engineered vascular graft for hemodialysis access. J Vasc Surg. 60 (5), 1353-1357 (2014).
- Konig, G., et al. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. 30 (8), 1542-1550 (2009).
- Gui, L., et al. Construction of tissue-engineered small-diameter vascular grafts in fibrin scaffolds in 30 days. Tissue Eng Part A. 20 (9-10), 1499-1507 (2014).
- Sundaram, S., Echter, A., Sivarapatna, A., Qiu, C., Niklason, L. Small-diameter vascular graft engineered using human embryonic stem cell-derived mesenchymal cells. Tissue Eng Part A. 20 (3-4), 740-750 (2014).
- Quint, C., Arief, M., Muto, A., Dardik, A., Niklason, L. E. Allogeneic human tissue-engineered blood vessel. J Vasc Surg. 55 (3), 790-798 (2012).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 31 (108), 9214-9219 (2011).
- Dahl, S. L., et al. Readily available tissue-engineered vascular grafts. Sci Transl Med. 2 (68), (2011).
- Syedain, Z. H., Meier, L. A., Lahti, M. T., Johnson, S. L., Tranquillo, R. T. Implantation of completely biological engineered grafts following decellularization into the sheep femoral artery. Tissue Eng Part A. 20 (11-12), 1726-1734 (2014).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Meier, L. A., et al. Blood outgrowth endothelial cells alter remodeling of completely biological engineered grafts implanted into the sheep femoral artery. J Cardiovasc Transl Res. 7 (2), 242-249 (2014).
- Pinnock, C. B., Meier, E. M., Joshi, N. N., Wu, B., Lam, M. T. Customizable engineered blood vessels using 3D printed inserts. Methods. S1046-2023 (15), 30184-30185 (2015).
- Blakely, A. M., Manning, K. L., Tripathi, A., Morgan, J. R. Bio-Pick, Place,and Perfuse: A New Instrument for Three-Dimensional Tissue Engineering. Tissue Eng Part C Methods. 21 (7), 737-746 (2015).
- Gwyther, T. A., et al. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cells Tissues Organs. 194 (1), 13-24 (2011).
- Fearon, W. F., et al. Changes in coronary arterial dimensions early after cardiac transplantation. Transplantation. 27 (6), 700-705 (2007).
- Erbel, R., Eggebrecht, H. Aortic dimensions and the risk of dissection. Heart. 92 (1), 137-142 (2006).
- Ha, D. M., et al. Transforming growth factor-beta 1 produced by vascular smooth muscle cells predicts fibrosis in the gastrocnemius of patients with peripheral artery disease. J Transl Med. 14, 39(2016).
- Skalli, O., et al. Alpha-smooth muscle actin, a differentiation marker of smooth muscle cells, is present in microfilamentous bundles of pericytes. J Histochem Cytochem. 37 (3), 315-321 (1989).
- von der Ecken, J., et al. Structure of the F-actin-tropomyosin complex. Nature. 519 (7541), 114-117 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten